Физические свойства углекислого газа: Физические и химические свойства углекислого газа
alexxlab | 19.05.2019 | 0 | Разное
Физические свойства углекислого газа :: HighExpert.RU
Углекислый газ [диоксид углерода] – негорючий бесцветный газ со слабым запахом и кисловатым вкусом, химическая формула CO2, молярная масса 44,01 кг/кмоль. Содержание углекислого газа в атмосферном воздухе составляет около 0,04%. Образуется при горении или гниении органических материалов. Относится к кислотным оксидам, при растворении в воде образует угольную кислоту, которая используется в пищевой промышленности как консервант и разрыхлитель, в химической промышленности для синтеза аммиака. Жидкая углекислота находит применение в системах пожаротушения и огнетушителях. В твёрдом состоянии в виде “сухого льда” [при температуре -73,8oC] применяется в промышленности для технологических процессов сборки неразъемных соединений с натягом [охлаждение охватываемой детали], а также в лабораторных исследованиях в качестве хладагента.
Плотность углекислого газа при нормальном атмосферном давлении 101,325 кПа (1 атм) и различной температуре
| Температура | Плотность углекислого газа, ρ |
| оС | кг/м3 |
| 7 | 1,902 |
| 27 | 1,773 |
| 47 | 1,661 |
| 67 | 1,562 |
| 87 | 1,474 |
| 107 | 1,396 |
| 127 | 1,326 |
| 177 | 1,178 |
| 227 | 1,059 |
Динамическая и кинематическая вязкость углекислого газа при нормальном атмосферном давлении и различной температуре
| Температура | Динамическая вязкость углекислого газа, μ | Кинематическая вязкость углекислого газа, ν |
| оС | (Н • c / м2) x 10-7 | (м2 / с) x 10-6 |
| 7 | 140 | 7,36 |
| 27 | 149 | 8,40 |
| 47 | 156 | 9,39 |
| 67 | 165 | 10,60 |
| 87 | 173 | 11,70 |
| 107 | 181 | 13,00 |
| 127 | 190 | 14,30 |
| 177 | 210 | 17,80 |
| 277 | 231 | 21,80 |
Основные физические свойства углекислого газа при различной температуре
| Температура | Плотность, ρ | Удельная теплоёмкость, Cp | Теплопроводность, λ | Кинематическая вязкость, ν | Число Прандтля, Pr |
| K | кг/м3 | Дж / (кг • К) | Вт / (м • К) | (м2 / с) x 10-6 | – |
| 280 | 1,902 | 830 | 0,0152 | 7,36 | 0,765 |
| 300 | 1,773 | 851 | 0,0166 | 8,40 | 0,766 |
| 400 | 1,326 | 942 | 0,0243 | 14,30 | 0,737 |
| 500 | 1,059 | 1020 | 0,0325 | 21,80 | 0,725 |
| 600 | 0,883 | 1080 | 0,0407 | 30,60 | 0,717 |
| 700 | 0,756 | 1130 | 0,0481 | 40,30 | 0,717 |
* Табличные данные подготовлены по материалам зарубежных справочников
Формулы физических свойств углекислого газа
При проведении инженерных расчетов удобнее использовать приближённые формулы для определения физических свойств углекислого газа CO2⋆:
Плотность CO2
⋆ [ кг/м3 ]Теплоёмкость CO2
⋆ [ Дж/(кг • К) ]Теплопроводность CO2
⋆ [ Вт/(м • K) ]Динамическая вязкость CO2
⋆ [ Па • c ]Кинематическая вязкость CO2
⋆ [ м2/с ]Температуропроводность CO2
[ м2/с ]Число Прандтля CO2
[ – ]⋆ Приближённые формулы физических свойств углекислого газа получены авторами настоящего сайта.
Размерность величин: температура – градусы Цельсия. Формула плотности диоксида углерода приведена для атмосферного давления.
Приближённые формулы действительны в диапазоне температур углекислого газа от 5 до 225 oC.
Углекислый газ физические и химические свойства – Moy-Instrument.Ru
Растворимость воды в жидкой углекислоте в диапазоне температур от -5,8 до +22,9 град. составляет не более 0,05% по весу.При применении сухого льда, при использовании сосудов с жидкой низкотемпературной углекислотой должно обеспечиваться соблюдение мер безопасности, предупреждающих обморожение рук и других участков тела работника.
Взаимодействие углекислого газа с веществами и его химические свойства
Общие химические свойства углекислого газа: CO2 инертен, то есть химически не активен; при попадании в водный раствор легко вступает в реакции.
Взаимодействие с другими веществами:
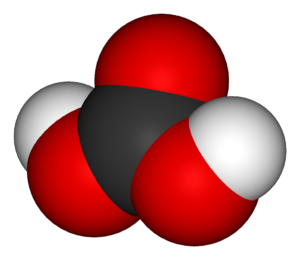
1) Углекислота относится к кислотным оксидам, то есть в сочетании с водой образуется кислота. Однако угольная кислота неустойчива и распадается сразу. Эта реакция имеет обратимый характер:
Диоксид углерода + вода ↔ угольная кислота
2) При взаимодействии углекислого газа и соединений азота с водородом (аммиаком) в водном растворе происходит разложение до углеаммонийной соли.
Аммиак + углекислота = гидрокарбонат аммония

Полученное вещество часто используется в приготовлении хлеба и различных кондитерских изделий.
3) Ход некоторых реакций должен поддерживаться высокими температурами. Примером является производство мочевины при 130 °C и давлении 200 атм., схематически изображаемое так:
Аммиак + диоксид углерода → карбамид + вода
Также под воздействием температуры около 800 градусов протекает реакция образования оксида цинка:
Zn + CO2 → ZnO + CO

Цинк + двуокись углерода → оксид цинка + оксид углерода
4) Возможно уравнение с гидроксидом бария, при котором выделяется средняя соль.
Гидроксид бария + углекислота = карбонат бария + оксид водорода.
Применяется для регулировки калориметров по теплоемкости. Также вещество используют в промышленности для производства красных кирпичей, синтетических тканей, фейерверков, гончарных изделий, плитки для ванн и туалетов.
5) Углекислый газ выделяется при реакциях горения.

Метан + кислород = углекислота + вода (в газообразном состоянии) + энергия
Этилен + кислород = диоксид углерода + оксид водорода + энергия
Этан + кислород = двуокись углерода + вода + энергия
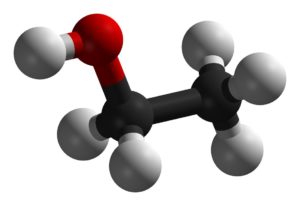
Этанол + кислород = вода + углекислота + энергия
6) Газ не поддерживает горения, этот процесс возможен только с некоторыми активными металлами, например, магнием.
2Mg + CO2 = C + 2MgO
Магний + углекислота = углерод + оксид магния.
MgO активно применяется при производстве косметических средств. Вещество используют в пищевой промышленности как пищевую добавку.
7) Двуокись углерода реагирует с гидроксидами с получением солей, которые существуют в двух формах, как карбонаты и бикарбонаты. Например, углекислый газ и гидроксид натрия, согласно формуле, образуют гидрокарбонат Na:
диоксид углерода + гидроксид натрия → гидрокарбонат натрия.
Или же при большем количестве NaOH образуется карбонат Na с образованием воды:
Диоксид углерода + гидроксид натрия → карбонат натрия + вода
Кислотно-щелочные реакции углекислоты используются на протяжении веков для затвердевания известкового раствора, что может быть выражено простым уравнением:
Гидроксид кальция + двуокись углерода → карбонат кальция + оксид водорода
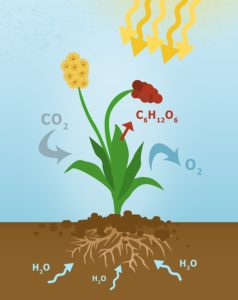
Диоксид углерода + вода → глюкоза + кислород.
9) Химические свойства углекислоты используются в промышленности при производстве соды, суть этого процесса можно выразить суммарным уравнением:
Хлорид натрия + Диоксид углерода + аммиак + вода → гидрокарбонат натрия + хлорид аммония
10) Фенолят Na разлагается при взаимодействии с углекислым газом, при этом малорастворимый фенол выпадает в осадок:
Фенолят натрия + двуокись углерода + оксид водорода = фенол + гидрокарбонат натрия
11) Пероксид натрия и углекислый газ, взаимодействуя, образуют среднюю соль карбоната Na с выделением кислорода.
Пероксид натрия + углекислота → карбонат натрия + кислород

Образование углекислоты происходит при растворении в воде кальцинированной соды (стиральной соды).
Гидрокарбонат натрия + вода → углекислота + вода + гидроксид натрия
При этой реакции (гидролиз по катиону) образуется сильнощелочная среда.
12) CO2 вступает в реакцию с гидроксидом калия, последний образуется путем электролиза хлористого калия.
Гидроксид калия + углекислота → карбонат калия + вода
13) Газ в силу своего строения не реагирует с благородными газами, то есть гелием, неоном, аргоном, криптоном, ксеноном, радоном, оганесоном.
Заключение
Мы привели большую часть химических реакций, в которых участвует CO2. Ученые всего мира пытаются решить проблему увеличения концентрации углекислоты в воздухе, не без помощи реакций с другими веществами, которые известны химикам. А какие химические формулы взаимодействия углекислого газа знаете вы?






Спасибо, что указали на ошибку. Исправили.
Скажите пожалуйста На производстве углекислоты мы заменили на комрессорном агрегате старый охладитель углекислого газа с трубками из нержавейки на новый, с латунными трубками. То есть в начале этих трубок охладителя Углекислый газ будет под давлением 16 бар и температурой 130 градусов, на выходе + 10 градусов, всё это с выделением конденсата. Не будет ли какой-то непредвиденной реакции в зоне взаимодействия уг. газа, латуни и воды? Охладитель работает хорошо, но не разрушаться ли трубки от коррозии?
Необходимо определиться для начала, откуда поступает к вам углекислый газ, какие еще газы поступают вместе с углекислым газом в охладитель. У нас, в энергетическом производстве, на определенном участке пароводяного тракта установлены латунные трубки, в которых происходит нагрев теплоносителя. Мы производим замеры растворенного кислорода в конденсате перед подачей его на подогреватели с трубками из латуни. В нашем случае большая концентрация кислорода в воде, при нагревании последней, приводит к коррозии латунных трубок.
Здравствуйте Вячеслав. Углекислый газ поступает с брожения пивного сусла. Углекислый газ (у.г.) сжимается компрессором и при t 130* подаётся на теплообменник (т.о.). хладоносителем t -4*. На латунных стенках т.о. образуется конденсат который отделяется от у.г. в конденсатоотводчике. Содержание кислорода в конденсате не должно быть большим, если вообще не минимальное. После установки нового т.о. конденсатоотводчик стал забиваться непонятной серой массой похожей на мокрый графит. Компрессор разбирали — проблема не в нём (думали одно из графитовых колец размолотило). Разбирать и осматривать т.о. более трудоёмкий процесс.
Затрудняюсь вам ответить на этот вопрос, надо изучать состав газа на входе в теплообменник. Возможно образование угольной кислоты в теплообменнике. А при наличии кислорода кислота может вызывать коррозию, но это не точно.
Углекислый газ физические и химические свойства

3. Сгорание углеродсодержащих веществ:
4. При медленном окислении в биохимических процессах (дыхание, гниение, брожение)
1) с водой даёт непрочную угольную кислоту:
2) реагирует с основными оксидами и основаниями, образуя соли угольной кислоты
Качественная реакция на углекислый газ:
Помутнение известковой воды Ca ( OH )2 за счёт образования белого осадка – нерастворимой соли CaCO 3 :

Угольная кислота и её соли
Структурная формула – все связи ковалентные полярные:

Кислота слабая, существует только в водном растворе, очень непрочная, разлагается на углекислый газ и воду:
Для угольной кислоты характерны все свойства кислот.
1) Диссоциация – двухосновная кислота, диссоциирует слабо в две ступени, индикатор — лакмус краснеет в водном растворе:
2) с активными металлами
3) с основными оксидами
4) с основаниями
5) Очень непрочная кислота – разлагается
Соли угольной кислоты – карбонаты и гидрокарбонаты
Угольная кислота образует два ряда солей:
· Кислые соли — бикарбонаты, гидрокарбонаты Na HCO3 , Ca ( HCO 3 )2
В природе встречаются :
K 2 CO 3 (поташ, в золе растений)
Na 2 CO 3 – сода, кальцинированная сода
Na 2 CO 3 x 10 H 2 O – кристаллическая сода
Все карбонаты – твёрдые кристаллические вещества. Большинство из них в воде не растворяются. Гидрокарбонаты растворяются в воде.
Химические свойства солей угольной кислоты:
Общие свойства солей:
1) Вступают в реакции обмена с другими растворимыми солями
2) Разложение гидрокарбонатов при нагревании
3) Разложение нерастворимых карбонатов при нагревании
4) Карбонаты и гидрокарбонаты могут превращаться друг в друга:
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№ 1. Закончите уравнения осуществимых химических реакций:
Основные химические свойства углекислого газа
Прежде чем рассматривать химические свойства углекислого газа, выясним некоторые характеристики данного соединения.
Общие сведения
Углекислый газ является важнейшим компонентом газированной воды. Именно он придает напиткам свежесть, игристость. Данное соединение является кислотным, солеобразующим оксидом. Относительная молекулярная масса углекислого газа составляет 44 г/моль. Этот газ тяжелее воздуха, поэтому скапливается в нижней части помещения. Данное соединение плохо растворяется в воде.

Химические свойства
Рассмотрим химические свойства углекислого газа кратко. При взаимодействии с водой происходит образование слабой угольной кислоты. Она практически сразу после образования диссоциирует на катионы водорода и анионы карбоната или гидрокарбоната. Полученное соединение вступает во взаимодействие с активными металлами, оксидами, а также со щелочами.
Каковы основные химические свойства углекислого газа? Уравнения реакций подтверждают кислотный характер данного соединения. Оксид углерода (4) способен образовывать карбонаты с основными оксидами.
Физические свойства
При нормальных условиях данное соединение находится в газообразном состоянии. При повышении давления можно перевести его до жидкого состояния. Этот газ не имеет цвета, лишен запаха, обладает незначительным кислым вкусом. Сжиженная углекислота является бесцветной, прозрачной, легкоподвижной кислотой, аналогичной по своим внешним параметрам эфиру либо спирту.
Относительная молекулярная масса углекислого газа составляет 44 г/моль. Это практически в 1,5 раза больше, чем у воздуха.
В случае понижения температуры до -78,5 градусов по Цельсию происходит образование сухого льда. Он по своей твердости аналогичен мелу. При испарении данного вещества образуется газообразный оксид углерода (4).
Качественная реакция
Рассматривая химические свойства углекислого газа, необходимо выделить его качественную реакцию. При взаимодействии данного химического вещества с известковой водой (гидроксидом кальция) происходит образование мутного осадка карбоната кальция.
Кавендишу удалось обнаружить такие характерные физические свойства оксида углерода (4), как растворимость в воде, а также высокий удельный вес.
Лавуазье был проведен химический эксперимент, в ходе которого он пытался из оксида винца выделить чистый металл.
Выявленные в результате подобных исследований химические свойства углекислого газа стали подтверждением восстановительных свойств данного соединения. Лавуазье при прокаливании окиси свинца с оксидом углерода (4) сумел получить металл. Для того чтобы удостовериться в том, что второе вещество является оксидом углерода (4), он пропустил через газ известковую воду.
Все химические свойства углекислого газа подтверждают кислотный характер данного соединения. В земной атмосфере данное соединение содержится в достаточном количестве. При систематическом росте в земной атмосфере данного соединения возможно серьезное изменение климата (глобальное потепление).
Именно диоксид углерода играет важную роль в живой природе, ведь данное химическое вещество принимает активное участие в метаболизме живых клеток. Именно это химическое соединение является результатом разнообразных окислительных процессов, связанных с дыханием живых организмов.
Углекислый газ, содержащийся в земной атмосфере, является основным источником углерода для живых растений. В процессе фотосинтеза (на свету) происходит процесс фотосинтеза, который сопровождается образованием глюкозы, выделением в атмосферу кислорода.
Диоксид углерода не обладает токсичными свойствами, он не поддерживает дыхания. При повышенной концентрации данного вещества в атмосфере у человека возникает задержка дыхания, появляются сильные головные боли. В живых организмах углекислый газ имеет важное физиологическое значение, к примеру, он необходим для регуляции сосудистого тонуса.

Особенности получения
В промышленных масштабах углекислоту можно выделять из дымового газа. Кроме того, СО2 является побочным продуктом разложения доломита, известняка. Современные установки для производства углекислого газа предполагают использование водного раствора этанамина, адсорбирующего газ, содержащийся в дымовом газе.
В лаборатории диоксид углерода выделяют при взаимодействии карбонатов или гидрокарбонатов с кислотами.

Применение углекислого газа
Данный кислотный оксид применяется в промышленности в качестве разрыхлителя или консерванта. На упаковке продукции данное соединение указывается в виде Е290. В жидком виде углекислоту используют в огнетушителях для тушения пожаров. Оксид углерода (4) используют для получения газированной воды и лимонадных напитков.
Что такое CO2
Что такое диоксид углерода
Диоксид углерода известен в основном в своем газообразном состоянии, т.е. в качестве углекислого газа с простой химической формулой CO2. В таком виде он существует в нормальных условиях – при атмосферном давлении и «обычных» температурах. Но при повышенном давлении, свыше 5 850 кПа (таково, например, давление на морской глубине около 600 м), этот газ превращается в жидкость. А при сильном охлаждении (минус 78,5°С) он кристаллизуется и становится так называемым сухим льдом, который широко используется в торговле для хранения замороженных продуктов в рефрижераторах.
Жидкая углекислота и сухой лед получаются и применяются в человеческой деятельности, но эти формы неустойчивы и легко распадаются.
А вот газообразный диоксид углерода распространен повсюду: он выделяется в процессе дыхания животных и растений и является важной составляющей частью химического состава атмосферы и океана.
Свойства углекислого газа
Углекислый газ CO2 не имеет цвета и запаха. В обычных условиях он не имеет и вкуса. Однако при вдыхании высоких концентраций диоксида углерода можно почувствовать во рту кисловатый привкус, вызванный тем, что углекислый газ растворяется на слизистых и в слюне, образуя слабый раствор угольной кислоты.
Кстати, именно способность диоксида углерода растворяться в воде используется для изготовления газированных вод. Пузырьки лимонада – тот самый углекислый газ. Первый аппарат для насыщения воды CO2 был изобретен еще в 1770 г., а уже в 1783 г. предприимчивый швейцарец Якоб Швепп начал промышленное производство газировки (торговая марка Schweppes существует до сих пор).
Углекислый газ тяжелее воздуха в 1,5 раза, поэтому имеет тенденцию «оседать» в его нижних слоях, если помещение плохо вентилируется. Известен эффект «собачьей пещеры», где CO2 выделяется прямо из земли и накапливается на высоте около полуметра. Взрослый человек, попадая в такую пещеру, на высоте своего роста не ощущает избытка углекислого газа, а вот собаки оказываются прямо в густом слое диоксида углерода и подвергаются отравлению.
CO2 не поддерживает горение, поэтому его используют в огнетушителях и системах пожаротушения. Фокус с тушением горящей свечки содержимым якобы пустого стакана (а на самом деле — углекислым газом) основан именно на этом свойстве диоксида углерода.
Углекислый газ в природе: естественные источники
Углекислый газ в природе образуется из различных источников:
- Дыхание животных и растений.
Каждому школьнику известно, что растения поглощают углекислый газ CO2 из воздуха и используют его в процессах фотосинтеза. Некоторые хозяйки пытаются обилием комнатных растений искупить недостатки приточной вентиляции. Однако растения не только поглощают, но и выделяют углекислый газ в отсутствие света – это часть процесса дыхания. Поэтому джунгли в плохо проветриваемой спальне – не очень хорошая идея: ночью уровень CO2 будет расти еще больше. - Вулканическая деятельность.
Диоксид углерода входит в состав вулканических газов. В местностях с высокой вулканической активностью CO2 может выделяться прямо из земли – из трещин и разломов, называемых мофетами. Концентрация углекислого газа в долинах с мофетами столь высока, что многие мелкие животные, попав туда, умирают. - Разложение органических веществ.
Углекислый газ образуется при горении и гниении органики. Объемные природные выбросы диоксида углерода сопутствуют лесным пожарам.
Углекислый газ «хранится» в природе в виде углеродных соединений в полезных ископаемых: угле, нефти, торфе, известняке. Гигантские запасы CO2 содержатся в растворенном виде в мировом океане.
Выброс углекислого газа из открытого водоема может привести к лимнологической катастрофе, как это случалось, например, в 1984 и 1986 гг. в озерах Манун и Ньос в Камеруне. Оба озера образовались на месте вулканических кратеров – ныне они потухли, однако в глубине вулканическая магма все еще выделяет углекислый газ, который поднимается к водам озер и растворяется в них. В результате ряда климатических и геологических процессов концентрация углекислоты в водах превысила критическое значение. В атмосферу было выброшено огромное количество углекислого газа, который наподобие лавины спустился по горным склонам. Жертвами лимнологических катастроф на камерунских озерах стали около 1 800 человек.
Искусственные источники углекислого газа
Основными антропогенными источниками диоксида углерода являются:
- промышленные выбросы, связанные с процессами сгорания;
- автомобильный транспорт.
Несмотря на то, что доля экологичного транспорта в мире растет, подавляющая часть населения планеты еще не скоро будет иметь возможность (или желание) перейти на новые автомобили.
Активное сведение лесов в промышленных целях также ведет к повышению концентрации углекислого газа СО2 в воздухе.
Углекислый газ в организме человека
CO2 – один из конечных продуктов метаболизма (расщепления глюкозы и жиров). Он выделяется в тканях и переносится при помощи гемоглобина к легким, через которые выдыхается. В выдыхаемом человеком воздухе около 4,5% диоксида углерода (45 000 ppm) – в 60-110 раз больше, чем во вдыхаемом.
Углекислый газ играет большую роль в регуляции кровоснабжения и дыхания. Повышение уровня CO2 в крови приводит к тому, что капилляры расширяются, пропуская большее количество крови, которое доставляет к тканям кислород и выводит углекислоту.
Дыхательная система тоже стимулируется повышением содержания углекислого газа, а не нехваткой кислорода, как может показаться. В действительности нехватка кислорода долго не ощущается организмом и вполне возможна ситуация, когда в разреженном воздухе человек потеряет сознание раньше, чем почувствует нехватку воздуха. Стимулирующее свойство CO2 используется в аппаратах искусственного дыхания: там углекислый газ подмешивается к кислороду, чтобы «запустить» дыхательную систему.
Углекислый газ и мы: чем опасен СO2
Углекислый газ необходим человеческому организму так же, как кислород. Но так же, как с кислородом, переизбыток углекислого газа вредит нашему самочувствию.
Большая концентрация CO2 в воздухе приводит к интоксикации организма и вызывает состояние гиперкапнии. При гиперкапнии человек испытывает трудности с дыханием, тошноту, головную боль и может даже потерять сознание. Если содержание углекислого газа не снижается, то далее наступает черед гипоксии – кислородного голодания. Дело в том, что и углекислый газ, и кислород перемещаются по организму на одном и том же «транспорте» – гемоглобине. В норме они «путешествуют» вместе, прикрепляясь к разным местам молекулы гемоглобина. Однако повышенная концентрация углекислого газа в крови понижает способность кислорода связываться с гемоглобином. Количество кислорода в крови уменьшается и наступает гипоксия.
Такие нездоровые для организма последствия наступают при вдыхании воздуха с содержанием CO2 больше 5 000 ppm (таким может быть воздух в шахтах, например). Справедливости ради, в обычной жизни мы практически не сталкиваемся с таким воздухом. Однако и намного меньшая концентрация диоксида углерода отражается на здоровье не лучшим образом.
Согласно выводам некоторых исследований, уже 1 000 ppm CO2 вызывает у половины испытуемых утомление и головную боль. Духоту и дискомфорт многие люди начинают ощущать еще раньше. При дальнейшем повышении концентрации углекислого газа до 1 500 – 2 500 ppm критически снижается работоспособность, мозг «ленится» проявлять инициативу, обрабатывать информацию и принимать решения.
И если уровень 5 000 ppm почти невозможен в повседневной жизни, то 1 000 и даже 2 500 ppm легко могут быть частью реальности современного человека. Наш эксперимент в школе показал, что в редко проветриваемых школьных классах уровень CO2 значительную часть времени держится на отметке выше 1 500 ppm, а иногда подскакивает выше 2 000 ppm. Есть все основания предполагать, что во многих офисах и даже квартирах ситуация похожая.
Безопасным для самочувствия человека уровнем углекислого газа физиологи считают 800 ppm.
Еще одно исследование обнаружило связь между уровнем CO2 и окислительным стрессом: чем выше уровень диоксида углерода, тем больше мы страдаем от окислительного стресса, который разрушает клетки нашего организма.
|
Физические свойства углекислоты Углекислота (СО2, двуокись углерода, диоксид углерода) – вещество с химическое формулой СО2 и молекулярной массой 44,011 г/моль, которое может существовать в четырёх фазовых состояниях – газообразном, жидком, твёрдом и сверхкритическом. Газообразное состояние СО2 носит общеупотребительное название «углекислый газ». При атмосферном давлении это бесцветный газ без цвета и запаха, при температуре +20 ?С плотностью 1,839 кг/м? (в 1,52 раза тяжелее воздуха), хорошо растворяется в воде (0,88 объёма в 1 объёме воды), частично взаимодействуя в ней с образованием угольной кислоты. Входит в состав атмосферы в среднем 0,035% по объёму. При резком охлаждении за счёт расширения (детандирование) СО2 способен десублимироваться – переходить сразу в твёрдое состояние, минуя жидкую фазу. Газообразный диоксид углерода ранее нередко хранили в стационарных газгольдерах. В настоящее время такой способ хранения не применяется; углекислый газ в необходимом количестве получают непосредственно на месте – путём испарения жидкой углекислоты в газификаторе. Далее газ можно легко перекачать по любому газопроводу под давлением 2-6 атмосфер. Жидкое состояние СО2 носит техническое название «жидкая углекислота» или просто «углекислота». Это бесцветная жидкость без запаха, средней плотностью 771 кг/м3, которая существует только под давлением 3 482…519 кПа при температуре 0…-56,5 град.С («низкотемпературная углекислота»), либо под давлением 3 482…7 383 кПа при температуре 0…+31,0 град.С («углекислота высокого давления»). Углекислоту высокого давления получают чаще всего путём сжатия углекислого газа до давления конденсации, при одновременном охлаждении водой. Низкотемпературную углекислоту, являющейся основной формой диоксида углерода для промышленного потребления, чаще всего получают по циклу высокого давления путём трехступенчатого охлаждения и дросселирования в специальных установках. При небольшом и среднем потреблении углекислоты (высокого давления),т для её хранения и транспортировки используют разнообразные стальные баллоны (от баллончиков для бытовых сифонов до ёмкостей вместимостью 55 л). Самым распространенным является 40 л баллон с рабочим давление 15 000 кПа, вмещающим 24 кг углекислоты. За стальными баллонами не требуется дополнительный уход, углекислота сохраняется без потерь в течение длительного времени. Баллоны с углекислотой высокого давления окрашивают в чёрный цвет. При значительном потреблении, для хранения и транспортировки низкотемпературной жидкой углекислоты используют изотермические цистерны самой разнообразной вместимости, оснащённые служебными холодильными установками. Существуют накопительные (стационарные) вертикальные и горизонтальные цистерны вместимостью от 3 до 250 т, транспортируемые цистерны вместимостью от 3 до 18 т. Цистерны вертикального исполнения требуют строительства фундамента и используются преимущественно в условиях ограниченного пространства для размещения. Применение горизонтальных цистерн позволяет снизить затраты на фундаменты, особенно при наличии общей рамы с углекислотной станцией. Цистерны состоят из внутреннего сварного сосуда, изготовленного из низкотемпературной стали и имеющего пенополиуретановую или вакуумную теплоизоляцию; наружного кожуха из пластика, оцинкованной или нержавеющей стали; трубопроводов, арматуры и приборов контроля. Внутренняя и наружная поверхности сварного сосуда подвергаются специальной обработке, благодаря чему снижена до вероятность поверхностной коррозии металла. В дорогих импортных моделях наружный герметичный кожух выполнен из алюминия. Использование цистерн обеспечивает заправку и слив жидкой углекислоты; хранение и транспортировку без потерь продукта; визуальный контроль массы и рабочего давления при заправке, в процессе хранения и выдачи. Все типы цистерн оснащены многоуровневой системой безопасности. Предохранительные клапаны позволяют производить проверку и ремонт без остановки и опорожнения цистерны. При мгновенном снижении давления до атмосферного, происходящем при впрыске в специальную расширительную камеру (дросселировании), жидкий диоксид углерода мгновенно превращается в газ и тончайшую снегообразную массу, которую прессуют и получают диоксид углерода в твёрдом состоянии, который носит общеупотребительное название «сухой лёд». При атмосферном давлении это белая стекловидная масса плотностью 1 562 кг/м?, с температурой -78,5 ?С, которая на открытом воздухе сублимируется – постепенно испаряется, минуя жидкое состояние. Сухой лёд может быть также получен непосредственно на установках высокого давления, применяемых для получения низкотемпературной углекислоты, из газовых смесей, содержащих СО2 в количестве не менее 75-80%. Объёмная холодопроизводительность сухого льда почти в 3 раза больше, чем у водяного льда, и составляет 573,6 кДж/кг. Твёрдый диоксид углерода обычно выпускают в брикетах размером 200?100?20-70 мм, в гранулах диаметром 3, 6, 10, 12 и 16 мм, редко в виде тончайшего порошка («сухой снег»). Брикеты, гранулы и снег хранят не более 1-2 суток в стационарных заглублённых хранилищах шахтного типа, разбитых на небольшие отсеки; перевозят в специальных изотермических контейнерах с предохранительным клапаном. Используются контейнеры разных производителей вместимостью от 40 до 300 кг и более. Потери на сублимацию составляют, в зависимости от температуры окружающего воздуха 4-6% и более в сутки. При давлении свыше 7,39 кПа и температуре более 31,6 град.С диоксид углерода находится в так называемом сверхкритическом состоянии, при котором его плотность как у жидкости, а вязкость и поверхностное натяжение как у газа. Эта необычная физическая субстанция (флюид) является отличным неполярным растворителем. Сверхкритический CO2 способен полностью или выборочно экстрагировать любые неполярные составляющие с молекулярной массой менее 2 000 дальтон: терпеновые соединения, воски, пигменты, высокомолекулярные насыщенные и ненасыщенные жирные кислоты, алкалоиды, жирорастворимые витамины и фитостерины. Нерастворимыми веществами для сверхкритического CO2 являются целлюлоза, крахмал, органические и неорганические полимеры с высоким молекулярным весом, сахара, гликозидные вещества, протеины, металлы и соли многих металлов. Обладая подобными свойствами, сверхкритический диоксид углерода всё шире применяется в процессах экстракции, фракционирования и импрегнации органических и неорганических веществ. Он является также перспективным рабочим телом для современных тепловых машин.
Техника безопасности По степени воздействия на организм человека газообразный диоксид углерода относится к 4-му классу опасности по ГОСТу 12.1.007-76 «Вредные вещества. Классификация и общие требования безопасности». Предельно допустимая концентрация в воздухе рабочей зоны не установлена, при оценке этой концентрации следует ориентироваться на нормативы для угольных и озокеритовых шахт, установленные в пределах 0,5%. При применении сухого льда, при использовании сосудов с жидкой низкотемпературной углекислотой должно обеспечиваться соблюдение мер безопасности, предупреждающих обморожение рук и других участков тела работника. |
Физические и химические свойства углекислого газа: формула,плотность
Применение углекислого газа в сварочной области является очень распространенной. Это один из основных вариантов, которые применяются для различных видов соединения металла. Физические свойства углекислого газа определяют его как универсальную субстанцию для газовой сварки, соединения газовой и электродуговой и так далее. Это относительно недорогое сырье, которое используется здесь на протяжении многих лет. Есть более эффективные варианты, но именно углекислота применяется чаще всего. Она находит применение как для обучения, так и для выполнения самых простых процедур.
Углекислота еще носит название диоксид углерода. Вещество не обладает запахом и бесцветно в обыкновенном состоянии. При нормальном атмосферном давлении, углекислота не состоит в жидком состоянии и из твердого сразу переходит в газообразное.
Область применения углекислого газа 
Химическое вещество используется не только для сварки. Физические свойства углекислого газа позволяют применять его как разрыхлитель или консервант в пищевой промышленности. Во многих системах пожаротушения, в частности в ручных огнетушителях. Его применяют для обеспечения питания аквариумных растений. Практически все газированные напитки содержат углекислый газ.
В сварочной сфере применение чистой углекислоты является не совсем безопасным для металла. Дело в том, что при воздействии высокой температуры он распадается и из него выделяется кислород. В свою очередь, кислород является опасным для сварочной ванны и чтобы ликвидировать его негативное воздействие, применяют разнообразные раскислители, такие как кремний и марганец.
Применение углекислоты встречается еще и в баллонах для пневматических пистолетов и винтовок. Как и в сварочных баллонах, углекислота здесь хранится в сжиженном состоянии под давлением.

Баллон с углекислотой для сварки
Химическая формула 
Химические свойства углекислого газа, а также его другие характеристики, напрямую зависят от элементов, которые входят в состав формулы. Формула углекислого газа в химии имеет вид CO2. Это означает, что углекислота содержит в себе один атом углерода и два атома кислорода.
Химические и физические свойства 
Рассмотрев, как обозначается химических газ в химии, стоит более внимательно рассмотреть его свойства. Физические свойства углекислого газа проявляются в различных параметрах. Плотность углекислого газа при стандартных атмосферных условиях составляет 1,98 кг/м3. Это делает его в 1,5 раза тяжелее, чем воздух в атмосфере. Диоксид углерода не имеет запаха и цвета. Если его подвергнуть сильному охлаждению, то он начинает кристаллизоваться в так называемый «сухой лед». Температура сублимации достигает -78 градусов Цельсия.
Химические свойства углекислого газа определяют его к кислотным оксидам, так как он может образовывать угольную кислоту, когда его растворяют в воде. При взаимодействии с щелочами, вещество начинает образовывать гидрокарбонаты и карбонаты. С некоторыми веществами, такими как фенол, диоксид углерода вступает в реакцию электрофильного замещения. С магнийорганическими вещество вступает в реакцию нуклеофильного присоединения. Использование углекислоты в огнетушителях обусловлено тем, что она не поддерживает процесс горения. Использование в сварке обусловлено тем, что в веществе горят некоторые активные металлы.
Преимущества 
- Использование углекислого газа является относительно недорогим, так как цена на данное вещество достаточно низкая, если сравнивать с другими газами;
- Это очень распространенное вещество, найти которое можно во многих местах;
- Углекислый газ удобен в хранении и не требует сверхсложных мер безопасности;
- Газ хорошо справляется с теми обязанностями, для которых он предназначается.
Недостатки 
- Во время использования на металле могут образовываться оксиды, которые выделяет вещество во время нагревания;
- Для нормальной работы нужно использовать дополнительные расходные материалы, которые бы помогли ликвидировать негативное воздействие оксидов;
- Существуют более эффективные газы, применяемые в сварочной сфере.
Применение углекислого газа при сварке 
Данное вещество применяется в области сваривания металлических изделий в качестве защитного газа. Он применяется как для автоматических, так и для полуавтоматических сварочных аппаратов. Зачастую его используют не в чистом виде а вместе с аргоном или кислородом в газовой смеси. В производственной сфере существует несколько вариантов снабжения постов. Среди них выделяют следующие методы:
- Поставка из баллона. Это очень удобно, когда речь идет об относительно небольших объемах вещества. Это обеспечивает мобильность, так как не всегда имеется возможность создать трубопровод к посту.
- Транспортная емкость для углекислоты. Это также отличный вариант для потребления вещества в небольших баллонах. Она обеспечивает поставку большего количества газа, чем в баллонах, но менее удобна в транспортировке.
- Стационарный сосуд накопитель. Он применяется для тех, кто использует углекислоту в больших объемах. Их используют при отсутствии на предприятии автономной станции.
- Автономная станция. Это наиболее широкий по объему метод поставки, так как может обслуживать пост практически для любых процедур, вне зависимости от объемов. Таким образом, пост получает вещество непосредственно с места его производства.
Автономная станция представляет собой специальный цех на предприятии, где получают диоксид углерода. Он может работать как исключительно для собственных нужд, так и на поставку другим цехам и организациям. Для обеспечения рабочих точек предприятия, газ поставляет по трубопроводам. В то время, когда на предприятии имеется необходимость в запасании углекислоты, ее перемещают в специальные накопители.
Меры безопасности
Хранение и использование вещества является относительно безопасным. Но для того, чтобы исключить вероятности несчастных случаев, следует придерживаться основных правил:
- Несмотря на то, что углекислота не отличается взрывоопасностью и токсичностью, если ее концентрация будет выше 5%, то человек будет чувствовать удушье и кислородную недостаточность. Не следует допускать утечки и хранения всего в закрытом не проветриваемом помещении.
- Если понизить давление, то жидкая углекислота превращается в газообразное состояние. В это время ее температура может составлять -78 градусов Цельсия. Это вредно для слизистых оболочек организма. Также это приводит к обморожению кожи
- Осмотр больших емкостей для хранения углекислоты следует проводить с использованием шлангового противогаза. Цистерна должна быть отогрета до температуры окружающей среды и быть хорошо проветренной.
Заключение
Физические свойства являются не единственным показателем, по которому подбирается газ для сварки. Совокупность всех параметров обеспечивает данному веществу уверенные позиции на современном рынке расходных материалов. Среди самых простых процедур это незаменимый газ, с которым сталкивался практически каждый профессиональный и начинающий сварщик.
объем, масса и сгорание углекислого газа
Углекислый газ, или диоксид углерода, или CO2 — одно из самых распространенных на Земле газообразных веществ. Он окружает нас в течение всей нашей жизни. Углекислый газ не имеет цвета, вкуса и запаха и никак не ощущается человеком.

 Углекислый газ
Углекислый газОн является важным участником обмена веществ живых организмов. Газ сам по себе не ядовит, но не поддерживает дыхание, поэтому превышение его концентрации ведет к ухудшению снабжения тканей организма кислородом и к удушью. Углекислый газ широко применяется в быту и в промышленности.
Что такое диоксид углерода
При атмосферном давлении и комнатной температуре диоксид углерода находится в газообразном состоянии. Это наиболее часто встречающаяся его форма, в ней он участвует в процессах дыхания, фотосинтеза и обмена веществ живых организмов.


Диоксид углерода
При охлаждении до -78 °С он, минуя жидкую фазу, кристаллизуется и образует так называемый «сухой лед», широко применяемый как безопасный хладагент в пищевой и химической промышленности и в уличной торговле и рефрижераторных перевозках.
При особых условиях — давлении в десятки атмосфер — углекислота переходит в жидкое агрегатное состояние. Это происходит на морском дне, на глубине свыше 600 м.
Свойства углекислого газа
В 17 веке Жан-Батист Ван Гельмонт из Фландрии открыл углекислый газ и определил его формулу. Подробное исследование и описание было сделано столетие спустя шотландцем Джозефом Блэком. Он исследовал свойства углекислого газа и провел серию опытов, в которых доказал, что он выделяется при дыхании животных.
В состав молекулы вещества входит один атом углерода и два атома кислорода. Химическая формула углекислого газа записывается как CO2
В нормальных условиях не обладает вкусом, цветом и запахом. Только вдыхая большое его количество, человек ощущает кислый привкус. Его дает угольная кислота, образующаяся в малых дозах при растворении углекислого газа в слюне. Эта особенность применяется для приготовления газированных напитков. Пузырьки в шампанском, просекко, пиве и лимонаде — это и есть углекислый газ, образовавшийся в результате естественных процессов брожения или добавленный в напиток искусственно.


Физические свойства углекислого газа
Плотность углекислого газа больше плотности воздуха, поэтому при отсутствии вентиляции он скапливается внизу. Он не поддерживает окислительные процессы, такие, как дыхание и горение.
Поэтому углекислоту применяют в огнетушителях. Это свойство углекислого газа иллюстрируют с помощью фокуса — горящую свечу опускают в «пустой» стакан, где она и гаснет. В действительности стакан заполнен CO2.
Углекислый газ в природе естественные источники
К таким источникам относятся окислительные процессы разной интенсивности:
- Дыхание живых организмов. Из школьного курса химии и ботаники все помнят, что в ходе фотосинтеза растения поглощают углекислый газ и выделяют кислород. Но не все помнят, что это происходит только днем, при достаточном уровне освещения. В темное время суток растения наоборот, поглощают кислород и выделяют углекислый газ. Так что попытка улучшить качество воздуха в комнате, превращая ее в заросли фикусов и герани может сыграть злую шутку.
- Извержения и другая вулканическая активность. CO2 выбрасывается из глубин мантии Земли вместе с вулканическими газами. В долинах рядом с источниками извержений газа настолько много, что, скапливаясь в низинах, он вызывает удушье животных и даже людей. Известны несколько случаев в Африке, когда задыхались целые деревни.
- Горение и гниение органики. Горение и гниение — это одна и та же реакция окисления, но протекающая с разной скоростью. Богатые углеродом разлагающиеся органические остатки растений и животных, лесные пожары и тлеющие торфяники — все это источники диоксида углерода.
- Самым же большим природным хранилищем CO2 являются воды мирового океана, в которых он растворен.


Углекислый газ в природе
За миллионы лет эволюции основанной на углеродных соединениях жизни на Земле в различных источниках накопились многие миллиарды тонн углекислого газа. Его одномоментный выброс в атмосферу приведет к гибели всего живого на планете из-за невозможности дыхания. Хорошо, что вероятность такого одномоментного выброса стремится к нулю.
Искусственные источники углекислого газа
Углекислый газ попадает в атмосферу и в результате человеческой жизнедеятельности. Самыми активными источниками в наше время считаются:
- Индустриальные выбросы, происходящие в ходе сгорания топлива на электростанциях и в технологических установках
- Выхлопные газы двигателей внутреннего сгорания транспортных средств: автомобилей, поездов, самолетов и судов.
- Сельскохозяйственные отходы — гниение навоза в больших животноводческих комплексах
Кроме прямых выбросов, существует и косвенное воздействие человека на содержание CO2 в атмосфере. Это массовая вырубка лесов в тропической и субтропической зоне, прежде всего в бассейне Амазонки.


Искусственный источник углекислого газа
Несмотря на то, что в атмосфере Земли содержится менее процента диоксида углерода, он оказывает все возрастающее действие на климат и природные явления. Углекислый газ участвует в создании так называемого парникового эффекта путем поглощения теплового излучения планеты и удерживания этого тепла в атмосфере. Это ведет к постепенному, но весьма угрожающему повышению среднегодовой температуры планеты, таянию горных ледников и полярных ледяных шапок, росту уровня мирового океана, затоплению прибрежных регионов и ухудшению климата в далеких от моря странах.
Знаменательно, что на фоне общего потепления на планете происходит значительное перераспределение воздушных масс и морских течений, и в отдельных регионах среднегодовая температура не повышается, а понижается. Это дает козыри в руки критикам теории глобального потепления, обвиняющим ее сторонников в подтасовке фактов и манипуляции общественным мнением в угоду определенным политическим центрам влияния и финансово-экономическим интересам
Человечество пытается взять под контроль содержание углекислого газа в воздухе, были подписаны Киотский и Парижский протоколы, накладывающие на национальные экономики определенные обязательства. Кроме того, многие ведущие автопроизводители автомобилей объявили о сворачивании к 2020-25 годам выпуска моделей с двигателями внутреннего сгорания и переходе на гибриды и электромобили. Однако некоторые ведущие экономики мира, такие, как Китай и США, не торопятся выполнять старые и брать на себя новые обязательства, мотивируя это угрозой уровню жизни в своих странах.
Углекислый газ и мы: чем опасен CO2
Углекислый газ — один из продуктов обмена веществ в организме человека. Он играет большую роль в управлении дыханием и снабжением кровью органов. Рост содержания CO2 в крови вызывает расширение сосудов, способных таким образом транспортировать больше кислорода к тканям и органам. Аналогично и система дыхания понуждается к большей активности, если концентрация углекислоты в организме растет. Это свойство используют в аппаратах искусственной вентиляции легких, чтобы подстегнуть собственные органы дыхания пациента к большей активности.
Кроме упомянутой пользы, превышение концентрации СO2 может принести организму и вред. Повышенное содержание во вдыхаемом воздухе приводит к тошноте, головной боли, удушью и даже к потере сознания. Организм протестует против углекислого газа и подает человеку сигналы. При дальнейшем увеличении концентрации развивается кислородное голодание, или гипоксия. Co2 мешает кислороду присоединяться к молекулам гемоглобина, которые и осуществляют перемещение связанных газов по кровеносной системе. Кислородное голодание ведет к снижению работоспособности, ослаблению реакции и способностей к анализу ситуации и принятию решений, апатии и может привести к смерти.


Общие симптомы отравления углекислым газом
Такие концентрации углекислого газа, к сожалению, достижимы не только в тесных шахтах, но и в плохо проветриваемых школьных классах, концертных залах, офисных помещениях и транспортных средствах — везде, где в замкнутом пространстве без достаточного воздухообмена с окружающей средой скапливается большое количество людей.
Основное применение
CO2 широко применяется в промышленности и в быту – в огнетушителях и для изготовления газировки, для охлаждения продуктов и для создания инертной среды при сварке.


Основное применение углекислого газа
Применение углекислого газа отмечено в таких отраслях, как:
- для чистки поверхностей сухим льдом.
Фармацевтика
- для химического синтеза компонентов лекарственных средств;
- создания инертной атмосферы;
- нормализация индекса pH отходов производства.


Углекислый газ в фармацевтике
Пищевая отрасль
- производство газированных напитков;
- упаковка продуктов питания в инертной атмосфере для продления срока годности;
- декаффеинизация кофейных зерен;
- замораживание или охлаждение продуктов.


Углекислый газ в пищевой отрасли
Медицина, анализы и экология
- Создание защитной атмосферы при полостных операциях.
- Включение в дыхательные смеси в качестве стимулятора дыхания.
- В хроматографических анализах.
- Поддержание уровня pH в жидких отходах производства.


Углекислый газ и экология
Электроника
- Охлаждение электронных компонентов и устройств при тестировании на температурную стойкость.
- Абразивная очистка в микроэлектронике (в твердой фазе).
- Очищающее средство в производстве кремниевых кристаллов.
Химическая отрасль
Широко применяется в химическом синтезе в качестве реагента и в качестве регулятора температур в реакторе. CO2 отлично подходит для обеззараживания жидких отходов с низким индексом pH.


Использование углекислого газа
Применяется также для осушения полимерных веществ, растительных или животных фиброматериалов, в целлюлозном производстве для нормализации уровня pH как компонентов основного процесса, так и его отходов.
Металлургическая отрасль
В металлургии CO2 в основном служит делу экологии, защиты природы от вредных выбросов путем их нейтрализации:


Применение углекислого газа в металлургии
- В черной металлургии — для нейтрализации плавильных газов и для донного перемешивания расплава.
- В цветной металлургии при производстве свинца, меди, никеля и цинка — для нейтрализации газов при транспортировке ковша с расплавом или горячих слитков.
- В качестве восстановительного агента при организации оборота кислотных шахтных вод.
Сварка в углекислой среде


Процесс сварки с применением углекислого газа
Разновидность сварки под флюсом является сварка в углекислой среде. Операции сварочных работ с углекислым газом осуществляется плавящимся электродом и распространен в процессе монтажных работ, устранении дефектов и исправления деталей с тонкими стенками.
Химические и физические свойства углекислого газа.
Углекислый газ (двуокись углерода), называемый также углекислотой, – важнейший компонент в составе газированных напитков. Он обусловливает вкус и биологическую стойкость напитков, сообщает им игристость и освежающие свойства.
Химические свойства. В химическом отношении углекислый газ инертен. Образовавшись с выделением большого количества тепла, он, как продукт полного окисления углерода, весьма стоек. Реакции восстановления двуокиси углерода протекают только при высоких температурах. Так, например, взаимодействуя с калием при 230° С, углекислый газ восстанавливается до щавелевой кислоты:
Вступая в химическое взаимодействие с водой, газ, в количестве не более 1% от содержания его в растворе, образует угольную кислоту, диссоциирующую на ионы Н+, НСО3–, СО23-. В водном растворе углекислый газ легко вступает в химические реакции, образуя различные углекислые соли. Поэтому водный раствор углекислого газа обладает большой агрессивностью по отношению к металлам, а также разрушающе действует на бетон.
Физические свойства. Для сатурации напитков используется углекислый газ, приведенный в жидкое состояние сжатием до высокого давления. В зависимости от температуры и давления углекислый газ может находиться также в газообразном и твердом состоянии. Температура и давление, соответствующие данному агрегатному состоянию, приведены на диаграмме фазового равновесия (рис. 13).
Рис. 13. Диаграмма фазового равновесия углекислого газа.
При температуре минус 56,6° С и давлении 0,52 Мн/м2 (5,28 кГ/см2), соответствующих тройной точке, углекислый газ может одновременно находиться в газообразном, жидком и твердом состоянии. При более высоких температуре и давлении углекислый газ находится в жидком и газообразном состоянии; при температуре и давлении, которые ниже этих показателей, газ, непосредственно минуя жидкую фазу, переходит в газообразное состояние (сублимирует). При температуре, превышающей критическую температуру 31,5° С, никакое давление не может удержать углекислый газ в виде жидкости.
В газообразном состоянии углекислый газ бесцветен, не имеет запаха и обладает слабовыраженным кислым вкусом. При температуре 0° С и атмосферном давлении плотность углекислого газа составляет 1,9769 кг/ж3; он в 1,529 раз тяжелее воздуха. При 0°С и атмосферном давлении 1 кг газа занимает объем 506 л. Связь между объемом, температурой и давлением углекислого газа выражается уравнением:
где V – объем 1 кг газа в м3/кг; Т – температура газа в ° К; Р – давление газа в н/м2; R – газовая постоянная; А – дополнительная величина, учитывающая отклонение от уравнения состояния идеального газа;
Ожиженный углекислый газ – бесцветная, прозрачная, легкоподвижная жидкость, напоминающая по внешнему виду спирт или эфир. Плотность жидкости при 0° С равна 0,947. При температуре 20°С ожиженный газ сохраняется под давлением 6,37 Мн/м2 (65 кГ/см2) в стальных баллонах. При свободном истечении из баллона жидкость испаряется с поглощением большого количества тепла. При снижении температуры до минус 78,5° С часть жидкости замерзает, превращаясь в так называемый сухой лед. По твердости сухой лед близок к мелу и имеет матово-белый цвет. Сухой лед испаряется медленнее жидкости, при этом он непосредственно переходит в газообразное состояние.
При температуре минус 78,9° С и давлении 1 кГ/см2 (9,8 Мн/м2) теплота сублимации сухого льда составляет 136,89 ккал/кг (573,57 кдж/кг).
Углекислый газ и его физические свойства — объем, плотность, масса, формула

Молекула углекислого газа
Углекислый газ представляет собой бесцветный газ, без запаха,который относится к неорганическим веществам. Другие названия вещества — диоксид углерода, двуокись углерода, углекислота, диоксид карбона, угольный ангидрид. Молекула углекислого газа состоит из атома углерода, соединенного двойной ковалентной связью с двумя атомами кислорода.
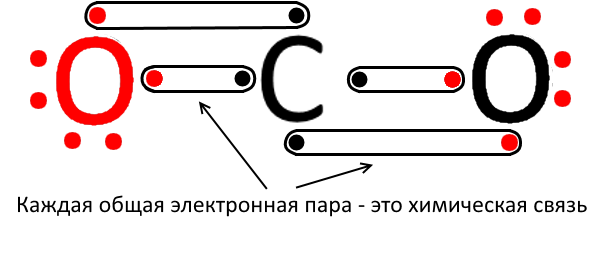
Электронная формула диоксида углерода
Химическая формула — CO2. Молярная масса углекислоты равна 44,01 г/моль. Расстояние от центра центрального атома углерода до каждого центра атома кислорода равно 116,3 пикометров (10 в -12 степени).

Структурная формула молекулы
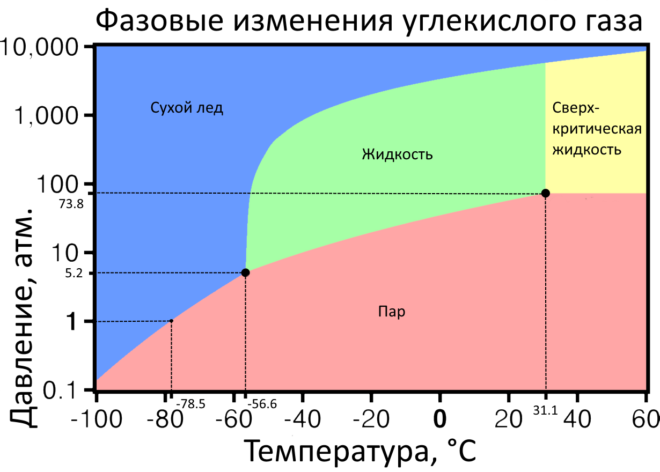
CO2 при низких температурах и нормальном давлении замерзает и кристаллизуется в белую массу, похожую на снег — «Сухой лед». При превышении температуры (-78.5 °C) начинается его испарение (кипение), минуя фазу жидкостного состояния.
В жидкостное состояние газ преобразуется при высоком давлении (73.8 атм.) и средних температурах (+31.1 °C). Это критическая точка углекислоты. Подъем температуры или давления после нее приводит к образованию сверхкритической жидкости (Отсутствует различие между жидкостной и газовой фазой). При снижении температуры до -56.6 °C и давления до 5.2 атм. он остается в жидкостной фазе. Это предельные значения, при изменении которых углекислота переходит в газообразную или твердую фазу (тройная точка состояний).
CO2 не ядовит, но при превышении концентрации в десятки раз, он оказывает удушающее воздействие на живые организмы и вызывает кисловатый вкус и запах (реакция CO2 со слюной и слизистыми образует угольную кислоту).
Читайте также: Углекислый газ в помещении.
Двуокись углерода превышает по плотности кислород на 37 процентов и равна 1,96 кг/м3 при нормальных условиях среды (температура — 273 К, давление — 101 кПа). Этим физическим свойством объясняется потеря сознания у животных в «Собачьей пещере», расположенной рядом с городом Поццуоли, Италия. Диоксид углерода скапливался из трещин кратеров в нижних слоях пещеры, тем самым достигая больших концентраций. Туристов приводили туда обычно с собакой, которая в пещере с течением времени теряла сознание. Человек обычно не подвергался воздействию CO2, так как дышал воздухом с более высокого уровня.
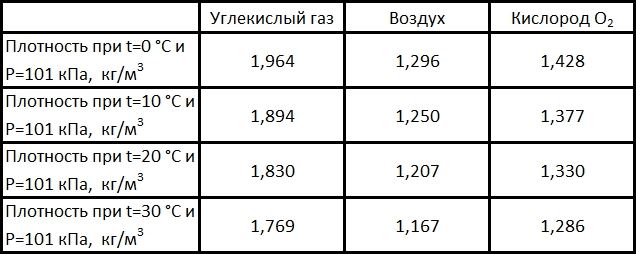
Плотность углекислоты, воздуха и кислорода.
Объем углекислого газа в окружающем нас воздухе, составляет 0,04% (406 ppm – 406 частиц на миллион).
Физические свойства диоксида углерода
| Двуокись углерода | |
| Формула | CO2 |
| Молекулярный вес (фунт / моль) | 44.01 |
| Critical Temp. (° F) | 87,9 |
| Критическое давление (psia) | 1071.0 |
| Точка кипения (° F) | -109,2 |
| Температура плавления (° F) | -69,9 |
| фунтов / кв. Дюйм при 70 ° F (фунт / кв. Дюйм) | 852,8 |
| Плотность жидкости при 70 ° F (фунт / фут3) | 47,64 |
| Плотность газа при 70 ° F 1 атм (фунт / фут3) | 0,1144 |
| Удельный объем при 70 ° F 1 атм (фут3 / фунт) | 8,74 |
| Удельный вес | 1.555 |
| Удельная теплоемкость при 70 ° F (БТЕ / фунт-моль- ° F) | 8,92 |
Физические свойства газа
Газовый Fast Facts
название Телефон| Двуокись углерода | |
| Формула | CO2 |
| Молекулярный вес (фунт / моль) | 44.01 |
| Critical Temp.(° F) | 87,9 |
| Критическое давление (psia) | 1071,0 |
| Точка кипения (° F) | -109,2 |
| Температура плавления (° F) | -69,9 |
| фунтов / кв. Дюйм при 70 ° F (фунт / кв. Дюйм) | 852,8 |
| Плотность жидкости при 70 ° F (фунт / фут3) | 47,64 |
| Плотность газа при 70 ° F 1 атм (фунт / фут3) | 0,1144 |
| Удельный объем при 70 ° F 1 атм (фут3 / фунт) | 8.74 |
| Удельный вес | 1,555 |
| Удельная теплоемкость при 70 ° F (БТЕ / фунт-моль- ° F) | 8,92 |
Физические свойства газа
Газовый Fast Facts
ИксЭтот сайт использует файлы cookie для хранения информации на вашем компьютере. Некоторые из них необходимы для работы нашего сайта; другие помогают нам лучше понимать наших пользователей.Используя сайт, вы соглашаетесь на размещение этих файлов cookie. Прочтите наше официальное уведомление, чтобы узнать больше.
Закрыть
,Свойства диоксида углерода
Свойства насыщенной жидкости Диоксид углерода – CO 2 – плотность, удельная теплоемкость, кинематическая вязкость, теплопроводность и число Прандтля:
| Температура – T – ( o C) | Плотность – ρ – (кг / м 3 ) | Удельная теплоемкость – c p – (10 3 Дж / кг K) | Теплопроводность – k – (Вт / м · K) | Кинематическая вязкость – ν – (10 -6 м 2 / с) | Прандтля No. – Pr – |
|---|---|---|---|---|---|
| -50 | 1156 | 1,84 | 0,086 | 0,119 | 2,96 |
| -40 | 1118 | 1,88 | 0,101 | 0,118 | 2,66 |
| -30 | 1077 | 1,97 | 0,112 | 0,117 | 2,22 |
| -20 | 1032 | 2.05 | 0,115 | 0,115 | 2,12 |
| -10 | 983 | 2,18 | 0,110 | 0,113 | 2,20 |
| 0 | 927 | 2,47 | 0,105 | 0,108 | 2,38|
| 10 | 860 | 3,14 | 0,097 | 0,101 | 2,80 |
| 20 | 773 | 5.0 | 0,087 | 0,091 | 4,10 |
| 30 | 598 | 36,4 | 0,070 | 0,080 | 28,7 |
- 1 кг / м 3 = 0,0624 фунт / фут 3
- 1 Дж / (кг · К) = 2,389×10 -4 ккал / (кг o C) = 2,389×10 -4 БТЕ / (фунт м o F)
- 1 Вт / (м · К) = 0.85984 ккал / (hm o C) = 0,5779 Btu / (ft h o F) = 0,048 BTU / (дюйм h o F)
- 1 м 2 / с = 10 4 St = 10 6 сСт = 10,764 футов 2 / с = 38750 футов 2 / ч
Углекислый газ образуется в результате сжигания угля или углеводородов, ферментации жидкостей и дыхания людей и людей. животными и вулканами.
Углекислый газ имеет низкую концентрацию в атмосфере и действует как парниковый газ.Двуокись углерода используется растениями для производства углеводов, при этом в процессе фотосинтеза кислород выделяется в атмосферу.
Углекислый газ бесцветен, тяжелее воздуха и имеет слегка раздражающий запах.
Температура замерзания -78,5 o C , где образуется двуокись углерода снег или «сухой лед».
Растворимость CO 2 в воде
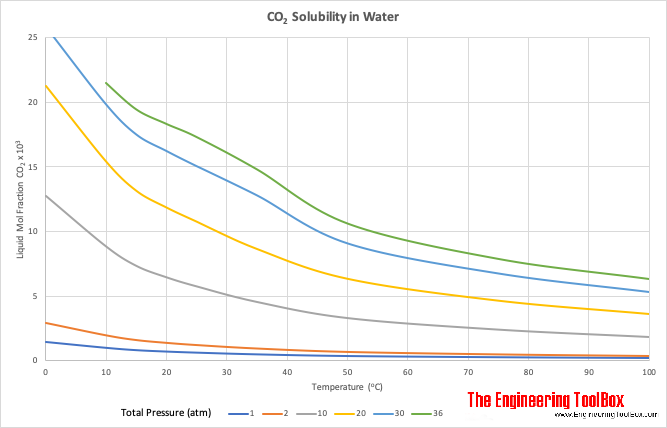
- жидкая мольная доля CO 2 x 10 3
Физико-химические свойства углерода
Что такое углерод? Свойства углерода и изотопов
СМОТРЕТЬ БОЛЬШЕ
ЧТО ТАКОЕ УГЛЕРОД? Углерод – это неметаллический химический элемент.Его символ – «C». Его атомный номер 6. Он принадлежит к группе 14 периодической таблицы. Углерод в основном содержится в угольных месторождениях, однако углерод, полученный из угольных месторождений, должен быть переработан для его коммерческого использования.
1) УГЛЕРОД-12 (12C) —> он имеет шесть нейтронов и шесть протонов. Это самый распространенный изотоп.
2) УГЛЕРОД-13 (13C) —-> он имеет семь нейтронов. Это самый тяжелый изотоп после 12С.
3) УГЛЕРОД-14 (14C) —–> Он содержит восемь нейтронов в своем ядре.Этот изотоп нестабилен и очень радиоактивен.
Однако со временем он превратится в стабильный продукт.
Атомы углерода могут быть связаны различными способами. Они образуют аллотропы углерода. Аллотропы – это разные формы элемента с разными физическими свойствами, но схожими химическими свойствами. Он находится в одном и том же физическом состоянии в двух или более кристаллических формах. Самые популярные из них – графит и алмаз.
Оба имеют разную кристаллическую структуру. Различия между графитом и алмазом : Графит : Он имеет три ковалентные связи вокруг одного атома углерода. Имеет планарную структуру. Он состоит из гибридизированного атома углерода sp 2 . Он имеет относительную плотность 2,3. Он имеет черный цвет и непрозрачен. Это хороший проводник электричества. Это очень хорошая смазка и самые мягкие из известных материалов, жирные на ощупь. Определенные формы графита используются в теплоизоляции, а некоторые другие – в теплопроводности.Он горит на воздухе при температуре 700-800 o C с образованием двуокиси углерода. Он не растворяется во всех обычных растворителях. Diamond : Встречается в свободном состоянии естественным образом.Это очень стабильный аллотроп углерода, состоящий из четырех ковалентных связей вокруг одного атома углерода. Он имеет гранецентрированную кубическую кристаллическую структуру. Он состоит из sp 3 гибридизованных атомов углерода. Он прозрачен и имеет высокую относительную плотность. Он также имеет высокий показатель преломления 2,45. Это непроводник тепла и электричества.Алмаз – самый твердый природный минерал, обнаруженный до сих пор. Он горит на воздухе при температуре 900 o C с образованием двуокиси углерода. Он не растворим во всех растворителях. И графит, и алмаз находятся в твердом состоянии. Оба они очень хрупкие. Плотность различных форм углерода зависит от их происхождения. Есть форма углерода, которая чиста, как уголь, а другая форма может быть не чистой и представляет собой смесь водорода и углерода.
Самая чистая форма углерода – фуллерен. У них есть потенциал функционировать как полупроводник, проводник и сверхпроводник при определенных условиях.Они также могут изменять пропускание света в зависимости от интенсивности, что называется фотометрическим эффектом. Они безопасны и инертны. Они также создают активные деривативы.
3) ДОПОЛНИТЕЛЬНАЯ РЕАКЦИЯ : Углерод обладает способностью образовывать длинные цепочки или цепочки атомов. Это называется реакцией присоединения
. Ненасыщенные соединения подвергаются этой реакции, чтобы стать насыщенными.Пример: Когда этен, содержащий двойную связь, нагревается в присутствии водорода с использованием никелевого катализатора, образуется этан.
CH 2 = CH 2 + H 2 + (никелевый катализатор) ⇨ CH 3- CH 3 Реакция замещения – это реакция, в которой функциональная группа в соединении заменяется другой функциональной группой ,
Пример) CH 3 Cl + OH – —-> CH 3 OH + Cl –
Конверсия углекислого газа в метанол: возможности и фундаментальные проблемы
1. Введение
В настоящее время спрос на энергию быстро растет из-за экономического роста во всем мире. Чтобы удовлетворить этот растущий спрос, необходимо большое количество ископаемого топлива (нефть, уголь и природный газ) [1]. Сжигание ископаемого топлива часто рассматривается как одна из основных угроз для окружающей среды из-за выброса CO 2 в атмосферу. CO 2 , который считается первичным парниковым газом (ПГ), периодически обменивается на поверхности суши, океана и атмосферы, где различные существа, включая животных, растения и микроорганизмы, поглощают и производят его ежедневно.Тем не менее, процесс выделения и потребления CO 2 должен быть сбалансирован по своей природе. С 1750 года, когда началась промышленная революция, изменилось изменение климата в связи с деятельностью, связанной с промышленностью. Чтобы сократить выбросы парниковых газов, процессы секвестрации и хранения CO 2 (CSS) получили широкое внимание. Однако это увеличит количество доступного уловленного CO 2 в качестве сырья с нулевой стоимостью. Таким образом, использование CO 2 и преобразование его в топливо и химические вещества, которое называется процессом улавливания и рециркуляции углерода (CCR), является активным вариантом, используемым во всем мире для преобразования пригодных для использования продуктов в ценные продукты, и он используется для уменьшения выбросов CO 2 выбросов, что более предпочтительно по сравнению с вариантом CSS [2, 3, 4, 5].В последние годы преобразование CO 2 в химикаты с добавленной стоимостью (например, этанол, метанол и муравьиную кислоту) с использованием различных способов привлекло большое внимание исследователей, поскольку его можно рассматривать как решение для сокращения глобального потепление [6, 7, 8], энергетический кризис (т. е. истощение запасов ископаемого топлива) [9, 10, 11] и проблемы хранения энергии [12]. Метанол – это возобновляемый источник энергии, который можно производить из любого сырья, содержащего углерод (в основном, CO 2 ), а также это чистый источник энергии, который можно использовать в качестве транспортного топлива.В целом, чтобы топливо удовлетворяло рыночный спрос, оно должно быть экологически безопасным, чистым и пригодным для синтеза из доступных ресурсов. Фактически, в настоящее время большинство производственных компаний по всему миру используют метанол в качестве сырья для производства различных продуктов. Метанол используется для производства таких растворителей, как уксусная кислота, на которые приходится 10% мирового спроса [13]. Метанол также может использоваться в топливных элементах с прямым метанолом (DMFC), которые используются для преобразования химической энергии метанола непосредственно в электрическую энергию в условиях окружающей среды [14].Метанол считается одним из важнейших видов органического сырья, которое может использоваться в отраслях промышленности с годовым объемом производства 65 миллионов тонн во всем мире [15]. Однако термин «экономика метанола» включает антропогенный углеродный цикл для производства метанола, как показано на рисунке 1, который можно использовать в качестве возобновляемого топлива или для производства почти всех продуктов, получаемых из ископаемого топлива [16, 17]. Завод Джорджа Олаха компании Carbon Recycling International (CRI) считается крупнейшим в мире заводом по производству метанола с CO 2 .В 2015 году компания Carbon Recycling International (CRI) увеличила мощность завода с 1,3 миллиона литров метанола в год до более 5 миллионов литров в год. Сейчас завод перерабатывает 5,5 тыс. Тонн CO 2 в год. Вся энергия, используемая на станции, поступает из исландской сети, которая вырабатывается за счет геотермальной и гидроэнергии [18]. Как показано на рисунке 2, установка использует электричество для производства H 2 , который вступает в реакцию с CO 2 в каталитической реакции производства метанола.Различные пути и процессы превращения CO 2 в метанол схематически описаны на рисунке 3. Существуют различные пути превращения CO 2 , такие как каталитический метод, который осуществляется в форме обычного, электрокаталитического, фотокаталитического и фотоэлектрокаталитического преобразования [ 19].
Рисунок 1.
Антропогенный углеродный цикл для производства метанола [20].
Рис. 2.
Производство зеленого метанола компанией Carbon Recycling International [18].
Рисунок 3.
Схема процессов химической конверсии СО2.
2. Методы преобразования CO 2 в метанол
2.1. Химическая конверсия
Каталитическое гидрирование CO 2 с H 2 считается наиболее простым способом получения метанола и ДМЭ из CO 2 , как показано в уравнении. (1). В течение 1920-х и 1930-х годов в США работали первые заводы по производству метанола, которые использовали CO 2 и H 2 для производства метанола.Системы как гетерогенных, так и гомогенных катализаторов изучались многими исследователями для процесса гидрирования CO 2 . Однако гетерогенные катализаторы имеют много преимуществ с точки зрения разделения, стабильности, обращения, стоимости и рециркуляции катализатора. Системы гетерогенных и гомогенных катализаторов обсуждаются в следующих разделах [21, 22, 23].
CO2 + 3h3↔Ch4OH + h3O∆h398K = −11,9 ккалмольE1
2.1.1. Гетерогенная каталитическая конверсия
Хотя гомогенный катализ также используется для производства метанола из CO 2 , гетерогенный катализ является предпочтительным выбором для инженеров-химиков из-за преимуществ гетерогенного катализа.Это включает в себя легкое отделение жидкости от твердого катализатора, удобное обращение с реакторами различных типов (т.е. с неподвижным, псевдоожиженным или подвижным слоем), а также возможность регенерации использованного катализатора. В последнее время было проведено большое количество экспериментов по разработке стабильных и эффективных гетерогенных катализаторов восстановления CO 2 с получением метанола. Однако многие исследования доказали, что катализаторы на основе меди с различными добавками, такими как ZrO 2 и ZrO, играют важную роль в повышении стабильности и активности гетерогенного катализатора (рис. 4).Таким образом, некоторые из катализаторов, которые показаны на рисунке 4, уже существуют и используются на демонстрационных и пилотных установках. Некоторые металлы (например, Cu и Zn) и их оксиды были разработаны для использования в качестве эффективного гетерогенного катализатора для превращения CO 2 в метанол [24, 25]. Этот тип катализатора аналогичен катализаторам на основе Cu / ZnO / Al 2 O 3 , которые используются для производства метанола в промышленности. Однако было доказано, что коммерческий метанольный катализатор, такой как гетерогенная смесь оксида цинка, оксида алюминия и меди (30, 10 и 60% соответственно), производит очень небольшое количество метанола [26].В различных обзорах обсуждались различные факторы, которые могут влиять на производство метанола из синтез-газа, такие как приготовление катализатора, конструкция катализатора, кинетика реакции, конструкция реактора и дезактивация катализатора [22, 27, 28, 29, 30]. Следовательно, будущие исследовательские работы должны быть сосредоточены на производстве метанола из CO 2 и H 2 , в которых количество метанола, полученного таким способом, выше по сравнению с синтез-газом. Чтобы поддерживать высокую производительность установки, катализатор должен оставаться активным в течение нескольких лет.Более того, повышение активности и стабильности катализатора с течением времени очень важно для экономики любого завода по производству метанола [31]. Недавно Lurgi, лидер в области технологий синтеза метанола, сотрудничал с Süd-Chemie, используя высокоактивный катализатор (C79-05-GL, на основе Cu / ZnO) для преобразования CO 2 и H 2 в метанол [24, 32]. Реактор метанола Lurgi представляет собой конвертер на основе трубок, который содержит катализаторы в неподвижных трубках и использует контроль давления пара для достижения реакции с контролируемой температурой.Этот тип реактора может обеспечить низкий коэффициент рециркуляции и высокий выход. Поэтому Lurgi была разработана как двухступенчатая конвертерная система, в которой используются два объединенных реактора Lurgi для высоких мощностей по метанолу. Однако объемные скорости и температуры в первом конвертере будут выше, чем в одноступенчатом конвертере, в котором требуется только частичное преобразование синтез-газа в метанол. Это делает конвертер меньше по размеру и производит пар под высоким давлением из-за высоких температур, что помогает снизить затраты на электроэнергию.Газ, выходящий из первого конвертера, содержит метанол, и он будет напрямую отправлен на вторую стадию реакции, которая работает с более низкой скоростью реакции [31]. Даже если рабочая температура системы Lurgi составляет около 260 ° C, что выше, чем температура, используемая для обычных катализаторов для производства метанола, селективность этой системы по метанолу превосходна. Однако активность этого катализатора снижается с той же скоростью, что и активность коммерческого катализатора, который в настоящее время используется в промышленности для производства метанола.Есть разные компании, продающие высокостабильные катализаторы для производства метанола, такие как Mitsubishi Gas Chemical, Sinetix и Haldor Topsøe. Arena et al. [33] изучили твердотельные взаимодействия, функциональность и адсорбционные центры катализаторов Cu – ZnO / ZrO 2 и его способность превращать CO 2 в метанол. Данные характеризации показали, что сильное взаимодействие Cu – ZnO эффективно способствует диспергированию металлической меди и ее реакционной способности по отношению к кислороду. Граница раздела металл / оксид в катализаторах Cu – ZnO / ZrO 2 играет важную роль в гидрировании CO 2 до метанола.Как показано на рисунке 5, двухцентровая природа реакционного пути объясняет формально нечувствительный к структуре характер конверсии CO 2 на катализаторах Cu – ZnO / ZrO 2 .
Рис. 4.
Подложки и добавки, используемые для катализаторов на основе меди.
Рис. 5.
Гетерогенно-каталитический процесс превращения CO2 в метанол с использованием Cu / ZrO2 и Cu-ZnO / ZrO2 [33].
2.1.2. Гомогенная каталитическая конверсия
2.1.2.1. Гомогенные катализаторы для CO 2 Гидрирование с получением метанола
Хотя для прямого превращения CO 2 в метанол были испытаны различные гетерогенные катализаторы, в литературе упоминается очень ограниченное количество гомогенных катализаторов.Tominaga et al. [34] сообщили о примере прямого превращения CO 2 в метанол с использованием гомогенных катализаторов. Они исследовали способность предшественника катализатора Ru 3 (CO) 12 в присутствии добавки KI для гидрирования CO 2 образовывать метан, метанол и CO. Кроме того, теми же авторами было доказано, что производительность Ru 3 (CO) 12 –KI для конверсии CO 2 намного лучше, чем у других карбонильных катализаторов переходных металлов, таких как W (CO) 6 ,, Fe 2 (CO) 9 , Ir 4 (CO) 12 , Mo (CO) 6, Co 2 (CO) 8 и Rh 4 (CO) 12 [35].В последнее время для восстановления CO 2 до метанола вместо шестиэлектронного процесса был использован каскадный процесс [36]. Каскадный процесс с использованием гомогенных катализаторов можно разделить на три стадии: гидрирование CO 2 до муравьиной кислоты; затем муравьиная кислота будет этерифицирована с образованием сложных эфиров формиата; и, наконец, сложный эфир формиата будет гидрогенизирован с получением метанола (рис. 6), как указано Хаффом и Сэнфордом [36].
Рисунок 6.
Гидрирование CO2 для производства метанола через каскадную систему [36].
На каждой стадии этого подхода будут использоваться разные катализаторы при определенных условиях реакции, которые включают высокую температуру (135 ° C) и давление (40 бар). Wesselbaum et al. [37] сообщили о гидрировании CO 2 60 барами H 2 и 20 барами CO 2 при 140 ° C в присутствии [(трифос) Ru- (TMM)] (TMM = триметиленметан, Трифос = 1,1,1-трис (дифенилфосфинометил) этан), что дает максимальное число оборотов 221. Таким образом, те же авторы доказали, что этот катализатор можно использовать в процессе гидрирования для превращения сложных эфиров формиата в метанол.Помимо прямого превращения CO 2 в метанол, превращение производных CO 2 путем гидрирования, таких как поликарбонаты, карбонаты, формиаты и карбаматы, привлекло огромное внимание из-за небольших барьеров этих реакций (рис. 7) [38, 39].
Рис. 7.
Непрямое гидрирование CO2 для производства метанола [39].
2.1.2.2. Гомогенное химическое превращение CO 2 в метанол
Силаны и гидриды являются основными восстановителями, которые должны использоваться при гомогенном химическом восстановлении CO 2 до метанола в присутствии органокатализаторов, таких как N-гетероциклические карбены (NHC).Хотя стоимость силанов высока, было доказано, что NHC-катализатор обладает способностью восстанавливать CO 2 до метоксидов в условиях окружающей среды, как указано Zhang et al. [40]. Как показано на рисунке 8, производные силанола и метанола будут производиться гидролизом метоксисиланов.
Рис. 8.
Катализируемая NHC конверсия CO2 и последующий гидролиз метанола [40].
Применение фрустрированных пар Льюиса для восстановления CO 2 до метанола считается еще одним примером безметаллового катализа (Рисунок 9) [41].На первом этапе производное форматобората получают посредством реакции между CO 2 и [TMPH] + [HB (C 6 F 5 ) 3 ] – . Координационно ненасыщенный B (C 6 F 5 ) 3 атакует нуклеофильные и промежуточные формы с форматным мостиком.
Рис. 9.
Гидрирование CO2, катализируемое кислотой Льюиса / основанием Льюиса [44].
После этого последний будет реагировать с [TMPH] + [HB (C 6 F 5 ) 3 ] – с образованием ацетального производного формальдегида.Реагент Шварца ((Cp) 2 Zr (H) (CI)) использовали в качестве источника гидрида для двухстадийного восстановления CO 2 до формальдегида и метанола, соответственно, как показано на (Рисунок 10) [42, 43]. На первом этапе превращение CO 2 в формальдегид дает некоторые м-оксокомплексы. Затем более глубокое восстановление формальдегида может быть достигнуто путем добавления большего количества реагента Шварца, что приводит к образованию метоксида циркония на второй стадии.
Рис. 10.
Двухступенчатое восстановление CO2 до метанола с помощью реактива Шварца [44].
2.2. Электрохимическое восстановление CO 2 до метанола
В течение последних десятилетий электрохимическое преобразование CO 2 широко использовалось в лабораторных масштабах, но пока не было успешно использовано в промышленных процессах (крупномасштабных). Электрохимический метод восстановления используется для преобразования CO 2 в ценные химические вещества и топливо, такое как метанол, с использованием электричества в качестве основного источника энергии [45, 46, 47]. Для восстановления CO 2 на металлических электродах было проведено множество экспериментов с различными условиями и электрокатализаторами [48].Различные восстановленные продукты могут быть образованы электрохимически из CO 2 , и некоторые из этих продуктов представлены в таблице 1. Выбор катализатора и условий реакции играет значительную роль по сравнению с возможностью регулирования между различными восстановленными продуктами. Однако все перечисленные стандартные потенциалы в таблице 1 относительно близки к стандартному потенциалу выделения водорода [49]. Реакция выделения водорода (HER) очень важна во время электрокаталитического восстановления CO 2 , в котором H 2 O обычно присутствует в качестве электролита (и источника протонов).По этой причине указанные металлы, которые можно использовать в качестве электрокатализатора для восстановления CO 2 , имеют относительно высокие перенапряжения HER. Необходимо приложить огромные усилия, чтобы найти оптимальный электрод для электрохимического восстановления CO 2 , который снизит селективность CO 2 при низких перенапряжениях и высоких скоростях без одновременного восстановления воды [44].
| Реакция полуэлементов | E ° по сравнению с SHE |
|---|---|
| CO2 + 8H ++ 8e- → Ch5 + 2h3O | +0.17 |
| CO2 + 6H ++ 6e− → Ch4OH + h3O | +0.031 |
| CO2 + 4H ++ 4e− → Ch3O + h3O | −0.028 |
| CO2− + 2H ++ 2e → CO + h3O | −0,10 |
| CO2 + 2H ++ 2e− → HCOOH | −0,11 |
Таблица 1.
Стандартные потенциалы для восстановления CO 2 [49].
Существует явное преимущество прямого преобразования захваченного CO 2 в метанол для получения полезного продукта, который можно использовать во многих энергопотребляющих устройствах.Этот процесс позволяет рециркулировать захваченный CO 2 и производить метанол, который можно использовать в качестве возобновляемой энергии вместо ископаемого топлива в энергопотребляющих устройствах. Другими словами, с помощью процесса электровосстановления CO 2 может быть восстановлен непосредственно в электролизной ячейке обратно до метанола за один этап. Для получения метанола непосредственно из CO 2 [44] можно использовать различные электроды, как показано в таблице 2. В 1983 году Кэнфилд и Фрезе [50] доказали, что некоторые полупроводники, такие как n -GaAs, p -InP и p -GaAs обладают способностью производить метанол непосредственно из CO 2 , хотя и при чрезвычайно низких плотностях тока и фарадеевской эффективности (FE).Многие другие исследователи приложили некоторые усилия для увеличения как плотности тока, так и фарадеевской эффективности процесса. Seshadri et al. [51] обнаружили, что ион пиридиния представляет собой новый гомогенный электрокатализатор для восстановления CO 2 до метанола при низком перенапряжении. В последнее время широко исследуется пиридин, в котором он используется в качестве сокатализатора для образования активных частиц пиридиния in situ [52, 53, 54, 55, 56]. Обычно продукты одноэлектронного восстановления CO 2 показывают более низкую плотность тока, чем продукты двухэлектронного восстановления, такие как CO.Прямое электрохимическое восстановление CO 2 до метанола является многообещающим процессом для уменьшения количества захваченного CO 2 .
| Электрод | Тип электрода | E по сравнению с NHE (В) | Плотность тока (мА см −2 ) | Фарадейская эффективность | Электролитическая эффективность (%)Ссылка | |
|---|---|---|---|---|---|---|
| p -InP | Semiconductor | -1.06 | 0,06 | 0,8 | Сб. Na 2 SO 4 | [50] |
| n-GaAs | 0,16 | 1,0 | ||||
| p -GaAs | 0,08 | 9027 9027 оксид Cu−1,3 | 6,9 | 28 | 0,5 M KHCO 3 | [59] |
| RuO 2 / TiO 2 Нанотрубки | −0.6 | 1 | 60 | 0,5 M NaHCO 3 | [58] | |
| Pt – Ru / C | Сплав | −0,06 | 0,4 | 7,5 Поточная ячейка | 9027 ]||
| n -GaP | Гомогенный катализатор | −0,06 | 0,27 | 90 | 10 мМ пиридина при pH = 5,2 | [61] |
| 0,027 Pd | 30 | 0.5 M NaClO4 с пиридином | [51] |
Таблица 2.
CO 2 электрохимическое восстановление до метанола.
Popić et al. [57] доказали, что Ru и Ru, модифицированные адатомами Cd и Cu, можно использовать в качестве электрода для восстановления CO 2 при относительно небольших перенапряжениях. Полученные результаты показали, что на поверхности чистого Ru, Ru, модифицированного адатомами Cu и Cd, и RuOx + IrOx, модифицированного адатомами Cu и Cd, достигается восстановление CO 2 с образованием метанола за 8 ч выдерживания потенциала при -0.8 В. Таким образом, в случае восстановления CO 2 на Ru, модифицированном адатомами Cu и Cd, образование метанола зависело от наличия адатомов на поверхности рутения. RuO 2 является перспективным материалом для использования в качестве электрода для восстановления CO 2 до метанола благодаря его высокой электрохимической стабильности и электропроводности. По этой причине Qu et al. [58] приготовили композитные электроды из наночастиц (НЧ) и нанотрубок (НТ) RuO 2 / TiO 2 путем нанесения RuO 2 на наночастицы и нанотрубки TiO 2 соответственно.Полученные результаты показали, что эффективность по току получения метанола из CO 2 составляет до 60,5% на платиновом электроде, модифицированном RuO 2 / TiO 2 НТ. Таким образом, композитные электроды НЧ RuO 2 и RuO 2 / TiO 2 показали более низкую электрокаталитическую активность, чем композитный модифицированный Pt электрод RuO 2 / TiO 2 НТ для электрохимического восстановления CO 2 до метанола. Как показали исследования, для повышения селективности и эффективности процесса электрохимического восстановления CO 2 в качестве электрода предлагается использовать структуру нанотрубок.
2.3. Фотохимическое восстановление CO 2 в метанол
Обычно фотохимический (или фотокаталитический) метод преобразования CO 2 используется для преобразования захваченного CO 2 в метанол и другие ценные продукты с использованием солнечной энергии, такой как свет или лазер [ 62, 63]. Даже если селективность по метанолу относительно низка, прямое преобразование CO 2 в метанол с использованием фотокаталитического метода было изучено [64]. Однако в последнее время этому методу уделяется большое внимание, и он считается наиболее привлекательным методом утилизации CO 2 .Фотокаталитический процесс конверсии CO 2 представляет собой сложную комбинацию фотофизических и фотохимических процессов вместе [62]. Следовательно, этот метод имеет некоторое сходство с электрокаталитическим восстановлением CO 2 , в котором в обоих случаях используются молекулярные катализаторы. Источники жидкого гидрида считаются основным ограничением для восстановления CO 2 фотокаталитическим методом. Аскорбиновая кислота, амин и 1-бензил-1,4-дигидроникотинамид являются примерами жертвенного источника гидрида, который необходимо добавлять в раствор для замены анода, который будет использоваться в процессе электрокаталитического восстановления CO 2 [65] ,Было проведено несколько экспериментов для проверки способности некоторых полупроводников и оксидов металлов преобразовывать СО2 в метанол. Сюда входят карбид кремния [66], TiO 2 [67, 68, 69, 70], WO 3 [71], NiO [70], ZnO [70] и InTaO 4 [72] либо сами по себе или их можно комбинировать с различными гетерогенными катализаторами для достижения той же цели. Основная проблема при производстве метанола на полупроводниках с использованием солнечной энергии заключается в том, что реакция образования обратима.Таким образом, чтобы уменьшить окисление метанола, очень важно найти новые стратегии для достижения практического промышленного процесса [66, 70].
Gondal et al. [66] доказали, что гранулированный карбид кремния является перспективным фотокатализатором для восстановления CO 2 до метанола. Гранулированный карбид кремния (α6H-SiC) был испытан в качестве фотокатализатора для восстановления CO 2 и преобразования его в метанол с помощью лазера с длиной волны 355 нм. Реакционная ячейка была заполнена гранулами α6H-SiC, сжатым газом CO 2 под давлением 50 psi и дистиллированной водой.Поэтому они упомянули, что в фотохимическом процессе существует пара конкурирующих реакций, а именно фотоокисление и фото восстановления, как показано на рисунке 11. Когда реакция начинается, скорости фотоокисления (Ко) будут ниже, чем скорости фото восстановления. (Kr) из-за низкой концентрации производимого метанола. Полученные результаты показали, что максимальная молярная концентрация метанола и достигнутые фотонные эффективности преобразования CO 2 в метанол составляли около 1.25 ммоль / л и 1,95% соответственно.
Рис. 11.
Схематическое изображение реакций фотовосстановления и фотоокисления в фотохимическом процессе [67].
CdS / TiO 2 и Bi 2 S 3 / TiO 2 Фотокатализаторы на основе нанотрубок были протестированы Li et al. [67], и их фотокаталитическая активность, которая восстанавливает CO 2 до метанола при облучении видимым светом. Полученные результаты доказали, что синтетические тротилы являются практически хорошим материалом для фотовосстановления при превращении CO 2 в метанол.Наибольшее образование метанола на фотокатализаторах ТНТ – CdS и ТНТ – Bi 2 S 3 при облучении видимым светом в течение 5 ч составило 159,5 и 224,6 мкмоль / л соответственно. Луо и др. [68] изучали способность Nd / TiO 2 , синтезированного золь-гель методом, восстанавливать CO 2 в метанол в водном растворе при УФ-облучении. Эксперимент показал, что максимальный выход метанола при УФ-облучении в течение 8 часов составил 184,8 мкмоль / г, что доказывает, что Nd / TiO 2 может повысить эффективность фотокаталитического восстановления CO 2 по сравнению с чистым оксидом титана.
2.4. Фотоэлектрохимическое восстановление CO 2 до метанола
Процесс фотоэлектрокаталитического восстановления CO 2 представляет собой сочетание фотокаталитического и электрокаталитического методов. Многие исследовательские работы были сосредоточены на поиске лучшего полупроводникового материала, который можно было бы использовать в качестве фотоэлектрода для преобразования CO 2 в метанол с использованием любой солнечной энергии в ячейке PEC; однако ни один из протестированных полупроводников не соответствовал желаемой стабильности и эффективности [73].Фактически, для фотоэлектрохимического восстановления CO 2 требуется около 1,5 эВ подвода термодинамической энергии. Следовательно, элемент PEC требует больших затрат энергии для компенсации потерь, вызванных изгибом зон (который необходим для разделения заряда на поверхности полупроводника), потенциалами перенапряжения и потерями сопротивления [61, 74, 75, 76, 77, 78, 79, 80, 81]. Первым важным шагом для восстановления CO 2 до метанола фотоэлектрохимическим (PEC) методом является генерация ионов водорода и электронов солнечным излучением полупроводника, который используется в качестве фотокатода.Полупроводник (например, GaP, SiC) освещается светом как источником энергии, превышающей ширину запрещенной зоны полупроводника. В этом случае электроны в полупроводнике будут возбуждены и перенесены в зону проводимости из зоны валанса, и они достигнут катодного противоэлектрода через внешний электрический провод. Кроме того, для проведения реакций электрохимического восстановления и окисления созданные электронно-дырочные пары на границе раздела или рядом с ним будут разделены полупроводником и впрыснуты в электролит [82, 83, 84].Основной проблемой при использовании фотоэлектрохимических ячеек является способность полупроводниковых материалов n-типа генерировать дырки на поверхности, которые могут окислять сам полупроводник [85]. В последнее время огромное внимание привлекла гибридная система, состоящая из полупроводникового светоуборочного комбайна и комплекса металлических сокатализаторов. В этой системе вода считается основным источником доноров электронов и протонов для восстановления CO 2 на поверхности катода. Пример гибридной системы обсуждался Zhao et al.[86]. Они исследовали полную ячейку фотокатода с InP / Ru-комплексами, которая была соединена с фотоанодом на основе TiO2 / Pt, как показано на рисунке 12. В этой полной ячейке, чтобы избежать повторного окисления формиата на поверхности фотоанода, в качестве сепаратора использовалась протонообменная мембрана. Однако Arai et al. сконструировал беспроводную полную ячейку для фотоэлектрохимического восстановления CO 2 , в которой система состоит из InP / Ru-комплекса в качестве гибридного фотокатода и фотоанода SrTiO 3 (рис. 13).В этой системе окислительно-восстановительные реакции CO 2 и H 2 O будут происходить под воздействием солнечного излучения без какого-либо смещения. Полученные результаты показали, что эффективность преобразования солнечной энергии в химическую в этих двух полных ячейках составила 0,03% и 0,14% для TiO2 – InP / [RuCP] и SrTiO3 – InP / [RuCP] соответственно. Barton et al. [61] успешно восстановили CO 2 до метанола с помощью катализированного фотоэлектрохимического элемента (PEC) на основе p-GaP в процессе, называемом химическим уменьшением выбросов углерода.Термин «уменьшение химического углерода» описывает фотоиндуцированное преобразование CO 2 в метанол без использования дополнительного источника энергии, генерирующего CO 2 . Полученные результаты показали, что селективность метанола и конверсия CO 2 составили 100 и 95% соответственно.
Рис. 12.
Двухкамерный фотоэлектрохимический элемент для восстановления CO2 [87].
Рис. 13.
Однокамерный фотоэлектрохимический элемент для восстановления CO2 [87].
3. Перспективы на будущее и выводы
Конверсия двуокиси углерода представляет собой как возможность, так и проблему во всем мире для обеспечения устойчивости окружающей среды и энергетики. Основные стратегии сокращения выбросов CO 2 должны быть сосредоточены на использовании CO 2 , переработке CO 2 в сочетании с возобновляемой энергией для экономии источников углерода и производстве полезных химикатов из CO 2 . Следовательно, преобразование CO 2 в энергетический продукт, такой как метанол, потребует большого количества захваченного CO 2 , в котором рынок метанола потенциально может быть значительным.Кроме того, образующийся метанол можно использовать вместо ископаемого топлива, таким образом снижая зависимость от ископаемого топлива и внося вклад в рост рынка использования CO 2 . Здесь представлена полная литература по различным методам преобразования CO 2 в метанол. Это включает гомогенное / гетерогенное каталитическое, электрохимическое, фотохимическое и фотоэлектрохимическое восстановление. Однако высокая производительность в процессе конверсии CO 2 может быть достигнута за счет использования эффективного катализатора.В общем, разработка необходимого катализатора может быть использована в качестве решения, если катализатор уже используется, но требуется высокая стоимость для увеличения масштаба, или он не существует и ожидает открытия, поэтому проблемы в каталитических процессах действительно огромны. Низкая селективность по продукту и низкие / высокие температуры реакции считаются основными препятствиями в гетерогенном процессе восстановления CO 2 . Однако приведенное выше обсуждение показывает, что среди различных способов, предлагаемых для преобразования CO 2 в метанол или в любое ценное химическое вещество, электрохимические ячейки являются предпочтительными по сравнению с другими методами.Тем не менее, при электрохимическом восстановлении CO 2 все еще существует множество барьеров, при котором электрокатализатор необходимо использовать с более высокой селективностью, а также с более низкими перенапряжениями. Различные гетерогенные электрокатализаторы являются селективными, быстрыми и энергоэффективными, но они считаются нестабильными катализаторами. Следовательно, в будущем электроэнергия, необходимая для электрохимического процесса восстановления CO 2 в больших масштабах, может поступать из различных возобновляемых источников энергии, таких как гидроэнергия, ветер, волны, геотермальные источники, приливы и т. Д.В этом смысле многие исследовательские работы должны быть сосредоточены на новых электрокаталитических материалах, которые можно использовать для работы при более высоких плотностях тока без потери фарадеевской эффективности. С другой стороны, фотохимические процессы предлагают привлекательный подход к восстановлению CO 2 до метанола с использованием солнечной энергии. Однако этот метод не получил широкого распространения из-за критических условий для поглощения необходимого количества солнечной энергии. В противном случае перспективы разработки успешных технологий для эффективного преобразования CO 2 с использованием солнечной энергии, безусловно, являются долгосрочными (> 5 лет).Тем не менее, процессы фотоэлектрохимического восстановления оказались привлекательными подходами для восстановления CO 2 до метанола. В настоящее время применение солнечных фотоэлектрохимических устройств очень ограничено из-за их высокой стоимости и нескольких причин, как обсуждалось выше. Однако очень важно продолжать исследования в этих областях, потому что эта технология будет крайне необходима для эффективного сокращения выбросов CO 2 в ближайшие годы.
Благодарности
Авторы хотели бы поблагодарить Центр перспективных материалов Катарского университета (QU) за поддержку этой работы.Г-жа Саджеда Альсайде также благодарит QU за предоставленную ей стипендию для выпускников.
.
