Физические свойства вольфрама: Свойства вольфрама как металла | СпецМеталлМастер
alexxlab | 18.05.1988 | 0 | Разное
получение, свойства, основные соединения, область применения
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ РФ
ВЯТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
КАФЕДРА
НЕОРГАНИЧЕСКОЙ
И ФИЗИЧЕСКОЙ ХИМИИ
Контрольная
работа
Тема:
“Вольфрам: получение, свойства, основные
соединения, область применения.”
Выполнила
студентка:
шифр 09-ЭКУу-6738
Проверила,
к.х.н., доцент:
Киров, 2010г.
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
Вольфрам
– (Wolframium), W – химический элемент VI группы
периодической системы Д. И.Менделеева,
атомный номер 74, атомная масса 183,85 г/моль.
Радиус атома 141 пм. Наиболее характерна
степень окисления +6. Известны соединения
со степенями окисления вольфрама +5, +4,
+3, +2 и 0.
И.Менделеева,
атомный номер 74, атомная масса 183,85 г/моль.
Радиус атома 141 пм. Наиболее характерна
степень окисления +6. Известны соединения
со степенями окисления вольфрама +5, +4,
+3, +2 и 0.
Еще в 14-16 вв. горняки и металлурги в Рудных горах Саксонии отмечали, что некоторые руды нарушали процесс восстановления оловянного камня (минерала касситерита,), приводили к зашлаковыванию расплавленного металла. Рудокопы дали этой “надоедливой” породе названия “Wolfert” и “Wolfrahm”, что в переводе означает “волчья пена”.
В
1783 в Испании братья д’Эльгуйяр при помощи
азотной кислоты выделили из этого минерала
“кислую землю” — желтый осадок оксида
неизвестного металла, растворимый в аммиачной
воде. В минерале также были обнаружены
оксиды железа и марганца. Хуан и Фаусто
прокалили “землю” с древесным углем
и получили металл, который они предложили
называть “вольфрамом”, а сам минерал
— “вольфрамитом”. Таким образом,
испанские химики д’Эльгуйяр первыми
опубликовали сведения об обнаружении
нового элемента.
В 1758 шведский химик и минералог Аксель Фредрик Кронштедт открыл и описал необычайно тяжелый минерал , названный в последствии шеелитом. Кронштедт был убежден, что этот минерал содержит новый, еще не открытый, элемент.
В 1781 великий шведский химик Карл Шееле разложил “тяжелый камень” азотной кислотой, обнаружив при этом, помимо соли кальция, “желтую землю”,
не похожую на белую “молибденовую землю”, впервые выделенную им же три года назад. Интересно, что один из братьев д’Эльгуйяр работал в то время в его лаборатории. Шееле назвал металл “tungsten”, по названию минерала, из которого был впервые выделен желтый оксид. Так у одного и того же элемента появилось два названия.
Вольфрам долго не находил промышленного применения. Лишь во второй половине 19 века начали изучать влияние добавок вольфрама на свойства стали.
1 ПОЛУЧЕНИЕ ВОЛЬФРАМА
Вольфрам
— довольно редкий элемент, его кларк
(процентное содержание в земной коре)
составляет 1,3·% (57-е
место среди химических
элементов).
Сырьем для получения вольфрама служат вольфрамитовые и шеелитовые концентраты (50-60%). Из концентратов непосредственно выплавляют ферровольфрам (сплав железа с 65-80% вольфрама), используемый в производстве стали; для получения вольфрама, его сплавов и соединений из концентрата выделяют вольфрамовый ангидрид. В промышленности применяют несколько способов получения . Шеелитовые концентраты разлагают в автоклавах раствором соды при 180-200°С (получают технический раствор вольфрамата натрия) или соляной кислотой (получают техническую вольфрамовую кислоту):
1. + = +
2. + = +
Вольфрамитовые
концентраты разлагают либо спеканием
с содой при 800-900°С с последующим
выщелачиванием вольфрамата натрия ( водой, либо обработкой
при нагревании раствором
едкого натра. При разложении
щелочными агентами (содой
или едким натром) образуется
раствор вольфрамата натрия ,
загрязненный примесями. После их отделения
из раствора выделяют
После их отделения
из раствора выделяют
получают
из порошка металлокерамическим
методом, то есть прессованием в стальных
прессформах под давлением 3000-5000
кгс/ и термической обработкой спрессованных
заготовок – штабиков.
Имеется
еще один способ получения окиси вольфрама
– через хлориды. Вольфрамовый концентрат
при повышенной температуре обрабатывают
газообразным хлором. Образовавшиеся
хлориды вольфрама довольно легко отделить
от хлоридов других металлов методом возгонки,
используя разницу температур, при которых
эти вещества переходят в парообразное
состояние. Полученные хлориды вольфрама
можно превратить в окисел, а можно пустить
непосредственно на переработку в элементарный
металл. Превращение окислов или хлоридов
в металл – следующая стадия производства
вольфрама.
карбиды
и другие соединения. Это приводит
к загрязнению металла. Между
тем электротехнике нужен весьма
чистый вольфрам. Всего 0,1% железа делает
вольфрам хрупким и малопригодным
для изготовления тончайшей проволоки.
Это приводит
к загрязнению металла. Между
тем электротехнике нужен весьма
чистый вольфрам. Всего 0,1% железа делает
вольфрам хрупким и малопригодным
для изготовления тончайшей проволоки.
Получение вольфрама из хлоридов основано на процессе пиролиза. Вольфрам образует с хлором несколько соединений. С помощью избытка хлора все их можно перевести в высший хлорид –, который разлагается на вольфрам и хлор при 1600°C. В присутствии водорода этот процесс идет уже при 1000°C.

2 ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
2.1 ФИЗИЧЕСКИЕ СВОЙСТВА ВОЛЬВРАМА
Вольфрам – металл серебристо-белого цвета, по внешнему виду похож на сталь: в порошкообразном состоянии – серого, тёмно-серого и даже черного цвета. Кристаллизуется в объемно-центрированной кубической решетке с периодом а = 0,31589 нм (-модификация).
К
самому выдающемуся физическому свойству
вольфрама относится его высокая температура
плавления 3410°С, при температуре около
1600оС хорошо поддается ковке и может
быть вытянут в тонкую нить; температура
кипения 5930оС. Вольфрам – один из
наиболее тяжелых металлов. От других
металлов отличается: высоким модулем
упругости (для проволоки модуль упругости
380-410 ГПа), по которым он превосходит все
металлы; низким давлением его паров
и малым коэффициентом сжимаемости, которые
являются самыми низкими по сравнению
со всеми остальными металлами. Вольфрам
обладает высокой коррозийной стойкостью,
при комнатной температуре не изменяется
на воздухе, малопластичен
.
Вольфрам
обладает высокой коррозийной стойкостью,
при комнатной температуре не изменяется
на воздухе, малопластичен
.
Плотность вольфрама составляет 19,3 г/, что соответствует плотности золота, но меньше, чем у платины, иридия, осмия и рения. Благодаря высокой плотности и сравнительно большому поперечному сечению захвата тепловых нейтронов вольфрам является эффективным защитным материалом.
Теплопроводность вольфрама составляет менее половины теплопроводности меди, но она намного выше, чем у железа или никеля. Хотя электропроводность вольфрама примерно втрое меньше электропроводности отожженной меди, она все же выше, чем у железа, никеля, ртути, платины и фосфористой бронзы.
Другие физические свойства вольфрама приведены в таблице 2.1.
Таблица 2.1
| Свойства | Единицы измерения | Показатели |
| Атомный диаметр | пм | 248 |
| Электронная конфигурация | [Xe] | |
| Молярный объем | см³/моль | 9,53 |
| Молярная теплоёмкость | Дж/(К∙моль) | 24,27 |
| Группа металлов | тугоплавкий металл | |
| Твердость по Бринеллю | кг/ | 488 |
| Удельное электросопротивление: | Ом см∙ | |
| при 20 оС | 5,5 | |
| при 2700оС | 90,4 | |
| Скорость звука в отраженном вольфраме | м/с | 4290 |
| Теплопроводность | Вт/(м·K) | 173 |
| Плотность в жидком состоянии | г/ | 16,65 |
| Твердость | HB | 350 |
| Теплота плавления | кДж/моль | 35 |
| Теплота испарения | кДж/моль | 824 |
| Цвет искры | Короткий желтый прерывистый пучок искр |
2. 2
ХИМИЧЕСКИЕ СВОЙСТВА
ВОЛЬФРАМА
2
ХИМИЧЕСКИЕ СВОЙСТВА
ВОЛЬФРАМА
Вольфрам
– один из наиболее коррозионно-устойчивых
металлов. В
обычных условиях химически стоек к действию
воды и воздуха, при 400-500°С заметно окисляется,
при температуре свыше 600°С окисляется
интенсивно, образуя вольфрамовый ангидрид . Не взаимодействует с водородом вплоть
до температуры плавления. При температуре
свыше 1500°С взаимодействует с азотом,
образуя нитрид . Галогены, сера, углерод,
кремний, бор взаимодействуют с вольфрамом
при высоких температурах (фтор с порошкообразным
вольфрамом – при комнатной). Твердый углерод при 1100 – 1200 °С
реагирует с вольфрамом, образуя карбиды
WC и . В обычных условиях
вольфрам стоек к соляной, серной, азотной
и плавиковой кислотам, а также к царской
водке, при 100°С слабо взаимодействует
с ними, быстро растворяется в смеси плавиковой
и азотной кислот. Растворы щелочей на
холоде не действуют на вольфрам. При нагревании
в растворах щелочей вольфрам растворяется
слегка, в расплавленных щелочах при доступе
воздуха или в присутствии окислителей
() интенсивно растворяется, образуя
соли.
В соединениях вольфрам проявляет степень окисления +2, +3, +4, +5, +6. В высших степенях окисления вольфрам обладает кислотными свойствами, в низших – основными. Соединения со степенью окисления +2 и +3 неустойчивы. Двухвалентный вольфрамам известен лишь в виде галогенидов. Из соединений вольфрама (IV) выделены в твёрдом виде устойчивые комплексные цианиды. Наибольшее практическое значение в анализе имеют соединения вольфрама (V) и (VI). Вольфрам (II) и (III) является сильным восстановителем, окислительная способность вольфрама (VI) проявляется слабо.
Поведение
вольфрама в растворах сложно,
особенно поведение в кислых
растворах, из-за отсутствия простых
соединений. Существенное значение
имеет его склонность к комплексообразованию.
Вследствие того, что в комплексных соединениях
индивидуальные свойства отдельных
элементов проявляются ярче, чем в простых,
комплексоообразование вольфрама широко
используют для его определения
в присутствии близких по свойствам
элементов.
3 ОСНОВНЫЕ СОЕДИНЕНИЯ
Из соединений вольфрама наибольшее значение имеют: триоксид вольфрама или вольфрамовый ангидрид, вольфроматы, перекисные соединения (с общей формулой ME2WOX ), соединения с галогенами, серой и углеродом.
Что такое вольфрам? Вольфрам, свойства атома, химические и физические свойства.
Содержание
- Краткое описание
- История открытия и изучения
- Физические свойства
- Химические свойства
- Запасы и добыча
- Нахождение в природе
- Месторождения
- Получение
- Сплавы
- Плюсы и минусы металла
- Переработка вольфрамового сырья.
- Свойства простого вещества.
- Свойства важнейших соединений вольфрама.
- Как используется
- Применение вольфрама и сплавов востребовано в разных сферах
- Виды продукции
- Другие формы
- Биологическая роль
- Факторы, ограничивающие применение вольфрама
Краткое описание
Вольфрам — тугоплавкий металл.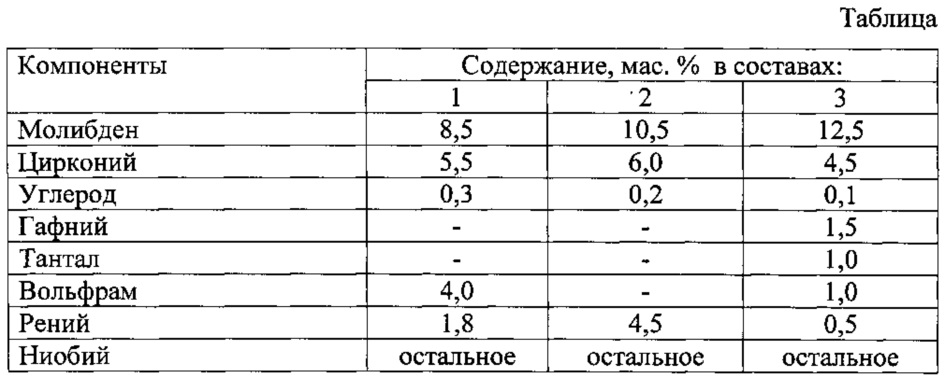 В таблице Менделеева его можно найти под номером 74. Характерные качества — серый цвет, естественный металлический блеск.
В таблице Менделеева его можно найти под номером 74. Характерные качества — серый цвет, естественный металлический блеск.
Во Франции, Великобритании и США этот материал называется tungsten, что переводится как «тяжелый камень».
История открытия и изучения
Свое название металл получил от минерала вольфрамит. Его начали добывать в XVI веке. Тогда его называли «волчьей пеной». Вольфрам часто встречался в оловянных рудах, мешал выплавлять этот металл. Он переводил его в пену шлаков.
Первое научное упоминание о нахождении нового химического элемента появилось в 1781 году. Тогда знаменитый химик из Швеции Карл Шееле работал с минералом шеелит. Он обрабатывал его азотной кислотой, в ходе чего получил новый химический элемент с желтым оттенком. Он назвал его «тяжелым камнем». Через два года, братья Элюар получили из саксонского минерала новый металл.
Если сравнивать защиту от ионизирующего излучения из свинца или вольфрама, второй вид металла выигрывает.
Готовый защитный слой будет задерживать больше частиц при меньшем весе.
Физические свойства
Вольфрам — блестящий светло-серый металл, имеющий самые высокие доказанные температуры плавления и кипения (предполагается, что сиборгий ещё более тугоплавок, но пока что об этом твёрдо утверждать нельзя — время существования сиборгия очень мало). Температура плавления — 3695 K (3422 °C), кипит при 5828 K (5555 °C). Плотность чистого вольфрама составляет 19,25 г/см³. Обладает парамагнитными свойствами (магнитная восприимчивость 0,32⋅10−9). Твёрдость по Бринеллю 488 кг/мм², удельное электрическое сопротивление при 20 °C — 55⋅10−9 Ом·м, при 2700 °C — 904⋅10−9 Ом·м. Скорость звука в отожжённом вольфраме 4290 м/с.
Вольфрам является одним из наиболее тяжёлых, твёрдых и самых тугоплавких металлов. В чистом виде представляет собой металл серебристо-белого цвета, похожий на платину, при температуре около 1600 °C хорошо поддаётся ковке и может быть вытянут в тонкую нить. Металл обладает высокой устойчивостью в вакууме.
Химические свойства
Проявляет валентность от 2 до 6. Наиболее устойчив 6-валентный вольфрам. 3- и 2-валентные соединения вольфрама неустойчивы и практического значения не имеют.
Вольфрам имеет высокую коррозионную стойкость: при комнатной температуре не изменяется на воздухе; при температуре красного каления медленно окисляется в оксид вольфрама (VI). Вольфрам в ряду напряжений стоит сразу после водорода, и в соляной, разбавленной серной и плавиковой кислотах почти нерастворим. В азотной кислоте и царской водке окисляется с поверхности. Растворяется в перекиси водорода.
Легко растворяется в смеси азотной и плавиковой кислот:
2W + 4HNO3 + 10HF ⟶ WF6 + WOF4 + 4NO ↑ + 7h3O
Реагирует с расплавленными щелочами в присутствии окислителей:
2W + 4NaOH + 3O2 ⟶ 2Na2WO4 + 2h3O W + 2NaOH + 3NaNO3 ⟶ Na2WO4 + 3NaNO2 + h3O
Поначалу данные реакции идут медленно, однако при достижении 400 °C (500 °C для реакции с участием кислорода) вольфрам начинает саморазогреваться, и реакция протекает достаточно бурно, с образованием большого количества тепла.
Растворяется в смеси азотной и плавиковой кислоты, образуя гексафторвольфрамовую кислоту h3[WF6]. Из соединений вольфрама наибольшее значение имеют: триоксид вольфрама или вольфрамовый ангидрид, вольфраматы, перекисные соединения с общей формулой Me2WOX, а также соединения с галогенами, серой и углеродом. Вольфраматы склонны к образованию полимерных анионов, в том числе гетерополисоединений с включением других переходных металлов.
Запасы и добыча
Кларк вольфрама земной коры составляет (по Виноградову) 1,3 г/т (0,00013 % по содержанию в земной коре). Его среднее содержание в горных породах, г/т: ультраосновных — 0,1, основных — 0,7, средних — 1,2, кислых — 1,9.
Процесс получения вольфрама проходит через подстадию выделения триоксида WO3 из рудных концентратов и последующем восстановлении до металлического порошка водородом при температуре около 700 °C. Из-за высокой температуры плавления вольфрама для получения компактной формы используются методы порошковой металлургии: полученный порошок прессуют, спекают в атмосфере водорода при температуре 1200—1300 °C, затем пропускают через него электрический ток. Металл нагревается до 3000 °C, при этом происходит спекание в монолитный материал. Для последующей очистки и получения монокристаллической формы используется зонная плавка.
Металл нагревается до 3000 °C, при этом происходит спекание в монолитный материал. Для последующей очистки и получения монокристаллической формы используется зонная плавка.
Нахождение в природе
Кларк вольфрама земной коры составляет (по Виноградову) 1,3 г/т(0.0013 % по содержанию в земной коре). Его среднее содержание в горных породах, г/т: ультраосновных — 0,1, основных — 0,7, средних — 1,2, кислых — 1,9.
Вольфрам встречается в природе главным образом в виде окисленных сложных соединений, образованных трехокисью вольфрама WO3 с оксидами железа и марганца или кальция, а иногда свинца, меди, тория и редкоземельных элементов. Промышленное значение имеют вольфрамит (вольфрамат железа и марганца nFeWO4 * mMnWO4 — соответственно, ферберит и гюбнерит) и шеелит (вольфрамат кальция CaWO4). Вольфрамовые минералы обычно вкраплены в гранитные породы, так что средняя концентрация вольфрама составляет 1-2 %.
Месторождения
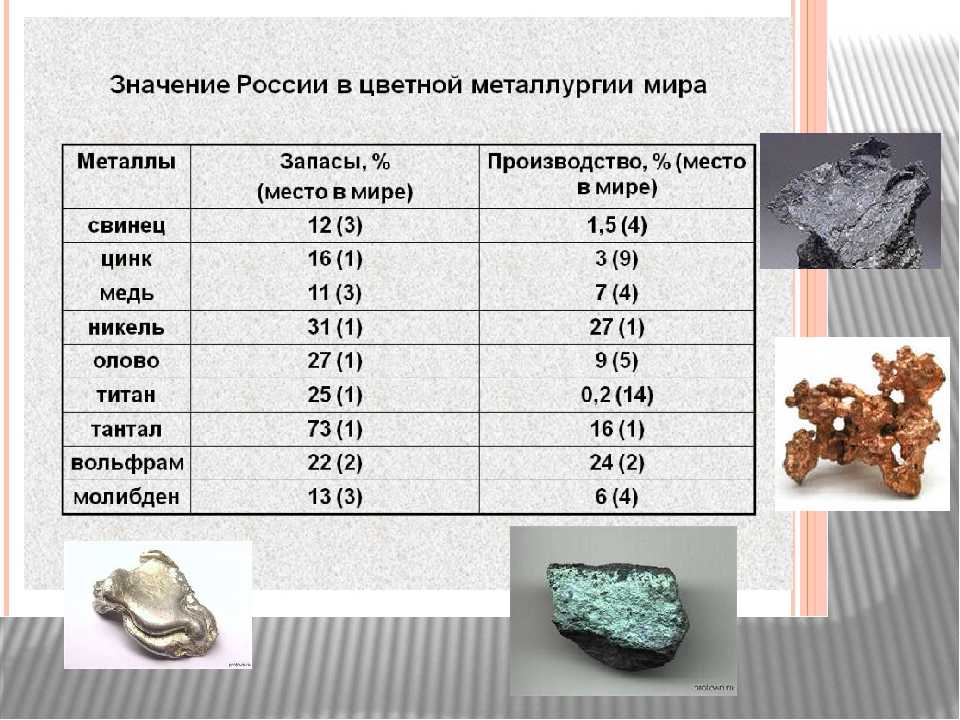
Наиболее крупными запасами обладают Казахстан, Китай, Канада и США; известны также месторождения в Боливии, Португалии, России и Южной Корее. Мировое производство вольфрама составляет 49-50 тысяч тонн в год, в том числе в Китае 41, России 3,5; Казахстане 0,7, Австрии 0,5. Основные экспортёры вольфрама: Китай, Южная Корея, Австрия. Главные импортёры: США, Япония, Германия, Великобритания.
Мировое производство вольфрама составляет 49-50 тысяч тонн в год, в том числе в Китае 41, России 3,5; Казахстане 0,7, Австрии 0,5. Основные экспортёры вольфрама: Китай, Южная Корея, Австрия. Главные импортёры: США, Япония, Германия, Великобритания.
Также есть месторождения вольфрама в Армении и других странах.
Получение
Вольфрамовый порошок
Процесс получения вольфрама проходит через подстадию выделения триоксида WO3 из рудных концентратов и последующем восстановлении до металлического порошка водородом при температуре ок. 700 °C. Из-за высокой температуры плавления вольфрама для получения компактной формы используются методы порошковой металлургии: полученный порошок прессуют, спекают в атмосфере водорода при температуре 1200—1300 °C, затем пропускают через него электрический ток. Металл нагревается до 3000 °C, при этом происходит спекание в монолитный материал. Для последующей очистки и получения монокристаллической формы используется зонная плавка.
Сплавы
Присадки меняют характеристики полученных сплавов.
| Марка российского сплава | Присадки |
| ВД-20 | 80% вольфрама, 20% меди |
| ВНЖ-95 | 3% никеля, 2% железа |
| ВНМ 2-1 | 2% никеля, 1% меди |
| ВНЖ 7-3 | 7% никеля, 3% железа |
| ВД-30 | 70% вольфрама, 30% меди |
| ВНЖ-97.5 | 1.5% никеля, 1% железа |
Плюсы и минусы металла
| Преимущества | Недостатки |
| Электрическое сопротивление | Высокая плотность |
| Температура плавления | Слабая сопротивляемость окислению |
| Коэффициент линейного расширения | Ломкость при низких температурах |
Переработка вольфрамового сырья.
Первичная руда содержит около 0,5% оксида вольфрама. После флотации и отделения немагнитных компонентов остается порода, содержащая порядка 70% WO3. Затем обогащенная руда (и окисленный лом вольфрама) выщелачивается с помощью карбоната или гидроксида натрия:
4FeWO4 + O2 + 4Na2CO3 = 4NaWO4 + 2Fe2O3 + 4CO2
6MnWO4 + O2 + 6Na2CO3 = 6Na2WO4 + 2Mn3O4 + 6CO2
WO3 + Na2CO3 = Na2WO4 + CO2
WO3 + 2NaOH = Na2WO4 + h3O
Na2WO4 + CaCl2 = 2NaCl + CaWO4Ї.
Полученный раствор освобождается от механических примесей, а затем подвергается переработке. Первоначально осаждается вольфрамат кальция с последующим его разложением соляной кислотой и растворением образовавшегося WO3 в водном аммиаке. Иногда очистку первичного вольфрамата натрия осуществляют с помощью ионообменных смол. Конечный продукт процесса – паравольфрамат аммония:
CaWO4 + 2HCl = h3WO4Ї + CaCl2
h3WO4 = WO3 + h3O
WO3 + 2Nh4·h3O(конц.) = (Nh5)2WO4 + h3O
12(Nh5)2WO4 + 14HCl(оч.разб.) = (Nh5)10h3W12O42 + 14Nh5Cl + 6h3O
Другим способом выделения вольфрама из обогащенной руды является обработка хлором или хлороводородом. Этот метод основан на относительно низкой температуре кипения хлоридов и оксохлоридов вольфрама (300° С). Способ применяется для получения особо чистого вольфрама.
Вольфрамитовый концентрат может быть сплавлен непосредственно с углем или коксом в камере с электрической дугой. При этом получают ферровольфрам, который используется при изготовлении сплавов в сталелитейной промышленности. Чистый концентрат шеелита также может быть добавлен в расплав стали.
Чистый концентрат шеелита также может быть добавлен в расплав стали.
Около 30% мирового потребления вольфрама обеспечивается за счет переработки вторичного сырья. Загрязненный лом карбида вольфрама, стружки, опилки и остатки порошкового вольфрама окисляются и переводятся в паравольфрамат аммония. Лом быстрорежущих сталей утилизируют в производстве этих же сталей (до 60–70% всего расплава). Лом вольфрама из ламп накаливания, электродов и химических реактивов практически не перерабатывается.
Основным промежуточным продуктом в производстве вольфрама является паравольфрамат аммония (Nh5)10W12O41·5h3O. Он является и основным транспортируемым соединением вольфрама. Прокаливая паравольфрамат аммония, получают оксид вольфрама(VI), который затем обрабатывают водородом при 700–1000° С и получают порошок металлического вольфрама. Спеканием его с углеродным порошком при 900–2200° С (процесс цементации) получают карбид вольфрама.
В 2002 цена паравольфрамата аммония – основного коммерческого соединения вольфрама – составляла около 9000 долл. за тонну в пересчете на металл. В последнее время появилась тенденция к снижению цен на вольфрамовую продукцию вследствие большого предложения со стороны Китая и стран бывшего СССР.
за тонну в пересчете на металл. В последнее время появилась тенденция к снижению цен на вольфрамовую продукцию вследствие большого предложения со стороны Китая и стран бывшего СССР.
В России вольфрамовые продукты производят: Скопинский гидрометаллургический завод «Металлург» (Рязанская область, вольфрамовый концентрат и ангидрид), Владикавказский Завод «Победит» (Северная Осетия, вольфрамовый порошок и слитки), Нальчикский Гидрометаллургический завод (Кабардино-Балкария, металлический вольфрам, карбид вольфрама), Кировградский завод твердых сплавов (Свердловская область, карбид вольфрама, вольфрамовый порошок), Электросталь (Московская область, паравольфрамат аммония, карбид вольфрама), Челябинский Электрометаллургический завод (ферровольфрам).
Свойства простого вещества.
Металлический вольфрам имеет светло-серый цвет. После углерода у него самая высокая температура плавления среди всех простых веществ. Ее значение определено в пределах 3387–3422° С. У вольфрама – превосходные механические качества при высоких температурах и наименьший коэффициент расширения среди всех металлов. Температура кипения 5400–5700° С. Вольфрам – один из наиболее тяжелых металлов с плотностью 19250 кг/м3. Электропроводность вольфрама при 0° C – величина порядка 28% от электропроводности серебра, являющегося наиболее электропроводящим металлом. Чистый вольфрам довольно легко поддается обработке, однако обычно он содержит примеси углерода и кислорода, что и придает металлу известную всем твердость.
Температура кипения 5400–5700° С. Вольфрам – один из наиболее тяжелых металлов с плотностью 19250 кг/м3. Электропроводность вольфрама при 0° C – величина порядка 28% от электропроводности серебра, являющегося наиболее электропроводящим металлом. Чистый вольфрам довольно легко поддается обработке, однако обычно он содержит примеси углерода и кислорода, что и придает металлу известную всем твердость.
Вольфрам обладает очень высоким модулем растяжения и сжатия, очень высоким сопротивлением температурной ползучести, высокой тепло- и электропроводностью, высоким коэффициентом электронной эмиссии, который может быть еще улучшен сплавлением вольфрама с некоторыми оксидами металлов.
Вольфрам химически стоек. Соляная, серная, азотная, фтороводородная кислоты, царская водка, водный раствор гидроксида натрия, аммиак (до 700° С), ртуть и пары ртути, воздух и кислород (до 400° С), вода, водород, азот, угарный газ (до 800° С), хлороводород (до 600° С) на вольфрам не действуют. С вольфрамом реагируют аммиак в смеси с пероксидом водорода, жидкая и кипящая сера, хлор (свыше 250° С), сероводород в условиях температуры красного каления, горячая царская водка, смесь фтористоводородной и азотной кислот, расплавы нитрата, нитрита, хлората калия, диоксида свинца, нитрита натрия, горячая азотная кислота, фтор, бром, йод.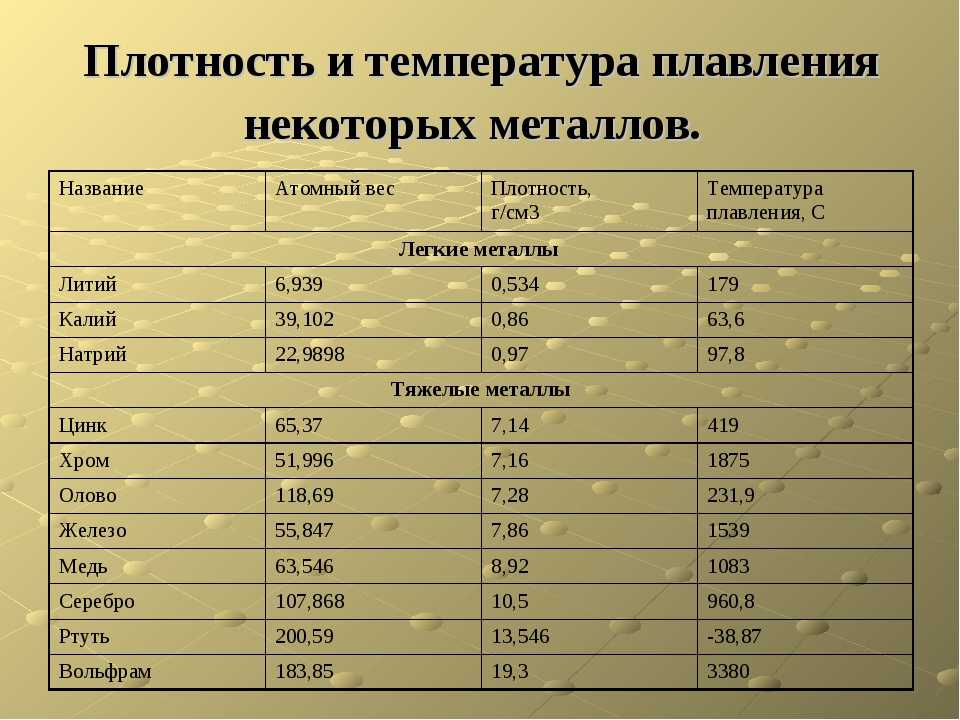 Карбид вольфрама образуется при взаимодействии углерода с вольфрамом при температуре выше 1400° С, оксид – при взаимодействии с водяным паром и диоксидом серы (при температуре красного каления), углекислым газом (выше 1200° С), оксидами алюминия, магния и тория.
Карбид вольфрама образуется при взаимодействии углерода с вольфрамом при температуре выше 1400° С, оксид – при взаимодействии с водяным паром и диоксидом серы (при температуре красного каления), углекислым газом (выше 1200° С), оксидами алюминия, магния и тория.
Свойства важнейших соединений вольфрама.
Среди важнейших соединений вольфрама – его оксид, хлорид, карбид и паравольфрамат аммония.
Оксид вольфрама(VI) WO3 – кристаллическое вещество светло-желтого цвета, при нагревании становящееся оранжевым, температура плавления 1473° С, кипения – 1800° С. Соответствующая ему вольфрамовая кислота неустойчива, в водном растворе в осадок выпадает дигидрат, теряющий одну молекулу воду при 70–100° С, а вторую – при 180–350° С. При реакции WO3 со щелочами образуются вольфраматы.
Анионы вольфрамовых кислот склонны к образованию полисоединений. При реакции с концентрированными кислотами образуются смешанные ангидриды:
12WO3 + h4PO4(кип., конц.) = h4[PW12O40]
При взаимодействии оксида вольфрама с металлическим натрием образуется нестехиометрический вольфрамат натрия, носящий название «вольфрамовая бронза»:
WO3 + xNa = NaxWO3
При восстановлении оксида вольфрама водородом в момент выделения образуются гидратированные оксиды со смешанной степенью окисления – «вольфрамовые сини» WO3–n(OH)n, n = 0,5–0,1.
WO3 + Zn + HCl ® [W10O25(OH) + W3O8(OH)] («синь»), W2O5(OH) (коричн.)
Оксид вольфрама(VI) полупродукт в производстве вольфрама и его соединений. Является компонентом некоторых промышленно важных катализаторов гидрирования и пигментов для керамики.
Высший хлорид вольфрама WCl6 образуется при взаимодействии оксида вольфрама (или металлического вольфрама) с хлором (так же как и с фтором) или тетрахлоридом углерода. Он отличается от других соединений вольфрама низкой температурой кипения (347° С). По своей химической природе хлорид является хлорангидридом вольфрамовой кислоты, поэтому при взаимодействии с водой образуются неполные хлорангидриды, при взаимодействии со щелочами – соли. В результате восстановления хлорида вольфрама алюминием в присутствии монооксида углерода образуется карбонил вольфрама:
WCl6 + 2Al + 6CO = [W(CO)6]Ї + 2AlCl3 (в эфире)
Карбид вольфрама WC получается при взаимодействии порошкового вольфрама с углем в восстановительной атмосфере. Твердость, сравнимая с алмазом, определяет сферу его применения.
Вольфрамат аммония (Nh5)2WO4 устойчив только в аммиачном растворе. В разбавленной соляной кислоте в осадок выпадает паравольфрамат аммония (Nh5)10h3W12O42, являющийся основным полупродуктом вольфрама на мировом рынке. Паравольфрамат аммония легко разлагается при нагревании:
(Nh5)10h3W12O42 = 10Nh4 + 12WO3 + 6h3O (400 – 500° C)
Как используется
Свойства вольфрама обозначили главного потребителя. Это металлургия. Она создает конечный продукт и исходники для других отраслей промышленности.
Порошковый вольфрам – основа либо компонент твердых, жаропрочных износоустойчивых сплавов, премиальных марок сталей.
Применение вольфрама и сплавов востребовано в разных сферах
- металлургии;
- судостроении;
- медицине;
- текстильном производстве;
- электротехнической, радиоэлектронной, химической, атомной, горнодобывающей и ряде других отраслей промышленности.
Из него получают сверхтвердые стали и сплавы, которые применяются, чтобы обрабатывать металлы механическим путем, в бурении скважин, для изготовления деталей, из которых собираются двигатели самолетов.
Вольфрамовые электроды предназначаются для аргонодуговой сварки.
В ядерной физике и медицине нашли применение монокристаллы вольфраматов.
Элемент необходим для нитей накаливания и элементов электровакуумных приборов, артиллерийских снарядов, роторов гироскопов (сверхскоростных) и др.
Виды продукции
Свойства вольфрама дают возможность изготавливать такие виды продукции:
- Электроды. Для работы с материалами разного состава, цветными металлами, высоколегированными сталями. Не плавятся, шов прочный и долговечный.
- Проволока. Используется в лампах накаливания, благодаря сопротивлению вольфрама (нагреватели, спирали).
- Порошок. Основа для сплавов и сталей.
- Прутки. Изделия для изготовления вольфрамовых электродов.
- Листы. Изделия из металла вольфрама необходимы для тепловых экранов, подставок и других элементов крепления для высокотемпературных печей.
Другие формы
Изотоп W184 – компонент сплавов с изотопами урана. Из них делают ракетные двигатели на ядерном топливе.
Из них делают ракетные двигатели на ядерном топливе.
Радионуклид искусственного происхождения (W185) востребован как детектор излучений (включая рентгеновское) ядерным сегментом физики и медицины.
Биологическая роль
Вольфрам не играет значительной биологической роли. У некоторых архебактерий и бактерий имеются ферменты, включающие вольфрам в своем активном центре. Существуют облигатно-зависимые от вольфрама формы архебактерий-гипертермофилов, обитающие вокруг глубоководных гидротермальных источников. Присутствие вольфрама в составе ферментов может рассматриваться как физиологический реликт раннего архея — существуют предположения, что вольфрам играл роль в ранних этапах возникновения жизни.
Пыль вольфрама, как и большинство других видов металлической пыли, раздражает органы дыхания.
Факторы, ограничивающие применение вольфрама
Есть ряд факторов, которые ограничивают применение этого материала:
- высокая плотность;
- значительная склонность к ломкости в условиях низких температур;
- малое сопротивление окислению.

По своему внешнему виду вольфрам имеет сходство с обычной сталью. Его основное применение связано главным образом с производством сплавов с высокими прочностными характеристиками. Этот металл поддается обработке, но только если его предварительно нагреть. В зависимости от выбранного типа обработки нагрев производится до определенной температуры. Например, если стоит задача выковать прутки из вольфрама, то заготовку необходимо предварительно нагреть до температуры 1450-1500 градусов Цельсия.
На протяжении 100 лет вольфрам не применялся в промышленных целях. Его использование при производстве различной техники сдерживалось его высокой температурой плавления.
Начало его промышленного применения связано с 1856 годом, когда он впервые стал использоваться для легирования инструментальных марок стали. При их производстве в состав стали добавлять вольфрам общей долей до 5%. Присутствие этого металла в составе стали позволило повысить скорость резки на токарных станках с 5 до 8 м в минуту.
Развитие промышленности во второй половине XIX века характеризуется активным развитием отрасли производства станков. Спрос на оборудование с каждым годом постоянно возрастал, что требовало от машиностроителей получения качественных характеристик машин, а помимо этого повышения их рабочей скорости. Первым импульсом в деле повышения скорости резки стало использование вольфрама.
Уже в начале XX века скорость резки была доведена до 35 метров в минуту. Добиться этого удалось за счет легирования стали не только вольфрамом, но и другими элементами:
- молибденом;
- хромом;
- ванадием.
В дальнейшем скорость резания на станках возросла до 60 метров в минуту. Но, несмотря на такие высокие показатели, специалисты понимали, что есть возможность улучшить эту характеристику. Какой способ выбрать для повышения скорости резания, специалисты долго не думали. Они прибегли к использованию вольфрама, но уже в виде карбидов в союзе с другими металлами и их видами. В настоящее время вполне обычной является скорость резания металла на станках 2000 метров в минуту.
В настоящее время вполне обычной является скорость резания металла на станках 2000 метров в минуту.
Источники
- https://metalloy.ru/metally/volfram
- https://chem.ru/volfram.html
- https://mineralpro.ru/minerals/tungsten/
- https://dic.academic.ru/dic.nsf/ruwiki/8720
- https://TheMineral.ru/metally/volfram
- https://www.krugosvet.ru/enc/nauka_i_tehnika/himiya/VOLFRAM.html
- https://jgems.ru/metally/volfram
- https://partalstalina.ru/volfram-opisanie
- https://stanok.guru/oborudovanie/raznoe/temperatura-plavleniya-i-drugie-svoystva-volframa.html
Ваша оценка?
Петр Иваныч
Возможно этот человек ответит на ваши вопросы
Задать вопрос
Область применения, формула и свойства вольфрама
Что представляет собой вольфрам? Основные свойства данного элемента базируются на особенностях его химического строения. Учитывая востребованность вольфрама, необходимо детальнее разобрать его строение.
Положение в таблице Менделеева
Рассматривая основные свойства вольфрамам, начнем с того, что он имеет 74-й порядковый номер. При нормальных условиях он собой представляет переходный металл, имеющий серо-серебристый цвет. Вольфрам твердый, обладает металлическим блеском. Это самый тугоплавкий элемент, большей температурой плавления обладает только углерод. Электронная формула: KLMN5s25p65d46s2, Eион (Ме => Ме+ + e) = 7,98 эВ.
История происхождения
Своему необычному названию данный металл обязан минералу вольфрамиту. «Волчья пена» известна с 16 века. Такое необычное наименование минерала объясняется наличием в нем оловянных руд. Вольфрам мешал выплавлять олово, переводил его в пену из шлаков. Какие физические свойства вольфрама стали основой его широкого применения в промышленности? В США данный металл называли «тяжелым камнем».
В конце 18 века швед Шееле при обработке минерала азотной кислотой получил шеелит, получив триоксид вольфрама. Чуть позже братьям Элиар удалось получить окись вольфрамам из саксонского вольфрамита. Именно этими химиками были выявлены некоторые химические свойства вольфрама.
Чуть позже братьям Элиар удалось получить окись вольфрамам из саксонского вольфрамита. Именно этими химиками были выявлены некоторые химические свойства вольфрама.
Нахождение в природе
Есть ли в природе в чистом виде вольфрам? Химические свойства данного металла предполагают его присутствие в земной коре по большей части в виде соединений. Например, есть смесь оксидов марганца, железа, вольфрама. Для промышленного применения выбирают соединения ферберит и гюбнерит. В них помимо вольфрама присутствуют железо и марганец. Физические свойства вольфрама позволяют выделять металл и из вольфрамовых минералов. В них его концентрация не превышает двух процентов. Среди крупнейших месторождений вольфрама отметим Китай, США, Казахстан. Кроме того, выявлены и существенные запасы руд данного металла в Южной Корее, Боливии, России, Португалии. Отличные физические свойства вольфрама предполагают его существенное промышленное производство. В мире ежегодно производят порядка 50 тысяч тонн этого тугоплавкого элемента. Главными экспортерами вольфрама считают Южную Корею, Китай, Австрию. Среди импортеров тугоплавкого металла пальма лидерства принадлежит Великобритании, Японии, США, Германии.
Главными экспортерами вольфрама считают Южную Корею, Китай, Австрию. Среди импортеров тугоплавкого металла пальма лидерства принадлежит Великобритании, Японии, США, Германии.
Особенности производства
Получение вольфрама осуществляется через промежуточную стадию, подразумевающую выделение из рудного концентрата триоксида вольфрама. Далее осуществляется восстановление его до порошкообразного металла. Подобный этап происходит при температуре около 700 градусов Цельсия. Какие физические свойства вольфрама лежат в основе данной технологии? Высокая температура его плавления позволяет с помощью порошкообразной металлургии подвергать порошок прессованию, спеканию в атмосфере водорода при температуре около 1300 градусов Цельсия. Далее через полученный вольфрам пропускают электрический ток. При нагревании металла до температуры в 3000 градусов наблюдается монолитный материал. Путем зонной плавки осуществляется последующая очистка и получение монокристаллического металла.
Свойства
Какие характеристики имеет вольфрам? Химические свойства его основываются на высокой температуре плавления. Элемент проявляет валентности от 2 до 6. Самым устойчивым является вольфрам с валентностью шесть. Металл характеризуется повышенной коррозионной стойкостью. Он не окисляется на воздухе при комнатной температуре. В оксид вольфрама он превращается только при достижении температуры белого коленья. В электрохимическом ряду напряжений металлов данный элемент располагается после водорода, поэтому он не растворяется в разбавленной плавиковой и серной кислотах. Вольфрам способен растворяться в пероксиде водорода, а также в смеси плавиковой и азотной кислот.
Элемент проявляет валентности от 2 до 6. Самым устойчивым является вольфрам с валентностью шесть. Металл характеризуется повышенной коррозионной стойкостью. Он не окисляется на воздухе при комнатной температуре. В оксид вольфрама он превращается только при достижении температуры белого коленья. В электрохимическом ряду напряжений металлов данный элемент располагается после водорода, поэтому он не растворяется в разбавленной плавиковой и серной кислотах. Вольфрам способен растворяться в пероксиде водорода, а также в смеси плавиковой и азотной кислот.
При наличии окислителей данный металл способен реагировать с расплавленными щелочами. Сначала взаимодействие протекает достаточно медленно, но после достижения температуры 400 градусов наблюдается самопроизвольное разогревание металла, которое ускоряет реакцию. Вольфрам в смеси плавиковой и азотной кислот образует гексафторвольфрамовую кислоту. В максимальном количестве в промышленности применяют вольфрамовый ангидрид. У вольфроматов есть способность к созданию полимерных анионов. Этот металл является основой тугоплавких материалов в современной металлургии.
Этот металл является основой тугоплавких материалов в современной металлургии.
Сферы применения
Как можно использовать карбид вольфрама? Свойства данного соединения позволяют выделять из него чистый вольфрам. Пластичность и тугоплавкость металла сделали его основой при создании нитей накаливания в многочисленных осветительных приборах. Кроме того, вольфрам используют в вакуумных трубках и кинескопах. Так как у этого элемента высокая плотность, он стал базой для производства тяжелых сплавов. Они незаменимы при создании противовесов, подкалиберных и бронебойных сердечников, сверхскоростных роторов гироскопов для создания баллистических ракет. В больших объемах вольфрам применяют при аргоново-дуговой сварке как электрод. Сплавы, которые в своем составе содержат вольфрам, имеют высокую жаропрочность, кислотостойкость, они устойчивы к механическим деформациях. Подобные характеристики позволяют применять их для производства хирургических инструментов, брони танков, двигателей самолетов, контейнеров для размещения радиоактивных веществ. Именно вольфрам является важным компонентом для изготовления высококачественных марок сталей.
Именно вольфрам является важным компонентом для изготовления высококачественных марок сталей.
Применяют его и в высокотемпературных вакуумных печах в виде нагревательного элемента. В сплаве с рением из него создают термопары для подобных печей.
Заключение
Именно благодаря высокой плотности вольфрама металл удобен для защиты поверхности от ионизирующего излучения. Повышенная твердость и тугоплавкость металла создают существенные сложности с его обработкой. Для решения проблемы вводят в состав никель, медь, железо. Стойкость вольфрама сделала его востребованным при изготовлении конструкционных материалов в современном машиностроении.
Он необходим при фрезеровании, долблении, точении, бурении скважин. Например, победит состоит из карбида вольфрама. Эта смесь наносится на сверла, применяемые при создании отверстий в бетоне. Сульфид вольфрама выступает в качестве высокотемпературной смазки. Он востребован в производстве. Часть соединений вольфрама используется в виде пигментов и катализаторов. Применяют соединения данного металла и как легирующий элемент в сплавах и сталях на базе железа. Биологической ценности металлический вольфрам не имеет.
Применяют соединения данного металла и как легирующий элемент в сплавах и сталях на базе железа. Биологической ценности металлический вольфрам не имеет.
Вольфрам: свойства, производство и применение
Более 350 лет назад было замечено, что китайские производители фарфора добавляли в свои изделия уникальный персиковый цвет, который не был известен или признан в остальном мире [1] . Так оставалось до 1779 г., когда ирландский химик и минералог Питер Вульф обнаружил наличие нового металла в образцах шведского вольфрамита, но не выделил его [2]. Позже, в 1781 году, немецкий химик Вильгельм Шееле продолжил исследования и сумел выделить кислый белый оксид, который, как он сделал вывод, был оксидом этого нового металла. Честь открытия этого металла была оказана испанским химикам и минералогам Хуану Хосе и Фаусто Эльхуяру, которые в 179 г.3 производили тот же кислый металл, но, в отличие от других, успешно выделили металлический вольфрам [1].
Вольфрам — это переходный металл, известный своими выдающимися свойствами, особенно в сочетании с другими элементами в таких соединениях, как карбид вольфрама. Название вольфрама произошло от скандинавских слов «tung» и «sten», которые вместе означают «тяжелый камень» [3]. Вольфрам также известен как вольфрам, от которого он получил свой химический символ W . Название вольфрам произошло от минерала вольфрамита.
Название вольфрама произошло от скандинавских слов «tung» и «sten», которые вместе означают «тяжелый камень» [3]. Вольфрам также известен как вольфрам, от которого он получил свой химический символ W . Название вольфрам произошло от минерала вольфрамита.
Содержание вольфрама в земной коре около 0,007% (мировой запас 3,5 млн тонн). Сегодня на Китай приходится значительная часть мировых запасов вольфрама [1]. Вольфрам и его соединения имеют широкий спектр применения благодаря своим физическим и химическим свойствам.
Здесь вы узнаете:
- Свойства вольфрама
- Источники вольфрама
- Продукты и применение вольфрама
- Будущие области применения вольфрама
Свойства вольфрама
Вольфрам — это светло-серый или серебристо-белый металл, который является одним из самых прочных металлов, встречающихся в природе. Плотность вольфрама значительно выше, фактически, среди всех металлов [2][4]. В приведенной ниже таблице показаны некоторые ключевые характеристики каждого из вольфрама и карбида вольфрама. Обратите внимание, как добавление углерода значительно увеличило его твердость, но снизило температуру плавления и теплопроводность.
Обратите внимание, как добавление углерода значительно увеличило его твердость, но снизило температуру плавления и теплопроводность.
Таблица 1. Сравнение вольфрама и карбида вольфрама
Вольфрам имеет самые высокие температуры плавления и кипения среди всех обнаруженных элементов и самый низкий коэффициент теплового расширения (КТР) среди металлов.
Вот сравнение свойств от Matmatch, которое показывает рейтинг вольфрама среди других металлов с точки зрения температуры плавления, коэффициента теплового расширения и плотности. Обратите внимание, что у вольфрама самая высокая температура плавления, самая низкая по КТР и одна из самых высоких по плотности. Нажмите на рисунок или ссылку в подписи ниже, чтобы выполнить собственную схему сравнения.
Рисунок 1. Property CO Mparison между вольфрамовым и другим металлами, показывающими свои рейтинги для температуры плавления, CTE и плотности
. легированная форма делает вольфрам весьма полезным для многих современных применений. Вольфрамовые кольца, например, считаются устойчивыми к царапинам и небьющимися из-за их невероятной твердости и прочности. Тот факт, что они не легко ржавеют и в высокой степени устойчивы к коррозии, делает их еще более привлекательными для будущего материаловедения.
легированная форма делает вольфрам весьма полезным для многих современных применений. Вольфрамовые кольца, например, считаются устойчивыми к царапинам и небьющимися из-за их невероятной твердости и прочности. Тот факт, что они не легко ржавеют и в высокой степени устойчивы к коррозии, делает их еще более привлекательными для будущего материаловедения.
Производство и переработка вольфрама
Вольфрам встречается в природе в окружающей среде в виде горных пород и минералов в сочетании с другими химическими веществами, но не существует в виде чистого металла. Двумя основными минералами вольфрама являются вольфрамит и шеелит . Вольфрамит [(Fe,Mn)WO 4 )] встречается в кварцевых жилах и пегматитах, связанных с гранитными интрузиями [5]. Вольфрамит прочен, очень плотен и имеет высокую температуру плавления. Его цвет варьируется от светло-серого до темно-черного, а блеск субметаллический. Шеелит (CaWO 4 ), с другой стороны, обычно встречается в виде компактных или гранулированных масс. Цвета шеелита варьируются от белого, серого, коричневого, бледно-желтого, оранжевого до бесцветного. Одной из его основных характеристик является то, что он сильно флуоресцирует в ультрафиолетовом свете [6].
Цвета шеелита варьируются от белого, серого, коричневого, бледно-желтого, оранжевого до бесцветного. Одной из его основных характеристик является то, что он сильно флуоресцирует в ультрафиолетовом свете [6].
Добыча руды осуществляется двумя основными способами добычи: добыча открытым способом и подземная добыча .
Открытая добыча полезных ископаемых
Поскольку некоторые залежи вольфрамовой руды расположены довольно близко к поверхности, практикуется открытая добыча, при которой в основном удаляются вышележащие слои почвы и породы на месторождении полезных ископаемых.
Подземная добыча полезных ископаемых
Для залежей руды на глубине ниже земной коры сооружают горизонтальные или вертикальные шахты и туннели и извлекают руду.
Поскольку вольфрам в основном получают из вольфрамита и шеелита, для его производства используется метод, разработанный Хуаном Хосе и Фаусто Эльхуяром. Вольфрамовые руды измельчают, очищают и обрабатывают щелочью с получением триоксида вольфрама (WO 3 ). Затем это триоксидное соединение нагревают с углеродом или газообразным водородом для получения металлического вольфрама и диоксида углерода (CO 2 ), или, в других случаях, металлический вольфрам и водяной пар (H 2 0) [4].
Затем это триоксидное соединение нагревают с углеродом или газообразным водородом для получения металлического вольфрама и диоксида углерода (CO 2 ), или, в других случаях, металлический вольфрам и водяной пар (H 2 0) [4].
Большинство месторождений вольфрамовой руды находится в горах Нань в Китае, что составляет около 50% мировых запасов. Другими регионами со значительными ресурсами вольфрама являются Северный Кавказ и озеро Байкал в России, Казахстан, Санд Донг в Южной Корее, север Канады, Чойлла в Боливии и Скалистые горы в США [4] [7].
Изделия из вольфрама и их применение
В зависимости от использования вольфрамовые изделия можно разделить на четыре основные категории : карбиды, прокат, сплавы и суперсплавы и различные химические продукты [8].
Карбиды являются наиболее распространенными и самыми твердыми продуктами из соединений вольфрама. Компании, которые химически перерабатывают вольфрам, в основном производят вольфрамовые концентраты, паравольфрамат аммония (АПТ), оксид вольфрама, порошок металлического вольфрама, порошок карбида вольфрама и другие химикаты для вольфрама [7]. Около 60 % производимого вольфрама используется в твердосплавных деталях режущего и износостойкого назначения, в первую очередь для строительства, металлообработки, горнодобывающей и нефтегазовой промышленности. Остальные 40% обычно используются для производства различных сплавов и специальных сталей, электродов, нитей накала, проволоки, а также различных компонентов для электрических, электронных, нагревательных, осветительных и сварочных приложений [7]. Краткое описание продуктов и пример использования представлены в таблице ниже.
Около 60 % производимого вольфрама используется в твердосплавных деталях режущего и износостойкого назначения, в первую очередь для строительства, металлообработки, горнодобывающей и нефтегазовой промышленности. Остальные 40% обычно используются для производства различных сплавов и специальных сталей, электродов, нитей накала, проволоки, а также различных компонентов для электрических, электронных, нагревательных, осветительных и сварочных приложений [7]. Краткое описание продуктов и пример использования представлены в таблице ниже.
Таблица 2. Различные изделия из вольфрама, их применение и использование
Продукт | Применение | Использование |
Карбиды | Режущие и износостойкие материалы | Режущие кромки станков, подверженные интенсивному истиранию Металлические поверхности в формовочных штампах Буровые долота и дробильные машины Ювелирные кольца |
Изделия мельничного производства | Электрические и электронные изделия | Нить накала в электрических лампах Катоды для электрических ламп Диски для автомобильных раздаточных пунктов Тепловая и радиационная защита Электроды для получения инертного газа Компоненты рентгеновских и электронно-лучевых трубок Нагревательный элемент в высокотемпературных печах сопротивления Сварочные процессы для придания поверхности стойкости к истиранию |
Сплавы | Компоненты сплава | Быстрорежущие стали Инструментальная и штамповая сталь Вооружение (гранаты, ракеты) |
Суперсплавы и сплавы цветных металлов | Применение при высоких температурах Электрические контакты | |
Различные химические соединения | Неметаллургические применения | Химические вещества в текстиле, красители, краски, эмали, тонеры и красящие стекла Люминофоры в пигментах Рентгеновские экраны и флуоресцентное освещение Огнезащита текстиля |
Другим интересным применением вольфрама была замена золота . В ювелирной промышленности вольфрам используется в качестве альтернативы золоту, так как его плотность одинакова (на 0,36% меньше плотности золота), а также он гипоаллергенен и устойчив к царапинам. В последние десятилетия было обнаружено, что вольфрам использовался для подделки золотых слитков, при этом было замечено, что в существующих золотых слитках просверленные отверстия заменены вольфрамовыми стержнями, поскольку они имеют аналогичные плотности и свойства и стоят значительно меньше, чем золото [9].].
В ювелирной промышленности вольфрам используется в качестве альтернативы золоту, так как его плотность одинакова (на 0,36% меньше плотности золота), а также он гипоаллергенен и устойчив к царапинам. В последние десятилетия было обнаружено, что вольфрам использовался для подделки золотых слитков, при этом было замечено, что в существующих золотых слитках просверленные отверстия заменены вольфрамовыми стержнями, поскольку они имеют аналогичные плотности и свойства и стоят значительно меньше, чем золото [9].].
Будущие области применения вольфрама
Использование энергии постоянно растет во всем мире, даже быстрее, чем предложение энергии. Кроме того, будущей тенденцией энергетики является эффективность ее производства и потребления. Затем ожидается, что продукты и приложения из вольфрама сыграют значительную роль в решении этой будущей задачи [10]. Электроды на основе оксида вольфрама были исследованы для разработки приложений для хранения энергии, таких как суперконденсаторы и батареи, учитывая, что этот материал обеспечивает преимущества благодаря своим характеристикам переноса заряда, уникальным физико-химическим свойствам и хорошей устойчивости к коррозии [11].
Изделия из вольфрама также имеют важные возможности в области возобновляемых источников энергии, где они могут оказать значительное влияние на производство ископаемой или возобновляемой энергии, передачу и распределение энергии [10].
Образец электронно-лучевой трубки.
[1] Дж. Роулатт, «Вольфрам: идеальный металл для пуль и ракет», журнал BBC News Magazine, Всемирная служба Би-би-си, 2014 г., https://www.bbc.com/news/magazine-28263683 (по состоянию на февраль 13, 2020)
[2] Ласснер Э. и Шуверт В.-Д., Вольфрам: свойства, химия, технология, элемент, сплавы и химические соединения , Springer Science Business Media, Нью-Йорк, 1999
[3] Оксфордский словарь английского языка, «Вольфрам», 3-е изд., Oxford University Press. Сентябрь 2005 г.
[4] JLab Science Education, «The Element Tungsten», https://education.jlab.org/itselemental/ele074.html (по состоянию на 10 февраля 2020 г.)
[5] Mitchell, A., Граниты, мелкие интрузии и оруденение в сланцевом поясе , Phayaungtaung и Gaoligong Range», Геологические пояса, границы плит и месторождения полезных ископаемых в Мьянме, 2018 г.
[6] Британская энциклопедия, «Обработка вольфрама», https://www.britannica.com/technology/tungsten-processing ( по состоянию на 10 февраля 2020 г.)
[7] Геологическая служба США, «Вольфрам», сводки по минеральным товарам, январь 2020 г., доступно по адресу https://pubs.usgs.gov/periodicals/mcs2020/mcs2020-tungsten.pdf (доступ 10 февраля 2020 г.)
[8] Министерство внутренних дел США, Горнорудное управление, «Вольфрам», годовой отчет, 19 ноября.94. https://www.google.com/books/edition/Tungsten/_7KWMjChLBwC?hl=en&gbpv=1&dq=tungsten&pg=PA2&printsec=frontcover (по состоянию на 10 февраля 2020 г.)
[9] DiMaggio R. and Barone, ВЕЧЕРА. Geoscientists at Crime Scenes, Springer Nature, Cham, Switzerland, 2017 г. обложка (по состоянию на 10 февраля 2020 г.)
[10] Международная ассоциация вольфрамовой промышленности, «Future Applications», https://www.itia.info/future-applications.html (по состоянию на 10 февраля 2020 г.)
[11] Shinde P.A, Chang Jung S. , Обзор последних достижений в разработке электродов на основе оксида вольфрама для электрохимического накопления энергии, ChemSusChem, 2020, том 13, с. 11-38
, Обзор последних достижений в разработке электродов на основе оксида вольфрама для электрохимического накопления энергии, ChemSusChem, 2020, том 13, с. 11-38
Свойства и информация о вольфрамовых элементах
ВольфрамСвойства и информация о вольфрамовых элементах
Вольфрам — это 74 -й -й элемент периодической таблицы. Элементы расположены в периодической таблице на основе атомного номера. Атомный номер – это количество протонов в ядре атома. Вольфрам имеет атомный номер 74 . Он расположен в 6-й группе и 6-м периоде периодической таблицы элементов. Обозначается ‘ W ’. Его название происходит от шведского «Tung Sten», что означает «Тяжелый камень».
Вольфрамовый пигмент использовался производителями фарфора в Китае около 350 лет назад, но металл Вольфрам не был официально известен как элемент, занимающий свое место в таблице Менделеева. Питер Вульф исследовал минерал из Швеции и пришел к выводу, что он содержит новый элемент. Вильгельм Шееле исследовал его и выделил оксид, который, как он также сделал вывод, является новым элементом в 1781 году. Заслуга в открытии этого элемента принадлежит Хуану и Фаусто Эльхуяру, которые не только выделили оксид, но и восстановили его до металла, используя углерод в 1783.
Вильгельм Шееле исследовал его и выделил оксид, который, как он также сделал вывод, является новым элементом в 1781 году. Заслуга в открытии этого элемента принадлежит Хуану и Фаусто Эльхуяру, которые не только выделили оксид, но и восстановили его до металла, используя углерод в 1783.
Вольфрам никогда не встречается в природе в свободном состоянии, всегда в сочетании с другими элементами. Это редкий элемент, и единственными минералами, которые используются в промышленности для получения вольфрама, являются вольфрамит и шеелит, все остальные минералы не имеют экономической ценности.
Физические свойства
- Металлический вольфрам имеет стально-серый цвет, он твердый и хрупкий.
- Атомная масса вольфрама 183,85.
- Температура плавления вольфрама 3410°C.
- Температура кипения вольфрама 5660°С.
- Плотность вольфрама составляет 19300 единиц СИ при 20°C.
- С хрупким вольфрамом трудно работать, его очищают, что делает его ковким и, следовательно, с ним легче работать.

- Среди всех металлов в чистом виде; вольфрам имеет самую высокую прочность на растяжение и температуру плавления, а при температурах выше 1650 ° C он имеет самое низкое давление паров. Кроме того, он имеет самое низкое тепловое расширение среди всех чистых металлов.
- Вольфрам существует в основном в двух формах; один из них стабилен и имеет объемно-центрированную кубическую структуру, а другой является метастабильным.
- Встречающийся в природе вольфрам состоит из 5 изотопов, среди которых 4 стабильных и 1 радиоактивный. Стабильные изотопы: вольфрам-182, вольфрам-183, вольфрам-184 и вольфрам-186. Радиоактивный изотоп – вольфрам-180.
Химические свойства
- Металлический вольфрам в основном неактивен по своей природе.
- Вольфрам не реагирует с водой, кислородом или воздухом при комнатной температуре.
- Вольфрам невосприимчив к большинству кислот и оснований.
- Вольфрам реагирует с кислородом при повышенных «красных» температурах с образованием триоксида.

- Вольфрам легко реагирует с фтором при комнатной температуре с образованием фторида вольфрама(VI).
- При 250°C вольфрам реагирует с бромом и хлором.
- Вольфрам является единственным элементом в третьем переходном ряду, который, как известно, встречается в биомолекулах.
Методы производства
Восстановление: руды проходят различные виды предварительной обработки, такие как дробление, магнитная сепарация, пенная флотация и т. д., затем проводятся химические стадии для получения вольфрама в форме оксида вольфрама (VI). . Первым шагом является восстановление этого соединения до металлического вольфрама с использованием углерода или водорода. Вольфрам получают в виде порошка. Невозможно превратить его в слитки, поэтому порошкообразный вольфрам смешивают с никелем или другим металлом и спекают.
Применение в химической и смежных отраслях
- Карбид вольфрама: Вольфрам в основном используется для производства карбида вольфрама, который используется для изготовления различных твердых материалов, таких как абразивы, ножи, сверла, пилы, штампы и различные режущие и фрезерные инструменты.
 .
. - Сплавы: Вольфрам смешивают с другими металлами для получения различных жаропрочных и износостойких сплавов.
- Химические соединения: около 10% вольфрама, производимого во всем мире, идет на изготовление различных соединений вольфрама; сульфид вольфрама(IV) используется в катализаторах процесса гидрообессеривания, кристаллические вольфраматы – в сцинтилляционных детекторах, оксид вольфрама – в селективном каталитическом восстановлении и т. д.
Применение в других отраслях промышленности
- Военные: вольфрам в сплаве с другими металлами находит хорошее применение в вооруженных силах, он использовался в пулях, гранатах, снарядах и ракетах.
- Ювелирные изделия: Вольфрам имеет плотность, очень похожую на золото; поэтому его часто использовали в качестве заменителя золота. Он также использовался в качестве заменителя платины.
- Электроника: благодаря способности вольфрама сохранять прочность при высоких температурах, а также иметь очень высокую температуру плавления, он находит множество применений в электронной промышленности; лампы накаливания, нити накала электронных ламп, электронно-лучевые трубки, нагревательные элементы, интегральные схемы, автоэмиссионные пушки, наноэлектроника и т.
 д.
д.
Воздействие на здоровье при воздействии
Раздражающее: Контакт вольфрама с любой частью тела вызывает раздражение этой части; На этих органах можно увидеть покраснение, шелушение и зуд. Длительное воздействие также приводит к воспалению.
Воздействие на окружающую среду
Ожидается, что вольфрам не будет вредным для окружающей среды.
Ссылки :
https://en.wikipedia.org/wiki/Tungsten
https://www.lenntech.com/periodic/elements/w.htm
https://www.rsc.org/periodic-table/element/74/tungsten
Вольфрамовый металл | AMERICAN ELEMENTS®
РАЗДЕЛ 1. ИДЕНТИФИКАЦИЯ
Наименование продукта: Вольфрамовый металл
Номер продукта: W-M-02 , W-M-03 , W-M-04 , W-M-05
Номер CAS: 7440-33-7
Соответствующие установленные области применения вещества: Научные исследования и разработки
Информация о поставщике:
American Elements
10884 Weyburn Ave.
Los Angeles, CA
Тел.: +1 310-208-0551
Факс: +1 310-208-0351
9000 , Северная Америка: +1 800-424-9300
Международный: +1 703-527-3887
РАЗДЕЛ 2. ИДЕНТИФИКАЦИЯ ОПАСНОСТИ
Классификация вещества или смеси
Классификация в соответствии с Регламентом (ЕС) № 1272/2008
Вещество не классифицируется как опасное для здоровья или окружающей среды согласно регламенту CLP.
Классификация в соответствии с Директивой 67/548/ЕЭС или Директивой 1999/45/ЕС
Н/Д
Информация об особых опасностях для человека и окружающей среды:
Нет данных
Опасности, не классифицированные иначе
Нет данных
Элементы маркировки
Маркировка в соответствии с Регламентом (ЕС) № 1272/2008
Н/Д
Пиктограммы опасности
Н/Д
Сигнальное слово
Н/Д
Краткая характеристика опасности
Н/Д
Классификация WHMIS
Не контролируется
Система классификации
Рейтинги HMIS (шкала 0–4)
(Система идентификации опасных материалов)
ЗДОРОВЬЕ
ПОЖАР
РЕАКТИВНОСТЬ
0
0
0
Здоровье (острые воздействия) = 0
Воспламеняемость = 9 0 0
Физические опасности4 оценки PBT и vPvB
PBT:
N/A
vPvB:
N/A
РАЗДЕЛ 3.
 СОСТАВ/ИНФОРМАЦИЯ О КОМПОНЕНТАХ
СОСТАВ/ИНФОРМАЦИЯ О КОМПОНЕНТАХ Вещества
CAS No. номер(а):
Номер ЕС:
231-143-9
РАЗДЕЛ 4. МЕРЫ ПЕРВОЙ ПОМОЩИ
Описание мер первой помощи
Общая информация
Никаких специальных мер не требуется.
При вдыхании:
В случае жалоб обратиться за медицинской помощью.
При попадании на кожу:
Обычно продукт не раздражает кожу.
При попадании в глаза:
Промыть открытые глаза в течение нескольких минут под проточной водой. Если симптомы сохраняются, обратитесь к врачу.
При проглатывании:
Если симптомы сохраняются, обратитесь к врачу.
Информация для врача
Наиболее важные симптомы и эффекты, как немедленные, так и замедленные
Нет данных
Указание на необходимость немедленной медицинской помощи и специального лечения
Нет данных
РАЗДЕЛ 5. МЕРЫ ПОЖАРОТУШЕНИЯ
Средства пожаротушения
Подходящие огнетушащие вещества
Специальный порошок для сжигания металлов. Не используйте воду.
Не используйте воду.
Неподходящие огнетушащие вещества из соображений безопасности
Вода
Особые опасности, создаваемые веществом или смесью
При пожаре этого продукта могут выделяться следующие вещества:
Пар оксида металла
Рекомендации для пожарных
Защитное снаряжение:
Никаких специальных мер не требуется.
РАЗДЕЛ 6. МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
Индивидуальные меры предосторожности, защитное снаряжение и чрезвычайные меры
Не требуется.
Меры предосторожности для окружающей среды:
Не допускайте попадания материала в окружающую среду без официального разрешения.
Не допускать попадания продукта в канализацию, канализационные системы или другие водотоки.
Не допускайте проникновения материала в землю или почву.
Методы и материалы для локализации и очистки:
Собрать механически
Предотвращение вторичных опасностей:
Никаких специальных мер не требуется.
Ссылка на другие разделы
См.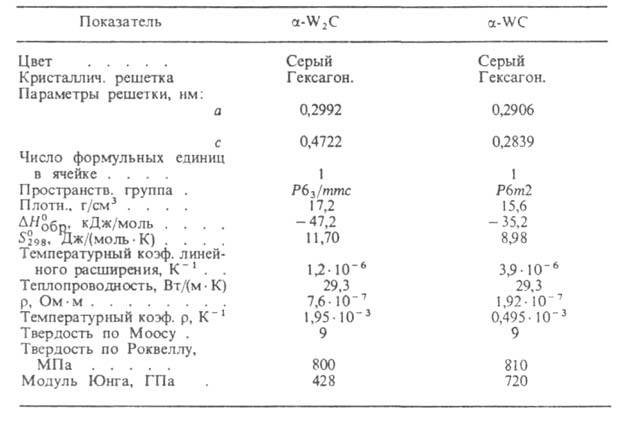 Раздел 7 для информации о безопасном обращении
Раздел 7 для информации о безопасном обращении
См. Раздел 8 для информации о средствах индивидуальной защиты.
Информацию об утилизации см. в Разделе 13.
РАЗДЕЛ 7. ОБРАЩЕНИЕ И ХРАНЕНИЕ
Обращение
Меры предосторожности для безопасного обращения
Держите контейнер плотно закрытым.
Хранить в прохладном, сухом месте в плотно закрытой таре.
Информация о защите от взрывов и пожаров:
Никаких специальных мер не требуется.
Условия безопасного хранения, включая любые несовместимости
Требования, которым должны соответствовать складские помещения и емкости:
Особых требований нет.
Сведения о хранении в одном общем хранилище:
Не хранить вместе с кислотами.
Дополнительная информация об условиях хранения:
Хранить контейнер плотно закрытым.
Хранить в прохладном сухом месте в хорошо закрытых контейнерах.
Особое конечное использование
Данные отсутствуют
РАЗДЕЛ 8. КОНТРОЛЬ ВОЗДЕЙСТВИЯ/СРЕДСТВА ИНДИВИДУАЛЬНОЙ ЗАЩИТЫ
Дополнительная информация о конструкции технических систем:
Дополнительные данные отсутствуют; см. раздел 7.
раздел 7.
Параметры управления
Компоненты с предельными значениями, требующими контроля на рабочем месте:
7440-33-7 Вольфрам (100,0%)
PEL (США) и нерастворимые соединения, такие как We
REL (США) Кратковременное значение: 10 мг/м 3
Долгосрочное значение: 5 мг/м 3
как W
TLV (США) Краткосрочное значение: 10 мг/м 3
Долговременное значение: 5 мг/м 3
как W
EL (Канада) Краткосрочное значение: 10 мг /м 3
Долгосрочное значение: 5 мг/м 3
as W
EV (Канада) Краткосрочное значение: 10* 3** мг/м 3
Долгосрочное значение: 5* 1** мг/м 3
(как вольфрам; состав.:*водораствор.;**водораствор.
Дополнительная информация:
Нет данных
Средства контроля воздействия
Средства индивидуальной защиты
Соблюдайте стандартные меры защиты и гигиены при обращении с химическими веществами.
Поддерживать эргономически подходящая рабочая среда
Дыхательное оборудование:
Не требуется
Защита рук:
Не требуется
Время проникновения через материал перчаток (в минутах)
Нет доступных данных
Защита глаз:
Защитные очки
Защита тела:
Защитная рабочая одежда
РАЗДЕЛ 9.
 ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА Информация об основных физико-химических свойствах
Внешний вид:
Форма: Твердое в различных формах
Цвет: Серебристо-серый
Запах: Нет данных доступно
Порог запаха: Нет доступных данных.
pH: неприменимо
Точка плавления/диапазон плавления: 3410 °C (6170 °F)
Точка кипения/диапазон кипения: 5900 °C (10652 °F)
Температура сублимации/начало: Нет данных
Воспламеняемость (твердое вещество, газ)
Нет данных.
Температура воспламенения: Данные отсутствуют
Температура разложения: Данные отсутствуют
Самовоспламенение: Данные отсутствуют.
Опасность взрыва: Данные отсутствуют.
Пределы взрываемости:
Нижний: Данные отсутствуют
Верхний: Данные отсутствуют
Давление паров: неприменимо
Плотность при 20 °C (68 °F): 19,3 г/см 3 (161,059 фунтов/галлон)
Объем плотность при 20 °C (68 °F): 4000 кг/м 3
Относительная плотность
Нет доступных данных.
Плотность пара
Н/Д
Скорость испарения
Н/Д
Растворимость в воде (H 2 O): нерастворим
Коэффициент распределения (н-октанол/вода): Нет доступных данных.
Вязкость:
Динамическая: Н/Д
Кинематика: Н/Д
Другая информация
Нет данных
РАЗДЕЛ 10. СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
Реактивность
Нет данных
Химическая стабильность
Стабилен при соблюдении рекомендуемых условий хранения.
Термическое разложение / условия, которых следует избегать:
Разложение не происходит, если используется и хранится в соответствии со спецификациями.
Возможность опасных реакций
Опасные реакции не известны
Условия, которых следует избегать
Нет данных
Несовместимые материалы:
Кислоты
Опасные продукты разложения:
Пары оксидов металлов
РАЗДЕЛ 11. ТОКСИКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ :
Реестр токсического воздействия химических веществ (RTECS) содержит данные об острой токсичности компонентов этого продукта.

Значения LD/LC50, важные для классификации:
Нет данных
Раздражение или коррозия кожи:
Нет раздражающего действия.
Раздражение или коррозия глаз:
Нет раздражающего действия.
Повышение чувствительности:
Сенсибилизирующие эффекты неизвестны.
Мутагенность зародышевых клеток:
Эффекты неизвестны.
Канцерогенность:
Данные по классификации канцерогенных свойств этого материала от EPA, IARC, NTP, OSHA или ACGIH отсутствуют.
Репродуктивная токсичность:
Реестр токсического воздействия химических веществ (RTECS) содержит репродуктивные данные для этого вещества.
Специфическая токсичность для системы органов-мишеней – повторное воздействие:
Неизвестно никаких последствий.
Специфическая системная токсичность на орган-мишень – однократное воздействие:
О влиянии не известно.
Опасность при вдыхании:
Воздействие неизвестно.
От подострой до хронической токсичности:
Эффекты неизвестны.

Дополнительная токсикологическая информация:
Насколько нам известно, острая и хроническая токсичность этого вещества полностью не известна.
РАЗДЕЛ 12. ЭКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Токсичность
Водная токсичность:
Нет данных
Стойкость и способность к разложению
Нет данных
Способность к биоаккумуляции
Нет данных
Мобильность в почве
Нет данных
Дополнительная экологическая информация:
Не допускать попадания материала в окружающую среду без официального разрешения .
Не допускайте попадания неразбавленного продукта или больших количеств в грунтовые воды, водотоки или канализационные системы.
Избегайте попадания в окружающую среду.
Результаты оценки PBT и vPvB
PBT:
Н/Д
vPvB:
Н/Д
Другие неблагоприятные воздействия
Данные отсутствуют
РАЗДЕЛ 13. РЕКОМЕНДАЦИИ ПО УТИЛИЗАЦИИ
Методы обработки отходов
Рекомендация
Для обеспечения надлежащей утилизации см. официальные правила.
официальные правила.
Неочищенная упаковка:
Рекомендация:
Утилизация должна производиться в соответствии с официальными правилами.
РАЗДЕЛ 14. ИНФОРМАЦИЯ О ТРАНСПОРТИРОВКЕ
Номер ООН
DOT, ADN, IMDG, IATA
Н/Д
Надлежащее отгрузочное наименование ООН
DOT, ADN, IMDG, IATA
N/A
Класс(ы) опасности при транспортировке
DOT, ADR, ADN, IMDG, IATA
Класс
N/A
Группа упаковки
DOT, IMDG, IATA
N/A
Окружающая среда опасности:
Н/Д
Особые меры предосторожности для пользователя
Н/Д
Транспортировка навалом в соответствии с Приложением II MARPOL73/78 и Кодексом IBC
Н/Д
Транспортировка/Дополнительная информация:
DOT
Морской загрязнитель (DOT):
№
РАЗДЕЛ 15. НОРМАТИВНАЯ ИНФОРМАЦИЯ
Правила/законодательные акты по безопасности, охране здоровья и окружающей среды, относящиеся к веществу или смеси
Национальные правила
Все компоненты этого продукта перечислены в Реестре химических веществ Агентства по охране окружающей среды США.
Все компоненты этого продукта перечислены в Канадском перечне веществ для внутреннего потребления (DSL).
Раздел 313 SARA (списки конкретных токсичных химических веществ)
Вещество не указано.
California Proposition 65
Proposition 65 — Химические вещества, вызывающие рак
Вещество не указано.
Prop 65 – Токсичность развития
Вещество не указано.
Prop 65 – Токсичность для развития, женщины
Вещество не указано.
Prop 65 – Токсичность для развития, мужчины
Вещество не указано.
Информация об ограничении использования:
Только для использования технически квалифицированными лицами.
Другие нормативы, ограничения и запретительные нормативы
Вещество, вызывающее особую озабоченность (SVHC) в соответствии с Регламентом REACH (ЕС) № 1907/2006.
Вещество не указано.
Условия ограничений согласно Статье 67 и Приложению XVII Регламента (ЕС) № 1907/2006 (REACH) в отношении производства, размещения на рынке и использования.


 Готовый защитный слой будет задерживать больше частиц при меньшем весе.
Готовый защитный слой будет задерживать больше частиц при меньшем весе.


 .
. д.
д.