Физико химические свойства ацетилена: Ацетилен физически и химические свойства
alexxlab | 29.04.2023 | 0 | Разное
Ацетилен физически и химические свойства
Ацетилен относится к органическим соединениям, ненасыщенным углеводородам — алкинам. В обычных условиях ацетилен представляет собой бесцветный газ. Очень горюч. Имеет формулу C2H2, то есть молекула ацетилена — это два атома углерода и два атома водорода, причём связь между углеродными атомами тройная.
Синтез ацетилена
В лабораторных условиях газ ацетилен получают, воздействуя водой на углеродистый кальций. Впервые эту реакцию провёл в 1860-х годах химик Вёлер. Ещё один способ получить молекулу ацетилена — дегидрировать две метановые молекулы, нагревая их до 1400 °C и выше.
Промышленный способ синтезировать ацетилен — гидролизовать углеродистый кальций, при этом ацетилен получают в чистом виде; или подвергнуть термическому разложению углеводородное сырьё.
Существует несколько видов термического разложения для получения ацетилена. Используемый в качестве сырья метан:
- нагревают до 1600 °C в электродуговой печи — электрокрекинг;
- обрабатывают ионизированным газом — аргоном или водородом;
- пропускают через нагретую до 1400 °C насадку — регенеративный пиролиз;
- смешивают с кислородом и нагревают смесь до 1600 °C или до 2000 °C — окислительный или гомогенный пиролиз, соответственно.

На термическое разложение тратится меньше энергии, чем на гидролиз, но полученный ацетилен нужно очищать.
Физические характеристики ацетилена
Чистый газ ацетилен летуч и не пахнет. Баллоны для него содержат пористый наполнитель. Ацетон и другие пропитки такого наполнителя дают узнаваемый запах.
Обращаться с ацетиленом нужно осторожно. Он может взорваться от удара, от нагрева до 500 °C, а при сжатии до двух атмосфер — и без нагрева. В открытом воздухе ацетилен загорается и от пламени, и от любых искр, поэтому перевозят и используют ацетилен только в защищённых баллонах.
Химические характеристики ацетилена
Ацетилен при окислении даёт высокотемпературное пламя — до 3150 °C. Сгорая, газ даёт так много тепла благодаря тройной связи углеродных атомов.
Известные химические реакции ацетилена:
- с водой образует этаналь, катализируется ртутными солями;
- обесцвечивает раствор марганцовки, водный раствор брома;
- с аммиачными растворами меди и серебра образует взрывоопасные соединения;
- полимеризируется в сложные органические соединения при 500 °C, катализируется графитом;
- проявляет свойства кислоты, образует взрывоопасный осадок с серебряными солями и одновалентной медью.

Чистый ацетилен закипает при –83 °C. Чтобы его химические свойства не привели к взрыву, ацетилен хранят только в специальных условиях, берегут от удара, от нагрева, от контакта с серебром и медью.
Требования безопасности и гигиены труда
Техника безопасности при работе с Ацетиленом
Применение ацетилена
История открытия ацетилена
Физические свойства ацетилена
Ацетилен газ со слабым чесночным запахом, конденсируется в жидкость при температуре84С и давлении 62 атм.
Смеси ацетилена с воздухом взрывоопасны. Жидкий ацетилен взрывает при попадании в него пыли.
Хранят и транспортируют ацетилен либо
в адсорбированном состоянии на
активированном угле, либо в растворах
карбонильных соединений. 1 объем ацетона
поглощает 25 объемов ацетилена (при
нормальных условиях). Перевозят ацетилен
в баллонах заполненных активированным
углем. Ацетилен легко разлагается на
углерод и водород при нагревании.
Ацетилен легко разлагается на
углерод и водород при нагревании.
Химические свойства
Реакции присоединения
Водород на катализаторах гидрирования восстанавливает алкины до алканов.
Чтобы остановить реакцию на стадии образования алкенов используют специальные добавки к катализаторам благородной группы:
Из химических восстановителей используют гидриды.
В отличии от гидрирования каталитического, которое приводит к образованию цис-алкенов, химические восстановители даюттранс-алкены.
В настоящее время в промышленности применяют жидкие гидриды алюминия:
(RO)2AlHжидкость светло-желтого цвета,
R=C4H9.
Метод широко используется в промышленности для получения хлорвинила, дихлорэтана, тетрахлорэтилена и других хлорпроизводных.
Реакция протекает по электрофильному механизму:
Реакция применяется для синтеза
тетрахлорэтилена.
Для получения тетрахлорэтилена применяют двухстадийный метод:
Присоединение хлора к ацетиленам протекает очень бурно, безопасное хлорирование можно проводить в растворе переносчика хлора:
[SbCl5·Cl2HCCCl3]комплекс пятихлористой сурьмы с пентахлорэтаном.
Реакции нуклеофильного присоединения к ацетиленам
Присоединение воды
Вода относится к нейтральным нуклеофилам.
Механизм реакции:
Активирование ацетилена комплексом со ртутью
Спирты несколько более сильные нейтральные нуклеофилы, чем вода:
.
Реакция присоединения спиртов к ацителенам называется
Виниловые эфиры устойчивая форма существования виниловых
спиртов (енолов).
Некоторые свойства виниловых эфиров
Виниловые эфиры более реакционоспособны в реакциях электрофильного присоединения [AE], чем этилены.
Алкоксигруппа благодаря сопряжению вызывает значительное увеличение электронной плотности на двойной связи, что способствует легкости образования -комплекса с электрофильными реагентами.
Так например, реакция с бромом протекает с количественным выходом:
В присутствии кислот виниловые эфиры могут полимеризоваться по катионному механизму:
ПВБЭ, так называемый бальзам Шостаковского, обладает антисептическими свойствами, является заменителем пенициллинов.
ПВА используется в качестве лаков и клеев; при гидролизе полвинилацетата образуется поливиниловый спирт:
Поливиниловый спирт незаменим для приготовления лаков и эмалей.
Все производные акриловой кислоты
находят широкое применение в качестве
полимерных материалов с индивидуальными
свойствами. Например, полиакриламид
используется в качестве синтетического
клея, а метилметакрилат – органического
стекла.
Например, полиакриламид
используется в качестве синтетического
клея, а метилметакрилат – органического
стекла.
Проводят смесью серной и азотной кислот с целью получения тетранитрометана.
В условиях реакции динитроуксусный альдегид окисляется, декарбоксилируется и донитровывается:
– Линейная полимеризация
Может проходить как димеризация или тримеризация:
Винилацетилен используют в промышленности для получения хлоропрена.
В присутствии ацетиленида меди ацетилен образует вещество купрен:
Если использовать карбонил железа в качестве катализатора, то можно получить даже циклооктатетраен:
Ацетилен | 74-86-2
Описание
Ацетилен (100% чистота) не имеет запаха, но товарная чистота имеет характерный чесночный запах.
запах, хорошо растворяется в спирте и почти смешивается с этаном. Ацетилен легко воспламеняется
газа и хранится под давлением в газовых баллонах. При определенных условиях ацетилен
может реагировать с медью, серебром и ртутью с образованием ацетилидов, соединений, которые могут действовать как
источники воспламенения. Латуни, содержащие менее 65% меди в сплаве и некоторое количество никеля
сплавы подходят для ацетилена. Ацетилен не совместим с сильными окислителями, такими как
хлор, пентафторид брома, кислород, дифторид кислорода и трифторид азота, латунь
металл, гипохлорит кальция, тяжелые металлы, такие как медь, серебро, ртуть и их соли,
бром, хлор, йод, фтор, гидрид натрия, гидрид цезия, озон, хлорная кислота
кислоты и калия.
Ацетилен легко воспламеняется
газа и хранится под давлением в газовых баллонах. При определенных условиях ацетилен
может реагировать с медью, серебром и ртутью с образованием ацетилидов, соединений, которые могут действовать как
источники воспламенения. Латуни, содержащие менее 65% меди в сплаве и некоторое количество никеля
сплавы подходят для ацетилена. Ацетилен не совместим с сильными окислителями, такими как
хлор, пентафторид брома, кислород, дифторид кислорода и трифторид азота, латунь
металл, гипохлорит кальция, тяжелые металлы, такие как медь, серебро, ртуть и их соли,
бром, хлор, йод, фтор, гидрид натрия, гидрид цезия, озон, хлорная кислота
кислоты и калия.
Химические свойства
Ацетилен (100% чистота) не имеет запаха, но товарная чистота имеет характерный чесночный запах.
запах. Он хорошо растворим в спирте и почти не смешивается с этаном. Ацетилен легко воспламеняется
газа и хранится под давлением в газовых баллонах. При определенных условиях ацетилен
может реагировать с медью, серебром и ртутью с образованием ацетилидов, соединений, которые могут действовать как
источники воспламенения. Латунь содержит форму ацетилидов, соединений, которые могут действовать как воспламенитель.
источники. Латуни, содержащие менее 65% меди в сплаве, и некоторые никелевые сплавы
подходит для ацетилена. Ацетилен не совместим с сильными окислителями, такими как хлор,
пентафторид брома, кислород, дифторид кислорода и трифторид азота, металлическая латунь,
гипохлорит кальция, тяжелые металлы, такие как медь, серебро, ртуть и их соли, бром,
хлор, йод, фтор, гидрид натрия, гидрид цезия, озон, хлорная кислота,
или калий.
При определенных условиях ацетилен
может реагировать с медью, серебром и ртутью с образованием ацетилидов, соединений, которые могут действовать как
источники воспламенения. Латунь содержит форму ацетилидов, соединений, которые могут действовать как воспламенитель.
источники. Латуни, содержащие менее 65% меди в сплаве, и некоторые никелевые сплавы
подходит для ацетилена. Ацетилен не совместим с сильными окислителями, такими как хлор,
пентафторид брома, кислород, дифторид кислорода и трифторид азота, металлическая латунь,
гипохлорит кальция, тяжелые металлы, такие как медь, серебро, ртуть и их соли, бром,
хлор, йод, фтор, гидрид натрия, гидрид цезия, озон, хлорная кислота,
или калий.
Химические свойства
Ацетилен — легковоспламеняющийся бесцветный сжатый газ. В чистом виде имеет слабый эфирный запах; чесночный запах при загрязнении
Физические свойства
Ацетилен, простейший алкиновый углеводород, существует в виде бесцветного легковоспламеняющегося нестабильного газа с характерным приятным запахом (ацетилен, полученный из карбида кальция, имеет чесночный запах из-за следов фосфина, образующегося в этом процессе).
История
Ацетилен был открыт в 1836 году Эдмундом Дэви (1785-1857), который произвел этот газ, пытаясь получить металлический калий из карбида калия (K 2 C 2 ). В 1859 году Марсель Моррен во Франции произвел ацетилен, запустив электрическую дугу между угольными электродами в присутствии водорода. Моррен назвал образующийся газ карбонизированным водородом. Три года спустя Пьер Эжен-Марселин Бертло (1827-1819 гг.07) повторил эксперимент Моррена и идентифицировал карбонизированный водород как ацетилен.
Использование
Около 80% производства ацетилена используется в замкнутой системе
производственный промежуточный продукт для производства других
химические вещества. Другие химические вещества, синтезированные из ацетилена
включают мономер винилхлорида, N-винилкарбазол, 1,4-
бутандиол, виниловые эфиры, N-винил-2-пирролидон, винилфторид,
N-винилкапролактам и сложные виниловые эфиры.
Использование
Ацетилен используется в кислородно-ацетиленовом пламени для сварки и резки металлов; как источник света; как топливо; для очистки меди, серебра и других металлов; и в производстве уксусной кислоты, ацетальдегида и ацетилидов. Он образуется при взаимодействии карбида кальция с водой. Его также получают крекингом фракций нефтяной нафты.
Использование
Осветительное оборудование, кислородно-ацетиленовая сварка, резка и пайка металлов, сигнализация; металлы pptg, особенно медь; производство ацетальдегида, уксусной кислоты; топливо для моторных лодок.
Методы производства
В промышленных масштабах ацетилен получают путем пиролиза нафты в процессе двухстадийного крекинга. И ацетилен, и этилен являются конечными продуктами. Соотношение двух продуктов может быть изменено путем изменения скорости подачи нафты. Ацетилен также получают методом погруженного пламени из сырой нефти. В сущности, газификация сырой нефти происходит посредством пламени, которое поддерживается кислородом под поверхностью нефти. Горение и растрескивание масла происходят на границах пламени. В состав крекинг-газа входит около 6,3% ацетилена и 6,7% этилена. Таким образом, требуется дальнейшее разделение и очистка. Несколько лет назад, когда были разработаны методы безопасного обращения с ацетиленом в больших масштабах, Дж. В. Реппе разработал ряд реакций, которые позже стали известны как «химия Реппе». Эти реакции были особенно важны для производства многих высокомолекулярных полимеров и других синтетических продуктов. Реппе и его коллеги смогли осуществить синтез химических веществ, которые были коммерчески недоступны. Примером может служить синтез циклооктатетраена путем нагревания раствора ацетилена под давлением в тетрагидрофуране в присутствии цианистого никеля в качестве катализатора.
И ацетилен, и этилен являются конечными продуктами. Соотношение двух продуктов может быть изменено путем изменения скорости подачи нафты. Ацетилен также получают методом погруженного пламени из сырой нефти. В сущности, газификация сырой нефти происходит посредством пламени, которое поддерживается кислородом под поверхностью нефти. Горение и растрескивание масла происходят на границах пламени. В состав крекинг-газа входит около 6,3% ацетилена и 6,7% этилена. Таким образом, требуется дальнейшее разделение и очистка. Несколько лет назад, когда были разработаны методы безопасного обращения с ацетиленом в больших масштабах, Дж. В. Реппе разработал ряд реакций, которые позже стали известны как «химия Реппе». Эти реакции были особенно важны для производства многих высокомолекулярных полимеров и других синтетических продуктов. Реппе и его коллеги смогли осуществить синтез химических веществ, которые были коммерчески недоступны. Примером может служить синтез циклооктатетраена путем нагревания раствора ацетилена под давлением в тетрагидрофуране в присутствии цианистого никеля в качестве катализатора. В другой реакции акриловая кислота была получена из СО и h3O в присутствии никелевого катализатора: C2h3 + CO + h3O → Ch3:CH·COOH. Эти две реакции представляют гораздо большее количество реакций, как тех, которые являются только прямыми, так и тех, которые включают замыкание кольца.
В другой реакции акриловая кислота была получена из СО и h3O в присутствии никелевого катализатора: C2h3 + CO + h3O → Ch3:CH·COOH. Эти две реакции представляют гораздо большее количество реакций, как тех, которые являются только прямыми, так и тех, которые включают замыкание кольца.
Определение
А газообразный алкин. Традиционно этин нашел применение в кислородно-ацетиленовой сварке факелы, так как его сжигание с кислородом производит пламя очень высокой температуры. Это также важно в органических химических веществах. промышленность по производству хлорэтен (винилхлорид), который исходный материал для производства поливинилхлорида (ПВХ), а для производства других виниловых соединений. До того как Недавно этин был произведен компанией синтез и последующий гидролиз кальция дикарбид, очень дорогая процедура. Современные методы все чаще используют крекинг алканов.
Методы производства
Традиционный метод производства ацетилена заключается в реакции извести, оксида кальция (CaO) с коксом с получением карбида кальция (CaC 2 ). Затем карбид кальция смешивают с водой для получения ацетилена:
Затем карбид кальция смешивают с водой для получения ацетилена:
2CaO (т) + 5C (т) →2CaC 2(г) + CO 2(г)
CaC 2(т) + 2H 2 O (л) → C 2 H 2(g) + Ca(OH) 2(aq)
Несколько процессов получения ацетилена из природного газа и других нефтепродуктов были разработаны в 1920-х годах. Термический крекинг метана включает нагревание метана примерно до 600 ℃ в среде с дефицитом кислорода для предотвращения сгорания всего метана. Сгорание части смеси метана повышает температуру примерно до 1500 ℃, вызывая расщепление оставшегося метана в соответствии с реакцией: 2CH 4(g) → C2H 2(г) + 3H 2(г) . Кроме метана в качестве исходных газов для получения ацетилена могут использоваться этан, пропан, этилен и другие углеводороды.
Реакции
Ацетилен реагирует (1) с хлором с образованием тетрахлорида ацетилена C2h3Cl4 или CHCl2·CHCl2, или дихлорида ацетилена C2h3Cl2 или CHCl:CHCl, (2) с бромом с образованием тетрабромида ацетилена C2h3Br4 или CHBr2·CHBr2, или дибромида ацетилена C2h3Br2 или CHBr:CHBr , (3) с хлороводородом (бромид, иодид), с образованием монохлорида этилена Ch3:CHCl (монобромид, монойодид) и 1,1-дихлорэтана, этилиденхлорида Ch4·CHCl2 (дибромид, дийодид), (4) с h3O в в присутствии катализатора, например сульфата ртути HgO4S, с образованием ацетальдегида Ch4·CHO, (5) с водородом, в присутствии катализатора, например тонкоизмельченного никеля, нагретого, с образованием этилена C2h5 или этана C2H6, (6) с металлами, такими как медь или никель, когда они влажные, а также со свинцом или цинком, когда они влажные и неочищенные. Жесть не атакована. Натрий при нагревании дает соединения C2HNa и C2Na2. (7) С раствором аммиачно-медистой (или серебра) соли образуется ацетиленид меди (или серебра) C2Cu2, темно-красный осадок, взрывоопасный в сухом состоянии и дающий ацетилен при обработке кислотой, (8) с раствором сулемы с образованием трихлорртуть-ацетальдегида C(HgCl)3·CHO, осадок, который дает смесь ацетальдегида HCl и хлорида ртути.
Жесть не атакована. Натрий при нагревании дает соединения C2HNa и C2Na2. (7) С раствором аммиачно-медистой (или серебра) соли образуется ацетиленид меди (или серебра) C2Cu2, темно-красный осадок, взрывоопасный в сухом состоянии и дающий ацетилен при обработке кислотой, (8) с раствором сулемы с образованием трихлорртуть-ацетальдегида C(HgCl)3·CHO, осадок, который дает смесь ацетальдегида HCl и хлорида ртути.
Общее описание
Бесцветный газ со слабым чесночным запахом. Легко воспламеняется и горит коптящим пламенем. Газ легче воздуха. Пламя может очень легко вернуться к источнику утечки. При длительном воздействии огня или тепла контейнеры могут сильно разорваться и взорваться.
Реакции воздуха и воды
Легко воспламеняется. Мало растворим в воде. Реагирует с водой с образованием токсичных паров аммиака.
Профиль реактивности
Ацетилен реагирует с щелочными металлами с образованием газообразного водорода. Ацетилен может взрывоопасно реагировать с бромом [Von Schwartz 1918. p.142]. Ацетилен образует чувствительный ацетилид при попадании в водный раствор нитрата ртути [Mellor 4:933. 1946-47]. Ацетиленовая горелка, использованная для сверления рамы плуга, наполненной газообразным водородом, произвела взрыв [NIOSH, июнь 1998]. Ацетилен реагирует с серебром, медью и свинцом с образованием чувствительных взрывоопасных солей. Поскольку ацетилен является эндотермическим и эффективным восстановителем, его реакция с окислителями может быть очень бурной (примеры: гипохлорит кальция, азотная кислота, оксид азота, озон, трифторметилгипофторит и т. д.). Контакт очень холодного сжиженного газа с водой может привести к сильному или сильному кипению продукта и чрезвычайно быстрому испарению из-за большой разницы температур. Если вода горячая, существует вероятность того, что может произойти взрыв «перегрева» жидкости. Давление может возрасти до опасного уровня, если сжиженный газ контактирует с водой в закрытом контейнере [Безопасное обращение с химическими веществами 1980].
Ацетилен может взрывоопасно реагировать с бромом [Von Schwartz 1918. p.142]. Ацетилен образует чувствительный ацетилид при попадании в водный раствор нитрата ртути [Mellor 4:933. 1946-47]. Ацетиленовая горелка, использованная для сверления рамы плуга, наполненной газообразным водородом, произвела взрыв [NIOSH, июнь 1998]. Ацетилен реагирует с серебром, медью и свинцом с образованием чувствительных взрывоопасных солей. Поскольку ацетилен является эндотермическим и эффективным восстановителем, его реакция с окислителями может быть очень бурной (примеры: гипохлорит кальция, азотная кислота, оксид азота, озон, трифторметилгипофторит и т. д.). Контакт очень холодного сжиженного газа с водой может привести к сильному или сильному кипению продукта и чрезвычайно быстрому испарению из-за большой разницы температур. Если вода горячая, существует вероятность того, что может произойти взрыв «перегрева» жидкости. Давление может возрасти до опасного уровня, если сжиженный газ контактирует с водой в закрытом контейнере [Безопасное обращение с химическими веществами 1980]. Ацетилен и аммиак могут образовывать взрывоопасные соли серебра при контакте с Ag. (Реннер, Герман, Гюнтер Шламп. «Серебро, соединения серебра и сплавы серебра». Энциклопедия промышленной химии Ульмана. Wiley-VCH Verlag GmbH & Co. KGaA. 2001.).
Ацетилен и аммиак могут образовывать взрывоопасные соли серебра при контакте с Ag. (Реннер, Герман, Гюнтер Шламп. «Серебро, соединения серебра и сплавы серебра». Энциклопедия промышленной химии Ульмана. Wiley-VCH Verlag GmbH & Co. KGaA. 2001.).
Опасность
НПВ ацетилена достигается задолго до того, как может произойти удушье, а опасность взрыва достигается до появления какой-либо другой опасности для здоровья. При тушении пожаров, связанных с баллонами с ацетиленом, огонь следует тушить до закрытия вентиля баллона. Это связано с тем, что ацетилен имеет такой широкий диапазон воспламенения, что может гореть внутри контейнера. Ацетилен несовместим с бромом, хлором, фтором, медью, серебром, ртутью и их соединениями. Ацетилен имеет четырехзначный идентификационный номер ООН 1001. Обозначение NFPA 704: здоровье 1, воспламеняемость 4 и реакционная способность 3. Реакционная способность снижается до 2, когда ацетилен растворяется в ацетоне.
Опасность для здоровья
Продолжительные периоды воздействия ацетилена вызывают симптомы, включая головные боли, респираторные затрудненное дыхание, звон в ушах, одышка, свистящее дыхание, головокружение, сонливость, потеря сознания, тошнота, рвота и угнетение всех органов чувств. Кожа жертвы передержки может иметь синий цвет. В настоящее время нет известных неблагоприятных для здоровья эффекты, связанные с хроническим воздействием компонентов этого сжатого газа. Недостаток недостаточного количества кислорода может привести к серьезной травме или смерти. К органам-мишеням относятся почек, ЦНС, печени, дыхательной системы и глаз.
Опасность для здоровья
Ацетилен удушает, как и другие углеводородные газы. Воздействие его атмосферы может вызвать смерть от удушья или удушья при исключении доступа кислорода. Он нетоксичен, но в высоких концентрациях оказывает наркотическое действие. Воздействие 20% концентрации в воздухе может вызвать у человека головную боль и одышку; вдыхание 50% ацетилена в воздухе в течение 5 минут может привести к летальному исходу (NIOSH 1986).
Воздействие 20% концентрации в воздухе может вызвать у человека головную боль и одышку; вдыхание 50% ацетилена в воздухе в течение 5 минут может привести к летальному исходу (NIOSH 1986).
Опасность для здоровья
Могут возникнуть головная боль, головокружение и потеря сознания. Смерть от «удушья» может наступить, если содержание кислорода в воздухе резко уменьшится за счет разбавления ацетиленом.
Пожарная опасность
Поведение в огне: может взорваться в огне
Воспламеняемость и взрывоопасность
Ацетилен является легковоспламеняющимся газом и образует взрывоопасные смеси с воздухом над
необычно широкий диапазон концентраций (от 2 до 80%). Ацетилен может полимеризоваться.
экзотермически, что приводит к дефлаграции. Обладая очень высокой положительной свободной энергией
ацетилен термодинамически нестабилен и чувствителен к ударам и
давление. Его стабильность повышается за счет присутствия небольших количеств других
такие соединения, как метан и ацетилен в баллонах, относительно безопасны в обращении
потому что он растворяется в ацетоне. Ацетиленовые пожары можно тушить углекислым газом.
сухие химические и галоновые огнетушители; Тушение пожара значительно облегчается за счет закрытия
отключена подача газа.
Его стабильность повышается за счет присутствия небольших количеств других
такие соединения, как метан и ацетилен в баллонах, относительно безопасны в обращении
потому что он растворяется в ацетоне. Ацетиленовые пожары можно тушить углекислым газом.
сухие химические и галоновые огнетушители; Тушение пожара значительно облегчается за счет закрытия
отключена подача газа.
Промышленное использование
Ацетилен — бесцветный легковоспламеняющийся газ с чесночным запахом. В сжатом состоянии он очень взрывоопасен; однако его можно безопасно сжимать и хранить в баллонах высокого давления, если баллоны покрыты абсорбирующим материалом, пропитанным ацетоном. Пользователей предупреждают, что нельзя сливать ацетилен при давлении, превышающем 15 фунтов на кв. дюйм (103 кПа), что отмечено красной линией на ацетиленовых манометрах.
Благодаря интенсивному нагреву и управляемости кислородно-ацетиленовое пламя можно использовать для различных операций сварки и резки, включая наплавку, пайку, снятие фаски, строжку и зачистку. Нагревательная способность ацетилена также может быть использована для гибки, правки, формовки, закалки, размягчения и упрочнения металлов.
Нагревательная способность ацетилена также может быть использована для гибки, правки, формовки, закалки, размягчения и упрочнения металлов.
Профиль безопасности
Смертельно токсичен при вдыхании. Системные воздействия на человека при вдыхании: головная боль и одышка. Наркотик в высокой концентрации. В общепромышленной практике ацетилен не представляет серьезной токсической опасности. Это очень опасная опасность возгорания при воздействии тепла, пламени или окислителей. Умеренная опасность взрыва при воздействии тепла или пламени или в результате самопроизвольной химической реакции. Известно, что при высоком давлении и умеренных температурах, а также в отсутствие воздуха ацетилен разлагается со взрывом. Реагирует с медью с образованием взрывоопасного ацетилида меди. Несовместим с латунью, солями меди, карбидом меди, порошкообразными солями Co, Hg, Hg, K, Ag и солями Ag, RbH, CsH, галогенами, HNO3, NaH, окислителями. Ацетилен + галогенид + ультрафиолет могут взорваться. Molten Kignites в C2h3, а затем взрывается. C2h3 энергично реагирует с трифторметилгипофлюоритом. С O2 C2h3 может взорваться очень мощно. См. АЦЕТИЛИДЫ. При воспламенении горит сильно горячим пламенем; может бурно реагировать с окислителями. При смешивании с O2 в пропорциях 40% и более ацетилен действует как наркотик и используется для анестезии. Ацетилена O2 в воздухе до уровня, не поддерживающего жизнь. Однако наличие примесей в коммерческом ацетилене может привести к появлению симптомов до того, как будет достигнута удушающая концентрация. Так: 10 % в воздухе вызывают легкое опьянение, 20 % — шатающуюся походку, 30 % — общую дезориентацию, 33 % — потерю сознания через 7 минут, до 80 % — полную анестезию, повышение артериального давления, наркоз, стимуляцию дыхания. .
сообщалось о симптомах, а также (при высокой концентрации) полуасфиксии и кратковременной потере сознания. См. ARGON, чтобы узнать об отравлении простыми удушающими средствами.
Ацетилен + галогенид + ультрафиолет могут взорваться. Molten Kignites в C2h3, а затем взрывается. C2h3 энергично реагирует с трифторметилгипофлюоритом. С O2 C2h3 может взорваться очень мощно. См. АЦЕТИЛИДЫ. При воспламенении горит сильно горячим пламенем; может бурно реагировать с окислителями. При смешивании с O2 в пропорциях 40% и более ацетилен действует как наркотик и используется для анестезии. Ацетилена O2 в воздухе до уровня, не поддерживающего жизнь. Однако наличие примесей в коммерческом ацетилене может привести к появлению симптомов до того, как будет достигнута удушающая концентрация. Так: 10 % в воздухе вызывают легкое опьянение, 20 % — шатающуюся походку, 30 % — общую дезориентацию, 33 % — потерю сознания через 7 минут, до 80 % — полную анестезию, повышение артериального давления, наркоз, стимуляцию дыхания. .
сообщалось о симптомах, а также (при высокой концентрации) полуасфиксии и кратковременной потере сознания. См. ARGON, чтобы узнать об отравлении простыми удушающими средствами. Для тушения пожара используйте CO2, распыленную воду или сухой химикат. Остановить подачу газа
Для тушения пожара используйте CO2, распыленную воду или сухой химикат. Остановить подачу газа
Потенциальное воздействие
Ацетилен можно сжигать на воздухе или в кислороде и использовать для пайки, сварки, резки, металлизации, закалки, зачистки пламенем; местный нагрев в металлургии. Пламя также используется в стекольной промышленности. В химическом отношении ацетилен используется в производстве винилхлорида, акрилинитрила, синтетического каучука; винилацетат; трихлорэтилен, акрилат, бутиролактон, 1,4-бутандиол, винилалкиловые эфиры, пирролидон и другие вещества
хранилище
Ацетилен следует хранить в прохладном сухом месте в плотно закрытой таре и
следует использовать только в хорошо проветриваемом помещении. Цилиндры должны быть отделены от
кислород и другие окислители не менее чем на 20 футов или барьером из негорючего материала высотой не менее 5 футов, имеющим класс огнестойкости не менее 30 мин. Хранение в
превышение 2500 куб. Футов запрещено в зданиях с другими помещениями. Цилиндры должны
хранить в вертикальном положении с установленным защитным колпачком клапана и надежно
падение или опрокидывание. Баллоны должны быть защищены от физического повреждения.
и избегайте перетаскивания, перекатывания, скольжения или падения цилиндра. Во время транспортировки рабочие
следует использовать подходящую ручную тележку для перемещения цилиндра. Следует проявлять осторожность, чтобы
маркируйте знаки «Не курить» или «Открытое пламя» в местах хранения или использования. Там должно
не иметь источников воспламенения. Все электрооборудование в хранилище должно быть взрывозащищенным.
и использовать площади.
Хранение в
превышение 2500 куб. Футов запрещено в зданиях с другими помещениями. Цилиндры должны
хранить в вертикальном положении с установленным защитным колпачком клапана и надежно
падение или опрокидывание. Баллоны должны быть защищены от физического повреждения.
и избегайте перетаскивания, перекатывания, скольжения или падения цилиндра. Во время транспортировки рабочие
следует использовать подходящую ручную тележку для перемещения цилиндра. Следует проявлять осторожность, чтобы
маркируйте знаки «Не курить» или «Открытое пламя» в местах хранения или использования. Там должно
не иметь источников воспламенения. Все электрооборудование в хранилище должно быть взрывозащищенным.
и использовать площади.
Доставка
UN1001 Ацетилен растворенный, класс опасности: 2.1; Метки: 2.1-Горючий газ. Баллоны необходимо транспортировать в безопасном вертикальном положении в хорошо проветриваемом грузовике. Защитите цилиндр и этикетки от физического повреждения. Владелец баллона со сжатым газом является единственным лицом, которому федеральный закон (49CFR) разрешает перевозить и заправлять его. Заправка баллонов со сжатым газом без письменного разрешения владельца является нарушением правил перевозки
Владелец баллона со сжатым газом является единственным лицом, которому федеральный закон (49CFR) разрешает перевозить и заправлять его. Заправка баллонов со сжатым газом без письменного разрешения владельца является нарушением правил перевозки
Методы очистки
Если ацетилен очень загрязнен, его следует очистить путем последовательного пропускания через спиральные промывочные склянки, содержащие в указанном порядке насыщенный водный раствор NaHSO4, h3O, 0,2 М йода в водном растворе KI (две склянки), раствор тиосульфата натрия (две склянки), щелочной гидросульфит натрия с антрахинон-2-сульфонатом натрия в качестве индикатора (два флакона) и 10%-ным водным раствором КОН (два флакона). Затем газ пропускают через ловушку с сухим льдом и две сушильные трубки, первая из которых содержит CaCl2, а вторая — дегидрит [Mg(ClO4)2] [Conn et al. J Am Chem Soc 61 1868 1939]. Пары ацетона можно удалить из ацетилена пропусканием через H3O, затем концентрированную H3SO4 или пропусканием через две газовые ловушки при -65°С и -80°С, конц. & Nieuwland Org Synth Coll Vol I 229 1941, Wiley Org Synth Coll Vol III 853 1955, Jones & Whiting Org Synth Coll Vol IV 793 1963]. Иногда содержит ацетон и воздух. Их можно удалить с помощью серии перегонок от колбы к колбе, т.е. цепочка, состоящая из ловушки conc h3SO4 и ловушки холодного EtOH (-73o), или пропускание через h3O и h3SO4, затем через KOH и CaCl2. [См. Brandsma Preparative Acetylenic Chemistry, 1st Edn Elsevier 1971 стр. 15, для pK, ISBN 0444409475, 2nd Edn Elsevier 1988, ISBN 0444429603 и ниже для ацетилида натрия.] Он также доступен в продаже как 10 ppm в гелии и несколько концентраций в N2 для калибровки прибора. [Beilstein 1 IV 939.] Ацетилид натрия [1066-26-8] M 48,0 получают растворением Na (23 г) в жидком Nh4 (1 л) и барботированием ацетилена до появления синей окраски (около 30 минут) и выпариванием досуха. [Saunders Org Synth Coll Vol III 416 1955] и коммерчески доступен в виде суспензии в ксилоле/легком минеральном масле. [См. запись в «Металлоорганических соединениях», глава 5.
& Nieuwland Org Synth Coll Vol I 229 1941, Wiley Org Synth Coll Vol III 853 1955, Jones & Whiting Org Synth Coll Vol IV 793 1963]. Иногда содержит ацетон и воздух. Их можно удалить с помощью серии перегонок от колбы к колбе, т.е. цепочка, состоящая из ловушки conc h3SO4 и ловушки холодного EtOH (-73o), или пропускание через h3O и h3SO4, затем через KOH и CaCl2. [См. Brandsma Preparative Acetylenic Chemistry, 1st Edn Elsevier 1971 стр. 15, для pK, ISBN 0444409475, 2nd Edn Elsevier 1988, ISBN 0444429603 и ниже для ацетилида натрия.] Он также доступен в продаже как 10 ppm в гелии и несколько концентраций в N2 для калибровки прибора. [Beilstein 1 IV 939.] Ацетилид натрия [1066-26-8] M 48,0 получают растворением Na (23 г) в жидком Nh4 (1 л) и барботированием ацетилена до появления синей окраски (около 30 минут) и выпариванием досуха. [Saunders Org Synth Coll Vol III 416 1955] и коммерчески доступен в виде суспензии в ксилоле/легком минеральном масле. [См. запись в «Металлоорганических соединениях», глава 5. ]
]
Оценка токсичности
Ацетилен попадает в окружающую среду через различные
промышленные стоки промышленных предприятий. Из-за пара
давление ацетилена (4,04×10 4 мм рт.ст. при 25°С), существует
в окружающей среде исключительно в виде газа.
газообразная фаза ацетилена разлагается в окружающей среде
с фотохимически индуцированными гидроксильными радикалами; период полураспада
для этого фотохимического разложения составляет приблизительно
20 дней. Расчетное значение Koc ацетилена составляет 38 и основано на
при этом значении Koc ожидается, что ацетилен будет обладать высокой подвижностью при попадании в почву. На основании закона Генри
постоянная 0,022 атм-м3моль -1 , получено из давления паров
4,04×10 4 мм рт.ст. и растворимостью в воде 1200 мг л1,
улетучивание из влажной почвы является основным процессом судьбы для
ацетилен. В почве биодеградация не ожидается.
важный процесс судьбы ацетилена, как предполагает 0%
биохимическое потребление кислорода (БПК) через 28 дней. Ацетилен это
не предполагается адсорбция взвешенными твердыми частицами и
отложений при попадании в воду из-за значения Koc.
Ожидается, что удаление ацетилена из воды будет
процесс улетучивания. Расчетная биоконцентрация
фактор (BCF) 3 для ацетилена предполагает, что потенциал
для биоаккумуляции ацетилена в гидробионтах
низкий.
Ацетилен это
не предполагается адсорбция взвешенными твердыми частицами и
отложений при попадании в воду из-за значения Koc.
Ожидается, что удаление ацетилена из воды будет
процесс улетучивания. Расчетная биоконцентрация
фактор (BCF) 3 для ацетилена предполагает, что потенциал
для биоаккумуляции ацетилена в гидробионтах
низкий.
Несовместимость
Вещество может полимеризоваться при нагревании. Вещество разлагается при нагревании и повышении давления с опасностью пожара и взрыва. Вещество является сильным восстановителем и бурно реагирует с окислителями, а также с фтором или хлором под действием света с опасностью пожара и взрыва. Реагирует с медью, серебром и ртутью или их солями, образуя чувствительные к удару соединения (ацетилиды). Содержание меди в трубопроводах, подающих ацетилен, не должно превышать 63 %. Может образовывать взрывоопасную смесь с воздухом. Образует ударостойкую смесь с медью и солями меди; ртуть и ртутные соли; и серебро и соли серебра. Реагирует с латунью, бромом, гидридом цезия, хлором, кобальтом, ацетилом меди; фтор, йод, нитрат ртути; азотная кислота, калий, гидрид рубидия; трифторметилгипофторит; и гидрид натрия.
Реагирует с латунью, бромом, гидридом цезия, хлором, кобальтом, ацетилом меди; фтор, йод, нитрат ртути; азотная кислота, калий, гидрид рубидия; трифторметилгипофторит; и гидрид натрия.
Удаление отходов
Возврат многоразовых баллонов со сжатым газом поставщику. Проконсультируйтесь с природоохранными органами для получения рекомендаций по приемлемым методам утилизации. Генераторы отходов, содержащих это загрязняющее вещество (≥100 кг/мес), должны соответствовать правилам EPA, регулирующим хранение, транспортировку, обработку и утилизацию отходов. Сжигание.
Формула ацетилена
Главная > Формулы > Химические формулы > Формула ацетилена
Формула ацетилена
Ацетилен, также известный как этин, представляет собой химическое соединение алкинового типа, которое используется в качестве топлива и промежуточного продукта в химическом синтезе.
Формула и структура: Химическая формула ацетилена C 2 H 2 , расширенная формула CHΞCH. Его молярная масса составляет 26,04 г моль -1 . Молекула представляет собой простейший алкин, функциональная группа которого характеризуется наличием тройных связей. Молекула ацетилена является линейной (180 ºC), следовательно, ее атомы углерода гибридизованы зр. Оба атома углерода имеют по 2 sp-орбитали, одна из которых связана с водородом, а другая — с простой углеродной связью. тройная связь, то есть 2 связи Π, образуется между четырьмя орбиталями P без гибридизации, которые ортогональны линейной системе. Его химическую структуру можно записать, как показано ниже, в общепринятых представлениях, используемых для органических молекул.
Распространение: Ацетилен можно найти в природе, особенно растворенным в воде. Это основной источник, который использует некоторые бактерии для производства ацетальдегида. Он содержится в природном газе и в нефтяных скважинах вместе с сырой нефтью и другими газами.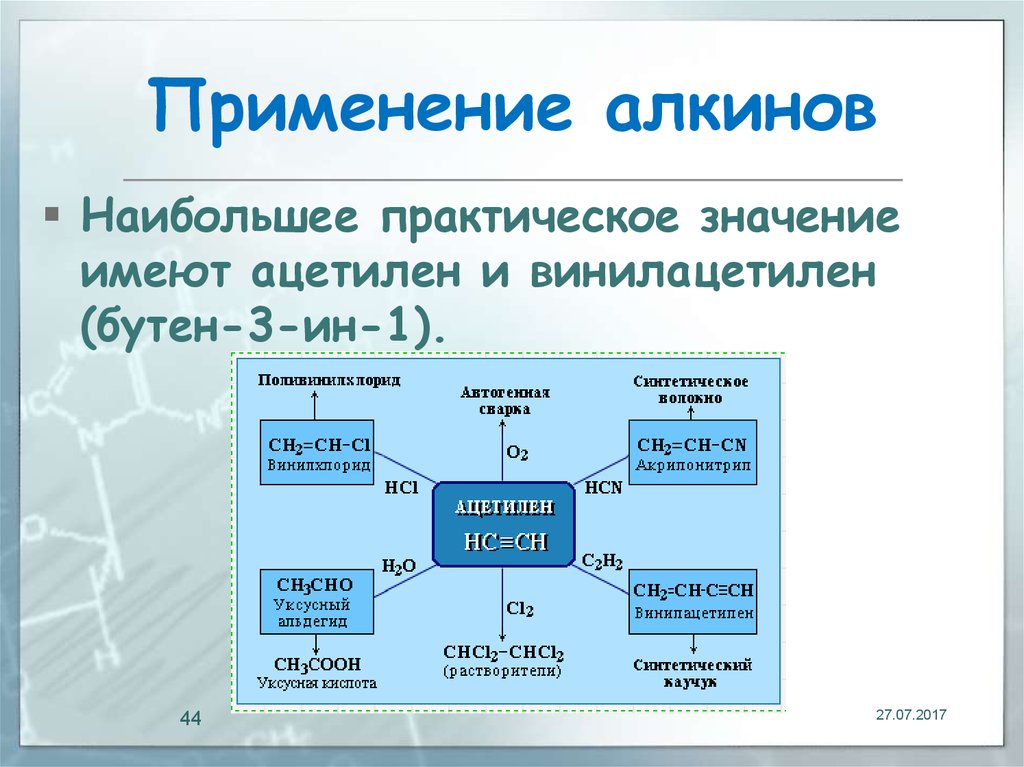 Он также является частью атмосферы некоторых солнечных планет.
Он также является частью атмосферы некоторых солнечных планет.
Подготовка: Ацетилен извлекается из природного газа или газов нефтяных скважин, но его также можно получить путем сжигания или электрической дуги углеводородов, таких как метан и этан, или даже из сырой нефти. В результате этого процесса образуется смесь газов, поэтому ацетилен необходимо отделять с помощью другого процесса химической промышленности. Другим, менее используемым методом является реакция между карбидом кальция и водой с образованием гидроксида кальция и ацетилена.
Физические свойства: Ацетилен – бесцветный газ с чесночным запахом, растворяется в ацетоне для транспортировки. Эти точки плавления (вернее, тройной точки, поскольку равновесие между тремя фазами) и температуры сублимации составляют -80,7 ºC и -84,7 ºC соответственно. Его плотность составляет 1,097 г/мл -1 . Он может легко воспламениться, образуя коптящее пламя. Ацетилен растворим в воде, ацетоне, бензоле и хлороформе. Он мало растворим
в этаноле.
Химические свойства: Ацетилен является очень реакционноспособным химическим соединением благодаря своим Π-электронам в тройной связи C-C, поэтому ацетилен является отличным нуклеофилом. Таким образом, ацетилен может подвергаться широкому ряду реакций с получением коммерческих продуктов, таких как ацетилен, спирты, акриловая кислота или виниловые соединения. Ацетальдегид можно использовать для получения металлоорганических соединений при взаимодействии с таким металлом, как медь.
Использование: Ацетальдегид широко используется в промышленности в сварочных процессах из-за высокой температуры ацетиленового пламени (3300 ºC). То же пламя используется в некоторых менее развитых странах в качестве лампы накаливания. осветительные приборы. Ацетилен также может давать промежуточные продукты, такие как этилен, очень используемый в производстве полипропилена в пластмассовой промышленности.
Влияние на здоровье/опасность: Ацетилен легче воздуха и токсичен только в том случае, если он производится методами, которые могут оставлять другие химические соединения в виде примесей.