Формула ацетилена в химии: Ацетилен: свойства и все характеристики
alexxlab | 01.03.2023 | 0 | Разное
Урок №17. Ацетилен и его гомологи.
Урок №17. Ацетилен и его гомологи.1. Алкины – это алифатически (ациклические), непредельные (ненасыщенные) углеводороды, с одной тройной углерод-углеродной связью С≡С в цепи и общей формулой СnH2n-2 2. Строение
Ацетилен – первый член гомологического ряда ацетиленовых углеводородов, или алкинов. Молекулярная формула ацетилена C2H2 Структурная формула ацетилена H–C≡C–H Электронная формула H : С : : : С : Н Углеродные атомы ацетилена, связанные тройной связью, находятся в состоянии sp-гибридизации. При образовании молекулы ацетилена у каждого атома С гибридизуются по одной  В результате этого каждый атом С приобретает по две гибридных орбитали, а две p-орбитали
остаются негибридными. Две гибридных орбитали взаимно перекрываются, и между
атомами С образуется σ-связь. Остальные две гибридных орбитали перекрываются с s-орбиталями
атомов H, и между ними и атомами С тоже образуются σ -связи. Четыре негибридных p-орбитали размещены взаимно перпендикулярно и перпендикулярно
направлениям σ-связей. В этих плоскостях p-орбитали взаимно
перекрываются, и образуются две π -связи, которые относительно непрочные и в
химических реакциях легко разрываются. В результате этого каждый атом С приобретает по две гибридных орбитали, а две p-орбитали
остаются негибридными. Две гибридных орбитали взаимно перекрываются, и между
атомами С образуется σ-связь. Остальные две гибридных орбитали перекрываются с s-орбиталями
атомов H, и между ними и атомами С тоже образуются σ -связи. Четыре негибридных p-орбитали размещены взаимно перпендикулярно и перпендикулярно
направлениям σ-связей. В этих плоскостях p-орбитали взаимно
перекрываются, и образуются две π -связи, которые относительно непрочные и в
химических реакциях легко разрываются.Таким образом, в молекуле ацетилена имеются три σ -связи (одна связь C–C и две связи C–H) и две π -связи между двумя С атомами. Тройная связь в алкинах – не утроенная простая, а комбинированная, состоящая из трех связей: одной σ – и двух π -связей. Молекула ацетилена имеет линейное
строение. Появление третьей связи вызывает дальнейшее сближение атомов С:
расстояние между их центрами составляет 0,120 нм. sp- Гибридные орбитали двух атомов
углерода в состоянии, предшествующем образованию тройной связи и связей C–H Схематическое изображение строения молекулы ацетилена (ядра атомов углерода и водорода на одной прямой, две p- связи между атомами углерода находятся в двух взаимно перпендикулярных плоскостях)
В 1862 г. немецкий химик Вёлер пытался выделить металлический кальций из извести (карбоната кальция CaСО3) путем длительного прокаливания смеси, состоящей из извести и угля. Он получил спекшуюся массу сероватого цвета, в которой признаков металла не обнаружил. 5С + 2СаСО3 = 3СаС2 + 3СО2↑ ; СаС2 + 2Н2О = Н2С2↑ + Са(ОН)2.(1) 3. Физические свойства
С2Н2 – Ацетилен – бесцветный газ, легче воздуха, мало растворим в воде, в чистом виде почти без запаха. Свойства гомологов изменяются аналогично
алкенам. По физическим свойствам алкины напоминают алкены и алканы. Температуры
их плавления и кипения увеличиваются с ростом молекулярной массы. В обычных
условиях алкины С2–С3 – газы, С4–С16 –
жидкости, высшие алкины – твердые вещества. Наличие тройной связи в цепи
приводит к повышению температуры кипения, плотности и растворимости их в воде
по сравнению с олефинами и парафинами. Физические свойства некоторых алкинов сведены в таблице. Таблица. Физические свойства некоторых алкинов
4.
Структурная изомерия
1. Изомерия положения тройной связи (начиная с С4Н6): 2. 2. Изомерия углеродного скелета (начиная с С5Н8): 3. Межклассовая изомерия с алкадиенами и циклоалкенами, начиная с С4Н6:
Пространственная изомерия относительно тройной связи в алкинах не проявляется, т.к. заместители могут располагаться только одним способом – вдоль линии связи.
5. Химические свойства алкинов
I. Реакции присоединения
1). Галогенирование – стадийно, до производных алканов: (как и алкены обесцвечивают бромную воду!)
СH≡CH + Br2 → CHBr=CHBr (1,2-дибромэтен)
CHBr=CHBr + Br2 → CHBr2-CHBr2 (1,1,2,2-тетрабромэтан) Опыт “Взаимодействие ацетилена с хлором” 2). (труднее, чем у алкенов) – стадийно:
* CH3-C≡CH + HBr AlBr3→ CH3-CBr=CH2 2-бромпропен
* – используется пр. Морковникова
3). Гидратация – ( р. М.Г. Кучерова)
CH≡CH + H2 O Hg2+,H+→ [CH2=CH-OH] → CH3-CH=Oнепредельный уксусный спирт – енол альдегид протекает в присутствии солей ртути(II) – HgSO4, Hg(NO3)2 – с образованием уксусного альдегида: Эта реакция носит имя русского ученого Михаила Григорьевича Кучерова (1881). 4). Полимеризация
В
определенных условиях ацетилен способен полимеризоваться в бензол и
винилацетилен. 1. При пропускании ацетилена над активированным углем при 450–500 °С происходит тримеризация ацетилена с образованием бензола (Н.Д.Зелинский, 1927 г.): 2. Под действием водного раствора CuCl и NH4Cl ацетилен димеризуется, образуя винилацетилен: Винилацетилен обладает большой реакционной способностью; присоединяя хлороводород, он образует хлоропрен, используемый для получения искусственного каучука:
II. Реакции окисления и восстановления
1). Горение – пламя сильно коптящее Опыт “Горение ацетилена” Опыт “Взрыв смеси ацетилена с кислородом” CnH2n-2 + (3n-1)/2O2t → nCO2 + (n-1)H2O + Q
2). Окисление
Протекание реакции и её продукты определяются средой!
А) в кислой среде при нагревании образуются карбоновые кислоты, при концевой кратной связи – CO2:
5CH3 – CH2 – C ≡ C – CH3 + 6KMnO4 + 9H 2SO4 → 5CH3 – CH2COOH + 5CH3COOH + 6MnSO4 + 3K2SO4 + 4H2O
5CH3 – C ≡ CH + 8KMnO4 + 12H2SO4 → 5CO2 + 5CH3COOH + 8MnSO4 + 4K2SO4 + 12H2O
Б) в нейтральной и слабощелочной средах на холоде образуются соли карбоновых кислот; ацетилен окисляется до оксалатов (солей щавелевой кислоты):
3CH ≡ CH + 8KMnO4 → 3KOOC – COOK + 8MnO2 + 2KOH + 2H2O (Качественная реакция – обесцвечивают раствор марганцовки)
CH3 – C ≡ C – CH3 + 2KMnO4 → 2CH3 – COOK + 2MnO2
3CH ≡ C – CH3 + 8KMnO4 → 3CH3 – COOK + 2K2CO3 + KHCO3 + 8MnO2 + H2O
 Восстановление ( kat – Ni,Pd или Pt) Восстановление ( kat – Ni,Pd или Pt)
C2H2 + H2 t,kat→ C2H4
C2H2 + 2H2 t,kat→ C2H6
III. Реакции замещения
1). Кислотные свойства (в отличие от алкенов, образуют соли – ацетилениды)
R-C≡C-H + NaH → R-C≡C-Na + H2↑
Качественные реакции на алкины с тройной связью в конце цепи: Опыт R-C≡CH + [Ag(NH3)2]OH → R-C≡C-Ag↓ +2NH3 + H2O серо-белый осадок Опыт R-C≡C-H + [Cu(NH3)2]Cl → R-C≡C-Cu↓ + NH4Cl +NH3 красный осадок
Ацетилениды серебра и меди (I)- разлагаются соляной кислотой: R-C≡C-Cu↓ +HCl → R-C≡C-H + CuCl
Ацетилениды металлов – взрывчатые вещества! Опыт “Непрочность ацетиленидов металлов” ЦОР: Образование молекулы ацетилена Образование названий алкинов по номенклатуре ИЮПАК Получение ацетилена, его химические свойства ТРЕНАЖЁРЫ: Алкины: строение, номенклатура, получение и физические свойства Алкины: строение, номенклатура, получение и физические свойства (расчетные задачи) Гомологический ряд ацетилена Типы химических реакций, характерные для алкинов Уравнения реакций, характеризующие химические свойства ацетилена Химические свойства алкинов Химические свойства алкинов (расчетные задачи) Источник: http://kursak. |
Реферат.химия.ацитилен
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«Московский авиационный институт
(национальный исследовательский университет)»
Реферат
на тему «Ацетилен»
Выполнил: студент
1МЕТ-1ДБ-033
Мельников Д.В.
Проверил: преподаватель
Белая А.В.
Москва 2015
СОДЕРЖАНИЕ
История открытия.
Название ацетилена по номенклатуре июпак.
Физические характеристики.
Структурная
формула ацетилена.
Характеристика класса органических соединений Ацетилена.
Реакции получения ацетилена.
Характерные химические реакции ацетилена.
Области применения ацетилена.
Воздействие ацетилена на человеческий организм и окружающую среду.
Список использованной литературы.
ИСТОРИЯ ОТКРЫТИЯ
Впервые ацетилен получил в 1836 Эдмунд Дэви, двоюродный брат знаменитого Гемфри Дэви. Он подействовал водой на карбид калия: К2С2 + Н2О=С2Н2 + 2КОН и получил новый газ, который назвал двууглеродистым водородом. Этот газ был, в основном, интересен химикам с точки зрения теории строения органических соединений. Один из создателей так называемой теории радикалов Юстус Либих назвал группу атомов (т.е. радикал) С2Н3 ацетилом.
На
латыни acetum – уксус; молекула уксусной
кислоты (С2Н3О+О+Н, как записывали тогда
ее формулу) рассматривалась как
производное ацетила. Когда французский
химик Марселен Бертло в 1855 сумел получить
«двууглеродистый водород» сразу
несколькими способами, он назвал его
ацетиленом. Бертло считал ацетилен
производным ацетила, от которого отняли
один атом водорода: С2Н3 – Н = С2Н2. Сначала
Бертло получал ацетилен, пропуская пары
этилена, метилового и этилового спирта
через раскаленную докрасна трубку. В
1862 он сумел синтезировать ацетилен из
элементов, пропуская водород через
пламя вольтовой дуги между двумя
угольными электродами. Все упомянутые
методы синтеза имели только теоретическое
значение, и ацетилен был редким и дорогим
газом, пока не был разработан дешевый
способ получения карбида кальция
прокаливанием смеси угля и негашеной
извести: СаО + 3С = СаС2 + СО. Это произошло
в конце XIX века.
Когда французский
химик Марселен Бертло в 1855 сумел получить
«двууглеродистый водород» сразу
несколькими способами, он назвал его
ацетиленом. Бертло считал ацетилен
производным ацетила, от которого отняли
один атом водорода: С2Н3 – Н = С2Н2. Сначала
Бертло получал ацетилен, пропуская пары
этилена, метилового и этилового спирта
через раскаленную докрасна трубку. В
1862 он сумел синтезировать ацетилен из
элементов, пропуская водород через
пламя вольтовой дуги между двумя
угольными электродами. Все упомянутые
методы синтеза имели только теоретическое
значение, и ацетилен был редким и дорогим
газом, пока не был разработан дешевый
способ получения карбида кальция
прокаливанием смеси угля и негашеной
извести: СаО + 3С = СаС2 + СО. Это произошло
в конце XIX века.
Тогда
ацетилен стали использовать для
освещения. В пламени при высокой
температуре этот газ, содержащий 92,3%
углерода (это своеобразный химический
рекорд), разлагается с образованием
твердых частичек углерода, которые
могут иметь в своем составе от нескольких
до миллионов атомов углерода. Сильно
накаливаясь во внутреннем конусе
пламени, эти частички обуславливают
яркое свечение пламени – от желтого до
белого, в зависимости от температуры
(чем горячее пламя, тем ближе его цвет
к белому).
Сильно
накаливаясь во внутреннем конусе
пламени, эти частички обуславливают
яркое свечение пламени – от желтого до
белого, в зависимости от температуры
(чем горячее пламя, тем ближе его цвет
к белому).
Ацетиленовые горелки давали в 15 раз больше света, чем обычные газовые фонари, которыми освещали улицы. Постепенно они были вытеснены электрическим освещением, но еще долго использовались в небольших фонарях на велосипедах, мотоциклах, в конных экипажах.
В течение длительного времени ацетилен для технических нужд (например, на стройках) получали «гашением» карбида водой. Полученный из технического карбида кальция ацетилен имеет неприятный запах из-за примесей аммиака, сероводорода, фосфина РН3, арсина Ash4.
НАЗВАНИЕ АЦЕТИЛЕНА ПО НОМЕНКЛАТУРЕ ИЮПАК
Согласно
номенклатуре ИЮПАК при построении
названий алкинов в названиях соответствующих
насыщенных углеводородов суффикс -ан
заменяется суффиксом -ин. Для указания
положения тройной связи и замещающих
групп цепь нумеруют также, как в
соответствующих алкенах. Этин также
возможно именовать тривиально – ацетилен.
Для указания
положения тройной связи и замещающих
групп цепь нумеруют также, как в
соответствующих алкенах. Этин также
возможно именовать тривиально – ацетилен.
ФИЗИЧЕСКИЕ ХАРАКТЕРИСТИКИ
При нормальных условиях – бесцветный газ, малорастворим в воде, легче воздуха. Температура кипения −83,8 °C. При сжатии разлагается со взрывом, хранят в баллонах, заполненных кизельгуром или активированным углем, пропитанным ацетоном, в котором ацетилен растворяется под давлением в больших количествах. Взрывоопасный. Нельзя выпускать на открытый воздух. C2h3 обнаружен на Уране и Нептуне.
СТРУКТУРНАЯ ФОРМУЛА АЦЕТИЛЕНА
Рис. 1
ХАРАКТЕРИСТИКА КЛАССА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ АЦЕТИЛЕНА
Ацетилен принадлежит к классу алкинов.
Алки́ны
(иначе ацетиленовые углеводороды) –
углеводороды, содержащие тройную связь
между атомами углерода, образующие
гомологический ряд с общей формулой
Cnh3n-2.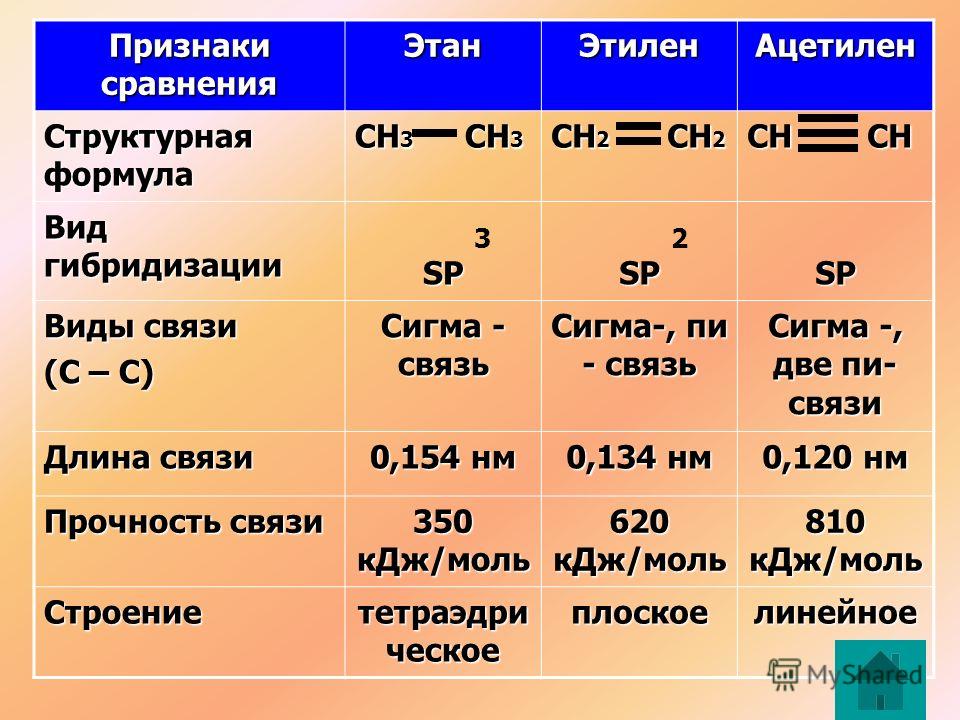 Атомы углерода при тройной связи
находятся в состоянии sp-гибридизации.
Атомы углерода при тройной связи
находятся в состоянии sp-гибридизации.
Для алкинов характерны реакции присоединения. В отличие от алкенов, которым свойственны реакции электрофильного присоединения, алкины могут вступать также и в реакции нуклеофильного присоединения. Это обусловлено значительным s-характером связи и, как следствие, повышенной электроотрицательностью атома углерода. Кроме того, большая подвижность атома водорода при тройной связи обуславливает кислотные свойства алкинов в реакциях замещения.
Алкины по своим физическим свойствам напоминают соответствующие алкены. Низшие (до С4) – газы без цвета и запаха, имеющие более высокие температуры кипения, чем аналоги в алкенах. Алкины плохо растворимы в воде, лучше – в органических растворителях.
ацетилен реакция соединение формула
РЕАКЦИИ ПОЛУЧЕНИЯ АЦЕТИЛЕНА
В лаборатории ацетилен получают действием воды на карбид кальция
CaC2+ 2 Н2О = С2Н2↑ + Са(ОН)2
а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
2СН4 = С2Н2↑ +3Н2↑
ХАРАКТЕРНЫЕ ХИМИЧЕСКИЕ РЕАКЦИИ АЦЕТИЛЕНА
Основные химические реакции ацетилена (реакции присоединения):
Основные
химические реакции ацетилена (реакции
присоединения, димеризации, полимеризации,
цикломеризации).
ОБЛАСТИ ПРИМЕНЕНИЯ АЦЕТИЛЕНА
Ацетилен используют:
– для сварки и резки металлов,
– как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидная лампа),
– в производстве взрывчатых веществ (см. ацетилениды),
– для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов,
– для получения технического углерода,
– в атомно-абсорбционной спектрофотометрии при пламенной атомизации,
– в ракетных двигателях (вместе с аммиаком).
ВОЗДЕЙСТВИЕ АЦИТЕЛЕНА НА ЧЕЛОВЕЧЕСКИЙ ОРГАНИЗМ И ОКРУЖАЮЩУЮ СРЕДУ
Поскольку
ацетилен растворим в воде, и его смеси
с кислородом могут взрываться в очень
широком диапазоне концентраций, его
нельзя собирать в газометры.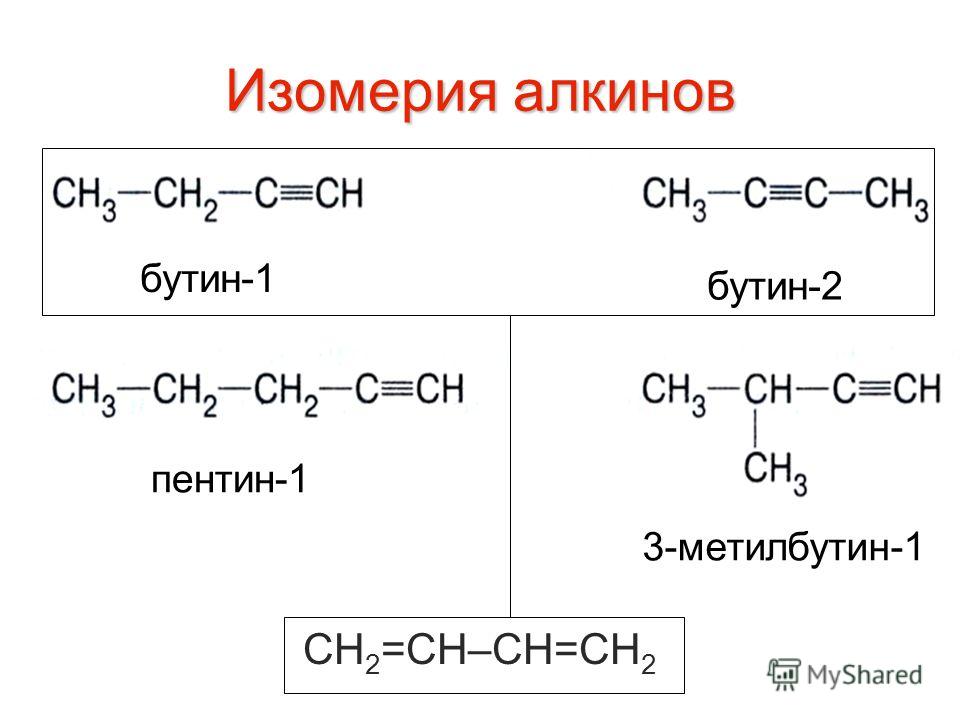
Ацетилен взрывается при температуре около 500 °C или давлении выше 0,2 МПа; КПВ 2,3-80,7 %, температура самовоспламенения 335 °C. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном. При длительном соприкосновении ацетилена с медью и серебром образуются ацетилениды меди и серебра, которые взрываются при ударе или повышении температуры. Поэтому при хранении ацетилена не используются материалы, содержащие медь (например, вентили баллонов).
Ацетилен обладает слабым токсическим действием. Для ацетилена нормирован ПДКм.р. = ПДК с.с. = 1,5 мг/м3 согласно гигиеническим нормативам ГН 2.1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест».
ПДКр.з. (рабочей зоны) не установлен (по ГОСТ 5457-75 и ГН 2.2.5.1314-03), так как концентрационные пределы распределения пламени в смеси с воздухом составляет 2,5-100 %.
Хранят
и перевозят его в заполненных инертной
пористой массой (например, древесным
углем) стальных баллонах белого цвета
(с красной надписью «А») в виде раствора
в ацетоне под давлением 1,5-2,5 МПа.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
Ньюленд Ю., Фогт Р., Химия ацетилена, Иниздат, 1947.
Федоренко Н.П., Методы и экономика получения ацетилена, Химическая наука и промышленность, 3, т. 1, 1956.
Федоренко Н.П. Химия и химическая технология, № 3, т. I, 1956.
Размещено на Allbest.ru
Ацетилен – определение, формула, структура, производство и свойства
Что такое ацетилен?
Ацетилен – Определение: Ацетилен – это углеводород, состоящий из двух атомов углерода и двух атомов водорода. Это бесцветный газ, который легко воспламеняется. Ацетилен используется в различных отраслях промышленности, включая сварку и резку металлов. Он также используется в качестве топлива для автомобилей.
Зарегистрируйтесь, чтобы получить бесплатные пробные тесты и учебные материалы
+91
Подтвердить OTP-код (обязательно)
Я согласен с условиями и политикой конфиденциальности.
Основные области применения меди
Медь — универсальный металл с широким спектром применения. Некоторые из наиболее распространенных основных применений меди включают:
• Электропроводка и компоненты: Медь является отличным проводником электричества, что делает ее идеальной для электропроводки и других электрических компонентов.
• Кровля и гидроизоляция: Медь часто используется для кровли и гидроизоляции из-за ее устойчивости к атмосферным воздействиям и долговечности.
• Оборудование для кухни и ванной комнаты: Медь часто используется для изготовления оборудования для кухни и ванной комнаты из-за ее коррозионной стойкости и привлекательного внешнего вида.
• Трубопроводы: Медные трубы часто используются для систем водоснабжения и канализации из-за их коррозионной стойкости и долговечности.
• Монеты: Медь часто используется для изготовления монет из-за ее коррозионной стойкости и привлекательного цвета.
Подробнее об ацетоне
Ацетон — бесцветная, летучая и легковоспламеняющаяся жидкость, используемая в качестве растворителя.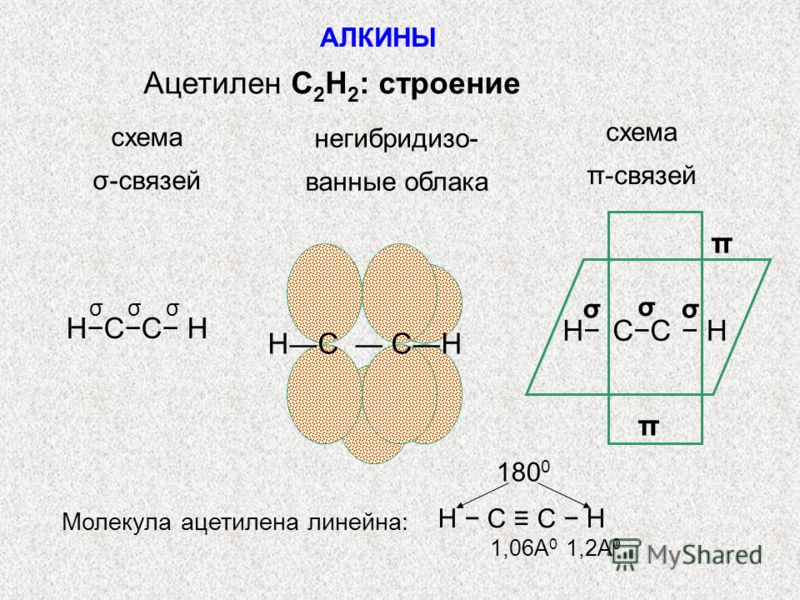 Он также входит в состав многих средств для снятия лака. Ацетон — это кетоновое тело, а это означает, что он вырабатывается, когда организм расщепляет жирные кислоты. Он вырабатывается в печени и используется в качестве источника энергии. Ацетон также является основным компонентом кетоновых тел, которые используются организмом для производства энергии в периоды поста или голодания.
Он также входит в состав многих средств для снятия лака. Ацетон — это кетоновое тело, а это означает, что он вырабатывается, когда организм расщепляет жирные кислоты. Он вырабатывается в печени и используется в качестве источника энергии. Ацетон также является основным компонентом кетоновых тел, которые используются организмом для производства энергии в периоды поста или голодания.
Формула и структура ацетилена
Химическая формула ацетилена C2h3. Это бесцветный легковоспламеняющийся газ с резким запахом. Ацетилен состоит из двух атомов углерода и двух атомов водорода.
Наличие ацетилена
Ацетилен содержится в сварочных горелках и другом сварочном оборудовании.
Производство ацетилена
Производство ацетилена начинается с реакции карбида кальция с водой. В результате этой реакции образуется газообразный ацетилен и гидроксид кальция:
- 2 CaC2(s) + 2 h3O(l) → Ca(OH)2(aq) + C2h3(g)
- Газообразный ацетилен затем очищают, пропуская его через слой активированного угля.
 Это удаляет водяной пар и другие примеси из газа.
Это удаляет водяной пар и другие примеси из газа.
Свойства ацетилена
- Молекула ацетилена состоит из двух атомов углерода и двух атомов водорода. Это бесцветный легковоспламеняющийся газ с характерным эфирным запахом. Ацетилен — простейшее алкиновое соединение и первый член семейства алкинов.
- Молекула ацетилена очень реакционноспособна и используется в качестве исходного материала для синтеза многих других органических соединений. Он также используется в качестве горючего газа, а также при сварке и резке металлов.
Использование ацетилена
Ацетилен используется для сварки и резки металлов.
Применение ацетилена
- Ацетилен используется во многих отраслях промышленности, но чаще всего используется в сварке.
- Ацетилен также используется в производстве металлов, пиротехнике и фармацевтике.
Сопутствующее содержание
Формула ацетилена – структура, свойства, использование, примерные вопросы
Этин является простейшим алкином, так как он состоит всего из двух атомов углерода, которые тройно связаны друг с другом.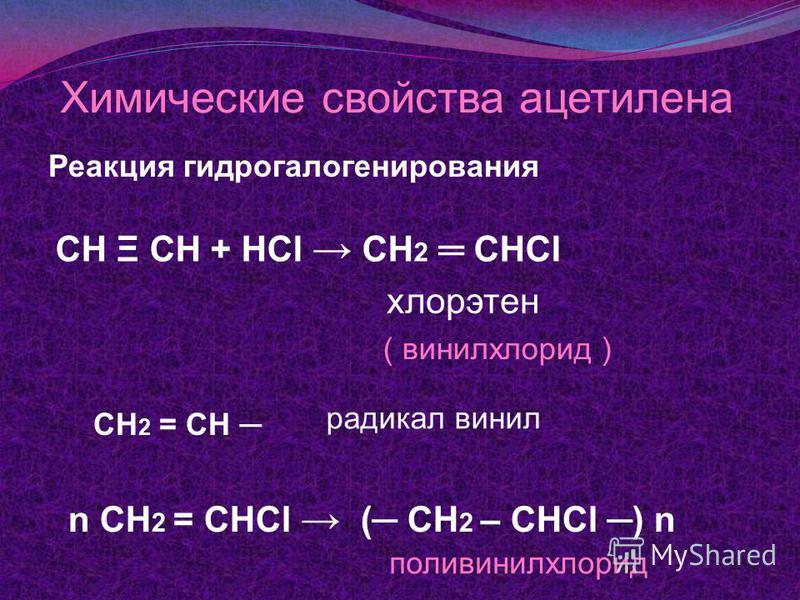 Известно, что один из чистых этинов очень нестабилен. Поскольку он содержит тройную углерод-углеродную связь, ацетилен или этин является ненасыщенным углеводородом. Он широко используется в качестве топлива и химикатов в строительном блоке. В чистом виде он нестабилен, поэтому с ним обычно обращаются в виде раствора, а из-за примесей технический ацетилен имеет резкий запах.
Известно, что один из чистых этинов очень нестабилен. Поскольку он содержит тройную углерод-углеродную связь, ацетилен или этин является ненасыщенным углеводородом. Он широко используется в качестве топлива и химикатов в строительном блоке. В чистом виде он нестабилен, поэтому с ним обычно обращаются в виде раствора, а из-за примесей технический ацетилен имеет резкий запах.
Открытие Эдмунда Дэви является первым, кто идентифицировал его в 1836 году как «новый карбюратор водорода». Позже, в 1860 году, французский художник Марселин Бертело заново открыл его и ввел название ацетилен.
Формула ацетилена
Этин представляет собой органическое химическое соединение алкильной группы с химической формулой C 2 H 2 , также известное как ацетилен. Это соединение является углеводородом, так как весь его химический состав состоит только из атомов водорода и углерода.
Структура ацетилена
Получение ацетилена
Его можно получить путем частичного сжигания метана. Это соединение Этин также может быть получен гидролизом карбида кальция (химическое соединение с формулой CaC 2 , также известное как ацетилид кальция). Химическое уравнение этой реакции между карбидом кальция и водой:
Это соединение Этин также может быть получен гидролизом карбида кальция (химическое соединение с формулой CaC 2 , также известное как ацетилид кальция). Химическое уравнение этой реакции между карбидом кальция и водой:
H 2 O + CaC 2 → C 2 H 2 + Ca(OH) 2
Таким образом, гидролиз этой реакции карбида кальция дает гидроксид кальция и этин в качестве конечных продуктов.
Ацетилен — бесцветный газ со слабым запахом эфира. Он легко растворим в воде, хлороформе, ацетоне и бензоле, мало растворим в сероуглероде и этаноле. по сравнению с воздухом он легче и легко воспламеняется. Это простейшее алкиновое химическое соединение C 9.0086 2 H 2 с химическим названием, также называемым этин, нарсилен или винилен.
Physical properties of Acetylene
| Acetylene | Value |
| Molecular weight of C 2 H 2 | 26.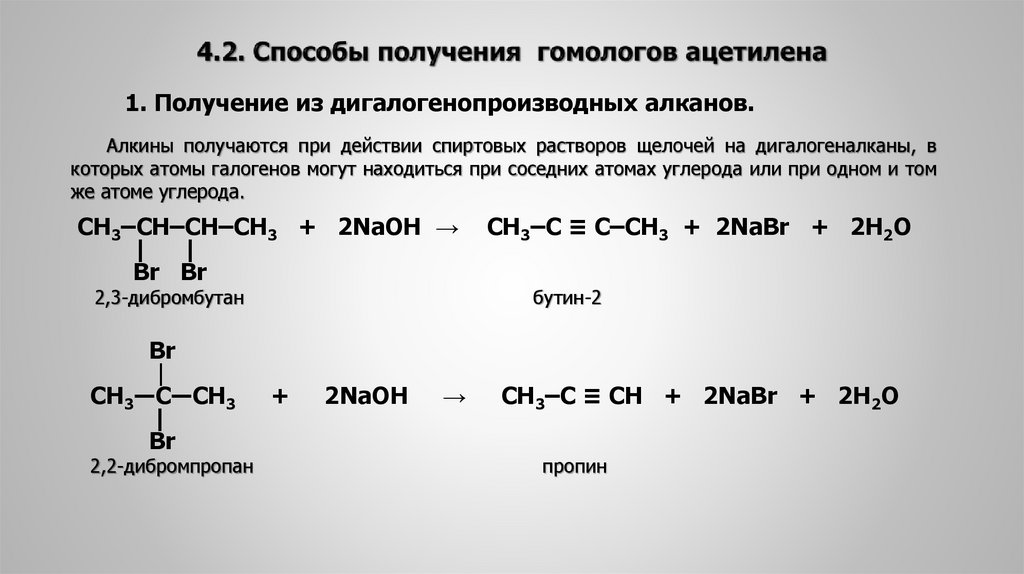 038 g/mol 038 g/mol |
| Density of Acetylene | 1,097 кг/м3 |
| Температура кипения ацетилена | -84,7°C |
| Переплавную точку ацетилена | −80,8 ° C |
Химические свойства ацетилена
40004 Акционированное-это ацетированное, потому что он-ацетированный, потому что он является ацетированным, потому что он является ацетированным, потому что он является ацетированным, потому что он-элеочный, потому что он-элеочный, потому что он-элеорист, потому что он-элеочный, потому что он-элеорист, потому что он-элеочный, потому что он-элеорист, потому что он-элеорист, потому что он является ацетилевым. , с широким спектром реакций для получения коммерческих продуктов, таких как ацетилид, акриловая кислота, виниловое соединение и спирт. АЦЕТИЛЕН можно использовать для получения металлоорганических соединений при взаимодействии с такими металлами, как медь.Использование ацетилена
- Ацетилен широко используется в сварочных процессах из-за высокой температуры ацетиленового пламени (3300°C) в промышленности.
 Некоторые менее развитые страны используют это пламя в качестве ламп накаливания.
Некоторые менее развитые страны используют это пламя в качестве ламп накаливания. - Ацетилен является очень реакционноспособным соединением и использовался в качестве основного компонента топлива в течение очень долгого времени. Сообщается также, что он используется во взрывчатых веществах.
- Ацетилен используется в портативном освещении, а также в производстве пластмасс и производных акриловой кислоты.
- Используется в процессе радиоуглеродного датирования.
- Ацетилен считается первым природным полупроводником и используется в производстве полиацетилена.
- Ацетилен используется при пайке.
- Ацетилен Используется в стекольной промышленности, а также в производстве синтетического каучука.
- Ацетилен используется при пайке металлов, а также в качестве добавки для сохранения пищевых продуктов.
Примеры вопросов
Вопрос 1: Каковы побочные эффекты ацетилена на здоровье?
Ответ:
Контакт с ацетиленом может привести к головной боли, потере сознания и головокружению.
Если в воздухе присутствует более высокий процент этина, это может привести к смерти от удушья.
Вопрос 2: Почему этин называют ацетиленом?
Ответ:
Эдмунд Дэви первым определил его в 1836 году как «новый карбюратор водорода». Позднее, в 1860 году, французский художник Марселлен Бертело заново открыл его и ввел название ацетилен.
Вопрос 3: Какова температура кипения и плавления ацетилена?
Ответ:
- Температура кипения ацетилена составляет -84,7°C.
- Температура плавления ацетилена составляет -80,8 °C.
Вопрос 4. Является ли ацетилен насыщенной кислотой?
Ответ:
Считается ненасыщенным органическим соединением из-за наличия тройной связи между двумя атомами углерода.
Вопрос 5: Как ацетилен реагирует на металл?
Ответ:
Так как ацетилен в чистом виде бесцветен, а также имеет приятный запах.





 Изомерия и номенклатура
Изомерия и номенклатура Гидрогалогенирование
Гидрогалогенирование
 net/interesnye-fakty-v-ximii-i-ne-tolko-sluchajnye-otkrytiya/
net/interesnye-fakty-v-ximii-i-ne-tolko-sluchajnye-otkrytiya/ Это удаляет водяной пар и другие примеси из газа.
Это удаляет водяной пар и другие примеси из газа. Некоторые менее развитые страны используют это пламя в качестве ламп накаливания.
Некоторые менее развитые страны используют это пламя в качестве ламп накаливания. Если в воздухе присутствует более высокий процент этина, это может привести к смерти от удушья.
Если в воздухе присутствует более высокий процент этина, это может привести к смерти от удушья.