Формула карбида кальция: Карбид кальция
alexxlab | 20.07.2023 | 0 | Разное
Карбид кальция
Карбид кальция (углеродистый кальций, ацетиленид кальция) — CaC2 — в чистом виде белое кристаллическое вещество. Бинарное неорганическое соединение кальция с углеродом.
Содержание
- 1 История получения
- 2 Получение
- 3 Физические свойства
- 4 Химические свойства
- 5 Внешний вид и характеристики технического карбида кальция
- 6 Область применения карбида кальция
- 7 Физиологическое действие
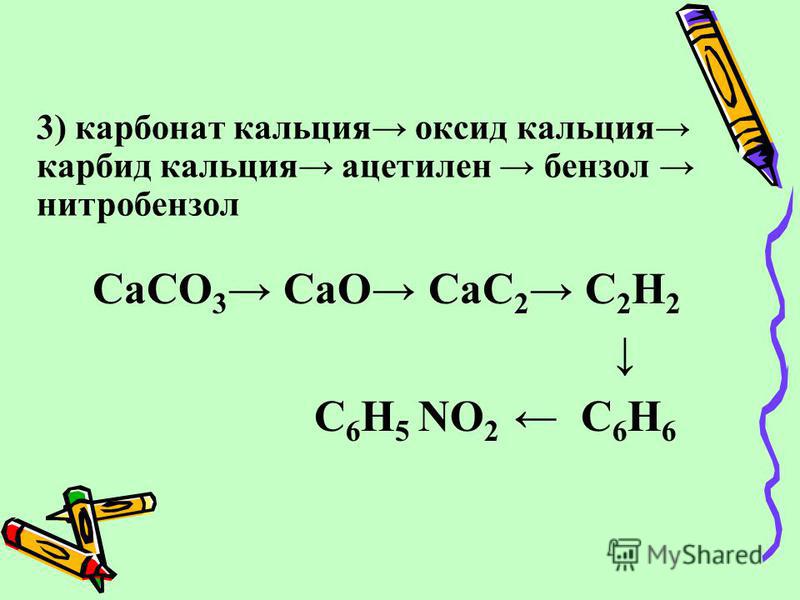
История получения
Впервые получен в 1861 году Фридрихом Вёлером нагреванием сплава цинка и кальция с углём.
Получение
В настоящее время получают прокаливанием в электрических печах (температура 1900—1950 °C) смеси оксида кальция с коксом.
- CaO + 3C → CaC2 + CO
Полученный таким образом технический продукт имеет чисто-черный цвет вследствие загрязнения углём и другими красящими примесями. Он содержит также примеси фосфида и сульфида кальция, вследствие чего такой карбид кальция и полученный из него ацетилен имеют неприятный запах.
Он содержит также примеси фосфида и сульфида кальция, вследствие чего такой карбид кальция и полученный из него ацетилен имеют неприятный запах.
Физические свойства
- Бесцветные тетрагональные кристаллы.
- Плотность: 228 (+20 °C, г/см3).
- Удельная теплоёмкость при постоянном давлении (в Дж/г·K): 0,92 (+20—325 °C).
- Стандартная энтальпия образования ΔfH (298 К, кДж/моль): −62,8 (т).
- Стандартная энергия Гиббса образования ΔfG (298 К, кДж/моль): −67,8 (т).
- Стандартная энтропия образования S (298 К, Дж/моль·K): 70,3 (т).
- Стандартная мольная теплоёмкость Cp (298 К, Дж/моль·K): 62,34 (т).
- Энтальпия плавления ΔHпл (кДж/моль): 32,2.
- Карбид кальция имеет резкий чесночный запах.
Химические свойства
При взаимодействии c водой карбид кальция гидролизуется с образованием ацетилена и гидроксида кальция (гашёной извести):
- CaC2 + 2H2O → Ca(OH)2 + C2H2↑
Представленная выше реакция является экзотермической.
Внешний вид и характеристики технического карбида кальция
Карбид кальция получают сплавлением в электрических печах кокса и негашеной извести. Расплавленный карбид кальция выпускается из печи в специальные формы — изложницы, в которых он затвердевает. Застывший карбид кальция дробится и сортируется на куски определённых размеров.
Технический карбид кальция представляет собой твёрдое кристаллическое вещество. По внешнему виду карбид кальция представляет собой твёрдое вещество тёмно-серого или коричневого цвета. Он даёт кристаллический излом серого цвета с различными оттенками в зависимости от чистоты. Карбид кальция жадно поглощает воду. При взаимодействии с водой даже на холоде карбид кальция разлагается с бурным выделением ацетилена и большого количества тепла. Разложение карбида кальция происходит и под влиянием атмосферной влаги.
По ГОСТ 1460-56 установлены следующие размеры (грануляция) кусков карбида кальция: 2×8; 8×15; 15×25; 25×80. Технический карбид кальция содержит до 80 % химически чистого карбида кальция, остальное составляют примеси — негашеная известь, углерод, кремнекислота и другое.
Область применения карбида кальция
Карбид кальция используют при проведении автогенных работ и освещения, а также в производстве ацетиленовой сажи и продуктов органического синтеза, из которых главным является синтетический каучук.
Карбид кальция применяют в производстве цианамида кальция, из которого получают удобрения, цианистые соединения. Карбид кальция используют для получения карбидно-карбамидного регулятора роста растений, изготовления порошкового карбидного реагента.
Из 1 кг технического карбида получается от 235 до 285 л ацетилена в зависимости от его сорта и грануляции: чем чище и крупнее карбид кальция, тем большее количество ацетилена он даёт при разложении.
Для разложения 1 кг карбида кальция теоретически требуется 0,56 л воды. Практически берут от 5 до 20 л воды с целью лучшего охлаждения ацетилена и обеспечения безопасности при работе. Скорость разложения карбида кальция водой зависит от его чистоты, грануляции, температуры и чистоты воды. Чем чище карбид кальция, меньше размер его кусков, выше температура и чище вода, тем больше скорость.
Чем чище карбид кальция, меньше размер его кусков, выше температура и чище вода, тем больше скорость.
Физиологическое действие
- Среди всех неорганических производных кальция CaC2 очень ядовит.
- По степени воздействия на организм человека карбид кальция относится к 1-му классу опасности согласно ГОСТ 12.1.007.
- Попадание карбида кальция внутрь организма также является опасным.
- Пыль карбида кальция оказывает раздражающее действие на кожу, слизистые оболочки органов дыхания.
- Карбид кальция CaC2 чрезвычайно опасен для окружающей среды.
|
| |||||||||||||||||||||||||||||||||||||||||||||||
Карбид кальция – структура, производство, применение и часто задаваемые вопросы
Дата последнего обновления: 15 апреля 2023 г. илид, который представляет собой химическое соединение, имеющее химическую формулу CaC2.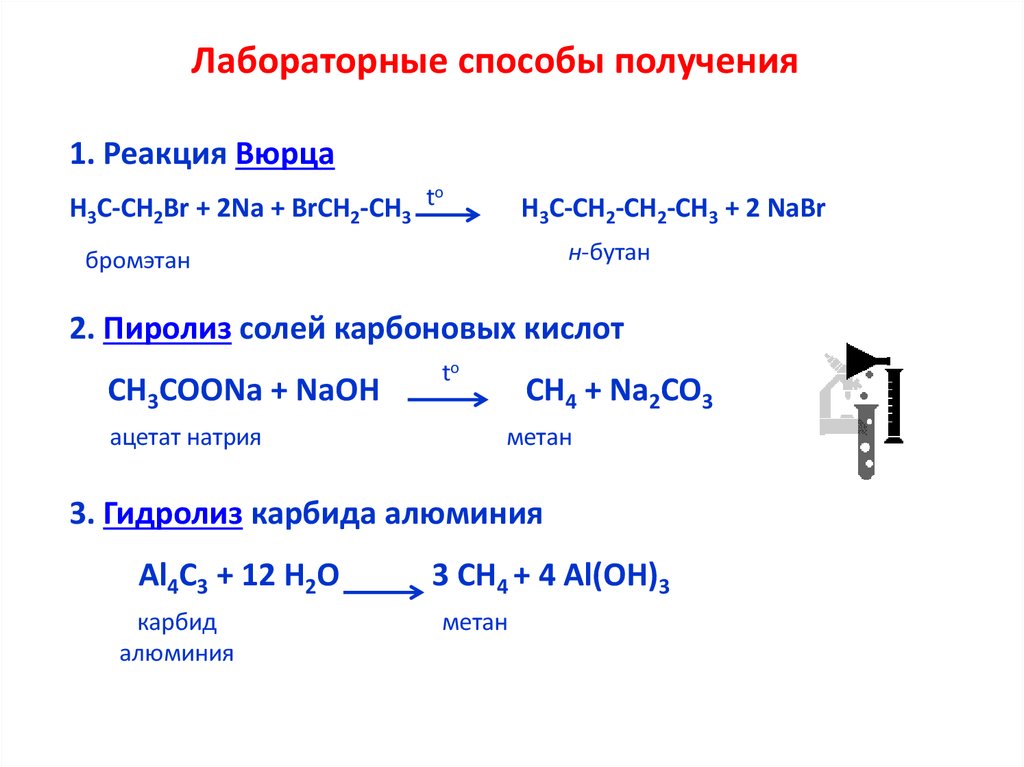 В основном он используется в промышленности для производства цианамида кальция и ацетилена.
В основном он используется в промышленности для производства цианамида кальция и ацетилена.
Это чистый материал бесцветного, а, однако, куски технического карбида кальция имеют либо коричневый, либо серый цвет и состоят примерно на 80–85 % из СаС2 (остальное — СаО — оксид кальция), Са3Р2 ( фосфид кальция), Ca3N2 (нитрид кальция), CaS (сульфид кальция), SiC (карбид кремния) и др.). При наличии следов влаги карбид кальция технический издает неприятный запах, напоминающий запах чеснока.
Примечание. Применение карбида кальция включает производство газообразного ацетилена и производство ацетилена в карбидных лампах; производство химикатов для удобрений; а также в сталелитейном производстве.
Структура CaC2
Рассмотрим структуру карбида кальция.
(изображение скоро будет загружено)
Производство карбида кальция
Карбид кальция промышленно производится в электродуговой печи со смесью кокса и извести, примерно при 2200 °C (3,990°F). Это эндотермическая реакция, которая требует высокой температуры для удаления монооксида углерода при 110 килокалориях (460 кДж) на моль. С момента своего изобретения в 1892 году этот метод не изменился.
Это эндотермическая реакция, которая требует высокой температуры для удаления монооксида углерода при 110 килокалориях (460 кДж) на моль. С момента своего изобретения в 1892 году этот метод не изменился.
CaO + 3C → CaC2 + CO
Высокая температура, необходимая для этой реакции, практически недостижима при традиционном сжигании. Итак, эту реакцию проводят в электродуговой печи с использованием графитовых электродов. Полученный карбидный продукт по весу будет содержать около 80% карбида кальция. Кроме того, карбид подвергается дальнейшему дроблению с образованием небольших кусков, размер которых может достигать 50 мм, а примеси концентрируются в более мелких фракциях.
Содержание CaC2 в этом продукте определяют путем измерения количества образовавшегося ацетилена при гидролизе. Например, немецкие и британские стандарты содержания более крупных фракций составляют 295 л/кг и 300 л/кг соответственно (при давлении 101 кПа и температуре 20 °C (68 °F)). Примеси карбида включают фосфид, который при гидролизе дает фосфин.
Примеси карбида включают фосфид, который при гидролизе дает фосфин.
В химии эта реакция не была важной частью промышленной революции и стала возможной в Соединенных Штатах в результате чрезмерного количества недорогой гидроэлектроэнергии, которая производилась на Ниагарском водопаде до конца 20-го века.
Производство цианамида кальция
Соединение карбида кальция реагирует с азотом при более высоких температурах с образованием цианамида кальция. Это представлено с помощью приведенного ниже уравнения.
CaC2 + N2 → CaCN2 + C
Обычно в качестве удобрения можно использовать термин нитролим, представляющий собой цианамид кальция. Он также гидролизуется до цианамида, h3NCN.
Сталеплавильное производство
Рассмотрим использование цианамида кальция в сталеплавильном производстве, как указано ниже:
Карбид кальция можно использовать при десульфурации железа (чугун, чугун и сталь).

Возможно использование в качестве мощного раскислителя на объектах внепечной обработки.
Его можно использовать в качестве топлива в сталеплавильном производстве, чтобы увеличить долю брака до жидкого чугуна, в зависимости от экономики.
Карбидные лампы
Карбид кальция можно использовать в карбидных лампах. Капание воды на карбид приводит к образованию газообразного ацетилена, который, в свою очередь, горит и излучает свет. Хотя эти лампы давали более устойчивый и яркий свет, чем свечи, они были настолько опасны в угольных шахтах, что горючий газ метан делал их серьезной опасностью.
Присутствие этих горючих газов в угольных шахтах привело к появлению шахтерских ламп безопасности, таких как лампа Дэви, где проволочная сетка снижает риск воспламенения метана. Тем не менее карбидные лампы широко использовались в медных, оловянных и сланцевых рудниках, где метан не считался серьезной опасностью. Большинство ламп горняков теперь заменены электрическими лампами.
Большинство ламп горняков теперь заменены электрическими лампами.
Но, тем не менее, карбидные лампы используются для добычи полезных ископаемых в нескольких менее богатых странах. Примером могут служить серебряные рудники недалеко от Потоси в Боливии. В настоящее время они также используются несколькими спелеологами, исследующими пещеры и другие подземные области, хотя в этом использовании их все чаще заменяют светодиодными лампами.
Использование карбида кальция (CaC2)
Карбид кальция используется в производстве поливинилхлорида в виде ацетилена, который является производным карбида кальция и используется в качестве сырья для производства ПВХ.
Карбид кальция также используется в производстве ацетилена и гидроксида кальция.
Может использоваться для удаления серы из железа.
 Удаление серы из любого материала называется десульфурацией.
Удаление серы из любого материала называется десульфурацией.Мы можем использовать его для производства цианамида кальция.
Это соединение также можно использовать в качестве агента созревания, такого как этилен.
Может использоваться в лампах, таких как карбидные лампы. Раньше его использовали в качестве автомобильных фар.
Он также используется в качестве раскислителя, что означает, что он помогает удалять кислород при производстве стали.
Он также используется в бамбуковых пушках и пушках большого взрыва.
Карбид кальция – определение, структура, формула, использование с часто задаваемыми вопросами
Здесь, в этой статье, мы обсудим карбиды, использование карбида, формулу карбида, что такое карбид кальция, использование карбида кальция, структуру кальция карбид, реакция карбида кальция и воды, химическая формула карбида кальция и карбида алюминия и некоторые часто задаваемые вопросы, связанные с карбидами, будут обсуждаться здесь.
Карбид кальция Структура показана ниже.
Формула карбида кальция
Формула карбида кальция CaC 2 .
Читайте также –
- Решения NCERT для 11 класса по химии
- NCERT Решения для 12 класса по химии
- NCERT Решения для всех предметов
Что такое carb?
Карбид — один из наиболее важных терминов, который используется как в органической, так и в неорганической химии. Это химическое соединение, состоящее из углерода и металлических или полуметаллических элементов. Это ионная или ковалентная связь, которая соединяет карбидную группу с металлическими или полуметаллическими элементами.
Формула карбид-иона (C 4-), а дикарбид-иона (C -2 2 ). Он существует в ионной форме и означает, что ионы дикарбида состоят из двух атомов «С». Формула дикарбида (C -2 2 ) показывает, что он существует в дианионной форме. Среди различных карбидов значительную роль играют карбиды кремния, карбиды вольфрама из-за их физических свойств, таких как прочность, твердость и способность противостоять химическим воздействиям при высоких температурах.
Формула дикарбида (C -2 2 ) показывает, что он существует в дианионной форме. Среди различных карбидов значительную роль играют карбиды кремния, карбиды вольфрама из-за их физических свойств, таких как прочность, твердость и способность противостоять химическим воздействиям при высоких температурах.
Карбид алюминия (Al 4 C 3 ), карбид бериллия (Be 2 C), карбид кальция (CaC 2 ) и т. д. являются некоторыми примерами карбида. Карбид железа или также называемый (цементит) является важным компонентом стали и чугуна.
Общие свойства карбидов
Карбиды обычно обладают очень высокой температурой плавления.
Карбиды проводят тепло и электричество.
Карбиды представляют собой соединения с металлическим блеском.
Карбиды щелочных металлов обычно мягкие и прозрачные в чистом состоянии.
 Они легко разлагаются водой или кислотами с образованием алифатических углеводородов. Они не будут проводить электрический ток в твердом состоянии.
Они легко разлагаются водой или кислотами с образованием алифатических углеводородов. Они не будут проводить электрический ток в твердом состоянии.Все карбиды металлов чеканки оказались окрашенными и взрывоопасными порошками. Примеры: Cu 2 C 2 (темно-коричневый), Ag 2 C 2 (белый), Au 2 C 2 (желтый).
Карбиды щелочноземельных металлов разлагаются разбавленными кислотами или водой с образованием газообразного ацетилена и реагируют с N 2 .
Оксид магния восстанавливается такими карбидами до магния. Они также реагируют с NH 3 и Br 2 .
Получение карбидов
Различные типы карбида
В зависимости от связи между ионом карбида и металлическим элементом обычно выделяют следующие типы.
Ионные карбиды- Сочетание щелочных или щелочноземельных металлов с ионами карбидов приводит к образованию ионных карбидов. Сила электростатического притяжения связывает эти ионы. В этом типе карбидов существует огромная разница в электроотрицательности. CaC 2 является примером.
Ковалентные карбиды- Низкоэлектроположительные элементы, такие как «Si» и «B», объединяются с ионами карбида с образованием ковалентных карбидов. В карбидах этого типа существует небольшая разница в электроотрицательности. «SiC» (карборунд), B 4 C являются примерами.
Карбиды внедрения- Комбинация переходных металлов и молекул карбида образует карбиды внедрения. В этом типе карбида ионы карбида занимают междоузлия металлической решетки. ТиК тому пример.
Промежуточный карбид переходного металла – Эти типы карбидов также состоят из переходного металла и карбид-иона, и их размеры одинаковы.
 Карбид железа или известный как цементит (Fe 3 C) является примером.
Карбид железа или известный как цементит (Fe 3 C) является примером.
Использование карбидов
Большинство карбидов очень твердые. Поэтому они используются в качестве абразивных инструментов, сверлильных и режущих инструментов.
Используются в качестве восстановителей в металлургии.
Al 4 C 3 используется для синтеза метана, тогда как CaC 2 используется для производства ацетилена.
Твердые сплавы также используются в качестве футеровки печей.
Карбид бора обычно используется для резки алмазов, изготовления ламп накаливания, а также для сверления отверстий в скалах.
Карбид вольфрама в настоящее время используется в ювелирном деле, а также в производстве различных хирургических инструментов.

Что такое карбид кальция?
Важное химическое соединение с формулой CaC 2 известно как карбид кальция или ацетилид кальция. Одним из его промышленных применений является то, что он используется для синтеза ацетилена и цианамида кальция.
В чистом виде оказывается бесцветным, но в любом случае куски технического сорта CaC 2 имеют серый или коричневый цвет и содержат CaC 2 . Остальная часть состоит из CaO, Ca 3 P 2 , CaS, Ca 3 N 2 , SiC и т. д.
CaC 2 в основном используется в производят ацетилен в карбидных лампах. Он также используется для синтеза различных химикатов и удобрений, а также участвует в производстве стали.
Приготовление
Карбид кальция синтезируют в промышленных масштабах с использованием электродуговой печи путем смешивания смеси кокса и извести при температуре . Это эндотермическая реакция, требующая 110 килокалорий на моль и очень высокой температуры для удаления CO.
Это эндотермическая реакция, требующая 110 килокалорий на моль и очень высокой температуры для удаления CO.
Высокотемпературные условия, необходимые для производства CaC 2 , не могут быть достигнуты путем традиционного сжигания. Следовательно, эту реакцию следует проводить в электрической печи с использованием графитовых электродов.
Также учащиеся могут обратиться,
- Решения NCERT для класса 12 по химии Глава 10 Элементы S-блока
- NCERT Примеры решений для класса 12 по химии Глава 10 Элементы S-блока
- Глава 1 NCERTm0 примечания Элементы S-Block
Применение карбида кальция
- Производство ацетилена: CaC 2 реагирует с водой с образованием ацетилена и гидроксида кальция.
Производство стали: CaC 2 используется для десульфурации железа, а также в качестве топлива в сталеплавильном производстве для увеличения доли брака в жидком чугуне.




 Его также используют для получения карбидно-карбамидного регулятора роста растений, изготовления порошкового карбидного реагента.
Его также используют для получения карбидно-карбамидного регулятора роста растений, изготовления порошкового карбидного реагента. Массовая доля ферросплава, %, не более
Массовая доля ферросплава, %, не более