Формула углекислого газа и воды: Углекислый газ (диоксид углерода) – Что такое Углекислый газ (диоксид углерода)?
alexxlab | 06.11.1986 | 0 | Разное
Растворимость газов в воде ⇆ Растворенные газы в воде
Главная » Растворимость газов в воде
Растворимость газов в воде. Растворенные газы в воде и их коэффициенты растворимости.
Нам известно, что многие газы могут растворяться в воде. К примеру, рыбы, как и множество других водных обитателей, дышат растворенным в воде кислородом. Морские водоросли особенно активно разрастаются в прибрежных зонах, насыщенных растворенным в воде углекислым газом, который необходим для протекания фотосинтеза. Взгляните на газы, растворимые в воде. В таблице приведен коэффициент рсрастворимости Растворенный в воде газ присутствует в жизни практически какждого из нас, ведь сложно найти человека, который откажется от охлажденного газированного напитка, в котором любезно растворили CO2. Подобных глобальных примеров растворения газа в воде очень много, как и газов, которые немедленно начнут растворятся в воде при контакте с ней.
Таблица №1 «Коэффициенты растворимости газов в воде»
В данной таблице приводятся коэффициенты растворимости (в литрах газа на литр воды) Числовое значение коэффициента выражает степень растворимости определенного газа в воде при давлении 1 бар (0,1 МПа)и температуре 20 °C. и является основным критерием оценки растворимости. и является основным критерием оценки растворимости.
|
Растворимость – это такой баланс, при котором количество растворенного газа пропорционально парциальному давлению в газообразной фазе над поверхностью воды. Если нам известно атмосферное давление и соответствующая концентрация газа, то можно вычислить максимальную концентрацию растворенного в воде газа, умножив значение парциального давления газа на расчетный коэффициент растворимости из таблици №1.
Пример №1 «Колличественная оценка содержания кислорода и азота, растворенных в воде»:
Классический пример, когда атмосферный воздух вступает с водой в реакцию, сопровождающуюся растворением основных его компоенетов.
1. Подсчитываем кислород O2: концентрация 20.9 объемн. % кислорода с атмосферным давлением 1000 мбар (750 мм. ртутного столба) создают парциальное давление 0. 209 бар (0.0209 МПа), таким образом, получаем числовое значение:
209 бар (0.0209 МПа), таким образом, получаем числовое значение:
0.031 x 0.209 = 0.00648 литра или 6.5 мл кислорода O2 растворены в 1 литре воды.
2. Подсчитываем азот N2: при создаваемом парциальном давление 0.791 бар N2) азот растворяется хуже кислорода, выражение:
0.016 x 0.791 = 0.01266 л или 12.7 мл. азота N2 содеожится в 1 л. воды.
Мы только что получили данные по составу и насущению кислродом большиснва пресных водемво и рек россиии.
Пример №2 «Расчет содержания растворенного углекислого газа в газированной воде»:
Газировка производится посредством растворения в воде CO2 под давлением около 2 бара (0,2 МПа). Этих данных достаточно, что бы вычислить содержание CO2 в заданной жидкости, принятой за минеральную воду.
Этих данных достаточно, что бы вычислить содержание CO2 в заданной жидкости, принятой за минеральную воду.
0.879 x 2 = 1.75 л CO2 растворенны в 1 литре газированной воды.
Как вы могли заметить, из таблицы и примеров, некоторые газы растворяются в воде очень быстро и эффективно. Именно поэтому в качестве мер безопасности широко распространено использование водяных распылителей, создание “водяных завес”, например, для снижения угрозы здоровью при выбросах значительных объемов аммиака, HCl и других токсичных газов.
Помните, что растворимость во многом зависит от температуры. Чем выше температура воды, тем меньше газа можно в ней растворить. По этой причине для растворения загрязняющих газов в воздухе их пропускают сквозь холодную техническую воду, Нагревание такого раствора с газами, сопровождается десорбцией и высвобождением всех растворенных газообразных компонентов до полного испарения основы (воды). Обладая подобной информацией, проектировщики систем безопасности выбирают наиболее подходящие для комплектации модели приборов, обозначая на схеме их предварительные места установки и требуемое количество.
Обладая подобной информацией, проектировщики систем безопасности выбирают наиболее подходящие для комплектации модели приборов, обозначая на схеме их предварительные места установки и требуемое количество.
Отсюда вывод: избегайте условий образования конденсата при монтаже датчиков! Влага внутри прибора коварна даже в небольших малозметных колличествах. Применяйте специальные аксессуары и опции для дополнительной защиты газоанализатора от внешних воздействий – брызгозащитные комлекты, антибликовые козырьки, термокожухи, модули защиты от насекомых и т.д.
Какова растворимость газов в воде? – FAQ
Заказать звонок
Поиск по каталогу
- Все
- КИП
- Газовый анализ
Нам известно, что газы могут растворяться в воде. Рыбы дышат растворенным в воде кислородом, морским водорослям растворенный в воде углекислый газ необходим для реакции фотосинтеза – а нам нравится, когда в напитках присутствует шипучий CO2.
| ГАЗ | КОЭФФ.РАСТВОРИМОСТИ |
| Метиламин | 757 |
| Аммиак | 685 |
| Бромистый водород | 532 |
| Хлористый водород | 448 |
| Метилхлорид | 317 |
| Триметиламин | 180 |
| Диметиламин | 118 |
| Диоксид серы | 39 |
| Диметилэфир | 35 |
| Метилмеркаптан | 11 |
| Метилвинилэфир | 3,86 |
| Сероводород | 2,59 |
| Хлор | 2,26 |
| Этиленоксид | 1,89 |
| Винилхлорид | 1,07 |
| Ацетилен | 1,04 |
| Диоксид углерода | 0,879 |
| Динитроген моноксид | 0,665 |
| Арсин | 0,23 |
| Пропилен | 0,23 |
| 1,3-Бутадиен | 0,202 |
| Этилен | 0,119 |
| Оксид азота | 0,048 |
| Этан | 0,043 |
| Пропан | 0,039 |
| Аргон | 0,034 |
| n-Бутан | 0,034 |
| Метан | 0,033 |
| i-Бутан | 0,033 |
| Кислород | 0,031 |
| Оксид углерода | 0,023 |
| Водород | 0,018 |
| Азот | 0,016 |
| Гелий | 0,0083 |
| Гексафторид серы | 0,0056 |
| Тетрафторметан | 0,0038 |
Растворимость – это такой баланс, при котором количество растворенного газа пропорционально парциальному давлению в газообразной фазе над поверхностью воды.
Пример:
20.9 об. % кислорода с атмосферным давлением 1000 мбар создают парциальное давление 0.209 бар O2, таким образом, 1 литр воды содержит 0.031 ∗ 0.209 = 0.00648 литра или 6.5 мл кислорода. Азот (парциальное давление 0.791 бар N2) растворяется хуже, 1 л воды содержит 0.016 ∗ 0.791 = 0.01266 л или 12.7 мл азота. В воде у нас 34 об. % кислорода. Рыбы этим довольны.
Газированная вода производится посредством растворением в воде CO2 под давлением 2 бара. Можно вычислить содержание CO2, оно составляет 0.879 ∗ 2 = 1.75 л CO2, растворенных в 1 л воды.
Как вы видите, некоторые газы растворяются в воде очень быстро и очень эффективно. Именно поэтому в качестве мер безопасности широко распространено использование водяных распылителей и “водяных завес”, например, для снижения угрозы здоровью при выбросах значительных объемов аммиака или HCl.
Помните, что растворимость зависит от температуры. Чем выше температура воды, тем меньше газа можно в ней растворить. По этой причине для растворения загрязняющих газов в воздухе их пропускают сквозь холодную воду, тогда как при нагревании происходит десорбция и высвобождение растворенных в воде газов (часто этому способствует падение давления).
Тонкий слой водяного конденсата на входном отверстии электрохимического сенсора может создать определенные проблемы, растворяя, например, h3S или Nh4, в результате этого уменьшаются показания сенсора.
Отсюда вывод: избегайте образования конденсата!
Темы Газовый анализ
Предыдущая статья
Следующая статья
Напишите нам, мы свяжемся с вами в ближайшее время и поможем подобрать оборудование и ответить на все возникшие у вас вопросы.
Телефон для связи
Представьтесь
Электронная почта
Сообщение или вопрос
Прикрепить файл
Спасибо за обращение!
В ближайщее время с вами
свяжется наш менеджер.
Wsn301210 – DW – 03.01.2011
Тропические леса Амазонки – “зеленые легкие” планетыФото: dpa
3 января 2011 г.
До сих пор ученые полагали, что увеличение содержания углекислого газа в атмосфере ускоряет рост лесов, и в результате те начинают поглощать еще больше углекислого газа. С этой иллюзией, похоже, придется расстаться.
https://www.dw.com/ru/%D0%B8%D0%B7%D0%B1%D1%8B%D1%82%D0%BE%D0%BA-%D1%83%D0%B3%D0%BB%D0%B5%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D0%B3%D0%BE-%D0%B3%D0%B0%D0%B7%D0%B0-%D0%B2-%D0%B0%D1%82%D0%BC%D0%BE%D1%81%D1%84%D0%B5%D1%80%D0%B5-%D0%BB%D0%B5%D1%81%D0%B0-%D0%B1%D1%8B%D1%81%D1%82%D1%80%D0%B5%D0%B5-%D1%80%D0%B0%D1%81%D1%82%D1%83%D1%82-%D0%B8-%D0%B1%D1%8B%D1%81%D1%82%D1%80%D0%B5%D0%B5-%D1%83%D0%BC%D0%B8%D1%80%D0%B0%D1%8E%D1%82/a-14744483
Реклама
Не будь на нашей планете лесов и океанов, содержание углекислого газа в земной атмосфере было бы гораздо выше, чем сегодня. Примерно половина всего антропогенного углекислого газа, то есть тех выбросов, источником которых являются промышленность, транспорт, энергетика, сельское хозяйство и прочая деятельность человека, из года в год поглощается морями и биосферой суши. Причем на суше – прежде всего, конечно, природными лесами, которые порой выспренне именуют “зелеными легкими планеты”.
Примерно половина всего антропогенного углекислого газа, то есть тех выбросов, источником которых являются промышленность, транспорт, энергетика, сельское хозяйство и прочая деятельность человека, из года в год поглощается морями и биосферой суши. Причем на суше – прежде всего, конечно, природными лесами, которые порой выспренне именуют “зелеными легкими планеты”.
Про один важный процесс забыли
Для фотосинтеза (процесса, в ходе которого образуется кислород) деревьям необходим углекислый газ. Рост содержания углекислого газа в атмосфере способствует росту деревьев, он для них своего рода дополнительное удобрение. Все верно, но вот какой вывод из этого следует? “Если содержание СО2 в атмосфере будет и дальше увеличиваться, то это, надеются многие, приведет к разрастанию лесов, что, в свою очередь, поможет биосфере поглощать еще больше СО2, – говорит Харальд Бугман (Harald Bugmann), профессор Швейцарской высшей технической школы в Цюрихе, специалист в области экологии леса. – То есть эти люди считают, что сам рост эмиссии углекислого газа позволит нам справиться с ростом эмиссии углекислого газа”.
– То есть эти люди считают, что сам рост эмиссии углекислого газа позволит нам справиться с ростом эмиссии углекислого газа”.
Конечно, это было бы замечательно. Тем более, что удобрение углекислым газом действительно оказывает воздействие на вегетацию – это не вызывает никаких сомнений. Со спутников видны регионы с пышно разрастающимися лесами, поглощающими все больше и больше углекислого газа. Вот только этот эффект может оказаться очень недолговечным, – предостерегает ученый: “Выполненные мною исследования указывают на то, что в наших расчетах и оценках мы забыли учесть один важный процесс, который способен существенно снизить или даже вовсе свести на нет такую функцию биосферы как поглощение углекислого газа”.
Чем быстрее рост, тем хуже древесина
Процесс, о котором говорит и пишет в своих научных статьях швейцарский эколог, – это преждевременное старение деревьев. Усиленный рост ведет к сокращению продолжительности жизни. “Это связано с тем, что у деревьев, растущих в атмосфере, пересыщенной углекислым газом, снижается качество древесины, – объясняет профессор. – Соответственно, они хуже противостоят болезням, вредителям, экстремальным погодным явлениям, и раньше умирают. При этом накопленный было углекислый газ ускоренными темпами выделяется обратно в атмосферу”.
– Соответственно, они хуже противостоят болезням, вредителям, экстремальным погодным явлениям, и раньше умирают. При этом накопленный было углекислый газ ускоренными темпами выделяется обратно в атмосферу”.
По крайней мере, так это выглядит в компьютерных расчетах цюрихского ученого. Профессор Бугман смоделировал процессы, протекающие в шести различных видах лесов, типичных для Швейцарии, под влиянием удобрения углекислым газом и ускоренным на 10-30 процентов ростом. Результаты этого исследования вполне репрезентативны для всех природных лесов Европы, – подчеркивает ученый: “Нынешние оценки экспертов исходят из предположения, что никакого ускоренного умирания лесов нет. При этом, вполне естественно, получается, что деревья накапливают все больше и больше углекислого газа. А мои данные говорят о том, что леса начнут умирать раньше. И если это так, то мы получим то, что в математике называется игрой с нулевой суммой. То есть удобрение углекислым газом в начале цикла круговорота не даст нам ровным счетом ничего”.
Если модель нельзя проверить, лучше перестраховаться
Расчеты швейцарского исследователя вызвали интерес у коллег. Американский эколог Хэнк Шугарт (Hank Shugart), профессор Вирджинского университета в Шарлоттсвилле, говорит: “Должен сказать, что мои работы подтверждают ряд полученных им данных. Про то, что в искусственных лесопосадках быстрый рост означает и быструю смерть, мы знали давно. Этот эффект связан с тем, что деревья более жестко конкурируют друг с другом. Исследование профессора Бугмана обогащает наши знания в этой области: оно свидетельствует о том, что сходный эффект имеет место и в природных лесах. То есть там, где масштабы поглощения углекислого газа из атмосферы наиболее велики – например, во влажных тропических лесах Амазонки”.
Впрочем, сам профессор Бугман признает, что у его модели имеется один весьма существенный недостаток: она практически не поддается проверке. Ведь для того, чтобы выяснить, насколько получаемые с ее помощью расчетные данные соответствуют реальным, нужно проследить за жизненным циклом, по крайней мере, одного поколения деревьев – от начала до (возможно, преждевременного) конца. Такой эксперимент едва ли возможен: он продлился бы несколько веков. В этой ситуации рецепт может быть один – осторожность и осмотрительность, – говорит швейцарский эколог: “На горизонте просматривается некий фактор. Есть основания полагать, что он реально существует. И действует так, что отменяет дополнительное поглощение биосферой СО2, на которое мы все так надеялись. Значит, не надо питать иллюзий, лучше перестраховаться. Не надо делать ставку на это дополнительное поглощение, когда речь заходит, скажем, о квотировании выбросов парниковых газов и о международных обязательствах по снижению уровня их эмиссии. То есть в этом деле есть и политическая составляющая”.
Такой эксперимент едва ли возможен: он продлился бы несколько веков. В этой ситуации рецепт может быть один – осторожность и осмотрительность, – говорит швейцарский эколог: “На горизонте просматривается некий фактор. Есть основания полагать, что он реально существует. И действует так, что отменяет дополнительное поглощение биосферой СО2, на которое мы все так надеялись. Значит, не надо питать иллюзий, лучше перестраховаться. Не надо делать ставку на это дополнительное поглощение, когда речь заходит, скажем, о квотировании выбросов парниковых газов и о международных обязательствах по снижению уровня их эмиссии. То есть в этом деле есть и политическая составляющая”.
Автор: Владимир Фрадкин
Редактор: Ефим Шуман
Реклама
Пропустить раздел Топ-тема1 стр. из 3
Пропустить раздел Другие публикации DWНа главную страницу
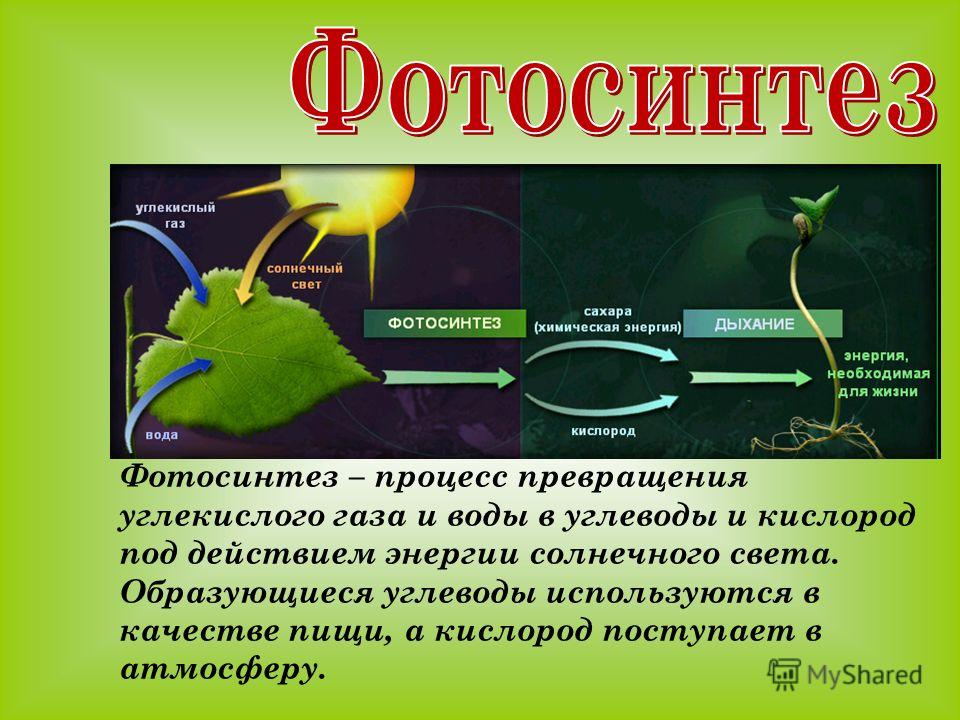
Углекислый газ
 Молекулы углекислого газа состоят из атома углерода , ковалентно связанного двойной связью с двумя атомами кислорода . Он встречается в природе в атмосфере Земли в виде следового газа . Текущая концентрация составляет около 0,04% (412 частей на миллион ) по объему, что выше доиндустриального уровня в 280 частей на миллион. [10] [11] К природным источникам относятся вулканы , лесные пожары, горячие источники , гейзерами , и освобождается от карбонатных пород путем растворения в воде и кислотах. Поскольку углекислый газ растворим в воде, он естественным образом встречается в подземных водах , реках и озерах , ледяных шапках , ледниках и морской воде . Он присутствует в месторождениях нефти и природного газа . Углекислый газ имеет резкий кислый запах и создает во рту вкус газированной воды . [12] Однако при обычно встречающихся концентрациях он не имеет запаха. [1]
Молекулы углекислого газа состоят из атома углерода , ковалентно связанного двойной связью с двумя атомами кислорода . Он встречается в природе в атмосфере Земли в виде следового газа . Текущая концентрация составляет около 0,04% (412 частей на миллион ) по объему, что выше доиндустриального уровня в 280 частей на миллион. [10] [11] К природным источникам относятся вулканы , лесные пожары, горячие источники , гейзерами , и освобождается от карбонатных пород путем растворения в воде и кислотах. Поскольку углекислый газ растворим в воде, он естественным образом встречается в подземных водах , реках и озерах , ледяных шапках , ледниках и морской воде . Он присутствует в месторождениях нефти и природного газа . Углекислый газ имеет резкий кислый запах и создает во рту вкус газированной воды . [12] Однако при обычно встречающихся концентрациях он не имеет запаха. [1]Как источник доступного углерода в углеродном цикле , атмосферный углекислый газ является основным источником углерода для жизни на Земле , и его концентрация в доиндустриальной атмосфере Земли с конца докембрия регулировалась фотосинтезирующими организмами и геологическими явлениями. Растения , водоросли и цианобактерии используют энергию солнечного света для синтеза углеводов из углекислого газа и воды в процессе, называемом фотосинтезом , который производит кислород в качестве побочного продукта. [13]В свою очередь, кислород потребляется, а CO 2 выделяется в виде отходов всеми аэробными организмами , когда они метаболизируют органические соединения для производства энергии посредством дыхания . [14] Поскольку растениям требуется CO 2 для фотосинтеза, а люди и животные зависят от растений в качестве пищи, CO 2 необходим для выживания жизни на Земле.
Растения , водоросли и цианобактерии используют энергию солнечного света для синтеза углеводов из углекислого газа и воды в процессе, называемом фотосинтезом , который производит кислород в качестве побочного продукта. [13]В свою очередь, кислород потребляется, а CO 2 выделяется в виде отходов всеми аэробными организмами , когда они метаболизируют органические соединения для производства энергии посредством дыхания . [14] Поскольку растениям требуется CO 2 для фотосинтеза, а люди и животные зависят от растений в качестве пищи, CO 2 необходим для выживания жизни на Земле.
Он возвращается в воду через жабры рыб и в воздух через легкие наземных животных, дышащих воздухом, включая человека. Углекислый газ образуется в процессе разложения органических материалов и ферментации сахаров при производстве хлеба , пива и вина . Он производится путем сжигания древесины , торфа и других органических материалов и ископаемых видов топлива , таких как уголь , нефть и природный газ . Это нежелательный побочный продукт во многих крупномасштабных процессах окисления , например, при производствеакриловая кислота (свыше 5 млн т/год). [15] [16] [17]
Это нежелательный побочный продукт во многих крупномасштабных процессах окисления , например, при производствеакриловая кислота (свыше 5 млн т/год). [15] [16] [17]
Это универсальный промышленный материал, используемый, например, в качестве инертного газа в сварке и огнетушителях , в качестве нагнетающего газа в пневматических пушках и при добыче нефти, в качестве химического сырья и в качестве сверхкритического жидкого растворителя при декофеинизации кофе и сверхкритической сушке . . [18] Его добавляют в питьевую воду и газированные напитки, включая пиво и игристое вино , для придания шипучести . Замороженная твердая форма CO 2 , известная как сухой лед , используется в качестве хладагента и абразива при струйной очистке сухим льдом . Это сырье для синтеза топлива и химикатов. [19] [20][21] [22]
Углекислый газ является наиболее значительным долгоживущим парниковым газом в атмосфере Земли . Со времен промышленной революции антропогенные выбросы — в первую очередь в результате использования ископаемого топлива и вырубки лесов — быстро увеличили его концентрацию в атмосфере, что привело к глобальному потеплению . Углекислый газ также вызывает закисление океана , поскольку он растворяется в воде с образованием угольной кислоты . [23]
Со времен промышленной революции антропогенные выбросы — в первую очередь в результате использования ископаемого топлива и вырубки лесов — быстро увеличили его концентрацию в атмосфере, что привело к глобальному потеплению . Углекислый газ также вызывает закисление океана , поскольку он растворяется в воде с образованием угольной кислоты . [23]
Углекислый газ был первым газом, который был описан как дискретное вещество. Примерно в 1640 году [ 24] фламандский химик Ян Баптист ван Гельмонт заметил, что, когда он сжигал древесный уголь в закрытом сосуде, масса образовавшейся золы была намного меньше массы исходного древесного угля. Его интерпретация заключалась в том, что остальная часть древесного угля превратилась в невидимую субстанцию, которую он назвал «газом» или «диким духом» ( spiritus sylvestris ). [25]
Кристаллическая структура сухого льда
Растяжительные и изгибные колебания молекулы углекислого газа СО 2 . Вверху слева: симметричное растяжение. Вверху справа: антисимметричное растяжение. Нижняя строка: вырожденная пара изгибных мод.
Вверху слева: симметричное растяжение. Вверху справа: антисимметричное растяжение. Нижняя строка: вырожденная пара изгибных мод.
Гранулы «сухого льда», распространенной формы твердого диоксида углерода.
Фазовая диаграмма давление-температура углекислого газа. Обратите внимание, что это логарифмическая диаграмма.
Пузырьки углекислого газа в безалкогольном напитке
Сухой лед используется для сохранения винограда после сбора урожая.
Использование огнетушителя CO 2
Сравнение фазовых диаграмм давление-температура диоксида углерода (красный) и воды (синий) в виде логарифмической диаграммы с точками фазовых переходов при 1 атмосфере.
Углекислый лазер
Кривая Килинга концентрации CO 2 в атмосфере [81]
Годовой прирост атмосферного CO 2 вырос на 300% с 1960-х годов. [82]
[82]
Ежегодные потоки CO 2 из антропогенных источников (слева) в атмосферу Земли, сушу и стоки океана (справа) с 1960-х годов. Единицы в эквивалентных гигатоннах углерода в год. [88]
Раковина птерапода, растворенная в морской воде, адаптирована к химическому составу океана , прогнозируемому на 2100 год.
Обзор цикла Кальвина и фиксации углерода
Обзор фотосинтеза и дыхания. Углекислый газ (справа) вместе с водой образует кислород и органические соединения (слева) в результате фотосинтеза , которые при вдыхании превращаются в воду и (CO 2 ).
Основные симптомы отравления углекислым газом по увеличению объемного процента в воздухе. [142]
Повышение уровня CO 2 угрожало астронавтам Аполлона-13 , которым пришлось адаптировать картриджи из командного модуля для питания скруббера углекислого газа в лунном модуле , который они использовали в качестве спасательной шлюпки.
Измеритель концентрации CO 2 с использованием недисперсионного инфракрасного датчика
8 класс. Химия. Углекислый газ – Углекислый газ
Комментарии преподавателяХимическая формула и названия
Химическая формула углекислого газа – СО2. Углекислый газ – вещество, которое имеет множество названий: оксид углерода (IV), диоксид углерода или же двуокись углерода. Также его еще называют угольным ангидридом. Он является совершенно бесцветным газом, который не имеет запаха, с кисловатым вкусом. Углекислый газ тяжелее воздуха, растворим в воде. При температуре ниже -78 °С кристаллизуется и становится похожим на снег.
Углекислый газ был первым между всеми другими газами противопоставлен воздуху под названием «дикий газ» алхимиком XVI века Вант Гельмонтом.
Открытием СО2 было положено начало новой отрасли химии – пневматохимии (химии газов).
Шотландский химик Джозеф Блэк (1728–1799) в 1754 году установил, что известковый минерал мрамор (карбонат кальция) при нагревании разлагается с выделением газа и образует негашеную известь (оксид кальция):
CaCO3CaO + CO2
Выделяющийся газ можно было вновь соединить с оксидом кальция и вновь получить карбонат кальция:
CaO + CO2CaCO3
Этот газ был идентичен открытому Ван Гельмонтом «дикому газу», но Блэк дал ему новое название – «связанный воздух» – так как этот газ можно было связать и вновь получить твердую субстанцию – карбонат кальция.
Несколько лет спустя Кавендиш обнаружил еще два характерных физических свойства углекислого газа – его высокую плотность и значительную растворимость в воде.
Содержание углекислого газа в атмосфере относительно небольшое, около 0,03% (по объему). Углекислый газ, сосредоточенный в атмосфере, имеет массу 2200 биллионов тонн.
В 60 раз больше углекислого газа содержится в растворенном виде в морях и океанах.
В течение каждого года из атмосферы извлекается примерно 1/50 часть всего содержащегося в ней CO2 растительным покровом земного шара в процессе фотосинтеза, превращающего минеральные вещества в органические.
Основная масса углекислого газа в природе образуется в результате различных процессов разложения органических веществ. Углекислый газ выделяется при дыхании растений, животных, микроорганизмов. Непрерывно увеличивается количество углекислого газа, выделяемого различными производствами. Углекислый газ содержится в составе вулканических газов, выделяется он и из земли в вулканических местностях.
Вне земного шара оксид углерода (IV) обнаружен в атмосферах Марса и Венеры – планетах «земного типа».
В промышленности углекислый газ получается главным образом как побочный продукт обжига известняка, спиртового брожения и др.
Получение в лаборатории
В химических лабораториях либо пользуются готовыми баллонами с жидким углекислым газом, либо получают CO2 в аппаратах Киппа или приборе для получения газов действием соляной кислоты на куски мрамора:
CaCO3 + 2HClCaCl2 + CO2+ h3O
Физические свойства
CO2 – это бесцветный газ, не имеет запаха, тяжелее воздуха в 1,5 раза. Хорошая растворимость углекислого газа в воде делает невозможным собирание его методом «вытеснения воды».
Химические свойства
Оксид углерода (IV) обладает кислотными свойствами, и при растворении этого газа в воде образуется угольная кислота. При пропускании CO2 через подкрашенную лакмусом воду можно наблюдать изменение цвета индикатора с фиолетового на красный.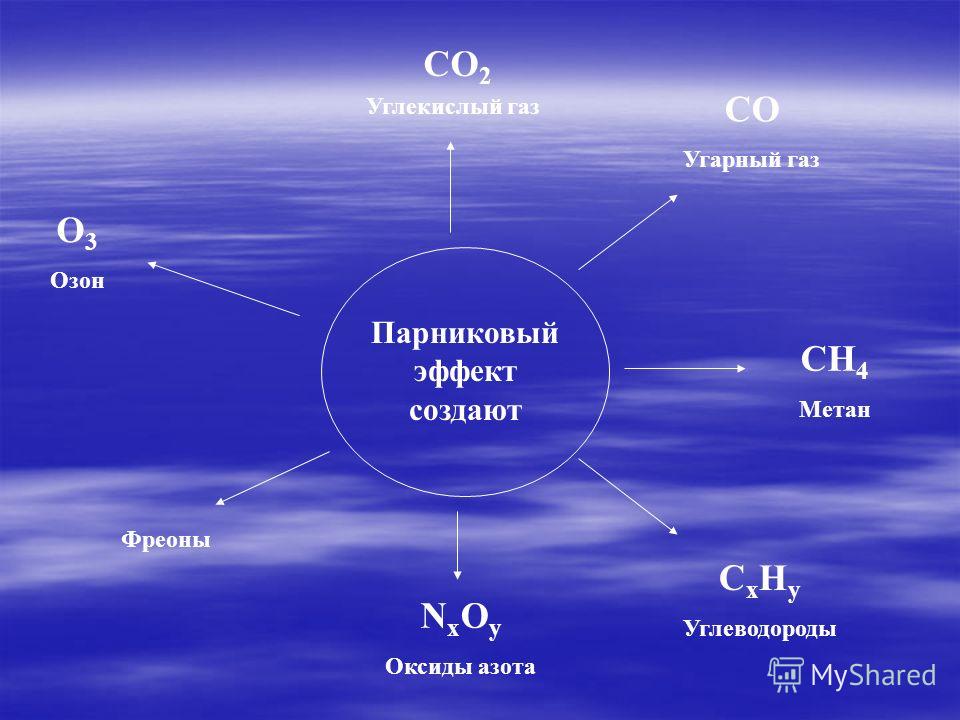
Качественной реакцией на содержание углекислого газа в воздухе является пропускание газа через разбавленный раствор гидроксида кальция (известковую воду). Рис. 1. Углекислый газ вызывает образование в этом растворе нерастворимого карбоната кальция, в результате чего раствор становится мутным:
CO2 + Ca(OH)2CaCO3+ h3O
Рис. 1. Помутнение известковой воды при пропускании через нее углекислого газа
При добавлении избыточного количества CO2 мутный раствор снова становится прозрачным из-за превращения нерастворимого карбоната в растворимый гидрокарбонат кальция:
CaCO3+ h3O + CO2Ca(HCO3)2
гидрокарбонат кальция
1. Прессованный твердый углекислый газ получил название «сухого льда».
Твердый CO2 скорее похож на спрессованный плотный снег, по твердости напоминающий мел. Рис. 2. Температура «сухого льда» –78 оС. Сухой лед, в отличие от водяного льда, плотный. Он тонет в воде, резко охлаждая её. Горящий бензин можно быстро потушить, бросив в пламя несколько кусочков сухого льда.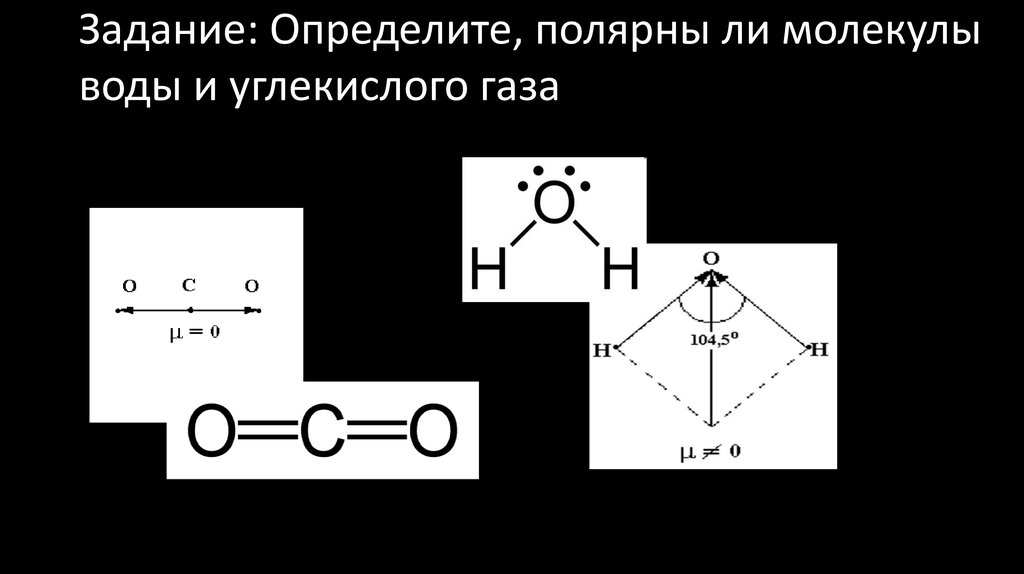
Рис. 2. «Сухой лед»
Главное применение сухого льда – хранение и перевозка продуктов питания: рыбы, мяса, мороженого и др. Ценность сухого льда заключается не только в его охлаждающем действии, но и в том, что продукты в углекислом газе не плесневеют и не гниют.
2. Сухим льдом испытывают в лабораториях детали, приборы, механизмы, которые будут служить в условиях пониженных температур. С помощью сухого льда испытывают морозоустойчивость резиновых покрышек автомобилей.
3. Углекислый газ применяют для газирования фруктовых и минеральных вод, а в медицине – для углекислотных ванн.
4. Жидкий углекислый газ используют в углекислотных огнетушителях. Он особенно эффективен в тех случаях, когда вода непригодна, например, при тушении загоревшихся огнеопасных жидкостей или при наличии в помещении не выключенной электропроводки или уникального оборудования, которое от воды может пострадать.
ИСТОЧНИКИ
источник конспекта – http://interneturok. ru/ru/school/chemistry/8-klass/bvewestva-i-ih-prevraweniyab/uglekislyy-gaz
ru/ru/school/chemistry/8-klass/bvewestva-i-ih-prevraweniyab/uglekislyy-gaz
источник видео – http://www.youtube.com/watch?v=hpAz781bobs
источнки видео – http://www.youtube.com/watch?v=jmzzcSfaSWI
источник видео – http://www.youtube.com/watch?v=ERM4xVavidc
источник видео – http://www.youtube.com/watch?v=Y8e5nvolpFY
источник видео – http://www.youtube.com/watch?v=UMiYymlKac0
источник презентации – http://ppt4web.ru/khimija/uglekislyjj-gaz.html
https://prezentacii.org/prezentacii/prezentacii-po-himiy/11405-uglekislyy-gaz.html
http://prezentacii.com/po_himii/12432-uglekislyy-gaz-co2.html
http://5klass.net/zip/khimija/SO2-uglekislyj-gaz.zip
Введение — СУНЦ МГУ
Лекция 01.
1. Что такое органическая химия?
1-1 Предмет органической химии Определение состава органических веществ
Тема 0. Задачи на определение состава веществ
- Найдите формулу вещества по данным элементного анализа:
a) Al – 75%, C- 25%
b) Н – 1,58%, N – 22,22%, O – 76,20%
c) Na – 42,07%, P – 18,91%, O – 39,02%
- Газообразное соединение азота и водорода содержит 12,5% водорода по массе, а плотность его паров по водороду равна 16.
 Найти молекулярную формулу этого соединения.
Найти молекулярную формулу этого соединения. - При полном сгорании 2,66г вещества получилось 1,54г углекислого газа и 4,48г оксида серы (IV). Найти простейшую формулу этого вещества.
- В состав винного спирта входят углерод, водород и кислород. Определите его молекулярную формулу, если известно, что при сгорании 1,38г этого соединения образуется 2,64г углекислого газа и 1,62г воды, а плотность его паров по воздуху равна 1,59.
- Определите формулу соединения, если известно, что оно содержит 28% металла, 24% серы и 48% кислорода по массе.
- Соль содержит 31,8% калия, 39,2% кислорода, остальное – некоторый кислотообразующий элемент. Найдите формулу соли.
- Хлорид некоторого металла содержит 74,7% хлора. Определите неизвестный металл.
- Соль, содержащая некоторый элемент Х, имеет следующее массовое соотношение элементов: X:H:N:O = 12:5:14:48. Какова формула этой соли?
Тема 1. Определение состава органических веществ
1. Соединение с простейшей формулой C3H4O имеет плотность по водороду, равную 84. Его молекулярная формула:
Соединение с простейшей формулой C3H4O имеет плотность по водороду, равную 84. Его молекулярная формула:
А — C3H4O, B — C9H14NO4, C — C12H16O, D — C9H12O3, E — C8H8O4
2. Сколько граммов углекислого газа образуется при полном сгорании 28,52 г октана (С8Н18) в избытке кислорода?
А — 11,0 г, В — 22,0 г, С — 44,0 г, D — 88,0 г, E — 176,0 г
3. При сгорании 1,24 г органического вещеcтва в избытке кислорода образуется 1,76 г углекислого газа и 1,08 г воды. Определить простейшую формулу этого вещества.
A — CHO, B — CH2O, C — CH3O, D — C2H3O, E — C3H5O
4. При анализе органического соединения было обнаружено, что оно содержит только 0,566 г водорода, 2,641 г азота и 6,793 г углерода. Определите простейшую формулу этого соединения.
A — C3H3N, B — C6H6N, C — C12HN5, D — C2H7N, E — HCN
5. Определите простейшую формулу вещества, содержащего 14,28% водорода и 85,72 % углерода. Определите его молекулярную формулу, если плотность его паров равна 2,5 г/л (н.у.).
6. Определите простейшую формулу вещества, если при сгорании 7,2 г его получили 22 г углекислого газа и 10,8 г воды. Достаточно ли данных, чтобы определить молекулярную формулу этого вещества?
7. Сожгли 4,8 г органического вещества, при этом образовалось 3,36 л (н.у.) углекислого газа и 5,4 мл (н.у.) воды. Плотность паров вещества по водороду равна 16. Определите его молекулярную формулу. Есть ли в задаче лишние данные?
8. Сгорело 9 г вещества и образовалось 8,96 л (н.у.) углекислого газа, 12,6 г воды и 2,8 г азота. Определите простейшую и молекулярную формулы.
9. При полном сгорании органического вещества массой 18,0 г образовалось 20,16 л (при н.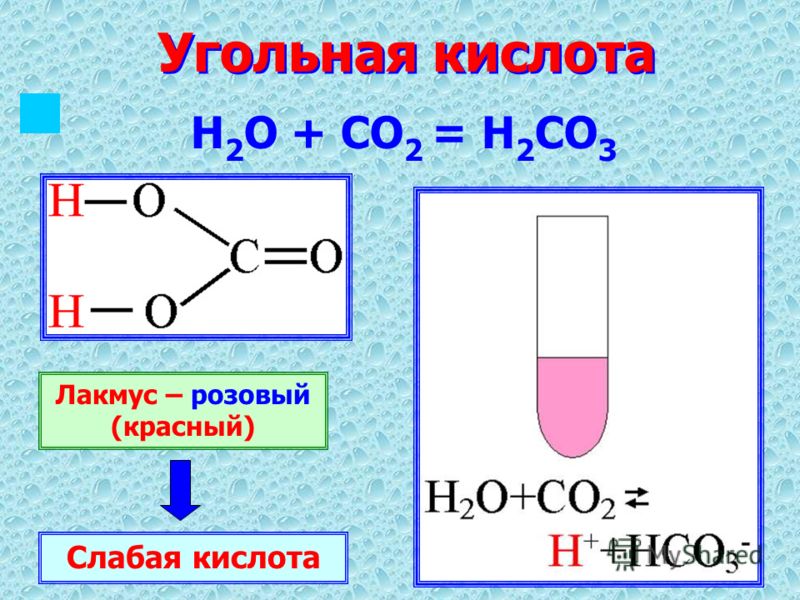 у.) углекислого газа и 21,6 г воды. Установите молекулярную формулу вещества
у.) углекислого газа и 21,6 г воды. Установите молекулярную формулу вещества
10. При сгорании 37,8 г органического вещества образовалось 66,0 г углекислого газа, 8,4 г азота и 16,2 г воды. Установите молекулярную формулу вещества, если известно, что его молярная масса меньше 240 г/моль.
11. При сгорании 4,48 л (н.у.) газообразного органического вещества получили 35,2 г углекислого газа и 10,8 мл воды. Плотность этого вещества составляет 2,41 г/л (н.у.).
На основании данных условия задачи:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу органического вещества;.
12. Некоторое органическое соединение содержит 40,0% углерода и 53,3% кислорода по массе. Плотность данного вещества по водороду равна 30.
На основании данных условия задачи:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу органического вещества
13. При сгорании 17,5 г органического вещества получили 28 л (н.у.) углекислого газа и 22,5 мл воды. Плотность паров этого вещества (н.у.) составляет 3,125 г/л.
При сгорании 17,5 г органического вещества получили 28 л (н.у.) углекислого газа и 22,5 мл воды. Плотность паров этого вещества (н.у.) составляет 3,125 г/л.
На основании данных условия задачи:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу органического вещества
14. При сгорании 10,5 г органического вещества получили 16,8 л углекислого газа (н.у.) и 13,5 г воды. Плотность паров этого вещества (н.у.) составляет 1,875 г/л.
На основании данных условия задачи:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу органического вещества
15. При сгорании 26,6 г органического вещества образовалось 35,2 г углекислого газа, 2,8 г азота и 12,6 г воды. Установите молекулярную формулу вещества, если известно, что его молярная масса меньше 250 г/моль.
16. Определите молекулярную формулу углеводорода, если известно, что при полном сгорании 25,0 г этого соединения образовалось 36,0 г воды. Сколько граммов углекислого газа при этом образовалось?
Сколько граммов углекислого газа при этом образовалось?
17. Известно, что в приведенных ниже результатах анализа вещества Х один из результатов неверен: углерод — 31,9%, водород — 2,23%, сера — 14,2%, кислород — 24,15%, азот — 6,2%, хлор — 31,4%. Установите молекулярную формулу вещества Х, если известно, что его молярная масса примерно равна 220 г/моль.
18. Твердый остаток, полученный при сжигании 50 мг хлорофилла, в состав которого входят углерод, водород, кислород, азот и магний, растворен в 20 мл 0,01 М соляной кислоты. На нейтрализацию полученного раствора потребовалось 8,8 мл раствора гидроксида натрия с концентрацией 0,01 моль/л. Вычислите минимальное значение молярной массы хлорофилла.
19. Может ли органическое вещество содержать 40% водорода по массе? Ответ подтвердите расчетом.
20. В 1928 году американскому химику корпорации «Дженерал Моторс» («General Motors Research») Томасу Мидглей младшему удалось синтезировать и выделить в своей лаборатории химическое соединение, состоявшее на 23,53% из углерода,1,96% водорода и 74,51% фтора. Полученный газ был в 3,52 раза тяжелее воздуха и не горел. Выведите формулу соединения
Полученный газ был в 3,52 раза тяжелее воздуха и не горел. Выведите формулу соединения
21. При сжигании 3,6 г некоторого органического вещества было получено 3,6 г воды и диоксид углерода, при пропускании которого в 1500 мл раствора гидроксида кальция с концентрацией 0,1 моль/л образовалось 10,0 г осадка. Рассчитайте брутто-формулу исходного вещества, если его относительная молекулярная масса меньше 100.
Лекция 02. Строение органических соединений. Классификация и номенклатура
Видеозапись лекции. Теория строения органических веществ А.М.Бутлерова
1-2 История развития представлений о химической связи Теория Бутлерова Изомерия
1-5 Классификация и номенклатура органических соединений (общие принципы)
Тема 2. Состав и структура органических веществ. Изомеры
- Нарисуйте все изомеры для C4H10 и C5H12
- Нарисуйте все изомеры состава С4H9Cl.

- Сколько изомеров имеет соединение состава C3H6.
- Верно ли утверждение, что вещество состава C7H16 имеет 8 структурных изомеров? Если нет – то сколько изомеров у этого вещества?
- Может ли молекула углеводорода содержать нечётное число атомов водорода? Ответ обоснуйте.
- Органическое вещество содержит 14.34% C, 0.80% H и хлор. Плотность его паров 11.2 г/л при пересчете на нормальные условия. Определите его простейшую и молекулярную формулу и нарисуйте все его изомеры.
- Бензин — это смесь углеводородов, содержащих от 5 до 9 атомов углерода в \ молекуле. Качество бензина характеризуется так называемым октановым числом. Чем выше этот показатель, тем сильнее можно сжать смесь паров бензина с воздухом без взрыва (детонации) и, следовательно, тем мощнее может быть двигатель внутреннего сгорания. Октановое число зависит от строения углеводорода. Чем больше разветвлений в молекуле, тем выше октановое число. Составьте структурные формулы углеводородов состава C8Н18 с максимально большим и максимально маленьким октановыми числами.

- Анализ вещества, состоящего из углерода, водорода и хлора дал следующие результаты: 42.6% C, 7.1% H, 50.3% Cl. Определите молекулярную формулу вещества, зная, что в состав молекулы входят два атома хлора и напишите две возможных структурных формулы.
- При сжигании 2.3 г газообразного при 0 С и давлении 101.3 кПа вещества было получено 2.24 л углекислого газа и 2.7 мл воды. Какова структурная формула исследуемого вещества?
- При сжигании 2,2 г вещества получили 2,24 л (н.у.) углекислого газа и 1,8 г воды. Определите простейшую формулу и предложите возможные структуры вещества.
- Образец вещества с массой 3,10 мг сожгли и получили 4,40 мг углекислого газа и 2,70 мг воды. Плотность паров этого вещества по водороду — 31. Какова молекулярная и возможные структурные формулы этого вещества
- При сгорании 1,4 мг наркотического вещества Х получилось 4,4 мг углекислого газа и 1,8 мг воды. Известно, что пары Х примерно в полтора раза тяжелее воздуха, а все атомы углерода в молекуле равноценны по реакционной способности.
 Напишите молекулярную и структурную формулы вещества Х и назовите его.
Напишите молекулярную и структурную формулы вещества Х и назовите его. - При сжигании 0,45 г соединения Х получено 0,88 г углекислого газа и 0,45 г воды. Известно, что плотность Х по водороду равна 45. Определите молекулярную формулу вещества Х, напишите уравнение его горения и две возможных структурных формулы.
- При сгорании 3,2 мг ядовитого вещества Х получилось 4,4 мг углекислого газа и 3,6 мг воды. Напишите молекулярную и структурную формулы вещества Х и назовите его.
- При сжигании 0,59 г соединения Х получено 1,32 г углекислого газа и 0,63 г воды. Известно, что плотность Х по водороду равна 59. Определите молекулярную формулу вещества Х, напишите уравнение его горения и две возможных структурных формулы.
- При сжигании 2,2 г вещества получили 2,24 л (н.у.) углекислого газа и 1,8 г воды. Определите состав и предложите возможные структуры вещества.
- Летучее органическое соединение А в процессе хроматографической очистки было загрязнено карбонатом кальция и в таком виде сдано на элементный анализ.
 При сожжении 108 мг образца загрязненного вещества было получено 78,4 мл углекислого газа (н.у.), 54 мг воды и 28 мг несгораемого остатка. Установите молекулярную формулу вещества А и предложите его возможные структурные формулы.
При сожжении 108 мг образца загрязненного вещества было получено 78,4 мл углекислого газа (н.у.), 54 мг воды и 28 мг несгораемого остатка. Установите молекулярную формулу вещества А и предложите его возможные структурные формулы. - Содержание углерода в газообразной смеси пентана с углеводородом Х составляет 85% по массе. Объем кислорода, необходимый для полного сгорания этой смеси, в 6,5 раза превышает объем смеси. Напишите структурные формулы всех возможных углеводородов, удовлетворяющих условию задачи
- При сожжении 1,64 г некоторого вещества X в избытке кислорода было получено 1,12 л углекислого газа, 1,26 мл воды (н.у.), а в трубке для сжигания осталось 1,06 г несгораемого остатка, представляющего собой карбонат натрия. Каким строением может обладать вещество Х? Приведите его возможные структурные формулы.
- (Мосгор 17-18) При сжигании 3,6 г некоторого органического вещества было получено 3,6 г воды и диоксид углерода, при пропускании которого в 1500 мл раствора гидроксида кальция с концентрацией 0,1 моль/л образовалось 10,0 г осадка.
 Рассчитайте брутто-формулу исходного вещества, если его относительная молекулярная масса меньше 100. Приведите для него все возможные структурные формулы, если известно, что его молекула содержит один цикл.
Рассчитайте брутто-формулу исходного вещества, если его относительная молекулярная масса меньше 100. Приведите для него все возможные структурные формулы, если известно, что его молекула содержит один цикл.
Тема 3. Классификация и номенклатура органических веществ
- В монохлоралкане массовая доля хлора равна 55,04%. Определите молекулярную формулу монохлоралкана.
- Для определения строения органических соединений современные химики широко используют метод ЯМР. Он основан на том, что ядра некоторых атомов, в том числе обычных атомов водорода Н-1, способны взаимодействовать с магнитным полем, излучая определённую энергию. Величина этой энергии зависит от окружения атома в молекуле, т. е. от того, с какими атомами или группами атомов он связан. Наиболее ценную информацию для органической химии несут спектры на ядро атомов водорода-1 — протонный магнитный резонанс (ПМР). Спектр ПМР показывает, сколько разных типов атомов водорода находится в молекуле, число атомов данного типа и некоторую другую информацию о структуре молекулы.

Например, спектр ПМР этанола CH3-CH2-OH выглядит так:
ПМР-спектр этанола
1) Рассмотрите ПМР-спектр, сопоставьте его со структурной формулой этанола. Сколько типов атомов водорода присутствует в данной молекуле? Есть ли на спектре информация, показывающая число атомов каждого типа в молекуле?
2)Для исследования был взят чистый этанол или присутствовала примесь другого вещества? Обоснуйте ваш ответ.
3)Опишите, как должен выглядеть спектр ПМР для изомера этанола — диметилового эфира.
3. Напишите структурные формулы двух веществ разных классов состава С7Н14, определите число первичных, вторичных, третичных и четвертичных атомов углерода в обоих случаях и назовите вещества по систематической номенклатуре.
4. Напишите формулу двух веществ разных классов состава С4Н7Cl, определите число первичных, вторичных, третичных и четвертичных атомов углерода в обоих случаях и назовите вещества по систематической номенклатуре.
5. Углеводород, содержащий одну двойную и одну тройную связь (но не содержащий циклов), смешали с эквивалентным количеством кислорода и сожгли. После сгорания общее число молей в системе не изменилось. Определите структурную формулу углеводорода.
6. (Биофак 2003). В молекуле алкана содержится 9 первичных и 3 четвертичных атома углерода. Найдите число третичных атомов углерода.
7. При сжигании 11,48 г органического вещества Х образовалось 10,08 л углекислого газа и 6,75 мл воды (н.у.). Плотность его паров в пересчете на нормальные условия примерно равна 3,4 г/л. Определите молекулярную формулу вещества Х, предложите структурные формулы и названия его возможных изомеров, если известно, что вещество Х содержит 46,4% хлора.
8. При сжигании 22,60 г органического вещества Х образовалось 13,44 л углекислого газа и 10,80 мл воды (н.у.). Плотность его паров в пересчете на нормальные условия примерно равна 5 г/л. Определите молекулярную формулу вещества Х, предложите структурные формулы и названия его возможных изомеров, если известно, что вещество Х содержит 62,8% хлора.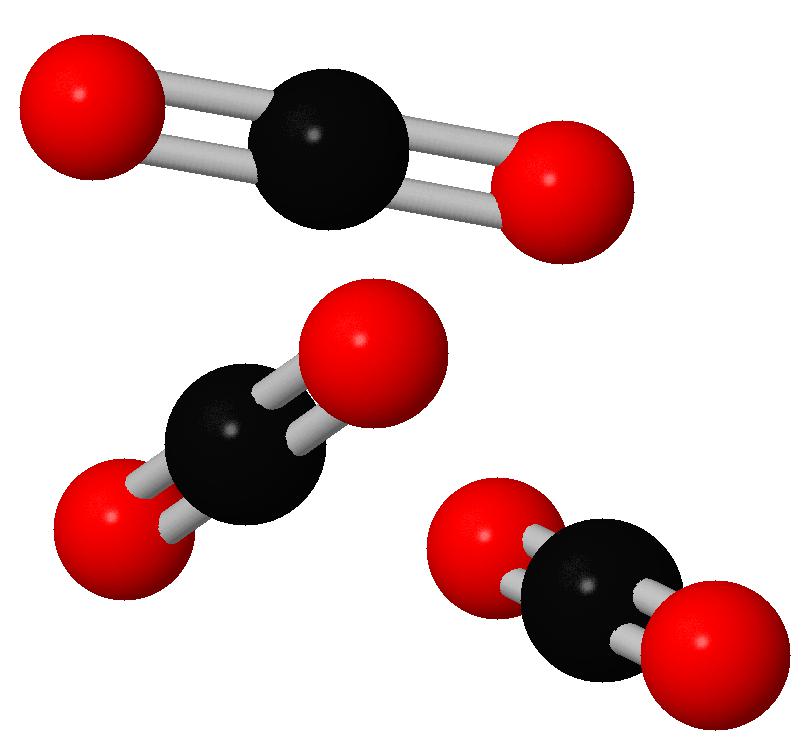
- Органическое вещество Х содержит 47,06% углерода, 6,54% водорода и хлор. Плотность его паров по водороду в пересчете на нормальные условия примерно равна 38. Определите молекулярную формулу вещества Х, предложите структурные формулы и названия его возможных изомеров.
- Органическое вещество содержит 47,1% углерода и 6,5% водорода. После сплавления 1,53 г вещества А с избытком металлического натрия и последующей обработки реакционной смеси сначала избытком спирта, затем разбавленной азотной кислотой и избытком раствора нитрата серебра выпало 2,87 г хлорида серебра. Плотность паров вещества А в пересчете на нормальные условия примерно равна 3,4 г/л. Установите молекулярную формулу вещества А, предложите структурные формулы возможных изомеров и назовите их.
- Учащийся, называя соединения по номенклатуре, допустил ошибки. Найдите их, напишите структурные формулы соединений, о которых идёт речь, и приведите правильные названия этих веществ: а) 1,3-диметилпентан, б) 2-этилбутан, в) 4-метилпентан, г) 2-метил-3-этил-4-метилгексан, д) 1-карбоксипропанол-1, е) 2-метилпент-4-ен.

- Учащийся, называя соединения по номенклатуре, допустил ошибки. Найдите их, напишите структурные формулы соединений, о которых идёт речь, и приведите правильные названия этих веществ: а) 1,3-диметилпентан, б) 2-пропилбутан, в) 4-хлорпентан, г) 2-метил-3-этил-4-метилгексан, д) циклогексановая кислота е) 3-метил-гекс-5-ин.
Лекция 03
Строение атома
Видеозапись лекции. Модели атома
Видеозапись лекции. Квантовомеханическая модель атома. Электронные конфигурации
1-3 Электрон в атоме
Тема 4 Строение атома и периодическая система
- Сколько электронов содержится на внешнем уровне атома серы?
- Приведите пример четырех частиц с электронной конфигурацией внешнего слоя 3s2 3p6.
- Могут ли электроны иона +К находится на следующих орбиталях: 2p, 4s, 2f, 4p? Ответ мотивируйте.
- Напишите электронную конфигурацию атома магния в первом возбужденном состоянии.

- Сколько элементов было бы в третьем периоде, если бы спиновое квантовое число имело единственное значение +1 (остальные квантовые числа имеют обычные значения)?
- Приведите примеры 4 частиц, электронная конфигурация которых совпадает с электронной конфигурацией аргона.
- В молекуле одного из алкенов находится 32 электрона. Установите его молекулярную формулу. Сколько различных изомерных алкенов соответствует данной формуле? Напишите их структурные формулы и назовите их.
Лекция 04
.
Химическая связь
Видеозапись лекции. Часть 1. Что такое химическая связь?
Видеозапись лекции. Часть 2. Характеристики ковалентной связи
Видеозапись лекции. Часть 3. Геометрия молекул
1-4 Природа химических связей (современные представления)
Тема 5. Химическая связь
1.Сколько сигма и пи-связей содержит молекула гепта-1,3-диен-6-ина? Определите гибридизации всех атомов углерода в молекуле.
2.Какие связи являются полярными, а какие – неполярными в молекулах тетрафторэтена, пропена и этанола? Нарисуйте структурные формулы и обозначьте в них полярные и неполярные связи.
3.Формальдегид используют как консервант при изготовлении биологических препаратов. Запах водного раствора формальдегида — формалина — вы можете почувствовать везде, где есть «заспиртованные» препараты, например, в зоологических музеях или в Кунсткамере.
Молекулярная формула формальдегида — CH2O. Валентный угол близок к 120∘, длины связей равны для C = O — 0,122 нм, для С-Н — 0,110 нм. Молекула плоская, представляет собой треугольник с атомом углерода в центре.
Нарисуйте структурную формулу формальдегида. Рассчитайте расстояние между атомом кислорода и атомом водорода, между двумя атомами водорода в молекуле.
4.Определите общую формулу гомологического ряда углеводородов, имеющих одну двойную связь, две тройных связи и один цикл. Сколько сигма- и пи- связей содержит молекула вещества данного ряда, в состав которой входит п атомов углерода. Приведите пример структурной формулы такой молекулы, содержащей 11 атомов углерода.
Приведите пример структурной формулы такой молекулы, содержащей 11 атомов углерода.
5.Смесь 10 мл углеводорода Х и 70 мл кислорода подожгли электрической искрой. После полного сгорания и конденсации водяных паров объем газа составил 65 мл, а после пропускания через избыток раствора щелочи уменьшился до 25 мл. (Все объемы газов измерены при температуре 23оС и давлении 753 мм рт ст.) Установите молекулярную формулу вещества А и предложите возможные структурные формулы.
Лекция 05. Пространственная изомерия, электронные эффекты заместителей и классификация органических реакций
Видеозапись лекции. Оптическая изомерия
Видеозапись леции. Геометрическая изомерия
Видеозапись лекции. Классификация органических реакций
Зеркальный мир глазами биологов
угольная кислота | Формула, использование и факты
- Связанные темы:
- мочевина барбитуровая кислота дициклогексилкарбодиимид карбамат изоцианат
См. все связанные материалы →
все связанные материалы →
угольная кислота , (H 2 CO 3 ), соединение элементов водорода, углерода и кислорода. Он образуется в небольших количествах при растворении его ангидрида, двуокиси углерода (CO 2 ), в воде.
CO 2 + H 2 O ⇌ H 2 CO 3 Преобладающими видами являются просто свободно гидратированные молекулы CO 2 . Угольную кислоту можно рассматривать как двухосновную кислоту, из которой могут быть образованы два ряда солей, а именно гидрокарбонаты, содержащие HCO 3 − , и карбонаты, содержащие CO 3 2− . H 2 CO 3 + H 2 O ⇌ H 3 O + + HCO 3 –
HCO 3 – + H 2 O ⇌ H 3 O + + CO 3 2- . Однако на поведении с кислотой-базой на карбин-аизировании. скорости некоторых участвующих реакций, а также их зависимость от рН системы. Например, при рН менее 8 основные реакции и их относительная скорость следующие: СО 2 + Н 2 О ⇌ Н 2 СО 3 (медленно)
скорости некоторых участвующих реакций, а также их зависимость от рН системы. Например, при рН менее 8 основные реакции и их относительная скорость следующие: СО 2 + Н 2 О ⇌ Н 2 СО 3 (медленно)
H 2 CO 3 + OH – ⇌ HCO 3 – + H 2 O (Fast) выше pH 10 Следующие реакции важны: CO 2 + OH – 4 ⇌ 4 ⇌ 4 ⇌ 4 ⇌ 4 ⇌ 4. HCO 3 – (медленное)
HCO 3 – + OH – ⇌ CO 3 2- + H 2 O (FAST) между ph 8 и 10, 100034 + H 2 O (FAST) между pH 8 и 10, 10, H 2 O (FAST). указанные выше равновесные реакции являются значительными.
Дополнительная информация по этой теме
оксикислоты: Угольная кислота и карбонатные соли
Угольная кислота (h3CO3) образуется в небольших количествах, когда ее ангидрид, диоксид углерода (CO2), растворяется в. ..
..
Углекислота играет роль в формировании пещер и пещерных образований, таких как сталактиты и сталагмиты. Самые большие и наиболее распространенные пещеры образуются в результате растворения известняка или доломита под действием воды, богатой углекислотой, полученной в результате недавних дождей. Кальцит в сталактитах и сталагмитах происходит из вышележащего известняка вблизи границы раздела коренной породы и почвы. Дождевая вода, просачивающаяся через почву, поглощает углекислый газ из богатой углекислым газом почвы и образует разбавленный раствор угольной кислоты. Когда эта кислая вода достигает основания почвы, она вступает в реакцию с кальцитом в известняковой породе и переводит часть его в раствор. Вода продолжает свой нисходящий поток через узкие трещины и трещины в ненасыщенной зоне с незначительной дальнейшей химической реакцией. Когда вода выходит из свода пещеры, углекислый газ теряется в атмосфере пещеры, а часть карбоната кальция выпадает в осадок. Проникающая вода действует как кальцитовый насос, удаляя его с верхней части коренной породы и повторно откладывая в пещере внизу.
Угольная кислота играет важную роль в переносе углекислого газа кровью. Углекислый газ поступает в кровь в тканях, потому что его местное парциальное давление больше, чем его парциальное давление в крови, протекающей через ткани. Когда углекислый газ попадает в кровь, он соединяется с водой с образованием угольной кислоты, которая диссоциирует на ионы водорода (H + ) и ионы бикарбоната (HCO 3 – ). Высвобождаемые ионы водорода минимально влияют на кислотность крови, поскольку белки крови, особенно гемоглобин, являются эффективными буферными агентами. (Буферный раствор сопротивляется изменению кислотности за счет соединения с добавленными ионами водорода и, по существу, их инактивации.) Естественное превращение двуокиси углерода в угольную кислоту — относительно медленный процесс; однако карбоангидраза, белковый фермент, присутствующий внутри эритроцита, катализирует эту реакцию с достаточной скоростью, чтобы она выполнялась всего за доли секунды. Поскольку фермент присутствует только внутри эритроцита, бикарбонат накапливается в нем в гораздо большей степени, чем в плазме. Способность крови переносить углекислый газ в виде бикарбоната усиливается за счет системы переноса ионов внутри мембраны эритроцитов, которая одновременно перемещает ион бикарбоната из клетки в плазму в обмен на ион хлорида. Одновременный обмен этих двух ионов, известный как хлоридный сдвиг, позволяет использовать плазму в качестве места хранения бикарбоната без изменения электрического заряда ни плазмы, ни эритроцита. Только 26 процентов общего содержания углекислого газа в крови находится в виде бикарбоната внутри эритроцита, а 62 процента существует в виде бикарбоната в плазме; однако основная масса ионов бикарбоната сначала образуется внутри клетки, а затем транспортируется в плазму. Обратная последовательность реакций возникает, когда кровь достигает легких, где парциальное давление углекислого газа ниже, чем в крови.
Поскольку фермент присутствует только внутри эритроцита, бикарбонат накапливается в нем в гораздо большей степени, чем в плазме. Способность крови переносить углекислый газ в виде бикарбоната усиливается за счет системы переноса ионов внутри мембраны эритроцитов, которая одновременно перемещает ион бикарбоната из клетки в плазму в обмен на ион хлорида. Одновременный обмен этих двух ионов, известный как хлоридный сдвиг, позволяет использовать плазму в качестве места хранения бикарбоната без изменения электрического заряда ни плазмы, ни эритроцита. Только 26 процентов общего содержания углекислого газа в крови находится в виде бикарбоната внутри эритроцита, а 62 процента существует в виде бикарбоната в плазме; однако основная масса ионов бикарбоната сначала образуется внутри клетки, а затем транспортируется в плазму. Обратная последовательность реакций возникает, когда кровь достигает легких, где парциальное давление углекислого газа ниже, чем в крови.
Редакторы Британской энциклопедии Эта статья была недавно отредактирована и обновлена Эриком Грегерсеном.
Понимание уравнения окисления океана и его биологического воздействия
Последствия изменения климата уже ощущаются во всем мире. Эти воздействия простираются от плохого качества воздуха до поврежденных мест обитания во всей окружающей среде. Среди основных причин изменения климата — закисление океана , из-за которого океаны во всем мире становятся более кислыми, чем когда-либо.
Даже если вы слышали об окислении океана, вы можете не знать, что этот процесс на самом деле начинается не в океане. Подкисление происходит при попадании в атмосферу избыточного количества двуокиси углерода. В то время как углекислый газ необходим для естественных процессов, таких как фотосинтез, закисление океана происходит, когда углекислый газ образуется быстрее, чем он может эффективно поглощаться. Этот процесс создает проблемы для океанских экосистем и морской жизни, обитающей в океанах по всему миру.
Хотя процесс подкисления океана может быть трудным для понимания, вы можете легче понять, что это такое, взглянув на уравнение CO2 + h3O -> (H+) + (HCO3-) .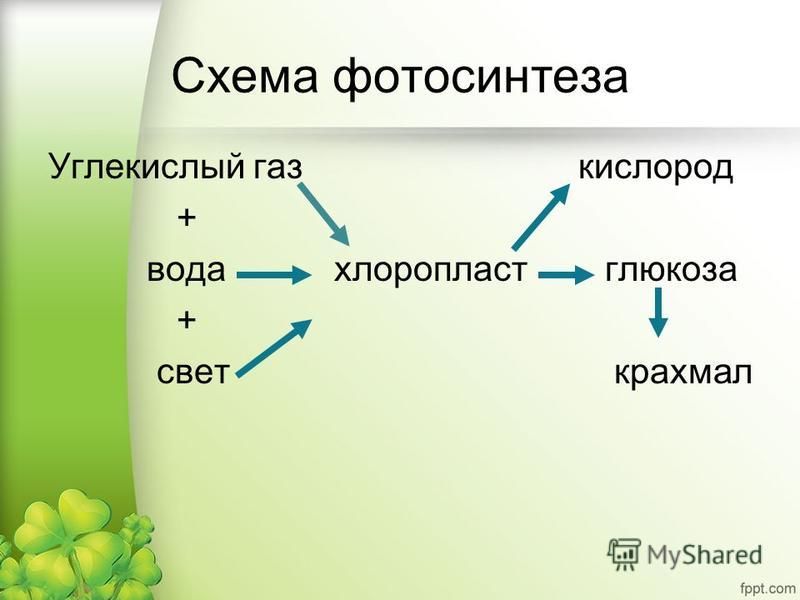 Когда углекислый газ достигает океанской воды, он образует так называемую угольную кислоту. Затем соединение распадается на ионы водорода и бикарбонат, первый из которых делает океаны более кислыми.
Когда углекислый газ достигает океанской воды, он образует так называемую угольную кислоту. Затем соединение распадается на ионы водорода и бикарбонат, первый из которых делает океаны более кислыми.
В этой статье рассказывается о закислении океана и о том, как оно напрямую влияет на окружающую среду и жизнь в океанах.
Расшифровка уравнения окисления океана
Чтобы лучше понять, что такое окисление океана, важно знать уравнение, лежащее в основе этого процесса. Само уравнение выглядит так: CO2 + h3O -> (H+) + (HCO3-). Закисление океана — это процесс, который возникает в результате поглощения водой слишком большого количества углекислого газа. Углекислый газ — это CO2 в уравнении. Молекулы воды, с которыми реагирует углекислый газ, в уравнении представляют собой h3O.
При протекании этой реакции образуется угольная кислота, имеющая формулу h3CO3. Соединение угольной кислоты далее распадается на бикарбонат и ион водорода, формулы которых HCO3- и H+ соответственно. Накопление ионов водорода в воде приводит к тому, что вода в океане становится более кислой. Однако молекула бикарбоната также вызывает ряд проблем с морской жизнью.
Накопление ионов водорода в воде приводит к тому, что вода в океане становится более кислой. Однако молекула бикарбоната также вызывает ряд проблем с морской жизнью.
Основы химии окисления океана
Углекислый газ — это химическое вещество, которое естественным образом присутствует в воздухе и необходимо для протекания различных процессов. Например, процесс фотосинтеза, необходимый растениям для роста и сохранения здоровья, осуществляется только при поглощении определенного количества углекислого газа. Однако при сжигании топлива образуется значительное количество углекислого газа, который затем выбрасывается в атмосферу. Этот углекислый газ соединяется с углекислым газом, который образуется при дыхании животных.
В настоящее время имеется больше углекислого газа в атмосфере , чем когда-либо прежде. Большая часть углекислого газа остается в атмосфере и медленно поглощает солнечное тепло. CO2, который в настоящее время находится в атмосфере, создал оболочку вокруг Земли, которая вызывает повышение температуры.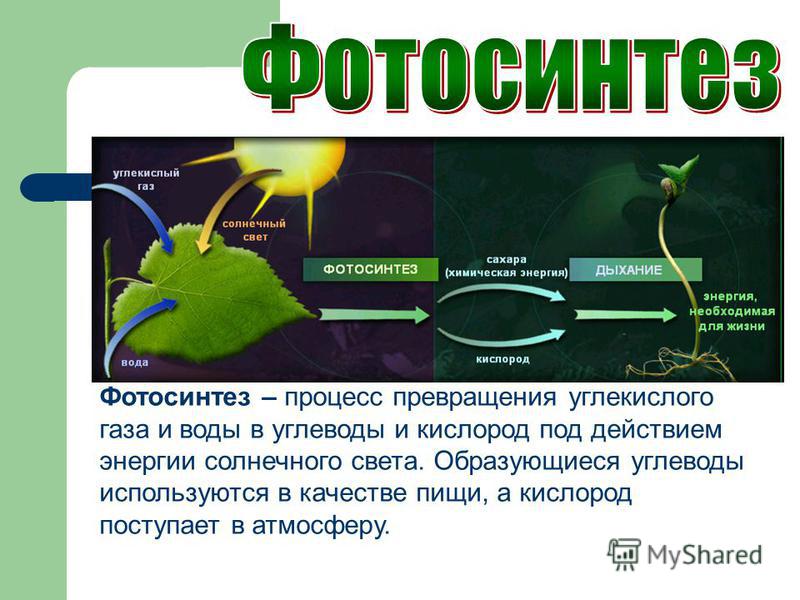 В то время как большая часть углекислого газа остается в атмосфере, около 30 процентов его выпадает в океанскую воду, после чего он распадается на более мелкие молекулы CO2, которые в конечном итоге объединяются с другими.
В то время как большая часть углекислого газа остается в атмосфере, около 30 процентов его выпадает в океанскую воду, после чего он распадается на более мелкие молекулы CO2, которые в конечном итоге объединяются с другими.
При выполнении упомянутого выше уравнения уровень pH в морской воде начинает падать, в результате чего вода становится более кислой. Некоторые из факты, касающиеся закисления океана , о которых вам следует знать, включают:
- Океаны не являются естественными кислыми веществами, и на самом деле их текущее значение pH равно 8,06, что является слегка щелочным
- Уровни рН в океанской воде продолжают падать, что делает воду более кислой, хотя показания все еще показывают щелочные показатели
- Океаны способны поглощать углекислый газ непосредственно из атмосферы
- Углекислый газ уменьшает количество ионов карбоната в воде, что затрудняет выживание раковинных организмов, таких как кораллы и моллюски
- Углекислый газ снижает pH при взаимодействии с водой и вызывает образование ионов водорода, что является процессом, который привел к повышению кислотности на 30-35 процентов с тех пор, как произошла индустриализация
- Изменения значительны и происходят быстрыми темпами
В сочетании с загрязнением закисление океана может нанести серьезный ущерб, поэтому очистные сооружения необходимы для того, чтобы часть воды в круговороте воды оказывала минимальное воздействие на окружающую среду.
Биологическое воздействие закисления океана
Биологическое воздействие закисления океана существенное . В то время как морские травы и некоторые водоросли извлекают выгоду из более высоких количеств CO2, почти все другие аспекты океанской экосистемы ухудшаются из-за закисления океана. Например, птероподы — это маленькие морские существа, которых обычно называют морскими бабочками. Когда птероподов помещают в воду с уровнем карбонатов и pH, которые соответствуют прогнозам на 2100 год, оболочка, окружающая птераподов, растворяется всего за 45 дней.
Кораллы — это морские организмы, создающие собственные скелеты и раковины из карбоната кальция. Когда количество углекислого газа увеличивается в океанской воде, содержание карбоната кальция уменьшается, что приводит к тому, что кораллы и подобные им организмы испытывают трудности в создании своих скелетов. В то время как большинство негативных последствий закисления океана затрагивает панцирные организмы, этот процесс негативно влияет на всю морскую жизнь. Всем видам требуется время, чтобы приспособиться к новому уровню рН в воде. Однако углекислый газ достигает океанской воды с очень высокой скоростью, что не дает морской жизни достаточно времени, чтобы адаптироваться к изменениям в воде.
Всем видам требуется время, чтобы приспособиться к новому уровню рН в воде. Однако углекислый газ достигает океанской воды с очень высокой скоростью, что не дает морской жизни достаточно времени, чтобы адаптироваться к изменениям в воде.
Что касается людей, подкисление океана влияет на пищу, которую мы едим, в первую очередь, нарушая способность организмов с панцирем создавать свои раковины. Ущерб, который подкисление наносит коралловым рифам, также проблематичен из-за роли, которую эти рифы играют в медицине, туризме, продовольствии и защите побережья. В настоящее время закисление океана является новой проблемой во всем мире , которая будет продолжать оказывать негативное воздействие на океан, если не будут приняты существенные меры.
Почему кислотность океана имеет значение?
Большинство химических реакций могут значительно измениться даже при небольшом изменении уровня pH . Например, нормальный уровень рН крови находится в пределах 7,35-7,45. Если эти уровни упадут всего на 0,2-0,3, кто-то может впасть в кому или страдать от припадка. То же самое происходит, когда океанская вода становится все более и более кислой. Как упоминалось ранее, вероятно, самая опасная проблема более низких уровней pH заключается в том, что некоторые морские существа не могут строить свои скелеты.
Если эти уровни упадут всего на 0,2-0,3, кто-то может впасть в кому или страдать от припадка. То же самое происходит, когда океанская вода становится все более и более кислой. Как упоминалось ранее, вероятно, самая опасная проблема более низких уровней pH заключается в том, что некоторые морские существа не могут строить свои скелеты.
Организмы с панцирем нуждаются в карбонат-ионах для завершения этих процессов, но не могут извлекать эти ионы из бикарбоната, образующегося при подкислении океана. Вы должны заботиться о кислотности океана, потому что она негативно влияет на всю экосистему океана. Чтобы эта экосистема оставалась здоровой в долгосрочной перспективе, необходимо уменьшить закисление океана и существенно уменьшить загрязнение. В противном случае морская жизнь продолжит страдать, что скажется на всем.
Будущее наших океанов
Чтобы поддерживать закисление океана и, в конечном итоге, повышать уровень pH, важно стабилизировать количество углекислого газа в атмосфере . Как только углекислый газ достигнет оптимального уровня, pH в океанской воде вернется к своим нормальным значениям. В прошлом океаны могли приспосабливаться к постепенным изменениям уровня pH. Однако в настоящее время уровни падают слишком быстро, поэтому необходимо принять дополнительные меры для защиты будущего океанов.
Как только углекислый газ достигнет оптимального уровня, pH в океанской воде вернется к своим нормальным значениям. В прошлом океаны могли приспосабливаться к постепенным изменениям уровня pH. Однако в настоящее время уровни падают слишком быстро, поэтому необходимо принять дополнительные меры для защиты будущего океанов.
Два основных шага, которые мы можем предпринять, включают:
- Сокращение выбросов углерода
- Геоинженерия
Еще в 2013 году выбросы углерода достигли 400 промилле в атмосферу, что намного выше безопасного уровня в 350 промилле. Если бы океаны не поглощали значительное количество углекислого газа, по оценкам, уровень CO2 в атмосфере достиг бы 475 частей на миллион.
Вероятно, самый простой способ сократить выбросы углерода — это найти дополнительные поглотители углерода и сжигать меньшее количество ископаемого топлива . Поглотители углерода можно получить путем выращивания болот и мангровых зарослей.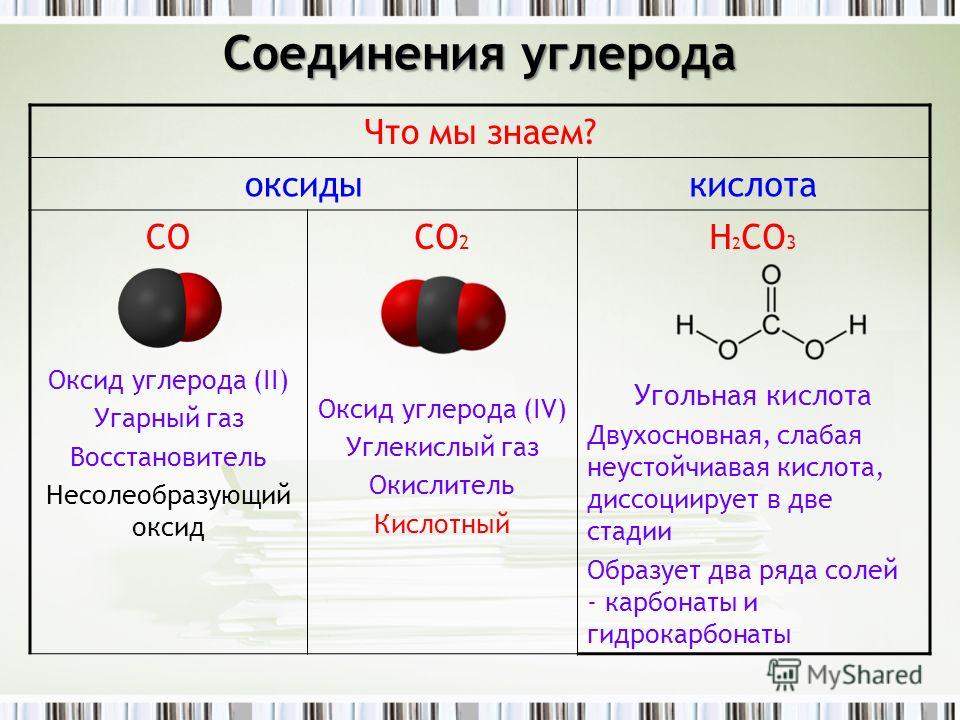 Даже если эти меры будут приняты немедленно, для полной стабилизации углекислого газа потребуются сотни тысяч лет.
Даже если эти меры будут приняты немедленно, для полной стабилизации углекислого газа потребуются сотни тысяч лет.
Что касается геоинженерии , то этот процесс фактически включает в себя разработку технологий, которые могут уменьшить содержание углекислого газа в атмосфере. Чтобы геоинженерия была жизнеспособной, планетарными системами необходимо управлять. Например, один из методов геоинженерии включает отражение солнечного света обратно в космос прямо из атмосферы. Это только уменьшит количество углекислого газа, достигающего атмосферы, без уменьшения количества, которое уже находится в атмосфере. Другая форма геоинженерии включает в себя выращивание большего количества организмов, которым для выживания требуется углекислый газ, включая фитопланктон. Этот конкретный метод сможет избавиться от некоторого количества избыточного углекислого газа, который в настоящее время находится в атмосфере.
Что вы можете сделать?
Закисление океана влияет как на морскую жизнь, так и на жизнь человека. Если вы заинтересованы в том, чтобы внести свой вклад в защиту окружающей среды и уменьшить количество выбросов углерода в атмосферу, вы можете делать множество вещей каждый день, чтобы уменьшить последствия. Во-первых, убедитесь, что вы максимально сокращаете потребление энергии, используя общественный транспорт, выключая свет, когда вы им не пользуетесь, и перерабатывая отходы. Вы также можете поддерживать чистую энергию, когда это возможно, что может включать установка солнечных панелей на крышу.
Если вы заинтересованы в том, чтобы внести свой вклад в защиту окружающей среды и уменьшить количество выбросов углерода в атмосферу, вы можете делать множество вещей каждый день, чтобы уменьшить последствия. Во-первых, убедитесь, что вы максимально сокращаете потребление энергии, используя общественный транспорт, выключая свет, когда вы им не пользуетесь, и перерабатывая отходы. Вы также можете поддерживать чистую энергию, когда это возможно, что может включать установка солнечных панелей на крышу.
Ваша главная цель должна состоять в том, чтобы уменьшить свой углеродный след, который можно измерить на этом веб-сайте. Подумайте о том, чтобы взять то, что вы узнали из этой статьи, и рассказать об этом своим друзьям и семье. Если они узнают о подкислении океана и его неблагоприятных последствиях для всех, они также могут захотеть внести свой вклад в сокращение выбросов углерода.
Реакция нескольких элементов – Lambda Geeks
CO2 — это молекулярная формула двуокиси углерода. В этой статье мы должны обсудить CO2+ h3O в деталях с реакциями некоторых других элементов.
В этой статье мы должны обсудить CO2+ h3O в деталях с реакциями некоторых других элементов.
Углекислый газ (CO2) представляет собой газообразную молекулу. Это газообразная молекула без запаха. Но при высоких концентрациях запах резкий и кислый. Плотность углекислого газа почти в 1,5 раза больше плотности воздуха. Плотность 1,98 кг/м 3 . Молекулярная масса составляет 44,009 г/моль. Поскольку это газообразная молекула, она имеет определенное давление паров, имеющее значение 5,72 МПа при температуре 30 0 C.
Реакционная способность Углекислый газ является высокореакционноспособной молекулой, поскольку он содержит двойную связь, и эта двойная связь может быть легко расщеплена соответствующей атакой нуклеофилоподобной воды (h30). Значение pka двуокиси углерода составляет 6,53, поэтому он слегка кислый и реагирует с основанием или нуклеофилом.
Молекулярная структура двуокиси углерода Что такое CO2 + h3O? CO2 + h3O оба являются химическими или молекулярными формулами. CO2 — это молекулярная формула углекислого газа, а h3O — это молекулярная формула воды.
CO2 — это молекулярная формула углекислого газа, а h3O — это молекулярная формула воды.
Двуокись углерода может быть быстро растворима в воде в процессе адсорбции и медленно ионизируется в водной среде. Поскольку он имеет слегка кислый характер, он может образовывать кислоту в водном растворе. Углекислый газ не ионизируется, как C + или О 2 – . Он растворяется в водном растворе и делает весь раствор кислым, а затем этот кислый раствор ионизируется.
Эта реакция является простой реакцией присоединения или реакцией комбинирования, поэтому для протекания всей реакции не требуется какой-либо катализатор. Реакция может протекать только сама по себе. Вода выступает здесь как среда, в которой углекислый газ может растворяться и ионизироваться или образовывать какую-либо кислоту или кислый раствор.
Что происходит, когда CO2 реагирует с h3O? Когда любая слегка кислая молекула растворяется в воде или реагирует с водой, обычно весь раствор становится кислым, потому что вода является нейтральной молекулой.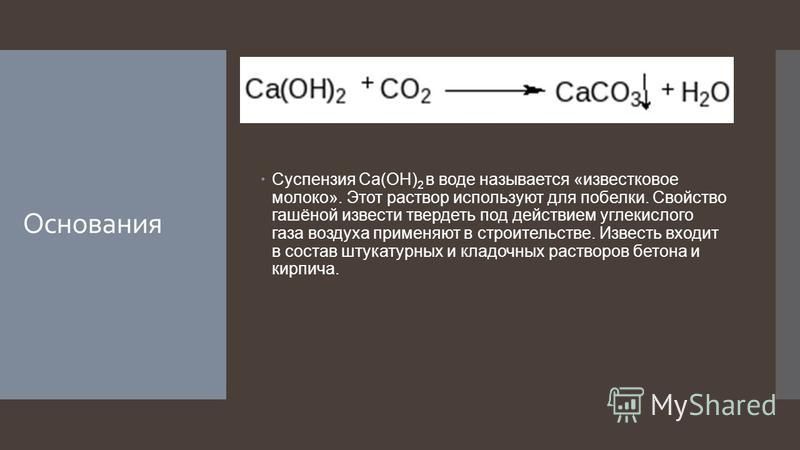 В зависимости от характера кислотности этой конкретной молекулы определяется кислотность всего раствора нового продукта.
В зависимости от характера кислотности этой конкретной молекулы определяется кислотность всего раствора нового продукта.
В этой реакции CO2 + h30 ожидается образование кислотного соединения.
Углекислый газ имеет слабокислую реакцию, значение pka равно 6,53. тогда как вода является нейтральной молекулой по шкале pk. Так, когда углекислый газ попадает в реакцию с водой или растворяется в воде, весь раствор становится кислым или происходит образование кислого соединения. Углекислый газ не может ионизироваться в водной среде, он реагирует с водой, а затем медленно ионизируется.
Вода действует как раствор или реакционная среда. Можно предположить, что механизм реакции состоит в том, что неподеленные пары молекул воды над атомами О доступны, и они атакуют двойник между углеродом и кислородом в углекислом газе. Затем происходит расщепление двойной связи, и гидроксидная группа включается между двойной связью между углеродом и кислородом в диоксиде углерода.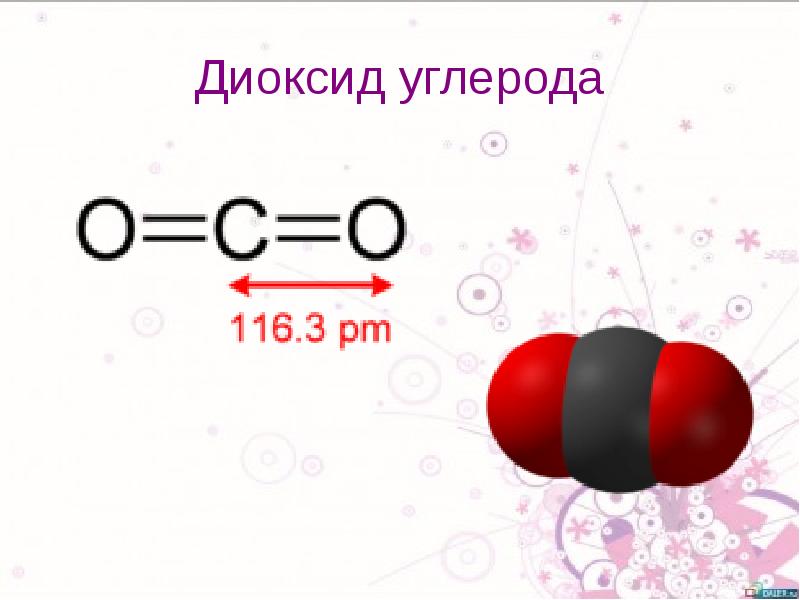
Вода представляет собой окаймляющую молекулу и может вести себя как кислота или щелочь в зависимости от характера реакции. Вода может ионизировать H + и OH – . Мы знаем, что гидроксид является сильным нуклеофилом и основанием.
Но здесь углекислота менее кислая, но C=O лучший электрофильный центр. Так что туда может атаковать любой вид нуклеофила. Гидроксид является одним из лучших нуклеофильных центров, поэтому он может атаковать этот электрофильный центр, и двойная связь может быть расщеплена, а группа ОН присоединена, а оставшийся H 9Ион 0033 + также присоединен к другому участку O – углекислого газа.
Какая реакция CO2 + h3O?CO2 + h3O представляет собой комбинированный тип реакции или, можно сказать, просто реакцию присоединения.
Мы не можем сказать, что CO2 + h3O является типичной кислотно-щелочной реакцией, потому что углекислый газ растворяется в воде и затем образует кислое соединение угольную кислоту. Здесь вода не является основой, здесь она действует как среда. Но можно предположить, что механизм гидроксид-иона атакует электрофильный центр двуокиси углерода и разрывает двойную связь и присоединенную ОН-группу, а ион Н+ координируется с О- с образованием h3CO3. Так что по-другому эту реакцию можно назвать реакцией нуклеофильного присоединения.
Здесь вода не является основой, здесь она действует как среда. Но можно предположить, что механизм гидроксид-иона атакует электрофильный центр двуокиси углерода и разрывает двойную связь и присоединенную ОН-группу, а ион Н+ координируется с О- с образованием h3CO3. Так что по-другому эту реакцию можно назвать реакцией нуклеофильного присоединения.
Каждая химическая реакция должна быть правильно сбалансирована по стехиометрическому значению. Без надлежащего балансирования реакция недействительна, потому что мы не можем понять, сколько реакций необходимо, чтобы прореагировать, сколько других реагентов и сколько продукта мы получим.
Сбалансируем уравнение CO2 + h3O,
CO2 + h3O = h3CO3, мы видим, что это уравнение уже уравновешено. Здесь левая и правая стороны должны быть равны.
Итак, реакция CO2 + h3O должна быть уравновешена фактическим методом. Есть много шагов, которые мы должны выполнить, чтобы сбалансировать химическую реакцию.
Есть много шагов, которые мы должны выполнить, чтобы сбалансировать химическую реакцию.
Этап 1. Каждая отдельная молекула или соединение помечается буквами a, b, c, x, y или z в зависимости от количества молекул, участвующих в реакции.
Мы используем коэффициенты, помеченные как коэффициент каждой отдельной молекулы с этой переменной, чтобы идентифицировать неидентифицированный коэффициент молекулы.
(A)CO2 + (B) h3O = (C) h3CO3
Шаг 2. Мы составляем некоторые уравнения для системы счисления
Это уравнение создается с использованием подходящих чисел этого коэффициента для каждого присутствующего элемента в реагенте и продукте, таких как углерод, водород и кислород.
C = A = B
H = 2B = 2C
O = 2A + B = 3C
Все переменные должны быть решены в различных методах.
Решите все переменные этого коэффициента с помощью метода исключения Гаусса или метода определения.
Использование Гаусса Элиминация или замены
A – B = 0
2B – 2C = 0
2A + B – 3C = 0
Таким эти переменные.
A = 1 (CO2)
B = 1 (h3O)
C = 1 (h3CO3)
Шаг 4 – На последнем шаге подставьте коэффициенты и проверьте результат L.H.S. и Р.Х.С.
1 CO2 + 1 ч30 = 1 ч3CO3
| Атомы | Р.Х.С. | |
| C | 1 | 1 |
| H | 2 | 2 |
| O | 3 | 3 |
SO, CO2 + H3O = H3CO3 является уравнением, а L. H.S. равен R.H.S.
H.S. равен R.H.S.
Реакция CO2 + h3O = C6h22O6 + O2 не сбалансирована должным образом, поэтому мы должны правильно сбалансировать это уравнение.
Итак, мы начинаем решать уравнение баланса, используя маркировку отдельных молекул.
(A)CO2 + (B)h3O = (C) C6h22O6 + (D)O2
Теперь мы составили числовое уравнение для коэффициента для каждого атома.
C = A = 6C
H = 2B = 12C
O = 2A + B = 6C + 2D
Теперь, используя исключение Гаусса, получаем
A – 6C = 0
2B2A + B – 6C – 2D = 0
Теперь результат, который показывает наименьшее целое число,
A = 6 (CO2)
B = 6 (h3O)
C = 1 (C6h22O6)
D = 6 (O2)
На последнем шаге подставляем коэффициент и проверяем результат L. H.S. и Р.Х.С.
H.S. и Р.Х.С.
6 CO2 + 6 h3O = C6h22O6 + 6 O2
Атомы L.H.S. Р.Х.С.
C 6 6
H 12 12
O 18 18
SO, 6CO2 + 6H3O = C6H22O6 + 6O2 – сбалансированное уравнение, а L.H.S. равен R.H.S.
Итак, 6CO2 + 6h3O = C6h22O6 + 6O2 сбалансированы должным образом.
Как сбалансировать CO2+h3O=C2h3+O2?Реакция CO2 + h3O = C2h3 + O2 не сбалансирована должным образом, и мы должны ее правильно сбалансировать.
Помечая каждую отдельную молекулу, мы получаем
(A)CO2 + (B)h3O = (C)C2h3 + (D)O2
Теперь мы составили числовое уравнение для коэффициента для каждого атома
C = A = 2C
H = 2B = 2C
O = 2A + B = 2D
Теперь, используя исключение Гаусса, мы получаем,
A – 2C = 0
2B – 2C = 0
2A + B – 2D = 0 При вычислении
90 получить значения,A = 4 (CO2)
B = 2 (h3O)
C = 2 (C2h3)
D = 5 (O2)
На последнем шаге подставляем коэффициент и проверяем результат L.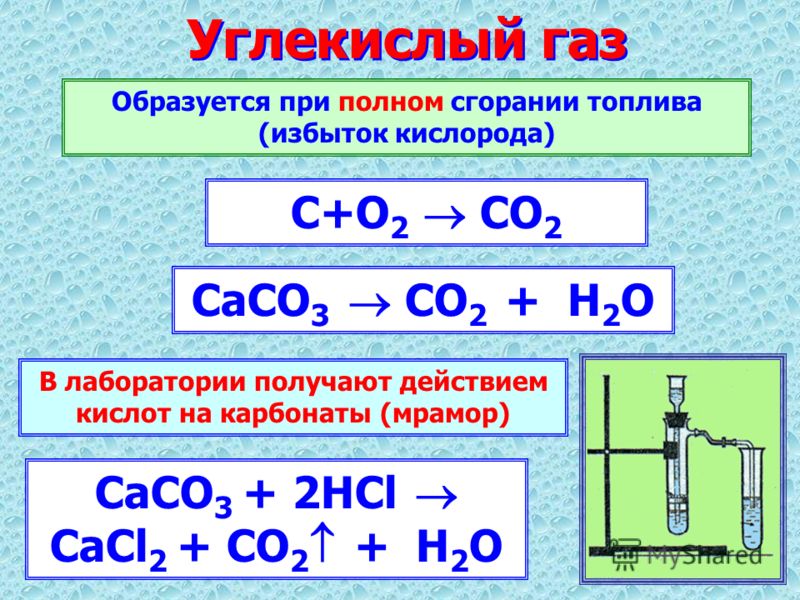 H.S. и Р.Х.С.
H.S. и Р.Х.С.
4 CO2 +2 h3O = 2 C2h3 + 5 O2
Атомы L.H.S. Р.Х.С.
C 4 4
H 4 4
O 10 10
Итак, 4CO2 + 2H3O = 2C2H3 + 5O2 – сбалансированное уравнение, а L.H.S. равен R.H.S.
Как сбалансировать CO2 + h3O = C2H6 + O2?CO2 + h3O = C2H6 + O2 реакция не сбалансирована должным образом, поэтому мы должны правильно сбалансировать это уравнение .
Итак, мы начинаем решать уравнение баланса, используя маркировку отдельных молекул.
(A)CO2 + (B)h3O = (C)C2H6 + (D)O2
Теперь мы составили числовое уравнение для коэффициента для каждого атома.
C = A = 2C
H = 2B = 2C
O = 2A + B = 2D
Теперь, используя исключение Гаусса, получаем, 2A + B – 2D = 0
Теперь результат, который показывает наименьшее целое число,
A = 4 (CO2)
B = 6 (h3O)
C = 2 (C2H6)
D = 7 (O2)
На последнем шаге подставляем коэффициент и проверяем результат L. H.S. и Р.Х.С.
H.S. и Р.Х.С.
4 CO2 + 6 h3O = 2 C2H6 + 7 O2
Атомы L.H.S. Р.Х.С.
C 4 4
H 12 12
O 14 14
Итак, 4CO2 + 6H3O = 2C2H6 + 7O2 – сбалансированное уравнение, а L.H.S. равен R.H.S.
Как сбалансировать Ch4OH + O2 = CO2 + h3O?Ch4OH + O2 = CO2 + h3O реакция не сбалансирована должным образом, поэтому мы должны правильно сбалансировать это уравнение .
Итак, мы начинаем решать уравнение баланса, используя маркировку отдельных молекул.
(A)Ch4OH + (B)O2 = (C)CO2 + (D)h3O
Теперь мы составили числовое уравнение для коэффициента для каждого атома.
C = A = C
H = 4A = 2D
O = A + 2B = 2C + D
Итак, в этой реакции числа H и O не сбалансированы, поэтому мы должны сбалансировать все уравнение, но первоочередной задачей является сбалансировать H и O вместе с C.
Теперь, используя исключение Гаусса, мы получаем,
A – C = 0
4A – 2D = 0
A + 2B -2C -D = 0
Теперь результат, который показывает наименьшее целое число,
A = 4 (Ch4OH)
B = 6 (O2)
(CO2)
D = 8 (h3O)
На последнем шаге подставляем коэффициент и проверяем результат L.H.S. и Р.Х.С.
4 Ch4OH + 6 O2 = 4 CO2 + 8 h3O
Атомы L.H.S. Р.Х.С.
C 4 4
H 16 16
O 16 16
SO, 4CH4OH + 6O2 = 4CO2 + 8H3O – это балансированное уравнение, а L.H.HS. равен R.H.S.
Заключение Реакция CO2 + h3O является примером реакции присоединения или можно сказать, что в конкретной реакции нуклеофильного присоединения. В качестве нуклеофила здесь выступает ион гидроксида из молекулы воды. Чтобы сбалансировать реакцию CO2 + h3O, нам нужно знать, сколько реагентов будет реагировать, чтобы произвести сколько продуктов, и в соответствии с этим стехиометрическим расчетом будет измерен вес реагентов. Даже при неизвестной реакции мы можем знать, сколько реагентов потребуется, поэтому балансировка уравнения очень важна.
В качестве нуклеофила здесь выступает ион гидроксида из молекулы воды. Чтобы сбалансировать реакцию CO2 + h3O, нам нужно знать, сколько реагентов будет реагировать, чтобы произвести сколько продуктов, и в соответствии с этим стехиометрическим расчетом будет измерен вес реагентов. Даже при неизвестной реакции мы можем знать, сколько реагентов потребуется, поэтому балансировка уравнения очень важна.
Химия поп-музыки | Поговорим о науке
AB Химия 20 (2007 г., обновление 2014 г.) 11 Блок B: Формы вещества: газы
AB Химия 20 (2007 г., обновление 2014 г.) 11 Модуль C: Вещество в виде растворов, кислот и оснований
AB Химия 30 (2007 г., обновление 2014 г.) 12 Раздел D: Химическое равновесие с акцентом на кислотно-основные системы
AB Наука о знаниях и трудоустройстве 10-4 (2006) 10 Блок A: Исследование свойств материи
AB Наука о знаниях и трудоустройстве 20–4 (2006 г.) 11 Раздел A: Применение материи и химических изменений
АВ
Наука о знаниях и трудоустройстве 8, 9 (пересмотрено в 2009 г. )
9
Модуль C: Химия окружающей среды
)
9
Модуль C: Химия окружающей среды
AB Наука 10 (2005 г., обновлено в 2015 г.) 10 Блок A: Энергия и материя в химическом изменении
AB Наука 14 (2003 г., обновлено в 2014 г.) 10 Блок A: Исследование свойств материи
AB Наука 20 (2007 г., обновлено в 2014 г.) 11 Блок A: химические изменения
AB Наука 24 (2003 г., обновлено в 2014 г.) 11 Блок A: Применение вещества и химических изменений
AB Наука 7-8-9(2003 г., обновлено в 2014 г.) 9 Модуль C: Экологическая химия
до н.э. Химия 11 (июнь 2018 г.) 11 Большая идея: материя и энергия сохраняются в химических реакциях.
до н.э. Химия 11 (июнь 2018 г.) 11 Большая идея: растворимость в растворе определяется природой растворенного вещества и растворителя.
до н.э. Химия 11 (июнь 2018 г.) 11 Большая идея: моль — это величина, используемая для того, чтобы сделать атомы и молекулы измеримыми.
до н.э.
Химия 12 (июнь 2018 г.)
12
Большая идея: Сила кислоты или основания зависит от степени диссоциации ионов.
до н.э. Химия 12 (июнь 2018 г.) 12 Большая идея: динамическое равновесие может быть смещено изменением окружающих условий.
до н.э. Химия 12 (июнь 2018 г.) 12 Большая идея: насыщенные растворы — это системы, находящиеся в равновесии.
до н.э. Естествознание 10 класс (март 2018 г.) 10 Большая идея: требуется изменение энергии, поскольку атомы перестраиваются в химических процессах.
МБ Химия 11 класс (2006) 11 Тема 2: Газы и атмосфера
МБ Химия 11 класс (2006) 11 Тема 4: Решения
МБ Химия 12 класс (2013) 12 Тема 1: Реакции в водных растворах
MB Химия 12 класс (2013) 12 Тема 4: Химическое равновесие
МБ Химия 12 класс (2013) 12 Тема 5: Кислоты и щелочи
MB Старший 2 науки (2001) 10 Кластер 2: Химия в действии
NB Химия 111/112 (2009) 11 Блок 2: Стехиометрия
NB Химия 121/122 (2009) 12 Модуль 2: От решений к кинетике к равновесию
NB Химия 121/122 (2009 г.)) 12 Раздел 3: Кислоты и основания
NB
Chimie 11e Année 52311/52312 (2007) (только на французском языке)
11
1. Matiere et liaisons
Matiere et liaisons
NB Chimie 11e Année 52311/52312 (2007) (только на французском языке) 11 3. Растворы
Примечание. Chimie 11e Année 52311/52312 (2007) (только на французском языке) 11 4. Газ
НБ Наука 10 класс (2002) 10 Физические науки: химические реакции
NL Химия 2202 (2018) 11 Блок 1: Стехиометрия
NL Химия 2202 (2018) 11 Модуль 2: От структур к свойствам
Нидерланды Химия 3202 (2005) 12 Модуль 1: От кинетики к равновесию
NL Химия 3202 (2005) 12 Раздел 2: Кислоты и основания
NL Наука 1206 (2018) 10 Блок 2: Химические реакции
NL Наука 3200 (2005) 12 Блок 1: Химические реакции
NL Наука 7 класс (2013) 7 Блок 3: Смеси и растворы
NS Химия 12 (2009, 2019) 12 Кислоты и основания
NS Химия 12 (2009, 2019) 12 Решения, кинетика и равновесие
NS Наука 1 (2019) 1 Науки о жизни: потребности живых существ
NS Наука 10 (2012, 2019) 10 Физические науки: химические реакции
NT
Химия 20 (Альберта, 2007 г. , обновлено в 2014 г.)
11
Блок B: Формы вещества: газы
, обновлено в 2014 г.)
11
Блок B: Формы вещества: газы
NT Химия 20 (Альберта, 2007 г., обновлено в 2014 г.) 11 Модуль C: Вещество в виде растворов, кислот и оснований
NT Химия 30 (Альберта, 2007 г., обновлено в 2014 г.) 12 Модуль D: Химическое равновесие с акцентом на кислотно-основные системы
NT Наука о знаниях и трудоустройстве 10-4 (Альберта, 2006 г.) 10 Модуль A: Исследование свойств материи
НТ Наука о знаниях и трудоустройстве 20–4 (Альберта, 2006 г.) 11 Модуль A: Применение материи и химических изменений
NT Наука о знаниях и трудоустройстве 9 (Альберта, редакция 2009 г.) 9 Модуль C: Химия окружающей среды
NT Science 10 (Альберта, 2005 г., обновлено в 2015 г.) 10 Модуль A: Энергия и материя в химическом изменении
NT Наука 14 (Альберта, 2003 г., обновлено в 2014 г.) 10 Модуль A: Исследование свойств материи
NT Science 20 (Альберта, 2007 г., обновлено в 2014 г.) 11 Блок А: Химические изменения
НТ
Наука 24 (Альберта, 2003 г.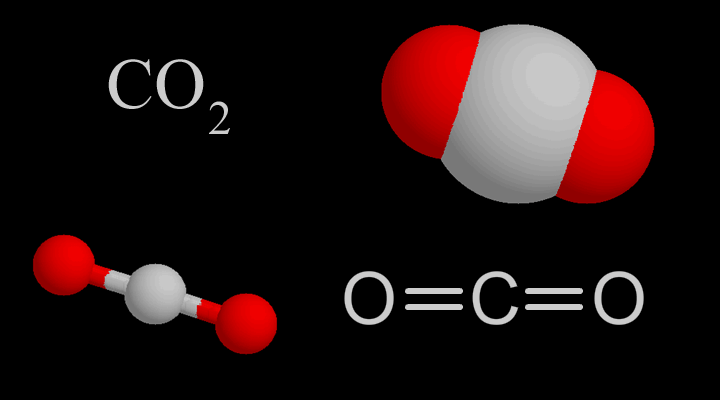 , обновлено в 2014 г.)
11
Модуль A: Применение вещества и химических изменений
, обновлено в 2014 г.)
11
Модуль A: Применение вещества и химических изменений
NU Химия 20 (Альберта, 2007 г., обновлено в 2014 г.) 11 Блок B: Формы вещества: газы
NU Химия 20 (Альберта, 2007 г., обновлено в 2014 г.) 11 Модуль C: Материя в виде растворов, кислот и оснований
NU Химия 30 (Альберта, 2007 г., обновлено в 2014 г.) 12 Модуль D: Химическое равновесие с акцентом на кислотно-основные системы
NU Наука о знаниях и трудоустройстве 10-4 (2006) 10 Модуль A: Исследование свойств материи
НУ Наука о знаниях и трудоустройстве 20–4 (Альберта, 2006 г.) 11 Модуль A: Применение вещества и химических изменений
NU Наука 10 (2005 г., обновлено в 2015 г.) 10 Блок A: Энергия и материя в химических изменениях
NU Наука 14 (2003 г., обновлено в 2014 г.) 10 Модуль A: Исследование свойств материи
NU Science 20 (Альберта, 2007 г., обновлено в 2014 г.) 11 Модуль A: химические изменения
NU
Наука 24 (Альберта, 2003 г., обновлено в 2014 г. )
11
Раздел A: Применение материи и химических изменений
)
11
Раздел A: Применение материи и химических изменений
ВКЛ. Химия, 11 класс, университет (СЧ4У) 11 Цепь C: Химические реакции
ON Химия, 11 класс, университет (СЧ4У) 11 Цепь E: растворы и растворимость
ON Химия, 11 класс, университет (СЧ4У) 11 Strand F: Газы и химия атмосферы
ON Химия, 12 класс, университет (СЧ5У) 12 Цепь E: Химические системы и равновесие
ON Естествознание, 10 класс, академический (SNC2D) 10 Цепь C: Химические реакции
ON Прикладные науки 10 класса (SNC2P) (2008 г.) 10 Цепь C: химические реакции и их практическое применение
ВКЛ. Наука, 12 класс, рабочее место (SNC4E) 12 Цепь C: Химические вещества в потребительских товарах
PE Химия 521А (проект 2021 г.) 11 Знание содержания: CK 2 .3
PE Химия 621А (проект 2021 г.) 12 Знание содержания: CK 2 .1
PE Химия 621А (проект 2021 г.) 12 Знание содержания: CK 2 .3
PE Химия 621А (проект 2021 г.) 12 Знание содержания: CK 3.1, 3.2, 3.3
PE
Наука 421А (2019)
10
Знание содержания: CK 2. 2
2
PE Наука 431A (без даты) 10 Модуль 2: Химические реакции
Контроль качества Прикладная наука и технологии Раздел III Материальный мир
КК Химия Раздел V Химическое равновесие
КК Химия Раздел V Газы
КК Экологические науки и технологии Раздел IV Материальный мир
QC Наука и технология Раздел I Материальный мир: Организация
QC Наука и технология Раздел II Материальный мир: Организация
QC Наука и технология Раздел III Материальный мир
КК Наука и технология Раздел IV Материальный мир
Контроль качества Наука и окружающая среда Раздел IV Материальный мир
SK Химия 30 (2016) 12 Химические равновесия
SK Физические науки 20 (2016) 11 Основы химии
YT Химия 11 (Британская Колумбия, июнь 2018 г.) 11 Большая идея: материя и энергия сохраняются в химических реакциях.
ЮТ
Химия 11 (Британская Колумбия, июнь 2018 г.)
11
Большая идея: растворимость в растворе определяется природой растворенного вещества и растворителя.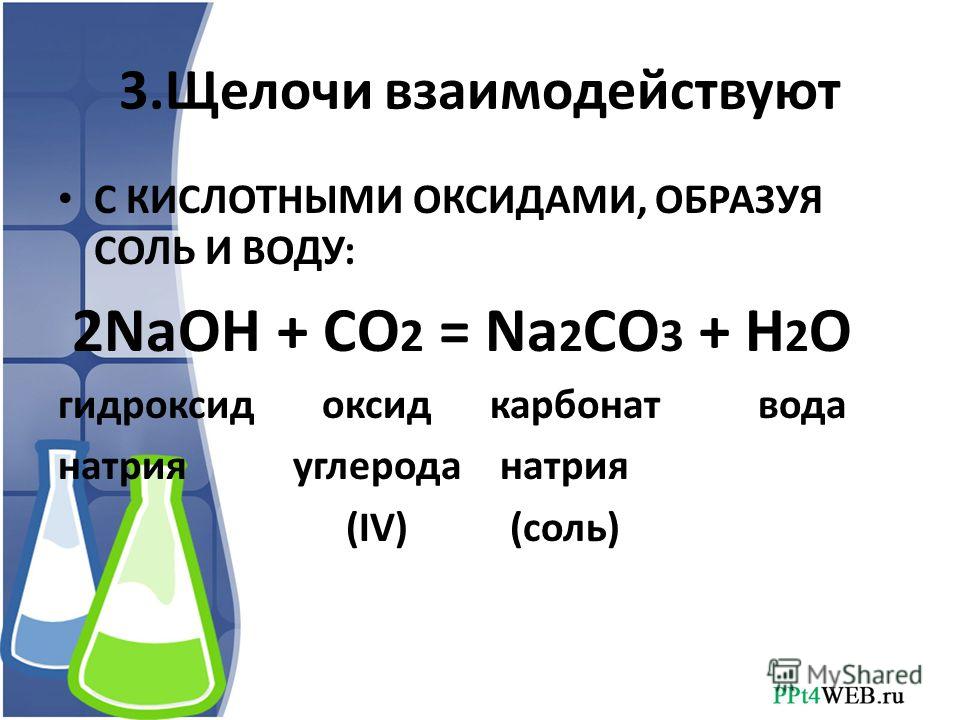
ЮТ Химия 11 (Британская Колумбия, июнь 2018 г.) 11 Большая идея: моль — это величина, используемая для того, чтобы сделать атомы и молекулы измеримыми.
YT Химия 12 (Британская Колумбия, июнь 2018 г.) 12 Большая идея: Сила кислоты или основания зависит от степени диссоциации ионов.
ЮТ Химия 12 (Британская Колумбия, июнь 2018 г.) 12 Большая идея: динамическое равновесие может быть смещено изменением окружающих условий.
ЮТ Химия 12 (Британская Колумбия, июнь 2018 г.) 12 Большая идея: насыщенные растворы — это системы, находящиеся в равновесии.
ЮТ Наука, 10 класс (Британская Колумбия, июнь 2016 г.) 10 Большая идея: требуется изменение энергии, поскольку атомы перестраиваются в химических процессах.
Кафедра химии и биохимии
ЦЕЛИ ОБУЧЕНИЯ: Физические и химические свойства сухого льда
Положите на прилавок плоский кусок сухого льда и посмотрите, как легко он «плавает» по прилавку, когда вы его даете небольшой толчок. Также посмотрите, как мелкий сухой лед перемещается по прилавку.
Также посмотрите, как мелкий сухой лед перемещается по прилавку.
Образуется ли лужица жидкости? Нет, почему бы и нет?
Твердое вещество → Газ (сублимация)
Сравните это с кубиком льда из H 2 O (s)
Твердое → Жидкое (Тающий)
Положите четвертак на край сухого льда. Что вы наблюдаете или слышите?
Что такое сухой лед? Он твердый, замороженный CO 2
Вдыхаем O 2 выдыхаем CO 2 . У нас кончатся O 2 на Земле?
Нет. Деревья и растения потребляют CO 2 , производят O 2 .
Почему больно прикасаться к сухому льду? Попросите учащихся прикоснуться к нему, но ненадолго.
При комнатной температуре и давлении CO 2 (s) → CO 2 (g). В твердом CO 2 между молекулами существует сила притяжения. Чтобы оттолкнуть молекулы друг от друга, требуется тепло. Твердое тело получает тепло от окружающих его молекул воздуха. Когда вы прикасаетесь к сухому льду более чем на несколько секунд, это причиняет боль. Когда вы прикасаетесь к ней, она забирает тепло вашей руки.
Твердое тело получает тепло от окружающих его молекул воздуха. Когда вы прикасаетесь к сухому льду более чем на несколько секунд, это причиняет боль. Когда вы прикасаетесь к ней, она забирает тепло вашей руки.
Учащиеся увидят, как сухой лед превращается из твердого состояния в газообразное, помещая кусок сухого льда в воздушный шар. Полностью растяните воздушный шар обеими руками — глубоко погрузите пальцы в воздушный шар, чтобы растянуть его как можно шире. С помощью щипцов попросите учащегося поместить в воздушный шар небольшой кусочек или пару маленьких кусочков сухого льда. Завяжите воздушный шар и наблюдайте, как он надувается, пока сухой лед возгоняется (твердое вещество → газ). Один из учеников может оставить себе воздушный шар, который будет использоваться для станции с жидким азотом.
Что за белый иней снаружи воздушного шара? Некоторые студенты думают, что сухой лед проходит через воздушный шар. Обсудите водяной пар в воздухе и то, как он конденсируется на воздушном шаре, потому что он холодный. Почувствуйте, как холодно.
Почувствуйте, как холодно.
Наполните пластиковую ванну наполовину горячей водой из раковины. Насыпьте одну-две чашки небольших кусочков сухого льда в горячую воду сразу. Что вы наблюдаете? Что такое туман? Почему он перетекает через край контейнера на землю?
ТУМАН: Туман — это не только CO 2 (г). Когда вы выдыхаете CO 2 , он чистый. Водяной пар над горячей водой конденсируется. Когда CO 2 возгоняется, CO 2 (s) → CO 2 (g), он поглощает тепло, делая его очень холодным, поэтому вода конденсируется (как туман или облака).
Почему туман падает на пол? Он тяжелее воздуха. Расскажите об огнетушителях, содержащих CO 2 (l), который образует CO 2 (g) и падает на огонь, удерживая O 2 (g) подальше от огня, поэтому он тушит огонь. Зажгите свечу на день рождения и попросите учеников поставить ее в туман. Они увидят, что CO 2 (g) немедленно задует пламя.
Наполните стакан на 250 мл водой примерно наполовину. Положите в воду небольшой кусочек сухого льда. Учащиеся могут видеть пузырьки как CO 2 (s) → CO 2 (g).
Предложите учащимся налить ~70 мл воды в три стакана по 100 мл. Поместите стаканы на мешалку. В каждую пробирку учащиеся наносят индикатор бромтимоловый синий – перемешивают раствор палочкой-мешалкой. В один стакан добавьте немного льда; в другой стакан добавить кусок сухого льда. Что ты видишь?
CO 2 растворяется в воде для производства углекислоты, H 2 CO 3 :
CO 2 + H 2 O → H 2 CO 3 → H + + + + + + + + + + + + + + + + + + + + + + + + CO 3 → H + + + + + + . HCO 3 – подкисление раствора.
HCO 3 – подкисление раствора.
Учащиеся увидят изменение цвета при реакции сухого льда и воды, а не при растворении обычного льда в воде. Пусть другие студенты попробуют это. Объясните, что такое универсальный индикатор.
Разговор о CO 2 (г) в газированных напитках. Высокая температура или высокое давление (содовая) высвобождает CO 2 (g). Газы, такие как углекислый газ и кислород, растворяются в воде — это хорошо, потому что водные растения, рыбы и все живые существа в воде нуждаются в углекислом газе и кислороде, чтобы выжить.
ТЕСТИРОВАНИЕ 7UP – ЯВЛЯЕТСЯ ЛИ СОДА КИСЛОЙ?
Добавьте 7-Up в третий стакан, содержащий 40 мл воды и индикатор. Что ты видишь?
7-Up содержит углекислоту, которая реагирует с водой так же, как сухой лед реагирует с водой!
CO 2 растворяется в воде с образованием угольной кислоты, H 2 CO 3 . Все газированные напитки содержат CO 2 , растворенный в растворе, что делает раствор кислым. CO 2 + H 2 O → H 2 CO 3 → H + + HCO 3 –
CO 2 + H 2 O → H 2 CO 3 → H + + HCO 3 –
Итак, если мы добавим сухой лед в миску с соком на Хэллоуин, безопасно ли его пить?
Сжигание углеводородов – Энергетическое образование
Energy EducationМеню навигации
ИСТОЧНИКИ ЭНЕРГИИ
ЭНЕРГЕТИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
ЭНЕРГЕТИЧЕСКОЕ ВОЗДЕЙСТВИЕ
Поиск
Сжигание углеводородов относится к химической реакции, при которой углеводород взаимодействует с кислородом с образованием двуокиси углерода, воды и тепла. Углеводороды представляют собой молекулы, состоящие как из водорода, так и из углерода. Они наиболее известны тем, что являются основным компонентом ископаемого топлива, а именно природного газа, нефти и угля. По этой причине ресурсы ископаемого топлива часто называют углеводородными ресурсами. [1] Энергия получается из ископаемого топлива путем сжигания (сжигания) топлива. Хотя в ископаемом топливе присутствуют примеси, сжигание углеводородов является основным процессом сжигания ископаемого топлива. Пример сжигания углеводородов показан на рисунке 1. Дополнительные примеры см. в моделировании внизу страницы.
По этой причине ресурсы ископаемого топлива часто называют углеводородными ресурсами. [1] Энергия получается из ископаемого топлива путем сжигания (сжигания) топлива. Хотя в ископаемом топливе присутствуют примеси, сжигание углеводородов является основным процессом сжигания ископаемого топлива. Пример сжигания углеводородов показан на рисунке 1. Дополнительные примеры см. в моделировании внизу страницы.
Рисунок 1. Метан соединяется с 2 кислородом с образованием углекислого газа, воды и тепла. [2]
Описание
Независимо от типа углеводорода при сгорании с кислородом образуются 3 продукта: двуокись углерода, вода и тепло, как показано в приведенной ниже общей реакции. Энергия, необходимая для разрыва связей в молекулах углеводородов, существенно меньше энергии, выделяемой при образовании связей в молекулах СО 2 и H 2 молекулы O. По этой причине в процессе выделяется значительное количество тепловой энергии (тепла). Эту тепловую энергию можно использовать напрямую (например, для обогрева дома) или преобразовать в механическую энергию с помощью тепловой машины. Однако это связано с потерями эффективности, что приводит к необходимым значительным потерям энергии (в виде отходящего тепла), регулируемым вторым законом термодинамики. Результирующая полезная механическая энергия будет намного меньше, чем начальная тепловая энергия, обеспечиваемая сгоранием углеводородов.
Эту тепловую энергию можно использовать напрямую (например, для обогрева дома) или преобразовать в механическую энергию с помощью тепловой машины. Однако это связано с потерями эффективности, что приводит к необходимым значительным потерям энергии (в виде отходящего тепла), регулируемым вторым законом термодинамики. Результирующая полезная механическая энергия будет намного меньше, чем начальная тепловая энергия, обеспечиваемая сгоранием углеводородов.
Общее уравнение реакции:
- [математика]x[/math] относится к числу атомов углерода в углеводороде
- [math]y[/math] относится к числу атомов водорода в углеводороде
- [math]N[/math] относится к числу атомов кислорода, необходимых для реакции горения углеводородов
Горение углеводородов и ископаемое топливо
Обратите внимание, что CO 2 это всегда производится при сжигании углеводородов; не имеет значения, какой тип молекулы углеводорода.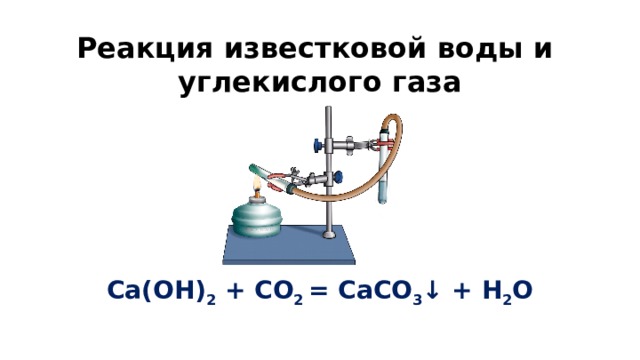 Производство CO 2 и H 2 O на самом деле является способом получения полезной энергии из ископаемого топлива. По этой причине важно проводить различие между двуокисью углерода и другими «отходами», образующимися из-за примесей в топливе, таких как соединения серы и азота. [1] Отходы, возникающие из-за примесей, можно устранить с помощью правильной технологии; СО 2 не может быть устранен, если ископаемое топливо не сжигается (не используется) в первую очередь.
Производство CO 2 и H 2 O на самом деле является способом получения полезной энергии из ископаемого топлива. По этой причине важно проводить различие между двуокисью углерода и другими «отходами», образующимися из-за примесей в топливе, таких как соединения серы и азота. [1] Отходы, возникающие из-за примесей, можно устранить с помощью правильной технологии; СО 2 не может быть устранен, если ископаемое топливо не сжигается (не используется) в первую очередь.
Не все виды ископаемого топлива имеют одинаковый состав. Природный газ состоит более чем на 90% из метана (CH 4 ), который является наименьшей молекулой углеводорода. Нефть, как правило, состоит из молекул среднего размера, хотя состав сильно различается от одного сорта сырой нефти к другому. Как правило, чем плотнее масло, тем длиннее углеродные цепи в молекулах. Наконец, уголь содержит самые большие и сложные молекулы углеводородов. [1]
Поскольку разные углеводороды имеют разное отношение водорода к углероду, они производят разное отношение воды к углекислому газу. В общем, чем длиннее и сложнее молекула, тем больше отношение углерода к водороду. По этой причине при сжигании равных количеств различных углеводородов образуется разное количество углекислого газа в зависимости от соотношения углерода и водорода в молекулах каждого из них. Поскольку уголь содержит самые длинные и сложные молекулы углеводородов, при сжигании угля выделяется больше CO 2 , чем сжигание той же массы нефти или природного газа. Это также изменяет плотность энергии каждого из этих видов топлива.
В общем, чем длиннее и сложнее молекула, тем больше отношение углерода к водороду. По этой причине при сжигании равных количеств различных углеводородов образуется разное количество углекислого газа в зависимости от соотношения углерода и водорода в молекулах каждого из них. Поскольку уголь содержит самые длинные и сложные молекулы углеводородов, при сжигании угля выделяется больше CO 2 , чем сжигание той же массы нефти или природного газа. Это также изменяет плотность энергии каждого из этих видов топлива.
Выбросы двуокиси углерода
Ниже представлена диаграмма выбросов CO 2 при производстве 293,1 кВтч (1 000 000 БТЕ) энергии из различных видов углеводородного топлива. [3]
| Топливо | кг CO 2 выбросы |
|---|---|
| Уголь антрацит | 104 |
| Каменный уголь | 93,5 |
| Уголь бурый | 97,9 |
| Полубитуминозный уголь | 97,4 |
| Дизель | 73,2 |
| Бензин | 71,5 |
| Пропан | 63,2 |
| Природный газ | 53,2 |
Анимация горения
Выберите топливо из выпадающего меню, чтобы увидеть результирующую реакцию, происходящую во время горения.


 Найти молекулярную формулу этого соединения.
Найти молекулярную формулу этого соединения.

 Напишите молекулярную и структурную формулы вещества Х и назовите его.
Напишите молекулярную и структурную формулы вещества Х и назовите его. При сожжении 108 мг образца загрязненного вещества было получено 78,4 мл углекислого газа (н.у.), 54 мг воды и 28 мг несгораемого остатка. Установите молекулярную формулу вещества А и предложите его возможные структурные формулы.
При сожжении 108 мг образца загрязненного вещества было получено 78,4 мл углекислого газа (н.у.), 54 мг воды и 28 мг несгораемого остатка. Установите молекулярную формулу вещества А и предложите его возможные структурные формулы. Рассчитайте брутто-формулу исходного вещества, если его относительная молекулярная масса меньше 100. Приведите для него все возможные структурные формулы, если известно, что его молекула содержит один цикл.
Рассчитайте брутто-формулу исходного вещества, если его относительная молекулярная масса меньше 100. Приведите для него все возможные структурные формулы, если известно, что его молекула содержит один цикл.