Формула углекислоты в химии: Углекислый газ (диоксид углерода) – Что такое Углекислый газ (диоксид углерода)?
alexxlab | 06.04.2023 | 0 | Разное
Углерод, подготовка к ЕГЭ по химии
Углерод
Углерод – неметаллический элемент IV группы периодической таблицы Д.И. Менделеева, является важнейшей частью всех органических веществ в природе.
Общая характеристика элементов IVa группы
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Из элементов IVа группы углерод и кремний относятся к неметаллам, германий, олово и свинец – металлы.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np2:
- C – 2s22p2
- Si – 3s23p2
- Ge – 4s24p
- Sn – 5s25p2
- Pb – 6s26p2
Природные соединения
В природе углерод встречается в виде следующих соединений:
- Аллотропных модификаций – графит, алмаз, фуллерен
- MgCO3 – магнезит
- CaCO3 – кальцит (мел, мрамор)
- CaCO3*MgCO3 – доломит
Получение
Углерод получают в ходе пиролиза углеводородов (пиролиз – нагревание без доступа кислорода). Также применяется получение углеродистых соединений:
древесины и каменного угля.
Также применяется получение углеродистых соединений:
древесины и каменного угля.
C2H6 → (t) C + H2 (пиролиз этана)
Химические свойства
- Реакции с неметаллами
- Реакции с металлами
- Восстановительные свойства
- Реакция с водой
- Реакции с кислотами
При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
C + H2 → (t) CH4 (метан)
2С + O2 → (t) 2CO (угарный газ – продукт неполного окисления углерода, образуется при недостатке кислорода)
С + O2 → (t) CO2 (углекислый газ – продукт полного окисления углерода, образуется при достаточном количестве кислорода)
С + F2 → (t) CF4
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства.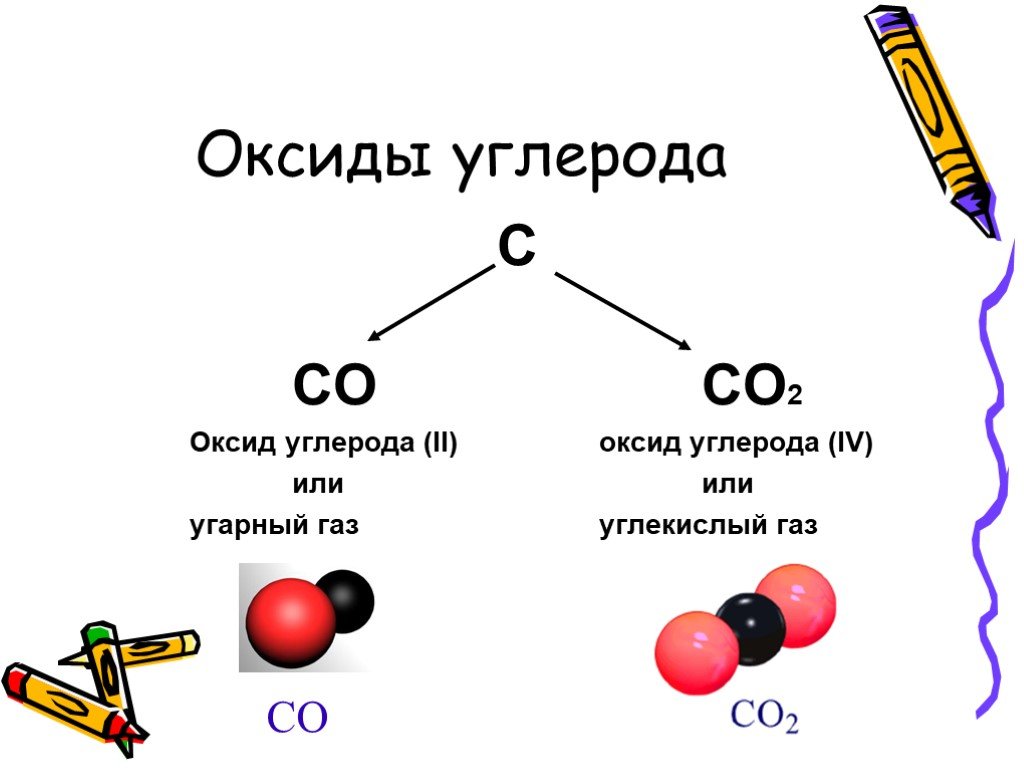 Напомню, что металлы могут принимать только положительные
степени окисления.
Напомню, что металлы могут принимать только положительные
степени окисления.
Ca + C → CaC
Al + C → Al4C3 (карбид алюминий, СО углерода -4)
Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.
Углерод – хороший восстановитель. С помощью него металлургическая промышленность справляется с задачей получения чистых металлов из их оксидов:
Fe2O3 + C → Fe + CO2
ZnO + C → Zn + CO
FeO + C → Fe + CO
Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
SiO2 + C → (t) Si + CO
Может восстановить и собственный оксид:
CO2 + C → CO
Известная реакция взаимодействия угля с водяным паром, называемая также газификацией угля, торфа, сланца – крайне важна в промышленности:
C + H2O → CO↑ + H2↑
В реакциях с кислотами углерод проявляет себя как восстановитель:
C + HNO3(конц. ) → (t) CO2 + NO2 + H2O
) → (t) CO2 + NO2 + H2O
C + HNO3 → CO2 + NO + H2O
C + H2SO
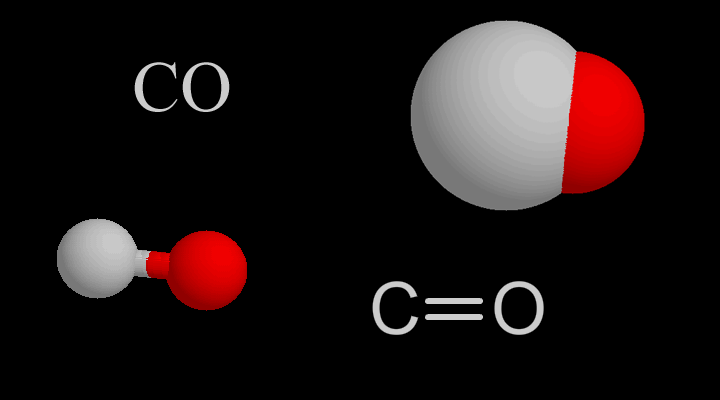
Оксид углерода II – СO
Оксид углерода II – продукт неполного окисления углерода. Несолеобразующий оксид. Это чрезвычайно опасное вещество часто образуется при пожарах в замкнутых помещениях, при прогревании машины в гараже.
Растворяясь в крови угарный газ (имеющий в 300 раз большее сродство к гемоглобину, чем кислород) легко выигрывает конкуренцию у кислорода и занимает его место в эритроцитах. Отравление угарным газом нередко заканчивается летальным исходом.
Получение
В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
C + H2O → (t) CO + H2
В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
HCOOH → (H2SO4) CO + H2O
Химические свойства
Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
CO + O2 → CO2
Fe2O3 + CO → Fe + CO2
FeO + CO → Fe + CO2
Образование карбонилов – чрезвычайно токсичных веществ.
Fe + CO → (t) Fe(CO)5
Оксид углерода IV – CO
2
Продукт полного окисления углерода.
Получение
В промышленности углекислый газ получают при разложении известняка, в ходе производства алкоголя, при спиртовом брожении глюкозы.
CaCO3 → (t) CaO + CO2↑
C6H12O6 → C2H5OH + CO2↑
В лабораторных условиях используют реакцию мела (мрамора) с соляной кислотой.
CaCO3 + HCl → CaCl2 + H2O + CO2↑
Углекислый газ образуется при горении органических веществ:
C3H8 + O2 → CO2 + H2O
Химические свойства
- Реакция с водой
- Реакции с основными оксидами и основаниями
- Окислительные свойства
В результате реакции с водой образуется нестойкая угольная кислота, которая сразу же распадается на воду и углекислый газ.
CO2 + H2O ⇄ H2CO3
В ходе реакций с основаниями и основными оксидами углекислый газ образует соли угольной кислоты: средние – карбонаты (при избытке основания), кислые – гидрокарбонаты (при избытке кислотного оксида).
2KOH + CO2
KOH + CO2 → KHCO3 (соотношение основание – кислотный оксид 1:1)
Na2O + CO2 → Na2CO3
При нагревании способен окислять металлы до их оксидов.
Zn + CO2 → (t) ZnO + CO
Угольная кислота
Слабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ.
Химические свойства
- Качественная реакция
- Средние и кислые соли
- Нагревание солей угольной кислоты
Определить наличие карбонат-иона можно с помощью кислоты: такая реакция сопровождается “закипанием” – появлением пузырьков бесцветного газа без запаха.
MgCO3 + HCl → MgCl2 + CO2↑ + H2O
Я не раз встречал описание реакций, связанных с этой кислотой, которое заслуживает нашего внимания. В задании было сказано, что при добавлении к раствору гидроксида кальция углекислого газа осадок появлялся, при дальнейшем пропускании углекислого газа – помутнение исчезало.
Это можно легко объяснить, вспомнив про способность угольной кислоты образовывать кислые соли, которые растворимы.
Ca(OH)2 + CO2 → CaCO3 (осадок выпадает)
CaCO3 + H2O + CO
Чтобы сделать из средней соли (карбоната) – кислую соль (гидрокарбонат) нужно добавить угольную кислоту. Однако написать ее формулу
H2CO3 – ошибка. Ее следует записать в виде воды и углекислого газа.
Однако написать ее формулу
H2CO3 – ошибка. Ее следует записать в виде воды и углекислого газа.
Li2CO3 + CO2 + H2O → LiHCO3 (средняя соль + кислота = кислая соль)
Чтобы вернуть среднюю соль, следует добавить к кислой соли щелочь.
LiHCO3 + LiOH → Li2CO3 + H2O
При нагревании карбонаты распадаются на соответствующий оксид металла и углекислый газ, гидрокарбонаты – на карбонат металла, углекислый газ и воду.
MgCO3 → (t) MgO + CO2
KHCO3 → (t) K2CO3 + CO2↑ + H2O
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Структура Льюиса Углекислый газ Структурная формула Резонанс Химия, другие, угол, текст, другие png
Структура Льюиса Углекислый газ Структурная формула Резонанс Химия, другие, угол, текст, другие pngтеги
- угол,
- текст,
- другие,
- монохромный,
- химия,
- число,
- черный,
- структура,
- углерод,
- структурная формула,
- линия,
- молекулярная формула,
- молекулярная геометрия,
- молекула,
- символ,
- резонанс,
- структура Льюиса,
- диоксид углерода,
- окись углерода,
- химическая связь,
- химическая формула,
- круг,
- со 2,
- общий,
- ковалентная связь,
- файл,
- площадь,
- Льюис,
- png,
- прозрачный,
- бесплатная загрузка
Об этом PNG
- Размер изображения
- 1280x354px
- Размер файла
- 17.
 99KB
99KB - MIME тип
- Image/png
изменить размер PNG
ширина(px)
высота(px)
Лицензия
Некоммерческое использование, DMCA Contact Us
- Углекислый газ Структурная формула Молекула Угарный газ, химические формулы, угол, текст, углерод png 1700x500px 6.01KB
- Структура Льюиса Метан Простая связь Химическая связь Валентный электрон, молекулярная цепь, разное, угол, текст png 1041x1079px 10.8KB
- Углекислый газ Молекула Угарный газ Атом, Молекулы с, химия, углерод, линия png 800x553px 168.72KB org/ImageObject”> Химическая формула Молекула Вода Химия Химическое соединение, вода, угол, текст, логотип png 1280x549px 12.36KB
- Химическое соединение Химический синтез Химия Органическое соединение Молекула, химическая формула, угол, белый, текст png 1917x1466px 134.17KB
- Структура Льюиса Молекулярная геометрия Метан Молекула Химическая формула, другие, разное, угол, текст png 800x916px 5.7KB
- Структура Льюиса Аммиак Молекулярная геометрия Молекула Аммоний, другие, Разное, другие, электрон png 777x600px 134.05KB
- Структура Льюиса Аммиак Молекула Химия Аммоний, точечная формула, угол, текст, логотип png 640x462px 4.05KB org/ImageObject”> черно-белая иллюстрация, Молекула Химия Молекулярная геометрия Химическая структура, молекула, синий, текст, цвет png 2482x1761px 300.48KB
- Кофеин Кофеин Молекулы Химическая структура Молекулярная геометрия, Кофе, угол, белый, текст png 1200x987px 40.58KB
- Молекула Молекулярная геометрия Химия Шестиугольник, здравый смысл, химический элемент, угол, текст png 615x679px 75.31KB
- шестигранная форма, циклогексановая конформация структурная формула химическое вещество молекула, шестиугольник, разное, угол, белый png 1200x1380px 28.68KB
- Этанол Химическая формула Алкоголь Химия Химическое вещество, другие, угол, белый, текст png
1280x837px
18.
 88KB
88KB - Бензол Химия Химическая структура Структурная формула, каучуки, угол, белый, текст png 880x1040px 38.73KB
- справочный материал химическая структура, черно-синие соты, текстура, материал, угол png 1213x931px 187.12KB
- Структура ацетилена Льюиса Химическая связь Тройная связь, наука, угол, текст, логотип png 1600x282px 12.97KB
- Молекула Химическое соединение Химическая формула Аминокислота Леводопа, дофамин, угол, белый, текст png 1280x546px 25.57KB
- Носкапин Молекула Химическое соединение Химическая формула Химия, Структура, угол, белый, текст png
1060x958px
23.
 77KB
77KB - Структура Льюиса Резонансная диаграмма диоксида углерода Электрон, структура Льюиса, текст, логотип, электрон png 960x404px 45.11KB
- Структура бензола Льюиса Резонанс Химическая структура, другие, угол, белый, текст png 800x945px 22.86KB
- Этаноловое топливо Алкоголь Структурная формула Структура, стоимость, организационная структура, угол, белый, текст png 1280x783px 14.72KB
- Химия Химическая формула Хлорид натрия Структурная формула Химическая структура, Металлическая молекулярная модель, знаменитости, металл Фон, структура png 500x500px 210.89KB org/ImageObject”> Диоксид серы Химия Структура Льюиса Молекула, диоксид серы, текст, другие, химия png 1280x603px 28.95KB
- Химическая формула Алкоголь Химическое вещество Химия Структурная формула, другие, угол, белый, текст png 800x558px 18.2KB
- Метан Алкан Углеводород Органическая химия, химия, разное, угол, другие png 1088x1100px 136.19KB
- Диоксид серы структура Льюиса Молекула Молекулярная геометрия Резонанс, структура диоксида кремния, угол, текст, другие png 1100x568px 24.73KB
- Серотонин молекула химия химическая структура мелатонин, другие, угол, белый, текст png 800x587px 16.54KB org/ImageObject”> Структура Льюиса Ковалентная связь Диаграмма Молекула Химическая связь, другие, разное, угол, белый png 1100x933px 60.42KB
- Углекислый газ Молекула Угарный газ Атом, частицы, Разное, другие, сфера png 1100x723px 89.84KB
- химическая тематика иллюстрации, химическая лаборатория рисования науки, каракули, угол, текст, фреска png 1640x1064px 2.32MB
- Напиток с кофеином Кофе Латте Кофеин Состав, формула, угол, белый, текст png 1024x842px 30.07KB
- Озон Химическая связь Заказ облигаций Молекула Льюиса структура, другие, угол, белый, текст png 1100x295px 16.57KB org/ImageObject”> Органическая химия Химическая формула Структура Молекула, этан, угол, белый, текст png 1019x768px 11.36KB
- Углекислый газ Химия Молекулярная модель Химическое соединение Молекула, др., другие, химия, углерод png 1100x373px 55.23KB
- Химия Молекула воды Структура Льюиса Теория ВСЭПР, вода, угол, текст, логотип png 773x576px 22.53KB
- Угарный газ Структурная формула Молекула углекислого газа, 30, Разное, текст, товарный знак png 2000x762px 30.85KB
- Химическая формула Молекула Химическая структура Химия Химические вещества, другие, угол, текст, прямоугольник png 709x616px 8.01KB org/ImageObject”> Кофеин Кофеин Молекула Химия Химическое вещество, Кофе, угол, белый, текст png 748x615px 25.92KB
- Углекислый газ Молекула Угарный газ Атом, ГАЗ, Разное, другие, химия png 2000x1422px 252.5KB
- Гликоген Химическая структура Молекула Полисахарид, другие, угол, белый, текст png 1280x564px 47.44KB
- Рисунок молекулы, ДНК, текст, фотография, сердце png 785x765px 171.36KB
- Структурная формула Пропан Химическая формула Скелетная формула Химическое соединение, другие, угол, белый, текст png 800x470px 8.42KB
- Циклогексан структура Льюиса Циклогексен Циклоалкан Органическая химия, бензольное кольцо, разное, угол, белый png
520x523px
20.
 52KB
52KB - Адреналин Химическая структура Норадреналин Дофамин, дофамин, угол, белый, текст png 1024x647px 17.56KB
- Химическая формула Молекулярная формула Структурная формула Молекула Химическое вещество, Формула Один флаг, угол, белый, текст png 1024x508px 22.3KB
- Этанол Скелетная формула Структурная формула Структура спирта, другие, разное, угол, текст png 1200x461px 14.77KB
- Тройная связь Химическая связь Азот Ковалентная связь Атом, Оксид бора, текст, другие, логотип png 508x567px 12.04KB
- Формула Математика Евклидова, математическая формула, угол, текст, монохромный png
3500x3313px
875.
 77KB
77KB - Кислород Озон Молекула Перекись водорода Атом, др., другие, атом, o 2 png 600x600px 120.29KB
- Химическая формула Молекулярная формула Молекула Химия Вода, раковина, химический элемент, мебель, текст png 1280x867px 22.72KB
Формула угольной кислоты. Использование, свойства, структура и формула
Формула угольной кислоты
Углекислота – слабая неорганическая кислота, которая также считается раствором двуокиси углерода в воде. Он существует только в виде раствора, и его также называют воздушной кислотой, воздушной кислотой, раствором углекислого газа или дигидрокарбонатом. Он наиболее известен как компонент большинства газированных напитков, таких как газированные и безалкогольные напитки.
Формула и структура: Химическая формула угольной кислоты H 2 CO 3 . Его молекулярная формула CH 2 O 3 , а его молярная масса составляет 62,03 г/моль. Химическая структура угольной кислоты показана ниже и состоит из карбоксильной группы и двух гидроксильных групп. Это двухосновная кислота, которая может высвобождать два протона, но является слабокислой из-за сильных связей OH.
Его молекулярная формула CH 2 O 3 , а его молярная масса составляет 62,03 г/моль. Химическая структура угольной кислоты показана ниже и состоит из карбоксильной группы и двух гидроксильных групп. Это двухосновная кислота, которая может высвобождать два протона, но является слабокислой из-за сильных связей OH.
Присутствие: В организме человека, CO 2 , присутствующий в крови, соединяется с водой с образованием угольной кислоты, которая затем выдыхается легкими в виде газа. Его также можно найти в скалах и пещерах, где он может растворять известняки. H 2 CO 3 также можно найти в угле, метеоритах, вулканах, кислотных дождях, грунтовых водах, океанах и растениях.
Приготовление: Углекислота образуется при растворении двуокиси углерода в воде и может существовать только в растворе. Эта реакция обычно находится в равновесии, что означает, что угольная кислота частично и обратимо образует двуокись углерода и воду.
CO 2 + H 2 O ⇌ H 2 CO 3
В промышленности угольную кислоту получают как побочный продукт других физических процессов, таких как ферментация, сжигание ископаемого топлива и т. д.
3
Свойства: Угольная кислота существует только в виде раствора с плотностью 1,668 г/моль. Он нерастворим в воде.
Химические свойства: Углекислота — слабая и нестабильная кислота, частично диссоциирующая в воде на ионы водорода (H + ) и ионы бикарбоната (HCO 3 – ). Будучи двухосновной кислотой, она может образовывать два вида солей: карбонаты и бикарбонаты. Добавление основания к избытку угольной кислоты дает бикарбонатные соли, а добавление избытка основания к угольной кислоте дает карбонатные соли.
Применение: Угольная кислота широко используется при приготовлении газированных напитков, таких как газированные напитки, безалкогольные напитки, игристые вина и другие газированные напитки. Углекислота также используется во многих других областях, таких как фармацевтика, косметика, удобрения, пищевая промышленность, анестетики и т. д.
Углекислота также используется во многих других областях, таких как фармацевтика, косметика, удобрения, пищевая промышленность, анестетики и т. д.
Опасность для здоровья/воздействие на здоровье: Углекислота не считается токсичной или опасной и присутствует в организме человека. Однако его воздействие в высоких концентрациях может вызвать раздражение глаз и дыхательных путей.
| Ссылки по теме: |
Формула угольной кислоты
Обучающие видео
Угольная кислота
Угольная кислота, также известная как h3CO3, представляет собой углеродсодержащую молекулу с химической формулой h3CO3. Незначительное количество этой молекулы можно найти в растворах диоксида углерода, включая воду. Поскольку эта молекула содержит одну углеродно-кислородную двойную связь, ее химическая формула также может быть представлена как OC(OH)2 из-за того, что она содержит одну углеродно-кислородную двойную связь.
Из-за того, что это единственная кислота, которая может выделяться в газообразном состоянии легкими человека, угольную кислоту обычно называют «дыхательной кислотой». Это слабая кислота, которая образует карбонатные и бикарбонатные соли при воздействии воздуха.
h3CO3 обладает способностью растворять известняк, в результате чего образуется бикарбонат кальция ((Ca(h3CO3)2). Многие характеристики известняка, такие как сталагмиты и сталактиты, являются результатом этого процесса.
Препараты угольной кислоты-h3CO3Структура угольной кислоты состоит из одной двойной связи углерод-кислород и двух одинарных связей углерод-кислород. Один атом водорода соединен с каждым из атомов кислорода, участвующих в одинарной связи с атомами углерода, участвующими в соединении.
Во многих местах обитания с умеренным климатом углекислота, образующаяся в результате растворения и гидролиза CO2 в воде, является наиболее важным природным выщелачивающим агентом. Он одновременно слаб и нестабилен, быстро распадается на ионы водорода (H+) и ионы бикарбоната (HCO3-), которые затем выделяются в окружающую среду.
Он одновременно слаб и нестабилен, быстро распадается на ионы водорода (H+) и ионы бикарбоната (HCO3-), которые затем выделяются в окружающую среду.
В этом подразделе содержится список некоторых наиболее важных физических и химических свойств угольной кислоты.
1. Физические характеристики sМолекулярная масса угольной кислоты составляет 62,024 грамма на моль.
• Плотность 1,668 грамма на кубический сантиметр в стандартном состоянии состава.
6,35 – значение pKa химической молекулы h3CO3.
• Бикарбонат представляет собой сопряженное основание, соответствующее угольной кислоте в уравнении.
• Это химическое вещество чаще всего встречается в виде раствора. Хотя было заявлено, что ученые НАСА создали твердые образцы h3CO3, неясно, правда ли это.
2. Химические характеристики • h3CO3 – слабая кислота, нестабильная в естественной среде.
• В присутствии воды подвергается частичной диссоциации с образованием ионов H+ и HCO3- (бикарбонат).
h3CO3+h3OHCO3-+H+
• Углекислота является двухосновной кислотой, поэтому она может реагировать с водой с образованием двух типов солей: бикарбонатов и карбонатов.
• Добавление небольшого количества основания к h3CO3 приводит к образованию бикарбонатных солей, тогда как добавление избытка основания приводит к образованию карбонатных солей.
Наблюдатели должны иметь в виду, что углекислота может образовываться как побочный продукт промышленных ферментационных операций или сжигания ископаемого топлива в больших масштабах в промышленности.
Использование угольной кислотыУчитывая широкий спектр применения, h3CO3 является очень важным химическим веществом, которое необходимо понимать. Некоторые из этих применений угольной кислоты перечислены в следующем разделе.
Газированные напитки, такие как газированная вода, игристое вино и другие газированные напитки, производятся с использованием угольной кислоты.
- При осаждении некоторых солей аммония, таких как персульфат аммония, в качестве растворителя используется h3CO3.
- Способствует удалению углекислого газа из атмосферы тела.
- Протонирование различных азотосодержащих оснований в сыворотке крови происходит в результате присутствия h3CO3
- Углекислота применяется для лечения стригущего лишая и других дерматитов путем нанесения непосредственно на пораженный участок. • Растворы, содержащие это химическое вещество, также особенно эффективны для очистки контактных линз.
- Это лекарство можно использовать внутрь, чтобы вызвать рвоту в любое время, когда это необходимо (например, в случаях передозировки наркотиков).
Бикарбонат-ион, известный как посредник в транспортировке углекислого газа из организма человека в процессе дыхательного газообмена, присутствует в организме. Реакции гидратации, которым подвергается диоксид углерода, протекают крайне вяло, особенно при отсутствии достаточного количества катализатора для реакции. С другой стороны, присутствие семейства ферментов, известных как карбоангидразы, в эритроцитах ускоряет скорость реакции. Ферменты карбоангидразы ответственны за катализ превращения углекислого газа и воды в диссоциированные ионы угольной кислоты в присутствии воды. Это приводит к образованию анионов бикарбоната, которые растворяются в плазме крови. После вдоха в легких снова происходит катализируемая реакция, в результате которой образуется углекислый газ СО2.
С другой стороны, присутствие семейства ферментов, известных как карбоангидразы, в эритроцитах ускоряет скорость реакции. Ферменты карбоангидразы ответственны за катализ превращения углекислого газа и воды в диссоциированные ионы угольной кислоты в присутствии воды. Это приводит к образованию анионов бикарбоната, которые растворяются в плазме крови. После вдоха в легких снова происходит катализируемая реакция, в результате которой образуется углекислый газ СО2.
Углекислота чрезвычайно важна для океанов.
Из-за способности океана поглощать избыток углекислого газа из атмосферы (в основном из-за деятельности человека) ученые предсказывают, что рН океанской воды снизился примерно на 0,1 единицы рН. Поглощенный углекислый газ соединяется с океанской водой, в результате чего образуется h3CO3. Подкисление океана — это термин, обычно используемый для описания этого процесса.
Заключение Углекислота — это химическое соединение, которое часто используется при создании безалкогольных напитков, искусственно газированных игристых вин и других игристых напитков.


 99KB
99KB