Формула углекислый газ химия: Углекислый газ (диоксид углерода) – Что такое Углекислый газ (диоксид углерода)?
alexxlab | 12.11.1985 | 0 | Разное
Формула углекислого газа в химии. Физические и химические свойства углекислого газа
Содержание
- Что такое углекислый газ
- Строение окида углерода (II)
- Углекислый газ и его физические свойства
- Химические свойства углекислого газа, реакции с другими веществами
- Взаимодействие с другими веществами:
- Углекислый газ: получение в промышленности
- Применение углекислого газа
- Углекислый газ в атмосфере
- Польза и вред Диоксида углерода
- Углекислый газ: хранение и транспортировка
Что такое углекислый газ
Оксид углерода (IV) представляет собой тяжёлый газ. Плотность углекислоты примерно в полтора раза больше чем у атмосферного воздуха. Несмотря на то, что этот газ уже при температуре минус 78,3 градуса Цельсия превращается в снегообразную массу, получить жидкую углекислоту при нормальном давлении не представляется возможным. Так называемый сухой лёд при малейшем повышении температуры сразу переходит из твёрдой, в газообразную форму. Получить жидкую углекислоту можно только при давлении более 60 атмосфер. В таких условиях газ конденсируется даже при комнатной температуре с образованием бесцветной жидкости.
Получить жидкую углекислоту можно только при давлении более 60 атмосфер. В таких условиях газ конденсируется даже при комнатной температуре с образованием бесцветной жидкости.
Углекислый газ не окисляется, но может поддерживать горение некоторых металлов. В среде углекислоты, при определённых условиях, могут возгораться такие активные элементы как магний, кальций и барий. Этот газ хорошо растворим в воде, а в воздухе его содержится большое количество благодаря дыханию живых организмов и растений, наличию вулканической активности на земле, а также в результате сгорания органических веществ.
В результате растворения СО2 в воде в большой концентрации образуется угольная кислота. Это вещество может вступать в реакцию с фенолом и магнийорганическими соединениями. Углекислый газ также реагирует с щелочами. В результате такой реакции образуются соли и эфиры угольной кислоты.
Строение окида углерода (II)
Степень окисления +2. Связь выглядит следующим образом:
Стрелкой показана дополнительная связь, которая образуется по донорно-акцепторному механизму за счет неподеленной пары электронов атома кислорода. Из-за этого связь в оксиде очень прочная, поэтому оксид способен вступать в реакции окисления-восстановления только при высоких температурах.
Из-за этого связь в оксиде очень прочная, поэтому оксид способен вступать в реакции окисления-восстановления только при высоких температурах.
Углекислый газ и его физические свойства
Углекислый газ состоит из углерода и кислорода. Формула углекислого газа выглядит так – CO₂. В природе он образуется при сжигании или гниении органических веществ. В воздухе и минеральных источниках содержание газа также достаточно велико. кроме того люди и животные также выделяют диоксид углерода при выдыхании.
Рис. 1. Молекула углекислого газа.
Диоксид углерода является абсолютно бесцветным газом, его невозможно увидеть. Также он не имеет и запаха. Однако при его большой концентрации у человека может развиться гиперкапния, то есть удушье. Недостаток углекислого газа также может причинить проблемы со здоровьем. В результате недостатка это газа может развиться обратное состояние к удушью – гипокапния.
Если поместить углекислый газ в условия низкой температуры, то при -72 градусах он кристаллизуется и становится похож на снег. Поэтому углекислый газ в твердом состоянии называют «сухой снег».
Поэтому углекислый газ в твердом состоянии называют «сухой снег».
Рис. 2. Сухой снег – углекислый газ.
Углекислый газ плотнее воздуха в 1,5 раза. Его плотность составляет 1,98 кг/м³ Химическая связь в молекуле углекислого газа ковалентная полярная. Полярной она является из-за того, что у кислорода больше значение электроотрицательности.
Важным понятием при изучении веществ является молекулярная и молярная масса. Молярная масса углекислого газа равна 44. Это число формируется из суммы относительных атомных масс атомов, входящих в состав молекулы. Значения относительных атомных масс берутся из таблицы Д.И. Менделеева и округляются до целых чисел. Соответственно, молярная масса CO₂ = 12+2*16.
Чтобы вычислить массовые доли элементов в углекислом газе необходимо следовать формулерасчета массовых долей каждого химического элемента в веществе. w = n * Ar / Mr
n – число атомов или молекул.
Ar – относительная атомная масса химического элемента.
Mr – относительная молекулярная масса вещества.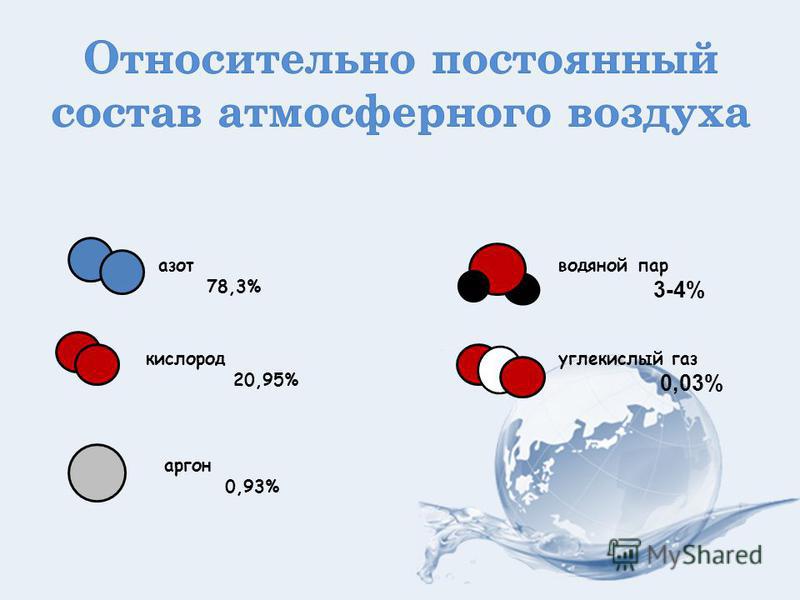
Рассчитаем относительную молекулярную массу углекислого газа.
Mr(CO₂) = 14 + 16 * 2 = 44 w(C) = 1 * 12 / 44 = 0,27 или 27 % Так как в формулу углекислого газа входит два атома кислорода, то n = 2 w(O) = 2 * 16 / 44 = 0,73 или 73 % Ответ: w(C) = 0,27 или 27 %; w(O) = 0,73 или 73 %
Химические свойства углекислого газа, реакции с другими веществами
Общие химические свойства углекислого газа: CO2 инертен, то есть химически не активен; при попадании в водный раствор легко вступает в реакции.
Большинство кислотных оксидов устойчивы к высоким температурам, но углекислота при их воздействии восстанавливается.
Взаимодействие с другими веществами:
1) Углекислота относится к кислотным оксидам, то есть в сочетании с водой образуется кислота. Однако угольная кислота неустойчива и распадается сразу. Эта реакция имеет обратимый характер:
СО2 + h3O ↔ CO2 × h3O (растворение) ↔ Н2СО3
Диоксид углерода + вода ↔ угольная кислота
Молекула угольной кислоты
2) При взаимодействии углекислого газа и соединений азота с водородом (аммиаком) в водном растворе происходит разложение до углеаммонийной соли.
2Nh4 + CO2 + h3O = Nh5HCO3
Аммиак + углекислота = гидрокарбонат аммония
Полученное вещество часто используется в приготовлении хлеба и различных кондитерских изделий.
3) Ход некоторых реакций должен поддерживаться высокими температурами. Примером является производство мочевины при 130 °C и давлении 200 атм., схематически изображаемое так:
2Nh4 + СО2 → (Nh3)2СО + h3O
Аммиак + диоксид углерода → карбамид + вода
Также под воздействием температуры около 800 градусов протекает реакция образования оксида цинка:
Zn + CO2 → ZnO + CO
Цинк + двуокись углерода → оксид цинка + оксид углерода
4) Возможно уравнение с гидроксидом бария, при котором выделяется средняя соль.
Ba(OH)2+CO2 = BaCO3 + h3O
Гидроксид бария + углекислота = карбонат бария + оксид водорода.
Применяется для регулировки калориметров по теплоемкости. Также вещество используют в промышленности для производства красных кирпичей, синтетических тканей, фейерверков, гончарных изделий, плитки для ванн и туалетов.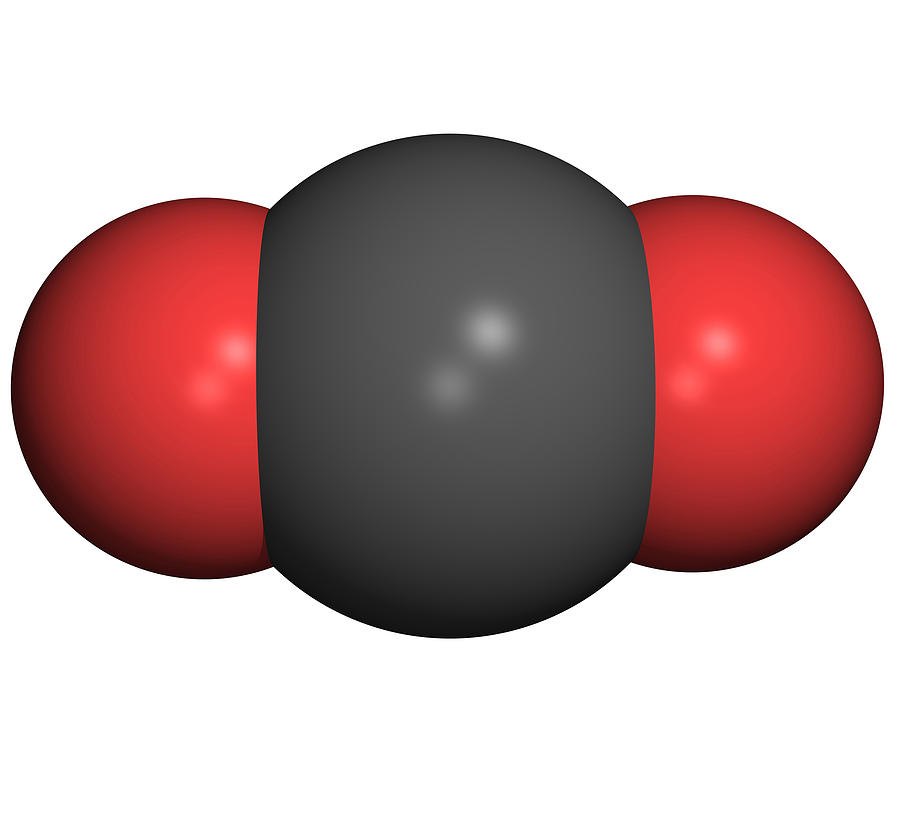
5) Углекислый газ выделяется при реакциях горения.
Горение метана.
Ch5 + 2O2 → CO2 + 2h3O + 891кДж
Метан + кислород = углекислота + вода (в газообразном состоянии) + энергия
Горение этилена
C2h5 + 3O2 → 2CO2 + 2h3O + Q
Этилен + кислород = диоксид углерода + оксид водорода + энергия
Горение этана
2С2Н6 + 7О2 → 4CO2 + 6h3O + Q
Этан + кислород = двуокись углерода + вода + энергия
Горение этанола
C2H5OH + 3O2 = 3h3O + 2CO2 + Q
Этанол + кислород = вода + углекислота + энергия
6) Газ не поддерживает горения, этот процесс возможен только с некоторыми активными металлами, например, магнием.
2Mg + CO2 = C + 2MgO
Магний + углекислота = углерод + оксид магния.
MgO активно применяется при производстве косметических средств. Вещество используют в пищевой промышленности как пищевую добавку.
7) Двуокись углерода реагирует с гидроксидами с получением солей, которые существуют в двух формах, как карбонаты и бикарбонаты.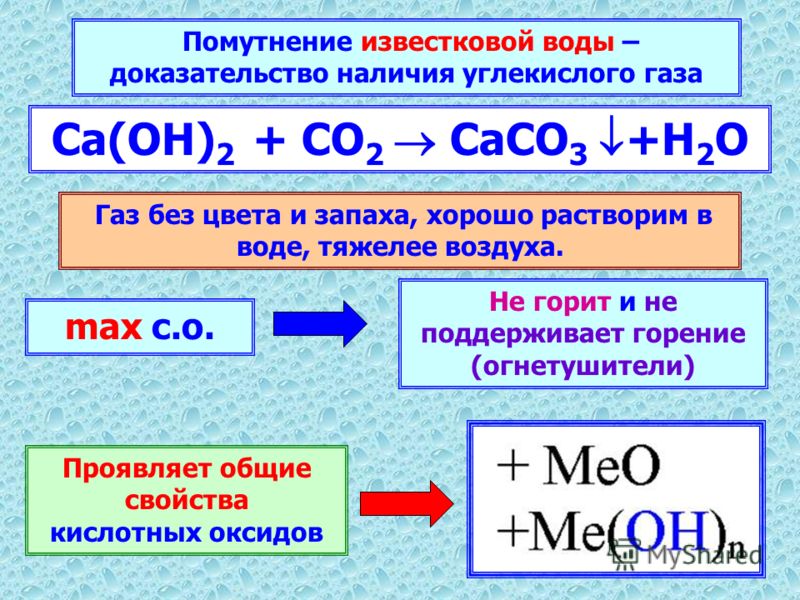 Например, углекислый газ и гидроксид натрия, согласно формуле, образуют гидрокарбонат Na:
Например, углекислый газ и гидроксид натрия, согласно формуле, образуют гидрокарбонат Na:
CO2 + NaOH → NaHCO3
диоксид углерода + гидроксид натрия → гидрокарбонат натрия.
Или же при большем количестве NaOH образуется карбонат Na с образованием воды:
CO2 + 2 NaOH → Na2CO3 + h3O
Диоксид углерода + гидроксид натрия → карбонат натрия + вода
Кислотно-щелочные реакции углекислоты используются на протяжении веков для затвердевания известкового раствора, что может быть выражено простым уравнением:
Ca(OH)2 + CO2 → CaCO3 + h3O
Гидроксид кальция + двуокись углерода → карбонат кальция + оксид водорода
В зелёных растениях играет важную роль в процессе фотосинтеза:
6CO2 + 6h3O → C6h22O6 + 6O2
Диоксид углерода + вода → глюкоза + кислород.
9) Химические свойства углекислоты используются в промышленности при производстве соды, суть этого процесса можно выразить суммарным уравнением:
NaCl + CO2 + Nh4 + h3O → NaHCO3 + Nh5Cl
Хлорид натрия + Диоксид углерода + аммиак + вода → гидрокарбонат натрия + хлорид аммония
10) Фенолят Na разлагается при взаимодействии с углекислым газом, при этом малорастворимый фенол выпадает в осадок:
C6H5ONa + CO2 + h3O = C6H5OH + NaHCO3
Фенолят натрия + двуокись углерода + оксид водорода = фенол + гидрокарбонат натрия
11) Пероксид натрия и углекислый газ, взаимодействуя, образуют среднюю соль карбоната Na с выделением кислорода.
2Na2O2 + 2CO2 → 2N2CO3 + O2
Пероксид натрия + углекислота → карбонат натрия + кислород
Колба с пероксидом натрия
Образование углекислоты происходит при растворении в воде кальцинированной соды (стиральной соды).
NaHCO3 + h3O → CO2 + h3O + NaOH
Гидрокарбонат натрия + вода → углекислота + вода + гидроксид натрия
При этой реакции (гидролиз по катиону) образуется сильнощелочная среда.
12) CO2 вступает в реакцию с гидроксидом калия, последний образуется путем электролиза хлористого калия.
2KOH + CO2 → K2CO3 + h3O
Гидроксид калия + углекислота → карбонат калия + вода
13) Газ в силу своего строения не реагирует с благородными газами, то есть гелием, неоном, аргоном, криптоном, ксеноном, радоном, оганесоном.
Углекислый газ: получение в промышленности
Существует большое количество способов промышленного получения углекислоты. Наиболее рентабельными являются варианты добычи газа, основанные на получении СО2, который образовывается на химических производствах в виде отходов.
Газообразный оксид углерода (IV) получают из промышленного дыма способом адсорбции моноэтаноламина. Частицы этого вещества подаются в трубу с отходами и вбирают в себя углекислоту. После прохождение через смесь CO2 моноэтаноламины направляются на очистку в специальные резервуары, в которых, при определённых показателях температуры и давления, происходит высвобождение углекислого газа.
Углекислый газ высокого качества получается в результате брожения сырья при изготовлении спиртных напитков. На таких производствах газообразный СО2 обрабатывают водородом, перманганатом калия и углем. В результате реакции получают жидкую форму углекислоты.
Твёрдое состояние СО2 или «сухой лёд» также получают из отходов пивоваренных заводов и ликероводочных производств. Это агрегатное состояние вещества в промышленных масштабах образуется в такой последовательности:
- Из резервуара, где происходит брожение, газ подаётся в ёмкость для промывки.
- Углекислота направляется в газгольдер, в котором подвергается воздействию повышенного давления.

- В специальных холодильниках СО2 охлаждается до определённой температуры.
- Образовавшаяся жидкость фильтруется через слой угля.
- Углекислота снова направляется в холодильник, где производится дополнительное охлаждение вещества с последующим прессованием.
Таким образом получается высококачественный «сухой лёд», который может использоваться в пищевой промышленности, растениеводстве или в быту.
Применение углекислого газа
Благодаря наличию определённых физических и химических свойств углекислый газ может использоваться в различных сферах. В химической промышленности углекислота используется для:
- Синтеза искусственных химических соединений.
- Для очистки животной и растительной ткани.
- Регулирования температуры реакций.
- Нейтрализации щёлочи.
В металлургии CO2 применяется с целью:
- Регулирования отвода воды в шахтах.
- Создания лазерного луча для резки металлов.
- Осаждения вредных газообразных веществ.

Кроме перечисленных областей углекислый газ активно используется при производстве бумаги. Оксид углерода применяется регулирования водородного показателя древесной массы, а также усиления мощности производственных машин.
Углекислый газ используется в пищевой промышленности в качестве добавки, которая оказывает консервирующее действие. При изготовлении выпечки СО2 применяется в качестве разрыхлителя. Газированные напитки также изготавливаются с применением углекислоты, а для хранения быстро портящихся продуктов используется «сухой лёд».
Незаменим углекислый газ и при выращивании овощей и фруктов в зимних теплицах. В таких помещения в воздухе недостаточное количество СО2, который необходим для «дыхания» растений, поэтому приходится искусственно насыщать атмосферу этим газом.
В медицине углекислота применяется во время проведения сложных операций на внутренних органах. Наиболее ценным качеством этого газа, является использование его для реанимационных мероприятий, ведь благодаря возможности повысить его концентрацию можно эффективно стимулировать процесс дыхания пациента.
При сварке металлов углекислота применяется в качестве инертного облака, которое служит защитой расплавленного участка от попадания в него активного кислорода. В результате такой обработки сварочный шов получается идеально ровным и не подверженным окислению.
Благодаря способности охлаждаться при испарении, СО2 используется для тушения пожаров. Заправленные этим веществом огнетушители являются эффективным средством борьбы с возгораниями на объектах, где применение порошковых или пенных средств тушения невозможно.
В быту углекислота используется в качестве напорного газа в пневматическом оружии, а также для отпугивания комаров и борьбы с грызунами.
Углекислый газ в атмосфере
Изменения концентрации атмосферной углекислоты (кривая Килинга). Измерения на обсерватории Мауна-Лоа.
Ежегодные колебания концентрации атмосферной углекислоты на планете определяются, главным образом, растительностью средних (40—70°) широт Северного полушария.
Вегетация в тропиках практически не зависит от сезона, сухой пояс пустынь 20—30° (обоих полушарий) дает малый вклад в круговорот углекислоты, а полосысуши, наиболее покрытые растительностью, расположены на Земле асимметрично (в Южном полушарии в средних широтах находится океан).
Поэтому с марта по сентябрь вследствие фотосинтеза содержание СО2 в атмосфере падает, а с октября по февраль — повышается. Вклад в зимний прирост дают как окисление древесины (гетеротрофное дыхание растений, гниение, разложение гумуса, лесные пожары), так и сжигание ископаемых топлив (угля, нефти, газа), заметно увеличивающееся в зимний сезон.
Польза и вред Диоксида углерода
Диоксид углерода не является токсичным веществом, поэтому считается безвредным для организма человека. Но, являясь ускорителем процесса всасывания веществ в слизистую желудка, провоцирует, например, быстрое опьянение при употреблении газированных алкогольных напитков. Не рекомендуется увлекаться употреблением газировки всем, имеющим любые проблемы с желудочно-кишечным трактом, потому что самыми безобидными негативными проявлениями действия Е290 являются вздутие живота и отрыжка.
Углекислый газ: хранение и транспортировка
Хранение СО осуществляется в баллонах чёрного цвета, на корпусе которых обязательно должна быть надпись «Углекислота».
Кроме этого, на ёмкости наносится маркировка, по которой можно получить информацию о производителе баллона, весе пустой ёмкости, а также узнать дату последнего освидетельствования. Нельзя использовать углекислотные баллоны, у которых:
- Истёк срок освидетельствования.
- Имеются повреждения.
- Неисправны вентили.
Транспортировка наполненных газом баллонов должна осуществляться по следующим правилам:
- Транспортировать ёмкости только в горизонтальном положении. Вертикальное размещение допускается только в том случае, если имеются специальные ограждения, которые препятствуют падению баллона во время перевозки.
- Для безопасного перемещения на баллонах должны быть резиновые кольца.
- Не допускать механических воздействий, а также чрезмерного нагрева.
- Запрещается перевозка углекислотных баллонов в торговых аппаратах.
Кроме этого, техникой безопасности запрещается переносить баллоны вручную или перекатывать их по земле.
Хранение баллонов с углекислотой может осуществляться как в специально оборудованных помещениях, так и под открытым небом. В зданиях ёмкости следует размещать на расстоянии не менее 1 метра от отопительных приборов. При хранении на улице необходимо оградить ёмкости от воздействия прямых солнечных лучей и осадков, поэтому размещать резервуары таким способом рекомендуется под навесом. Если хранение баллонов осуществляется в неотапливаемом помещении или под открытым небом, то в зимнее время необходимо следить за тем, чтобы ёмкости не охлаждались ниже минус 40 градусов Цельсия.
Источники
- https://ballonis.ru/stati/uglekislyy-gaz-harakteristiki-i-primenenie
- https://www.calc.ru/Oksid-Ugleroda-Ii.html
- https://obrazovaka.ru/himiya/uglekislyy-gaz-formula-8-klass.html
- https://student-madi.ru/prochee/fizicheskie-i-himicheskie-svojstva-uglekislogo-gaza.html
- https://tgko.ru/spravka/gaz/dvuokis_ugleroda/
- https://calorizator.ru/addon/e2xx/e290
Ваша оценка?
Петр Иваныч
Возможно этот человек ответит на ваши вопросы
Задать вопрос
Углекислый газ (диоксид углерода) – Актуальные публикации на сайте компании «НИИ КМ»
Он не пригоден для поддержания жизни. Однако именно им «питаются» растения, превращая его в органические вещества. К тому же он является своеобразным «одеялом» Земли. Если этот газ вдруг исчезнет из атмосферы, на Земле станет гораздо прохладнее, а дожди практически исчезнут.
Однако именно им «питаются» растения, превращая его в органические вещества. К тому же он является своеобразным «одеялом» Земли. Если этот газ вдруг исчезнет из атмосферы, на Земле станет гораздо прохладнее, а дожди практически исчезнут.
«Одеяло Земли»
Углекислый газ (двуокись углерода, диоксид углерода, CO2) формируется при соединении двух элементов: углерода и кислорода. Он образуется в процессе сжигания угля или углеводородных соединений, при ферментации жидкостей, а также как продукт дыхания людей и животных. В небольших количествах он содержится и в атмосфере, откуда он ассимилируется растениями, которые, в свою очередь, производят кислород.
Углекислый газ бесцветен и тяжелее воздуха. Замерзает при температуре −78.5°C с образованием снега, состоящего из двуокиси углерода. В виде водного раствора он образует угольную кислоту, однако она не обладает достаточной стабильностью для того, чтобы ее можно было легко изолировать.
Углекислый газ — это «одеяло» Земли. Он легко пропускает ультрафиолетовые лучи, которые обогревают нашу планету, и отражает инфракрасные, излучаемые с ее поверхности в космическое пространство. И если вдруг углекислый газ исчезнет из атмосферы, то это в первую очередь скажется на климате. На Земле станет гораздо прохладнее, дожди будут выпадать очень редко. К чему это в конце концов приведет, догадаться нетрудно.
Он легко пропускает ультрафиолетовые лучи, которые обогревают нашу планету, и отражает инфракрасные, излучаемые с ее поверхности в космическое пространство. И если вдруг углекислый газ исчезнет из атмосферы, то это в первую очередь скажется на климате. На Земле станет гораздо прохладнее, дожди будут выпадать очень редко. К чему это в конце концов приведет, догадаться нетрудно.
Правда, такая катастрофа нам пока еще не грозит. Скорее даже, наоборот. Сжигание органических веществ: нефти, угля, природного газа, древесины – постепенно увеличивает содержание углекислого газа в атмосфере. Значит, со временем надо ждать значительного потепления и увлажнения земного климата. Кстати, старожилы считают, что уже сейчас заметно теплее, чем было во времена их молодости…
Двуокись углерода выпускается жидкая низкотемпературная, жидкая высокого давления и газообразная. Ее получают из отбросных газов производств аммиака, спиртов, а также на базе специального сжигания топлива и других производств. Газообразная двуокись углерода – газ без цвета и запаха при температуре 20°С и давлении 101,3 кПа (760 мм рт. ст.), плотность – 1,839 кг/м3. Жидкая двуокись углерода – просто бесцветная жидкость без запаха.
Газообразная двуокись углерода – газ без цвета и запаха при температуре 20°С и давлении 101,3 кПа (760 мм рт. ст.), плотность – 1,839 кг/м3. Жидкая двуокись углерода – просто бесцветная жидкость без запаха.
Углекислый газ нетоксичен и невзрывоопасен. При концентрациях более 5% (92 г/м3) двуокись углерода оказывает вредное влияние на здоровье человека — она тяжелее воздуха и может накапливаться в слабо проветриваемых помещениях у пола. При этом снижается объемная доля кислорода в воздухе, что может вызвать явление кислородной недостаточности и удушья.
Получение двуокиси углерода
В промышленности углекислый газ получают из печных газов, из продуктов разложения природных карбонатов (известняк, доломит). Смесь газов промывают раствором карбоната калия, который поглощает углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании разлагается, высвобождая углекислоту. При промышленном производстве газ закачивается в баллоны.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора с соляной кислотой.
«Сухой лед» и прочие полезные свойства диоксида углерода
В повседневной практике углекислый газ используется достаточно широко. Например, газированная вода с добавками ароматных эссенций – прекрасный освежающий напиток. В пищевой промышленности диоксид углерода используется и как консервант — он обозначается на упаковке под кодом Е290, а также в качестве разрыхлителя теста.
Углекислотными огнетушителями пользуются при пожарах. Биохимики нашли, что удобрение… воздуха углекислым газом весьма эффективное средство для увеличения урожайности различных культур. Пожалуй, такое удобрение имеет единственный, но существенный недостаток: применять его можно только в оранжереях. На заводах, производящих диоксид углерода, сжиженный газ расфасовывают в стальные баллоны и отправляют потребителям. Если открыть вентиль, то из отверстия с шипением вырывается… снег. Что за чудо?
Если открыть вентиль, то из отверстия с шипением вырывается… снег. Что за чудо?
Все объясняется просто. Работа, затраченная на сжатие газа, оказывается значительно меньше той, которая требуется на его расширение. И чтобы как-то компенсировать возникающий дефицит, углекислый газ резко охлаждается, превращаясь в «сухой лед». Он широко используется для сохранения пищевых продуктов и перед обычным льдом имеет значительные преимущества: во-первых, «хладопроизводительность» его вдвое выше на единицу веса; во-вторых, он испаряется без остатка.
Углекислый газ используется в качестве активной среды при сварке проволокой, так как при температуре дуги углекислота разлагается на угарный газ СО и кислород, который, в свою очередь, и входит во взаимодействие с жидким металлом, окисляя его.
Углекислота в баллончиках применяется в пневматическом оружии и в качестве источника энергии для двигателей в авиамоделировании.
Углекислый газ – формула, молярная масса, физические свойства (8 класс, химия)
Углекислый газ Составная часть атмосферы, основное сырье для процесса фотосинтеза зеленых растений, продукт жизнедеятельности живых организмов.
По систематической международной номенклатуре (IUPAC) вещество с формулой СО2 получило название – Оксид углерода(IV). Тривиальные (общепринятые названия) – двуокись или диоксид углерода, угольный ангидрид (солеобразующий оксид, обладающий кислотными свойствами).
Формула углекислого газа
СО2
Молекула углекислого газа образована двумя атомами кислорода и атомом углерода. Структурная формула – О=С=О. Валентность углерода равна 4. Степень окисления – (+4). Тип связи – ковалентная полярная.
Углекислый газ, формула, молекула, строение, состав, вещество:
Углекислый газ (диоксид углерода, двуокись углерода, углекислота, оксид углерода (IV), угольный ангидрид) – бесцветный газ, почти без запаха (в больших концентрациях с кисловатым «содовым» запахом).
Углекислый газ – бинарное химическое соединение углерода и кислорода, имеющее формулу CO2.
Химическая формула углекислого газа CO2.
Строение молекулы углекислого газа, структурная формула углекислого газа:
Углекислый газ тяжелее воздуха приблизительно в 1,5 раза. Его плотность при нормальных условиях составляет 1,98 кг/м3, по отношении к воздуху – 1,524. Поэтому скапливается в низких непроветриваемых местах.
Концентрация углекислого газа в воздухе (в атмосфере Земли) составляет в среднем 0,046 % (по массе) и 0,0314 % (по объему).
Углекислый газ вырабатывается в органах и тканях человека образуется в качестве одного из конечных продуктов метаболизма. Он переносится от тканей по венозной системе и затем выделяется с выдыхаемым воздухом через лёгкие. Таким образом, содержание углекислого газа в крови велико в венозной системе, уменьшается в капиллярной сети лёгких, и содержание его мало в артериальной крови. В выдыхаемом человеком воздухе содержится около 4,5% диоксида углерода, что в 60-110 раз больше, чем во вдыхаемом. Организм человека выделяет приблизительно 1 кг углекислого газа в сутки.
В выдыхаемом человеком воздухе содержится около 4,5% диоксида углерода, что в 60-110 раз больше, чем во вдыхаемом. Организм человека выделяет приблизительно 1 кг углекислого газа в сутки.
Углекислый газ растворяется в воде. В 100 граммах воды растворяется 0,3803 грамма CO2 при 16 °C, 0,3369 грамма CO2 – при 20 °C, 0,2515 грамма CO2 – при 30 °C. Растворяясь в воде, образует угольную кислоту Н2CO3. Растворим также в ацетоне, бензоле, метаноле и этаноле.
Термически устойчив при температурах менее 1000 °C. При температуре 1000 °C восстанавливается углем до оксида углерода (II).
При нормальном атмосферном давлении диоксид углерода не существует в жидком состоянии, существует только в твердом или газообразном состоянии. Твердая двуокись углерода при повышении температуры не плавится, а переходит (возгоняется) непосредственно из твёрдого состояния в газообразное. Твёрдую двуокись углерода также называют сухим льдом. Внешний вид сухого льда напоминает обычный лед, снегоподобную массу. При сублимации сухой лед поглощает около 590 кДж/кг (140 ккал/кг) теплоты.
При сублимации сухой лед поглощает около 590 кДж/кг (140 ккал/кг) теплоты.
Под давлением 35 000 атм. твердая углекислота становится проводником электрического тока.
Жидкий углекислый газ можно получить при повышении давления. Так, при температуре 20 °С и давлении свыше 6 МПа (~60 атм.) газ сгущается в бесцветную жидкость. При нормальных условиях (20 °С и 101,3 кПа) при испарении 1 кг жидкой углекислоты образуется 509 л углекислого газа. Хранят и транспортируют углекислый газ, как правило, в жидком состоянии
Двуокись углерода негорюча, но в ее атмосфере может поддерживаться горение активных металлов, например, щелочных металлов и щелочноземельных – магния, кальция, бария.
Двуокись углерода нетоксична, невзрывоопасна.
Предельно допустимая концентрация двуокиси углерода в воздухе рабочей зоны не установлена, при оценке этой концентрации можно ориентироваться на нормативы для угольных и озокеритовых шахт, установленные в пределах 0,5% (об. ) или 9,2 г/м (см. ГОСТ 8050-85 «Двуокись углерода газообразная и жидкая. Технические условия»).
) или 9,2 г/м (см. ГОСТ 8050-85 «Двуокись углерода газообразная и жидкая. Технические условия»).
По степени воздействия на организм человека двуокись углерода относится к 4-му классу опасности по ГОСТ 12.1.007-76.
При концентрациях более 5% (92 г/м) двуокись углерода оказывает вредное влияние на здоровье человека, так как она тяжелее воздуха в полтора раза и может накапливаться в слабопроветриваемых помещениях у пола и в приямках, а также во внутренних объемах оборудования для получения, хранения и транспортирования газообразной, жидкой и твердой двуокиси углерода. При этом снижается объемная доля кислорода в воздухе, что может вызвать явление кислородной недостаточности и удушья.
Углекислый газ образуется при гниении и горении органических веществ, в результате вулканической деятельности. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Искусственными источниками образования углекислого газа являются промышленные выбросы и выхлопные газы автомобильного транспорта.
Углекислый газ легко пропускает излучение в ультрафиолетовой и видимой частях спектра, которое поступает на Землю от Солнца и обогревает её. В то же время он поглощает испускаемое Землёй инфракрасное излучение и является одним из парниковых газов, вследствие чего участвует в процессе глобального потепления.
Тест по теме
- Вопрос 1 из 10
Как выглядит формула углекислого газа?
Начать тест(новая вкладка)
Доска почёта
Чтобы попасть сюда — пройдите тест.
-
- Яна Василькова
8/10
- Карина Гаврилова
10/10
- Елена Асадова
7/10
- Лиана Бизина
10/10
- Кристина Микляева
10/10
Получение углекислого газа:
В промышленности углекислый газ образуется в дымовых газах при сжигании различных органических и неорганических веществ или как побочный продукт химических процессов, например, при разложении природных карбонатов (доломита, известняка).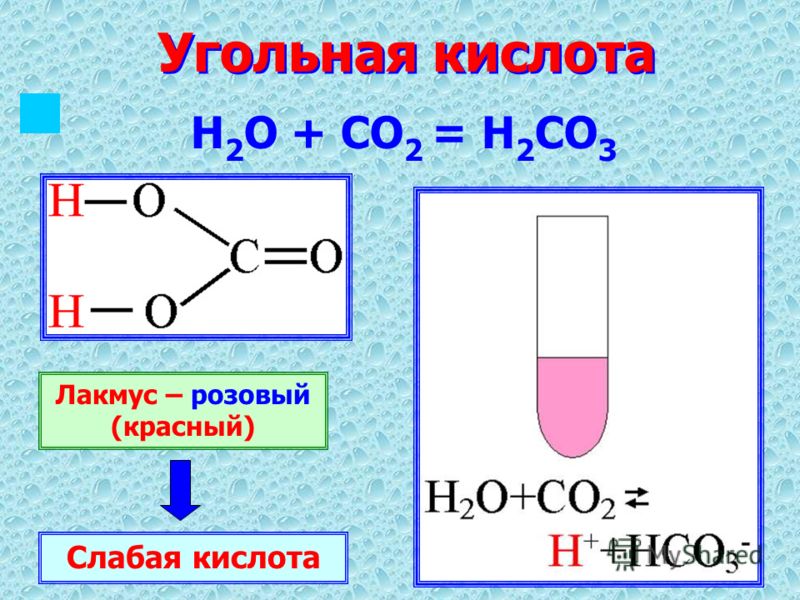 Также углекислый газ как побочный продукт получают на установках разделения воздуха с целью получения чистого кислорода, азота и аргона.
Также углекислый газ как побочный продукт получают на установках разделения воздуха с целью получения чистого кислорода, азота и аргона.
В лабораторных условиях углекислый газ получают, например, в результате следующих химических реакций:
1. взаимодействия карбоната кальция и азотной кислоты:
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + h3O,
2. в результате взаимодействия карбоната кальция с другими минеральными кислотами,
3. взаимодействия пищевой соды с лимонной кислотой или с кислым лимонным соком,
4. реакции горения углерода:
С + O2 → CO2.
Примеры решения задач
Задача 1
Найти массовую долю углерода в углекислом газе.
Решение
М(СО2) = 12+2х16 = 44 г/моль. Аr(С) = 12 г/моль. W(С) = 12/44 = 0,27 или 27%
Ответ: массовая доля углерода в углекислом газе равна 27%.
Задача 2
Вычислить объем углекислого газа, выделившегося при взаимодействии соляной кислоты с мрамором массой 100 г.
Решение
300 г — х л
CaCO3 + 2HCl → CaCl2+ h3O + CO2
1 моль — 1 моль 100 г/моль — 22,4 л/моль 100 г — 22,4 л
х(СО2) = 300х22,4/100 = 67, 2 (л).
Ответ: Объем углекислого газа равен 67, 2 л.
Химические свойства углекислого газа. Химические реакции (уравнения) углекислого газа:
Диоксид углерода относится к кислотным оксидам, поэтому для него характерны следующие химические реакции:
1. реакция взаимодействия оксида углерода (IV) и водорода:
CO2 + 4h3 → Ch5 + 2h3O (t ~ 200 °C, kat = Cu2O).
В результате реакции образуются метан и вода.
2. реакция взаимодействия оксида углерода (IV) и углерода:
CO2 + C ⇄ 2CO (t = 700-1000 °C).
В результате реакции образуется оксид углерода (II). Реакция протекает при взаимодействии углекислого газа с раскаленными углями.
3. реакция взаимодействия оксида углерода (IV) и магния:
CO2 + 2Mg → 2MgO + C (t ~ 500 °C).
В результате реакции образуются оксид магния и углерод.
4. реакция взаимодействия оксида углерода (IV) и гафния:
Hf + CO2 → HfC + HfO2 (t = 800-1000 °C).
В результате реакции образуются карбид гафния и оксид гафния.
5. реакция взаимодействия оксида углерода (IV) и германия:
Ge + CO2 → GeO + CO (t = 700-900 °C).
В результате реакции образуются оксид германия и оксид углерода (II).
6. реакция взаимодействия оксида углерода (IV) и цинка:
Zn + CO2 → ZnO + CO (t = 800-950 °C).
В результате реакции образуются оксид цинка и оксид углерода (II).
7. реакция взаимодействия оксида углерода (IV) и индия:
2In + CO2 → In2O + CO (t ~ 850 °C).
В результате реакции образуются оксид индия и оксид углерода (II).
8. реакция взаимодействия оксида углерода (IV) и циркония:
2Zr + CO2 → ZrC + ZrO2 (t = 800-100 °C).
В результате реакции образуются карбид циркония и оксид циркония.
9. реакция взаимодействия оксида углерода (IV) и вольфрама:
W + 2CO2 → WO2 + 2CO (t ~ 1200 °C).
В результате реакции образуются оксид вольфрама и оксид углерода (II).
10. реакция взаимодействия оксида углерода (IV) и оксида лития:
Li2O + CO2 → Li2CO3.
В результате реакции образуется карбонат лития.
11. реакция взаимодействия оксида углерода (IV) и оксида натрия:
Na2O + CO2 → Na2CO3 (t = 450-550 °C).
В результате реакции образуется карбонат натрия.
12. реакция взаимодействия оксида углерода (IV) и оксида калия:
K2O + CO2 → K2CO3 (t ~ 400 °C).
В результате реакции образуется карбонат калия.
13. реакция взаимодействия оксида углерода (IV) и оксида бария:
BaO + CO2 → BaCO3.
В результате реакции образуется карбонат бария.
14. реакция взаимодействия оксида углерода (IV) и оксида кальция:
CaO + CO2 → CaCO3.
В результате реакции образуется карбонат кальция.
15. реакция взаимодействия карбоната кальция, оксида углерода (IV) и воды:
CaCO3 + CO2 + h3O → Ca(HCO3)2.
В результате реакции образуется гидрокарбонат кальция.
16. реакция взаимодействия оксида углерода (IV) и оксида магния:
MgO + CO2 → MgCO3.
В результате реакции образуется карбонат магния.
17. реакция взаимодействия оксида углерода (IV) и оксида кремния (II):
SiO + CO2 → SiO2 + CO (t ~ 500 °C).
В результате реакции образуются оксид кремния (IV) и оксид углерода (II).
18. реакция взаимодействия оксида углерода (IV) и воды:
CO2 + h3O ⇄ h3CO3.
В результате реакции образуется угольная кислота.
19. реакция взаимодействия оксида углерода (IV) и гидроксида лития:
2LiOH + CO2 → Li2CO3 + h3O.
В результате реакции образуются карбонат лития и вода. В ходе реакции используется концентрированный раствор гидроксида лития.
В ходе реакции используется концентрированный раствор гидроксида лития.
20. реакция взаимодействия оксида углерода (IV) и гидроксида калия:
KOH + CO2 → KHCO3,
2KOH + CO2 → K2CO3 + h3O.
В первом случае в результате реакции образуются гидрокарбонат калия, во втором случае – карбонат калия и вода. Реакция протекает в первом случае в этаноле и используется разбавленный раствор гидроксида калия, во втором используется концентрированный раствор гидроксида калия.
21. реакция взаимодействия оксида углерода (IV) и гидроксида натрия:
NaOH + CO2 → NaHCO3,
2NaOH + CO2 → Na2CO3 + h3O.
В первом случае в результате реакции образуются гидрокарбонат натрия, во втором – карбонат натрия и вода. В ходе первой реакции используется разбавленный раствор гидроксида натрия, в ходе второй – концентрированный раствор гидроксида натрия.
22. реакция взаимодействия оксида углерода (IV) и гидроксида кальция:
Ca(OH)2 + CO2 → CaCO3 + h3O.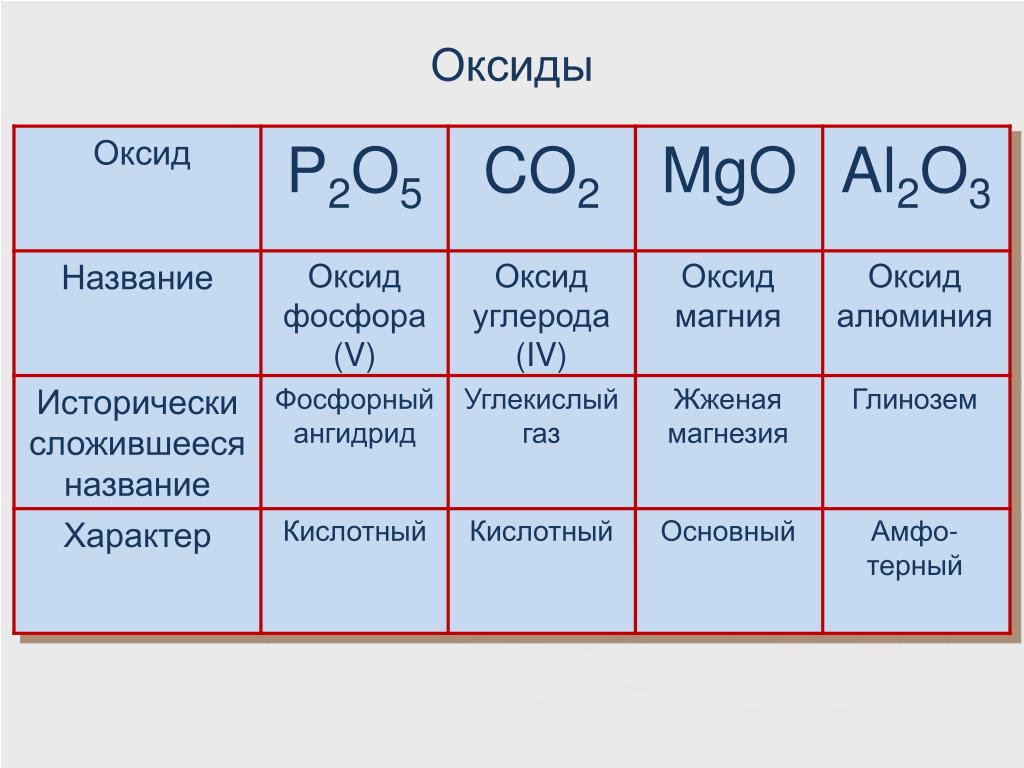
В результате реакции образуются карбонат кальция и вода.
23. реакция взаимодействия оксида углерода (IV) и гидроксида бария:
Ba(OH)2 + CO2 → BaCO3 + h3O.
В результате реакции образуются карбонат бария и вода.
24. реакция взаимодействия оксида углерода (IV) и метана:
Ch5 + CO2 → 2CO + 2h3 (t = 800-900 °C, kat = NiO, нанесенный на Al2O3).
В результате реакции образуются оксид углерода (II) и вода.
25. реакция термического разложения оксида углерода (IV):
2CO2 → 2CO + O2 (t > 2000 °C).
В результате реакции образуются оксид углерода (II) и кислород.
26. реакция фотосинтеза:
6CO2 + 6h3O → C6h22O6 + 6O2 (hv, kat = хлорофилл).
В результате реакции образуются глюкоза и кислород.
Carbon Dioxide | SIAD
Навигационная цепочка
Углекислый газ header
Контакты generico
Контакты
+7. 495.7213026
495.7213026
Ссылка на страницу
Углекислый газ
- ТЕХНИЧЕСКИЕ СВОЙСТВА
- ПРИМЕНЕНИЕ
- БЕЗОПАСНОСТЬ
- ПРОИЗВОДСТВО
- СПОСОБЫ ПОСТАВКИ
Углекислый газ – неотъемлемая часть основного жизненного цикла в природе: он выдыхается людьми и животными, затем используется растениями, способствуя их росту; растения, в свою очередь, производят кислород, который необходим для жизни людей.
Технические свойства
Продукт: carbon dioxide
Химическая формула: CO2
Уровень чистоты: ≥ 99.5%
Относительная плотность (воздух = 1): 1.529
Вид: бесцветный газ
Запах: газ без запаха
Точка воспламенения в воздухе: негорючий
Технические свойства
Углекислый газ имеет несколько видов применения, которые перечислены ниже.
Производство продовольствия и напитков
В производстве продовольствия и напитков углекислый газ используется:
- для насыщения напитков углекислотой (газирования)
- как естественное антибактериальное средство, для увеличиения срока годности молочных продуктов, сохранения их вкуса и структуры и сокращения потребности в естественных и искусственных консервантах
- для заморозки и охлаждения пищевых продуктов
- для криогенной заморозки IQF пищевых продуктов
- для упаковки в измененной атмосфере
- для охлаждения блендеров и миксеров
- для охлаждения и конвейерной транспортировки компонентов
- для охлаждения грузов при транспортировке
- для криоочистки пищевых красителей и производственных установок
- в твердой форме, известной, как “сухой лед”.

Водоочистка
В водоочистке углекислый газ используется:
- для процессов нейтрализации. Углекислый газ заменяет более жёсткие кислоты в процессе нейтрализации щелочей. Это более безопасно и более дешево, чем серно-кислотные системы, улучшается контроль над процессом и снижается время простоя, а также не требуется применения химикалий. Также это менее коррозийный способ, с углекислотой легче обращаться и хранить её.
Производство метеллопродукции
В производстве метеллопродукции углекислый газ используется:
- как защитный газ во время сварки. Он предотвращает загрязнение атмосферы расплавленным металлом во время процесса электродуговой сварки.
Питомники и рассадники
В питомниках и рассадниках углекислый газ используется:
- для роста растений. Системы углекислого газа значительно улучшают рост и качество растений в теплице. При увеличении концентрации газа, растения становятся крупнее и здоровее, растут быстрее, и всё это – при снижении эксплуатационных расходов, что особенно важно зимой, когда углекислота позволяет уменьшить затраты на отопление до 50%.
 Углекислый газ заменяет газовые генераторы, экономя топливные затраты и устраняя вредные выбросы.
Углекислый газ заменяет газовые генераторы, экономя топливные затраты и устраняя вредные выбросы.
Целлюлозно-бумажная промышленность
В целлюлозно-бумажной промышленности углекислый газ используется:
- для нескольких видов применения на бумажных фабриках, каждое из которых способно уменьшить затраты и сэкономить ценные химикалии, используемые в производственном процессе. Процесс с использованием углекислого газа вместо применения серной кислоты для обработки массы в экранированных помещениях является очень успешным.
- Для изготовления осаждённого карбоната кальция (PCC), который используется для уменьшения использования девственного (без рециркуляции) древесного волокна в бумажном производстве.
Другие виды применения
Другие важные виды применения углекислого газа:
- В качестве источника энергии. Хранение углекислого газа в его тройной точке (комбинация температуры и давления, при которой углекислый газ может существовать одновременно как твёрдое тело, жидкость или газ) испытывается как средство обеспечения охлаждения замкнутого цикла, чтобы сдвинуть использование электрической энергии на непиковые часы потребления.

- В очистке и экстракции растворителем, в сверхкритическом состоянии (31.1°C и 7.38MPa), взамен хлорированных фторуглеродов, для очистки компонентов оборудования.
- В очистке и экстракции растворителем, в сверхкритическом состоянии (31.1°C и 7.38MPa), взамен многих изменчивых органических соединений для операций типа извлечения кофеина из кофе или извлечения жира из продовольственных продуктов.
- В криогенной очистке. Сухая ледовая крупа углекислого газа, разогнанная сжатым воздухом, может заменить чистящие растворители и абразивные материалы типа песка и пластмассовых бусинок. Этот процесс также устраняет пыль и ядовитые химические пары и минимизирует отходы. Углекислый газ не проводит электричество, то есть безопасен для очистки электрических комплектующих, и неабразивен, взрыво- и пожаробезопасен.
- В борьбе с огнем. Углекислый газ тушит пожары, не повреждая и не загрязняя никакие материалы, и используется для борьбы с пожарами, когда вода неэффективна, нежелательна или недоступна.

Максимальные концентрации свободного углекислого газа в рабочих областях не должны быть выше 0.5%. Кроме того, контакт с газом в его жидких или твердых состояниях может причинить холодные или морозные ожоги.
Чтобы избежать этих вредных воздействий, производители и клиенты должны следовать строгим правилам безопасности при хранении газа и обращении с ним, а также сверяться с нашим относящимся к углекислоте Информационным листком по безопасности материалов.
Производство водорода и углекислого газа происходит путём преобразования пара, этот процесс основан на реакции между метаном и водяным паром.
Главные этапы процесса упомянуты ниже:
Восстановление и хранение углекислого газа соединяет экономические и экологические преимущества благодаря сокращению выброса газов, вызывающих парниковый эффект в атмосфере.
Варианты поставки углекислого газа и услуги, доступные клиентам SIAD, включают:
- Транспортировку в баллонах, блоках баллонов и резервуарах.

- Проектирование и установка систем распределения газа.
- Поставка оборудования для правильного использования газа.
- Помощь и техническое консультирование по транспортировке, распределению и применению газа.
Углекислый газ может также поставляться:
- Со степенью чистоты 3.5 – 4.0 – 4.8
- В специальных и калибровочных смесях с различным составом, по запросу.
- В смесях для лазера.
- Для терапевтического и диагностического использования.
Способы поставки
Угарный газ – воздействие на человека, и приборы, его контролирующие
Из статьи вы узнаете, как образуется угарный газ, его формулу, где встречается, каким образом им можно отравиться в быту и на производстве, а также познакомитесь с признаками и симптомами отравления.
Общие сведения о СО
Окись углерода, монооксид углерода, или всем известный угарный газ (формула СО) – это не имеющий запаха, цвета или вкуса очень токсичное и опасное для здоровья человека газообразное соединение.
Угарный газ образуется при горении любых материалов, в состав которых входит углерод – это бензин, природный газ солярка, угли, дрова и прочие органические материалы, в том числе мебель и предметы обихода. Процесс горения приводит к окислению органических веществ и сопровождается выделением двуокиси углерода (углекислого газа) и воды. В идеале, полное сгорание ограничивается этими двумя веществами. Однако в нормальных условиях при горении наблюдается недостаток кислорода (особенно в замкнутом или плохо проветриваемом пространстве), что приводит к неполному окислению углеродов и образованию угарного газа.
Немного печальной статистики – при пожаре основная причина гибели людей это, как вы могли бы предположить, не обширные ожоговые поражения и смерть в огне, а именно отравление угарным газом.
Действие угарного газа заключается в следующем – попадая в дыхательные пути молекулы этого соединения быстро всасываются в кровь и связываются с молекулами гемоглобина. При этом образуется карбоксигемоглобин, вещество, препятствующее транспортировке кислорода по организму человека и очень быстро вызывающее кислородную недостаточность.
Небольшая концентрация угарного газа (не более 0,08%) вызывает удушье и головную боль, при превышении до 0,32% наблюдается паралич и потеря сознания. При воздействии такой концентрации в течение 25-30 минут наиболее вероятен смертельный исход.
В зависимости от симптомов отравления от угарного газа различают три степени тяжести:
- Легкая степень тяжести. Эта стадия характеризуется такими признаками угарного газа как: общая слабость, головная боль, отдающая в лобную долю и виски и височной областях, головокружения и шум в ушах, а также нарушение зрительных функций. Отравление сопровождается сухим кашлем, нехваткой воздуха, одышкой, слезотечением, тошнотой и тахикардией.
- Тяжесть средней степени. В данном случае все вышеперечисленные признаки не просто сохраняются, но и усугубляются. Так, чувство тошноты переходит в рвоту, возникает затуманенность сознания и кратковременная потеря сознания, галлюцинации, боли в груди давящего характера.
- Тяжелая степень.
 Как уже говорилось выше, главное свойство угарного газа – это способность вызывать кислородную недостаточность в организме человека. При относительно длительном воздействии (15-25 минут), наступает необратимое изменение биологических и физических показателей в крови, сопровождающееся параличом, долговременной потерей сознания, вплоть до коматозного состояния. Также наблюдаются судороги, непроизвольное мочеиспускание и опорожнение кишечника, посинение кожных покровов и слизистых оболочек. Дыхание человека при этом, вследствие дефицита кислорода, становится поверхностным и прерывистым. Далее наступает смерть.
Как уже говорилось выше, главное свойство угарного газа – это способность вызывать кислородную недостаточность в организме человека. При относительно длительном воздействии (15-25 минут), наступает необратимое изменение биологических и физических показателей в крови, сопровождающееся параличом, долговременной потерей сознания, вплоть до коматозного состояния. Также наблюдаются судороги, непроизвольное мочеиспускание и опорожнение кишечника, посинение кожных покровов и слизистых оболочек. Дыхание человека при этом, вследствие дефицита кислорода, становится поверхностным и прерывистым. Далее наступает смерть.
Как обнаружить угарный газ
Утечка угарного газа в быту чаще всего связана с неправильной установкой или эксплуатацией отопительных бытовых приборов. В зоне риска находятся дома с печным отоплением и каминами, бани и сауны. Оставленная в заведенном состоянии в гараже машина также выделяет угарный газ и делает длительное нахождение в помещении опасным для здоровья. Также работающая машина в гараже, прилегающем к дому, становится потенциальным источников опасности для всех его жителей.
Также работающая машина в гараже, прилегающем к дому, становится потенциальным источников опасности для всех его жителей.
Повышенный риск образования угарного газа имеют закрытые помещения, такие как лифт, подсобки и прочие небольшие или имеющие затрудненный выход пространства.
Образование угарного газа и достижение его смертельных концентраций часто возникает и на объектах производства. Так, работа большинства отраслей промышленности сопровождается технологическими процессами, связанными с горением. Особому риску подвержены шахты, разведочные буровые установки, эксплуатационные платформы, наземные нефте- и газохранилища, нефтеперерабатывающие заводы и т.д.
Утечку угарного газа невозможно обнаружить без применения специальных приборов, так как отсутствует изменение цвета, вкуса и запаха воздуха. С этой целью выпускают специальные системы обнаружения угарного газа, помогающие сделать бытовую жизнь и производственные процессы безопасными, сократить риски для здоровья.
В состав системы входят датчики угарного газа (газоанализаторы угарного газа или сигнализаторы угарного газа), а также контроллеры и устройства оповещения. В совокупности эти приборы позволяют быстро обнаружить угарный газ и предупредить о развитие опасной ситуации еще на ранних стадиях.
В совокупности эти приборы позволяют быстро обнаружить угарный газ и предупредить о развитие опасной ситуации еще на ранних стадиях.
Мы собрали ТОП-10 газоанализаторов угарного газа, разделенных по сфере применения и наличию дополнительных функций.
ТОП-10 газоанализаторов угарного газа
| Модель | Внешний вид | Характеристики |
| Domino B10-DM03G газоанализаторы угарного газа стационарные | Тип: Стационарный/Одноканальный. Режим работы: Непрерывный. Область применения: Производственные помещения, котельные, административный и жилой сектор. Особенности: Настенный монтаж. Съемный электрохимическим сенсор. Высокая степень надежности и малое энергопотребление. Ударопрочный эргономичный корпус. | |
| Testo-317-3 течеискатели угарного газа портативные | Тип: Портативный (индивидуальный). Режим работы: Периодический. Область применения: Котельные, кухни, прачечные, системы вентиляции и кондиционирования воздуха, промышленный сектор, склады, мониторинг газового отопительного оборудования. Особенности: Выдача оптический и акустический сигнал тревоги при превышении предельных значений. Функция самодиагностики. | |
| Testo-315-3 анализаторы угарного и углекислого газов | Тип: Стационарный/Одноканальный. Режим работы: Непрерывный. Область применения: Котельные, кухни, прачечные, системы вентиляции и кондиционирования воздуха, промышленный сектор, склады, мониторинг газового отопительного оборудования. Особенности: Параллельное измерение СО и CO2. Опциональное измерение относительной влажности и температуры воздуха. Возможность печати данных непосредственно на объекте с помощью опционального принтера. | |
| СЗ-2Е сигнализаторы загазованности угарным газом | Тип: Стационарный/Одноканальный. Режим работы: Непрерывный. Область применения: Котельные и других коммунально-бытовые и производственные помещения. Особенности: Возможность управления клапаном. Порт RS485 или радиоканал. Питание от сети ~230В или внешнего источника. | |
| ОКА исп. И11 газоанализаторы переносные с выносным блоком датчиков | Тип: Переносной.Режим работы: Периодический. Область применения: Подвалы, подземные коммуникации, туннели канализации и связи, емкости и подобные труднодоступные места. Особенности: Одновременный контроль до 5 газов. Малые масса и габариты. Работоспособность при отрицательных температурах (до -40°С). | |
| ОКА исп. И22Д2 газоанализаторы стационарные с графическим дисплеем | Тип: Стационарный/Многоканальный. Режим работы: Непрерывный. Область применения: Производственные помещения, колодцы, подвалы, подземные коммуникации и другие объекты, где возможно опасное изменение состава воздуха рабочей зоны. Особенности: Одновременный контроль до 4 газов. Малогабаритный корпус с устройствами крепления на DIN-рейку. Блок индикации имеет графический дисплей. | |
| Хоббит-Т исп. И11 газоанализаторы переносные с выносным блоком датчиков | Тип: Переносной. Режим работы: Периодический. Область применения: Подвалы, подземные коммуникации, туннели канализации и связи, емкости и подобные труднодоступные места. Особенности: Одновременный контроль до 5 газов. Блок индикации оснащен жидкокристаллическим дисплеем для индикации показаний и имеет встроенную световую и звуковую сигнализацию. | |
| Хоббит-Т стационарный многоканальный газоанализатор исп. И21 | Тип: Стационарный/Многоканальный Режим работы: Непрерывный. Область применения: Производственные помещения, колодцы, подвалы, подземные коммуникации и другие объекты, где возможно опасное изменение состава воздуха рабочей зоны. Особенности: Одновременный контроль до 12 газов. Выносной блок датчиков. Предусмотрена возможность связи с компьютером с помощью последовательного интерфейса. Для каждого канала измерения имеется светодиодная сигнализация неисправности, дублируемая звуковым сигналом. | |
| ОКА исп. И21 газоанализаторы стационарные многоканальные | Тип: Стационарный/Многоканальный Режим работы: Непрерывный Область применения: Производственные помещения, колодцы, подвалы, подземные коммуникации и другие объекты, где возможно опасное изменение состава воздуха рабочей зоны. Особенности: Одновременный контроль до 16 газов. Жидкокристаллический дисплей. Высокая степень защиты корпуса. | |
| СОУ-1 сигнализатор оксида углерода | Тип: Стационарный/Одноканальный Режим работы: Непрерывный Область применения: Коммунальное хозяйство и индивидуальный жилой сектор, помещения котельных, колодцы, шахты, гаражи, крытые автостоянки и помещения других объектов, где существует опасность выделения и скопления угарного газа. Особенности: Наличие «сухих» контактов реле с повышенной нагрузочной способностью, позволяющих включать (отключать) вентиляцию, сирену и другие исполнительные устройства. Наличие внешнего входа «авария», что позволяет соединять приборы в шлейф совместно с газосигнализаторами или подключать их к пожарной или охранной сигнализации. |
Чтобы правильно подобрать газоанализаторы угарного газа, узнать их стоимость или приобрести, вам достаточно позвонить по телефону +7 (4812) 209-311 или написать по электронной почте info@gasdetecto. ru.
ru.
формула, плотность, свойства, применение. Баллон для углекислоты
История открытия углекислого газа
Углекислый газ – это первый газ, который был описан как дискретное вещество. В семнадцатом веке, фламандский химик Ян Баптист ван Гельмонт (Jan Baptist van Helmont) заметил, что после сжигания угля в закрытом сосуде масса пепла была намного меньше массы сжигаемого угля. Он объяснял это тем, что уголь трансформируется в невидимую массу, которую он назвал «газ».
Свойства углекислого газа были изучены намного позже в 1750г. шотландским физиком Джозефом Блэком (Joseph Black).
Он обнаружил, что известняк (карбонат кальция CaCO3) при нагреве или взаимодействии с кислотами, выделяет газ, который он назвал «связанный воздух». Оказалось, что «связанный воздух» плотнее воздуха и не поддерживает горение.
CaCO3 + 2HCl = СО2 + CaCl2 + h3O
Пропуская «связанный воздух» т.е. углекислый газ CO2 через водный раствор извести Ca(OH)2 на дно осаждается карбонат кальция CaCO3.
Джозеф Блэк использовал этот опыт для доказательства того, что углекислый газ выделяется в результате дыхания животных.
CaO + h3O = Ca(OH)2
Ca(OH)2 + CO2 = CaCO3 + h3O
Химические свойства углекислого газа. Химические реакции (уравнения) углекислого газа:
Диоксид углерода относится к кислотным оксидам, поэтому для него характерны следующие химические реакции:
1. реакция взаимодействия оксида углерода (IV) и водорода:
CO2 + 4h3 → Ch5 + 2h3O (t ~ 200 °C, kat = Cu2O).
В результате реакции образуются метан и вода.
2. реакция взаимодействия оксида углерода (IV) и углерода:
CO2 + C ⇄ 2CO (t = 700-1000 °C).
В результате реакции образуется оксид углерода (II). Реакция протекает при взаимодействии углекислого газа с раскаленными углями.
3. реакция взаимодействия оксида углерода (IV) и магния:
CO2 + 2Mg → 2MgO + C (t ~ 500 °C).
В результате реакции образуются оксид магния и углерод.
4. реакция взаимодействия оксида углерода (IV) и гафния:
Hf + CO2 → HfC + HfO2 (t = 800-1000 °C).
В результате реакции образуются карбид гафния и оксид гафния.
5. реакция взаимодействия оксида углерода (IV) и германия:
Ge + CO2 → GeO + CO (t = 700-900 °C).
В результате реакции образуются оксид германия и оксид углерода (II).
6. реакция взаимодействия оксида углерода (IV) и цинка:
Zn + CO2 → ZnO + CO (t = 800-950 °C).
В результате реакции образуются оксид цинка и оксид углерода (II).
7. реакция взаимодействия оксида углерода (IV) и индия:
2In + CO2 → In2O + CO (t ~ 850 °C).
В результате реакции образуются оксид индия и оксид углерода (II).
8. реакция взаимодействия оксида углерода (IV) и циркония:
2Zr + CO2 → ZrC + ZrO2 (t = 800-100 °C).
В результате реакции образуются карбид циркония и оксид циркония.
9. реакция взаимодействия оксида углерода (IV) и вольфрама:
W + 2CO2 → WO2 + 2CO (t ~ 1200 °C).
В результате реакции образуются оксид вольфрама и оксид углерода (II).
10. реакция взаимодействия оксида углерода (IV) и оксида лития:
Li2O + CO2 → Li2CO3.
В результате реакции образуется карбонат лития.
11. реакция взаимодействия оксида углерода (IV) и оксида натрия:
Na2O + CO2 → Na2CO3 (t = 450-550 °C).
В результате реакции образуется карбонат натрия.
12. реакция взаимодействия оксида углерода (IV) и оксида калия:
K2O + CO2 → K2CO3 (t ~ 400 °C).
В результате реакции образуется карбонат калия.
13. реакция взаимодействия оксида углерода (IV) и оксида бария:
BaO + CO2 → BaCO3.
В результате реакции образуется карбонат бария.
14. реакция взаимодействия оксида углерода (IV) и оксида кальция:
CaO + CO2 → CaCO3.
В результате реакции образуется карбонат кальция.
15. реакция взаимодействия карбоната кальция, оксида углерода (IV) и воды:
CaCO3 + CO2 + h3O → Ca(HCO3)2.
В результате реакции образуется гидрокарбонат кальция.
16. реакция взаимодействия оксида углерода (IV) и оксида магния:
MgO + CO2 → MgCO3.
В результате реакции образуется карбонат магния.
17. реакция взаимодействия оксида углерода (IV) и оксида кремния (II):
SiO + CO2 → SiO2 + CO (t ~ 500 °C).
В результате реакции образуются оксид кремния (IV) и оксид углерода (II).
18. реакция взаимодействия оксида углерода (IV) и воды:
CO2 + h3O ⇄ h3CO3.
В результате реакции образуется угольная кислота.
19. реакция взаимодействия оксида углерода (IV) и гидроксида лития:
2LiOH + CO2 → Li2CO3 + h3O.
В результате реакции образуются карбонат лития и вода. В ходе реакции используется концентрированный раствор гидроксида лития.
20. реакция взаимодействия оксида углерода (IV) и гидроксида калия:
KOH + CO2 → KHCO3,
2KOH + CO2 → K2CO3 + h3O.
В первом случае в результате реакции образуются гидрокарбонат калия, во втором случае – карбонат калия и вода. Реакция протекает в первом случае в этаноле и используется разбавленный раствор гидроксида калия, во втором используется концентрированный раствор гидроксида калия.
21. реакция взаимодействия оксида углерода (IV) и гидроксида натрия:
NaOH + CO2 → NaHCO3,
2NaOH + CO2 → Na2CO3 + h3O.
В первом случае в результате реакции образуются гидрокарбонат натрия, во втором – карбонат натрия и вода. В ходе первой реакции используется разбавленный раствор гидроксида натрия, в ходе второй – концентрированный раствор гидроксида натрия.
22. реакция взаимодействия оксида углерода (IV) и гидроксида кальция:
Ca(OH)2 + CO2 → CaCO3 + h3O.
В результате реакции образуются карбонат кальция и вода.
23. реакция взаимодействия оксида углерода (IV) и гидроксида бария:
Ba(OH)2 + CO2 → BaCO3 + h3O.
В результате реакции образуются карбонат бария и вода.
24. реакция взаимодействия оксида углерода (IV) и метана:
Ch5 + CO2 → 2CO + 2h3 (t = 800-900 °C, kat = NiO, нанесенный на Al2O3).
В результате реакции образуются оксид углерода (II) и вода.
25. реакция термического разложения оксида углерода (IV):
2CO2 → 2CO + O2 (t > 2000 °C).
В результате реакции образуются оксид углерода (II) и кислород.
26. реакция фотосинтеза:
6CO2 + 6h3O → C6h22O6 + 6O2 (hv, kat = хлорофилл).
В результате реакции образуются глюкоза и кислород.
youtube.com/embed/SgKkD_js3mg?feature=oembed” frameborder=”0″ allow=”accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture” allowfullscreen=””/>
Применение углекислого газа
Двуокись углерода чаще всего применяют:
- для создания защитной среды при сварке полуавтоматом;
- в производстве газированных напитков;
- охлаждение, замораживание и хранения пищевых продуктов;
- для систем пожаротушения;
- очистка сухим льдом от загрязнений поверхности изделий.
Применение углекислоты для сварки
Плотность углекислого газа достаточно высока, что позволяет обеспечивать защиту реакционного пространства дуги от соприкосновения с газами воздуха и предупреждает азотирование металла шва при относительно небольших расходах углекислоты в струе. Углекислый газ является активным газом, т.е. в процессе сварки он взаимодействует с металлом шва и оказывает на металл сварочной ванны окисляющее, а также науглероживающее действие.
В настоящее время ввиду большого разбрызгивания металла сварочной ванны при сварке в углекислоте все чаще применяют сварочные смеси с аргоном. Производители сварочного оборудования не остались в стороне от даной проблемы и предусматривают специальный режим на сварочных полуавтоматах, при котором уменьшается эффект разбрызгивания. Еще один путь решения данной проблемы – это применение специальных спреев или жидкостей, которые не позволяют прикипать брызгам к металлу свариваемой детали. В любом случае применение любого из данных методов с лихвой окупит затраты времени и расходных материалов на удаление брызг путем механической зачистки.
Ранее препятствием для применения углекислоты в качестве защитной среды являлось образование дефектов в швах в виде пор. Поры вызывались кипением затвердевающего металла сварочной ванны от выделения окиси углерода (СО) вследствие недостаточной его раскисленности.
При высоких температурах углекислый газ диссоциирует с образованием весьма активного свободного, одноатомного кислорода:
СO2=CO+O
Окисление металла шва выделяющимся при сварке из углекислого газа свободным кислородом нейтрализуется содержанием дополнительного количества легирующих элементов с большим сродством к кислороду, чаще всего кремнием и марганцем (сверх того количества, которое требуется для легирования металла шва) или вводимыми в зону сварки флюсами (полуавтоматическая сварка порошковой проволокой).
Как двуокись, так и окись углерода практически не растворимы в твердом и расплавленном металле. Свободный активный кислород окисляет элементы, присутствующие в сварочной ванне, в зависимости от их сродства к кислороду и концентрации по уравнению:
Мэ + О = МэО
где Мэ — металл (марганец, алюминий или др.).
Кроме того, и сам углекислый газ реагирует с этими элементами.
В результате этих реакций при сварке в углекислоте наблюдается значительное выгорание алюминия, титана и циркония, и менее интенсивное — кремния, марганца, хрома, ванадия и др.
Особенно энергично окисление примесей происходит при полуавтоматической сварке. Это связано с тем, что при сварке плавящимся электродом взаимодействие расплавленного металла с газом происходит при пребывании капли на конце электрода и в сварочной ванне, а при сварке неплавящимся электродом — только в ванне. Как известно, взаимодействие газа с металлом в дуговом промежутке происходит значительно интенсивнее вследствие высокой температуры и большей поверхности контактирования металла с газом.
Ввиду химической активности углекислого газа по отношению к вольфраму сварку в этом газе ведут только плавящимся электродом.
Углекислый газ: применение, технические характеристики и способы промышленного производства
Человечество научилось использовать газообразные вещества для поддержания искусственных процессов и реакций, в результате которых удаётся получить другие химические соединения.
Кроме этого, различные газы используются для получения определённых физических явлений и свойств.
Углекислый газ или СО2 обладает большим количеством качеств, которые не могут не использоваться в химической промышленности и быту.
Что такое углекислый газ
Оксид углерода (IV) представляет собой тяжёлый газ. Плотность углекислоты примерно в полтора раза больше чем у атмосферного воздуха.
Несмотря на то, что этот газ уже при температуре минус 78,3 градуса Цельсия превращается в снегообразную массу, получить жидкую углекислоту при нормальном давлении не представляется возможным. Так называемый сухой лёд при малейшем повышении температуры сразу переходит из твёрдой, в газообразную форму.
Так называемый сухой лёд при малейшем повышении температуры сразу переходит из твёрдой, в газообразную форму.
Получить жидкую углекислоту можно только при давлении более 60 атмосфер. В таких условиях газ конденсируется даже при комнатной температуре с образованием бесцветной жидкости.
Углекислый газ не окисляется, но может поддерживать горение некоторых металлов. В среде углекислоты, при определённых условиях, могут возгораться такие активные элементы как магний, кальций и барий.
Этот газ хорошо растворим в воде, а в воздухе его содержится большое количество благодаря дыханию живых организмов и растений, наличию вулканической активности на земле, а также в результате сгорания органических веществ.
В результате растворения СО2 в воде в большой концентрации образуется угольная кислота. Это вещество может вступать в реакцию с фенолом и магнийорганическими соединениями. Углекислый газ также реагирует с щелочами. В результате такой реакции образуются соли и эфиры угольной кислоты.
Свойства углекислого газа
Углекислый газ невозможно определить органами зрения или обоняния. Если концентрация СО2 невелика, то не будет ощущаться и вкуса, но при наличии большого количества этого газа в воздухе может ощущаться кисловатый привкус.
При большой концентрации углекислоты во вдыхаемом воздухе может наступить отравление. Признаками негативного воздействия СО2 на организм человека являются:
- Шум и гул в ушах.
- Обильный холодный пот.
- Потеря сознания.
Учитывая тот факт, что углекислый газ тяжелее воздуха, его концентрация в нижней части помещения будет более значительной.
По этой причине, первую очередь симптомы отравления могут наблюдаться у животных и детей, а также у взрослых очень маленького роста. Большая концентрация СО2 может привести к гибели людей.
При потере сознания человек может оказаться на полу, где количество кислорода будет недостаточным для поддержания нормального процесса дыхания.
Углекислый газ: получение в промышленности
Существует большое количество способов промышленного получения углекислоты. Наиболее рентабельными являются варианты добычи газа, основанные на получении СО2, который образовывается на химических производствах в виде отходов.
Наиболее рентабельными являются варианты добычи газа, основанные на получении СО2, который образовывается на химических производствах в виде отходов.
Газообразный оксид углерода (IV) получают из промышленного дыма способом адсорбции моноэтаноламина. Частицы этого вещества подаются в трубу с отходами и вбирают в себя углекислоту. После прохождение через смесь CO2 моноэтаноламины направляются на очистку в специальные резервуары, в которых, при определённых показателях температуры и давления, происходит высвобождение углекислого газа.
Углекислый газ высокого качества получается в результате брожения сырья при изготовлении спиртных напитков. На таких производствах газообразный СО2 обрабатывают водородом, перманганатом калия и углем. В результате реакции получают жидкую форму углекислоты.
Твёрдое состояние СО2 или «сухой лёд» также получают из отходов пивоваренных заводов и ликероводочных производств. Это агрегатное состояние вещества в промышленных масштабах образуется в такой последовательности:
- Из резервуара, где происходит брожение, газ подаётся в ёмкость для промывки.

- Углекислота направляется в газгольдер, в котором подвергается воздействию повышенного давления.
- В специальных холодильниках СО2 охлаждается до определённой температуры.
- Образовавшаяся жидкость фильтруется через слой угля.
- Углекислота снова направляется в холодильник, где производится дополнительное охлаждение вещества с последующим прессованием.
Таким образом получается высококачественный «сухой лёд», который может использоваться в пищевой промышленности, растениеводстве или в быту.
Применение углекислого газа
Благодаря наличию определённых физических и химических свойств углекислый газ может использоваться в различных сферах. В химической промышленности углекислота используется для:
- Синтеза искусственных химических соединений.
- Для очистки животной и растительной ткани.
- Регулирования температуры реакций.
- Нейтрализации щёлочи.
В металлургии CO2 применяется с целью:
- Регулирования отвода воды в шахтах.

- Создания лазерного луча для резки металлов.
- Осаждения вредных газообразных веществ.
Кроме перечисленных областей углекислый газ активно используется при производстве бумаги. Оксид углерода применяется регулирования водородного показателя древесной массы, а также усиления мощности производственных машин.
Углекислый газ используется в пищевой промышленности в качестве добавки, которая оказывает консервирующее действие. При изготовлении выпечки СО2 применяется в качестве разрыхлителя. Газированные напитки также изготавливаются с применением углекислоты, а для хранения быстро портящихся продуктов используется «сухой лёд».
Незаменим углекислый газ и при выращивании овощей и фруктов в зимних теплицах. В таких помещения в воздухе недостаточное количество СО2, который необходим для «дыхания» растений, поэтому приходится искусственно насыщать атмосферу этим газом.
com/embed/h5-xKRG7uRc?feature=oembed” frameborder=”0″ allow=”accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture” allowfullscreen=””>В медицине углекислота применяется во время проведения сложных операций на внутренних органах. Наиболее ценным качеством этого газа, является использование его для реанимационных мероприятий, ведь благодаря возможности повысить его концентрацию можно эффективно стимулировать процесс дыхания пациента.
При сварке металлов углекислота применяется в качестве инертного облака, которое служит защитой расплавленного участка от попадания в него активного кислорода. В результате такой обработки сварочный шов получается идеально ровным и не подверженным окислению.
Благодаря способности охлаждаться при испарении, СО2 используется для тушения пожаров. Заправленные этим веществом огнетушители являются эффективным средством борьбы с возгораниями на объектах, где применение порошковых или пенных средств тушения невозможно.
В быту углекислота используется в качестве напорного газа в пневматическом оружии, а также для отпугивания комаров и борьбы с грызунами.
Углекислый газ: хранение и транспортировка
Хранение СО осуществляется в баллонах чёрного цвета, на корпусе которых обязательно должна быть надпись «Углекислота».
Кроме этого, на ёмкости наносится маркировка, по которой можно получить информацию о производителе баллона, весе пустой ёмкости, а также узнать дату последнего освидетельствования. Нельзя использовать углекислотные баллоны, у которых:
- Истёк срок освидетельствования.
- Имеются повреждения.
- Неисправны вентили.
Транспортировка наполненных газом баллонов должна осуществляться по следующим правилам:
- Транспортировать ёмкости только в горизонтальном положении. Вертикальное размещение допускается только в том случае, если имеются специальные ограждения, которые препятствуют падению баллона во время перевозки.
- Для безопасного перемещения на баллонах должны быть резиновые кольца.

- Не допускать механических воздействий, а также чрезмерного нагрева.
- Запрещается перевозка углекислотных баллонов в торговых аппаратах.
Кроме этого, техникой безопасности запрещается переносить баллоны вручную или перекатывать их по земле.
Хранение баллонов с углекислотой может осуществляться как в специально оборудованных помещениях, так и под открытым небом. В зданиях ёмкости следует размещать на расстоянии не менее 1 метра от отопительных приборов.
При хранении на улице необходимо оградить ёмкости от воздействия прямых солнечных лучей и осадков, поэтому размещать резервуары таким способом рекомендуется под навесом.
Если хранение баллонов осуществляется в неотапливаемом помещении или под открытым небом, то в зимнее время необходимо следить за тем, чтобы ёмкости не охлаждались ниже минус 40 градусов Цельсия.
youtube.com/embed/O0pYnTf8tXU?feature=oembed” frameborder=”0″ allow=”accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture” allowfullscreen=””/>
Вредность и опасность углекислого газа
Двуокись углерода нетоксична и невзрывоопасна. При концентрациях более 5% (92 г/м3) углекислый газ оказывает вредное влияние на здоровье человека, так как он тяжелее воздуха и может накапливаться в слабо проветриваемых помещениях у пола. При этом снижается объемная доля кислорода в воздухе, что может вызвать явление кислородной недостаточности и удушья. Помещения, где производится сварка с использованием углекислоты, должны быть оборудованы общеобменной приточно-вытяжной вентиляцией. Предельно допустимая концентрация углекислого газа в воздухе рабочей зоны 9,2 г/м3 (0,5%).
Хранение и транспортировка углекислого газа
Углекислый газ поставляется по ГОСТ 8050. Для получения качественных швов используют газообразную и сжиженную двуокись углерода высшего и первого сортов.
Углекислоту транспортируют и хранят в стальных баллонах по ГОСТ 949 или цистернах большой емкости в жидком состоянии с последующей газификацией на заводе, с централизованным снабжением сварочных постов через рампы.
В стандартный баллон с водяной емкостью 40 л заливается 25 кг жидкой углекислоты, которая при нормальном давлении занимает 67,5% объема баллона и дает при испарении 12,5 м3 углекислого газа.
В верхней части баллона вместе с газообразной углекислотой скапливается воздух. Вода, как более тяжелая, чем жидкая двуокись углерода, собирается в нижней части баллона.
Для снижения влажности углекислого газа рекомендуется установить баллон вентилем вниз и после отстаивания в течение 10…15 мин осторожно открыть вентиль и выпустить из баллона влагу. Перед сваркой необходимо из нормально установленного баллона выпустить небольшое количество газа, чтобы удалить попавший в баллон воздух. Часть влаги задерживается в углекислоте в виде водяных паров, ухудшая при сварке качество шва.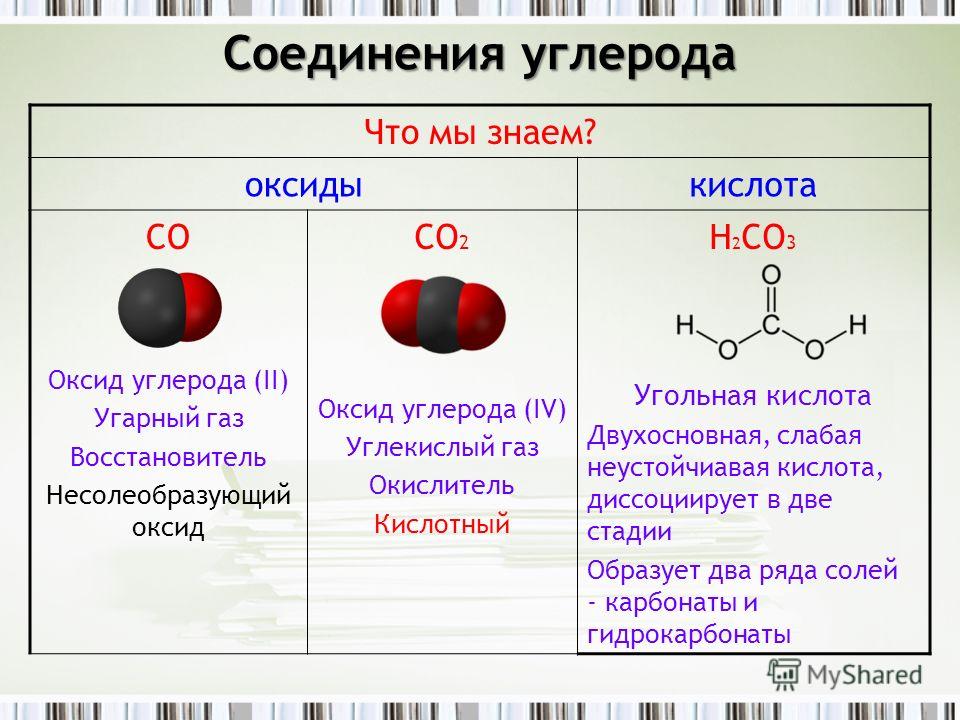
При выпуске газа из баллона вследствие эффекта дросселирования и поглощения теплоты при испарении жидкой двуокиси углерода газ значительно охлаждается. При интенсивном отборе газа возможна закупорка редуктора замерзшей влагой, содержащейся в углекислоте, а также сухим льдом. Во избежание этого при отборе углекислого газа перед редуктором устанавливают подогреватель газа. Окончательное удаление влаги после редуктора производится специальным осушителем, наполненным стеклянной ватой и хлористым кальцием, силикогелием, медным купоросом или другими поглотителями влаги.
Баллон окрашен в черный цвет, с надписью желтыми буквами «УГЛЕКИСЛОТА».
Характеристики углекислого газа
Характеристики углекислого газа представлены в таблицах ниже:
Коэффициенты перевода объема и массы CO2 при Т=15°С и Р=0,1 МПа
| Масса, кг | Объем газа, м3 |
| 1,848 | 1 |
| 1 | 0,541 |
Коэффициенты перевода объема и массы CO2 при Т=0°С и Р=0,1 МПа
| Масса, кг | Объем газа, м3 |
| 1,975 | 1 |
| 1 | 0,506 |
Тест по теме
- Вопрос 1 из 10
Как выглядит формула углекислого газа?
Начать тест(новая вкладка)
Доска почёта
Чтобы попасть сюда — пройдите тест.![]()
-
- Яна Василькова
8/10
- Карина Гаврилова
10/10
- Елена Асадова
7/10
- Лиана Бизина
10/10
- Кристина Микляева
10/10
Оксиды углерода – Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 35967
- Чанг (Питер) Чие
- Университет Ватерлоо
Вопросы для обсуждения
- Какова молекулярная структура оксидов углерода?
- Какие атомные орбитали входят в состав молекулярных орбиталей оксидов углерода?
- Почему молекулы CO образуют прочные связи с атомами металлов в карбонилах?
- Каковы некоторые из применений оксидов углерода?
- Как изменился уровень углекислого газа?
- Какие меры можно принять для сокращения выбросов CO 2 ?
Оксиды углерода
Углерод вместе с кислородом образует два важных газа: монооксид углерода CO и диоксид углерода CO 2 . Оксиды углерода являются важными компонентами атмосферы и частью углеродного цикла.
Оксиды углерода являются важными компонентами атмосферы и частью углеродного цикла.
Углекислый газ естественным образом вырабатывается в результате дыхания и метаболизма и потребляется растениями в ходе их фотосинтеза. После промышленной революции за более чем сто лет было произведено большее количество углекислого газа из-за увеличения промышленной деятельности.
Сегодня важна информация об оксидах углерода. Проблемы, связанные с оксидами углерода, не имеют границ. Центр анализа информации о двуокиси углерода (CADIAC) предоставляет глобальные наборы данных о двуокиси углерода и других атмосферных газах и климате. Эти наборы данных доступны для международных исследователей, политиков, менеджеров и преподавателей, чтобы помочь оценить сложные экологические проблемы, связанные с потенциальным изменением климата.
Угарный газ также является национальной и глобальной проблемой. Комиссия по безопасности потребительских товаров (CPSC) считает CO бессмысленным убийцей и предоставляет информацию об отравлении CO и его обнаружении.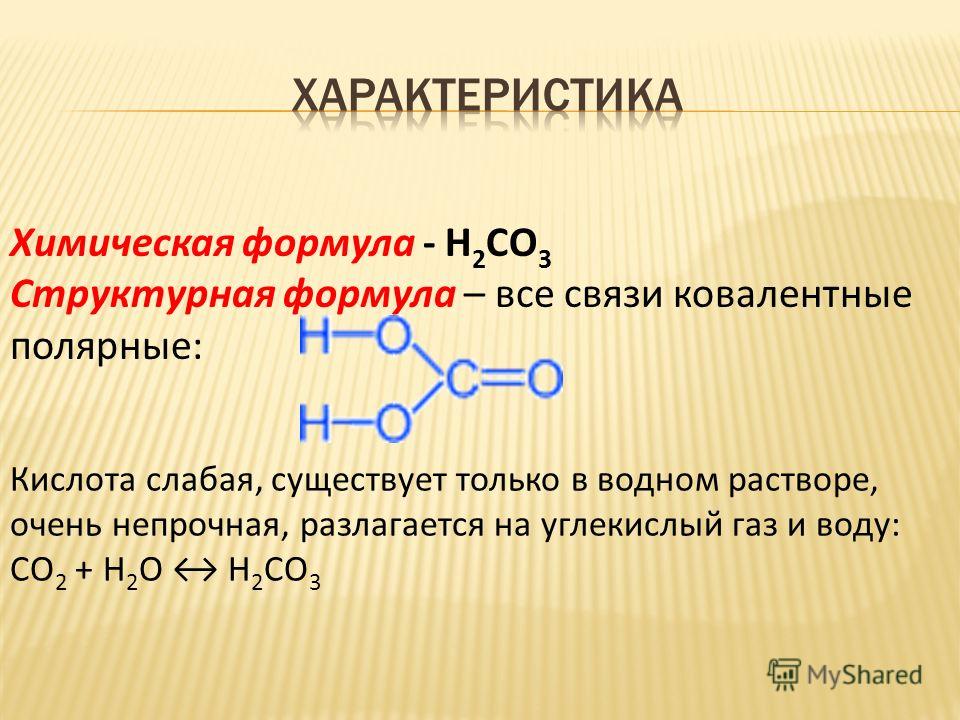
Какова молекулярная структура оксидов углерода?
Образование оксидов углерода обусловлено электронными конфигурациями углерода и кислорода. У них соответственно 4 и 6 валентных электронов. Используя эти валентные электроны, мы можем дать точечную структуру Льюиса для CO и три резонансные структуры для CO2 следующим образом:
.. .. .. ..
:C:::O: :O::C::O: « :O:C:::O: « :O:::C:O:
'' ''
Эти формулы предполагают очень сильную связь между углеродом и кислородом в этих газообразных молекулах: тройная связь в CºO и двойная связь в O=C=O. Однако формулы, содержащие тройную связь, вносят свой вклад в резонансную структуру.
Какие атомные орбитали входят в состав молекулярных орбиталей оксидов углерода?
Химическая связь – это скорее интерпретация молекул с точки зрения их свойств. Используя результаты квантово-механического подхода, мы можем начать с обзора электронных конфигураций углерода и кислорода:
C: 1S 2 2S 2 2P 2
O: 1S 2 2S 2 2P 4
Таким образом, углерода имеет 4. Electrons, а кислота – 6 Valence. Атомные орбитали s и p доступны для химической связи.
Electrons, а кислота – 6 Valence. Атомные орбитали s и p доступны для химической связи.
Подход, основанный на валентной связи, предполагает, что в этих молекулах используются р-орбитали углерода и кислорода. В CO только одна такая атомная орбиталь от каждого атома C и O используется для образования сигма, s, связи, а перекрытие двух p-орбиталей приводит к образованию двух пи, p, связи. Таким образом, порядок связи между C и O в CºO равен 3.
Примечание
Молекула \(CO\) имеет то же количество электронов, что и \(N_2\), и эти молекулы называются изоэлектронными . Молекула N 2 также представлена NºN.
Молекулярно-орбитальный (МО) подход для СО описан в лекции, там же приведена диаграмма энергетических уровней МО. Графики контуров равных электронных плотностей также были показаны в предыдущих лекциях, а диаграмма для молекулярных орбиталей СО показана ниже:
Подход валентной связи для связывания CO 2 также очень интересен. Две sp-гибридные орбитали центрального углерода перекрываются с одной p-орбиталью от каждого из атомов кислорода к двум связям CO s в OCO. Две оставшиеся p-орбитали углерода перекрываются с p-орбиталями каждого из двух атомов кислорода, образуя две p-связи, что приводит к образованию O=C=O.
Две sp-гибридные орбитали центрального углерода перекрываются с одной p-орбиталью от каждого из атомов кислорода к двум связям CO s в OCO. Две оставшиеся p-орбитали углерода перекрываются с p-орбиталями каждого из двух атомов кислорода, образуя две p-связи, что приводит к образованию O=C=O.
Вот задача: найти подходящую диаграмму либо для подхода валентной связи, либо для подхода МО для двуокиси углерода в сети.
Почему молекулы CO образуют прочные связи с атомами металлов в карбонилах?
Молекулы \(CO\) и \(NN\) имеют две связи \(\pi\). Поскольку два атома в \(CO\) разные, это сделало \(CO\) намного более реакционноспособным, чем азот. Действительно, \(CO\) образует много карбонилов с атомами или ионами металлов. Например, вы встретили некоторые из следующих карбонилов на странице Гетерогенные катализаторы
- Ni(CO)4
- Fe(CO)5
- Co2(u-CO)2(CO)6, (u-CO означает CO, связанный мостиком между двумя атомами металла)
- Mn2(CO)10
- Fe3(CO)12
- Со4(СО)12
- Rh5(CO)12
- CFe5(CO)15
- Rh6(CO)16
- Ос6(СО)18
Изучение карбонилов металлов началось с открытия ферроцена Fe(C 5 H 5 ) 2 и в настоящее время синтезированы сотни, если не тысячи карбонилов металлов. СО и атом металла. Такая связь весьма разумна, если учесть используемые в данном случае sp-гибридные атомные орбитали углерода. Поскольку на этих орбиталях CO два электрона, атом металла получает по крайней мере некоторую долю электрона за счет образования этой связи. 9*\) \(CO\) имеет правильную симметрию и ориентацию, чтобы получить обратно отданный электрон с заполненных d-орбиталей атома металла. Обратное пожертвование усиливает сигма-связь, и наоборот. Этот тип связывания был назван механизмом синергетического связывания Коттоном и Уилкинсоном в их Advanced Inorganic Chemistry . Диаграмма, показывающая этот тип схемы связывания, показана на странице 159 в Inorganic Chemistry от Swaddle.
СО и атом металла. Такая связь весьма разумна, если учесть используемые в данном случае sp-гибридные атомные орбитали углерода. Поскольку на этих орбиталях CO два электрона, атом металла получает по крайней мере некоторую долю электрона за счет образования этой связи. 9*\) \(CO\) имеет правильную симметрию и ориентацию, чтобы получить обратно отданный электрон с заполненных d-орбиталей атома металла. Обратное пожертвование усиливает сигма-связь, и наоборот. Этот тип связывания был назван механизмом синергетического связывания Коттоном и Уилкинсоном в их Advanced Inorganic Chemistry . Диаграмма, показывающая этот тип схемы связывания, показана на странице 159 в Inorganic Chemistry от Swaddle.
Каковы некоторые области применения оксидов углерода?
Оксиды углерода являются полезным товаром. Газ, содержащий CO и водород, называется синтетическим газом, потому что его можно преобразовать в метанол с помощью катализатора. За последние несколько десятилетий было получено много карбонилов металлов.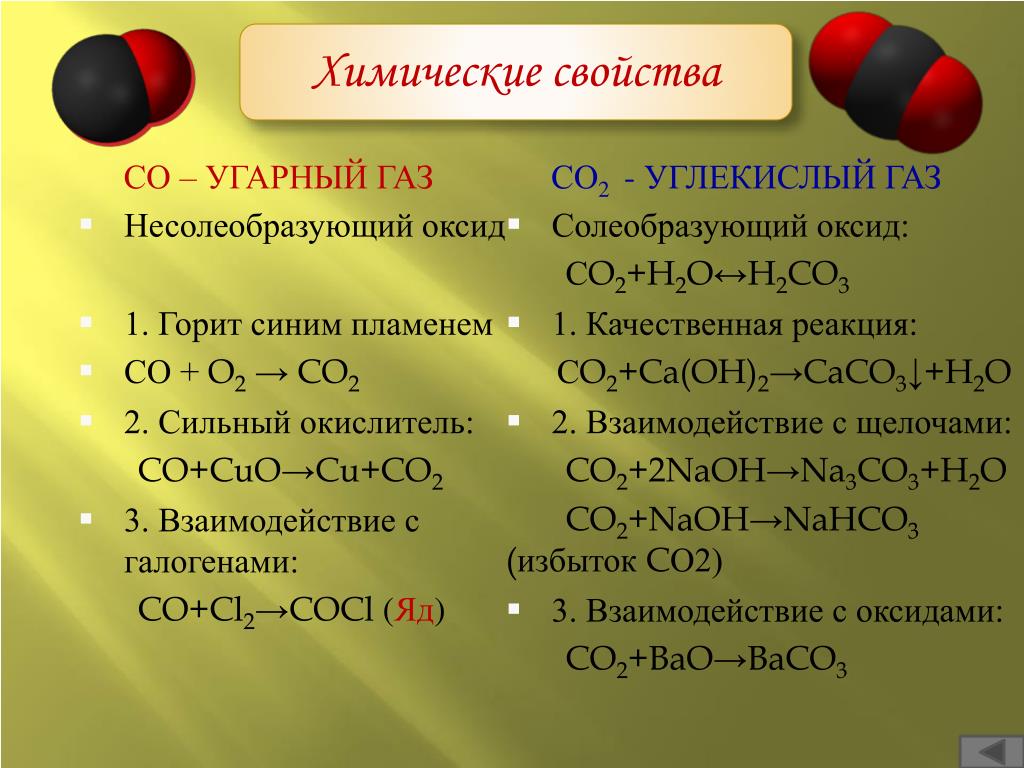 Эти карбонилы являются потенциальными катализаторами. Когда карбонил металла представляет собой газ, очищенный газ карбонила металла можно использовать для производства сверхчистых металлов.
Эти карбонилы являются потенциальными катализаторами. Когда карбонил металла представляет собой газ, очищенный газ карбонила металла можно использовать для производства сверхчистых металлов.
Двуокись углерода также является полезным промышленным газом. Он широко используется в пищевой промышленности и производстве напитков. Вот некоторые из его применений.
- приготовление шипучих напитков
- производство мочевины, CO(NH 2 ) 2 , в качестве удобрения
- стимулируют рост растений в теплице
- изготовление сухого льда
- огнетушитель
- обеспечивают инертную атмосферу для консервирования фруктов и овощей
- в качестве сверхкритической жидкости для экстракции растворителем
Критическая температура двуокиси углерода составляет всего 304 К при критическом давлении 7,39МПа (почти 7 атм). Эти условия могут быть легко соблюдены для получения сверхкритического диоксида углерода, который является мощным растворителем. Сверхкритический флюид проникает в пористые твердые тела, бесследно испаряется. Таким образом, эта жидкость широко используется в качестве экстрагирующего растворителя. Эта жидкость также очень полезна в области аналитической химии.
Сверхкритический флюид проникает в пористые твердые тела, бесследно испаряется. Таким образом, эта жидкость широко используется в качестве экстрагирующего растворителя. Эта жидкость также очень полезна в области аналитической химии.
С точки зрения высоких технологий лазеры на углекислом газе могут обеспечивать непрерывный лазерный луч мощностью от нескольких милливатт до нескольких киловатт с типичной эффективностью 30%, что является одним из наиболее эффективных устройств генерации лазерного излучения. Эта ссылка также иллюстрирует основную теорию лазера. Среди многих применений лазера лазер на углекислом газе использовался для шлифовки кожи как искусство косметической хирургии.
С другой стороны, более тяжелый углекислый газ обычно задерживается в нижних слоях почвы, и когда его концентрация очень высока, он может стать нитью для живых существ, которые умрут от удушья.
Как изменился уровень углекислого газа?
Когда Генри Форд заставлял людей работать на конвейере, он не беспокоился о последствиях автомобильных выхлопов. Вероятно, он не предвидел изменения общества. Теперь каждый хочет получить часть машины по производству углекислого газа. Вы можете себе представить, что когда все страны будут потреблять столько энергии, сколько канадцы, уровень углекислого газа в атмосфере будет намного выше. Нам нужны хорошие измерения уровня углекислого газа, чтобы знать, как он меняется.
Вероятно, он не предвидел изменения общества. Теперь каждый хочет получить часть машины по производству углекислого газа. Вы можете себе представить, что когда все страны будут потреблять столько энергии, сколько канадцы, уровень углекислого газа в атмосфере будет намного выше. Нам нужны хорошие измерения уровня углекислого газа, чтобы знать, как он меняется.
Национальное управление океанических и атмосферных исследований (NOAA) США отслеживает его и измерения в Барроу, Аляска. Сообщается, что ежегодное увеличение составляет 1,49 частей на миллион по объему в год. С другой стороны, концентрация CO 2 в атмосфере составляла около 280 частей на миллион по объему в 1700-х годах до промышленной революции и 360 частей на миллион в 1994 году. Если вы хотите получить более подробную информацию о выбросах углекислого газа в США, эта ссылка полно данных.
Инженеры, ученые, политики и широкая общественность считают, что повышение уровня CO 2 заставит мир нагреваться, потому что некоторые ученые продемонстрировали свои открытия, и эксперты согласились. Чтобы представить научные доказательства так называемого парникового эффекта CO 2 , требуется продолжительное обсуждение, и, надеюсь, когда-нибудь вы сможете сами оценить этот аргумент. На данный момент я не нашел простых и убедительных доказательств, которые можно было бы представить. Однако специалисты предположили корреляцию с повышением уровня CO 2 и средней температурой земного шара.
Чтобы представить научные доказательства так называемого парникового эффекта CO 2 , требуется продолжительное обсуждение, и, надеюсь, когда-нибудь вы сможете сами оценить этот аргумент. На данный момент я не нашел простых и убедительных доказательств, которые можно было бы представить. Однако специалисты предположили корреляцию с повышением уровня CO 2 и средней температурой земного шара.
Какие меры можно принять для сокращения выбросов CO
2 ?Парниковый эффект \(CO_2\) привлек внимание не только экспертов и политиков, общественное давление (в основном средства массовой информации) сделало сокращение выбросов \(CO_2\) международным приоритетом. Группа ООН по изменению климата сделала несколько рекомендаций относительно \(CO_2\).
- использовать в качестве топлива природный газ, а не уголь или нефть
- использовать солнечную или ядерную энергию вместо ископаемого топлива для производства электроэнергии
- уменьшить скорость обезлесения
- ограничение использования автомобилей
То, что можно сделать на личном уровне, как в сообществе, так и в стране, требует решимости отдельных лиц. Это вызов для всех нас, особенно для инженеров, потому что они находятся в авангарде многих отраслей. Перед нами стоит много фронтов за решение проблемы выброса углекислого газа.
Это вызов для всех нас, особенно для инженеров, потому что они находятся в авангарде многих отраслей. Перед нами стоит много фронтов за решение проблемы выброса углекислого газа.
Пример 1
Стандартная энтальпия образования NO составляет 90,25 кДж/моль, а стандартные энтропии \(N_2\), \(O_2\), \(NO\) равны 19o \\[4pt] &= 180,5 – 298*0,02477 \\[4pt] & = 180,5 – 7,38 \,кДж \\[4pt] &= 173,12\, кДж \end{align*}\]
Это значение показывает что реакция эндотермическая.
ОБСУЖДЕНИЕ
Какова константа равновесия реакции, как написано, и каков результат при обсуждении NO в воздухе?
Авторы и авторство
Эта страница под названием «Окиси углерода» распространяется по незаявленной лицензии, ее автором, ремиксом и/или куратором является Чанг (Питер) Чие.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Чанг (Питер) Чие
- хайтоп
- да
- Показать страницу TOC
- № на стр.

- Теги
Вводная глава: Краткий обзор химии, использования и технологии двуокиси углерода
- Вход в панель авторов
Что такое открытый доступ?
Открытый доступ — это инициатива, направленная на то, чтобы сделать научные исследования бесплатными для всех. На сегодняшний день наше сообщество сделало более 100 миллионов загрузок. Он основан на принципах сотрудничества, беспрепятственного открытия и, самое главное, научного прогресса. Будучи аспирантами, нам было трудно получить доступ к нужным нам исследованиям, поэтому мы решили создать новое издательство с открытым доступом, которое уравняет правила игры для ученых со всего мира. Как? Упрощая доступ к исследованиям и ставя академические потребности исследователей выше деловых интересов издателей.
Наши авторы и редакторы
Мы являемся сообществом из более чем 103 000 авторов и редакторов из 3 291 учреждения в 160 странах, в том числе лауреатов Нобелевской премии и самых цитируемых исследователей мира. Публикация на IntechOpen позволяет авторам получать цитирование и находить новых соавторов, а это означает, что больше людей увидят вашу работу не только из вашей собственной области исследования, но и из других смежных областей.
Оповещения о содержимом
Краткое введение в этот раздел, описывающий открытый доступ, особенно с точки зрения IntechOpen
Как это работаетУправление предпочтениями
Контакты
Хотите связаться? Свяжитесь с нашим головным офисом в Лондоне или командой по работе со СМИ здесь:
Карьера:
Наша команда постоянно растет, поэтому мы всегда ищем умных людей, которые хотят помочь нам изменить мир научных публикаций.
Открытый доступ
Автор:
Джана Шайя, Хассан Сроур и Ияд Караме
Опубликовано: 16 августа 2018 г.461
СКАЧАТЬ БЕСПЛАТНОИз отредактированного тома
Под редакцией Iyad Karamé, Janah Shaya и Hassan Srour
Сведения о книге Заказ в печати
Обзор показателей главы
1649 загрузок глав
Посмотреть полные показатели
СКАЧАТЬ БЕСПЛАТНОРекламное объявление
1. Введение
Двуокись углерода (CO 2 ) представляет собой стабильную и относительно инертную трехатомную молекулу, существующую в виде газа при температуре и давлении окружающей среды. СО 9Молекула 0045 2 имеет линейную структуру, в которой углерод связан с каждым атомом кислорода посредством сигма- и пи-связи, образуя две связи C=O. Каждая связь С=О имеет длину 116,3 пм и энергию связи 750 кДж.моль -1 , что значительно выше, чем энергия связи связей С=С, С-О и С-Н [1]. Углекислый газ образуется естественным образом из различных источников, таких как лесные пожары, извержения вулканов и дыхание живых организмов. Фотосинтез растений и других автотрофов играет незаменимую роль в уравновешивании углеродно-кислородного цикла и, следовательно, в поддержании земной жизни. Глобальная концентрация CO 2 в атмосфере составлял примерно 270 частей на миллион по объему до промышленной революции. В настоящее время уровень углекислого газа достиг 405 частей на миллион, что составляет увеличение примерно на 50%. Этот устойчивый рост выбросов CO 2 связан с большим потреблением ископаемого топлива и антропогенной деятельностью (электростанции, нефтеперерабатывающие заводы, цементная, металлургическая и сталелитейная промышленность, очистка биогаза, химическая промышленность и переработка) в дополнение к широкомасштабной вырубке лесов.
Каждая связь С=О имеет длину 116,3 пм и энергию связи 750 кДж.моль -1 , что значительно выше, чем энергия связи связей С=С, С-О и С-Н [1]. Углекислый газ образуется естественным образом из различных источников, таких как лесные пожары, извержения вулканов и дыхание живых организмов. Фотосинтез растений и других автотрофов играет незаменимую роль в уравновешивании углеродно-кислородного цикла и, следовательно, в поддержании земной жизни. Глобальная концентрация CO 2 в атмосфере составлял примерно 270 частей на миллион по объему до промышленной революции. В настоящее время уровень углекислого газа достиг 405 частей на миллион, что составляет увеличение примерно на 50%. Этот устойчивый рост выбросов CO 2 связан с большим потреблением ископаемого топлива и антропогенной деятельностью (электростанции, нефтеперерабатывающие заводы, цементная, металлургическая и сталелитейная промышленность, очистка биогаза, химическая промышленность и переработка) в дополнение к широкомасштабной вырубке лесов. землепользования [2].
землепользования [2].
Загрязнение считается проблемой нашей эпохи, поскольку доминирующие отрасли промышленности рассматривают его контроль как расходы, которые превышают области, полезные для достижений науки. Поиск альтернатив незаменимым областям, таким как обеспечение энергией, продуктами питания, лекарствами и красителями для медицинских зондов, среди прочего, кажется, противоречит инновационному прогрессу, о котором ежедневно сообщают академические круги и промышленность. В этом отношении парниковый эффект является одной из самых актуальных проблем современности. Углекислый газ в настоящее время является наиболее распространенным парниковым газом (ПГ). Парниковые газы, такие как озон, закись азота, метан, хлорфторуглероды (ХФУ) и CO 2 играет важную роль в предотвращении потери тепла и защите жизни на Земле в ночное время. Однако считается, что повышенные концентрации парниковых газов, особенно CO 2 , вызывают резкие изменения, такие как глобальное потепление и закисление океана [3].
Под глобальным потеплением понимается повышение средних глобальных температур, наиболее заметное в виде таяния ледяных шапок в полярных регионах и повышения уровня моря. В частности, парниковый эффект CO 2 основан на его асимметричных валентных и деформационных модах колебаний, которые позволяют этому газу поглощать и излучать инфракрасное излучение с длинами волн 4,26 и 14,99 мкм соответственно [1, 4]. С другой стороны, подкисление океана относится к продолжающемуся снижению рН воды в морях и океанах. Около 30–40% антропогенного CO 2 растворяются в океанах и морях, образуя угольные кислоты для достижения химического равновесия. Следовательно, образующиеся ионы H + приводят к снижению рН подземных вод от слабощелочных условий до нейтральности или даже кислотности в долгосрочной перспективе, тем самым влияя на жизненные циклы морских организмов и последующие пищевые цепи [5].
Несколько международных конвенций и правительственных протоколов были сформулированы для сокращения выбросов CO 2 , такие как Киотский протокол , Рамочная конвенция ООН об изменении климата и Межправительственная группа экспертов по изменению климата . На сегодняшний день не существует универсального соглашения по этим законам, и многие страны и отрасли не соблюдают эти соглашения. Поэтому требуются немедленные действия и решения, чтобы обойти потенциальное влияние все еще высокого содержания CO 2 Выбросы на климат. В общем, общий выброс CO 2 можно контролировать путем снижения энергоемкости, ограничения углеродоемкости или улучшения связывания CO 2 . В краткосрочной перспективе ископаемое топливо на основе углерода останется основным источником энергии. Таким образом, существует острая необходимость в разработке экономически целесообразных и эффективных процессов улавливания, разделения, хранения, секвестрации и утилизации непрерывных выбросов CO 2 . Однако будущие тенденции должны быть направлены на сокращение потребления энергии и зависимости от ископаемых видов топлива, а также на разработку и широкомасштабное использование возобновляемых и менее углеродоемких источников энергии, таких как ядерная энергия (например, H 2 ), биотоплива, геотермальной и приливной энергии [4, 6, 7].
На сегодняшний день не существует универсального соглашения по этим законам, и многие страны и отрасли не соблюдают эти соглашения. Поэтому требуются немедленные действия и решения, чтобы обойти потенциальное влияние все еще высокого содержания CO 2 Выбросы на климат. В общем, общий выброс CO 2 можно контролировать путем снижения энергоемкости, ограничения углеродоемкости или улучшения связывания CO 2 . В краткосрочной перспективе ископаемое топливо на основе углерода останется основным источником энергии. Таким образом, существует острая необходимость в разработке экономически целесообразных и эффективных процессов улавливания, разделения, хранения, секвестрации и утилизации непрерывных выбросов CO 2 . Однако будущие тенденции должны быть направлены на сокращение потребления энергии и зависимости от ископаемых видов топлива, а также на разработку и широкомасштабное использование возобновляемых и менее углеродоемких источников энергии, таких как ядерная энергия (например, H 2 ), биотоплива, геотермальной и приливной энергии [4, 6, 7].
В этой вводной главе обсуждаются основных свойств и основных технологий двуокиси углерода . На рисунке 1 показаны основные источники выбросов CO 2 и различные методы, используемые или предполагаемые для улавливания, хранения CO 2 ( CCS ) и утилизации ( CCU ). Наиболее важные технологии будут представлены в следующих разделах этого предварительного просмотра и будут подробно описаны в отдельных главах этого «9».0149 Книга проект.
Рисунок 1.
Основные источники выбросов CO 2 и технологии, используемые в CCS и CCU.
Реклама
2. Улавливание двуокиси углерода
Технологии улавливания двуокиси углерода включают процессы получения относительно высокочистого потока CO 2 для транспортировки и хранения, поскольку большая часть выбросов CO 2 от производства электроэнергии и промышленности высвобождается в виде дымовой газ (4–14% по объему CO 2 ). Хранение дымовых газов в принципе возможно путем сжатия до давления, как правило, выше 10 МПа, что требует огромного количества энергии помимо больших объемов производства, которые могут быстро заполнить резервуары для хранения. Поэтому технологии улавливания и хранения углерода (CCS) представляют собой экономичное решение для хранения дымовых газов [4, 8].
Хранение дымовых газов в принципе возможно путем сжатия до давления, как правило, выше 10 МПа, что требует огромного количества энергии помимо больших объемов производства, которые могут быстро заполнить резервуары для хранения. Поэтому технологии улавливания и хранения углерода (CCS) представляют собой экономичное решение для хранения дымовых газов [4, 8].
Известны три метода улавливания CO 2 в системах сжигания ископаемого топлива, а именно улавливание после конверсии , улавливание до преобразования и кислородно-топливное сжигание (рис. 1).
2.1. Улавливание после конверсии
Выделение CO 2 из потоков отходящих газов после конверсии (в основном сжигания) источника углерода известно как процесс постконверсии. Для этого процесса улавливания разработаны различные технологии, такие как адсорбция твердыми сорбентами, вакуумная колебательная адсорбция, абсорбция растворителями и криогенное разделение. Эти методы по-прежнему считаются энергозатратными. Абсорбция растворителем рассматривается здесь как пример захвата. В частности, физическое поглощение CO 2 основан на его растворимости на основе закона Генри, не вызывая химической реакции. Таким образом, для этого применения необходимы низкие температуры и повышенные парциальные давления CO 2 . Напротив, химическая абсорбция зависит от химической реакции между CO 2 (при низком парциальном давлении) и используемым растворителем, образующим слабые связи. Последний больше подходит для улавливания выбросов CO 2 в промышленных процессах с учетом условий дымовых газов при атмосферном давлении и больших объемах с различными концентрациями CO 2 , что может быть низким в некоторых процессах.
Абсорбция растворителем рассматривается здесь как пример захвата. В частности, физическое поглощение CO 2 основан на его растворимости на основе закона Генри, не вызывая химической реакции. Таким образом, для этого применения необходимы низкие температуры и повышенные парциальные давления CO 2 . Напротив, химическая абсорбция зависит от химической реакции между CO 2 (при низком парциальном давлении) и используемым растворителем, образующим слабые связи. Последний больше подходит для улавливания выбросов CO 2 в промышленных процессах с учетом условий дымовых газов при атмосферном давлении и больших объемах с различными концентрациями CO 2 , что может быть низким в некоторых процессах.
2.2. Улавливание перед конверсией
Включает улавливание CO 2 , образующегося на промежуточной стадии некоторых конверсий, таких как синтез аммиака. Обычно это достигается с помощью абсорбции растворителями или процессов адсорбции. Этот захват также страдает от высоких энергетических потребностей.
Этот захват также страдает от высоких энергетических потребностей.
2.3. Улавливание кислородно-топливного сжигания
Эта технология используется только в преобразованиях сжигания, при которых образуются дымовые газы, обогащенные CO 2 , но не содержит продуктов N 2 и NO x . Энергетические потребности в этом процессе улавливания ниже, но затраты в основном связаны с необходимостью использования чистого кислорода в процессе сжигания, чтобы избежать образования побочных продуктов и их последующего разделения.
Реклама
3. Хранение двуокиси углерода
После улавливания CO 2 может быть сжат и транспортирован путем отгрузки или по трубопроводам в места хранения в земле (геологическое секвестрирование), океанах (все еще на стадии испытаний), или в виде минеральных карбонатов (рассматривается как процесс утилизации и хранения) [4] (рис. 1).
В геологическом хранилище СО 2 закачивается под высоким давлением в устойчивые породы, богатые порами, которые удерживают природные флюиды на глубине от 0,8 до 1 км. Могут использоваться различные механизмы улавливания, температуры и давления, позволяющие хранить CO 2 в виде жидкости, сжатого газа или в его сверхкритическом состоянии, в зависимости от характеристик резервуара. Геологические образования включают неразрабатываемые угольные пласты, истощенные запасы нефти и газа.
Могут использоваться различные механизмы улавливания, температуры и давления, позволяющие хранить CO 2 в виде жидкости, сжатого газа или в его сверхкритическом состоянии, в зависимости от характеристик резервуара. Геологические образования включают неразрабатываемые угольные пласты, истощенные запасы нефти и газа.
Напротив, минеральная карбонизация или образование карбоната металла включает прямую или косвенную реакцию между CO 2 и оксидом металла, таким как Ca и Mg, естественным образом встречающимся в виде силикатных минералов. Помимо доступности полезных ископаемых, преимуществом этой технологии является получение стабильных карбонатов, пригодных для длительного хранения, которые могут храниться веками без утечек. Другим преимуществом является прямое использование CO 2 из дымовых газов без дорогостоящей необходимости создания чистого потока, поскольку другие примеси газа, такие как NO x не влияют на реакцию карбонизации. Крупномасштабные приложения этого метода еще не полностью разработаны и все еще связаны с высокой общей стоимостью [4, 9].
Крупномасштабные приложения этого метода еще не полностью разработаны и все еще связаны с высокой общей стоимостью [4, 9].
Реклама
4. Улавливание и утилизация углерода
Технологии улавливания и хранения углерода (CCS) до сих пор страдают от экономических и технических ограничений для крупномасштабного применения, таких как огромные капиталовложения, нехватка геологических хранилищ и высокая утечка нормы CO 2 . Однако стратегия улавливания и утилизации углерода (CCU) стала перспективной альтернативой CCS, направленной на превращение выбросов CO 2 в соответствующие продукты, такие как топливо и химикаты. Обе технологии нацелены на улавливание антропогенных выбросов CO 2 перед выбросом в окружающую среду, но они различаются конечным пунктом назначения, где CCS нацелена на долгосрочное хранение, а CCU — на преобразование в полезные продукты. CCU имеет ряд преимуществ по сравнению с CCS, а именно снижение затрат за счет синтеза ценных продуктов и инвестиций в CO 2 как доступный, нетоксичный и постоянно выделяемый «возобновляемый» ресурс. Тем не менее, CCU может быть лишь краткосрочным решением, которое откладывает выпуск CO 2 на более поздние стадии. Другим важным аспектом, вызывающим серьезные опасения при крупномасштабном применении как CCU, так и CCS, является обеспечение того, чтобы смягчение последствий изменения климата не достигалось за счет других экологических проблем [10, 11].
Тем не менее, CCU может быть лишь краткосрочным решением, которое откладывает выпуск CO 2 на более поздние стадии. Другим важным аспектом, вызывающим серьезные опасения при крупномасштабном применении как CCU, так и CCS, является обеспечение того, чтобы смягчение последствий изменения климата не достигалось за счет других экологических проблем [10, 11].
Углекислый газ действительно является чрезвычайно ценной молекулой, которую можно использовать различными полезными способами, как показано на рисунке 1 и подробно описано здесь.
4.1. Прямое использование CO
2Двуокись углерода обычно используется в огнетушителях и фотосинтезе, а также в качестве карбонизирующего агента и консерванта в пищевой промышленности и производстве напитков.
Кроме того, сверхкритический диоксид углерода (scCO 2 ) нашел незаменимое применение в технологии сверхкритических флюидов. scCO 2 представляет собой жидкое состояние CO 2 , при котором он поддерживается при критической температуре (304,25 К) и давлении (7,39 К) или выше их. МПа). В процессах при высоком давлении (при критических параметрах или выше) резко возрастает плотность, поэтому scCO 2 может заполнять объем как газ, но с плотностью, как у жидкости. scCO 2 используется для устойчивой экстракции биоактивных соединений и в качестве экологически чистой альтернативы для многофазных каталитических реакций, где он используется в качестве промотора или модификатора жидкофазных органических реакций, но не в качестве реактора. Растворенный CO 2 в органической фазе действует как «промотор», изменяя физические свойства растворителя от чистой органической фазы до CO 9 высокой плотности.0045 2 состояние, которое может растворять газообразные реагенты, такие как O 2 , CO, H 2 , тем самым ускоряя вовлеченные реакции, такие как окисление, гидроформилирование и гидрирование, соответственно. Напротив, влияние scCO 2 на химические свойства модулируется его взаимодействием с функциональными группами субстратов и/или промежуточных продуктов (будь то газы или нет), что подтверждается in situ инфракрасным преобразованием Фурье высокого давления.
МПа). В процессах при высоком давлении (при критических параметрах или выше) резко возрастает плотность, поэтому scCO 2 может заполнять объем как газ, но с плотностью, как у жидкости. scCO 2 используется для устойчивой экстракции биоактивных соединений и в качестве экологически чистой альтернативы для многофазных каталитических реакций, где он используется в качестве промотора или модификатора жидкофазных органических реакций, но не в качестве реактора. Растворенный CO 2 в органической фазе действует как «промотор», изменяя физические свойства растворителя от чистой органической фазы до CO 9 высокой плотности.0045 2 состояние, которое может растворять газообразные реагенты, такие как O 2 , CO, H 2 , тем самым ускоряя вовлеченные реакции, такие как окисление, гидроформилирование и гидрирование, соответственно. Напротив, влияние scCO 2 на химические свойства модулируется его взаимодействием с функциональными группами субстратов и/или промежуточных продуктов (будь то газы или нет), что подтверждается in situ инфракрасным преобразованием Фурье высокого давления. спектроскопия. Следовательно, он выступает здесь как «модификатор» реакционной способности этих групп и, тем самым, селективности реакции (например, реакции Хека). Стоит отметить, что большинство вышеупомянутых применений ограничивается CO 2 эмиссионные потоки высокой чистоты (например, при производстве аммиака) [10, 12].
спектроскопия. Следовательно, он выступает здесь как «модификатор» реакционной способности этих групп и, тем самым, селективности реакции (например, реакции Хека). Стоит отметить, что большинство вышеупомянутых применений ограничивается CO 2 эмиссионные потоки высокой чистоты (например, при производстве аммиака) [10, 12].
4.2. Повышенная добыча нефти (МУН) и метана угольных пластов (ЭУГП)
Нагнетание CO 2 в процессы добычи сырой нефти (УНП или третичная добыча) и природного газа (УЭП), соответственно, из нефтяных месторождений и угля месторождения представляют собой привлекательный вариант получения неизвлекаемых ископаемых видов топлива. Эти методы были успешно испытаны и широко исследуются для снижения затрат, оптимизации условий CCS и CCU и, таким образом, предотвращения повторного выброса CO 9 .0045 2 к окружающей среде. В МУН закачка CO 2 в сверхкритических условиях позволяет эффективно смешивать с нефтью, снижая вязкость и, следовательно, повышая выход извлечения на 5–15%. ECBM использует аналогичный метод, в котором закачиваемый CO 2 занимает поры угольного пласта и адсорбируется на углероде в два раза быстрее, чем метан, что приводит к его более быстрому вытеснению и увеличению извлечения. Стоит отметить, что поверхностно-активные вещества и другие газы, а также различные методы, такие как процессы тепловой энергии, также применяются в процессах EOR и ECBM.
ECBM использует аналогичный метод, в котором закачиваемый CO 2 занимает поры угольного пласта и адсорбируется на углероде в два раза быстрее, чем метан, что приводит к его более быстрому вытеснению и увеличению извлечения. Стоит отметить, что поверхностно-активные вещества и другие газы, а также различные методы, такие как процессы тепловой энергии, также применяются в процессах EOR и ECBM.
4.3. Превращение CO
2 в химикаты и топливо CO 2 представляет собой богатый и безопасный ресурс C и O, который можно использовать для синтеза различных полезных продуктов в соответствии с принципами зеленой химии. Например, использование CO 2 в качестве альтернативы токсичным реагентам, таким как фосген и CO, привлекает огромное внимание. Типы превращений диоксида углерода вместе с примерами основных продуктов проиллюстрированы в Таблице 1. Они будут далее обсуждаться в этом разделе, за исключением биологического процесса, который будет следовать в разделе биотоплива и образования неорганических карбонатов, который был уже обсуждалось как вариант хранения [13].
| Transformation | Main products |
|---|---|
| Chemical (nonhydrogenative) | Carbamates, carbonates, urea, carboxylates |
| Chemical (hydrogenative) | HCOOH, hydrocarbons, MeOH, EtOH |
| Фотохимический или электрохимический | CO, CH 4 , MeOH, HCOOH |
| Риформинг | CO + H 2 |
| Biological | Sugar, EtOH, CH 3 COOH |
| Inorganic | M 2 CO 3 |
Table 1.
Types of chemical transformations of carbon dioxide.
Химию CO 2 можно разделить на две основные категории (Схема 1):
«Основные превращения CO 2 » зависят от поляризации связей C=O, где более высокие электроотрицательные атомы кислорода переносят частичный отрицательный заряд -0,296, а углеродный центр имеет частичный положительный заряд +0,592.
 Эта поляризация обеспечивает реакцию нуклеофилов (аминов, реактивов Гриньяра, фенолятов и др.) по углеродному центру.
Эта поляризация обеспечивает реакцию нуклеофилов (аминов, реактивов Гриньяра, фенолятов и др.) по углеродному центру.«Более продвинутые химические взаимодействия CO 2 » основаны на координации трехатомных молекул с металлами, вызывая серьезные изменения в его химической реактивности путем изменения как его молекулярной геометрии (например, от линейной до более активной) и его электронное распределение (например, менее электронодефицитный углерод при координации). До сих пор были исследованы различные катализаторы для достижения этой цели и активации стабильного и относительно нереакционноспособного CO 9 .0045 2 . Эта область до сих пор считается горячей темой в металлоорганических и теоретических исследованиях из-за различных режимов координации между CO 2 и различными металлами [1].
Схема 1.
w3.org/2001/XMLSchema-instance”> Общие закономерности химических превращений СО 2 . Основываясь на этих двух химических режимах, сообщалось о многочисленных преобразованиях CO 2 с получением ряда полезных химических продуктов. Большинство этих трансформаций обобщены в схеме, показанной на схеме 2, и были рассмотрены Sakakura et al. Преобразования включают либо (i) использование CO 2 молекула в качестве предшественника органических соединений, таких как карбонаты, карбаматы, полимеры и акрилаты , посредством реакций карбоксилирования или (ii) восстановления связей C=O, что приводит к химическим веществам, таким как метанол, диметиловый эфир, метан, мочевина ( важное удобрение), синтез-газ и даже муравьиную кислоту и CO. Муравьиная кислота является безопасным материалом для хранения H 2 , а CO может быть преобразован в жидкие углеводороды в процессе Фишера-Тропша. Некоторые преобразования CO 2 были промышленно внедрены (схема 2) и в настоящее время играют важную роль в восстановлении антропогенных выбросов CO 2 . Основными недостатками этих технологий являются короткий срок хранения, высокая потребность в энергии и необходимость высокоселективных процессов катализа из-за низкой химической активности и высокой термодинамической стабильности СО -2- в дополнение к короткому сроку хранения [13]. ].
Основными недостатками этих технологий являются короткий срок хранения, высокая потребность в энергии и необходимость высокоселективных процессов катализа из-за низкой химической активности и высокой термодинамической стабильности СО -2- в дополнение к короткому сроку хранения [13]. ].
Схема 2.
Основные химические превращения СО 2 .
Недавние достижения во всех областях катализа (органокатализ, фотокатализ, палладиевый катализ и др.) [14, 15, 16, 17, 18] сопровождались значительным прогрессом в превращениях СО 2 , особенно в электрохимическом и фотохимическом восстановлении и риформинге как в каталитических, так и в нетермических плазменных технологиях. Следовательно, разработка новых эффективных электро- и фотокатализаторов направлена на повышение селективности и снижение внутренней потребности в энергии за счет использования возобновляемых источников, таких как солнечная энергия.
Электрохимическое и фотохимическое восстановление CO 2 основано на различных экспериментальных подходах, но по существу они имеют одинаковую природу. Оба они полагаются на внешний энергетический стимул для активации химически инертного CO 9.0045 2 и осуществляют термодинамически восходящую реакцию. Более того, стадия переноса поверхностного заряда при фотокаталитическом восстановлении CO 2 действительно представляет собой электрохимический процесс, которому обычно способствует добавление сокатализатора (электрокатализатора). Оба процесса могут протекать посредством переноса 2, 4, 6, 8, 12 или более электронов в зависимости от природы используемого катализатора и условий эксперимента, и, следовательно, они дают различные продукты, как упоминалось ранее.
4.3.1. Электрохимическое восстановление СО
2 Кинетика электрохимического восстановления вялая из-за реорганизации линейной молекулы СО 2 в более активную изогнутую форму, что создает перенапряжение до первого переноса электрона после адсорбции молекулы на рабочий электрод. Этот этап в основном идентифицируется как определяющий скорость этап, начинающийся при -1,9 В, и он образует анион-радикал CO 2 •- , который далее протонируется в HCOO • или HOOC • и восстановлены в HCOO − (формиат) или CO соответственно. Большинство электрохимических восстановлений CO 2 производят HCOOH или CO в качестве первичных продуктов. Очень немногие электрокатализаторы (например, Cu) обеспечивают дальнейшее восстановление CO до углеводородов, но механизм до сих пор не выяснен. В процессах восстановления CO 2 были исследованы различные электролитические материалы, включая металлы (Sn, Pd, Cu, Pt и т. д.), слоистые дихалькогениды переходных металлов (например, WS 9[19].
Этот этап в основном идентифицируется как определяющий скорость этап, начинающийся при -1,9 В, и он образует анион-радикал CO 2 •- , который далее протонируется в HCOO • или HOOC • и восстановлены в HCOO − (формиат) или CO соответственно. Большинство электрохимических восстановлений CO 2 производят HCOOH или CO в качестве первичных продуктов. Очень немногие электрокатализаторы (например, Cu) обеспечивают дальнейшее восстановление CO до углеводородов, но механизм до сих пор не выяснен. В процессах восстановления CO 2 были исследованы различные электролитические материалы, включая металлы (Sn, Pd, Cu, Pt и т. д.), слоистые дихалькогениды переходных металлов (например, WS 9[19].
4.3.2. Фотохимическое восстановление CO
2 Фотокаталитическое восстановление CO 2 широко изучалось с использованием различных полупроводников следующих типов: оксиды, сульфиды или нитриды металлов, слоистые металлические материалы, такие как слоистый двойной гидроксид, металлоорганические каркасы, и не содержащие металлов углеродсодержащие материалы, такие как графитовый нитрид углерода. Фотокаталитическое восстановление можно разделить на пять этапов:
Фотокаталитическое восстановление можно разделить на пять этапов:
Поглощение фотонов полупроводниковым фотокатализатором, генерирующим дырочную и электронную пары.
Разделение зарядов генерируемых электронов и дырок.
CO 2 адсорбция и перенос электронов на молекулы CO 2 .
Поверхностная окислительно-восстановительная реакция, включающая восстановление CO 2 и окисление обычных восстановителей, таких как H 2 O и H 2 .
Десорбция продуктов [19, 20].
4.3.3. СО
2 риформинг с метаном Наконец, риформинг СО 2 и СН 4 в синтетический газ (смесь Н 2 /СО) можно проводить каталитическим и нетепловым плазменным методами или новым гибридным методом, комбинируя оба. Каталитические методы по-прежнему страдают от высокого потребления тепловой энергии, дезактивации катализатора отложением кокса и высокой стоимости. Выбранными примерами катализаторов для процесса риформинга являются Pt, Pd, Ir, Rh, Ru, Co и Ni. Общий механизм сухого риформинга метана (DRM) включает адсорбцию CO 2 и CH 4 на катализатор с последующей диссоциацией молекул на атомы CO и O, C и H. Атомы рекомбинируют, образуя дополнительную молекулу CO и газ H 2 , после чего происходит десорбция газов, где десорбция CO является определяющей стадией процесса.
Выбранными примерами катализаторов для процесса риформинга являются Pt, Pd, Ir, Rh, Ru, Co и Ni. Общий механизм сухого риформинга метана (DRM) включает адсорбцию CO 2 и CH 4 на катализатор с последующей диссоциацией молекул на атомы CO и O, C и H. Атомы рекомбинируют, образуя дополнительную молекулу CO и газ H 2 , после чего происходит десорбция газов, где десорбция CO является определяющей стадией процесса.
Нетепловая плазма основана на электронной энергии. Электроны ускоряются внешним электрическим полем и сталкиваются с CO 2 и CH 4 , передавая свою энергию, чтобы вызвать диссоциацию молекул, когда энергия превышает 4,5 и 8,8 эВ соответственно. В результате диссоциации образуются радикалы и более активные частицы, которые преобразуют CO и H 2 товаров. Главной характеристикой этого метода является низкая селективность, поскольку радикалы могут превращаться в побочные продукты, такие как углеводороды [4].
4.4. Биотопливо из микроводорослей
Фотосинтезирующие микроорганизмы (например, микроводоросли) представляют собой будущие источники энергии, альтернативные ископаемому топливу, и могут служить для фиксации CO 2 непосредственно из потоков отходов, снижая существующие высокие уровни. Микроводоросли могут преобразовывать солнечную энергию в химические формы через фотосинтеза и обладают более высокой скоростью роста, чем растения. Их можно выращивать в различных средах, как в открытых или закрытых прудах, так и в фотобиореакторах с минимальными требованиями к питательным веществам. После выращивания биомассу собирают, сушат и превращают в топливо с помощью термохимических (например, пиролиз) или биохимических (например, ферментация) процессов. Ограниченные посевные площади и затраты на сбор урожая по-прежнему обременяют крупномасштабные маршруты этого перспективного CO 2 утилизация [21].
Реклама
5.
 Зрелость технологий использования диоксида углерода
Зрелость технологий использования диоксида углеродаТехнологии диоксида углерода, которые были описаны в этой перспективе, можно резюмировать на основе их зрелости для промышленного применения следующим образом.
«Развитый рынок», , такие как разделение и транспортировка газа, МУН и промышленное преобразование в химические вещества, такие как мочевина.
« Экономически целесообразно», , например улавливание до и после конверсии.
«Этап демонстрации», , такой как кислородно-топливное сжигание и ECBM.
«Этап исследований», , например, карбонизация минералов и хранение в океане.
Реклама
6. Заключение
В этой главе представлены основные свойства углекислого газа, которые используются для разработки технологий его использования или хранения, чтобы помочь в смягчении его последствий глобального потепления. Основные источники CO 9Были описаны выбросы 0045 2 и обсуждены технологии хранения и использования улавливания углерода (CCS и CCU). Химическим превращениям CO 2 уделялось особое внимание как средствам снижения высоких уровней CO 2 и понимания химии CO 2 . В рамках этого аспекта были особенно описаны электрохимическое и фотохимическое восстановление и риформинг CO 2 метаном. Завершается глава классификацией технологий хранения и утилизации в соответствии с их зрелостью на рынке.
Основные источники CO 9Были описаны выбросы 0045 2 и обсуждены технологии хранения и использования улавливания углерода (CCS и CCU). Химическим превращениям CO 2 уделялось особое внимание как средствам снижения высоких уровней CO 2 и понимания химии CO 2 . В рамках этого аспекта были особенно описаны электрохимическое и фотохимическое восстановление и риформинг CO 2 метаном. Завершается глава классификацией технологий хранения и утилизации в соответствии с их зрелостью на рынке.
Ссылки
- 1. North M. Глава 1 — Что такое CO 2 ? Термодинамика, основные реакции и физическая химия. Гарвард и Ванкувер: Elsevier BV; 2015. С. 3-17. DOI: 10.1016/B978-0-444-62746-9.00001-3
- 2. Юн Ю. Последние достижения в области улавливания и хранения углерода. Риека: Intech Open; 2017. DOI: 10.5772/62966
- 3.
 Ламас Б. Парниковые газы. Риека: Intech Open; 2016. ISBN: 978-953-51-2273-9
Ламас Б. Парниковые газы. Риека: Intech Open; 2016. ISBN: 978-953-51-2273-9 - 4. Куэльяр-Франка Р.М., Азапагич А. Технологии улавливания, хранения и утилизации углерода: критический анализ и сравнение их воздействия на окружающую среду в течение жизненного цикла. Биохимическая фармакология. 2015;9: 82-102. DOI: 10.1016/j.jcou.2014.12.001
- 5. Mostofa KMG, Liu C-Q, Zhai W, et al. Обзоры и обобщения: закисление океана и его потенциальное воздействие на морские экосистемы. Биогеонауки. 2016;13(6):1767-1786. DOI: 10.5194/bg-13-1767-2016
- 6. Караме И. Гидрирование. Риека: Intech Open; 2012. DOI: 10.5772/3208
- 7. Караме И. Грин Химическая обработка и синтез. Риека: Intech Open; 2012. DOI: 10.5772/65562
- 8. Корнниф Дж., Ван Т., Ван А., Рамирес А. Улавливание углекислого газа и качество воздуха. Риека: InTech; 2011. DOI: 10.5772/18075
- 9.
 Романов В., Сун Ю., Карни С., Раш Г.Э., Нильсен Б., О’Коннор В. Минерализация углекислого газа: обзор литературы. Обзоры ChemBioEng. 2015;2(4):231-256. DOI: 10.1002/cben.201500002
Романов В., Сун Ю., Карни С., Раш Г.Э., Нильсен Б., О’Коннор В. Минерализация углекислого газа: обзор литературы. Обзоры ChemBioEng. 2015;2(4):231-256. DOI: 10.1002/cben.201500002 - 10. Бханаге Б.М., Араи М. Преобразование и использование углекислого газа. Берлин: Springer Science & Business Media; 2014. ISBN: 978-3-642-44988-8
- 11. Стайринг П., Квадрелли Э.-С., Армстронг К. Использование углекислого газа: замыкание углеродного цикла. 1-е изд. Эльзевир; 2014. ISBN: 9.780444627483
- 12. Centi G, Perathoner S. Зеленый диоксид углерода: достижения в области использования CO 2 . Хобокен, Нью-Джерси: John Wiley & Sons Inc.; 2014. ISBN: 978-1-118-59088-1
- 13. Сакакура Т., Чой Дж. К., Ясуда Х. Преобразование углекислого газа. Химические обзоры. 2007;107(6):2365-2387. DOI: 10.1021/cr068357u
- 14. Караме И. Последние достижения в органокатализе.
 Риека: Intech Open; 2016. DOI: 10.5772/61548
Риека: Intech Open; 2016. DOI: 10.5772/61548 - 15. Chen C-C, Shaya J, Fan HJ, Chang YK, Chi H-T, Lu C-S. Материалы оксида ванадия серебра: контролируемый синтез гидротермальным методом и эффективное фотокаталитическое разложение атразина и красителя CV. Технология разделения и очистки. 2018;206:1-16. DOI: 10.1016/j.seppur.2018.06.011
- 16. Huang S, Chen C, Tsai H, Shaya J, Lu C. Фотокаталитическая деградация тиобенкарба с помощью фотокатализатора MoS 2 , управляемого видимым светом. Технология разделения и очистки. 2018;197:147-155. DOI: 10.1016/j.seppur.2018.01.009
- 17. Shaya J, Deschamps MA, Michel BY, Burger A. Стабильные на воздухе каталитические системы Pd для последовательного однореакторного синтеза сложных несимметричных аминоароматических соединений. Журнал органической химии. 2016;81(17):7566-7573. DOI: 10.1021/acs.joc.6b01248
- 18. Shaya J, Fontaine-Vive F, Michel BY, Burger A.
 Рациональный дизайн двухтактных флуореновых красителей: синтез и взаимосвязь между структурой и фотофизикой. Химия – Европейский журнал. 2016;22(30):10627-10637. DOI: 10.1002/chem.201600581
Рациональный дизайн двухтактных флуореновых красителей: синтез и взаимосвязь между структурой и фотофизикой. Химия – Европейский журнал. 2016;22(30):10627-10637. DOI: 10.1002/chem.201600581 - 19. Wu J, Huang Y, Ye W, Li Y. CO 2 восстановление: от электрохимического к фотохимическому подходу. Развитие науки. 2017;4(11):1700194-1700129. DOI: 10.1002/advs.201700194
- 20. Карамян Э., Шарифния С. Об общем механизме фотокаталитического восстановления СО 2 . Биохимическая фармакология. 2016;16:194-203. DOI: 10.1016/j.jcou.2016.07.004
- 21. Milano J, Ong HC, Masjuki HH, et al. Биотопливо из микроводорослей как альтернатива ископаемому топливу для производства электроэнергии. Обзоры возобновляемых и устойчивых источников энергии. 2016;58(С):180-197. DOI: 10.1016/j.rser.2015.12.150
Разделы
Информация об авторе
- 0010
- 5.
 Благодарность технологий углекислого газа
Благодарность технологий углекислого газа - 6. Conclusion
Ссылки
Реклама
. Авторы). Лицензиат IntechOpen. Эта глава распространяется в соответствии с условиями лицензии Creative Commons Attribution 3.0, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии надлежащего цитирования оригинальной работы.
Carbon Dioxide Chemical Formula – Bilder und Stockfotos
515Bilder
- Bilder
- Fotos
- Grafiken
- Vektoren
- Videos
Niedrigster Preis
SignatureBeste Qualität
Durchstöbern Sie 515
carbon dioxide chemical формула Фото и фотографии. Oder starten Sie eine neuesuche, um noch mehr Stock-Photografie und Bilder zu entdecken. wasserstoffmoleküle – 3d-иллюстрация – химическая формула диоксида углерода фото и изображения
Oder starten Sie eine neuesuche, um noch mehr Stock-Photografie und Bilder zu entdecken. wasserstoffmoleküle – 3d-иллюстрация – химическая формула диоксида углерода фото и изображенияWasserstoffmoleküle – 3D-иллюстрация
molekülliniensymbole. вектор-иллюстрация энтальтен значок-аминозавр, пептид, гормон, белок, коллаген, озон, o2 химическая форма пиктограмма для химии. 64 x 64 пикселя совершенный концентратор editierbarer – химическая формула углекислого газа стоковые графики, -клипарты, -мультфильмы и -символыMolekülliniensymbole. Векторная иллюстрация вызывает восторг Icon-Aminosäur
Molekülliniensymbole. Die Vectorillustration umfasste das Symbol Aminosäure, Peptid, Hormon, Protein, Kollagen, Ozon, O2 chemische Formel Umriss Piktogramm für die Chemie. 64×64 пикселей идеальное изображение.
Набор молекул Gemeinsame Moleküle – химическая формула диоксида углерода, стоковые графики, клипарты, мультфильмы и символы weißem Hintergrund. молекулярный символ. вектор-иллюстрация энтальтен значок-аминозавр, пептид, гормон, белок, коллаген, озон, o2 химическая форма пиктограмма для химии. grüne farbe bearbeitbarer strich – химическая формула диоксида углерода фондовая графика, -клипарт, -мультфильмы и -символ
молекулярный символ. вектор-иллюстрация энтальтен значок-аминозавр, пептид, гормон, белок, коллаген, озон, o2 химическая форма пиктограмма для химии. grüne farbe bearbeitbarer strich – химическая формула диоксида углерода фондовая графика, -клипарт, -мультфильмы и -символMolekülliniensymbole. Увлекательная векторная иллюстрация Icon-Aminosäur
Molekülliniensymbole. Die Vectorillustration umfasste das Symbol Aminosäure, Peptid, Hormon, Protein, Kollagen, Ozon, O2 chemische Formel Umriss Piktogramm für die Chemie. Bearbeitbarer Strich mit grüner Farbe.
editierbare schlaganfall. 48 x 48 пикселей идеальное 20 символов во флахен стиле для научных, химических, физических, медицинских, педагогических проектов. вектор абстрактный черный логотип isoliert – химическая формула диоксида углерода стоковые графики, -клипарт, -мультфильмы и -символEditierbare Schlaganfall. 48 x 48 Pixel perfekte 20 Symbole in…
treibhausgasen – химическая формула двуокиси углерода стоковые графики, -клипарты, -мультфильмы и -символы – химическая формула диоксида углерода стоковые фотографии и изображенияHand hält Wolke mit dem Wort CO 2, reduzieren Kohlendioxid-Emissio
hand hält wolke mit dem wort co 2, kohlendioxid-emission, umweltproblem, luftverschmutzung – углекислый газ химическая формула стоковые фото и изображения Hand hält Wolke mit dem Wort CO 2 , Kohlendioxid-Emission,. ..
..
Oktan, organische chemische Verbindung, Molekül. Stick-Model…
значки молекулы – серия классических линий – химическая формула диоксида углерода фондовая графика, -клипарт, -мультфильмы и -символзначки молекулы – классическая линия серия
выделены выбросы СО2 в облако-символ, изолированный на черном фоне. kohlendioxidformel, смог-verschmutzungskonzept, umweltkonzept. векторная иллюстрация – химическая формула двуокиси углерода фондовая графика, клипарт, карикатуры и символыStellen Sie CO2-Emissionen im Cloud-Symbol isoliert auf schwarz-we
einfaches co2-wolkensymbol иллюстрация -клипарт, -мультфильмы и -символEinfaches CO2-Wolkensymbol Illustration
h3 wasserstoffmoleküle symbol – двуокись углерода химическая формула стоковые фото и изображенияh3 Wasserstoffmoleküle Symbol
. kohlendioxidformel, смог-verschmutzungskonzept, umweltkonzept. папье-кунст-стиль. вектор-иллюстрация – химическая формула диоксида углерода сток-график, -клипарт, -мультфильмы и -символ
kohlendioxidformel, смог-verschmutzungskonzept, umweltkonzept. папье-кунст-стиль. вектор-иллюстрация – химическая формула диоксида углерода сток-график, -клипарт, -мультфильмы и -символДокумент, уменьшающий выбросы CO2 в общем символе, выделенном для…
Колендиоксид углерода – химическая формула двуокиси углерода стоковые фото и изображенияФон Колендиоксид
Co2-колендиоксид-цейхен и пфайле нах unten auf grünem blatthintergrund. co2-reductionskonzept. Концепция спасения планеты – химическая формула двуокиси углерода фото и фотоCo2-Kohlendioxid-Zeichen und Pfeile nach unten auf grünem…
CO2-Kohlendioxid-Zeichen und Pfeile auf grünem Blatthintergrund. Konzept zur CO2-Reduction. Rette den Planeten Konzept.
konzeptsymbol für treibhausgasemissionen aus nutztieren – химическая формула двуокиси углерода фондовая графика, -клипарт, -мультфильмы и -symbolekonzeptsymbol für Treibhausgasemissionen aus Nutztieren
kohlendioxid formel linie symbol. люфтемиссион СО2, смог. ölindustrie vektor-design-konzept, umriss stil piktogramm auf weißem hintergrund. – химическая формула диоксида углерода стоковые графики, -клипарты, -мультфильмы и -символы
люфтемиссион СО2, смог. ölindustrie vektor-design-konzept, umriss stil piktogramm auf weißem hintergrund. – химическая формула диоксида углерода стоковые графики, -клипарты, -мультфильмы и -символыKohlendioxid Formel Line Symbol. Luftemissionen CO2, Smogwolke. О
Nationale Emissionshöchstgrenzen für bestimmte luftschadstoffe – химическая формула двуокиси углерода фондовая графика, -клипарт, -мультфильмы и -symboleNationale Emissionshöchstgrenzen für bestimmte Luftschadstoffe
линия CO2-выбросы в общем символе изолированы на белом фоне. kohlendioxidformel, смог-verschmutzungskonzept, umweltkonzept. бунтес умриссконцепт. векторная иллюстрация – химическая формула диоксида углерода стоковые графики, клипарты, мультфильмы и символыЛиния CO2-Emissionen in Wolke Symbol isoliert auf weißem…
установить öltropfen, chemische formel bestehend aus benzolringen, reagenzglas und kolben und co2-emissionen in der wolke. черный квадратный вкус. вектор – химическая формула диоксида углерода стоковые графики, -клипарты, -мультфильмы и -символы Set Öltropfen, Chemische Formel bestehend aus Benzolringen,. ..
..
Eischemische Formel von Kohlendioxid CO2
co2-uhr – химическая формула двуокиси углерода сток-график, -клипарт, -мультфильмы и -символCO2-Uhr
CO2-Symbol mit Erduhr.
Auswirkung der änderung der konzentration des reaktanten oder produkts – химическая формула двуокиси углерода Stock-grafiken, -clipart, -cartoons und -symbole abstraktes konzept der medizinischen, wissenschaftlichen, technologischen energieforschung. – химическая формула диоксида углерода стоковые фотографии и изображенияMolekulare oder atomare Struktur glänzend schwarz goldbrauner…
baum kohlendioxid absorption infografik zeichnung – carbon dioxide chemical formula stock-grafiken, -clipart, -cartoons und -symboleBaum Kohlendioxid Absorption Infografik Zeichnung
3d isometrischer flacher vektor konzeptionelle illustration des kohlendioxidmoleküls – химическая формула диоксида углерода стоковые графики, -клипарты, -мультфильмы и -символы 3D Isometrischer flacher Vektor Konzeptionelle des. ..
..
Funktionelle Gruppen, die häufig in der organischen Chemie…
chemische gleichung der reaktion zwischen kohlendioxid und wasser – химическая формула двуокиси углерода Stock-grafiken , -clipart, -cartoons und -symboleChemische Gleichung der Reaktion zwischen Kohlendioxid und Wasser
co2 – химическая формула диоксида углерода сток-график, -клипарт, -мультфильмы и -символCo2
Kohlendioxid-Symbol.
Предотвращение хронической мигрени – химическая формула двуокиси углерода фондовая графика, -клипарт, -мультфильмы и -символ -cartoons und -symboleChemische Struktur des CO2-Moleküls: Doppelte kovalente Bindungen
baumaterial und kohlendioxid-rgb-farbsymbol – химическая формула двуокиси углерода фондовая графика, -клипарт, -мультфильмы и -symboleBaumaterial und Kohlendioxid-RGB-Farbsymbol
abstraktes design weißer moleküle oder atom. Saubere Reine Struktur für wissenschaftliches technologieexperiment oder medizin in der LaborForschung. – химическая формула диоксида углерода фото и фото
Saubere Reine Struktur für wissenschaftliches technologieexperiment oder medizin in der LaborForschung. – химическая формула диоксида углерода фото и фотоAbstraktes Design Weißer Moleküle oder Atome. Saubere reine…
cloud-kurve-symbol – химическая формула двуокиси углерода сток-график, -клипарт, -мультфильмы и -символCloud-Kurve-Symbol
darstellung eines gasmoleküls (c2o) в форме прозрачного газа – двуокись углерода химическая формула фото и изображенияDarstellung eines Gasmoleküls (C2O) в форме прозрачного… – химическая формула углекислого газа stock-grafiken, -clipart, -cartoons und -symbole
Kohlendioxid-Schwarz-Vektor-Symbol
einfaches design des co2-wolkensymbolsymbols – химическая формула углекислого газа stock-grafiken, -clipart, -cartoons und -symboleEinfaches Design des CO2-Wolkensymbolsymbols
ikone der kohlenstoff-perioden-table der elemente mit kristallsystem-hintergrund – химическая формула двуокиси углерода Stock-grafiken, -clipart, -cartoons und -symbole Ikone der Kohlenstoff-Perioden-Tabelle der Elemente mit. ..
..
Векторсимвол des Kohlenstoff Periodensystems der Elemente mit Kristallsystemhintergrund
treibhausgase. колендиоксид, метан, лахгаз, фторколенвассерстофф, перфторколенвассерстофф, швефельгексафторид. – химическая формула диоксида углерода сток-график, -клипарт, -мультфильмы и -символТрейбхаусгазе. Kohlendioxid, Methan, Lachgas,…
бумажный символ облака СО2, сокращение количества выбросов, символ формы Kohlendioxid. 3D-рендеринг – химическая формула двуокиси углерода стоковые фотографии и изображенияПапье, изображающее CO2 Cloud Symbol, Kohlenstoffemissionen…
синий молекулярный символ. Linearer Stil Flacher вектор синий символ химических элементов. атомная модель для флюсовых газов с CO2-колендиоксидом. wissenschaft, bildung, technologie, бизнес-логотип-символ. – химическая формула диоксида углерода сток-график, -клипарт, -мультфильмы и -символ Синий Молекулсимвол. Linearer Stil flacher Вектор синий Символ. ..
..
Kohlendioxid-symbol
гетерогены gleichgewicht – химическая формула двуокиси углерода сток-график, -клипарт, – Cartoons und -symboleHeterogenes Gleichgewicht
abtrennung von gasen aus der luft – химическая формула двуокиси углерода Stock-grafiken, -clipart, -cartoons und -symboleAbtrennung von Gasen aus der Luft
Pflanze, die atmung prozess – химическая формула двуокиси углерода, графика, -клипарт, -мультфильмы и -symbolePflanze, die Atmung Prozess
kugel- und stockmodell von kohlenwasserstoffen sind alkan, alken, alkin. структуроформ, органическая химия. . konzept für chemiegrundlagen, ausbildung. векторная иллюстрация – химическая формула диоксида углерода фондовый график, клипарт, мультфильмы и символыKugel- und Stockmodell von Kohlenwasserstoffen sind Alkan, Alken,
zeitleiste der atommodelltheorie von der vergangenheit bis zur gegenwart von vielen wissenschaftlern. die wissenschaftliche theorie der natur der materie. konzepte für chemiegrundlagen, ausbildung. вектор – химическая формула диоксида углерода сток-график, -клипарт, -мультфильмы и -символ
die wissenschaftliche theorie der natur der materie. konzepte für chemiegrundlagen, ausbildung. вектор – химическая формула диоксида углерода сток-график, -клипарт, -мультфильмы и -символZeitleiste der Atommodelltheorie von der Vergangenheit bis zur…
schöne abstrakte illustrationen co2-symbol-symbole auf einer spalte und wunderbarem intergrund. 3D-рендеринг-иллюстрация. Hintergrundmuster für den entwurf. – химическая формула диоксида углерода фото и изображенияSchöne abstrakte Illustrationen Co2-Symbol-Symbole auf einer…
co2 3d typografie – химическая формула двуокиси углерода фото и изображенияCO2 3D Typografie
co2-auswirkungen auf erden – carbon Химическая формула двуокиси стоковые фотографии и изображенияCO2-Auswirkungen auf Erden
[b] CO2-Formel, die von Ozeankugeln gebildet wird. [/б] [url=http://www.istockphoto.com/stock-photo-32847548-co2-impact-on-earth.php] [img]http://i.istockimg.com/file_thumbview_approve. php?size=2&id= 32847548[/img][/url] [i] CO2-Fußabdruck[/i]
[url=http://www.istockphoto.com/photo/co2-footprint-33622600.php] [img]http://i.istockimg.com/file_thumbview_approve.php?size=1&id=33622600[/img][ /url]
php?size=2&id= 32847548[/img][/url] [i] CO2-Fußabdruck[/i]
[url=http://www.istockphoto.com/photo/co2-footprint-33622600.php] [img]http://i.istockimg.com/file_thumbview_approve.php?size=1&id=33622600[/img][ /url]
Wissenschaftliche Vektordarstellung von vier Arten von…
ethan, organische chemische verbindung, molekül. stabmodell, структурно-химическая форма и электронная форма – химическая формула диоксида углерода, графика, клипарт, мультфильмы и символыЭтан, органическая химия Verbindung, Molekül. Stabmodell,…
papierschnitt-co2-emissionen in cloud-symbol isoliert auf grauem und schwarzem undergrund. кохлендиоксид-формель, смог-версхмутцунгсконцепт, умвельтконцепт. папьекунстстил. вектор – химическая формула диоксида углерода сток-график, -клипарт, -мультфильмы и -символ Papierschnitt-CO2-Emissionen in Cloud-Symbol isoliert auf grauem. ..
..
Ökologie-Konzept: CO2
co2-warnschild auf ротем хинтергрунд. gelbes dreieck sicherheit gekennzeichnet kohlendioxid. – химическая формула двуокиси углерода фото и фотоCO2-Warnschild на Hintergrund. Gelbes Dreieck Sicherheit…
leuchtende neon-co2-emissionen in wolkensymbol isoliert auf schwarzem undergrund. кохлендиоксид-формель, смог-версхмутцунгсконцепт, умвельтконцепт. вектор – химическая формула диоксида углерода сток-график, -клипарт, -мультфильмы и -символLeuchtende Neon-CO2-Emissionen in Wolkensymbol isoliert auf…
Спиртосодержащие спирты, реагенты и микроорганизмы под действием лупы. вайссе квадратный вкус. вектор – химическая формула диоксида углерода стоковые графики, -клипарты, -мультфильмы и -символыСпиртовой спирт, реагенты и…
co2-auswirkungen auf erden – химическая формула диоксида углерода стоковые фотографии и изображенияCO2-Auswirkungen auf Erden
Rauchige Kugeln, Die Die CO2-Formel bilden.
Gefüllter Umriss CO2-Emissionen in Wolkensymbol isoliert auf…
von 9Определение содержания углекислого газа и угарного газа
Несмотря на многие сходства, между двуокисью углерода и угарным газом существует много различий. Их часто по понятным причинам ошибочно принимают за один и тот же газ, однако различие между ними имеет решающее значение, когда речь идет об обнаружении газа.
Что такое углекислый газ?
Двуокись углерода (CO2) представляет собой химическое соединение, состоящее из одного атома углерода и двух атомов кислорода. Это бесцветный газ без запаха при комнатной температуре, который присутствует в атмосфере Земли в низкой концентрации. CO2 попадает в атмосферу в результате дыхания организмов, разложения органического вещества, сжигания ископаемого топлива и ферментации. Он поглощается растениями в процессе фотосинтеза и может быть вредным для окружающей среды, поскольку это парниковый газ, который удерживает тепловую энергию в атмосфере земли и способствует глобальному потеплению. Некоторые из основных применений CO2 включают замораживание продуктов питания, газирование напитков, тушение пожаров и различные применения в сельском хозяйстве и медицине.
Он поглощается растениями в процессе фотосинтеза и может быть вредным для окружающей среды, поскольку это парниковый газ, который удерживает тепловую энергию в атмосфере земли и способствует глобальному потеплению. Некоторые из основных применений CO2 включают замораживание продуктов питания, газирование напитков, тушение пожаров и различные применения в сельском хозяйстве и медицине.
Узнайте больше об углекислом газе.
Что такое угарный газ?
Окись углерода (CO) представляет собой химическое соединение, содержащее один атом углерода и один атом кислорода, а также газ без цвета и запаха. В отличие от CO2, он полностью создан человеком и в природе не присутствует в атмосфере. Он образуется при неполном сгорании органических веществ, которое может происходить в автомобилях, обогревателях или кухонном оборудовании, работающем на углеродосодержащем топливе. Таким образом, CO является пространственно изменчивым и недолговечным в атмосфере, где он играет роль в формировании озона на уровне земли. Когда угарный газ присутствует в концентрациях выше 35 частей на миллион, он токсичен для людей и животных, поскольку препятствует переносу кислорода кровью.
Когда угарный газ присутствует в концентрациях выше 35 частей на миллион, он токсичен для людей и животных, поскольку препятствует переносу кислорода кровью.
Узнайте больше об угарном газе.
Каковы основные области применения обнаружения двуокиси углерода и угарного газа?
Измерение содержания углекислого газа имеет решающее значение для целого ряда различных отраслей, включая HVAC, полигоны отходов, садоводство, хранение и упаковку в контролируемой атмосфере, термообработку металлов, TOC и многие другие. Каждое из этих применений было бы невозможно без точного измерения CO2. Если вам интересно узнать больше о конкретных применениях датчиков CO2, почему бы не просмотреть следующие статьи…
- Использование датчика углекислого газа при хранении и дозревании фруктов
- Роль измерения содержания углекислого газа в предотвращении синдрома больного здания
- Роль измерения углекислого газа в виноделии
- Ядерные приложения с использованием датчика углекислого газа
- Измерение диоксида углерода для раннего обнаружения порчи хранящегося зерна
- Мониторинг концентрации CO2 в свиноводстве и птицеводстве
Обнаружение угарного газа с помощью датчика CO не менее важно, поскольку обнаружение не может быть выполнено только с помощью зрения или обоняния. Это необходимо, потому что может предотвратить отравление угарным газом, которое может привести к потере сознания, судорогам и даже смерти. Кроме того, обнаружение CO применяется в ряде других приложений, о которых вы можете прочитать, перейдя по ссылкам ниже.
Это необходимо, потому что может предотвратить отравление угарным газом, которое может привести к потере сознания, судорогам и даже смерти. Кроме того, обнаружение CO применяется в ряде других приложений, о которых вы можете прочитать, перейдя по ссылкам ниже.
- Обнаружение угарного газа для газификации
- Печи для эндотермических процессов и термообработки
- Управление технологическим процессом
- ОВКВ
В чем разница между определением содержания углекислого газа и угарного газа?
Обнаружение двух газов различается, потому что детекторы CO2 обычно используют инфракрасные датчики, а для обнаружения CO2 используются электрохимические датчики. Однако CO также можно обнаружить с помощью датчика NDIR.
Несмотря на то, что CO2 и CO трудно обнаружить, линейка датчиков Edinburgh Sensors позволяет сильно поглощать газ с помощью технологии недисперсионного инфракрасного излучения (NDIR). Датчики NDIR обеспечивают высокочувствительное обнаружение CO2, поскольку газ может очень сильно поглощать инфракрасный свет и имеет характерные сигналы отпечатков пальцев для однозначной идентификации, поэтому можно обнаружить даже следовые количества газа. Узнайте больше о недисперсионном инфракрасном обнаружении газа здесь.
Узнайте больше о недисперсионном инфракрасном обнаружении газа здесь.
Детекторы CO2 и CO2 компании Edinburgh Sensors
В Edinburgh Sensors мы являемся лидерами рынка с более чем сорокалетним опытом разработки высокочувствительных быстродействующих датчиков ближнего инфракрасного диапазона для обнаружения двуокиси углерода и угарного газа.
В зависимости от конкретных потребностей компания Edinburgh Sensors предлагает ряд датчиков для измерения CO2/CO, включая Gascard NG, Chillgard NG, Guardian NG, Boxed Gascard, IRgaskiT и Gascheck. Из них Gascard NG предлагает огромную гибкость в настройке, параметрах мониторинга и интеграции в подключенные системы.
Перейдите по ссылкам ниже, чтобы узнать больше о каждом из этих датчиков.
Позвольте нам помочь с обнаружением углекислого газа или угарного газа…
Если вам понравилась эта статья о разнице между определением углекислого газа и угарного газа и вы хотите узнать больше, свяжитесь с нами, мы с нетерпением ждем помогая вам.
Или, если вы хотите быть в курсе будущих новостей и исследований в области обнаружения газа, почему бы не присоединиться к нам в социальных сетях и не подписаться на нашу нечастую рассылку, нажав на ссылку ниже.
Цикл и формула диоксида углерода || Как производится углекислый газ
Углекислый газ , соединение оксида углерода, имеет химическую формулу CO 2 и химическую формулу 44,0095. Он бесцветен и не имеет запаха при нормальной температуре и давлении или бесцветен и не имеет запаха (без запаха) Слабокислый газ также является обычным парниковым газом, а также является компонентом воздуха (0,03–0,04% от общего объема атмосфера).
По физическим свойствам углекислый газ имеет температуру кипения -78,5 °С, температуру плавления -56,6 °С, плотность больше плотности воздуха (при стандартных условиях), растворим в воде.
Углекислый газ
Цикл С точки зрения химических свойств химические свойства углекислого газа неактивны и обладают высокой термической стабильностью (разложение всего 1,8% при 2000°C).
Они не могут гореть и обычно не поддерживают горение. Они представляют собой кислотные оксиды и в большинстве своем являются кислотными оксидами. Поскольку угольная кислота образуется в результате реакции с водой, это ангидрид угольной кислоты.
Двуокись углерода обычно получают путем прокаливания известняка при высоких температурах или реакции известняка с разбавленной соляной кислотой. Он в основном используется в охлажденных и скоропортящихся пищевых продуктах (твердых), в качестве хладагента (жидких), в газированных безалкогольных напитках (газообразных), а также в качестве растворителя для гомогенных реакций (сверхкритическое состояние) и так далее.
Что касается его токсичности, исследования показали, что низкие концентрации углекислого газа не токсичны, а высокие концентрации углекислого газа могут отравить животных.
Молекулярная структура
Молекулярная форма CO 2 линейная, и когда-то считалось, что его структура следующая: O = C = O. Однако длина связи углерод-кислород в молекуле CO 2 составляет 116 мкм. , которая находится между двойной связью углерод-кислород (124 мкм) и тройной связью углерод-кислород (113 мкм), поэтому связь углерод-кислород в CO 2 имеет определенную степень. Трехключевая функция.
Однако длина связи углерод-кислород в молекуле CO 2 составляет 116 мкм. , которая находится между двойной связью углерод-кислород (124 мкм) и тройной связью углерод-кислород (113 мкм), поэтому связь углерод-кислород в CO 2 имеет определенную степень. Трехключевая функция.
Современные ученые обычно считают CO.’S 2 центральным атомом атомов углерода молекулы получают sp-гибридизацию, две sp-гибридные орбитали и два атома кислорода на 2p-орбитали соответственно (содержащие один электрон), образованные путем наложения двух σ-связей, перпендикулярных друг другу, на атомы углерода, Затем p-орбитали образуют две большие π-связи с параллельными p-орбиталями двух атомов кислорода.
Физический свойстваУглекислый газ представляет собой бесцветный газ без запаха при комнатной температуре. температура и давление. Он растворим в большинстве органических растворителей, таких как вода. и углеводороды.
Химическая промышленность свойства Углекислый газ является одним из оксиуглеродов. Это неорганическое вещество, негорючее и обычно не поддерживает горение. Он нетоксичен при низких концентрациях. Это также угольные ангидриды, кислотные оксиды, кислотные оксиды, имеющие непрерывность, при этом валентность углерода равна валентности +4, валентность углерода самая высокая, поэтому восстановление диоксида углерода не сопровождается окислением, но окисление не сильное.
Это неорганическое вещество, негорючее и обычно не поддерживает горение. Он нетоксичен при низких концентрациях. Это также угольные ангидриды, кислотные оксиды, кислотные оксиды, имеющие непрерывность, при этом валентность углерода равна валентности +4, валентность углерода самая высокая, поэтому восстановление диоксида углерода не сопровождается окислением, но окисление не сильное.
- 1-1. Реагировать с водой
Углекислый газ может растворяться в воде и реагировать с воды с образованием угольной кислоты. Нестабильный углекислый газ легко разлагается на вода и углекислый газ. Соответствующее уравнение химической реакции:
- 1-2. Реагировать с основными оксидами
При определенных условиях углекислый газ может реагировать с основными оксидами с образованием соответствующих соли, такие как:
- 1-3. Реакция со щелочью
Добавление углерода
диоксида к осветленной известковой воде сделает осветленную известковую воду мутной
и вызвать осаждение карбоната кальция (эта реакция часто используется для проверки углекислого газа). Соответствующее уравнение химической реакции:
Соответствующее уравнение химической реакции:
Когда углерод диоксида избыточно, образуется бикарбонат кальция:
первая стадия:
Второй шаг:
Общее уравнение:
Из-за большого растворимость бикарбоната кальция при пропускании углекислого газа в мутная известковая вода в течение длительного времени, видно, что осадок постепенно исчезает.
② Реакция с гидроксидом натрияУглерод диоксид портит едкий натр. Соответствующее уравнение химической реакции:
Когда углерод диоксида избыточно, образуется бикарбонат натрия:
Первый шаг:
Второй шаг:
Общее уравнение:
2. Слабый окисление
- 2-1. Уменьшение углеродного элемента
Под высоким температурных условиях углекислый газ может реагировать с углеродным простым веществом с образованием угарного газа. Соответствующее уравнение химической реакции:
- 2-2.
 Элементарное восстановление магния
Элементарное восстановление магния
При прокаливании условиях слитки магния могут гореть в углекислом газе. Соответствующий уравнение химической реакции:
- 2-3. Восстановление водорода
Ряд реакций углекислого газа и водорода с образованием метанола, монооксида углерода, метана и т. д. под действием катализатора. Уравнения химических реакций нескольких реакций:
3. Реакция с перекисью
Углекислый газ может реагировать с пероксидом натрия (Na ₂ O ₂ ) с образованием карбоната натрия (Na ₂ CO 3 ) и кислорода (O ₂ ). Соответствующее химическое уравнение реакции:
4. Реакция с форматными реагентами
В кислых условиях диоксид углерода может реагировать с реагентами формы в безводном эфире с образованием карбоновых кислот. соответствующее уравнение химической реакции:
Примечание. В формуле R представляет собой алифатический углеводород. группа или ароматическая углеводородная группа, X представляет собой галоген, а эфироводород
представляет собой безводный эфир.
группа или ароматическая углеводородная группа, X представляет собой галоген, а эфироводород
представляет собой безводный эфир.
6. Получение алмаза (реакция замещения)
При 440°С (713,15 К) и 800 атмосфер (около 808 МПа), углекислый газ может реагировать с металлический натрий с образованием алмаза. Соответствующее уравнение химической реакции:
7. Темновая реакция фотосинтеза
Углекислый газ участвует в темновой реакции фотосинтеза и является незаменимым сырьем материал для фотосинтеза зеленых растений. Процесс реакции, в котором участвует называется «фиксацией углекислого газа». Соответствующее химическое уравнение реакции:
Подготовка
Промышленная подготовка- Прокаливание
Углекислый газ, образующийся при высокотемпературной обжига известняк (или доломит) промывают водой, удаляют примесей и сжатие для получения газообразного диоксида углерода:
- Извлечение газа при ферментации
Газообразный диоксид углерода, полученный при ферментации этанола
процесс промывают водой, удаляют примеси и сжимают для получения
углекислый газ.
- Извлечение побочного газа
При производстве аммиака, водорода и синтетического аммиака часто происходит процесс обезуглероживания (то есть удаление углекислого газа в газовой смеси), так что углекислый газ в смешанном газе может быть поглощен под давлением и нагревание при пониженном давлении для получения углерода высокой чистоты двуокись газа.
- Метод адсорбционного расширения
Как правило, побочный диоксид углерода используется в качестве сырья сырьевой газ, а углекислый газ высокой чистоты извлекается из фаза адсорбции методом расширения адсорбции, и продукт собирается крионасосом. После удаления некоторых примесей углерод высокой чистоты продукты двуокиси могут быть получены после ректификации.
- Угольная печь
Двуокись углерода получают очисткой печного газа и газ, полученный при крекинге метанола.
Лаборатория препарат- Приготовлен реакцией мрамора с разбавленным соляная кислота
Наконечник
Диоксоуглерод, мрамор и разбавленная соляная кислота. Ни один
тип соды используется, и скорость слишком быстро, чтобы контролировать.
Ни один
тип соды используется, и скорость слишком быстро, чтобы контролировать.
Без серной кислоты соли магния не такие дешевые, как соли кальция. Азотная кислота легко разлагается при воздействии легкий.
Принадлежности для реакции
Мрамор или известняк (основной ингредиентом является CaCO ₃ ) и разбавленной соляной кислотой.
Реакция Принцип
Реакция уравнение:
Подготовка набор аппаратовТвердое-жидкое ненагревательного типа (на фото).
Коллекция методПотому что плотность углекислого газа больше плотности воздуха, он может растворяться в воды и вступают в реакцию с водой, поэтому используется метод восходящего выхлопа.
Метод испытанияОбразовавшийся газ пропускали в чистую известковую воду, и известь вода стала мутной, доказывая, что газ был углекислым газом.
Метод проверки Горящая деревянная палка помещается в горловину газовой
цилиндр (не может дотянуться до бутылки). Если пламя погаснет, значит, оно полное.
Если пламя погаснет, значит, оно полное.
① Хлороводород (HCl) газ, который может улетучиваться во время реакции, можно удалить с помощью насыщенный бикарбонат натрия (NaHCO 3 ) решение.
② При необходимости водяной пар образовавшийся газ можно удалить с помощью скруббера, наполненного концентрированная серная кислота.
③ Невозможно используйте карбонат кальция и концентрированную соляную кислоту для реакции. Причина: концентрированная соляная кислота легко испаряет большое количество газообразный хлористый водород, так что бикарбонат натрия не может быть полностью удален, и чистота производимого углекислого газа снизится.
④ есть мрамор (CaCO в лаборатории ₃ реакция) развести соляную кислоту и диоксид углерода из система.
⑤ Не
используйте Na ₂ CO ₃ (сода) и NaHCO ₃ вместо CaCO ₃ (пищевая сода) для реакции с соляной кислотой, чтобы получить
углекислый газ. Причина: Na ₂ CO ₃ и NaHCO ₃ слишком быстро реагируют с соляной кислотой, и углерод
диоксид образуется очень быстро. Побег, трудно контролировать и легко
работать.
Причина: Na ₂ CO ₃ и NaHCO ₃ слишком быстро реагируют с соляной кислотой, и углерод
диоксид образуется очень быстро. Побег, трудно контролировать и легко
работать.
⑥ Разбавить вместо соляной кислоты нельзя использовать серную кислоту. Причина: реакция разбавленной серной кислоты с мрамором (CaCO ₃ ) будет образовываться слегка растворенный сульфат кальция (CaSO ₄ ) на поверхности мрамора, предотвращая реакцию от продолжения и принятия Ответ очень медленный.
⑦ Нельзя использовать MgCO ₃ (соль магния) вместо CaCO ₃ (соль кальция). Причина: Хотя MgCO ₃ и соляная кислота и CaCO ₃ и соляная кислота реагируют одинаково, потому что источников MgCO ₃ меньше, он не такой дешевый и легкодоступный, как CaCO ₃ .
⑧ Азотная кислоту нельзя использовать вместо соляной кислоты. Причина: Азотная кислота легко разлагается на свету
Если заменить соляную кислоту и азотную кислоту, то в результате получится CO. ’S ₂ в небольшом количестве NO ₂ и O ₂ . Кроме того, азотная кислота дороже соляной, поэтому азотную кислоту обычно не используют вместо соляной.
’S ₂ в небольшом количестве NO ₂ и O ₂ . Кроме того, азотная кислота дороже соляной, поэтому азотную кислоту обычно не используют вместо соляной.
⑨Потому что углекислый газ может потушить огонь, вы можете поднести горящую спичку к горловину газового баллона для осмотра. Если пламя погаснет, это доказывает, что углекислый газ заполнил газовый баллон.
- Разлагается из бикарбоната натрия с помощью нагрев
После того, как бикарбонат натрия достаточно высохнет, его заполняют в жесткую стеклянную трубку, горловину трубки заполняют стекловатой, затем закрывают, а для откачки используют вакуумный насос. Затем бикарбонат натрия разлагают при нагревании.
Первоначально образовавшийся углекислый газ может быть высвобожден. Газ, полученный при разложении, необходимо ввести в охлаждаемый льдом канал для конденсации водяного пара в газе, а затем газ последовательно вводят в U-образную трубу, содержащую хлорид кальция и пятиокись фосфора, соответственно, для сушки. . При 100 °С давление разложения гидрокарбоната натрия составило 97,458 кПа, а при 120 °С — 166,652 кПа.
. При 100 °С давление разложения гидрокарбоната натрия составило 97,458 кПа, а при 120 °С — 166,652 кПа.
Основное применение
Углекислый газ высокой чистоты в основном используется в электронике промышленность, медицинские исследования и клиническая диагностика, калибровочный газ для углерода диоксидные лазеры, испытательные приборы и другие специальные газовые смеси. Он также используется в качестве регулятора полимеризации полиэтилена.
Твердый диоксид углерода широко используется в охлажденных молочных продуктах. продукты, мясо, замороженные продукты и другие скоропортящиеся продукты в пути. Это используется в качестве хладагента во многих промышленных процессах, таких как дробление термочувствительных материалы, полировка резины, холодная обработка металла, термоусадочная сборка механические части, вакуумная охлаждающая ловушка и т. д.
Газообразный диоксид углерода используется для газированных безалкогольных напитков, pH
контроль процессов водоподготовки, химической обработки, консервирования пищевых продуктов, инертных
защита химических и пищевых процессов, сварочных газов, оборудования
стимуляторы роста, применяемые при упрочнении форм и стержней при литье и для
Пневматическое устройство, также используемое в качестве разбавителя для бактерицидного газа (то есть смешанное
газ окиси этилена и углекислого газа используется в качестве стерилизации, инсектицида,
фумигант, широко используемый при стерилизации медицинских изделий, упаковочных материалов,
одежда, меха, постельные принадлежности, Дезинфекция костной мукой, фумигация складов,
фабрики, культурные реликвии, книги).
Жидкий диоксид углерода используется в качестве низкотемпературного хладагента испытания самолетов, ракет и электронных компонентов, для улучшения нефтяной скважины восстановление, полировка резины и контроль химических реакций. Это также может быть используется в качестве средства пожаротушения.
Углекислый газ в сверхкритическом состоянии можно использовать в качестве растворитель для растворения неполярных, неионогенных и низкомолекулярных соединений, поэтому он широко используется в гомогенных реакциях.
Меры безопасности
натуральный Окружающая среда- Опасности для окружающей среды
Естественный парниковый эффект: Парниковые газы, такие как двуокись углерода в атмосфере, могут излучать длинноволновое излучение на землю после сильного поглощения длинноволнового излучения земли , который действует как теплоизоляция для земли.
Усиленный парниковый эффект: После промышленной революции в результате деятельности человека выбрасывается большое количество парниковых газов, таких как двуокись углерода, что привело к резкому увеличению концентрации парниковых газов в атмосфере, что привело к усилению парникового эффекта.
Согласно статистике, глобальный среднегодовой атмосферный концентрация углекислого газа до индустриализации составляла 278 частей на миллион (1 часть на миллион — один миллионная), а в 2012 г. глобальное среднегодовое содержание углекислого газа в атмосфере концентрация составляла 393,1 частей на миллион. К апрелю 2014 года атмосфера на севере полушарие. Средняя концентрация углекислого газа превышала 400 частей на миллион. первый раз.
Глобальное потепление: Возрастающее усиление парникового эффекта атмосферы привело к глобальному потеплению и ряду глобальных непредсказуемых глобальных климатических проблем.
Согласно Международному экономическому отчету об изменении климата, если люди сохранят свой нынешний образ жизни, к 2100 году средний глобальный температура с вероятностью 50 % повысится на 4 ° C. Если глобальная температура повысится на 4°С, ледники на северном и южном полюсах земли растают, соответственно поднимется уровень моря.
Более 40 островных государств и самые густонаселенные прибрежные районы мира
города столкнутся с угрозой затопления. Десятки миллионов людей по всему миру
Жизнь столкнется с кризисом и даже вызовет нарушение глобального экологического баланса,
что в конечном итоге приводит к крупномасштабной миграции и конфликтам по всему миру.
Десятки миллионов людей по всему миру
Жизнь столкнется с кризисом и даже вызовет нарушение глобального экологического баланса,
что в конечном итоге приводит к крупномасштабной миграции и конфликтам по всему миру.
- Ответы
Низкоуглеродная жизнь: Минимизируйте потребление энергии в повседневной жизни, тем самым сокращение выбросов углекислого газа, уменьшение загрязнения атмосферы и замедление экологическая деградация.
Технология CCS: Технология CCS, или технология улавливания и хранения углекислого газа (CCS), является одной из наиболее важных технологий для решения проблемы глобального изменения климата в краткосрочной перспективе. Это относится к использованию технологии улавливания углерода. Двуокись углерода, производимая энергетической промышленностью, отделяется, а затем хранится и транспортируется в место, изолированное от атмосферы, например, на морское дно или под землю.
Здоровье человека Исследования показали, что при концентрации углекислого газа
в воздухе менее 2%, явного вреда для людей нет. Превышение этого
концентрация может вызвать поражение органов дыхания человека, т. е. углерод
диоксид обычно не является ядовитым веществом, но при концентрации
углекислый газ в воздухе превышает определенный предел, это может привести к тому, что тело
отравлены, а высокие концентрации углекислого газа могут вызвать удушье.
Превышение этого
концентрация может вызвать поражение органов дыхания человека, т. е. углерод
диоксид обычно не является ядовитым веществом, но при концентрации
углекислый газ в воздухе превышает определенный предел, это может привести к тому, что тело
отравлены, а высокие концентрации углекислого газа могут вызвать удушье.
Эксперименты на животных доказали, что в воздухе с нормальным содержанием кислорода (20%), чем выше концентрация углекислого газа, тем выше смертность животного. В то же время чистый углекислый газ вызывал более быструю гибель животных из-за более низкого содержания кислорода.
Кроме того, некоторые считают, что в условиях низкого содержания кислорода углекислый газ в концентрации от 8% до 10% может вызвать смерть людей и животных за короткое время.
Принцип отравления Высокая концентрация
углекислый газ сам по себе оказывает стимулирующее и анестезирующее действие и может вызывать
гипоксия, вызывающая удушье организма.
Симптомы отравления
Легкое: Общий дискомфорт, такой как головокружение, головная боль, мышечная слабость и общая слабость.
Умеренная: Головокружение, чувство стеснения в груди, боль в носу и першение в горле, затрудненное дыхание, сжатие грудной клетки и удушье, сильная головная боль, шум в ушах, мышечная слабость, покраснение кожи, повышение артериального давления, учащенный пульс И сильный.
Тяжелая: Внезапное головокружение не может поддерживать и падает на землю, отрыжка, одышка, сердцебиение, потеря сознания, кома, кровоподтеки на коже губ и ногтей, падение артериального давления, пульс слишком слабый, зрачок расширен. Отражение света исчезает, все тело мягкое, голосовая щель увеличена, дыхание и сердцебиение останавливаются последовательно до смерти. Некоторые симптомы могут включать сонливость и потерю памяти после острого периода.
Первая помощь
①
Быстро вывести отравленного человека из высококонцентрированного углекислого газа
окружающую среду, выйти на свежий воздух, ослабить воротник отравившегося,
искусственно помогать дыханию, чтобы оно как можно скорее вдохнуло кислород, и
при необходимости обработайте гипербарическим кислородом, спасатели должны носить эффективную
защитник дыхания.
② Инъекции стимуляторов дыхания, антибиотиков при вторичных инфекциях; при сниженной способности связывания углекислого газа следует вводить внутривенно бикарбонат натрия или лактат натрия, при спазмах конечностей можно принимать большие дозы седативные средства, длительно сохраняющаяся высокая температура и судороги могут быть использованы в качестве седативных средств, другие, такие как легкие. Лечение таких симптомов, как отек и отек головного мозга.
Метод предотвращения
Перед входом в рабочую зону с высокой концентрацией углекислого газа, проверьте, не поступает ли углекислый газ концентрация в воздухе превышает 2%. Если она превышает, необходимо принять эффективные меры безопасности, такие как:
① проветривайте и детоксицируйте, замените воздух на рабочем месте и сделайте углекислый газ концентрация в воздухе. Не более 2%.
② носить вентиляционную маску, противогаз с самоотсасывающимся катетером, кислородный респиратор и другие часто используемые противогазы.
Подходит для хранения в прохладном вентилируемом складе для негорючих газов, подходит для отгрузки в жидком или твердом виде. При хранении и транспортировке двуокиси углерода следует обратить внимание на следующие моменты:
① Хранить вдали от огня и источников тепла, а температура хранения не должна превышать 30 ℃.
② Магазин отдельно от легковоспламеняющихся материалов и избегать смешанного хранения.
③ складское помещение должно быть оборудовано оборудованием для экстренной очистки от протечек.
- Почему важен круговорот углерода || Как это работает
- Альдегиды, кетоны и карбоновые кислоты
- Спирты, фенолы и эфиры
Теги: круговорот углекислого газа, элемент углекислого газа, формула углекислого газа, молекула углекислого газа, отравление углекислым газом, использование углекислого газа, использование углекислого газа в повседневной жизни
Угарный газ и углекислый газ: сравним
В чем разница между угарным газом и углекислым газом? Если вы путаете их, вы не одиноки. Вы, наверное, знаете, что это два разных газа, но какой из них хороший, а какой плохой? Правильно ли вообще классифицировать их таким образом? Прежде чем перейти к тому, как и где окись углерода (CO) и двуокись углерода (CO2) влияют на людей и окружающую среду, и как их проверять, давайте разберемся, откуда они берутся.
Вы, наверное, знаете, что это два разных газа, но какой из них хороший, а какой плохой? Правильно ли вообще классифицировать их таким образом? Прежде чем перейти к тому, как и где окись углерода (CO) и двуокись углерода (CO2) влияют на людей и окружающую среду, и как их проверять, давайте разберемся, откуда они берутся.
Оба газа представляют собой комбинацию углерода и кислорода, поэтому их названия похожи. Но эти газы создаются в результате различных химических реакций.
Откуда берется углекислый газ? Углекислый газ является результатом полного сгорания. Полное сгорание – это химическая реакция, при которой углеводород взаимодействует с кислородом с образованием углекислого газа и воды. Полное сгорание часто (но не всегда) связано с пламенем. Вы наблюдаете полное сгорание, когда смотрите, как горит свеча: воск свечи — это углеводород, который вступает в реакцию с кислородом воздуха и теплом от зажженного фитиля. Углекислый газ выделяется в воздух в виде бесцветного газа без запаха. Это в основном нереакционноспособный газ, и после выпуска он быстро смешивается с атмосферой.
Это в основном нереакционноспособный газ, и после выпуска он быстро смешивается с атмосферой.
Двуокись углерода также производится в промышленных процессах. Промышленные предприятия, которые производят водород или аммиак из природного газа, угля или ферментации в больших объемах, являются одними из крупнейших коммерческих производителей двуокиси углерода. Углекислый газ имеет множество применений в пищевой промышленности и производстве напитков, включая газирование напитков.
Откуда берется окись углерода?Угарный газ, с другой стороны, является результатом неполного сгорания. Неполное сгорание происходит при ограниченном доступе воздуха, поэтому к углероду присоединяется только половина кислорода, образуя монооксид углерода (CO = один атом кислорода, CO2 = два атома кислорода).
В отличие от двуокиси углерода, угарный газ не встречается в природе в атмосфере. Он образуется при неполном сгорании угля, природного газа и нефти. Низкий уровень кислорода и низкие температуры приводят к образованию угарного газа в горючей смеси.
Опасные уровни угарного газа могут образовываться в любом топливном приборе, включая газовые печи, газовые плиты, газовые сушилки, газовые водонагреватели, камины и автомобили. Поскольку это бесцветный газ без запаха, вы не можете идентифицировать его без детекторов газа.
В промышленных условиях двигатель внутреннего сгорания является основным источником угарного газа. Многие печи и печи производят большое количество газа, особенно если они не обслуживаются должным образом. Водители грузовиков, операторы вилочных погрузчиков или люди, работающие рядом с этим типом оборудования, подвергаются более высокому риску воздействия. Работники вблизи или в закрытых помещениях или замкнутых пространствах, таких как люки, гаражи, туннели, погрузочные доки, склады, мастерские по ремонту автомобилей и машины для сращивания, также подвергаются риску.
Хотя монооксид углерода обычно является нежелательным побочным продуктом, упакованный монооксид углерода используется в различных отраслях промышленности, включая производство металлов, химическое производство, фармацевтику, электронику и полупроводники, а также для восстановления руд при производстве карбонилов металлов.
Хотя отравление двуокисью углерода встречается редко, его высокая концентрация в замкнутом пространстве может быть токсичной. Избыток углекислого газа занимает пространство в воздухе вместо кислорода, создавая среду для удушья. Симптомы легкого отравления углекислым газом включают головные боли и головокружение при концентрации менее 30 000 частей на миллион. При концентрации 80 000 частей на миллион CO2 может быть опасным для жизни. Для справки, OSHA (Управление по безопасности и гигиене труда) установило допустимый предел воздействия CO2 (PEL) в 5000 частей на миллион в течение восьми часов и 30 000 частей на миллион в течение 10-минутного периода.
Угарный газ — гораздо более опасный газ. Угарный газ, также известный как «Бесшумный убийца», представляет собой бесцветный, не имеющий запаха, вкуса и не вызывающий раздражения газ, поэтому ранние признаки отравления трудно обнаружить. По оценкам Центров по контролю и профилактике заболеваний, более 50 000 человек в США госпитализированы с симптомами отравления угарным газом, а более 430 человек ежегодно умирают от этого газа. [3] Угарный газ настолько опасен, потому что он связывается с частями вашей крови, которые несут молекулы кислорода, поэтому он химически блокирует ваше тело и органы от получения кислорода, в котором они нуждаются. Текущий допустимый предел воздействия OSHA (PEL) для окиси углерода составляет 50 частей на миллион в среднем за восемь часов, что намного ниже, чем PEL для двуокиси углерода. Уровень воздействия, который считается непосредственно опасным для жизни и здоровья (IDLH), составляет 1500 частей на миллион.
По оценкам Центров по контролю и профилактике заболеваний, более 50 000 человек в США госпитализированы с симптомами отравления угарным газом, а более 430 человек ежегодно умирают от этого газа. [3] Угарный газ настолько опасен, потому что он связывается с частями вашей крови, которые несут молекулы кислорода, поэтому он химически блокирует ваше тело и органы от получения кислорода, в котором они нуждаются. Текущий допустимый предел воздействия OSHA (PEL) для окиси углерода составляет 50 частей на миллион в среднем за восемь часов, что намного ниже, чем PEL для двуокиси углерода. Уровень воздействия, который считается непосредственно опасным для жизни и здоровья (IDLH), составляет 1500 частей на миллион.
Когда дело доходит до выбора промышленного газоанализатора для рабочего места, одногазовый детектор угарного газа не измеряет уровни двуокиси углерода и не работает в обратном направлении.





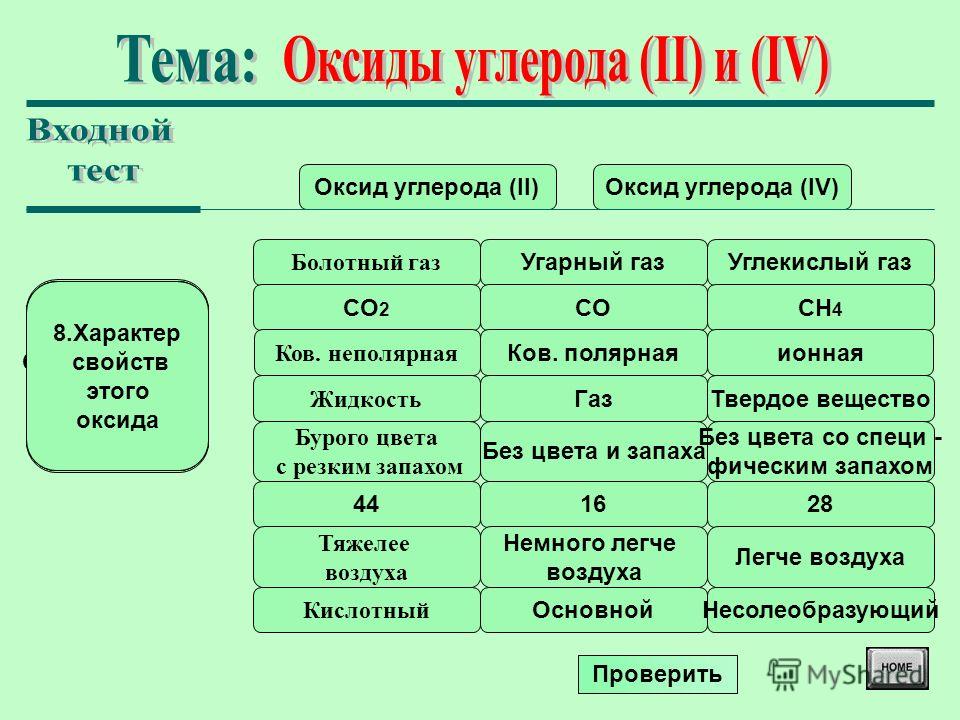 Углекислый газ заменяет газовые генераторы, экономя топливные затраты и устраняя вредные выбросы.
Углекислый газ заменяет газовые генераторы, экономя топливные затраты и устраняя вредные выбросы.

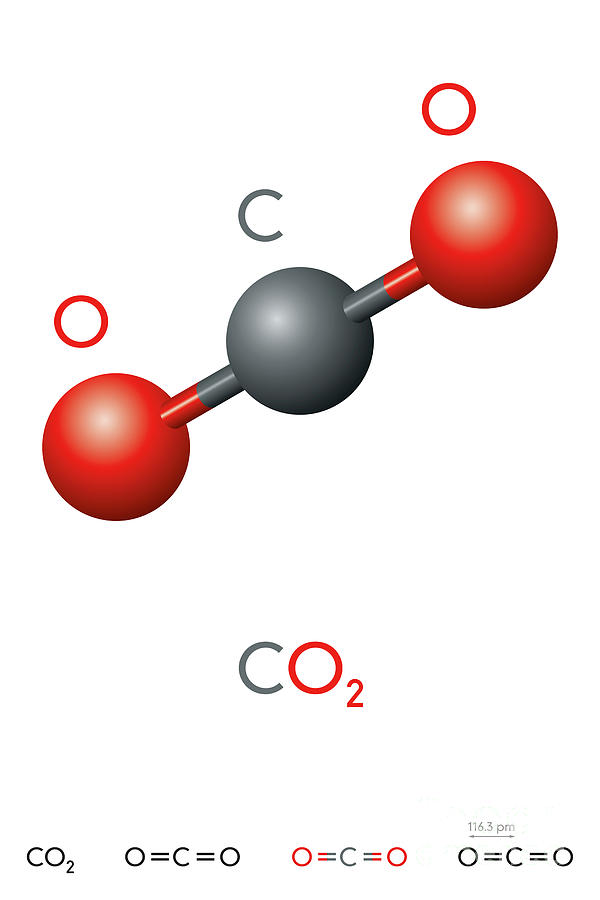
 Как уже говорилось выше, главное свойство угарного газа – это способность вызывать кислородную недостаточность в организме человека. При относительно длительном воздействии (15-25 минут), наступает необратимое изменение биологических и физических показателей в крови, сопровождающееся параличом, долговременной потерей сознания, вплоть до коматозного состояния. Также наблюдаются судороги, непроизвольное мочеиспускание и опорожнение кишечника, посинение кожных покровов и слизистых оболочек. Дыхание человека при этом, вследствие дефицита кислорода, становится поверхностным и прерывистым. Далее наступает смерть.
Как уже говорилось выше, главное свойство угарного газа – это способность вызывать кислородную недостаточность в организме человека. При относительно длительном воздействии (15-25 минут), наступает необратимое изменение биологических и физических показателей в крови, сопровождающееся параличом, долговременной потерей сознания, вплоть до коматозного состояния. Также наблюдаются судороги, непроизвольное мочеиспускание и опорожнение кишечника, посинение кожных покровов и слизистых оболочек. Дыхание человека при этом, вследствие дефицита кислорода, становится поверхностным и прерывистым. Далее наступает смерть.

 Предусмотрен контроль разряда аккумулятора. Электронная установка “нуля”.
Предусмотрен контроль разряда аккумулятора. Электронная установка “нуля”.




