Формула вольфрама: Таблица менделеева – Электронный учебник K-tree
alexxlab | 25.05.2023 | 0 | Разное
Таблица менделеева – Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную
электронную конфигурацию.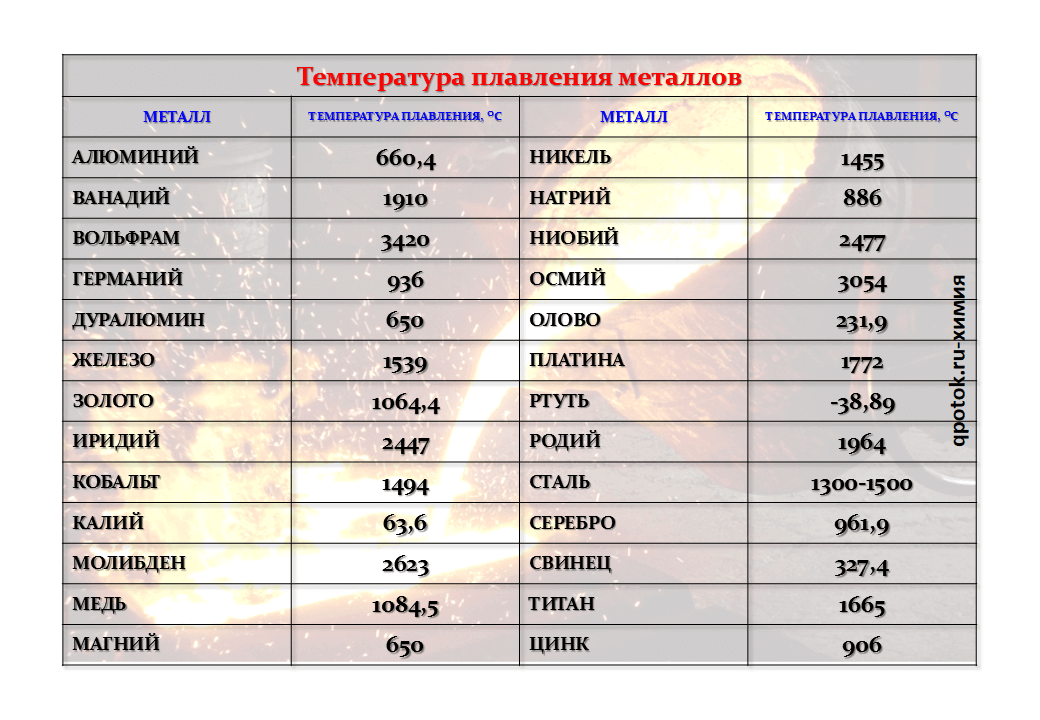
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Вольфрам, свойства атома, химические и физические свойства
Вольфрам, свойства атома, химические и физические свойства.
Поделиться в:
W 74 Вольфрам
183,84(1) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d4 6s2
Вольфрам — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 74. Расположен в 6-й группе (по старой классификации — побочной подгруппе шестой группы), шестом периоде периодической системы.
И. Менделеева с атомным номером 74. Расположен в 6-й группе (по старой классификации — побочной подгруппе шестой группы), шестом периоде периодической системы.
Атом и молекула вольфрама. Формула вольфрама. Строение вольфрама
Изотопы и модификации вольфрама
Свойства вольфрама (таблица): температура, плотность, давление и пр.
Физические свойства вольфрама
Химические свойства вольфрама. Взаимодействие вольфрама. Реакции с вольфрамом
Получение вольфрама
Применение вольфрама
Таблица химических элементов Д.И. Менделеева
Атом и молекула вольфрама. Формула вольфрама. Строение вольфрама:
Вольфрам (лат. Wolframium, от нем. Wolf Rahm – «волчья пена») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением W и атомным номером 74. Расположен в 6-й группе (по старой классификации – побочной подгруппе шестой группы), шестом периоде периодической системы.
Вольфрам – металл. Относится к переходным металлам. Относится группе тяжёлых, редких, тугоплавких, цветных металлов.
Вольфрам — самый тугоплавкий из металлов.
Вольфрам обозначается символом W.
Как простое вещество вольфрам при нормальных условиях представляет собой твёрдый, блестящий, серебристо-серый металл.
Молекула вольфрама одноатомна.
Химическая формула вольфрама W.
Электронная конфигурация атома вольфрама 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d4 6s2. Потенциал ионизации (первый электрон) атома вольфрама равен 758,76 кДж/моль (7,86403(10) эВ).
Потенциал ионизации (первый электрон) атома вольфрама равен 758,76 кДж/моль (7,86403(10) эВ).
Строение атома вольфрама. Атом вольфрама состоит из положительно заряженного ядра (+74), вокруг которого по шести оболочкам движутся 74 электрона. При этом 72 электрона находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку вольфрам расположен в шестом периоде, оболочек всего шесть. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья и пятая – внутренние оболочки представлены s-, р- и d-орбиталями. Четвертая – внутренняя оболочка представлена s-, р-, d- и f-орбиталями. Шестая – внешняя оболочка представлена s-орбиталью. На внутреннем энергетическом уровне атома вольфрама на 5d-орбитали находятся четыре неспаренных электрона. На внешнем энергетическом уровне атома вольфрама – на s-орбитали находятся два спаренных электрона. В свою очередь ядро атома вольфрама состоит из 74 протонов и 110 нейтронов. Вольфрам относится к элементам d-семейства.
Вольфрам относится к элементам d-семейства.
Радиус атома вольфрама (вычисленный) составляет 193 пм.
Атомная масса атома вольфрама составляет 183,84(1) а. е. м.
При стандартных условиях вольфрам химически стоек.
Вольфрам, свойства атома, химические и физические свойства
Изотопы и модификации вольфрама:
Свойства вольфрама (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Вольфрам |
| 102 | Прежнее название | |
| 103 | Латинское название | Wolframium |
| 104 | Английское название | Tungsten |
| 105 | Символ | W |
| 106 | Атомный номер (номер в таблице) | 74 |
| 107 | Тип | Металл |
| 108 | Группа | Переходный, тяжёлый, редкий, тугоплавкий, цветной металл |
| 109 | Открыт | Карл Вильгельм Шееле, Швеция, 1781 г. (назван), Хуан Хосе Эльхуяр Любизе и Фаусто де Эльхуяр, Испания, 1783 г. (назван), Хуан Хосе Эльхуяр Любизе и Фаусто де Эльхуяр, Испания, 1783 г. |
| 110 | Год открытия | 1783 г. |
| 111 | Внешний вид и пр. | Твёрдый, тугоплавкий, блестящий серебристо-серый металл |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 2 аллотропные модификации: – α-вольфрам с кубической объёмно-центрированной кристаллической решёткой, – β-вольфрам с кубической кристаллической решёткой, именуемой фаза А15 |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,00011 % |
| 120 | Содержание в морях и океанах (по массе) | 1,2·10-8 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 5,0·10-8 % |
| 122 | Содержание в Солнце (по массе) | 4,0·10-7 % |
| 123 | Содержание в метеоритах (по массе) | 0,000012 % |
| 124 | Содержание в организме человека (по массе) | |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 183,84(1) а. е. м. (г/моль) е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f 14 5s2 5p6 5d4 6s2 |
| 203 | Электронная оболочка | K2 L8 M18 N32 O12 P2 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 193 пм |
| 205 | Эмпирический радиус атома* | 135 пм |
| 206 | Ковалентный радиус* | 162 пм |
| 207 | Радиус иона (кристаллический) | W4+ 80 (6) пм, W5+ 76 (6) пм, W6+ 74 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | |
| 209 | Электроны, Протоны, Нейтроны | 74 электрона, 74 протона, 110 нейтронов |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 6 |
| 212 | Группа в периодической таблице | 6-ая группа (по старой классификации – побочная подгруппа 6-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -4, -2, -1, 0, +1, +2, +3, +4, +5, +6 |
| 302 | Валентность | II, III, IV, V, VI |
| 303 | Электроотрицательность | 2,3 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 758,76 кДж/моль (7,86403(10) эВ) |
| 305 | Электродный потенциал | W3+ + 3e– → W, Eo = +0,11 В, W6+ + 6e– → W, Eo = +0,68 В |
| 306 | Энергия сродства атома к электрону | 78,76(1) кДж/моль (0,81626(8) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность* | 19,3 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 17,6 г/см3 (при температуре плавления 3422 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 3422 °C (3695 K, 6192 °F) |
| 403 | Температура кипения* | 5930 °C (6203 K, 10706 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 52,31 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔH | 774 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,114 Дж/г·K (при 0-1000 °C) |
| 410 | Молярная теплоёмкость | 24,27 Дж/(K·моль) |
| 411 | Молярный объём | 9,55 см³/моль |
| 412 | Теплопроводность | 173 Вт/(м·К) (при стандартных условиях), 162,8 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | α-вольфрам |
| 512 | Структура решётки | Кубическая объёмно-центрированная
|
| 513 | Параметры решётки | 3,160 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 310 K |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-33-7 |
Примечание:
205* Эмпирический радиус вольфрама согласно [1] и [3] составляет 139 пм и 137 пм соответственно.
206* Ковалентный радиус вольфрама согласно [1] и [3] составляет 162±7 пм и 170 пм соответственно.
401* Плотность вольфрама согласно [3] и [4] составляет 19,25 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – твердое тело) и 19,32 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) соответственно.
402* Температура плавления вольфрама согласно [4] составляет 3420 °C (3693,15 K, 6188 °F).
403* Температура кипения вольфрама согласно [3] и [4] составляет 5555 °C (5828 K, 10031 °F) и 5680 °C (5953,15 K, 10256 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) вольфрама согласно [4] составляет 61,5 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) вольфрама согласно [3] и [4] составляет 824 кДж/моль и 769 кДж/моль соответственно.
Физические свойства вольфрама:
Химические свойства вольфрама.
 Взаимодействие вольфрама. Реакции с вольфрамом:
Взаимодействие вольфрама. Реакции с вольфрамом:
Получение вольфрама:
Применение вольфрама:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28.
 Никель
Никель - 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62.
 Самарий
Самарий - 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95.
 Америций
Америций - 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Tungsten
- https://de.wikipedia.org/wiki/Wolfram
- https://ru.wikipedia.org/wiki/Вольфрам
- http://chemister.
 ru/Database/properties.php?dbid=1&id=284
ru/Database/properties.php?dbid=1&id=284 - https://chemicalstudy.ru/volfram-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: © Фото https://www.pexels.com, https://pixabay.com
вольфрам атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле вольфрама вольфрам
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности 1 859
Селенид вольфрама – Металлы ESPI
ПАСПОРТ БЕЗОПАСНОСТИ МАТЕРИАЛА
0
3 I. ИДЕНТИФИКАЦИЯ ПРОДУКТА
ИДЕНТИФИКАЦИЯ ПРОДУКТА
Производитель/Поставщик :
ESPI Metals
1050 Benson Way, Ashland, OR 97520
Бесплатный звонок (800) 638-2581 * Факс (541) 488-8313
Электронная почта: Этот адрес электронной почты защищен от спам-ботов. У вас должен быть включен JavaScript для просмотра.
Наименование продукта : Селенид вольфрама
Формула : 1 Номер AS : 12067-46-8
II. ОПАСНЫЕ КОМПОНЕНТЫ
Опасный компонент: Селенид вольфрама
Проценты (%): 3
OSHA/PEL: 0,2 мг/м 3
ACGIH/TLV: 0,2 мг/м 3 22 3 1 Рейтинги HMIS :
Здоровье : 3
Воспламеняемость : 0
Реактивность : 0
III. ФИЗИЧЕСКИЕ ДАННЫЕ
ФИЗИЧЕСКИЕ ДАННЫЕ
Температура кипения : Н/Д
Температура плавления : N/A
Удельный вес : 9,32 г/куб. см 046 O : Нерастворимый
Внешний вид и запах : Черный порошок и кусочки, нет запах
IV. ДАННЫЕ ПО ОПАСНОСТИ ПОЖАРА И ВЗРЫВА
Температура вспышки : Н/Д
Температура самовоспламенения : Н/Д
Пределы воспламеняемости : Верхний : Н/Д Нижний : Н/Д
Средства пожаротушения : Используйте и подходящие средства пожаротушения для окружающих материалов.
Особые правила пожаротушения : Пожарные должны носить закрытый автономный дыхательный аппарат с полной защитной одеждой для предотвращения контакта с кожей и глазами. Испарения от огня опасны. Изолируйте сток, чтобы предотвратить загрязнение окружающей среды.
Необычные опасности пожара и взрыва : При нагревании до разложения селенид вольфрама может выделять токсичные пары селена.
V. ИНФОРМАЦИЯ ОБ ОПАСНОСТИ ДЛЯ ЗДОРОВЬЯ
Эффекты воздействия :
Насколько нам известно, химические, физические и токсикологические свойства селенидеттена не были тщательно исследованы.
В промышленности вольфрам не представляет серьезной опасности для здоровья. Воздействие связано главным образом с пылью, образующейся при дроблении и измельчении двух основных вольфрамовых руд, а именно шелита и вольфрамита. Большие передозировки вызывают расстройства центральной нервной системы, диарею, дыхательную недостаточность и смерть экспериментальных животных (Sax, Dangerous Properties of Industrial Materials).
Соединения селена являются ядом при вдыхании и внутривенном введении. Некоторые соединения селена являются экспериментальными канцерогенами. Длительное воздействие может быть причиной бокового амиотрофического склероза у людей, так же как может вызвать «слепое пошатывание» у крупного рогатого скота. Элементарный селен обладает низкой острой системной токсичностью, но пыль или пары могут вызвать серьезное раздражение дыхательных путей. Неорганические соединения селена могут вызывать дерматит. Чесночный запах изо рта является распространенным симптомом. В случаях хронического воздействия сообщалось о бледности, нервозности, депрессии, расстройствах пищеварения и смерти (Sax, Dangerous Properties of Industrial Materials).
Элементарный селен обладает низкой острой системной токсичностью, но пыль или пары могут вызвать серьезное раздражение дыхательных путей. Неорганические соединения селена могут вызывать дерматит. Чесночный запах изо рта является распространенным симптомом. В случаях хронического воздействия сообщалось о бледности, нервозности, депрессии, расстройствах пищеварения и смерти (Sax, Dangerous Properties of Industrial Materials).
Острые эффекты :
Вдыхание : ОПАСНО-ЯД. Может вызывать раздражение дыхательных путей и острое отравление селеном.
Проглатывание : Может вызывать желудочно-кишечные расстройства.
Кожа : Может вызывать раздражение.
Глаза : Может вызывать раздражение.
Хронические эффекты :
Вдыхание : Может вызвать хроническое отравление селеном. Продолжительная интоксикация может вызвать потерю ногтей и волос, гемолитическую анемию и повреждение почек, печени и селезенки.
Проглатывание : Может вызвать хроническую токсичность селена. Большие передозировки могут вызвать расстройства нервной системы и диарею.
Кожа : Может вызывать дерматит.
Глаз : Хронических последствий для здоровья не зарегистрировано.
Органы-мишени : Верхние дыхательные пути и центральная нервная система, печень, почки и кровь.
Медицинские состояния, обычно усугубляемые воздействием : Ранее существовавшие респираторные и кожные заболевания.
Канцерогенность : NTP : Нет IARC : Нет ПРОЦЕДУРЫ СКОРОЙ ПОМОЩИ И ПЕРВОЙ ПОМОЩИ :
ВДЫХАНИЕ : Вынести пострадавшего на свежий воздух, обеспечить тепло и покой, дайте кислород, если дыхание затруднено, и обратитесь за медицинской помощью.
ПРОГЛАТЫВАНИЕ : Дайте 1-2 стакана молока или воды и вызовите рвоту. Сохраняйте тепло и тишину, обратитесь за медицинской помощью. Никогда не вызывайте рвоту и не давайте ничего перорально человеку, находящемуся без сознания.
Никогда не вызывайте рвоту и не давайте ничего перорально человеку, находящемуся без сознания.
КОЖА : Снять загрязненную одежду, очистить кожу щеткой, промыть пораженный участок мягким мылом и водой. Обратитесь за медицинской помощью, если симптомы сохраняются.
ГЛАЗ : Промывать глаза теплой водой, поднимая верхнее и нижнее веко, в течение не менее 15 минут. Обратитесь за медицинской помощью, если симптомы сохраняются.
VI. ДАННЫЕ О РЕАКЦИОННОЙ СПОСОБНОСТИ
Стабильность : Стабильная
Условия, которых следует избегать : Нет
Несовместимость (материал, которого следует избегать) : Не записано.
Опасные продукты разложения : Пары селена
Опасная полимеризация : Не произойдет ПРОЦЕДУРЫ РАЗЛИВА ИЛИ УТЕЧКИ
Действия, которые необходимо предпринять в случае утечки или разлива материала : Наденьте соответствующие средства защиты органов дыхания и защиты, указанные в разделе VIII.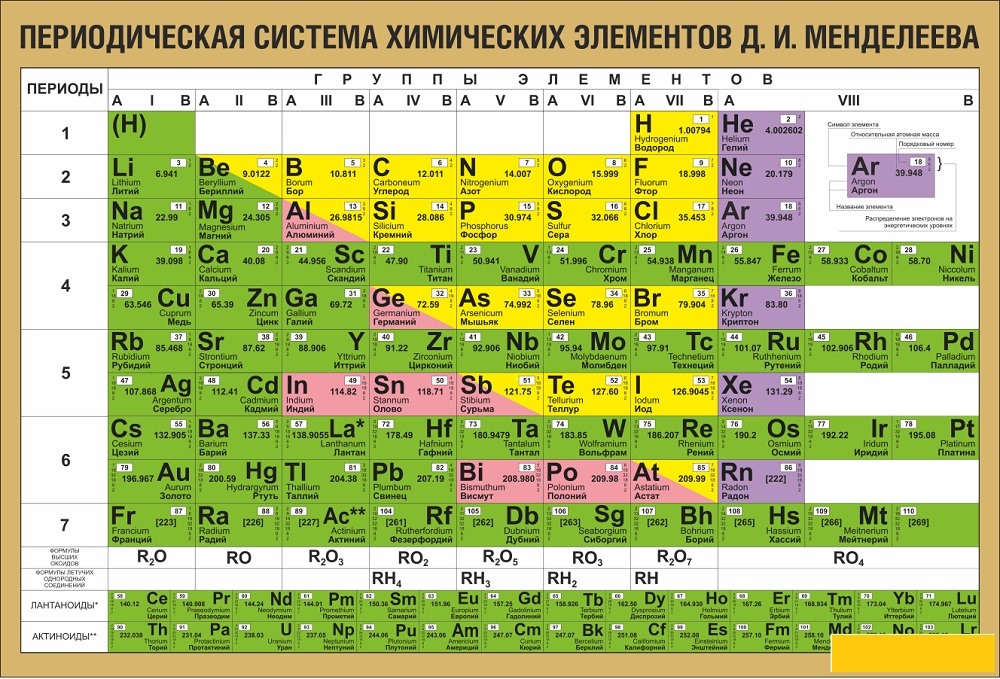 Изолируйте место разлива и обеспечьте вентиляцию. Пропылесосить разлитое, используя высокоэффективный воздушный фильтр для удаления твердых частиц (HEPA), и поместить в закрытый контейнер для надлежащей утилизации. Следите за тем, чтобы не поднималась пыль.
Изолируйте место разлива и обеспечьте вентиляцию. Пропылесосить разлитое, используя высокоэффективный воздушный фильтр для удаления твердых частиц (HEPA), и поместить в закрытый контейнер для надлежащей утилизации. Следите за тем, чтобы не поднималась пыль.
Метод утилизации отходов : Утилизируйте в соответствии с местными, государственными и федеральными нормами.
VIII. ИНФОРМАЦИЯ О СПЕЦИАЛЬНОЙ ЗАЩИТЕ
Защита органов дыхания : Одобренный NIOSH респиратор с картриджем от пыли, тумана и паров
Вентиляция : Обращение в контролируемом закрытом процессе. Используйте местный выхлоп для поддержания концентрации на уровне или ниже PEL, TLV. Особое: не рекомендуется использование общего выхлопа
Защитные перчатки : Резиновые перчатки
Средства защиты глаз : Защитные очки
Другая защитная одежда или оборудование : Защитное снаряжение, подходящее для предотвращения загрязнения.
IX. ОСОБЫЕ МЕРЫ ПРЕДОСТОРОЖНОСТИ
Меры предосторожности при обращении и хранении : Хранить в прохладном, сухом месте. Хранить в плотно закрытой таре. Тщательно мойте после обработки.
Методы работы : Внедрить инженерно-технические средства контроля и методы работы для снижения и поддержания концентрации воздействия на низких уровнях. Используйте хорошие методы уборки и санитарии. Не используйте табак или пищу в рабочей зоне. Тщательно мойте перед едой и курением. Не сдувайте пыль с одежды или кожи сжатым воздухом. Поддерживайте средства для промывания глаз, обеспечивающие продолжительную промывку, безопасный душ и приспособления для промывания.
Перечислено TSCA : Да
Правила DOT :
Класс опасности : 6.1
Идентификационный номер : UN3283
900 III Правильное транспортное наименование : Соединение селена, твердое, н. у.к., (селенид вольфрама)
у.к., (селенид вольфрама)
Приведенная выше информация считается верной, но не претендует на полноту и должна использоваться только в качестве руководства. ESPI не несет ответственности за любой ущерб, возникший в результате обращения или контакта с вышеуказанным продуктом.
Выдано: S. Dierks
Пересмотрено/проверено: Май 2012 г.
WebElements Periodic Table » Tungsten » гексабромид вольфрама
- Формула: WBr 6
- Формула системы Hill: Br 6 W 1
- Регистрационный номер CAS: [13701-86-5]
- Вес формулы: 663.264
- Класс: бромид
- Цвет: от темно-синего до черного
- Внешний вид: кристаллическое твердое вещество
- Температура плавления: 309°C
- Точка кипения: сублим при 327
- Плотность:
Ниже приведены некоторые синонимы числа 9. 0363 гексабромид вольфрама :
0363 гексабромид вольфрама :
- гексабромид вольфрама
- вольфрама(VI) бромид
- бромид вольфрама
Степень окисления вольфрама в гексабромиде вольфрама 6 .
Синтез
Нет в наличии
Твердотельная структура
- Геометрия вольфрама: 6 координата: октаэдрическая
- Прототип конструкции:
Элементный анализ
В таблице показано процентное содержание элементов для WBr 6 (гексабромид вольфрама).
| Элемент | % |
|---|---|
| Бр | 72,28 |
| Вт | 27,72 |
Изотопная схема WBr
6 На приведенной ниже диаграмме показана рассчитанная изотопная картина для формулы WBr 6 с наиболее интенсивным ионом, установленным на 100%.
Каталожные номера
Данные на страницах этих соединений собраны и адаптированы из основной литературы и нескольких других источников, включая следующие.
- Р.Т. Сандерсон в Chemical Periodicity , Reinhold, New York, USA, 1960.
- Н.Н. Гринвуд и А. Эрншоу в Chemistry of the Elements , 2-е издание, Butterworth, UK, 1997.
- Ф.А. Коттон, Г. Уилкинсон, К.А. Мурильо и М. Бохманн, в Advanced Inorganic Chemistry , John Wiley & Sons, 1999.
- А. Ф. Тротман-Дикенсон, (редактор) в Комплексная неорганическая химия , Пергамон, Оксфорд, Великобритания, 1973.
- Р.В.Г. Вайкофф, в Crystal Structures , том 1, Interscience, John Wiley & Sons, 1963.
- A.R.West в Базовая химия твердого тела Химия , John Wiley & Sons, 1999.
- А. Ф. Уэллс в Структурная неорганическая химия , 4-е издание, Оксфорд, Великобритания, 1975.
- Дж.Д.Х. Донней, (редактор) в Определяющих таблицах данных о кристаллах , монография ACA № 5, Американская кристаллографическая ассоциация, США, 1963.



 Никель
Никель Самарий
Самарий Америций
Америций ru/Database/properties.php?dbid=1&id=284
ru/Database/properties.php?dbid=1&id=284