Формула вуглекислого газу: Формула углекислого газа в химии
alexxlab | 01.04.2020 | 0 | Разное
Формула углекислого газа в химии
Химическая, структурная и электронная формулы углекислого газа
Химическая формула: СО2.
Структурная формула: O = C = O
Электронная формула:
Молярная масса: 44,01 г/моль.
Физические свойства углекислого газа
При стандартных условиях – газ без цвета и запаха, с кисловатым вкусом. При атмосферном давлении не существует в жидком состоянии, при сильном охлаждении кристаллизуется в виде «сухого льда» – белой снегообразной массы. Температура сублимации равна –78 °С. При нормальных условиях в одном объеме воды растворяется 0,9 объемов углекислого газа.
Химические свойства углекислого газа
Является кислотным оксидом.
Качественная реакция – помутнение известковой воды (Ca(OH)2) за счет образования белого осадка карбоната кальция:
Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений.
В промышленности углекислый газ получают термическим разложением карбонатов:
В лаборатории – действием сильных кислот на карбонаты или гидрокарбонаты:
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Углекислота – это… Что такое Углекислота?
| Диоксид углерода | |
|---|---|
  | |
| Другие названия | углекислый газ, углекислота, сухой лед(твердый) |
| Формула | CO2 |
| Молярная масса | 44.0095(14) г/моль |
| В твердом виде | сухой лед |
| Вид | бесцветный газ |
| Номер CAS | [124-38-9] |
| Свойства | |
| Плотность и фазовое состояние | 1.98 кг/м³, при н.у.; 771 кг/м³, жидкий; 1512 кг/м³, твёрдый |
| Растворимость в воде | 1.45 кг/м³ |
| Удельная теплота плавления | 25.13 кДж/моль |
| Точка плавления | −57 °C (216 K), под давлением |
| Точка кипения | −78 °C (195 K), возгоняется |
| Константа диссоциации кислоты (pKa) | 6.35 and 10.33 |
| Вязкость | 0.07 пз при −78 °C |
| Строение | |
| Форма молекулы | линейная |
| Кристаллическая решётка | кварцевидная |
| Дипольный момент | ноль |
| Техника безопасности | |
| MSDS | External MSDS |
| Главные опасности | удушающее, раздражающее |
| NFPA 704 |  0 0 0
(жидкость) |
| R-phrases | R: As, Fb |
| S-phrases | S9, S23, S36 (ж) |
| RTECS number | FF6400000 |
| Страница дополнительных сведений | |
| Структура и свойства | n, εr , и т. д. |
| Спектр | УФ, ИК, ЯМР, Масс-спектроскопия |
| Родственные соединения | |
| Оксиды | CO C3O2 C2O CO3 |
| Если не указано иное, данные даны для материалов при стандартных условиях (25 °C, 100 кПа) Infobox disclaimer and references | |
Диокси́д углеро́да (двуо́кись углеро́да, углеки́слый газ, окси́д углеро́да (IV), диокси́д углеро́да, у́гольный ангидрид, углекислота́) — CO2, бесцветный газ со слегка кисловатым запахом и вкусом.
Концентрация углекислого газа в атмосфере Земли составляет 0,038 %.
- Не следует путать с Диоксин.
Свойства
Физические
Плотность при нормальных условиях 1,98 г/л. При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное. Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Углекислый газ легко пропускает ультрафиолетовые лучи и лучи видимой части спектра, которые поступают на Землю от Солнца и обогревают её. В то же время он поглощает испускаемые Землёй инфракрасные лучи и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
Химические
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом — реакция Кольбе) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Биологические
Диоксид углерода играет одну из главных ролей в живой природе, участвуя во многих процессах метаболизма живой клетки. Диоксид углерода получается в результате множества окислительных реакций у животных, и выделяется в атмосферу с дыханием. Углекислый газ атмосферы — основной источник углерода для растений. Однако, ошибкой будет утверждение, что животные только выделяют углекислый газ, а растения — только поглощают его. Растения поглощают углекислый газ в процессе фотосинтеза, а без освещения они тоже его выделяют.
Диоксид углерода не токсичен, но не поддерживает дыхание. Большая концентрация в воздухе вызывает удушье (см. Гиперкапния). Недостаток углекислого газа тоже опасен (см. Гипокапния)
Углекислый газ в организмах животных имеет и физиологическое значение, например, участвует в регуляции сосудистого тонуса (см. Артериолы).
Получение
В промышленности получают из печных газов, из продуктов разложения природных карбонатов (известняк, доломит). Смесь газов промывают раствором карбоната калия, который поглощает углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании разлагается, высвобождая углекислоту. При промышленном производстве закачивается в баллоны.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора с соляной кислотой.
Применение
В пищевой промышленности диоксид углерода используется как консервант и обозначается на упаковке под кодом Е290, а также в качестве разрыхлителя теста.
Жидкая углекислота (жидкая пищевая углекислота) — сжиженный углекислый газ, хранящийся под высоким давлением (~ 65-70 Атм). Бесцветная жидкость. При выпуске жидкой углекислоты из баллона в атмосферу часть её испаряется, а другая часть образует хлопья сухого льда.
Баллоны с жидкой углекислотой широко применяются в качестве огнетушителей и для производства газированной воды и лимонада. Углекислый газ используется в качестве активной среды при сварке проволокой так как при температуре дуги углекислота разлагается на угарный газ СО и кислород который в свою очередь и входит в заимодействие с жидким металом окисляя его. Углекислота в баллончиках применяется в пневматическом оружии и в качестве источника энергии для двигателей в авиамоделировании.
Твёрдая углекислота — сухой лёд — используется в качестве хладагента в ледниках и морозильных установках.
Методы регистрации
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта.
Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф.
Концентрация
- Подземное животное голый землекоп отличается терпимостью к большим (смертельным для других животных) концентрациям углекислого газа.[1]
Примечания
См. также
Ссылки
Wikimedia Foundation. 2010.
Вуглекислий газ — формула, молярна маса, фізичні властивості
Діоксид вуглецю, оксид вуглецю, вуглекислота – всі ці назви однієї і тієї ж речовини, відомої нам як вуглекислий газ. Так якими ж властивостями володіє цей газ, і які сфери його застосування?
Вуглекислий газ і його фізичні властивості
Вуглекислий газ складається з вуглецю і кисню. Формула вуглекислого газу виглядає так
CO2
У природі він утворюється при спалюванні або гнитті органічних речовин. В повітрі і мінеральних джерелах вміст газу також досить великий. Крім того люди і тварини також виділяють діоксид вуглецю при видихання.
Діоксид вуглецю є абсолютно безбарвним газом, його неможливо побачити. Також він не має і запаху. Однак при його великій концентрації у людини може розвинутися гіперкапнія, тобто задуха. Нестача вуглекислого газу також може заподіяти проблеми зі здоров’ям. В результаті нестачі цього газу може розвинутися зворотний стан до задухи – гіпокапнія.
Якщо помістити вуглекислий газ в умови низької температури, то при -72 градусах він кристалізується і стає схожий на сніг. Тому вуглекислий газ в твердому стані називають «сухий сніг».
Вуглекислий газ щільніший за повітря в 1,5 рази.
Його щільність становить 1,98 кг/м3. Хімічний зв’язок в молекулі вуглекислого газу ковалентно-полярний. Полярний він (зв’язок) є через те, що у кисню більше значення електронегативності.
Важливим поняттям при вивченні речовин є молекулярна і молярна маса.
Молярна маса вуглекислого газу дорівнює 44.
Це число формується з суми відносних атомних мас атомів, які входять до складу молекули. Значення відносних атомних мас беруться з таблиці Д. І. Менделєєва і округлюються до цілих чисел.
Відповідно, молярна маса CO2 = 12 + 2 * 16.
Щоб обчислити масові частки елементів в вуглекислому газі необхідно слідувати формі розрахунку масових часток кожного хімічного елемента в речовині.
w = n * Ar/Mr
де
- n – число атомів або молекул;
- Ar – відносна атомна маса хімічного елемента;
- Mr – відносна молекулярна маса речовини.
Розрахуємо відносну молекулярну масу вуглекислого газу.
Mr (CO2) = 14 + 16 * 2 = 44 w (C) = 1 * 12/44 = 0,27 або 27%
Так як в формулу вуглекислого газу входить два атома кисню, то
n = 2 w (O) = 2 * 16/44 = 0,73 або 73%
Відповідь: w (C) = 0,27 або 27%; w (O) = 0,73 або 73%
Хімічні і біологічні властивості вуглекислого газу
Вуглекислий газ має кислотні властивості, так як є кислотним оксидом, і при розчиненні у воді утворює вугільну кислоту:
CO2 + H2O = H2CO3
Вуглекислий газ вступає в реакцію з лугами, в результаті чого утворюються:
- карбонати;
- гідрокарбонати.
Цей газ не схильний до горіння. У ньому горять тільки деякі активні метали, наприклад, магній.
При нагріванні вуглекислий газ розпадається на чадний газ і кисень:
2CO3 = 2CO + O3.
Як і інші кислотні оксиди, даний газ легко вступає в реакцію з іншими оксидами:
СaO + Co3 = CaCO3.
Вуглекислий газ входить до складу всіх органічних речовин. Кругообіг цього газу в природі здійснюється за допомогою:
- продуцентів;
- консументів;
- редуцентів.
У процесі життєдіяльності людина виробляє приблизно 1 кг. вуглекислого газу на добу.
При вдиху ми отримуємо кисень, проте в цей момент в альвеолах утворюється вуглекислий газ. У цей момент відбувається обмін: кисень потрапляє в кров, а вуглекислий газ виходить назовні.
Отримання вуглекислого газу відбувається при виробництві алкоголю. Також цей газ є побічним продуктом при отриманні:
- азоту;
- кисню;
- аргону.
Застосування вуглекислого газу необхідно в харчовій промисловості, де вуглекислий газ виступає в якості консерванту, а також вуглекислий газ у вигляді рідини міститься в вогнегасниках.
Що ми дізналися?
Вуглекислий газ – це речовина, яка в нормальних умовах не має кольору і запаху. Крім своєї звичайної назви – вуглекислий газ, його також називають:
- оксид вуглецю;
- діоксид вуглецю.
Двуокись углерода – это… Что такое Двуокись углерода?
| Диоксид углерода | |
|---|---|
  | |
| Другие названия | углекислый газ, углекислота, сухой лед(твердый) |
| Формула | CO2 |
| Молярная масса | 44.0095(14) г/моль |
| В твердом виде | сухой лед |
| Вид | бесцветный газ |
| Номер CAS | [124-38-9] |
| Свойства | |
| Плотность и фазовое состояние | 1.98 кг/м³, при н.у.; 771 кг/м³, жидкий; 1512 кг/м³, твёрдый |
| Растворимость в воде | 1.45 кг/м³ |
| Удельная теплота плавления | 25.13 кДж/моль |
| Точка плавления | −57 °C (216 K), под давлением |
| Точка кипения | −78 °C (195 K), возгоняется |
| Константа диссоциации кислоты (p | 6.35 and 10.33 |
| Вязкость | 0.07 пз при −78 °C |
| Строение | |
| Форма молекулы | линейная |
| Кристаллическая решётка | кварцевидная |
| Дипольный момент | ноль |
| Техника безопасности | |
| MSDS | External MSDS |
| Главные опасности | удушающее, раздражающее |
| NFPA 704 |  0 0 0
(жидкость) |
| R-phrases | R: As, Fb |
| S-phrases | S9, S23, S36 (ж) |
| RTECS number | FF6400000 |
| Страница дополнительных сведений | |
| Структура и свойства | n, εr, и т. д. |
| Спектр | УФ, ИК, ЯМР, Масс-спектроскопия |
| Родственные соединения | |
| Оксиды | CO C3O2 C2O CO3 |
| Если не указано иное, данные даны для материалов при стандартных условиях (25 °C, 100 кПа) Infobox disclaimer and references | |
Диокси́д углеро́да (двуо́кись углеро́да, углеки́слый газ, окси́д углеро́да (IV), диокси́д углеро́да, у́гольный ангидрид, углекислота́) — CO2, бесцветный газ со слегка кисловатым запахом и вкусом.
Концентрация углекислого газа в атмосфере Земли составляет 0,038 %.
- Не следует путать с Диоксин.
Свойства
Физические
Плотность при нормальных условиях 1,98 г/л. При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное. Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Углекислый газ легко пропускает ультрафиолетовые лучи и лучи видимой части спектра, которые поступают на Землю от Солнца и обогревают её. В то же время он поглощает испускаемые Землёй инфракрасные лучи и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
Химические
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом — реакция Кольбе) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Биологические
Диоксид углерода играет одну из главных ролей в живой природе, участвуя во многих процессах метаболизма живой клетки. Диоксид углерода получается в результате множества окислительных реакций у животных, и выделяется в атмосферу с дыханием. Углекислый газ атмосферы — основной источник углерода для растений. Однако, ошибкой будет утверждение, что животные только выделяют углекислый газ, а растения — только поглощают его. Растения поглощают углекислый газ в процессе фотосинтеза, а без освещения они тоже его выделяют.
Диоксид углерода не токсичен, но не поддерживает дыхание. Большая концентрация в воздухе вызывает удушье (см. Гиперкапния). Недостаток углекислого газа тоже опасен (см. Гипокапния)
Углекислый газ в организмах животных имеет и физиологическое значение, например, участвует в регуляции сосудистого тонуса (см. Артериолы).
Получение
В промышленности получают из печных газов, из продуктов разложения природных карбонатов (известняк, доломит). Смесь газов промывают раствором карбоната калия, который поглощает углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании разлагается, высвобождая углекислоту. При промышленном производстве закачивается в баллоны.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора с соляной кислотой.
Применение
В пищевой промышленности диоксид углерода используется как консервант и обозначается на упаковке под кодом Е290, а также в качестве разрыхлителя теста.
Жидкая углекислота (жидкая пищевая углекислота) — сжиженный углекислый газ, хранящийся под высоким давлением (~ 65-70 Атм). Бесцветная жидкость. При выпуске жидкой углекислоты из баллона в атмосферу часть её испаряется, а другая часть образует хлопья сухого льда.
Баллоны с жидкой углекислотой широко применяются в качестве огнетушителей и для производства газированной воды и лимонада. Углекислый газ используется в качестве активной среды при сварке проволокой так как при температуре дуги углекислота разлагается на угарный газ СО и кислород который в свою очередь и входит в заимодействие с жидким металом окисляя его. Углекислота в баллончиках применяется в пневматическом оружии и в качестве источника энергии для двигателей в авиамоделировании.
Твёрдая углекислота — сухой лёд — используется в качестве хладагента в ледниках и морозильных установках.
Методы регистрации
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта.
Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф.
Концентрация
- Подземное животное голый землекоп отличается терпимостью к большим (смертельным для других животных) концентрациям углекислого газа.[1]
Примечания
См. также
Ссылки
Wikimedia Foundation. 2010.
Діоксид вуглецю — Вікіпедія
Матеріал з Вікіпедії — вільної енциклопедії.


Діокси́д вуглецю́, оксид карбону (IV), вуглекислий газ, CO2 — тривка хімічна сполука, поширена в природних газах, що містять його в кількості від декількох відсотків до практично чистого вуглекислого газу. Безбарвний, має кислуватий смак і запах. Є кінцевим продуктом окиснення вуглецю, не горить, не підтримує горіння і дихання. Токсична дія вуглекислого газу виявляється при його вмісті в повітрі 3—4 % і полягає в подразненні дихальних шляхів, запамороченні, головному болі, шумі у вухах, психічному збудженні, непритомному стані.
Неотруйний газ, без кольору і запаху, що є природною складовою атмосфери. Вуглекислий газ є продуктом спалювання викопного палива. Він має парникові властивості, тобто сприяє утриманню тепла на поверхні Землі і вносить основний вклад у глобальне потепління.
При 20 °C в 1 об’ємі води розчиняється 0,88 об’ємів CO2. Водний розчин його має кислуватий смак. На відміну від монооксиду діоксид вуглецю є солетвірним оксидом — ангідридом карбонатної кислоти H2CO3.
Під тиском близько 60 атм діоксид вуглецю при звичайній температурі перетворюється в рідину. У зрідженому стані у сталевих балонах його можна зберігати і транспортувати. При сильному охолодженні він перетворюється в снігоподібну масу (сухий лід), яка сублімує (випаровується не плавлячись) при —78,5°С.
Діоксид вуглецю не підтримує дихання і горіння звичайних видів палива. Але речовини, що мають більше споріднення до кисню, ніж вуглець, можуть віднімати у нього кисень. Так, наприклад, запалена свічка гасне в атмосфері CO2, а запалена магнієва стрічка продовжує горіти:
- 2 Mg + CO 2 ⟶ 2 MgO + C {\displaystyle {\ce {2Mg + CO_2 -> 2MgO + C}}}
Незначні кількості CO2 нешкідливі для людини і тварин, але при концентрації його в повітрі понад 3 % за об’ємом він стає шкідливим, а при 10 % і більше — смертельним.
У народному господарстві діоксид вуглецю широко застосовується в хімічній промисловості при виробництві соди, сечовини тощо, а також у виробництві цукру, вина, пива, для виготовлення газованої води і т. д. Широко відомі природні джерела діоксиду вуглецю у вигляді мінеральних вод «Нарзан», «Боржомі» та інші. Спресований твердий CO2 під назвою «сухий лід» застосовують для охолодження м’яса, риби і інших харчових продуктів, що швидко псуються. Сухий лід значно більше, ніж звичайний, знижує температуру і при випаровуванні не залишає ніякої рідини. У техніці діоксид вуглецю одержують розкладанням карбонату кальцію:
- CaCO 3 → t CaO + CO 2 {\displaystyle {\ce {CaCO_3 ->[{t}] CaO + CO_2}}}
В лабораторних умовах його звичайно одержують при дії хлоридної кислоти на мармур: CaCO 3 + 2 HCl ⟶ CaCl 2 + CO 2 ↑ + H 2 O {\displaystyle {\ce {CaCO_{3}{+}2HCl->CaCl_{2}{+}CO_{2}\uparrow \ {+}H_{2}O}}}
У природі діоксид вуглецю постійно утворюється при найрізноманітніших процесах: горінні вугілля і інших видів палива, диханні, бродінні, гнитті тощо.
При виділенні вуглекислого газу з підошви виробки і відсутності активного струменя повітря в нижній частині її можуть утворюватися застійні зони з високою концентрацією. В рудниковій атмосфері вуглекислий газ присутній завжди, бо утворюється у великій кількості за рахунок біохімічних та хімічних реакцій окиснення, що протікають в гірничих виробках. Звичайно виділення природного вуглекислого газу в гірничі виробки незначні, винятками є виділення вуглекислого газу магматичного походження в деяких вугільних та калійних родовищах. Граничний допустимий вміст СО2 в шахтному повітрі 0,5-1 % (за об’ємом). При 10 % наступає непритомність, при 20-25 % — смертельне отруєння. Перша допомога при отруєнні полягає у винесенні потерпілого на свіже повітря, проведенні штучного дихання.
формула, свойства и области применения :: SYL.ru
Диоксид углерода (углекислый газ) – часто встречающееся в природе соединение. Оно образуется при окислении различных органических веществ. Наиболее часто встречающиеся процессы образования этого соединения – гниение животных и растительных останков, горение различных видов топлива, дыхание животных и растений. Например, один человек за сутки выделяет в атмосферу около килограмма углекислого газа. Оксид и диоксид углерода могут образовываться и в неживой природе. Углекислый газ выделяется при вулканической деятельности, а также может быть добыт из минеральных водных источников. Углекислый газ находится в небольшим количестве и в атмосфере Земли.

Особенности химического строения данного соединения позволяют ему участвовать во множестве химических реакций, основой для которых является диоксид углерода.
Формула
В соединении этого вещества четырехвалентный атом углерода образовывает линейную связь с двумя молекулами кислорода. Внешний вид такой молекулы можно представить так:

Теория гибридизации объясняет строение молекулы диоксида углерода так: две существующие сигма-связи образованы между sp-орбиталями атомов углерода и двумя 2р-орбиталями кислорода; р-орбитали углерода, которые не принимают участие в гибридизации, связаны в соединении с аналогичными орбиталями кислорода. В химических реакциях углекислый газ записывается в виде: CO2.
Физические свойства
При нормальных условиях диоксид углерода представляет собой бесцветный газ, не обладающий запахом. Он тяжелее воздуха, поэтому углекислый газ и может вести себя, как жидкость. Например, его можно переливать из одной емкости в другую. Это вещество немного растворяется в воде – в одном литре воды при 20 ⁰С растворяется около 0,88 л CO2. Небольшое понижение температуры кардинально меняет ситуацию – в том же литре воды при 17⁰С может раствориться 1,7 л CO2. При сильном охлаждении это вещество осаждается в виде снежных хлопьев – образуется так называемый «сухой лед». Такое название произошло от того, что при нормальном давлении вещество, минуя жидкую фазу, сразу превращается в газ. Жидкий диоксид углерода образуется при давлении чуть выше 0,6 МПа и при комнатной температуре.

Химические свойства
При взаимодействии с сильными окислителями 4-диоксид углерода проявляет окислительные свойства. Типичная реакция этого взаимодействия:
С + СО2 = 2СО.
Так, при помощи угля диоксид углерода восстанавливается до своей двухвалентной модификации – угарного газа.
При нормальных условиях углекислый газ инертен. Но некоторые активные металлы могут в нем гореть, извлекая из соединения кислород и высвобождая газообразный углерод. Типичная реакция – горение магния:
2Mg + CO2 = 2MgO + C.
В процессе реакции образуется оксид магния и свободный углерод.

В химических соединениях СО2 часто проявляет свойства типичного кислотного оксида. Например, он реагирует с основаниями и основными оксидами. Результатом реакции становятся соли угольной кислоты.
Например, реакция соединения оксида натрия с углекислым газом может быть представлена так:
Na2O + CO2 = Na2CO3;
2NaOH + CO2 = Na2CO3 + H2O;
NaOH + CO2 = NaHCO3.
Угольная кислота и раствор СО2
Диоксид углерода в воде образует раствор с небольшой степенью диссоциации. Такой раствор углекислого газа называется угольной кислотой. Она бесцветна, слабо выражена и имеет кисловатый вкус.
Запись химической реакции:
CO2 + H2O ↔ H2CO3.
Равновесие довольно сильно сдвинуто влево – лишь около 1% начального углекислого газа превращается в угольную кислоту. Чем выше температура – тем меньше в растворе молекул угольной кислоты. При кипении соединения она исчезает полностью, и раствор распадается на диоксид углерода и воду. Структурная формула угольной кислоты представлена ниже.

Свойства угольной кислоты
Угольная кислота очень слабая. В растворах она распадается на ионы водорода Н+ и соединения НСО3– . В очень небольшом количестве образуются ионы СО3–.
Угольная кислота – двухосновная, поэтому соли, образованные ею, могут быть средними и кислыми. Средние соли в русской химической традиции называются карбонатами, а сильные – гидрокарбонатами.
Качественная реакция
Одним из возможных способов обнаружения газообразного диоксида углерода является изменение прозрачности известкового раствора.
Ca(OH)2 + CO2 = CaCO3↓ + H2O.
Этот опыт известен еще из школьного курса химии. В начале реакции образуется небольшое количество белого осадка, который впоследствии исчезает при пропускании через воду углекислого газа. Изменение прозрачности происходит потому, что в процессе взаимодействия нерастворимое соединение – карбонат кальция превращается в растворимое вещество – гидрокарбонат кальция. Реакция протекает по такому пути:
CaCO3 + H2O + CO2 = Ca(HCO3)2.
Получение диоксида углерода
Если требуется получить небольшое количество СО2, можно запустить реакцию соляной кислоты с карбонатом кальция (мрамором). Химическая запись этого взаимодействия выглядит так:
CaCO3 + HCl = CaCl2 + H2O + CO2 ↑.
Также для этой цели используют реакции горения углеродсодержащих веществ, например ацетилена:
СН4 + 2О2 → 2H2O + CO2.
Для сбора и хранения полученного газообразного вещества используют аппарат Киппа.
Для нужд промышленности и сельского хозяйства масштабы получения диоксида углерода должны быть большими. Популярным методом такой масштабной реакции является обжиг известняка, в результате которого получается диоксид углерода. Формула реакции приведена ниже:
CaCO3 = CaO + CO2 ↑.
Применение диоксида углерода
Пищевая промышленность после масштабного получения «сухого льда» перешла на принципиально новый метод хранения продуктов. Он незаменим при производстве газированных напитков и минеральной воды. Содержание СО2 в напитках придает им свежесть и заметно увеличивает срок хранения. А карбидизация минеральных вод позволяет избежать затхлости и неприятного вкуса.

В кулинарии часто используют метод погашения лимонной кислоты уксусом. Выделяющийся при этом углекислый газ придает пышность и легкость кондитерским изделиям.
Данное соединение часто используется в качестве пищевой добавки, повышающей срок хранения пищевых продуктах. Согласно международным нормам классификации химических добавок содержания в продуктах, проходит под кодом Е 290,
Порошкообразный углекислый газ – одно из наиболее популярных веществ, входящих в состав пожаротушительных смесей. Это вещество встречается и в пене огнетушителей.
Транспортировать и хранить углекислый газ лучше всего в металлических баллонах. При температуре более 31⁰С давление в баллоне может достигнуть критического и жидкий СО2 перейдет в сверхкритическое состояние с резким подъемом рабочего давления до 7,35 МПа. Металлический баллон выдерживает внутреннее давление до 22 МПа, поэтому диапазон давления при температурах свыше тридцати градусов признается безопасным.
Вуглекислий газ в атмосфері Землі — Вікіпедія
 Зміни концентрації CO2 в ppm впродовж останніх 400 тис. років (зверху — за останню тисячу років)
Зміни концентрації CO2 в ppm впродовж останніх 400 тис. років (зверху — за останню тисячу років)Вуглекислий газ в атмосфері Землі, станом на 2013 рік, коливався в межах від 393 ppm (0,0393 %) до 397 ppm (0,0397 %)[1]. Роль вуглекислого газу (CO2, двоокис або діоксид вуглецю ) в життєдіяльності біосфери полягає насамперед у підтриманні процесу фотосинтезу, який здійснюється рослинами. Оскільки двоокис вуглецю є парниковим газом, то він впливає на теплообмін планети з навколишнім простором, ефективно блокуючи відбите інфрачервоне випромінювання на низці частот, і таким чином бере участь у формуванні клімату планети[2].
Оскільки людство активно застосовує викопні енергоносіїв як паливо, то відбувається швидке збільшення концентрації цього газу в атмосфері. Крім того, за даними МГЕЗК ООН, до третини загальних антропогенних викидів CO2 є результатом збезлісення[3] [4]. Антропогенний вплив на концентрацію двоокису вуглецю помітний від середини XIX століття. Починаючи з цього часу, темп її зростання збільшувався і наприкінці 2000-х років відбувався зі швидкістю 2,20±0,01 ppm/рік або 1,7 % за рік. Згідно з окремими дослідженням, сучасний рівень CO2 в атмосфері є максимальним за останні 800 тис. років і, можливо, за останні 20 млн років[5][6].
Роль в парниковому ефекті[ред. | ред. код]
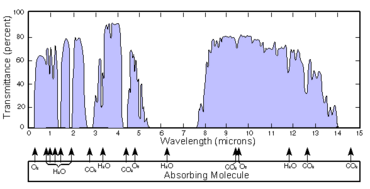 Спектр пропускання земної атмосфери (залежність прозорості від довжини хвилі). Видно смуги поглинання CO2, O2, O3 і H2O.
Спектр пропускання земної атмосфери (залежність прозорості від довжини хвилі). Видно смуги поглинання CO2, O2, O3 і H2O.Відмінною особливістю парникових властивостей двоокису вуглецю в порівнянні з іншими газами є його довгостроковий вплив на клімат, який, після припинення емісії, що його викликала, продовжується за інерцією впродовж до тисячі років. Інші парникові гази, такі як метан і оксид азоту, існують у вільному стані в атмосфері протягом коротшого часу.[7][8][9]
Попри відносно невелику концентрацію в повітрі, CO2 є важливою компонентою земної атмосфери, оскільки він поглинає і перевипромінює інфрачервоне випромінювання на різних довжинах хвиль, включаючи довжину хвилі 4,26 мкм (вібраційний режим — за рахунок асиметричного розтягнення молекули) і 14,99 мкм (вигинні коливання). Цей процес виключає або знижує випромінювання Землі в космос на цих довжинах хвиль, що призводить до парникового ефекту[2].
Крім парникових властивостей двоокису вуглецю, має значення той факт, що він важчий від повітря. Оскільки середня відносна молярна маса повітря становить 28,98 г/моль, а молярна маса CO2 — 44,01 г/моль, то збільшення частки вуглекислого газу призводить до збільшенню густини повітря і, відповідно, до зміни профілю його тиску залежно від висоти. В силу фізичної природи парникового ефекту, така зміна властивостей атмосфери призводить до збільшення середньої температури на поверхні.[10]
Основним джерелом парникового ефекту в атмосфері Землі є водяна пара[11]. За відсутності парникових газів у атмосфері і значенні сонячної постійної 1 368 Вт⁄м², середня температура на поверхні повинна становити -15 °C.[11] Насправді середня температура на поверхні Землі становить +15 °C, тобто парниковий ефект призводить до її збільшення на 30 °C, з яких 20,6 °C пояснюється наявністю в повітрі водяної пари, а 7,2 °C. [11] — вуглекислого газу. Оскільки при збільшенні частки цього газу в атмосфері його велика молярна маса призводить до зростання густини і тиску, то при одній і тій самій температурі зростання концентрації CO2 призводить до збільшення вологоємності повітря і до посилення парникового ефекту, обумовленого великою кількістю води в атмосфері.[12][13][14] Збільшення частки води в повітрі для досягнення одного і того ж рівня відносної вологості — внаслідок малої молярної маси води (18 г/моль) — знижує густину повітря, що компенсує збільшення густини, викликане наявністю підвищеного рівня вуглекислого газу в атмосфері.
Комбінація перерахованих факторів у цілому призводить до того, що збільшення концентрації від доіндустріального рівня 280 ppm до сучасного 392 ppm еквівалентне додатковому виділенню 1,8 Вт на кожен квадратний метр поверхні планети. [15]
Джерела вуглекислого газу[ред. | ред. код]


До природних джерел двоокису вуглецю в атмосфері належать вулканічні виверження, згоряння органічних речовин у повітрі і дихання представників тваринного світу (аеробні організми). Також деякі мікроорганізми виробляють вуглекислий газ в процесу бродіння, клітинного дихання і перегнивання органічних останків у повітрі. До антропогенним джерел емісії CO2 в атмосферу належать: спалювання викопних і невикопних енергоносіїв для отримання тепла, виробництва електроенергії, транспортування людей і вантажів. До значного виділення CO2 призводять деякі види промислової активності, такі, наприклад, як виробництво цементу та утилізація газів шляхом їх спалювання в газових факелах.
Рослини перетворюють одержуваний вуглекислий газ у вуглеводи в процесі фотосинтезу, який здійснюється за допомогою пігменту хлорофілу, що використовує енергію сонячного випромінювання. Одержуваний газ, кисень, вивільняється в атмосферу Землі і гетеротрофні організми та інші рослини використовують його для дихання, формуючи таким чином вуглецевий цикл.
Природні джерела[ред. | ред. код]
Більшість джерел емісії CO2, за даними на 98-й рік, є природними. Перегнивання органічного матеріалу, такого як мертві дерева і трава, призводить до щорічного виділення 220 млрд тонн двоокису вуглецю, земні океани виділяють 330 млрд.[15] Внаслідок індонезійських лісових і торф’яних пожеж 1997 року[en] було виділено 13-40 % від середньорічної емісії CO2, одержуваної в результаті спалювання копалин палив.[16][17] У часи молодої Землі вулканічна активність була головним джерелом вуглекислого газу, а нині його вулканічна емісія (близько 130—230 млн тонн на рік) становить менш як 1 % від антропогенних викидів.[18][19]
У звичайному стані ці природні джерела перебувають у рівновазі з фізичними та біологічними процесами, що видаляють двоокис вуглецю з атмосфери — частина CO2 розчиняється в морській воді і частина видаляється з повітря в процесі фотосинтезу. Оскільки зазвичай в ході цього процесу поглинається 5,5 ×1011 т діоксиду вуглецю, а його загальна маса в земній атмосфері становить 3,03 ×1012 т, то в середньому весь атмосферний CO2 бере участь у вуглецевому циклі раз на шість років.[15] Через наявність антропогенних викидів поглинання CO 2 біосферою перевершувало його виділення на ≈17 млрд тонн в середині 2000-х років, швидкість його поглинання має стійку тенденцію до збільшення разом із зростанням атмосферної концентрації.[15][20]
Антропогенна емісія[ред. | ред. код]
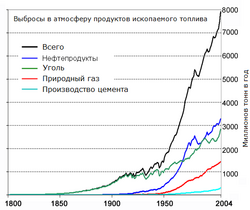 Емісія вуглецю в атмосферу в результаті промислової активності в 1800—2004 роках
Емісія вуглецю в атмосферу в результаті промислової активності в 1800—2004 рокахЗ настанням промислової революції в середині XIX століття відбувалося поступове збільшення антропогенних викидів двоокису вуглецю в атмосферу, що призвело до порушення балансу вуглецевого циклу і зростання концентрації CO2. Нині близько 57 % виробленого людством вуглекислого газу видаляється з атмосфери рослинами і океанами.[21] Співвідношення збільшення кількості CO 2 в атмосфері до всього виділеного CO2 становить постійну величину порядку 45 % і зазнає короткоперіодичних коливань і коливань з періодом п’ять років.[20]
Спалювання викопних палив, таких як вугілля, нафта і природний газ, є основною причиною емісії антропогенного CO2, знеліснення є другою за значимістю причиною. У 2008 році в результаті спалювання викопного палива в атмосферу було виділено 8,67 млрд тонн вуглецю (31,8 млрд тонн CO2), тоді як в 1990 році річна емісія вуглецю становила 6,14 млрд тонн.[22] Відведення лісів під землекористування привела до збільшення вмісту атмосферного двоокису вуглецю еквівалентне спалюванню 1,2 млрд тонн вугілля у 2008 році (1,64 млрд тонн у 1990).[22] Сумарне збільшення за 18 років становить 3 % від щорічного природного циклу CO2, що достатньо для виведення системи з рівноваги і для прискореного зростання рівня CO2.[23] Внаслідок цього, двоокис вуглецю поступово акумулювався в атмосфері й станом на 2009 рік його концентрація на 39 % перевершувала доіндустріальну.[24]
Таким чином, попри те, що (станом на 2011 рік) сумарне антропогенне виділення CO2 не перевищує 8 % від його природного річного циклу, спостерігається збільшення концентрації, обумовлене не лише рівнем антропогенних викидів, але й постійним зростанням рівня викидів з часом.
Зміна температури і вуглецевий цикл[ред. | ред. код]
До інших чинників, що збільшує вміст CO 2 в атмосфері, слід віднести зростання середньої температури в XX столітті, що повинно було відбиватися в прискоренні перегнивання органічних залишків і, внаслідок прогрівання океанів, в зниженні загальної кількості діоксиду вуглецю, що розчиняється у воді. Збільшення температури відбувалося в тому числі через виключно високу сонячну активність в цей період і в XIX столітті (див., наприклад, подія Каррінгтона 1859 року)[25].
При переході від умов холодного до теплого клімату протягом останнього мільйона років, природна зміна концентрації атмосферного CO2 залишалася в межах 100 ppm, тобто сумарне збільшення його вмісту не перевищувало 40 %.[26] При цьому, наприклад, середня температура планети в період кліматичного оптимуму 9000÷5000 років до н. е. була приблизно на 1-2 °C вища від сучасної, а внаслідок сильніше вираженого парникового ефекту в умовах теплого клімату середньорічна аномалія температури в субарктичних широтах сягала 9 °C[27].
Вплив вулканізму[ред. | ред. код]

Сучасний вулканізм в середньому призводить до виділення 2×108 тонн CO2 на рік, що становить менш як 1 % від антропогенних викидів емісії.[18] Основна відмінність цього виду емісії від антропогенної полягає в тому, що при спалюванні викопних енергоносіїв у повітрі відбувається заміщення молекул кисню молекулами вуглекислого газу, тобто сумарне збільшення маси атмосфери відповідає масі спаленого вуглецю, тоді як при вулканічних виверженнях відбувається збільшення маси атмосфери на величину, що дорівнює масі виділеного газу.
Вуглекислий газ — другий за кількістю (після водяної пари) газ, що виділяється вулканами. Більшість газу, який виділяють підводні вулкани, розчиняється у воді.[28] Ізотопний склад діоксиду вуглецю, що виділяється, приблизно відповідає ізотопному складу атмосферного CO2, який утворюється в результаті спалювання викопних енергоносіїв, що ускладнює точне визначення об’єму вулканічної емісії CO2.[28]
Великі вулканічні виверження можуть призводити до значного виділенню діоксиду вуглецю в атмосферу, але такі виверження відбуваються рідко — кілька подій на століття — і в середньому не роблять помітного впливу на рівень емісії цього газу в атмосферу. Наприклад, при виверженні вулкана Лакі 1783 року виділилося приблизно 90 млн тонн CO2, при виверженні Тамбори 1815 близько 48 млн тонн.[28] Окремі дослідження вказують на дещо більше виділення двоокису вуглецю під час вищезгаданих виверженнь (Лакі 1783 ≈6,5 ×108 т), але відносна рідкість подібних подій робить їх вплив на вміст вуглекислого газу несуттєвим і в цьому разі.[28]
Останнім виверженням категорії VEI 6 було виверження вулкана Пінатубо 1991 року. Його основний вплив на вміст вуглекислого газу в атмосфері полягав у виділенні аерозолів у стратосферу і, як наслідок, у порушенні балансу вуглецевого циклу через зниження на 0,5 °C середньої температури на планеті унаслідок антипарникового ефекту. Збільшення амплітуди сезонних коливань на графіку Кілінга в цей період часу вказує на деяке поліпшення умов для здійснення фотосинтезу рослинами на початку 1990-х років. Останнє можна пояснити ефектом розсіювання сонячного випромінювання на частинках стратосферного аерозолю, що і призвело до збільшення споживання атмосферного CO2 рослинами.[29]
Сучасна концентрація[ред. | ред. код]
 Зміна концентрації CO2 за 50 років.
Зміна концентрації CO2 за 50 років.Станом на 2009 рік середня концентрація CO2 в атмосфері Землі становила 0,0387 % або 387 ppm[1][30]. Разом з річним зростанням на 2,20±0,01 ppm впродовж року спостерігається періодична зміна концентрації амплітудою 3-9 ppm, яка йде за розвитком вегетаційного періоду в Північній півкулі. Оскільки в північній частині планети розташовані всі основні континенти, вплив рослинності північної півкулі домінує в річному циклі концентрації CO2. Рівень досягає максимуму в травні, коли кількість біомаси, яка здійснює фотосинтез, є найбільшою, й мінімуму в жовтні[31].
Зміна концентрації в минулому[ред. | ред. код]
Найбільш достовірний спосіб вимірювання концентрації двоокису вуглецю в атмосфері за період часу до початку прямих вимірювань — визначення його кількості в бульбашках повітря, укладених в крижаних кернах з материкових льодовиків Антарктиди і Гренландії. Найбільш широко заради цього використовують антарктичні керни, згідно з якими рівень атмосферного CO2 залишався в межах 260—284 ppm до початку промислової революції в середині XIX століття і протягом 10 тис. років до цього моменту часу.[32] Окремі дослідження, засновані на вивченні викопного листя, вказують на набагато суттєвіші зміни рівня CO2 за цей час (~ 300 ppm), але їх піддають критиці.[33][34] Також керни, взяті в Гренландії, вказують на значну відмінність концентрації вуглекислого газу в них, як порівняти з показниками Антарктиди. Але при цьому дослідники гренландських кернів припускають, що ця різниця обумовлена локальними опадами карбонату кальцію[35]. У разі низького рівня пилу в зразках льоду, взятого в Гренландії, дані за рівнями CO2 протягом голоцену добре узгоджуються з даними з Антарктики.
Найбільш тривалий період вимірювань рівнів CO2 на підставі вивчення крижаних кернів можливий в Східній Антарктиді, де вік льоду досягає 800 тис. років, і який показує, що концентрація двоокису вуглецю змінювалася в межах 180—210 ppm під час льодовикових періодів і збільшувалася до 280—300 ppm під час тепліших періодів. [5][26][36]
 Зміни концентрації атмосферного вуглекислого газу впродовж фанерозою (останні 541 млн років, сучасність ліворуч). Протягом більшої частини останніх 550 млн років рівень CO2 значно перевершував сучасний.
Зміни концентрації атмосферного вуглекислого газу впродовж фанерозою (останні 541 млн років, сучасність ліворуч). Протягом більшої частини останніх 550 млн років рівень CO2 значно перевершував сучасний.На більш тривалих інтервалах часу вміст атмосферного CO2 підраховують на підставі визначення балансу геохімічних процесів, включаючи визначення кількості матеріалу органічного походження в осадових породах, вивітрювання силікатних порід і вулканізм у досліджуваний період. Протягом десятків мільйонів років у разі будь-якого порушення рівноваги у вуглецевому циклі відбувалося подальше зменшення концентрації CO2. Оскільки швидкість цих процесів виключно низька, то встановлення взаємозв’язку емісії двоокису вуглецю з подальшою зміною його рівня протягом наступних сотень років є складним завданням.
Для вивчення концентрації вуглекислого газу в минулому також використовують різні непрямі[en] методи датування. Вони включають визначення співвідношення ізотопів бору і вуглецю в деяких типах морських осадових порід і кількість продихів у викопному л́исті рослин. Попри те, що ці вимірювання менш точні, ніж дані крижаних кернів, вони дозволяють визначити дуже високі концентрації CO2 у минулому, які 150—200 млн років тому становили 3000 ppm (0,3 %) і 400—600 млн років тому — 6000 ppm (0,6 %)[6].
Зниження рівня атмосферного CO2 припинилося на початку пермського періоду, але продовжилося, починаючи приблизно з 60 млн років тому. На рубежі еоцену і олігоцену (34 млн років тому — початок формування сучасного Антарктичного льодовикового щита) кількість CO2 становила 760 ppm.[37] За геохімічними даними встановлено, що рівень вуглекислого газу в атмосфері досягнув доіндустріального рівня 20 млн років тому і становив 300 ppm.
Взаємозв’язок із концентрацією в океані[ред. | ред. код]
 Обмін вуглекислого газу між водоймами і повітрям
Обмін вуглекислого газу між водоймами і повітрямУ земних океанах двоокису вуглецю в сто разів більше, ніж в атмосфері — 36 ×1012 тонн у перерахунку на вуглець. Він там перебуває у вигляді гідрокарбонат — і карбонат — іонів. Гідрокарбонати з’являються в результаті реакцій між скельними породами, водою і CO2. Одним із прикладів є розкладання карбонату кальцію:
- CaCO3 + CO2 + H2O ⇌ Ca2+ + 2 HCO3–
Реакції, подібні до цієї, призводять до згладжування коливань концентрації атмосферного CO2. Оскільки права частина реакції містить кислоту, додавання CO2 в лівій частині зменшує pH, тобто призводить до закислення океану. Інші реакції між двоокисом вуглецю і некарбонатними породами теж призводять до утворення вугільної кислоти та її іонів.
Цей процес є зворотним, що призводить до утворення вапнякових та інших карбонатних порід з вивільненням половини гідрокарбонатів у вигляді CO2. Впродовж сотень мільйонів років цей процес призвів до зв’язування в карбонатних породах здебільшого первісного діоксиду вуглецю з протоатмосфери Землі. У кінцевому підсумку більшість CO2, отриманого в результаті антропогенної емісії, буде розчинено в океані, але швидкість, з якою буде відбуватися цей процес у майбутньому, залишається не до кінця визначеною.[38]
- ↑ а б (англ.) Tans, Pieter. Globally averaged marine surface monthly mean data. NOAA/ESRL[en]. Процитовано 2014-02-19.
- ↑ а б (англ.) Petty, G.W.: A First Course in Atmospheric Radiation, pages 229—251, Sundog Publishing, 2004
- ↑ http://www.ipcc.ch/pdf/assessment-report/ar4/wg1/ar4-wg1-chapter7.pdf IPCC Fourth Assessment Report, Working Group I Report «The Physical Science Basis», Section 7.3.3.1.5 (p. 527)
- ↑ www.un.org: Зміна клімату.(рос.)
- ↑ а б (англ.) Deep ice tells long climate story. BBC News. 2006-09-04. Процитовано 2010-04-28.
- ↑ а б (англ.) Climate Change 2001: The Scientific Basis Архівовано 27 квітень 2007 у Wayback Machine.
- ↑ (англ.) Irreversible climate change due to carbon dioxide emissions — PNAS
- ↑ (англ.) WMO statement on the globa climate in 2010 Архівовано 11 травень 2011 у Wayback Machine.
- ↑ (англ.) Bundle Up, It’s Global Warming, JUDAH COHEN, 25.12.2010
- ↑ Природа парникового ефекту Архівовано 1 травень 2009 у Wayback Machine., Об’єднана наукова рада РАН з проблем геоінформатики(рос.)
- ↑ а б в Подрезов А. О., Аламанов С. К.; Лелевкин В. М., Подрезов О. А., Балбакова Ф. (Москва – Бишкек, 2006). ИЗМЕНЕНИЕ КЛИМАТА и водные проблемы в Центральной Азии. WWF: Учебный курс для студентов естественных и гуманитарных специальностей. с. 18. Архів оригіналу за 2012-07-12. Процитовано 2015-12-06.
- ↑ (англ.) An Introduction to Air Density and Density Altitude Calculations, 1998 — 2012 Richard Shelquist
- ↑ Абсолютна і відносна вологість(рос.)
- ↑ (англ.) Humidity 101 Архівовано 16 квітень 2013 у Archive.is, World Water Rescue Foundation
- ↑ а б в г Зміна клімату, торгівля вуглецем і біорізноманіття, World Bank Group: Хабіба Гітай(рос.)
- ↑ (англ.) Indonesian Wildfires Accelerated Global Warming
- ↑ (англ.) Massive peat burn is speeding climate change — 06 November 2004 — New Scientist
- ↑ а б (англ.) Gerlach, T.M., 1992, Present-day CO2 emissions from volcanoes: Eos, Transactions, American Geophysical Union, Vol. 72, No. 23, June 4, 1991, pp. 249, and 254—255
- ↑ (англ.) U.S. Geological Survey, «Volcanic Gases and Their Effects», volcanoes.usgs.gov
- ↑ а б Keeling et al., 1995
- ↑ (англ.) Abstract, Contributions to accelerating atmospheric CO2 growth from economic activity, carbon intensity, and efficiency of natural sinks .
- ↑ а б (англ.) Global carbon budget 2008 Архівовано 12 січень 2016 у Wayback Machine., lgmacweb.env.uea.ac.uk Архівовано 5 березень 2016 у Wayback Machine.
- ↑ (англ.) US Global Change Research Information Office, «Common Questions about Climate Change»
- ↑ (англ.) Carbon Budget 2009 Highlights Архівовано 16 грудень 2011 у Wayback Machine., The Global Carbon Project.
- ↑ (англ.) Usoskin, Ilya G., Ilya G.; Solanki, Sami K.; Schüssler, Manfred; Mursula, Kalevi; Alanko, Katja (2003). A Millennium Scale Sunspot Number Reconstruction: Evidence For an Unusually Active Sun Since the 1940’s (PDF). Physical Review Letters 91: 211101. doi:10.1103/PhysRevLett.91.211101.
- ↑ а б (англ.) Vostok Ice Core Data, ncdc.noaa.gov
- ↑ (англ.) V.L. Koshkarova and A.D. Koshkarov (2004). Regional signatures of changing landscape and climate of northern central Siberia in the Holocene. Russian Geology and Geophysics 45 (6): 672–685.
- ↑ а б в г (англ.) Volcanic Carbon Dioxide, Timothy Casey
- ↑ (англ.) Mount Pinatubo as a Test of Climate Feedback Mechanisms, Alan Robock, Department of Environmental Sciences, Rutgers University
- ↑ (англ.) Current atmospheric CO2 concentration at http://co2unting.com. Архів оригіналу за 2012-07-12. Процитовано 2019-04-06.
- ↑ (англ.) Carbon Dioxide Information Analysis Center (CDIAC) — Frequently Asked Questions
- ↑ (англ.) Historical CO2 record derived from a spline fit (20 year cutoff) of the Law Dome DE08 and DE08-2 ice cores. Архів оригіналу за 2012-07-12. Процитовано 2007-06-12.
- ↑ (англ.) Wagner, Friederike; Bent Aaby and Henk Visscher (2002). Rapid atmospheric O2 changes associated with the 8,200-years-B.P. cooling event. PNAS 99 (19): 12011–12014. PMC 129389. PMID 12202744. doi:10.1073/pnas.182420699.
- ↑ (англ.) Indermühle, Andreas; Bernhard Stauffer, Thomas F. Stocker (1999). Early Holocene Atmospheric CO2 Concentrations. Science 286 (5446): 1815. doi:10.1126/science.286.5446.1815a. Процитовано May 26, 2005.
- ↑ (англ.) Smith, H.J.; M Wahlen and D. Mastroianni (1997). The CO2 concentration of air trapped in GISP2 ice from the Last Glacial Maximum-Holocene transition. Geophysical Research Letters 24 (1): 1 – 4. doi:10.1029/96GL03700.
- ↑ (англ.) Chemical & Engineering News: Latest News — Ice Core Record Extended
- ↑ (англ.) New CO2 data helps unlock the secrets of Antarctic formation September 13th, 2009
- ↑ (англ.) Archer, D. (2005). Fate of fossil fuel CO2 in geologic time. J. Geophys. Res., 110.
- GMS: A Year In The Life Of Earth’s CO2 : [арх. 28 лютого 2018 року] : [англ.] // NASA. Scientific Visualization Studio. — 2014. — 17 November. — Дата звернення: 28 лютого 2018 року. — анімація річного циклу концентрації вуглекислого газу в атмосфері Землі; відео на сайті YouTube
диоксида углерода | Определение, формула, применение и факты
Двуокись углерода , (CO 2 ), бесцветный газ со слабым резким запахом и кислым вкусом. Это один из наиболее важных парниковых газов, связанных с глобальным потеплением, но он является второстепенным компонентом атмосферы Земли (примерно 3 объема на 10000), образуется при сгорании углеродсодержащих материалов, при ферментации и дыхании животных и используется растениями при фотосинтезе углеводов.Присутствие газа в атмосфере удерживает часть получаемой Землей лучистой энергии от возврата в космос, вызывая так называемый парниковый эффект. В промышленности он восстанавливается для множества различных применений из дымовых газов, как побочный продукт при получении водорода для синтеза аммиака, из печей для обжига извести и других источников.
фотосинтез Схема фотосинтеза, показывающая, как вода, свет и углекислый газ поглощаются растением с образованием кислорода, сахара и других углекислых газов. Британская энциклопедия, Inc.Британская викторина
Ветер и воздух: факт или вымысел?
Аэрозоли – это мелкие частицы.
Углекислый газ был признан в начале 17 века отличным от других газом бельгийским химиком Яном Баптистой ван Гельмонтом, который обнаружил, что он является продуктом брожения и сгорания.Он разжижается при сжатии до 75 кг на квадратный сантиметр (1071 фунт на квадратный дюйм) при 31 ° C (87,4 ° F) или до 16–24 кг на квадратный см (230–345 фунтов на квадратный дюйм) при температуре от –23 до – 12 ° C (от -10 до 10 ° F). К середине 20-го века большая часть углекислого газа продавалась в жидком виде. Если жидкости позволяют расшириться до атмосферного давления, она охлаждается и частично замерзает до снежного твердого вещества, называемого сухим льдом, которое сублимируется (переходит непосредственно в пар без таяния) при -78,5 ° C (-109,3 ° F) при нормальном давлении. Атмосфера.
При обычных температурах углекислый газ практически не реагирует; выше 1700 ° C (3100 ° F) он частично разлагается на окись углерода и кислород. Водород или углерод также преобразуют его в окись углерода при высоких температурах. Аммиак реагирует с диоксидом углерода под давлением с образованием карбамата аммония, затем мочевины, важного компонента удобрений и пластмасс. Двуокись углерода слабо растворяется в воде (1,79 объема на объем при 0 ° C и атмосферном давлении, большие количества при более высоком давлении), образуя слабокислый раствор.Этот раствор содержит двухосновную кислоту, называемую угольной кислотой (H 2 CO 3 ).
Двуокись углерода используется в качестве хладагента, в огнетушителях, для надувания спасательных плотов и спасательных жилетов, взрыва угля, вспенивания резины и пластмасс, стимулирования роста растений в теплицах, иммобилизации животных перед забоем и в газированных напитках.
Britannica Premium: удовлетворение растущих потребностей искателей знаний. Получите 30% подписки сегодня. Подпишись сейчасГорящий магний продолжает гореть в двуокиси углерода, но этот газ не поддерживает горение большинства материалов.Длительное воздействие на людей 5-процентной концентрации углекислого газа может привести к потере сознания и смерти.
.Двуокись углерода
2
«Лакмусовая бумага для CO2:» Ученые разрабатывают бумажные датчики для углекислого газа
2 июня 2020 – Новый датчик для определения углекислого газа может быть изготовлен на простом листе бумаги, согласно …
Удаление «темной стороны» искусственных листьев
31 июля 2019 г. – Хотя искусственные листья многообещающи как способ вывести из атмосферы углекислый газ – мощный парниковый газ, у искусственных листьев есть «темная сторона», на которую не обращали внимания…
Химия для устойчивого развития планеты
6 марта 2018 г. – Химики разработали высокоселективный катализатор, способный восстанавливать двуокись углерода до окиси углерода. Окись углерода впоследствии может быть использована для разработки полезных …
Новый метод преобразования двуокиси углерода в метан при низких температурах
27 февраля 2020 г. – Ученые разработали новый метод преобразования двуокиси углерода в метан с помощью электрического поля при низких температурах.По сравнению с предыдущими методами, этот новый метод может производить любое количество метана …
CO превращается в CO2 с помощью одного металлического атома
5 марта 2018 г. – Исследователи впервые продемонстрировали, что отдельный атом металла может действовать как катализатор при превращении окиси углерода в двуокись углерода, химической реакции, которая обычно используется в …
Первая полностью перезаряжаемая углекислотная батарея с углеродным нейтралитетом
Сен.26, 2019 – Исследователи первыми показали, что литиево-углекислые батареи могут быть разработаны для работы на полностью перезаряжаемой основе, и они успешно протестировали литий-углекислотные батареи …
Перемещение искусственных листьев из лаборатории в воздух
12 февраля 2019 г. – Исследователи предложили дизайнерское решение, позволяющее переносить искусственные листья из лаборатории в окружающую среду. Их улучшенный лист, который будет использовать углекислый газ – мощный парниковый газ…
Дождь важен для воздействия углекислого газа на луга
6 марта 2019 г. – Биомасса растительности на пастбищах увеличивается в ответ на повышение уровня углекислого газа, но меньше, чем ожидалось. Растительность на пастбищах с влажным весенним сезоном имеет наибольшую …
Превращение двуокиси углерода в топливо и полезные химические вещества
27 ноября 2017 г. – Превращение загрязнения в топливо: новый метод может быть использован для преобразования парниковых газов в полезное топливо и химические вещества прямо на электростанции…
Производство графена из диоксида углерода
8 июля 2019 г. – Широкой публике известно химическое соединение двуокиси углерода как парникового газа в атмосфере из-за его эффекта глобального потепления. Однако диоксид углерода также может быть полезным сырьем …
.
Молекулярная масса диоксида углерода
Молярная масса CO2 = 44,0095 г / моль
Перевести граммы диоксида углерода в моль или моль диоксида углерода в граммы
Расчет молекулярной массы:
12.0107 + 15.9994 * 2
| Элемент | Условное обозначение | Атомная масса | Количество атомов | Массовый процент |
| Углерод | С | 12.0107 | 1 | 27,291% |
| Кислород | O | 15.9994 | 2 | 72,709% |
Обратите внимание, что все формулы чувствительны к регистру.
Вы хотели найти молекулярную массу одной из этих похожих формул?
CO2
Co2
В химии вес формулы – это величина, вычисляемая путем умножения атомного веса (в единицах атомной массы) каждого элемента в химической формуле на количество атомов этого элемента, присутствующего в формуле, с последующим сложением всех этих продуктов вместе.
Используя химическую формулу соединения и периодическую таблицу элементов, мы можем сложить атомные веса и вычислить молекулярную массу вещества.
Если формула, используемая при вычислении молярной массы, является молекулярной формулой, вычисленная формула веса является молекулярной массой. Весовой процент любого атома или группы атомов в соединении может быть вычислен путем деления общего веса атома (или группы атомов) в формуле на вес формулы и умножения на 100.
Определение молярной массы начинается с единиц граммов на моль (г / моль). При расчете молекулярной массы химического соединения он говорит нам, сколько граммов содержится в одном моль этого вещества. Вес формулы – это просто вес в атомных единицах массы всех атомов в данной формуле.
Формула веса особенно полезна при определении относительного веса реагентов и продуктов в химической реакции. Эти относительные веса, вычисленные по химическому уравнению, иногда называют весами по уравнениям.
Часто на этом сайте просят перевести граммы в моль. Чтобы выполнить этот расчет, вы должны знать, какое вещество вы пытаетесь преобразовать. Причина в том, что на конверсию влияет молярная масса вещества. Этот сайт объясняет, как найти молярную массу.
Атомные веса, используемые на этом сайте, получены от NIST, Национального института стандартов и технологий. Мы используем самые распространенные изотопы. Вот как рассчитать молярную массу (среднюю молекулярную массу), которая основана на изотропно взвешенных средних.Это не то же самое, что молекулярная масса, которая представляет собой массу одной молекулы четко определенных изотопов. Для объемных стехиометрических расчетов мы обычно определяем молярную массу, которую также можно назвать стандартной атомной массой или средней атомной массой.
.Перевести граммы диоксида углерода в моль
›› Перевести граммы диоксида углерода в
мольПожалуйста, включите Javascript использовать конвертер величин
›› Дополнительная информация в конвертере величин
Сколько граммов диоксида углерода в 1 моль?
Ответ 44.0095.
Мы предполагаем, что вы конвертируете граммов диоксида углерода в моль .
Вы можете просмотреть более подробную информацию о каждой единице измерения:
молекулярная масса диоксида углерода или
моль
Молекулярная формула диоксида углерода – CO2.
Основной единицей СИ для количества вещества является моль.
1 грамм диоксида углерода равен 0,022722366761722 моля.
Обратите внимание, что могут возникнуть ошибки округления, поэтому всегда проверяйте результаты.
Используйте эту страницу, чтобы узнать, как переводить между граммами диоксида углерода и молями.
Введите свои числа в форму для преобразования единиц!
›› Похожие химические формулы
Обратите внимание, что все формулы чувствительны к регистру.
Вы хотели преобразовать одну из этих похожих формул?
граммов CO2 на моль
граммов Co2 на моль
›› График перевода граммов диоксида углерода в
моль1 грамм углекислого газа на моль = 0.02272 моль
10 граммов диоксида углерода на моль = 0,22722 моль
20 граммов диоксида углерода на моль = 0,45445 моль
30 граммов диоксида углерода на моль = 0,68167 моль
40 граммов диоксида углерода на моль = 0,90889 моль
50 граммов диоксида углерода на моль = 1,13612 моль
100 граммов диоксида углерода на моль = 2,27224 моль
200 граммов диоксида углерода на моль = 4,54447 моль
›› Хотите другие единицы?
Вы можете выполнить обратное преобразование единиц измерения из моль диоксида углерода в граммы, или введите другие единицы для преобразования ниже:
›› Общее количество преобразований веществ
граммов диоксида углерода на микромоль
граммов диоксида углерода на молекулу
граммов диоксида углерода на наномоль
граммов диоксида углерода на атом
граммов диоксида углерода на пикомоль
граммов диоксида углерода на киломоль
граммов диоксида углерода на сантимоль
граммов диоксида углерода на децимоль
граммов диоксида углерода на децимоль диоксид углерода в миллимоль
›› Подробная информация о расчетах молекулярной массы
В химии вес формулы – это величина, вычисляемая путем умножения атомного веса (в единицах атомной массы) каждого элемента в химической формуле на количество атомов этого элемента, присутствующего в формуле, с последующим сложением всех этих продуктов вместе.
Если формула, используемая при расчете молярной массы, является молекулярной формулой, вычисленная формула веса является молекулярной массой. Весовой процент любого атома или группы атомов в соединении можно вычислить, разделив общую массу атома (или группы атомов) в формуле на вес формулы и умножив на 100.
Часто на этом сайте просят перевести граммы в моль. Чтобы выполнить этот расчет, вы должны знать, какое вещество вы пытаетесь преобразовать.Причина в том, что на конверсию влияет молярная масса вещества. Этот сайт объясняет, как найти молярную массу.
Формула веса особенно полезна при определении относительного веса реагентов и продуктов в химической реакции. Эти относительные веса, вычисленные по химическому уравнению, иногда называют весами по уравнениям.
Определение молярной массы начинается с единиц граммов на моль (г / моль). При расчете молекулярной массы химического соединения он говорит нам, сколько граммов содержится в одном моль этого вещества.Вес формулы – это просто вес в атомных единицах массы всех атомов в данной формуле.
Используя химическую формулу соединения и периодическую таблицу элементов, мы можем сложить атомные веса и вычислить молекулярную массу вещества.
Атомные веса, используемые на этом сайте, получены от NIST, Национального института стандартов и технологий. Мы используем самые распространенные изотопы. Вот как рассчитать молярную массу (среднюю молекулярную массу), которая основана на изотропно взвешенных средних.Это не то же самое, что молекулярная масса, которая представляет собой массу одной молекулы четко определенных изотопов. Для объемных стехиометрических расчетов мы обычно определяем молярную массу, которую также можно назвать стандартной атомной массой или средней атомной массой.
›› Метрические преобразования и др.
ConvertUnits.com предоставляет онлайн калькулятор преобразования для всех типов единиц измерения. Вы также можете найти метрические таблицы преобразования для единиц СИ. в виде английских единиц, валюты и других данных.Введите единицу символы, сокращения или полные названия единиц длины, площадь, масса, давление и другие типы. Примеры включают мм, дюйм, 100 кг, жидкая унция США, 6 футов 3 дюйма, 10 стоун 4, кубический см, метры в квадрате, граммы, моль, футы в секунду и многое другое!
.
