Газ аргон формула: Аргон – это газ: плотность, формула, масса в баллоне, применение в сварке
alexxlab | 20.03.2023 | 0 | Разное
Цены и новости на рынке химии
Новости и события
Химический способ предсказывать упаковку молекул ускорит процесс создания лекарств
используют сверхкритические флюиды — вещества, которые представляют собой нечто среднее между жидкостью и газом. В такое состояние можно при определенных значениях температуры и давления привести, например, обычный углекислый газ. Он предпочтителен для измельчения…
Российские ученые проводят исследования по улучшению катализаторов для нейтрализации аммиака
;полимерови т.д.
Однако этот газ токсичен для окружающей среды…
Япония будет продвигать инвестиции в газ, СПГ, водород и аммиак
Япония, во время председательства страны на саммите G7 в конце этого года, планирует подчеркнуть важность инвестиций в природный газ, сжиженный природный газ, а также в более чистые виды топлива, такие как водород и аммиак.
Такеши Сода…
В американском штате Огайо, где сошел с рельсов грузовой состав с химикатами, начали контролируемый сброс ядовитых паров
избежать выброса в воздух фосгена. Это высокотоксичный газ, в годы Первой мировой его использовали как химическое оружие. Людям из районов рядом с железной дорогой приказали в обязательном порядке срочно покинуть дома. Власти отчитались, что оповещены все жители…
Это высокотоксичный газ, в годы Первой мировой его использовали как химическое оружие. Людям из районов рядом с железной дорогой приказали в обязательном порядке срочно покинуть дома. Власти отчитались, что оповещены все жители…
Нацпроект улучшит работу химического завода «Формула-ДВ» в Хабаровске
Руководство предприятия «Формула-ДВ» в Хабаровске, занимающегося производством технических, пищевых и медицинских газов, намерено достичь роста производительности труда сотрудников химзавода минимум на 5% ежегодно, начиная с 2023 года. Менеджмент…
Объемы добычи нефти и газа в 2022 г.
По итогам 2022 г. топливно-энергетический сектор России демонстирует умеренный рост по объемам добычи нефти обезвоженной. При этом значительно сократились объемы добычи газа горючего природного, в то же время показатели по объемам…
Информация
Аргон рпк
Химический способ предсказывать упаковку молекул ускорит процесс создания лекарств
Российские ученые проводят исследования по улучшению катализаторов для нейтрализации аммиака
Япония будет продвигать инвестиции в газ, СПГ, водород и аммиак
Сварка аргоном видеоурок
Химический способ предсказывать упаковку молекул ускорит процесс создания лекарств
Российские ученые проводят исследования по улучшению катализаторов для нейтрализации аммиака
Япония будет продвигать инвестиции в газ, СПГ, водород и аммиак
Каталог организаций и предприятий
Прима-Газ
Компания «Прима-Газ» занимается производством и снабжением технических, пищевых и медицинских газов (азот, аргон, ацетилен, водород, газовые смеси, гелий, кислород, пропан, углекислота) предприятий, частных предпринимателей и физических лиц.
АРГОН-СЕРВИС
…
Продюсерский центр Формула 21
…
Формула строительства
…
Мост (ООО ТД Формула вкуса)
…
АРГОН
оказываем помощь на Кустанайской бирже, обеспечим Вас различными видами удобрений…
Предложения на покупку и продажу продукции
Продажа Нефтепродуктов, Нефти, Газа.
ООО «ПетроГаз Групп» реализует ГСМ в широком ассортименте. В наличии и под заказ. Можем купить для вас любой продукт на бирже СпбМТСБ + 300 р/тн к цене покупки. В наличии: ДТ сорт С, Омск 48 000 ру…
Нефтяная промышленность в России и СНГ, нефтяная биржа. ::
ООО «ПетроГаз Групп» реализует ГСМ в широком ассортименте. В наличии и под заказ. Можем купить для вас любой продукт на бирже СпбМТСБ + 300 р/тн к цене покупки. В наличии: ДТ сорт С, Омск 48 000 ру…
Продаем Перекись водорода 50
Перекись водорода 50%. Техническая
CAS: 7722-84-1
Прозрачная бесцветная жидкость
Формула H₂O₂
Упаковка: еврокуб 1150 кг.
Метанол технический марки А
Внешний вид: Бесцветная ядовитая жидкость, с характерным запахом алкоголя, контаминант. Метанол — это первый представитель гомологического ряда одноатомных спиртов. Химическая формула: Ch4OH. Синони…
Продаем нефтепродукты на экспорт, в другие страны. Поставщик не РФ.
Наша компания как МЕЖДУНАРОДНЫЙ поставщик с полными корпоративными полномочиями и ответственностью, предлагает на экспорт ниже перечисленные нефтепродукты, на условиях FOB, CIF: -D2 Gas oil., -EN59…
ЛИКОПОДИЙ – зрелые сухие споры плауна булавовидного.
ООО “НПК ЕРМАКХИМ” предлагает со склада Москвы : Ликоподий используется в литейном производстве при фасонном литье. При соприкосновении с жидким металлом ликоподий, покрывающий поверхность формы, вс…
Аргон, свойства атома, химические и физические свойства
Общие сведения:
| 100 | Общие сведения | |
| 101 | Название | Аргон |
| 102 | Прежнее название | |
| 103 | Латинское название | Argon |
| 104 | Английское название | Argon |
| 105 | Символ | Ar |
| 106 | Атомный номер (номер в таблице) | 18 |
| 107 | Тип | Неметалл |
| 108 | Группа | Инертный (благородный) газ |
| 109 | Открыт | Уильям Рамзай, Джон Уильям Стретт (лорд Рэлей), Великобритания, 1894 г. |
| 110 | Год открытия | 1894 г. |
| 111 | Внешний вид и пр. | Инертный газ без цвета, вкуса и запаха |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 1,292 % |
| 119 | Содержание в земной коре (по массе) | 0,00015 % |
| 120 | Содержание в морях и океанах (по массе) | 0,000045 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,02 % |
| 122 | Содержание в Солнце (по массе) | 0,007 % |
| 123 | Содержание в метеоритах (по массе) | |
| 124 | Содержание в организме человека (по массе) |
Область применения
Применение аргона в сварочной сфере за последние годы существенно расширилось. В основном, его используют для сложных и ответственных работ. Если для стандартных процедур соединения с обыкновенными металлами подходят и другие, менее дорогостоящие газы, то для сложно свариваемых изделий необходим только аргон. С его помощью можно сваривать алюминий, нержавеющую сталь различных марок, никель и прочие цветные металлы.
В основном, его используют для сложных и ответственных работ. Если для стандартных процедур соединения с обыкновенными металлами подходят и другие, менее дорогостоящие газы, то для сложно свариваемых изделий необходим только аргон. С его помощью можно сваривать алюминий, нержавеющую сталь различных марок, никель и прочие цветные металлы.
В строительной сфере, где нужно получить соединение максимально высокого качества, аргонная сварка является основной. Свою популярность газ получил благодаря минимальному количеству брака, который получается во время сваривания. Тонкие трубопроводы, химическая и пищевая промышленность, машиностроение и прочие места, в которых находит применение сварка аргоном. В частной сфере используется все достаточно редко, так как себестоимость процесса оказывается довольно высокой и зачастую неоправданно. Если в быту возникает необходимость в применении аргона, то чаще всего люди обращаются за услугами специалистов.
Свойства атома аргона:
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 39,948(1) а. е.м. (г/моль) е.м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 |
| 203 | Электронная оболочка | K2 L8 M8 N0 O0 P0 Q0 R0 |
| 204 | Радиус атома (вычисленный) | 71 пм |
| 205 | Эмпирический радиус атома | |
| 206 | Ковалентный радиус* | 106 пм |
| 207 | Радиус иона | 154 пм |
| 208 | Радиус Ван-дер-Ваальса | 188 пм |
| 209 | Электроны, Протоны, Нейтроны | 18 электронов, 18 протонов, 22 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 3 |
| 212 | Группа в периодической таблице | 18-ая группа (по старой классификации – главная подгруппа 8-ой группы) |
| 213 | Эмиссионный спектр излучения |
Атом и молекула аргона.
 Формула аргона. Строение аргона:
Формула аргона. Строение аргона:Аргон (лат. Argon, от др.-греч. ἀργός – «ленивый, медленный, неактивный») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Ar и атомным номером 18. Расположен в 18-й группе (по старой классификации — главной подгруппе восьмой группы), третьем периоде периодической системы.
Аргон самый лёгкий элемент периодической таблицы химических элементов Д. И. Менделеева из группы инертных (благородных) газов.
Аргон – химически инертный неметалл. Химически малоактивен.
Аргон обозначается символом Ar.
Как простое вещество аргон (химическая формула Ar) при нормальных условиях представляет собой одноатомный газ без цвета, вкуса и запаха.
Молекула аргона одноатомна.
Химическая формула аргона Ar.
Электронная конфигурация атома аргона 1s2 2s2 2p6 3s2 3p6. Потенциал ионизации (первый электрон) атома аргона равен 1520,57 кДж/моль (15,7596117(5) эВ).
Потенциал ионизации (первый электрон) атома аргона равен 1520,57 кДж/моль (15,7596117(5) эВ).
Строение атома аргона. Атом аргона состоит из положительно заряженного ядра (+18), вокруг которого по трем атомным оболочкам движутся 18 электронов. При этом 10 электронов находятся на внутреннем уровне, а 8 электронов – на внешнем. Поскольку аргон расположен в третьем периоде, оболочки всего три. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внешняя оболочка представлена s- и р-орбиталями. Внешний энергетический уровень атома аргона полностью завершен – 8 спаренных электронов. Поэтому аргон химически малоактивен. В свою очередь ядро атома аргона состоит из 18 протонов и 22 нейтронов. Аргон относится к элементам p-семейства.
Радиус атома аргона (вычисленный) составляет 71 пм.
Атомная масса атома аргона составляет 39,948(1) а. е. м.
Аргон – третий по содержанию после азота и кислорода компонент воздуха, его среднестатистическое содержание в атмосфере Земли составляет 0,934 % по объёму и 1,292 % по массе. Аргон – самый распространённый инертный газ в земной атмосфере.
Аргон, свойства атома, химические и физические свойства
Химические свойства аргона:
| 300 | Химические свойства | |
| 301 | Степени окисления | 0 |
| 302 | Валентность | 0 |
| 303 | Электроотрицательность | 4,3 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 1520,57 кДж/моль (15,7596117(5) эВ) |
| 305 | Электродный потенциал | 0 |
| 306 | Энергия сродства атома к электрону | -96(20) кДж/моль (-1,0(2) эВ) – предположительно |
Физические свойства аргона:
| 401 | Плотность* | 0,001784 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – газ), 1,3954 г/см3 (при температуре кипения -185,848 °C и иных стандартных условиях, состояние вещества – жидкость), 1,65 г/см3 (при -233 °C и иных стандартных условиях, состояние вещества – твердое тело) |
| 402 | Температура плавления* | -189,34 °C (83,81 K, -308,81 °F) |
| 403 | Температура кипения* | -185,848 °C (87,302 K, -302,526 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 1,18 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 6,53 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость* | 20,85 Дж/(K·моль) |
| 411 | Молярный объём | 22,392 см³/моль |
| 412 | Теплопроводность | 17,72·10-3 Вт/(м·К) (при стандартных условиях), 0,0164 Вт/(м·К) (при 300 K) |
| 413 | Коэффициент теплового расширения | |
| 414 | Коэффициент температуропроводности | |
| 415 | Критическая температура* | |
| 416 | Критическое давление* | |
| 417 | Критическая плотность | |
| 418 | Тройная точка | |
| 419 | Давление паров (мм. рт.ст.) рт.ст.) | |
| 420 | Давление паров (Па) | |
| 421 | Стандартная энтальпия образования ΔH | |
| 422 | Стандартная энергия Гиббса образования ΔG | |
| 423 | Стандартная энтропия вещества S | |
| 424 | Стандартная мольная теплоемкость Cp | |
| 425 | Энтальпия диссоциации ΔHдисс | |
| 426 | Диэлектрическая проницаемость | |
| 427 | Магнитный тип | |
| 428 | Точка Кюри | |
| 429 | Объемная магнитная восприимчивость | |
| 430 | Удельная магнитная восприимчивость | |
| 431 | Молярная магнитная восприимчивость | |
| 432 | Электрический тип | |
| 433 | Электропроводность в твердой фазе | |
| 434 | Удельное электрическое сопротивление | |
| 435 | Сверхпроводимость при температуре | |
| 436 | Критическое магнитное поле разрушения сверхпроводимости | |
| 437 | Запрещенная зона | |
| 438 | Концентрация носителей заряда | |
| 439 | Твёрдость по Моосу | |
| 440 | Твёрдость по Бринеллю | |
| 441 | Твёрдость по Виккерсу | |
| 442 | Скорость звука | |
| 443 | Поверхностное натяжение | |
| 444 | Динамическая вязкость газов и жидкостей | |
| 445 | Взрывоопасные концентрации смеси газа с воздухом, % объёмных | |
| 446 | Взрывоопасные концентрации смеси газа с кислородом, % объёмных | |
| 446 | Предел прочности на растяжение | |
| 447 | Предел текучести | |
| 448 | Предел удлинения | |
| 449 | Модуль Юнга | |
| 450 | Модуль сдвига | |
| 451 | Объемный модуль упругости | |
| 452 | Коэффициент Пуассона | |
| 453 | Коэффициент преломления |
Свойства аргона (таблица): температура, плотность, давление и пр.

Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Аргон |
| 102 | Прежнее название | |
| 103 | Латинское название | Argon |
| 104 | Английское название | Argon |
| 105 | Символ | Ar |
| 106 | Атомный номер (номер в таблице) | 18 |
| 107 | Тип | Неметалл |
| 108 | Группа | Инертный (благородный) газ |
| 109 | Открыт | Уильям Рамзай, Джон Уильям Стретт (лорд Рэлей), Великобритания, 1894 г. |
| 110 | Год открытия | 1894 г. |
| 111 | Внешний вид и пр. | Инертный газ без цвета, вкуса и запаха |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 1,292 % |
| 119 | Содержание в земной коре (по массе) | 0,00015 % |
| 120 | Содержание в морях и океанах (по массе) | 0,000045 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,02 % |
| 122 | Содержание в Солнце (по массе) | 0,007 % |
| 123 | Содержание в метеоритах (по массе) | |
| 124 | Содержание в организме человека (по массе) | |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 39,948(1) а. е. м. (г/моль) е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 |
| 203 | Электронная оболочка | K2 L8 M8 N0 O0 P0 Q0 R0 |
| 204 | Радиус атома (вычисленный) | 71 пм |
| 205 | Эмпирический радиус атома | |
| 206 | Ковалентный радиус* | 106 пм |
| 207 | Радиус иона (кристаллический) | |
| 208 | Радиус Ван-дер-Ваальса | 188 пм |
| 209 | Электроны, Протоны, Нейтроны | 18 электронов, 18 протонов, 22 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 3 |
| 212 | Группа в периодической таблице | 18-ая группа (по старой классификации – главная подгруппа 8-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | 0 |
| 302 | Валентность | 0 |
| 303 | Электроотрицательность | 4,3 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 1520,57 кДж/моль (15,7596117(5) эВ) |
| 305 | Электродный потенциал | 0 |
| 306 | Энергия сродства атома к электрону | -96(20) кДж/моль (-1,0(2) эВ) – предположительно |
| 400 | Физические свойства | |
| 401 | Плотность* | 0,001784 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – газ), 1,3954 г/см3 (при температуре кипения -185,848 °C и иных стандартных условиях, состояние вещества – жидкость), 1,65 г/см3 (при -233 °C и иных стандартных условиях, состояние вещества – твердое тело) |
| 402 | Температура плавления* | -189,34 °C (83,81 K, -308,81 °F) |
| 403 | Температура кипения* | -185,848 °C (87,302 K, -302,526 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 1,18 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 6,53 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость* | 20,85 Дж/(K·моль) |
| 411 | Молярный объём | 22,392 см³/моль |
| 412 | Теплопроводность | 17,72·10-3 Вт/(м·К) (при стандартных условиях), 0,0164 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая гранецентрированная |
| 513 | Параметры решётки | 5,260 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 85 К |
| 516 | Название пространственной группы симметрии | Fm_ 3m |
| 517 | Номер пространственной группы симметрии | 225 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-37-1 |
Примечание:
206* Ковалентный радиус аргона согласно [1] составляет 106±10 пм.
401* Плотность аргона согласно [3] и [4] [Россия] составляет 0,0017839 г/см3 (при 0 °C /20 °C и иных стандартных условиях, состояние вещества – газ).
402* Температура плавления аргона согласно [3] и [4] составляет -189,35 °C (83,8 K, -308,83 °F) и -189,6 °C (83,55 K, -309,28 °F) соответственно.
403* Температура кипения аргона согласно [3] и [4] составляет -185,85 °C (87,3 K, -302,53 °F) и -185,9 °C (87,25 K, -302,62 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) аргона согласно [3] и [4] составляет 7,05 кДж/моль и 1,19 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) аргона согласно [3] и [4] составляет 6,45 кДж/моль и 6,51 кДж/моль соответственно.
410* Молярная теплоемкость аргона [3] составляет 20,79 Дж/(K·моль).
Кристаллическая решётка аргона:
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая гранецентрированная |
| 513 | Параметры решётки | 5,260 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 85 К |
| 516 | Название пространственной группы симметрии | Fm_ 3m |
| 517 | Номер пространственной группы симметрии | 225 |
Х3860Е
Х3860Е Новые спецификации, подготовленные на 53-й сессии JECFA (1999 г. | |
СИНОНИМЫ | ИНН № 938 |
ОПРЕДЕЛЕНИЕ | |
Химические названия | Аргон |
К.А.С. номер | 7440-37-1 |
Химическая формула | Ар |
Вес формулы | 40,0 |
Анализ | Не менее 99,0% по объему |
ОПИСАНИЕ | Газ без цвета и запаха |
ФУНКЦИОНАЛЬНОЕ ИСПОЛЬЗОВАНИЕ | Упаковка газа |
ХАРАКТЕРИСТИКИ | |
ИДЕНТИФИКАЦИЯ | |
Испытание пламенем | Пламя горящей щепки гаснет, если ее вставить в вертикальную пробирку, наполненную аргоном |
ЧИСТОТА | |
Вода | Проходит тест |
Кислород, азот, водород | Не более 1,0% в сочетании |
Запах | Осторожно откройте клапан контейнера, чтобы создать умеренный поток газа. Не направлять струю газа в лицо, а отклонить часть струи в сторону носа: ощутимого запаха не различить |
ИСПЫТАНИЯ | |
ИСПЫТАНИЯ НА ЧИСТОТУ | |
Вода | Пропустите 24 000 мл пробы газа через подходящую водопоглощающую трубку длиной не менее 100 мм, предварительно промытую примерно 500 мл пробы и взвесив ее. Отрегулируйте поток так, чтобы для прохождения газа требовалось около 60 мин. Прибавка в массе поглотительной трубки не превышает 1,0 мг. |
Кислород, азот, водород | Определение методом газовой хроматографии в следующих условиях: Столбец: – материал: нержавеющая сталь – длина: 6 м – внутренний диаметр: 6 мм – упаковочный материал: соответствующие молекулярные сита, т.е. 5А Перевозчик: – газ: гелий (не менее 99,99 % (об/об)) – расход: 30 мл/мин Детектор: детектор теплопроводности Форсунка: петлевая форсунка Температура колонки: 50 Датчик температуры: 130 Эталонный газ (а): эталонные газы водород, кислород, азот Исследуемый газ (b) Процедура: Индивидуальный ввод эталонных газов (a). Отрегулируйте вводимые объемы и рабочие условия таким образом, чтобы анализатор был способен разделять и обнаруживать названные компоненты с чувствительностью 0,1 л/л или 10% от указанного максимального количества компонента, в зависимости от того, что больше. Введите исследуемый газ (b). На хроматограмме, полученной с исследуемым газом, суммарная площадь водорода, кислорода и азота не должна превышать 1,0 % от общего объема исследуемого газа. |
МЕТОД АНАЛИЗА | После определения общего содержания воды, водорода, кислорода и азота баланс состоит из аргона |
отклонений от поведения закона идеального газа:
отклонений от поведения закона идеального газа: Отклонения от закона идеального газа Поведение| Уравнение Ван-дер-Ваальса | Анализ констант Ван-дер-Ваальса |
Уравнение Ван-дер-Ваальса
Поведение реальных газов обычно согласуется с предсказаниями идеального газа
уравнение с точностью до 5% при нормальном
температуры и давления. При низких температурах или высоких давлениях реальные газы отклоняются
существенно отличается от поведения идеального газа. В 1873 году при поиске способа связать
поведения жидкостей и газов голландский физик Йоханнес ван дер Ваальс разработал
объяснение этих отклонений и уравнение, которое могло соответствовать поведению реальных
газов в гораздо более широком диапазоне давлений.
При низких температурах или высоких давлениях реальные газы отклоняются
существенно отличается от поведения идеального газа. В 1873 году при поиске способа связать
поведения жидкостей и газов голландский физик Йоханнес ван дер Ваальс разработал
объяснение этих отклонений и уравнение, которое могло соответствовать поведению реальных
газов в гораздо более широком диапазоне давлений.
Ван-дер-Ваальс понял, что два предположения кинетической молекулярной теории неверны. под вопросом. Кинетическая теория предполагает, что частицы газа занимают ничтожную долю всего объема газа. Также предполагается, что сила притяжения между газом молекул равна нулю.
Первое предположение работает при давлениях, близких к 1 атм. Но что-то происходит с
справедливость этого предположения при сжатии газа. Представьте на мгновение, что
атомы или молекулы газа были сгруппированы в одном углу цилиндра, как показано на рис.
рисунок ниже. При нормальном давлении объем, занимаемый этими частицами, равен
пренебрежимо малая доля от общего объема газа. Но при высоком давлении это
уже не правда. В результате реальные газы не так сжимаемы при высоких давлениях, как
идеальный газ. Следовательно, объем реального газа больше, чем ожидается от идеального газа.
уравнение при высоких давлениях.
Но при высоком давлении это
уже не правда. В результате реальные газы не так сжимаемы при высоких давлениях, как
идеальный газ. Следовательно, объем реального газа больше, чем ожидается от идеального газа.
уравнение при высоких давлениях.
Ван-дер-Ваальс предложил внести поправку на тот факт, что объем реального газа равен слишком большой при высоких давлениях на вычитая член из объема реального газа прежде чем мы подставим его в уравнение идеального газа. Поэтому он ввел константу
постоянная ( b ) в уравнение идеального газа, которое на самом деле было равно объему занимает моль частиц газа. Поскольку объем частиц газа зависит от число молей газа в сосуде, член, который вычитается из реального объем газа равен числу молей газа, умноженному на 9.0277 б .
P ( В – nb ) = нРТ
Когда давление относительно небольшое, а объем достаточно большой, nb срок слишком мал, чтобы иметь какое-либо значение в расчете.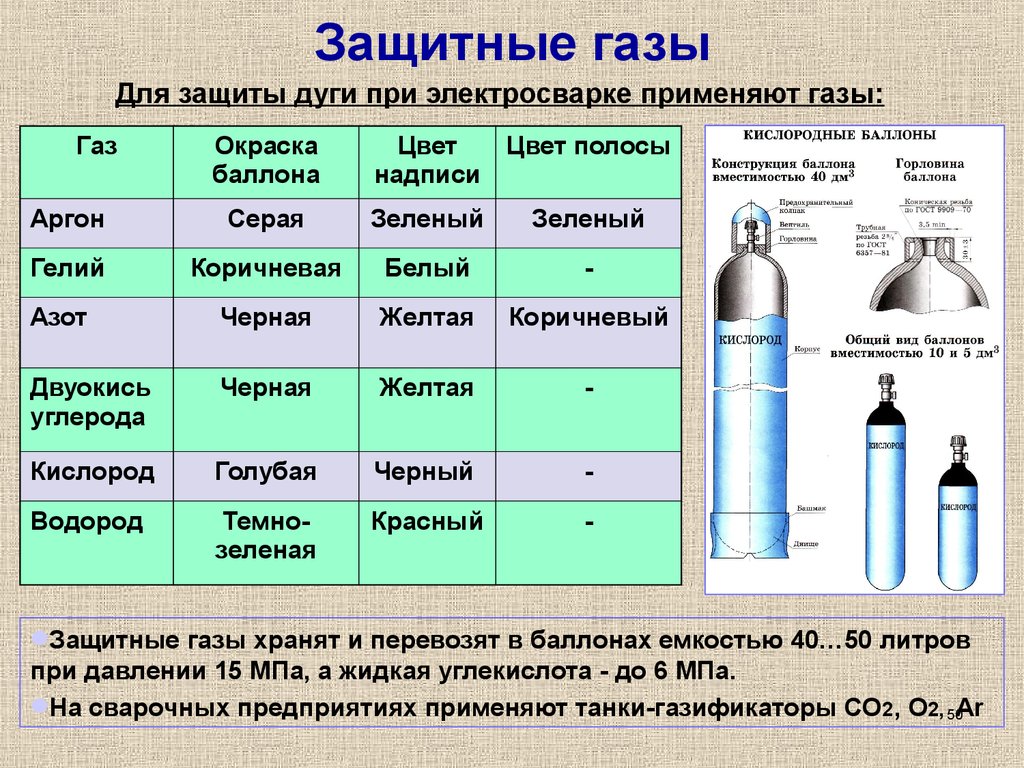 Но при высоких давлениях, когда
объем газа небольшой, термин нб исправляет тот факт, что объем
реального газа больше, чем ожидалось из уравнения идеального газа.
Но при высоких давлениях, когда
объем газа небольшой, термин нб исправляет тот факт, что объем
реального газа больше, чем ожидалось из уравнения идеального газа.
Предположение об отсутствии силы притяжения между частицами газа не может быть истинный. Если бы это было так, газы никогда не конденсировались бы в жидкости. На самом деле существует небольшой сила притяжения между молекулами газа, стремящаяся удерживать молекулы вместе. Этот сила притяжения имеет два следствия: (1) газы конденсируются с образованием жидкостей при низких температуры и (2) давление реального газа иногда меньше ожидаемого для идеальный газ.
Скорректировать тот факт, что давление реального газа меньше ожидаемого
уравнение идеального газа, Ван-дер-Ваальс добавил члена к давлению в этом
уравнение. Этот член содержит вторую константу ( a ) и имеет вид: an 2 / V 2 .
Таким образом, полное уравнение Ван-дер-Ваальса записывается следующим образом.
В этом уравнении смешанное благословение. Он обеспечивает гораздо лучшее соответствие поведение реального газа, чем уравнение идеального газа. Но это происходит за счет потери в общем. Уравнение идеального газа справедливо для любого газа, тогда как уравнение Ван-дер- Уравнение Ваальса содержит пару констант ( a и b ), которые отличаются от газ к газу.
Уравнение идеального газа предсказывает, что график зависимости PV от P для газа будет горизонтальной линией, потому что PV должно быть константой. Экспериментальные данные для PV по сравнению с P для газа H 2 и N 2 при 0C и CO 2 при 40°С приведены на рисунке ниже. Значения констант Ван-дер-Ваальса для этих и другие газы приведены в таблице ниже.
Константы Ван-дер-Ваальса для различных газов
| Соединение | а (L 2 -атм/моль 2 ) | б (л/моль) | ||
| Он | 0,03412 | 0,02370 | ||
| Не | 0,2107 | 0,01709 | ||
| Н 2 | 0,2444 | 0,02661 | ||
| Ар | 1,345 | 0,03219 | ||
| О 2 | 1,360 | 0,03803 | ||
| Н 2 | 1,390 | 0,03913 | ||
| СО | 1,485 | 0,03985 | ||
| Ч 4 | 2,253 | 0,04278 | ||
| СО 2 | 3,592 | 0,04267 | ||
| НХ 3 | 4. 170 170 | 0,03707 |
Величину отклонений от поведения идеального газа можно проиллюстрировать, сравнив результаты расчетов с использованием уравнения идеального газа и уравнения Ван-дер-Ваальса на 1,00 моль CO 2 при 0, o С в контейнерах разного объема. Начнем с контейнера на 22,4 л.
Согласно уравнению идеального газа, давление этого газа должно быть 1,00 атм.
Подстановка того, что мы знаем о CO 2 , в уравнение Ван-дер-Ваальса дает гораздо более сложное уравнение.
Однако это уравнение можно решить для давления газа.
P = 0,995 атм
При нормальных температурах и давлениях уравнения идеального газа и Ван-дер-Ваальса дают
по сути те же результаты.
Теперь повторим этот расчет, предполагая, что газ сжат так, что заполняет контейнер объемом всего 0,200 л. Согласно уравнению идеального газа, давление должно быть увеличено до 112 атм, чтобы сжать 1,00 моль CO 2 при 0С до объема 0,200 л.
Уравнение Ван-дер-Ваальса, однако, предсказывает, что давление должно только увеличьте до 52,6 атм для достижения тех же результатов.
Р = 52,6 атм
При увеличении давления CO 2 уравнение Ван-дер-Ваальса первоначально дает давления, которые на 90 277 меньше, чем в уравнении идеального газа на 90 280, как показано на рисунке. ниже из-за сильной силы притяжения между молекулами CO 2 .
График произведения давления на объем для образцов H 2 , N 2 ,
CO 2 газов в зависимости от давления этих газов. |
Давайте теперь сожмем газ еще больше, повышая давление до тех пор, пока объем газа всего 0,0500 л. Уравнение идеального газа предсказывает, что давление должно быть увеличить до 448 атм, чтобы сконденсировать 1,00 моль CO 2 при 0 o C до объема 0,0500 л.
Уравнение Ван-дер-Ваальса предсказывает, что давление должно достичь 1620 атм, чтобы добиться тех же результатов.
P = 1620 атм
Уравнение Ван-дер-Ваальса дает результаты, которые в раз больше , чем для идеального газа.
уравнение при очень высоких давлениях, как показано на рисунке выше, из-за объема
занято СО 2 молекул.
Анализ констант Ван-дер-Ваальса
Уравнение Ван-дер-Ваальса содержит две константы, a и b , которые равны
характерные свойства конкретного газа. Первая из этих констант корректирует
сила притяжения между частицами газа. Соединения, для которых сила притяжения
между частицами сильно имеют большие значения для и . Если подумать о том, что
случается, когда жидкость кипит, можно ожидать, что соединения с большими значениями и будет иметь более высокую температуру кипения. (Поскольку сила притяжения между частицами газа
становится сильнее, нам нужно перейти к более высоким температурам, прежде чем мы сможем разорвать связи
между молекулами жидкости с образованием газа.) Неудивительно, что
корреляция между значением константы a в уравнении Ван-дер-Ваальса и
температуры кипения ряда простых соединений, как показано на рисунке ниже.


 ) и опубликованные в FNP 52 Add 7 (1999 г.).
) и опубликованные в FNP 52 Add 7 (1999 г.).  описание в разделе ИСПЫТАНИЯ
описание в разделе ИСПЫТАНИЯ
