Газ аргон свойства: Аргон — свойства и сферы применения
alexxlab | 26.05.1987 | 0 | Разное
технические характеристики и применение. Значение слова «аргон» и его свойства
Содержание
- Об элементе
- Как добывают аргон
- История открытия
- Распространение в природе
- Свойства аргона (таблица): температура, плотность, давление и пр.
- Химические свойства
- Классификация аргона по сортам
- Аргон – это инертный газ с одноатомной структурой,
- Изотопы
- Физические свойства
- Химические свойства
- Производство аргона
- Заправка аргоном баллонов
- Доставка аргона и хранение
- Аргон в сварочном процессе
- Применение
- Применения аргона:
- Биологическая роль
- Физиологическое действие
- Периодическая система химических элементов Менделеева
- Где применяется аргон?
- Способы получения аргона
- Меры безопасности
Об элементе
Арго́н — элемент 18-й группы периодической таблицы химических элементов(по устаревшей классификации — элемент главной подгруппы VIII группы) третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 18. Обозначается символом.
И. Менделеева, с атомным номером 18. Обозначается символом.
Ar (лат. Argon). Третий по распространённости элемент в земной атмосфере (после азота и кислорода) — 0,93 % по объёму. Простое вещество аргон — инертный одноатомный газ без цвета, вкуса и запаха.
Как добывают аргон
Ar не поддается изменениям в процессе его использования и всегда возвращается в атмосферу. Поэтому ученые считают данный источник неисчерпаемым. Он добывается как сопутствующий продукт при разделении воздуха на кислород и азот посредством низкотемпературной ректификации.
Для реализации этого метода применяются специальные воздухоразделительные аппараты, состоящие из колонн высокого, низкого давления и конденсатора-испарителя. В результате процесса ректификации (разделения) получается аргон с небольшими примесями (3-10%) азота и кислорода. Чтобы произвести очистку, примеси убираются с помощью дополнительных химических реакций. Современные технологии позволяют достичь 99,99% чистоты данного продукта.
Представлены установки по производству данного химического элемента.
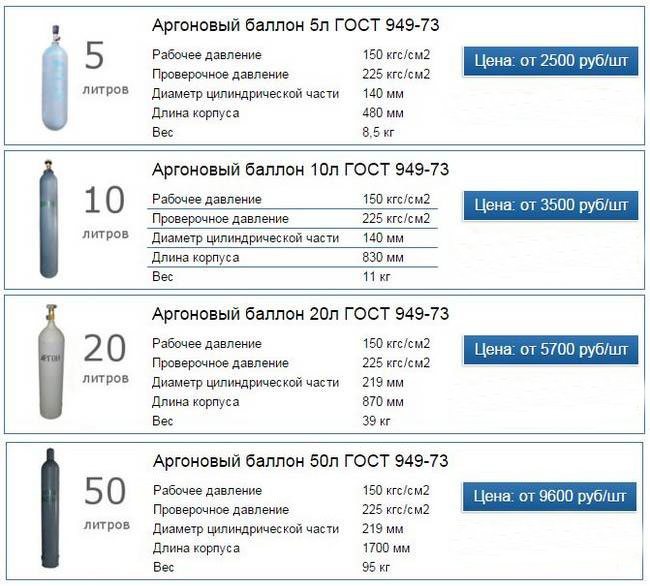
Хранится и транспортируется газ аргон в стальных баллонах (ГОСТ 949-73), которые имеют серый окрас с полосой и соответствующей надписью зеленого цвета. При этом процесс наполнения емкости должен полностью соответствовать технологическим нормам и правилам безопасности. Детальную информацию о специфике заполнения газовых баллонов можно прочитать в статье: баллоны со сварочной смесью – технические особенности и правила эксплуатации.
История открытия
История открытия аргона начинается в 1785 году, когда английский физик и химик Генри Кавендиш, изучая состав воздуха, решил установить, весь ли азот воздуха окисляется.
Дальнейшая история открытия аргона связана с именем Рэлея, который несколько лет посвятил исследованиям плотности газов, особенно азота.
У известного уже в то время английского химика Уильяма Рамзая также не было готового ответа, но он предложил Рэлею своё сотрудничество. Интуиция побудила Рамзая предположить, что азот воздуха содержит примеси неизвестного и более тяжёлого газа, а Дьюар обратил внимание Рэлея на описание старинных опытов Кавендиша (которые уже были к этому времени опубликованы).
Интуиция побудила Рамзая предположить, что азот воздуха содержит примеси неизвестного и более тяжёлого газа, а Дьюар обратил внимание Рэлея на описание старинных опытов Кавендиша (которые уже были к этому времени опубликованы).
Большую роль в изучении нового газа сыграл спектральный анализ. Спектр выделенного из воздуха газа с его характерными оранжевыми, синими и зелёными линиями резко отличался от спектров уже известных газов. Уильям Крукс, один из виднейших спектроскопистов того времени, насчитал в его спектре почти 200 линий. Уровень развития спектрального анализа на то время не дал возможности определить, одному или нескольким элементам принадлежал наблюдаемый спектр. Несколько лет спустя выяснилось, что Рамзай и Рэлей держали в своих руках не одного незнакомца, а нескольких — целую плеяду инертных газов.
7 августа 1894 года в Оксфорде, на собрании Британской ассоциации физиков, химиков и естествоиспытателей, было сделано сообщение об открытии нового элемента, который был назван аргоном..jpg)
Распространение в природе
Содержание аргона в мировой материи оценивается приблизительно в 0,02 % по массе.
Аргон (вместе с неоном) наблюдается на некоторых звёздах и в планетарных туманностях. В целом его в космосе больше, чем кальция, фосфора, хлора, в то время как на Земле существуют обратные отношения.
Аргон — третий по содержанию после азота и кислорода компонент воздуха, его среднестатистическое содержание в атмосфере Земли составляет 0,934 % по объёму и 1,288 % по массе, его запасы в атмосфере оцениваются в 4·1014 т.
Свойства аргона (таблица): температура, плотность, давление и пр.
| Название | Аргон |
| Латинское название | Argon |
| Английское название | Argon |
| Символ | Ar |
| Атомный номер (номер в таблице) | 18 |
| Тип | Неметалл |
| Группа | Инертный (благородный) газ |
| Открыт | Уильям Рамзай, Джон Уильям Стретт (лорд Рэлей), Великобритания, 1894 г. |
| Год открытия | 1894 г. |
| Внешний вид и пр. | Инертный газ без цвета, вкуса и запаха |
| Происхождение | Природный материал |
| Содержание в атмосфере и воздухе (по массе) | 1,292 % |
| Содержание в земной коре (по массе) | 0,00015 % |
| Содержание в морях и океанах (по массе) | 0,000045 % |
| Содержание во Вселенной и космосе (по массе) | 0,02 % |
| Содержание в Солнце (по массе) | 0,007 % |
| Атомная масса (молярная масса) | 39,948(1) а. е. м. (г/моль) |
| Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 |
| Электронная оболочка | K2 L8 M8 N0 O0 P0 Q0 R0 |
| Радиус атома (вычисленный) | 71 пм |
| Ковалентный радиус* | 106 пм |
| Радиус Ван-дер-Ваальса | 188 пм |
| Электроны, Протоны, Нейтроны | 18 электронов, 18 протонов, 22 нейтронов |
| Семейство (блок) | элемент p-семейства |
| Период в периодической таблице | 3 |
| Группа в периодической таблице | 18-ая группа (по старой классификации – главная подгруппа 8-ой группы) |
| Степени окисления | 0 |
| Валентность | 0 |
| Электроотрицательность | 4,3 (шкала Полинга) |
| Энергия ионизации (первый электрон) | 1520,57 кДж/моль (15,7596117(5) эВ) |
| Электродный потенциал | 0 |
| Энергия сродства атома к электрону | 0 кДж/моль |
| Плотность* | 0,001784 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – газ), 1,3954 г/см3 (при температуре кипения -185,848 °C и иных стандартных условиях, состояние вещества – жидкость),1,65 г/см3 (при -233 °C и иных стандартных условиях, состояние вещества – твердое тело) |
| Температура плавления* | -189,34 °C (83,81 K, -308,81 °F) |
| Температура кипения* | -185,848 °C (87,302 K, -302,526 °F) |
| Удельная теплота плавления (энтальпия плавления ΔHпл)* | 1,18 кДж/моль |
| Удельная теплота испарения (энтальпия кипения ΔHкип)* | 6,53 кДж/моль |
| Молярная теплоёмкость* | 20,85 Дж/(K·моль) |
| Молярный объём | 24,2 см³/моль |
| Теплопроводность | 17,72·10-3 Вт/(м·К) (при стандартных условиях), 0,0164 Вт/(м·К) (при 300 K) |
| Структура решётки | Кубическая гранецентрированная |
| Параметры решётки | 5,260 Å |
| Температура Дебая | 85 К |
| Название пространственной группы симметрии | Fm_ 3m |
| Номер пространственной группы симметрии | 225 |
| Номер CAS | 7440-37-1 |
Примечание:
206* Ковалентный радиус аргона согласно [1] составляет 106±10 пм.
401* Плотность аргона согласно [3] и [4] [Россия] составляет 0,0017839 г/см3 (при 0 °C /20 °C и иных стандартных условиях, состояние вещества – газ).
402* Температура плавления аргона согласно [3] и [4] составляет -189,35 °C (83,8 K, -308,83 °F) и -189,6 °C (83,55 K, -309,28 °F) соответственно.
403* Температура кипения аргона согласно [3] и [4] составляет -185,85 °C (87,3 K, -302,53 °F) и -185,9 °C (87,25 K, -302,62 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) аргона согласно [3] и [4] составляет 7,05 кДж/моль и 1,19 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) аргона согласно [3] и [4] составляет 6,45 кДж/моль и 6,51 кДж/моль соответственно.
410* Молярная теплоемкость аргона [3] составляет 20,79 Дж/(K·моль).
Химические свойства
Пока известны только 2 химических соединения аргона — гидрофторид аргона и CU(Ar)O, которые существуют при очень низких температурах. Кроме того, аргон образует эксимерные молекулы, то есть молекулы, у которых устойчивы возбуждённые электронные состояния и неустойчиво основное состояние.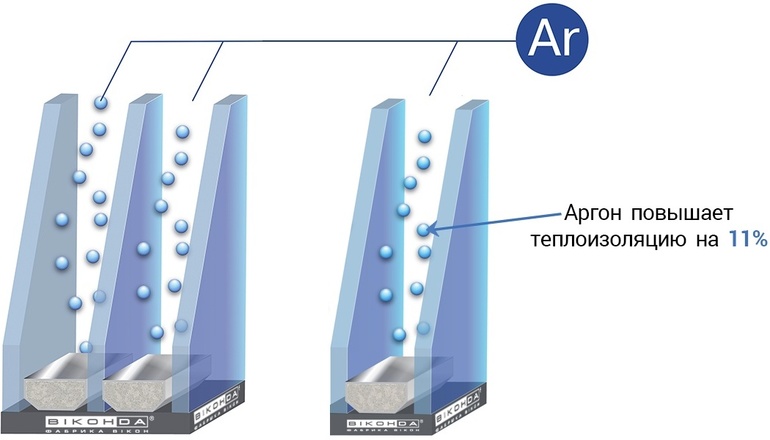 Есть основания считать, что исключительно нестойкое соединение Hg—Ar, образующееся в электрическом разряде, — это подлинно химическое (валентное) соединение. Не исключено, что будут получены другие валентные соединения аргона с фтором и кислородом, которые тоже должны быть крайне неустойчивыми. Например, при электрическом возбуждении смеси аргона и хлора возможна газофазная реакция с образованием ArCl. Также со многими веществами, между молекулами которых действуют водородные связи (водой, фенолом, гидрохиноном и другими), образует соединения включения (клатраты), где атом аргона, как своего рода «гость», находится в полости, образованной в кристаллической решётке молекулами вещества-хозяина, например, Ar·6h3O.
Есть основания считать, что исключительно нестойкое соединение Hg—Ar, образующееся в электрическом разряде, — это подлинно химическое (валентное) соединение. Не исключено, что будут получены другие валентные соединения аргона с фтором и кислородом, которые тоже должны быть крайне неустойчивыми. Например, при электрическом возбуждении смеси аргона и хлора возможна газофазная реакция с образованием ArCl. Также со многими веществами, между молекулами которых действуют водородные связи (водой, фенолом, гидрохиноном и другими), образует соединения включения (клатраты), где атом аргона, как своего рода «гость», находится в полости, образованной в кристаллической решётке молекулами вещества-хозяина, например, Ar·6h3O.
Классификация аргона по сортам
Аргон обеспечивает хорошую защиту сварочной ванны. В зависимости от назначения и содержания этот газ делится на три сорта. Высший сорт аргона (99,99% Ar) используется для сварки, химически активных металлов, циркония, титановых сплавов, молибдена, сплавов на их основе, ответственных конструкций из нержавеющих сталей. Первый сорт аргона (99,98% Ar) применяется для сварки неплавящимся электродом, магния, алюминия, магниевых и алюминиевых сплавов, менее чувствительных к примесям кислорода и азота. Второй сорт аргона (99,95% Ar) используется для сварки нержавеющих сталей, жаропрочных сплавов и чистого алюминия. Для сварки могут также использоваться смеси аргона с другими газами (кислородом, углекислым газом).
Первый сорт аргона (99,98% Ar) применяется для сварки неплавящимся электродом, магния, алюминия, магниевых и алюминиевых сплавов, менее чувствительных к примесям кислорода и азота. Второй сорт аргона (99,95% Ar) используется для сварки нержавеющих сталей, жаропрочных сплавов и чистого алюминия. Для сварки могут также использоваться смеси аргона с другими газами (кислородом, углекислым газом).
Аргон – это инертный газ с одноатомной структурой,
Который имеет температуру кипения в условиях нормального давления ниже, чем у кислорода. Средняя температура кипения аргона составляет около ста восьмидесяти градусов по Цельсию.
Изотопы
Аргон представлен в земной атмосфере тремя стабильными изотопами: 36Ar (0,337 %), 38Ar (0,063 %), 40Ar (99,600 %). Почти вся масса тяжёлого изотопа 40Ar возникла на Земле в результате распада радиоактивного изотопа калия 40K (содержание этого изотопа в изверженных породах в среднем составляет 3,1 г/т). Распад радиоактивного калия идёт по двум направлениям одновременно:
Первый процесс (обычный β-распад) протекает в 88 % случаев и ведет к возникновению стабильного изотопа кальция. Во втором процессе, где участвуют 12 % атомов, происходит электронный захват, в результате чего образуется тяжёлый изотоп аргона. Одна тонна калия, содержащегося в горных породах или водах, в течение года генерирует приблизительно 3100 атомов аргона. Таким образом, в минералах, содержащих калий, постепенно накапливается 40Ar, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии. Вероятные источники происхождения изотопов 36Ar и 38Ar — неустойчивые продукты спонтанного деления тяжёлых ядер, а также реакции захвата нейтронов и альфа-частиц ядрами лёгких элементов, содержащихся в урано-ториевых минералах. Подавляющая часть космического аргона состоит из изотопов 36Ar и 38Ar. Это вызвано тем обстоятельством, что калий распространён в космосе примерно в 50 000 раз меньше, чем аргон (на Земле калий преобладает над аргоном в 660 раз). Примечателен произведенный геохимиками подсчёт: вычтя из аргона земной атмосферы радиогенный 40Ar, они получили изотопный состав, очень близкий к составу космического аргона.
Во втором процессе, где участвуют 12 % атомов, происходит электронный захват, в результате чего образуется тяжёлый изотоп аргона. Одна тонна калия, содержащегося в горных породах или водах, в течение года генерирует приблизительно 3100 атомов аргона. Таким образом, в минералах, содержащих калий, постепенно накапливается 40Ar, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии. Вероятные источники происхождения изотопов 36Ar и 38Ar — неустойчивые продукты спонтанного деления тяжёлых ядер, а также реакции захвата нейтронов и альфа-частиц ядрами лёгких элементов, содержащихся в урано-ториевых минералах. Подавляющая часть космического аргона состоит из изотопов 36Ar и 38Ar. Это вызвано тем обстоятельством, что калий распространён в космосе примерно в 50 000 раз меньше, чем аргон (на Земле калий преобладает над аргоном в 660 раз). Примечателен произведенный геохимиками подсчёт: вычтя из аргона земной атмосферы радиогенный 40Ar, они получили изотопный состав, очень близкий к составу космического аргона.
Физические свойства
Аргон — одноатомный газ с температурой кипения (при нормальном давлении) −185,9 °C (немного ниже, чем у кислорода, но немного выше, чем у азота). В 100 мл воды при 20 °C растворяется 3,3 мл аргона, в некоторых органических растворителях аргон растворяется значительно лучше, чем в воде.
Химические свойства
Пока известны только 2 химических соединения аргона — гидрофторид аргона и CU(Ar)O, которые существуют при очень низких температурах. Кроме того, аргон образует эксимерные молекулы, то есть молекулы, у которых устойчивы возбужденные электронные состояния и неустойчиво основное состояние. Есть основания считать, что исключительно нестойкое соединение Hg—Ar, образующееся в электрическом разряде, — это подлинно химическое (валентное) соединение. Не исключено, что будут получены другие валентные соединения аргона с фтором и кислородом, которые тоже должны быть крайне неустойчивыми. Например, при электрическом возбуждении смеси аргона и хлора возможна газофазная реакция с образованием ArCl.
Также со многими веществами, между молекулами которых действуют водородные связи (водой, фенолом, гидрохиноном и другими), образует соединения включения (клатраты), где атом аргона, как своего рода «гость», находится в полости, образованной в кристаллической решётке молекулами вещества-хозяина.
Соединение CU(Ar)O получено из соединения урана с углеродом и кислородом CUO. Вероятно существование соединений со связями Ar-Si и Ar-C: FArSiF3 и FArCCH.
Производство аргона
Технический газ аргон получают в качестве побочного продукта производственного процесса, в ходе которого кислород отделяют от азота. Для этого применяются специальные камеры с использованием воздухоразделительных аппаратов с двукратной ректификацией. Аргон обладает большими летучими свойствами, чем кислород, и меньшими, чем азот. Поэтому в процессе разделения воздуха на кислород и азот аргон остается в средней фракции. Из средней точки верхней колонны аппарата аргон направляют в специальные камеры для сжатия и хранения.
При первичном отборе массовая доля аргона в отобранной фракции составляет ничтожно малые показатели, всего около пяти процентов. Это так называемый сырой аргон. После последующей конденсации и очистки удается получить чистый аргон с массовой долей содержания его во фракции около 99,99 процентов. Практикуется так же способ извлечения аргона в процессе утилизации отходов аммиачного производства. В этом случае аргон получают из азота, оставшегося после связывания его с молекулами водорода.
Заправка аргоном баллонов
Предлагаем технический аргон. Заправляем баллоны на любых площадках и в производственных цехах.
Гарантируем высокое качество – сварочный аргон имеет сертификат РОСС RU.AЯ02.Н40876 и изготавливается по ГОСТу 10157-79.
При хранении и перевозке газа используются баллоны из стали объемом 40, 10 и 5 л, вся тара соответствует ГОСТу 949-73.
Доставка аргона и хранение
Транспортировка и хранение аргона допускается только в специализированных емкостях, газовых баллонах. В большинстве случаев для этого применяются сорокалитровые газовые баллоны. Баллоны с аргоном окрашиваются в серый цвет. Поперек баллона наносится зеленая полоса и надпись аналогичного цвета. Стандартное давление в баллонах с аргоном составляет сто пятьдесят атмосфер. В ряде случаев для снижения затрат на перевозку, аргон транспортируется в сжиженном состоянии. При этом его закачивают в специализированные ёмкости и сосуды Дюара. Также можно использовать и специализированные цистерны. Аргон не является взрывоопасным веществом. Меры предосторожности при его транспортировке в основном сводятся к тому, чтобы обеспечить сохранность самого технического газа, так как он обладает большой летучестью.
В большинстве случаев для этого применяются сорокалитровые газовые баллоны. Баллоны с аргоном окрашиваются в серый цвет. Поперек баллона наносится зеленая полоса и надпись аналогичного цвета. Стандартное давление в баллонах с аргоном составляет сто пятьдесят атмосфер. В ряде случаев для снижения затрат на перевозку, аргон транспортируется в сжиженном состоянии. При этом его закачивают в специализированные ёмкости и сосуды Дюара. Также можно использовать и специализированные цистерны. Аргон не является взрывоопасным веществом. Меры предосторожности при его транспортировке в основном сводятся к тому, чтобы обеспечить сохранность самого технического газа, так как он обладает большой летучестью.
Аргон в сварочном процессе
В сварочных процессах аргон применяется при сварке ответственных узлов и агрегатов, которые нуждаются в повышенной защите от коррозийных процессов. Есть также такие сплавы и металлы, которые без применения аргона не могут быть обработаны при помощи сварочных операций. В частности, такие металлы, как тантал, ниобий, цирконий, гафний, вольфрам, уран, торий, титан, не могут подвергаться обработке без дополнительной защиты их при помощи инертного газа аргона.
В частности, такие металлы, как тантал, ниобий, цирконий, гафний, вольфрам, уран, торий, титан, не могут подвергаться обработке без дополнительной защиты их при помощи инертного газа аргона.
При сварке в аргоне не применяются различные флюсы и электродные покрытия. Сварочные швы после такой обработки получаются совершенно чистыми и ровными. Они не нуждаются в дополнительной обработке в виде зачистки от остатков сварочного материала и шлаков. В ходе работ струя аргона полностью удаляет не только воздух из места сварки, но и все остаточные продукты.
Применение
Применения аргона:
- в аргоновых лазерах
- в лампах накаливания и при заполнении внутреннего пространства стеклопакетов
- в качестве защитной среды при сварке (дуговой, лазерной, контактной и т. п.) как металлов, так и неметаллов
- в качестве плазмаобразователя в плазматронах при сварке и резке
- в пищевой промышленности аргон зарегистрирован в качестве пищевой добавки E938, в качестве пропеллента и упаковочного газа
- в качестве огнетушащего вещества в газовых установках пожаротушения
Биологическая роль
Аргон не играет никакой биологической роли.
Физиологическое действие
Инертные газы обладают физиологическим действием, которое проявляется в их наркотическом воздействии на организм. Наркотический эффект от вдыхания аргона проявляется только при барометрическом давлении свыше 0,2 МПа.. Содержание аргона в высоких концентрациях во вдыхаемом воздухе может вызвать головокружение, тошноту, рвоту, потерю сознания и смерть от асфиксии (в результате кислородного голодания).
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
Периодическая система элементов
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | —- | VIIIB | —- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 1 | 1 H Водород | 2 He Гелий | ||||||||||||||||
| 2 | 3 Li Литий | 4 Be Бериллий | 5 B Бор | 6 C Углерод | 7 N Азот | 8 O Кислород | 9 F Фтор | 10 Ne Неон | ||||||||||
| 3 | 11 Na Натрий | 12 Mg Магний | 13 Al Алюминий | 14 Si Кремний | 15 P Фосфор | 16 S Сера | 17 Cl Хлор | 18 Ar Аргон | ||||||||||
| 4 | 19 K Калий | Ca Кальций | 21 Sc Скандий | 22 Ti Титан | 23 V Ванадий | 24 Cr Хром | 25 Mn Марганец | 26 Fe Железо | 27 Co Кобальт | 28 Ni Никель | 29 Cu Медь | 30 Zn Цинк | 31 Ga Галлий | 32 Ge Германий | 33 As Мышьяк | 34 Se Селен | 35 Br Бром | 36 Kr Криптон |
| 5 | 37 Rb Рубидий | 38 Sr Стронций | 39 Y Иттрий | 40 Zr Цирконий | 41 Nb Ниобий | 42 Mo Молибден | (43) Tc Технеций | 44 Ru Рутений | 45 Rh Родий | 46 Pd Палладий | 47 Ag Серебро | 48 Cd Кадмий | 49 In Индий | 50 Sn Олово | 51 Sb Сурьма | 52 Te Теллур | 53 I Иод | 54 Xe Ксенон |
| 6 | 55 Cs Цезий | 56 Ba Барий | * | 72 Hf Гафний | 73 Ta Тантал | 74 W Вольфрам | 75 Рений | 76 Os Осмий | 77 Ir Иридий | 78 Pt Платина | 79 Au Золото | 80 Hg Ртуть | 81 Tl Таллий | 82 Pb Свинец | 83 Bi Висмут | (84) Po Полоний | (85) At Астат | 86 Rn Радон |
| 7 | 87 Fr Франций | 88 Ra Радий | ** | (104) Rf Резерфордий | (105) Db Дубний | (106) Sg Сиборгий | (107) Bh Борий | (108) Hs Хассий | (109) Mt Мейтнерий | (110) Ds Дармштадтий | (111) Rg Рентгений | (112) Cp Коперниций | (113) Uut Унунтрий | (114) Uuq Унунквадий | (115) Uup Унунпентий | (116) Uuh Унунгексий | (117) Uus Унунсептий | (118) Uuo Унуноктий |
| 8 | (119) Uue Унуненний | (120) Ubn Унбинилий | ||||||||||||||||
| Лантаноиды * | 57 La Лантан | 58 Ce Церий | 59 Pr Празеодим | 60 Nd Неодим | (61) Pm Прометий | 62 Sm Самарий | 63 Eu Европий | 64 Gd Гадолиний | 65 Tb Тербий | 66 Dy Диспрозий | 67 Ho Гольмй | 68 Er Эрбий | 69 Tm Тулий | 70 Yb Иттербий | 71 Lu Лютеций | |||
| Актиноиды ** | 89 Ac Актиний | 90 Th Торий | 91 Pa Протактиний | 92 U Уран | (93) Np Нептуний | (94) Pu Плутоний | (95) Am Америций | (96) Cm Кюрий | (97) Bk Берклий | (98) Cf Калифорний | (99) Es Эйнштейний | (100) Fm Фермий | (101) Md Менделевий | (102) No Нобелей | (103) Lr Лоуренсий | |||
Химические семейства элементов периодической таблицы
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
Где применяется аргон?
Аргон получил большое распространение в промышленности.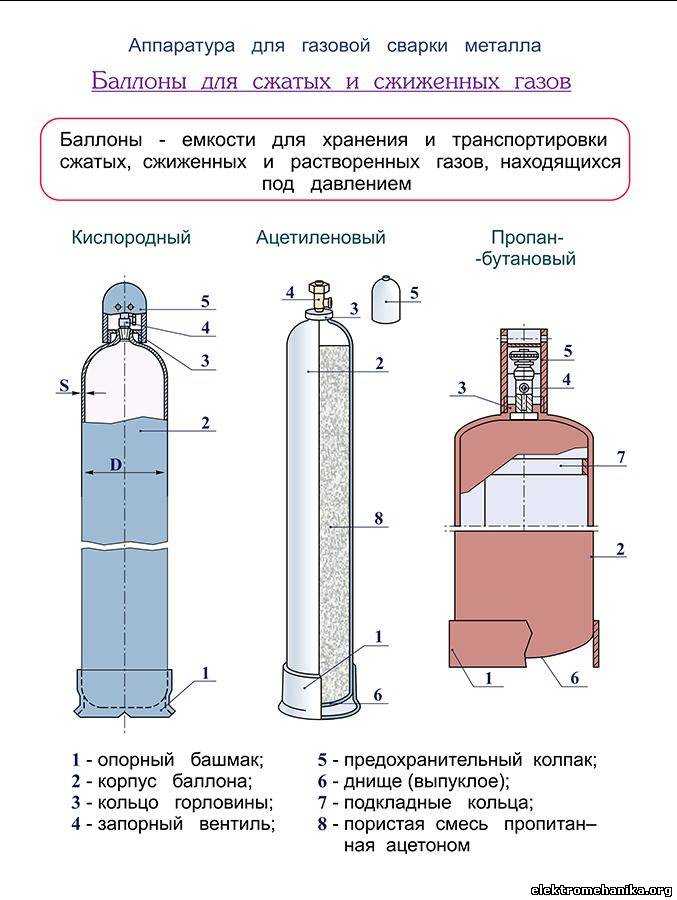 Инертные свойства этого газа особенно востребованы в различных производственных процессах, где необходимо вытеснить один из самых активных элементов – кислород. Использование аргона очень дёшево, в сравнении с другими инертными летучими веществами, поэтому газ незаменим в том случае, когда требуется защитная среда при сваривании металлов, а также вытеснение влаги и кислорода в ёмкостях, где хранятся пищевые продукты.
Инертные свойства этого газа особенно востребованы в различных производственных процессах, где необходимо вытеснить один из самых активных элементов – кислород. Использование аргона очень дёшево, в сравнении с другими инертными летучими веществами, поэтому газ незаменим в том случае, когда требуется защитная среда при сваривании металлов, а также вытеснение влаги и кислорода в ёмкостях, где хранятся пищевые продукты.
Наполнение колб ламп накаливания инертным газом, позволяет значительно увеличить ресурс работы осветительного прибора. Кроме повышенного срока использования такие элементы обладают большей яркостью. Используется инертный газ и при производстве люминесцентных ламп. Применение аргона позволяет облегчить запуск разряда электрической дуги, а также значительно увеличить ресурс электродов.
При изготовлении стеклопакетов, инертным газом заполняются полости между стёклами, что позволяет значительно улучшить теплоизоляционные свойства. Учитывая тот факт, что аргон является абсолютно прозрачным, использование его никак не ограниченно даже при изготовлении многослойных конструкций.
Инертный газ аргон используется также в установках плазменной резки металлов. Преимущество использования этого газа заключается в том, что для возникновения дуги не требуется слишком высокого напряжения, поэтому такие установки могут иметь очень простую конструкцию. При генерации плазмы с использованием аргона образуется минимальное количество вредных газообразных веществ во время выполнения резки, поэтому этот метод идеально подходит для ручных приборов.
Благодаря возможности образовывать плазму при относительно невысоком напряжении, этот благородный газ используется в медицине для проведения аргоновой коагуляции. Такой метод успешно используется для удаления новообразований, а также для остановки кровотечений.
Аргон применяется и в химической промышленности. Благодаря отсутствию взаимодействия с другими элементами этот газ используется для получения сверхчистых веществ, а также для их анализа. В металлургической промышленности благородный газ позволяет обрабатывать такие металлы, как: титан, тантал, ниобий, бериллий, цирконий и др. Кроме этого, газ используется для перемешивания расплавленных веществ и снижения окисления хрома при производстве хромированной стали.
Кроме этого, газ используется для перемешивания расплавленных веществ и снижения окисления хрома при производстве хромированной стали.
Способы получения аргона
Аргон является третьим по распространённости газом в земной атмосфере, поэтому наиболее логичным способом является добывание его из воздуха. Для этой цели используются специальные низкотемпературные ректификационные аппараты.
Процесс отделения инертного вещества осуществляется в такой последовательности:
- Воздух очищается от пыли и подвергается сжатию до жидкого состояния.
- Жидкий воздух, состоящий преимущественно из кислорода, азота и аргона подвергается ректификации.
- После отделения азота, из получившейся при сжатии жидкости, осуществляется доочистка кислородно-аргоновой смеси.
Температура кипения аргона в ректификационной установке составляет минус 185,3˚С. При этом, кислород кипит при температуре на 3 градуса выше, а азот – на 13˚С ниже этого показателя. По причине небольшого отличия в переходе из одного агрегатного состояния в другое, на первом этапе отделения аргона смесь содержит большое количество жидкого кислорода. На заключительной стадии получения аргона производится отделение благородного газа из кислородно-аргоновой смеси. Процесс доочистки, как правило, осуществляется с помощью электролитического водорода. В результате реакции в контактном аппарате с кислородом образуется водяной пар, который затем утилизируется через влагоотделитель.
На заключительной стадии получения аргона производится отделение благородного газа из кислородно-аргоновой смеси. Процесс доочистки, как правило, осуществляется с помощью электролитического водорода. В результате реакции в контактном аппарате с кислородом образуется водяной пар, который затем утилизируется через влагоотделитель.
Аргон может быть получен не только из атмосферного воздуха. При некоторых производственных процессах этот газ может являться сопутствующим продуктом. Например, при производстве аммиака, аргон является примесью азота и является совершенно ненужным элементом, поэтому полученный таким образом газ имеет очень низкую себестоимость, в сравнении с криогенным аргоном.
Меры безопасности
Применение технического газа аргона не требует специальных мер предосторожности. Этот газ обладает высокими экологическими свойствами. Это природный газ, который не претерпевает никаких технологических изменений. При этом аргон не отличается повышенной взрывоопасностью. Технология транспортировки и хранения газовых баллонов, наполненных аргоном, соответствует требованиям, применяемым для остальных технических газов.
Технология транспортировки и хранения газовых баллонов, наполненных аргоном, соответствует требованиям, применяемым для остальных технических газов.
Источники
- https://MetalListen.ru/raboty-s-metallami/argon-primenenie.html
- https://www.gaz-kom.ru/katalog/texnicheskie-gazyi/argon/
- http://himsnab-spb.ru/article/ps/ar/
- https://ballonis.ru/stati/gaz-argon-tehnicheskie-harakteristiki-i-primenenie
Аргон. Аспекты его применения в сварочном процессе технического газа аргона
Аргон – это инертный газ с одноатомной структурой, который имеет температуру кипения в условиях нормального давления ниже, чем у кислорода. Средняя температура кипения аргона составляет около ста восьмидесяти градусов по Цельсию. Аргон достаточно хорошо растворяется в воде, но лучше для этих целей использовать органические растворители.
Производство аргона не составляет особого труда и не требует значительных затрат. Он в большом количестве содержится в земной атмосфере. При этом следует учитывать, что в процессе использования аргон не претерпевает совершенно никаких структурных и химических изменений. Он возвращается в атмосферу в своем первоначальном виде. В настоящее время учеными открыты только два соединения, в которых участвует аргон. Оба эти соединения могут образовываться только под воздействием критически низких температур.
При этом следует учитывать, что в процессе использования аргон не претерпевает совершенно никаких структурных и химических изменений. Он возвращается в атмосферу в своем первоначальном виде. В настоящее время учеными открыты только два соединения, в которых участвует аргон. Оба эти соединения могут образовываться только под воздействием критически низких температур.
Технический газ аргон получают в качестве побочного продукта производственного процесса, в ходе которого кислород отделяют от азота. Для этого применяются специальные камеры с использованием воздухоразделительных аппаратов с двукратной ректификацией. Аргон обладает большими летучими свойствами, чем кислород, и меньшими, чем азот. Поэтому в процессе разделения воздуха на кислород и азот аргон остается в средней фракции. Из средней точки верхней колонны аппарата аргон направляют в специальные камеры для сжатия и хранения.
При первичном отборе массовая доля аргона в отобранной фракции составляет ничтожно малые показатели, всего около пяти процентов. Это так называемый сырой аргон. После последующей конденсации и очистки удается получить чистый аргон с массовой долей содержания его во фракции около 99,99 процентов. Практикуется так же способ извлечения аргона в процессе утилизации отходов аммиачного производства. В этом случае аргон получают из азота, оставшегося после связывания его с молекулами водорода.
Это так называемый сырой аргон. После последующей конденсации и очистки удается получить чистый аргон с массовой долей содержания его во фракции около 99,99 процентов. Практикуется так же способ извлечения аргона в процессе утилизации отходов аммиачного производства. В этом случае аргон получают из азота, оставшегося после связывания его с молекулами водорода.
Транспортировка и хранение аргона допускается только в специализированных емкостях, газовых баллонах. В большинстве случаев для этого применяются сорокалитровые газовые баллоны. Баллоны с аргоном окрашиваются в серый цвет. Поперек баллона наносится зеленая полоса и надпись аналогичного цвета. Стандартное давление в баллонах с аргоном составляет сто пятьдесят атмосфер. В ряде случаев для снижения затрат на перевозку, аргон транспортируется в сжиженном состоянии. При этом его закачивают в специализированные ёмкости и сосуды Дюара. Также можно использовать и специализированные цистерны. Аргон не является взрывоопасным веществом. Меры предосторожности при его транспортировке в основном сводятся к тому, чтобы обеспечить сохранность самого технического газа, так как он обладает большой летучестью.
Меры предосторожности при его транспортировке в основном сводятся к тому, чтобы обеспечить сохранность самого технического газа, так как он обладает большой летучестью.
Технический газ аргон широко используется в самых разнообразных сферах производства. Наибольшее применение он нашел в производстве металлов и их обработке. В металлургической промышленности аргон используется для получения высококачественных видов стали. Для этого аргон пропускают через расплавленную массу, предназначенную для проката стального листа. При этом аргон полностью освобождает сталь от присутствия в ней молекул кислорода, водорода и других газов, содержащихся в воздухе.
В сварочных процессах аргон применяется при сварке ответственных узлов и агрегатов, которые нуждаются в повышенной защите от коррозийных процессов. Есть также такие сплавы и металлы, которые без применения аргона не могут быть обработаны при помощи сварочных операций. В частности, такие металлы, как тантал, ниобий, цирконий, гафний, вольфрам, уран, торий, титан, не могут подвергаться обработке без дополнительной защиты их при помощи инертного газа аргона.
В настоящее время использование электрической дуги в аргонной среде дает колоссальные возможности для производства работ с самыми различными металлами и деталями из них. В частности, сварка в аргоне дает возможность нагрева металлических поверхностей до температуры выше шести градусов по Цельсию. Это дает уникальную возможность при помощи простейшего сварочного аппарата резать металлы самой различной толщины.
При сварке в аргоне не применяются различные флюсы и электродные покрытия. Сварочные швы после такой обработки получаются совершенно чистыми и ровными. Они не нуждаются в дополнительной обработке в виде зачистки от остатков сварочного материала и шлаков. В ходе работ струя аргона полностью удаляет не только воздух из места сварки, но и все остаточные продукты.
Применение технического газа аргона не требует специальных мер предосторожности. Этот газ обладает высокими экологическими свойствами. Это природный газ, который не претерпевает никаких технологических изменений. При этом аргон не отличается повышенной взрывоопасностью. Технология транспортировки и хранения газовых баллонов, наполненных аргоном, соответствует требованиям, применяемым для остальных технических газов.
При этом аргон не отличается повышенной взрывоопасностью. Технология транспортировки и хранения газовых баллонов, наполненных аргоном, соответствует требованиям, применяемым для остальных технических газов.
Химическая характеристика аргона. Аргон – это особенный элемент периодической системы
ОПРЕДЕЛЕНИЕ
Аргон – восемнадцатый элемент Периодической таблицы. Обозначение – Ar от латинского «argon». Расположен в третьем периоде, VIIIА группе. Относится к группе благородных (инертных) газов. Заряд ядра равен 18.
Самый распространенный в природе элемент VIIIA-группы. Содержание аргона в воздухе 0,932% (об.), 1,28% (масс).
Представляет собой бесцветный газ. Плохо растворяется в воде (растворимость понижается в присутствии сильных электролитов), лучше — в органических растворителях. Образует клатрат состава 8Ar×46Н 2 О. Не реагирует со всеми другими веществами (простыми и сложными).
Атомная и молекулярная масса аргона
ОПРЕДЕЛЕНИЕ
Относительной молекулярная масса вещества (M r) – это число, показывающее, во сколько раз масса данной молекулы больше 1/12 массы атома углерода, а относительная атомная масса элемента (A r) — во сколько раз средняя масса атомов химического элемента больше 1/12 массы атома углерода.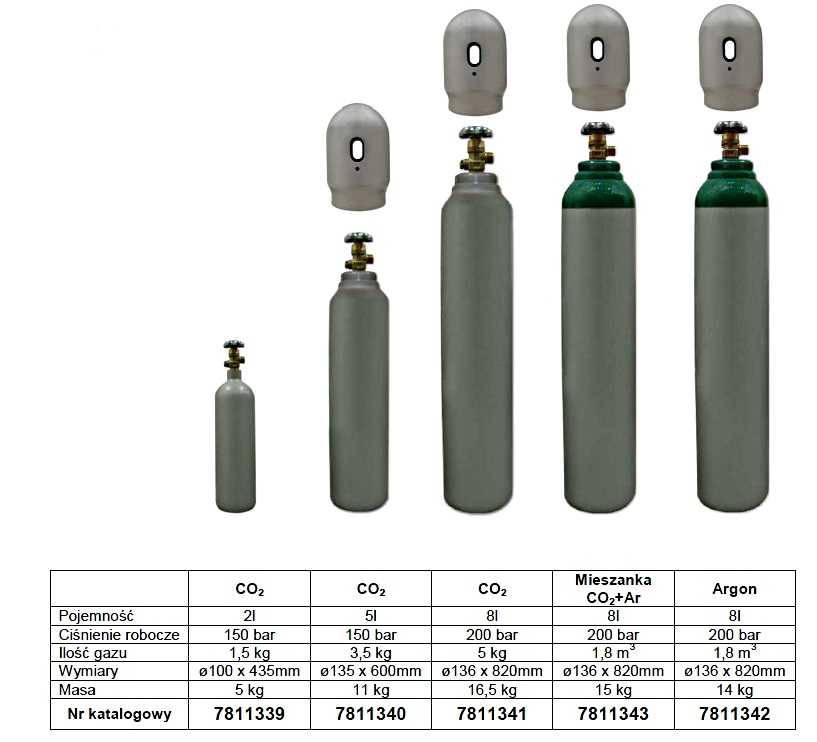
Поскольку в свободном состоянии аргон существует в виде одноатомных молекул Ar, значения его атомной и молекулярной масс совпадают. Они равны 39,948.
Изотопы аргона
Известно, что в природе аргон может находиться в виде трех стабильных изотопов 36 Ar (0,337%), 38 Ar (0,063%) и 40 Ar (99,6%). Их массовые числа равны 36, 38 и 40 соответственно. Ядро атома изотопа аргона 36 Ar содержит восемнадцать протонов и восемнадцать нейтронов, а изотопов 38 Ar и 40 Ar- такое же количество протонов, двадцать и двадцать два нейтронов/а соответственно.
Существуют искусственные изотопы аргона с массовыми числами от 32-х до 55-ти, среди которых наиболее стабильным является 39 Ar с периодом полураспада равным 269 лет.
Ионы аргона
Как гелий и неон при сильном возбуждении атомов аргон образует молекулярные ионы типа Ar 2 + .
Молекула и атом аргона
В свободном состоянии аргон существует в виде одноатомных молекул Ar.
Примеры решения задач
ПРИМЕР 1
АРГОН, Ar (лат. Argon * а. argon; н. Argon; ф. argon; и. argon), — химический элемент главной подгруппы VIII группы периодической системы , относится к инертным газам, атомный номер 18, атомная масса 39,948. Состоит из трёх стабильных изотопов, основной — 40 Ar (99,600%). Выделен из воздуха в 1894 английскими учёными Дж. Рэлеем и У. Рамзаем.
Argon * а. argon; н. Argon; ф. argon; и. argon), — химический элемент главной подгруппы VIII группы периодической системы , относится к инертным газам, атомный номер 18, атомная масса 39,948. Состоит из трёх стабильных изотопов, основной — 40 Ar (99,600%). Выделен из воздуха в 1894 английскими учёными Дж. Рэлеем и У. Рамзаем.
Аргон в природе
В природе аргон существует только в свободном виде. При обычных условиях аргон — газ без цвета, запаха и вкуса. Твёрдый аргон кристаллизуется в кубические . аргона 1,78 кг/м3, t плавления — 189,3°С, t кипения — 185,9°С, критическое давление 48 МПа, критическая температура — 122,44°С. Первый потенциал ионизации 15,69 эВ. Атомный радиус 0,188 нм (1,88Е).
Свойства аргона
Химические соединения не получены (известны лишь соединения включения). В 1 л дистиллированной воды при нормальных условиях растворяется 51,9 см 3 аргона. Образует кристаллогидраты типа Ar . 6Н 2 О. Весовой кларк в земной коре 4 . 10 -4 ; содержание в атмосфере 0,9325 объёмных % (6,5 . 10 16 кг), в изверженных породах 2,2 . 10 -5 см 3 /г, в океанической воде 0,336 см 3 /л. В мантии продуцировано 5,3. 10 19 кг 40 Ar, средняя скорость накопления 40 Ar в земной коре 2 .10 7 кг/год.
10 16 кг), в изверженных породах 2,2 . 10 -5 см 3 /г, в океанической воде 0,336 см 3 /л. В мантии продуцировано 5,3. 10 19 кг 40 Ar, средняя скорость накопления 40 Ar в земной коре 2 .10 7 кг/год.
Из минералов атомы аргона мигрируют по дислокациям в зоны нарушения кристаллической структуры и затем по микротрещинам и порам поступают в , нефтяные и газовые залежи. На измерении отношения содержаний 40 Ar/ 40 K в калийсодержащих минералах основан метод определения возраста геологических объектов. Аргоновым методом определяют возрасты изверженных (по слюдам, амфиболам), осадочных (по глауконитам, сильвинам), метаморфизованных пород, для которых также с известным приближением даётся возраст . Разработан активационный метод датирования, основанный на измерении отношения 40 Ar/ 39 Ar.
Получение и применение аргона
В промышленности аргон получают в процессе разделения воздуха при глубоком охлаждении. Возможно получение аргона из продувочных газов колонн синтеза аммиака. Отделение аргона от других инертных газов наиболее полно осуществляется газохроматографическим методом.
Аргон используется при термической обработке легко окисляющихся металлов. В защитной атмосфере аргона проводят сварку и резку редких и цветных металлов, плавку , и др., выращивают кристаллы полупроводниковых материалов. Радиоактивный изотоп (37 Ar) применяют для контроля вентиляционных систем.
В переводе с греческого «argon» означает «медленный» или «неактивный». Такое определение газ аргон получил благодаря своим инертным свойствам, позволяющим широко его использовать во многих промышленных и бытовых целях.
Химический элемент Ar
Ar – 18-й элемент периодической таблицы Менделеева, относящийся к благородным инертным газам. Данное вещество является третьим после N (азота) и O (кислорода) по содержанию в атмосфере Земли. В обычных условиях – бесцветен, не горюч, не ядовит, без вкуса и запаха.
Другие свойства газа аргона:
- атомная масса: 39,95;
- содержание в воздухе: 0,9% объема и 1,3% массы;
- плотность в нормальных условиях: 1,78 кг/м³;
- температура кипения: -186°С.

На рисунке название химического элемента и его свойства
Данный элемент был открыт Джоном Стреттом и Уильямом Рамзаем при исследовании состава воздуха. Несовпадение плотности при различных химических испытаниях натолкнуло ученых на мысль, что в атмосфере помимо азота и кислорода присутствует инертный тяжелый газ. В итоге в 1894 г. было сделано заявление об открытии химического элемента, доля которого в каждом кубометре воздуха составляет 15 г.
Как добывают аргон
Ar не поддается изменениям в процессе его использования и всегда возвращается в атмосферу. Поэтому ученые считают данный источник неисчерпаемым. Он добывается как сопутствующий продукт при разделении воздуха на кислород и азот посредством низкотемпературной ректификации.
Для реализации этого метода применяются специальные воздухоразделительные аппараты, состоящие из колонн высокого, низкого давления и конденсатора-испарителя. В результате процесса ректификации (разделения) получается аргон с небольшими примесями (3-10%) азота и кислорода. Чтобы произвести очистку, примеси убираются с помощью дополнительных химических реакций. Современные технологии позволяют достичь 99,99% чистоты данного продукта.
Чтобы произвести очистку, примеси убираются с помощью дополнительных химических реакций. Современные технологии позволяют достичь 99,99% чистоты данного продукта.
Представлены установки по производству данного химического элемента
Хранится и транспортируется газ аргон в стальных баллонах (ГОСТ 949-73), которые имеют серый окрас с полосой и соответствующей надписью зеленого цвета. При этом процесс наполнения емкости должен полностью соответствовать технологическим нормам и правилам безопасности. Детальную информацию о специфике заполнения газовых баллонов можно прочитать в статье: баллоны со сварочной смесью – технические особенности и правила эксплуатации .
Где применяется газ аргон
Данный элемент имеет достаточно большую сферу применения. Ниже приведены основные области его использования:
- заполнение внутренней полости ламп накаливания и стеклопакетов;
- вытеснение влаги и кислорода для долгого хранения пищевых продуктов;
- огнетушащее вещество в некоторых системах тушения пожара;
- защитная среда при сварочном процессе;
- плазмообразующий газ для плазменной сварки и резки.

В сварочном производстве он применяется как защитная среда в процессе сварки редких металлов (ниобия, титана, циркония) и их сплавов, легированный сталей разных марок, а также алюминиевых, магниевых и хромоникелевых сплавов. Для черных металлов, как правило, применяют смесь Ar с другими газами – гелием, кислородом, углекислотой и водородом.
Вид защитной среды при сварочном процессе, которую создает аргон
Меры предосторожности при эксплуатации
Данный химический элемент не представляет абсолютно никакой опасности для окружающей среды, но при большой концентрации оказывает удушающее воздействие на человека. Он нередко скапливается в районе пола в недостаточно проветриваемых помещениях, а при значительном уменьшении содержание кислорода может привести к потере сознания и даже смертельному исходу. Поэтому важно следить за концентрацией кислорода в закрытом помещении, которая не должна падать ниже 19%.
Жидкий Ar способен вызвать обморожение участков кожи и повредить слизистую оболочку глаз, поэтому в процессе работы важно использовать спецодежду и защитные очки. При работе в атмосфере этого газа с целью предотвращения удушения необходимо применять изолирующий кислородный прибор или шланговый противогаз.
При работе в атмосфере этого газа с целью предотвращения удушения необходимо применять изолирующий кислородный прибор или шланговый противогаз.
Все мы знаем, что аргон применяется для сварки разных металлов, но не каждый задумывался, о том, что представляет собой этот химический элемент. А между тем его история богата событиями. Что характерно, аргон – это исключительный экземпляр периодической таблицы Менделеева, который не имеет аналогов. Сам ученый удивлялся в свое время, как он вообще мог сюда попасть.
В атмосфере присутствует примерно 0,9 % этого газа. Как и азот, он имеет нейтральный характер без цвета и запаха. Для поддержания жизни он не подходит, но зато просто незаменим в некоторых областях человеческой деятельности.
Небольшой экскурс в историю
Впервые его обнаружил англичанин и физик по образованию Г. Кавендиш, который заметил присутствие в воздухе чего-то нового, стойкого к химическому воздействию. К сожалению, Кавендиш так и не узнал природу нового газа..png) Чуть более ста лет спустя это заметил и другой ученый – Джон Уильям Страт. Он пришел к выводу, что в азоте из воздуха есть какая-то примесь газа неизвестного происхождения, но аргон это или что-то еще, он пока не мог понять.
Чуть более ста лет спустя это заметил и другой ученый – Джон Уильям Страт. Он пришел к выводу, что в азоте из воздуха есть какая-то примесь газа неизвестного происхождения, но аргон это или что-то еще, он пока не мог понять.
При этом газ не вступал в реакцию с различными металлами, хлором, кислотами, щелочами. То есть с химической точки зрения носил инертный характер. Еще одной неожиданностью стало открытие – молекула нового газа включает в себя лишь один атом. А на тот момент подобный состав газов был еще неизвестен.
Публичное сообщение о новом газе привело в шок многих ученых со всего мира – как можно было проглядеть новый газ в воздухе на протяжении многих научных исследований и опытов?! Но в открытие поверили не все ученые, включая Менделеева. Судя по атомной массе нового газа (39,9), он должен расположиться между калием (39,1) и кальцием (40,1), но позиция уже была занята.
Как уже упоминалось, аргон – с богатой и детективной историей. На некоторое время он был забыт, но после открытия гелия новый газ признали официально. Было решено отвести для него отдельную нулевую позицию, расположенную в между галогенов и щелочных металлов.
Было решено отвести для него отдельную нулевую позицию, расположенную в между галогенов и щелочных металлов.
Свойства
Среди прочих инертных газов, которые входят в тяжелую группу, аргон считается самым легким. Его масса превышает вес воздуха в 1,38 раза. В жидкое состояние газ переходит при температуре -185,9 °С, а при -189,4 °С и нормальном давлении твердеет.
От гелия и неона аргон отличается тем, что способен растворяться в воде – при температуре 20 градусов в количестве 3,3 мл в ста граммах жидкости. Но в ряде органических растворов газ растворяется лучше. Воздействие электрического тока заставляет его светиться, благодаря чему он стал широко применяться в осветительном оборудовании.
Биологами обнаружено другое полезное свойство, которым обладает аргон. Это своего рода среда, где растение прекрасно себя чувствует, что доказано опытами. Так, находясь в атмосфере газа, посаженые семена риса, кукурузы, огурцов и ржи дали свои ростки. В другой атмосфере, где 98 % приходится на аргон и 2 % – на кислород, хорошо прорастает такая овощная культура, как морковь, салат и лук.
Что особенно характерно, содержание этого газа в земной коре намного больше, чем других элементов, находящихся в его группе. Его примерное содержание – 0,04 г на одну тонну. Это в 14 раз превышает количество гелия и в 57 раз – неона. Что касается окружающей нас Вселенной, его там еще больше, в особенности на разных звездах и в туманностях. По некоторым подсчетам, аргона на просторах космоса больше, чем хлора, фосфора, кальция или калия, которых полно на Земле.
Получение газа
Тот аргон в баллонах, в которых мы его чаще встречаем, является неисчерпаемым источником. К тому же он в любом случае возвращается в атмосферу в силу того, что при использовании не меняется в физическом или химическом плане. Исключением могут быть случаи расхода малого количества изотопов аргона на получение новых изотопов и элементов в ходе ядерных реакций.
В промышленности газ получают путем разделения воздуха на кислород и азот. В результате чего и рождается газ как побочный продукт. Для этого используется специальное промышленное оборудование двукратной ректификации с двумя колоннами высокого и низкого давления и промежуточным конденсатором-испарителем. Помимо этого, для получения аргона могут быть использованы отходы аммиачного производства.
Для этого используется специальное промышленное оборудование двукратной ректификации с двумя колоннами высокого и низкого давления и промежуточным конденсатором-испарителем. Помимо этого, для получения аргона могут быть использованы отходы аммиачного производства.
Область применения
Сфера применения аргона насчитывает несколько областей:
- пищевая промышленность;
- металлургия;
- научные исследования и опыты;
- сварочные работы;
- электроника;
- автомобильная промышленность.
Этот нейтральный газ находится внутри электрических лапочек, что замедляет испарение вольфрамовой спирали внутри. Благодаря этому свойству широко применяется основанный на данном газе сварочный аппарат. Аргон позволяет надежно соединять детали из алюминия и дюраля.
Широкое распространение газ получил при создании защитной и инертной атмосферы. Это обычно необходимо для термической обработки тех металлов, которые легко подвержены окислению.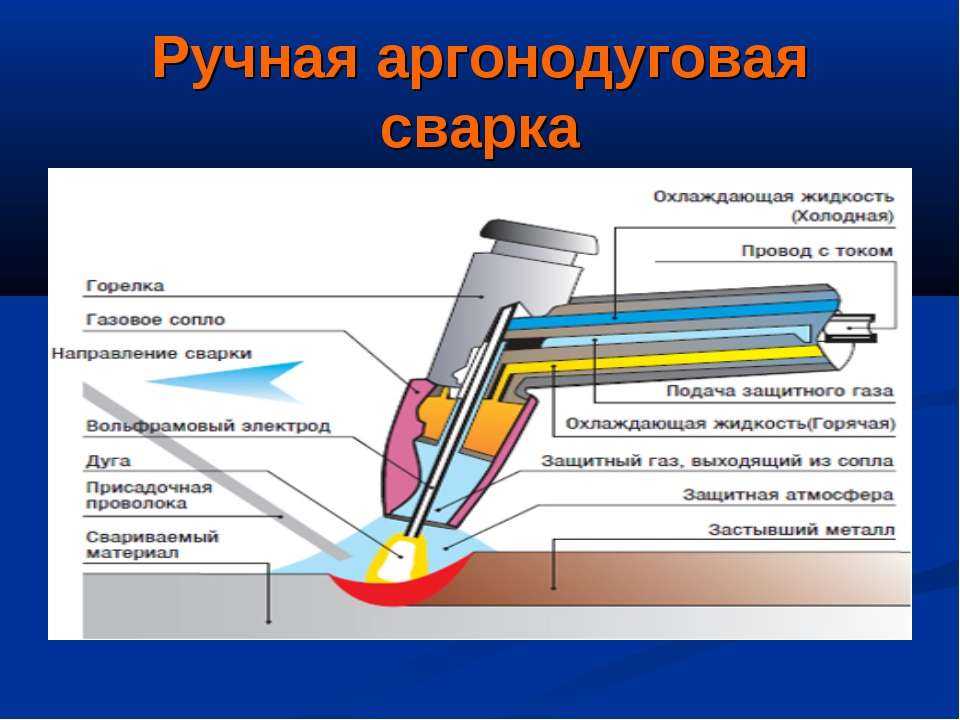 В атмосфере аргона хорошо растут кристаллы для получения полупроводниковых элементов или сверхчистых материалов.
В атмосфере аргона хорошо растут кристаллы для получения полупроводниковых элементов или сверхчистых материалов.
Преимущества и недостатки применения аргона в сварке
Касательно области сварки аргон дает определенные преимущества. Прежде всего, металлические детали в ходе сварки не так сильно нагреваются. Это позволяет избежать деформации. К прочим достоинствам относятся:
- надежная защита сварного шва;
- скорость на порядок выше;
- процесс легко контролировать;
- сварку можно механизировать либо полностью перевести в автоматический режим;
- возможность соединять детали из разнородных металлов.
В то же время сварочный аргон подразумевает и ряд недостатков:
- при сварке возникает ультрафиолетовое излучение;
- для использования высокоамперной дуги необходимо качественное охлаждение;
- сложная работа на открытом воздухе или сквозняке.
Тем не менее при наличии стольких достоинств трудно недооценить значение аргонной сварки.
Меры предосторожности
При использовании аргона стоит проявлять осторожность. Хоть газ нетоксичен, но способен вызывать удушье, замещая собой кислород или сжижая его. Поэтому крайне важно контролировать объем O 2 в воздухе (не менее 19 %) при помощи специальных приборов, ручных или автоматических.
Работа с жидким газом требует предельной осторожности, поскольку низкая температура аргона может вызвать сильное обморожение кожного покрова и повреждение глазной оболочки. Необходимо использовать очки и спецодежду. Лицам, которым необходимо проводить работы в аргонной атмосфере, нужно надевать противогазы либо прочие изолирующие кислородные приборы.
| Внешний вид простого вещества | |
|---|---|
| Инертный газ без цвета, вкуса и запаха | |
| Свойства атома | |
| Имя, символ, номер | Аргон / Argon (Ar), 18 |
| Атомная масса (молярная масса) | 39,948 а. е. м. (г/моль) е. м. (г/моль) |
| Электронная конфигурация | 3s 2 3p 6 |
| Радиус атома | 71пм |
| Химические свойства | |
| Ковалентный радиус | 106 пм |
| Радиус иона | 154 пм |
| Электроотрицательность | 4,3 (шкала Полинга) |
| Электродный потенциал | 0 |
| Степени окисления | 0 |
| Энергия ионизации (первый электрон) | 1519,6(15,75) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | (при 186 °C) 1,40 г/см 3 |
| Температура плавления | 83,8 K |
| Температура кипения | 87,3 K |
| Теплота испарения | 6,52 кДж/моль |
| Молярная теплоёмкость | 20,79 Дж/(K·моль) |
| Молярный объём | 24,2 см 3 /моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 5,260 A |
| Температура Дебая | 85 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 0,0177 Вт/(м·К) |
История открытия аргона начинается в 1785 году, когда английский физик и химик Генри Кавендиш, изучая состав воздуха, решил установить, весь ли азот воздуха окисляется.
В течение многих недель он подвергал воздействию электрического разряда смесь воздуха с кислородом в U-образных трубках, в результате чего в них образовывались все новые порции бурых окислов азота, которые исследователь периодически растворял в щёлочи. Через некоторое время образование окислов прекращалось, но, после связывания оставшегося кислорода, оставался газовый пузырь, объём которого не уменьшался при длительном воздействии электрических разрядов в присутствии кислорода. Кавендиш оценил объём оставшегося газового пузыря в 1/120 от первоначального объёма воздуха. Разгадать загадку пузыря Кавендиш не смог, поэтому прекратил свое исследование, и даже не опубликовал его результатов. Только спустя много лет английский физик Джеймс Максвелл собрал и опубликовал неизданные рукописи и лабораторные записки Кавендиша.
Дальнейшая история открытия аргона связана с именем Рэлея, который несколько лет посвятил исследованиям плотности газов, особенно азота. Оказалось, что литр азота, полученного из воздуха, весил больше литра «химического» азота (полученного путём разложения какого-либо азотистого соединения, например, закиси азота, окиси азота, аммиака, мочевины или селитры) на 1,6 мг (вес первого был равен 1,2521, а второго 1,2505 г. ). Эта разница была не так уж мала, чтобы можно было её отнести на счет ошибки опыта. К тому же она постоянно повторялась независимо от источника получения химического азота.
). Эта разница была не так уж мала, чтобы можно было её отнести на счет ошибки опыта. К тому же она постоянно повторялась независимо от источника получения химического азота.
Не придя к разгадке, осенью 1892 года Рэлей в журнале «Nature» опубликовал письмо к учёным, с просьбой дать объяснение тому факту, что в зависимости от способа выделения азота он получал разные величины плотности. Письмо прочли многие учёные, однако никто не был в состоянии ответить на поставленный в нём вопрос.
У известного уже в то время английского химика Уильяма Рамзая также не было готового ответа, но он предложил Рэлею свое сотрудничество. Интуиция побудила Рамзая предположить, что азот воздуха содержит примеси неизвестного и более тяжелого газа, а Дьюар обратил внимание Рэлея на описание старинных опытов Кавендиша (которые уже были к этому времени опубликованы).
Пытаясь выделить из воздуха скрытую составную часть, каждый из учёных пошел своим путём. Рэлей повторил опыт Кавендиша в увеличенном масштабе и на более высоком техническом уровне. Трансформатор под напряжением 6000 вольт посылал в 50-литровый колокол, заполненный азотом, сноп электрических искр. Специальная турбина создавала в колоколе фонтан брызг раствора щёлочи, поглощающих окислы азота и примесь углекислоты. Оставшийся газ Рэлей высушил, и пропустил через фарфоровую трубку с нагретыми медными опилками, задерживающими остатки кислорода. Опыт длился несколько дней.
Трансформатор под напряжением 6000 вольт посылал в 50-литровый колокол, заполненный азотом, сноп электрических искр. Специальная турбина создавала в колоколе фонтан брызг раствора щёлочи, поглощающих окислы азота и примесь углекислоты. Оставшийся газ Рэлей высушил, и пропустил через фарфоровую трубку с нагретыми медными опилками, задерживающими остатки кислорода. Опыт длился несколько дней.
Рамзай воспользовался открытой им способностью нагретого металлического магния поглощать азот, образуя твёрдый нитрид магния. Многократно пропускал он несколько литров азота через собранный им прибор. Через 10 дней объём газа перестал уменьшаться, следовательно, весь азот оказался связанным. Одновременно путём соединения с медью был удален кислород, присутствовавший в качестве примеси к азоту. Этим способом Рамзаю в первом же опыте удалось выделить около 100 см³ нового газа.
Итак, был открыт новый элемент. Стало известно, что он тяжелее азота почти в полтора раза и составляет 1/80 часть объёма воздуха. Рамзай при помощи акустических измерений нашёл, что молекула нового газа состоит из одного атома — до этого подобные газы в устойчивом состоянии не встречались. Отсюда следовал очень важный вывод — раз молекула одноатомна, то, очевидно, новый газ представляет собой не сложное химическое соединение, а простое вещество.
Рамзай при помощи акустических измерений нашёл, что молекула нового газа состоит из одного атома — до этого подобные газы в устойчивом состоянии не встречались. Отсюда следовал очень важный вывод — раз молекула одноатомна, то, очевидно, новый газ представляет собой не сложное химическое соединение, а простое вещество.
Много времени затратили Рамзай и Рэлей на изучение его реакционной способности по отношению ко многим химически активным веществам. Но, как и следовало ожидать, пришли к выводу: их газ совершенно недеятелен. Это было ошеломляюще — до той поры не было известно ни одного настолько инертного вещества.
Большую роль в изучении нового газа сыграл спектральный анализ. Спектр выделенного из воздуха газа с его характерными оранжевыми, синими и зелёными линиями резко отличался от спектров уже известных газов. Уильям Крукс, один из виднейших спектроскопистов того времени, насчитал в его спектре почти 200 линий. Уровень развития спектрального анализа на то время не дал возможности определить, одному или нескольким элементам принадлежал наблюдаемый спектр. Несколько лет спустя выяснилось, что Рамзай и Рэлей держали в своих руках не одного незнакомца, а нескольких — целую плеяду инертных газов.
Несколько лет спустя выяснилось, что Рамзай и Рэлей держали в своих руках не одного незнакомца, а нескольких — целую плеяду инертных газов.
7 августа 1894 года в Оксфорде, на собрании Британской ассоциации физиков, химиков и естествоиспытателей, было сделано сообщение об открытии нового элемента, который был назван аргоном. В своём докладе Рэлей утверждал, что в каждом кубическом метре воздуха присутствует около 15 г открытого газа (1,288 вес. %). Слишком невероятен был тот факт, что несколько поколений ученых не заметили составной части воздуха, да еще и в количестве целого процента! В считанные дни десятки естествоиспытателей из разных стран проверили опыты Рамзая и Рэлея. Сомнений не оставалось: воздух содержит аргон.
Через 10 лет, в 1904 году, Рэлей за исследования плотностей наиболее распространённых газов и открытие аргона получает Нобелевскую премию по физике, а Рамзай за открытие в атмосфере различных инертных газов — Нобелевскую премию по химии.
Основное применение
Пищевая отрасль
В контролируемой среде аргон может во многих процессах использоваться в качестве замены для азота. Высокая растворимость (в два раза превышающая растворимость азота) и определенные молекулярные характеристики обеспечивают его особые свойства при хранении овощей. При определенных условиях он способен замедлять метаболические реакции и значительно сокращать газообмен.
Высокая растворимость (в два раза превышающая растворимость азота) и определенные молекулярные характеристики обеспечивают его особые свойства при хранении овощей. При определенных условиях он способен замедлять метаболические реакции и значительно сокращать газообмен.
Производство стекла, цемента и извести
При использовании для заполнения ограждений с двойным глазурованием аргон обеспечивает превосходную тепловую изоляцию.
Металлургия
Аргон используется для предупреждения контакта и последующего взаимодействия между расплавленным металлом и окружающей атмосферой.
Использование аргона позволяет оптимизировать такие производственные процессы как перемешивание расплавленных веществ, продувка поддонов реакторов для предупреждения повторного окисления стали и обработка стали узкого применения в вакуумных дегазаторах, включая вакуумно-кислородное обезуглероживание, окислительно-восстановительных процессы и процессы открытого сжигания. Однако наибольшую популярность аргон приобрел в процессах аргоно-кислородного обезуглероживания нерафинированной высокохромистой стали, позволяя минимизировать окисление хрома.
Лабораторные исследования и анализы
В чистом виде и в соединениях с другими газами аргон используется для проведения промышленных и медицинских анализов и испытаний в рамках контроля качества.
В частности аргон выполняет функцию газовой плазмы в эмиссионной спектрометрии индуктивно-связанной плазмой (ICP), газовой подушки в атомно-абсорбционной спектроскопии в графитной печи (GFAAS) и газа-носителя в газовой хроматографии с использованием различных газоанализаторов.
В соединении с метаном аргон используется в счетчиках Гейгера и детекторах рентгеновского флуоресцентного анализа (XRF), где он выполняет функцию гасящего газа.
Сварка, резка и нанесение покрытия
Аргон используется в качестве защитной среды в процессах дуговой сварки, при поддуве защитного газа и при плазменной резке.
Аргон предупреждает окисление сварных швов и позволяет сократить объем дыма, сбрасываемого в процессе сварки.
Электроника
Сверхчистый аргон служит в качестве газа-носителя для химически активных молекул, а также в качестве инертного газа для защиты полупроводников от посторонних примесей (например, аргон обеспечивает необходимую среду для выращивания кристаллов силикона и германия).
В ионном состоянии аргон используется в процессах металлизации напылением, ионной имплантации, нормализации и травления при производстве полупроводников и высокоэффективном производстве материалов.
Автомобильная и транспортная отрасль
Затаренный герметизированный аргон служит для наполнения подушек безопасности в автомобилях.
Аргон
Эта статья о химическом элементе. Для использования в других целях см. Аргон (значения).
Аргон это химический элемент с символ Ar и атомный номер 18. Входит в 18 группу периодическая таблица и является благородный газ.[6] Аргон является третьим по распространенности газом в Атмосфера Земли, при 0,934% (9340 ppmv ). Его более чем в два раза больше, чем водяной пар (что в среднем составляет около 4000 ppmv, но сильно варьируется), в 23 раза больше, чем углекислый газ (400 ppmv) и более чем в 500 раз больше, чем неон (18 частей на миллион по объему). Аргон – самый распространенный благородный газ в земной коре, составляющий 0,00015% коры.
Почти весь аргон в атмосфере Земли радиогенный аргон-40, полученный из разлагаться из калий-40 в земной коре. Во вселенной аргон-36 на сегодняшний день самый распространенный аргон изотоп, поскольку его легче всего производить звездными нуклеосинтез в сверхновые.
Название «аргон» происходит от Греческий слово ἀργόν, средний род единственного числа ἀργός означает «ленивый» или «неактивный», имея в виду тот факт, что элемент почти не подвергается химическим реакциям. Полный октет (восемь электронов) во внешней оболочке атома делает аргон стабильным и устойчивым к связыванию с другими элементами. Его тройная точка температура 83,8058K является определяющей фиксированной точкой в Международная температурная шкала 1990 г..
Аргон промышленно производится фракционная перегонка из жидкий воздух. Аргон в основном используется как инертный защитный газ при сварке и других высокотемпературных промышленных процессах, где обычно нереактивные вещества становятся реактивными; например, в атмосфере аргона используется графит электрические печи для предотвращения возгорания графита. Аргон также используется в раскаленный, флуоресцентное освещение, и др. газоразрядные трубки. Аргон выделяет сине-зеленый газовый лазер. Аргон также используется в стартерах люминесцентного свечения.
Аргон также используется в раскаленный, флуоресцентное освещение, и др. газоразрядные трубки. Аргон выделяет сине-зеленый газовый лазер. Аргон также используется в стартерах люминесцентного свечения.
Содержание
- 1 Характеристики
- 2 История
- 3 Вхождение
- 4 Изотопы
- 5 Соединения
- 6 Производство
- 6.1 Промышленное
- 6.2 В радиоактивных распадах
- 7 Приложения
- 7.1 Промышленные процессы
- 7.2 Научное исследование
- 7.3 Консервант
- 7.4 Лабораторное оборудование
- 7.5 Медицинское использование
- 7.6 Освещение
- 7.7 Разное использование
- 8 Безопасность
- 9 Смотрите также
- 10 Рекомендации
- 11 дальнейшее чтение
- 12 внешняя ссылка
Характеристики
Небольшой кусочек быстро плавящегося твердого аргона
Аргон примерно такой же растворимость в воде в виде кислорода и растворяется в воде в 2,5 раза больше, чем азот. Аргон не имеет цвета, запаха, негорючего вещества и нетоксичен как твердое вещество, жидкость или газ.[7] Аргон химически инертный в большинстве условий и не образует подтвержденных стабильных соединений при комнатной температуре.
Аргон не имеет цвета, запаха, негорючего вещества и нетоксичен как твердое вещество, жидкость или газ.[7] Аргон химически инертный в большинстве условий и не образует подтвержденных стабильных соединений при комнатной температуре.
Хотя аргон – это благородный газ, он может образовывать некоторые соединения в различных экстремальных условиях. Фторгидрид аргона (HArF), соединение аргона с фтор и водород который стабилен ниже 17 K (-256,1 ° C; -429,1 ° F).[8][9] Хотя нейтральные химические соединения аргона в основном состоянии в настоящее время ограничиваются HArF, аргон может образовывать клатраты с воды когда атомы аргона захвачены решеткой молекул воды.[10]Ионы, Такие как ArH+
, и комплексы возбужденного состояния, такие как ArF. Теоретический расчет предсказывает еще несколько соединения аргона это должно быть стабильно[11] но еще не синтезированы.
История
A: пробирка, B: разбавленная щелочь, C: U-образная стеклянная трубка, D: платиновый электрод
Аргон (Греческий ἀργόν, средний род единственного числа ἀργός что означает «ленивый» или «неактивный») назван в связи с его химической неактивностью. Это химическое свойство этого первого благородный газ открытие произвело впечатление на именников.[12][13] Предполагалось, что инертный газ является компонентом воздуха. Генри Кавендиш в 1785 г.[14]
Это химическое свойство этого первого благородный газ открытие произвело впечатление на именников.[12][13] Предполагалось, что инертный газ является компонентом воздуха. Генри Кавендиш в 1785 г.[14]
Аргон был впервые выделен из воздуха в 1894 г. Лорд Рэйли и сэр Уильям Рамзи в Университетский колледж Лондона путем удаления кислород, углекислый газ, вода и азот из пробы чистого воздуха.[15][16][17] Сначала они добились этого, повторив эксперимент Генри Кавендиш с. Они захватили смесь атмосферного воздуха с дополнительным кислородом в пробирке (A) вверх дном над большим количеством разбавленного газа. щелочь раствор (B), который в первоначальном эксперименте Канвендиша был гидроксидом калия,[14] и пропускал ток через провода, изолированные U-образными стеклянными трубками (CC), которые герметизировались вокруг электродов из платиновой проволоки, оставляя концы проводов (DD) открытыми для газа и изолированными от раствора щелочи. Дуга питалась от батареи из пяти Клетки рощи и Катушка Румкорфа среднего размера. Щелочь поглотила оксиды азота, образующиеся при дуге, а также диоксид углерода. Они включили дугу до тех пор, пока уменьшение объема газа не перестанет наблюдаться в течение как минимум часа или двух, а спектральные линии азота не исчезнут при исследовании газа. Оставшийся кислород прореагировал с щелочным пирогаллатом, оставив после себя явно нереактивный газ, который они назвали аргоном.
Дуга питалась от батареи из пяти Клетки рощи и Катушка Румкорфа среднего размера. Щелочь поглотила оксиды азота, образующиеся при дуге, а также диоксид углерода. Они включили дугу до тех пор, пока уменьшение объема газа не перестанет наблюдаться в течение как минимум часа или двух, а спектральные линии азота не исчезнут при исследовании газа. Оставшийся кислород прореагировал с щелочным пирогаллатом, оставив после себя явно нереактивный газ, который они назвали аргоном.
Перед тем как изолировать газ, они определили, что азот, полученный из химических соединений, на 0,5% легче азота из атмосферы. Разница была небольшой, но достаточно важной, чтобы привлекать их внимание на многие месяцы. Они пришли к выводу, что в воздухе есть еще один газ, смешанный с азотом.[18] Аргон также был обнаружен в 1882 году в результате независимых исследований Х. Ф. Ньюолла и У. Н. Хартли.[19] Каждый наблюдал новые линии в спектр излучения воздуха, который не соответствует известным элементам.
До 1957 года символ аргона был «A», но теперь это «Ar».[20]
Вхождение
Аргон составляет 0,934% по объему и 1,288% по массе. Атмосфера Земли,[21] а воздух является основным промышленным источником продуктов очищенного аргона. Аргон выделяют из воздуха фракционированием, чаще всего криогенный фракционная перегонка, процесс, который также производит очищенные азот, кислород, неон, криптон и ксенон.[22] Земная кора и морская вода содержат 1,2 и 0,45 частей на миллион аргона соответственно.[23]
Изотопы
Основная статья: Изотопы аргона
Главный изотопы аргона, обнаруженного на Земле, составляют 40
Ar (99.6%), 36
Ar (0,34%), и 38
Ar (0,06%). Встречающиеся в природе 40
K, с период полураспада 1,25×109 лет, распадается на стабильную 40
Ar (11,2%) по захват электронов или же позитронное излучение, а также к стабильной 40
Ca (88,8%) по бета-распад. Эти свойства и соотношения используются для определения возраста горные породы к K – Ar датирование.[23][24]
Эти свойства и соотношения используются для определения возраста горные породы к K – Ar датирование.[23][24]
В атмосфере Земли, 39
Ar сделано космический луч активности, в первую очередь за счет нейтронного захвата 40
Ar с последующей двухнейтронной эмиссией. В подземной среде он также производится за счет захват нейтронов к 39
Kс последующим испусканием протонов. 37
Ar создается из захват нейтронов к 40
Ca за которым следует альфа-частица выбросы в результате недр ядерные взрывы. Период полувыведения составляет 35 дней.[24]
Между локациями в Солнечная система, изотопный состав аргона сильно различается. Если основным источником аргона является распад 40
K в скалах, 40
Ar будет доминирующим изотопом, как и на Земле. Аргон производится непосредственно звездный нуклеосинтез преобладает альфа-процесс нуклид 36
Ar. Соответственно в солнечном аргоне содержится 84,6% 36
Соответственно в солнечном аргоне содержится 84,6% 36
Ar (в соответствии с Солнечный ветер измерения),[25] и соотношение трех изотопов 36Ar:38Ar:40Ar в атмосферах внешних планет составляет 8400: 1600: 1.[26] Это контрастирует с низким содержанием изначальный 36
Ar в атмосфере Земли, которая составляет всего 31,5 ppmv (= 9340 ppmv × 0,337%), что сравнимо с неоном (18,18 ppmv) на Земле и с межпланетными газами, измеренными зонды.
Атмосфера Марс, Меркурий и Титан (самая большая луна Сатурн ) содержат аргон, преимущественно в виде 40
Ar, а его содержание может достигать 1,93% (Марс).[27]
Преобладание радиогенный 40
Ar это причина стандартный атомный вес земного аргона больше, чем у следующего элемента, калий, факт, который озадачил, когда был открыт аргон. Менделеев расположил элементы на своем периодическая таблица в порядке атомного веса, но инертность аргона предполагает размещение перед реактивный щелочной металл. Генри Мозли позже решил эту проблему, показав, что периодическая таблица на самом деле расположена в порядке атомный номер (видеть История периодической таблицы ).
Генри Мозли позже решил эту проблему, показав, что периодическая таблица на самом деле расположена в порядке атомный номер (видеть История периодической таблицы ).
Соединения
Основная статья: Соединения аргона
Модель заполнения пространства из фторгидрид аргона
Полный октет Аргона электроны обозначает полные подоболочки s и p. Это полное валентной оболочки делает аргон очень стабильным и чрезвычайно устойчивым к соединению с другими элементами. До 1962 года аргон и другие благородные газы считались химически инертными и неспособными образовывать соединения; однако с тех пор были синтезированы соединения более тяжелых благородных газов. Первое соединение аргона с пентакарбонилом вольфрама, W (CO)5Ar был выделен в 1975 году. Однако в то время он не получил широкого распространения.[28] В августе 2000 года другое соединение аргона, фторгидрид аргона (HArF), была создана исследователями из Университет Хельсинки, направляя ультрафиолетовый свет на замороженный аргон, содержащий небольшое количество фтороводород с йодид цезия. Это открытие вызвало осознание того, что аргон может образовывать слабосвязанные соединения, хотя и не первое.[9][29][30] Стабильно до 17кельвин s (-256 ° С). В метастабильный ArCF2+
Это открытие вызвало осознание того, что аргон может образовывать слабосвязанные соединения, хотя и не первое.[9][29][30] Стабильно до 17кельвин s (-256 ° С). В метастабильный ArCF2+
2 дикция, которая является валентнойизоэлектронный с карбонилфторид и фосген, наблюдалась в 2010 г.[31]Аргон-36, в виде гидрида аргона (аргоний ) ионов, была обнаружена в межзвездная среда связанный с Крабовидная туманность сверхновая звезда; это был первый молекула благородного газа обнаружен в космическое пространство.[32][33]
Твердый аргон гидрид (Ar (H2)2) имеет ту же кристаллическую структуру, что и MgZn2Фаза Лавеса. Он образуется при давлениях от 4,3 до 220 ГПа, хотя измерения комбинационного рассеяния показывают, что H2 молекул в Ar (H2)2 диссоциировать выше 175 ГПа.[34]
Производство
Промышленное
Аргон промышленно производится фракционная перегонка из жидкий воздух в криогенный разделение воздуха единица измерения; процесс, который разделяет жидкий азот, который кипит при 77,3 К, из аргона, который кипит при 87,3 К, и жидкий кислород, который кипит при 90,2 К. Около 700000 тонны аргона производятся во всем мире каждый год.[23][35]
Около 700000 тонны аргона производятся во всем мире каждый год.[23][35]
В радиоактивных распадах
40Ar, самый многочисленный изотоп аргона, образуется при распаде 40K с периодом полураспада 1,25×109 лет захват электронов или же позитронное излучение. Из-за этого он используется в калий-аргоновое датирование для определения возраста горных пород.
Приложения
Баллоны с газообразным аргоном для тушения пожара без повреждения серверного оборудования
Аргон обладает несколькими желательными свойствами:
- Аргон химически инертный газ.
- Аргон – самая дешевая альтернатива, когда азот недостаточно инертен.
- Аргон имеет низкое теплопроводность.
- Аргон обладает электронными свойствами (ионизацией и / или спектром излучения), желательными для некоторых приложений.
Другой благородные газы будет одинаково подходящим для большинства из этих приложений, но аргон, безусловно, самый дешевый. Аргон стоит недорого, поскольку он естественным образом встречается в воздухе и легко получается как побочный продукт криогенный разделение воздуха в производстве жидкий кислород и жидкий азот: основные компоненты воздуха используются в больших промышленных масштабах. Другие благородные газы (кроме гелий ), но аргон является наиболее распространенным. Основная часть применений аргона возникает просто потому, что он инертен и относительно дешев.
Аргон стоит недорого, поскольку он естественным образом встречается в воздухе и легко получается как побочный продукт криогенный разделение воздуха в производстве жидкий кислород и жидкий азот: основные компоненты воздуха используются в больших промышленных масштабах. Другие благородные газы (кроме гелий ), но аргон является наиболее распространенным. Основная часть применений аргона возникает просто потому, что он инертен и относительно дешев.
Промышленные процессы
Аргон используется в некоторых высокотемпературных промышленных процессах, где обычно нереактивные вещества становятся реактивными. Например, в графитовых электрических печах используется атмосфера аргона для предотвращения горения графита.
Для некоторых из этих процессов присутствие газов азота или кислорода может вызвать дефекты в материале. Аргон используется в некоторых типах дуговая сварка Такие как газовая дуговая сварка и газовая вольфрамовая дуговая сварка, а также при обработке титан и другие реактивные элементы. Атмосфера аргона также используется для выращивания кристаллов кремний и германий.
Атмосфера аргона также используется для выращивания кристаллов кремний и германий.
Смотрите также: защитный газ
Аргон используется в птицеводстве для задыхаться птиц, либо для массовой выбраковки после вспышек болезней, либо в качестве более гуманного способа убоя, чем электрическое оглушение. Аргон плотнее воздуха и вытесняет кислород у земли во время удушение инертным газом.[36][37] Его нереактивная природа делает его подходящим для пищевых продуктов, а поскольку он заменяет кислород в мертвой птице, аргон также увеличивает срок хранения.[38]
Иногда аргон используется для тушение пожаров где ценное оборудование может быть повреждено водой или пеной.[39]
Научное исследование
Жидкий аргон используется в качестве мишени для нейтринных экспериментов и прямого темная материя поиски. Взаимодействие гипотетических WIMPs а ядро аргона производит мерцание свет, который обнаруживается фотоумножители. Двухфазные детекторы, содержащие газообразный аргон, используются для обнаружения ионизированных электронов, образующихся во время рассеяния WIMP-ядра. Как и большинство других сжиженных благородных газов, аргон имеет высокий световыход сцинтилляции (около 51 фотон / кэВ[40]), прозрачна для собственного сцинтилляционного света и относительно легко очищается. В сравнении с ксенон, аргон дешевле и имеет отчетливый временной профиль сцинтилляции, который позволяет отделить электронные отдачи от ядерных. С другой стороны, его собственный фон бета-лучей больше из-за 39
Как и большинство других сжиженных благородных газов, аргон имеет высокий световыход сцинтилляции (около 51 фотон / кэВ[40]), прозрачна для собственного сцинтилляционного света и относительно легко очищается. В сравнении с ксенон, аргон дешевле и имеет отчетливый временной профиль сцинтилляции, который позволяет отделить электронные отдачи от ядерных. С другой стороны, его собственный фон бета-лучей больше из-за 39
Ar загрязнения, если только не используется аргон из подземных источников, в котором гораздо меньше 39
Ar загрязнение. Большая часть аргона в атмосфере Земли была произведена электронным захватом долгоживущих 40
K (40
K + е− → 40
Ar + ν), присутствующий в природном калии на Земле. В 39
Ar активность в атмосфере поддерживается за счет космогенного производства за счет реакции выбивания 40
Ar(n, 2n)39
Ar и подобные реакции. Период полураспада 39
Период полураспада 39
Ar всего 269 лет. В результате подземный Ar, защищенный камнями и водой, имеет гораздо меньше 39
Ar загрязнение.[41] Детекторы темной материи, в настоящее время работающие с жидким аргоном, включают: Темная сторона, WArP, ArDM, microCLEAN и DEAP. Эксперименты с нейтрино включают ИКАРУС и MicroBooNE, оба из которых используют жидкий аргон высокой чистоты в камера времени проекции для детального трехмерного изображения нейтринных взаимодействий.
В Университете Линчёпинга, Швеция, инертный газ используется в вакуумной камере, в которую вводится плазма для ионизации металлических пленок.[42] В результате этого процесса получается пленка, которую можно использовать для производства компьютерных процессоров. Новый процесс устранит необходимость в химических ваннах и использовании дорогих, опасных и редких материалов.
Консервант
Образец цезий упакован под аргоном, чтобы избежать реакции с воздухом
Аргон используется для вытеснения воздуха, содержащего кислород и влагу, в упаковочном материале, чтобы продлить срок хранения содержимого (аргон имеет Европейский код пищевых добавок E938). Воздушное окисление, гидролиз и другие химические реакции, приводящие к разложению продуктов, замедляются или полностью предотвращаются. Химические вещества высокой чистоты и фармацевтические препараты иногда упаковываются и запечатываются в аргоне.[43]
Воздушное окисление, гидролиз и другие химические реакции, приводящие к разложению продуктов, замедляются или полностью предотвращаются. Химические вещества высокой чистоты и фармацевтические препараты иногда упаковываются и запечатываются в аргоне.[43]
В виноделие, аргон используется в различных сферах деятельности, чтобы обеспечить барьер против кислорода на поверхности жидкости, который может испортить вино, подпитывая как микробный метаболизм (как и уксуснокислые бактерии ) и стандартный редокс химия.
Аргон иногда используется в качестве топлива в аэрозоль банки.
Аргон также используется в качестве консерванта для таких продуктов, как лак, полиуретан, и краска, вытесняя воздух, чтобы подготовить контейнер для хранения.[44]
С 2002 г. американская Национальный архив хранит важные национальные документы, такие как Декларация независимости и Конституция внутри корпуса, заполненного аргоном, чтобы предотвратить их разложение. Аргон предпочтительнее гелия, который использовался в предыдущие пять десятилетий, потому что газообразный гелий выходит через межмолекулярные поры в большинстве контейнеров и должен регулярно заменяться. [45]
[45]
Лабораторное оборудование
Перчаточные ящики часто заполнены аргоном, который рециркулирует через скрубберы для поддержания кислород -, азот -, и невлажная атмосфера
Смотрите также: Безвоздушная техника
Аргон может использоваться как инертный газ в Линии Шленка и перчаточные ящики. Аргон предпочтительнее менее дорогого азота в тех случаях, когда азот может реагировать с реагентами или аппаратом.
Аргон может использоваться в качестве газа-носителя в газовая хроматография И в масс-спектрометрия с ионизацией электрораспылением; это предпочтительный газ для плазмы, используемой в ICP спектроскопия. Аргон предпочтителен для напыления образцов для сканирующая электронная микроскопия. Газ аргон также обычно используется для напыление тонких пленок как в микроэлектроника и для очистка пластин в микротехнологии.
Медицинское использование
Криохирургия такие процедуры как криоабляция используйте жидкий аргон для разрушения тканей, например рак клетки. Он используется в процедуре, называемой «коагуляция с усилением аргона», форма аргона. плазменный луч электрохирургия. Процедура сопряжена с риском производства газовая эмболия и привел к смерти по крайней мере одного пациента.[46]
Он используется в процедуре, называемой «коагуляция с усилением аргона», форма аргона. плазменный луч электрохирургия. Процедура сопряжена с риском производства газовая эмболия и привел к смерти по крайней мере одного пациента.[46]
Синий аргоновые лазеры используются в хирургии для сваривания артерий, разрушения опухолей и коррекции глазных дефектов.[23]
Аргон также использовался экспериментально для замены азота в смеси для дыхания или декомпрессии, известной как Аргокс, чтобы ускорить выведение растворенного азота из крови.[47]
Освещение
Аргон газоразрядная лампа образуя символ аргона «Ar»
Лампы накаливания заполнены аргоном, чтобы сохранить нити при высокой температуре от окисления. Он используется для определенного способа ионизации и излучения света, например, в плазменные шары и калориметрия в экспериментальных физика элементарных частиц. Газоразрядные лампы наполненный чистым аргоном дает сиреневый / фиолетовый свет; с аргоном и немного ртути, синий свет. Аргон также используется для синего и зеленого цветов. аргон-ионные лазеры.
Аргон также используется для синего и зеленого цветов. аргон-ионные лазеры.
Разное использование
Аргон используется для теплоизоляция в энергоэффективные окна.[48] Аргон также используется в технических подводное плавание с аквалангом надуть сухой костюм потому что он инертен и имеет низкую теплопроводность.[49]
Аргон используется в качестве топлива при разработке Магнитоплазменная ракета с переменным удельным импульсом (ВАСИМР). Сжатый газ аргон расширяется, чтобы охладить головки искателя некоторых версий AIM-9 Сайдвиндер ракета и другие ракеты, в которых используются охлаждаемые тепловые головки самонаведения. Газ хранится под высоким давлением.[50]
Аргон-39 с периодом полураспада 269 лет использовался для ряда приложений, в первую очередь ледяной керн и грунтовые воды знакомства. Также, калий-аргоновое датирование и связанные аргон-аргоновое датирование используется на сегодняшний день осадочный, метаморфический, и Магматические породы. [23]
[23]
Аргон использовался спортсменами в качестве допинга для моделирования гипоксический условия. В 2014 г. Всемирное антидопинговое агентство (ВАДА) добавил аргон и ксенон в список запрещенных веществ и методов, хотя на данный момент нет надежного теста на злоупотребление.[51]
Безопасность
Хотя аргон не токсичен, он на 38% больше плотный чем воздух и поэтому считается опасным удушающий на закрытых территориях. Его трудно обнаружить, потому что он не имеет цвета, запаха и вкуса. Инцидент 1994 года, когда мужчина задохнулся после входа в аргононаполненный участок строящегося нефтепровода в г. Аляска, подчеркивает опасность утечки аргона из резервуара в ограниченном пространстве и подчеркивает необходимость правильного использования, хранения и обращения.[52]
Смотрите также
- Химический портал
- Промышленный газ
- Соотношение кислород – аргон, соотношение двух физически похожих газов, которое имеет значение в различных секторах.
 Расследование FACE на Аляске 94AK012 (23 июня 1994 г.). «Помощник сварщика задохнулся в трубе с инертным аргоном – Аляска (FACE AK-94-012)». Департамент здравоохранения штата Аляска. Получено 29 января 2011.
Расследование FACE на Аляске 94AK012 (23 июня 1994 г.). «Помощник сварщика задохнулся в трубе с инертным аргоном – Аляска (FACE AK-94-012)». Департамент здравоохранения штата Аляска. Получено 29 января 2011. - Brown, T. L .; Bursten, B.E .; ЛеМэй, Х. Э. (2006). Дж. Чаллис; Н. Фолчетти (ред.). Химия: центральная наука (10-е изд.). Pearson Education. стр.276 & 289. ISBN 978-0-13-109686-8.
- Лиде, Д. Р. (2005). «Свойства элементов и неорганических соединений; плавление, кипение, тройные и критические температуры элементов». CRC Справочник по химии и физике (86-е изд.). CRC Press. §4. ISBN 978-0-8493-0486-6. При давлении тройной точки 69 кПа.
- Престон-Томас, Х. (1990). «Международная температурная шкала 1990 г. (ITS-90)». Метрология. 27 (1): 3–10. Bibcode:1990Метро..27 …. 3П. Дои:10.1088/0026-1394/27/1/002. При давлении тройной точки 83,8058 К.

- Аргон в Периодическая таблица видео (Ноттингемский университет)
- Периодическая таблица USGS – аргон
- Приложения для дайвинга: Почему аргон?
- Символ: Вкл.
- Атомный номер: 18
- Атомный вес: 39.
 948
948 - Классификация: благородный газ
- Фаза при комнатной температуре: газ
- Плотность: 1,784 г / л при 0 ° C
- Точка плавления: -189,35 ° C, -308,83 ° F
- Точка кипения: -185,85 ° C, -302,53 ° F
- Обнаружено: лордом Рэли и сэром Уильямом Рамзи в 1894 году.
- У аргона нет известных биологических функций.

- Когда газообразный аргон соединяется с небольшим количеством ртути, он светится синим цветом при возбуждении электричеством.
- Большое количество чистого аргона может считаться опасным в закрытых помещениях, поскольку он плотнее воздуха и может вызвать удушье.
- Когда аргон используется в качестве газового лазера, он излучает сине-зеленый цвет.
- Газ аргон в атмосфере Земли образуется в результате радиоактивного распада калия.
Для многих десятилетия, наиболее распространенный процесс извлечения и очистки аргона, используемый несколько шагов: 1) забор «бокового» потока из первичного воздуха разделительной дистилляционной системы в точке колонны низкого давления, где концентрация аргона самая высокая, 2) обработка сырья в сыром аргоновая колонна, возвращающая азот в колонну низкого давления и производит сырой аргон, 3) нагревает сырой аргон и реагирует примеси кислорода (обычно около 2%) в потоке с регулируемой количество водорода для образования воды, 4) удаление водяного пара путем конденсация и адсорбция, 5) переохлаждение газа до криогенного температуры и 6) удаление оставшихся неаргоновых компонентов (небольшие количества азота и неизрасходованного водорода) путем дальнейшей перегонки в дистилляционной колонне с чистым аргоном.
С развитием технологии насадочных колонн, позволяющей криогенно дистилляция будет выполняться с низким перепадом давления, многие заводы в настоящее время использовать полностью криогенный процесс дистилляции для извлечения аргона и очищение.

- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 31741
- Гелий 1s 2
- Неон [He] 2s 2 2 шт. 6
- Аргон [Ne] 3s 2 3p 6
- Криптон [Ar] 3d 10 4s 2 4p 6
- Ксенон [Kr] 4d 10 5s 2 5p 6
- Радон [Xe] 4f 14 5d 10 6s 2 6p 6
- Атомная масса, температура кипения и атомные радиусы УВЕЛИЧИТЬ вниз на группу в таблице Менделеева.
- Энергия первой ионизации УМЕНЬШАЕТСЯ вниз на группу в таблице Менделеева.
- Благородные газы обладают наибольшей энергией ионизации, что отражает их химическую инертность.
- Вниз Группа 18, атомный радиус и межатомные силы ПОВЫШЕНИЕ приводит к ПОВЫШЕНИЮ температуры плавления, точки кипения, энтальпии парообразования и растворимости.
- УВЕЛИЧЕНИЕ плотности вниз по группе коррелирует с УВЕЛИЧЕНИЕ атомной массы.
- Поскольку атомы УВЕЛИЧИВАЮТ атомный размер в группе, электронные облака этих неполярных атомов становятся все более поляризованными, что приводит к слабым ван-дер-ваальсовым силам между атомами.
 Таким образом, образование жидкостей и твердых тел более легко достижимо для этих более тяжелых элементов из-за их температур плавления и кипения.
Таким образом, образование жидкостей и твердых тел более легко достижимо для этих более тяжелых элементов из-за их температур плавления и кипения. - Поскольку внешние оболочки благородных газов заполнены, они чрезвычайно стабильны, имеют тенденцию не образовывать химических связей и имеют небольшую тенденцию к присоединению или потере электронов.
- В стандартных условиях все члены группы благородных газов ведут себя одинаково.
- Все являются моноатомными газами при стандартных условиях.
- Атомы благородных газов, как и атомы других групп, УВЕЛИЧИВАЮТ неуклонно атомный радиус от одного периода к другому из-за УВЕЛИЧЕНИЕ числа электронов.
- Размер атома положительно коррелирует с некоторыми свойствами благородных газов. Потенциал ионизации УМЕНЬШАЕТСЯ с радиусом УВЕЛИЧИВАЕТСЯ , потому что валентные электроны в более крупных благородных газах находятся дальше от ядра; поэтому они менее крепко удерживаются атомом.

- Сила притяжения УВЕЛИЧИВАЕТ размер атома в результате УВЕЛИЧИВАЕТ по поляризуемости и, следовательно, ПОНИЖЕНИЕ по потенциалу ионизации.
- В целом благородные газы обладают слабыми межатомными взаимодействиями и, следовательно, очень низкими температурами кипения и плавления по сравнению с элементами других групп.
- Фрей, Джон Э. «Открытие благородных газов и основы теории строения атома». J. Chem. Образовательный 1966 , 43 , 371.
- Luckenbaugh, Raymond W. «Связь радона с раком легких (L)». J. Chem. Образовательный 1994 , 71 , 902.
- Хайман, Герберт Х. «Химия благородных газов».
 J. Chem. Образовательный 1964 , 41 , 174.
J. Chem. Образовательный 1964 , 41 , 174. - Мартин, Р. Брюс. «Радон в дырявом доме (LTE)». J. Chem. Образовательный 1993 , 70 , 1040.
- Мик, Терри Л. «Электроотрицательность благородных газов». J. Chem. Образовательный 1995 , 72 , 17.
- Уэлч, Лоуренс Э.; Моссман, Дэниел М. «Эксперимент по химии окружающей среды: определение уровня радона в воде». J. Chem. Образовательный 1994 , 71 , 521.
- Петруччи и др. Общая химия: принципы и современные приложения, 9-е издание . Нью-Джерси: Pearson Education, Inc., 2007. Главы 21 и 22.
- Различные приложения для различных благородных газов: http://www.praxair.com/praxair.nsf/AllContent/708AB72B4FC2BC3B85256A93005D3D5A?OpenDocument&URLMenuBranch=BB99E322786CC5CF8525704B0058F7DF
- Статья в Википедии о XeF 2 : http://en.
 Wikipedia.org/wiki/XeF2
Wikipedia.org/wiki/XeF2 - Статья в Википедии о XeF 4 : en.Wikipedia.org/wiki/XeF4
- Статья в Википедии о XeF 6 : en.Wikipedia.org/wiki/XeF6
- Статья в Википедии о XeO 4 : en.Wikipedia.org/wiki/XeO4
- История благородных газов: http://www.bbc.co.uk/dna/h3g2/A2342189
- Изображение гелия: http://www.flw.com/datatools/periodic/e_model/2.gif
- Изображение неона: http://creationwiki.org/pool/images/thumb/4/41/Electron_shell_Neon.png/112px-Electron_shell_Neon.png
- Изображение Аргона: http://www.flw.com/datatools/periodic/002.php?id=18
- Изображение Криптона: http://www.flw.com/datatools/periodic/e_model/36.gif
- Изображение ксенона: http://www.flw.com/datatools/periodic/e_model/54.gif
- Изображение Радона: http://www.flw.com/datatools/periodic/002.php?id=86
- Изображение XeF 6 : http://www.
 faidherbe.org/site/cours/dupuis/images4/xef6.gif
faidherbe.org/site/cours/dupuis/images4/xef6.gif - Изображение гелиевых шаров: http://www.carondelet.pvt.k12.ca.us/PeriodicTable/He/helium%20pic3.jpg
- Изображение неонового света: http://www.neonsdirect.co.uk/images/blue-neon-lights.jpg
- Изображение аргоновой плазменной лампочки: http://www.vk2zay.net/article/file/17
- Изображение криптонового лазера: www.ucd.ie/physics/preston/re…biophysics.jpg
- Изображение ксеноновых фар: www.bmw.com/com/en/newvehicle…s_bi_xenon.jpg
- Изображение радоновой ванны:www.sibyllenbad.de/cms/medien…264-sb_199.jpg
- Вернуться к началу
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Показать страницу Содержание
- нет на странице
- Теги
- Аргон
- Кавендиш
- Эксперимент Кавендиша
- Группа 18
- Гелий
- Генри Кавендиш
- инертные газы
- Джон Уильям Стратт
- криптон
- Неон
- Благородные газы
- октетов
- периодическая таблица
- Физические свойства
- Радон
- валентные оболочки
- Уильям Рамзи
- Ксенон
- 1 Возникновение
- 2 История
- 3 примечательных характеристики
- 3.1 Изотопы
- 4 соединения
- 5 приложений
- 6 Сноски
- 7 Каталожные номера
- 8 Внешние ссылки
- 9 кредитов
- Аргон используется в лампах накаливания и других устройствах, в которых двухатомный азот недостаточно инертен. Аргон не вступает в реакцию с нитью накаливания даже при высоких температурах.
- Он также используется в качестве защиты от инертного газа во многих видах сварки, включая сварку вольфрамовым электродом в среде инертного газа.
- Это нереакционноспособное покрытие в производстве титана и других реактивных элементов.
- Обеспечивает защитную атмосферу для выращивания кристаллов кремния и германия.
- Этот газ используется в плазменных шарах.

- Используется для теплоизоляции энергосберегающих окон.
- Аргон-39 использовался для ряда применений, в первую очередь для бурения льда. Он также использовался для датирования подземных вод.
- Процедуры криохирургии, такие как криоабляция, используют сжиженный аргон для разрушения раковых клеток.
- Жидкий аргон используется в калориметрии в экспериментальной физике элементарных частиц. Аргон
- используется в техническом подводном плавании для надувания сухого гидрокостюма, так как газ инертен и имеет низкую теплопроводность.
- Синие аргоновые лазеры используются в хирургии для сваривания артерий, разрушения опухолей и исправления дефектов глаз.
- Благодаря своим инертным свойствам реставраторы музеев используют его для защиты старых материалов, склонных к постепенному окислению на воздухе.
- ↑ Титан
- ↑ Свойства Аргона
- ↑ Благородные газы
- Лос-Аламосская национальная лаборатория – Аргон Проверено 31 августа 2007 г.

- Периодическая таблица Геологической службы США – аргон Проверено 31 августа 2007 г.
- Эмсли, Дж. Строительные блоки природы . Оксфорд, Нью-Йорк: Издательство Оксфордского университета, 2001. .
- Браун, Т.Л., Б.Э. Бёрстен и Х.Е. ЛеМэй. В химии: Центральная наука , 10-е изд. Река Аппер-Сэдл, Нью-Джерси: Pearson Education, Inc., 2006.
- Аргон: главное WebElements.com
- Почему аргон? Эрик Майкен
- Свойства, использование, применение аргона
- Аргон история
- История “Аргона”
- Эта статья относится к химическому элементу. Чтобы узнать о других значениях, см. Аргон (значения) .
- 1 Характеристики
- 2 История
- 3 приложения
- 4 Возникновение
- 5 соединений
- 6 изотопов
- 7 Потенциальные опасности
- 8 Каталожные номера
- 9 Дальнейшее чтение
- Требуется инертный газ. В частности, аргон является самой дешевой альтернативой, когда двухатомный азот недостаточно инертен.
- Требуется низкая теплопроводность.
- Электронные свойства (ионизация и/или эмиссионный спектр) необходимы.
- В качестве заполняющего газа в лампах накаливания, поскольку аргон не вступает в реакцию с нитью накаливания даже при высоких температурах.
- В качестве защиты от инертного газа при многих видах сварки, включая сварку металлов в среде инертного газа и сварку вольфрама в среде инертного газа.
- Для тушения пожаров, когда необходимо избежать повреждения оборудования (см. фото).
- В качестве предпочтительного газа для плазмы, используемой в ИСП-спектроскопии
- В качестве нереактивного покрытия при обработке титана и других химически активных элементов,
- В качестве защитной атмосферы для выращивания кристаллов кремния и германия, а также в печах для термообработки при парциальном давлении.

- Музейные реставраторы для защиты старых материалов или документов, склонных к постепенному окислению в присутствии воздуха. [8]
- Для предотвращения окисления открытых бутылок с вином, а также в ряде раздаточных устройств и систем крышек.
- В виноделии для доливки бочек, вытеснения кислорода и, таким образом, предотвращения превращения вина в уксус в процессе старения.
- В фармацевтической промышленности для доливки флаконов с лекарственными препаратами для внутривенного введения (например, парацетамола для внутривенного введения), снова вытесняя кислород и тем самым продлевая срок годности лекарства.
- Используется для охлаждения головки самонаведения ракеты AIM-9 Sidewinder версии ВВС США. Газ хранится под высоким давлением, и расширение газа охлаждает ГСН [9] .
- Лос-Аламосская национальная лаборатория – Аргон
- Периодическая таблица Геологической службы США — аргон
- Эмсли, Дж., Строительные блоки природы; Издательство Оксфордского университета: Оксфорд, Нью-Йорк, 2001; стр. 35-39.
- Браун, Т. Л.; Берстен, BE; LeMay, HE, In Химия: Центральная наука , 10-е изд.; Чалис, Дж.; Дрейпер, П.; Фолчетти, Н. и др.; Ред.; Pearson Education, Inc.: Аппер-Сэдл-Ривер, Нью-Джерси, 2006 г.; стр. 276 и 289.
- Температура тройной точки: 83,8058 K – Preston-Thomas, H. (1990). «Международная температурная шкала 1990 г. (МТС-90)». Метрология 27 : 3-10.
- Давление в тройной точке: 69 кПа – (2005) “Раздел 4, Свойства элементов и неорганических соединений.
 Температуры плавления, кипения, тройной и критические температуры элементов”, Справочник CRC по химии и физике , 85-е издание, Бока-Ратон, Флорида: CRC Press.
Температуры плавления, кипения, тройной и критические температуры элементов”, Справочник CRC по химии и физике , 85-е издание, Бока-Ратон, Флорида: CRC Press. - Аргон является наиболее распространенным и дешевым инертным газом, в основном получаемым в больших масштабах путем фракционной перегонки воздуха. Применяется для защиты металлических поверхностей от окисления при сварке стали, алюминия, магния.
- Он широко используется в электрическом оборудовании, таком как лампы накаливания и радиолампы.
- Мы использовали газообразный аргон в различных типах промышленных производственных процессов, научных исследованиях и медицине.
- Атмосфера аргона используется в некоторых высокотемпературных промышленных процессах для производства таких металлов, как титан, ванадий, цирконий, уран и т. д.
- Нетоксичный аргон также используется для упаковки пищевых продуктов, чтобы продлить срок их хранения.
- Мы также использовали его для консервации и упаковки химикатов, таких как лак, полиуретан и краска.

- Используется для теплоизоляции в энергосберегающих окнах.
- Синий аргоновый лазер используется в медицине для уничтожения опухолей человеческого тела.
дальнейшее чтение
внешняя ссылка
15 фактов об аргоне, которые проливают свет на этот благородный газ!
Аргон — бесцветный элемент без запаха и вкуса.
Аргон был впервые обнаружен в 1894 году лордом Рэлеем и сэром Уильямом Рамзи, когда они выделили этот элемент из воздуха. Аргон имеет атомный номер 18 и следует за хлором, который имеет атомный номер 17.
Аргон занимает 12-е место среди химических элементов, распространенных на космическом уровне, и этот элемент составляет около 0,934% по объему и 1,288% атмосферы Земли по весу. Его находят заваленным в скалах. Аргон также используется в промышленности в качестве инертной атмосферы для дуговой сварки таких металлов, как нержавеющая сталь и алюминий. Он также используется для производства и производства металлов, таких как уран, цирконий, и титан.
Аргон также используется для выращивания кристаллов полупроводников, таких как германий и кремний. Аргон встречается в атмосфере в 24 раза чаще и примерно в 500 раз чаще, чем неон, по сравнению с углекислым газом.
Если вам понравилась эта статья об аргоне, обязательно ознакомьтесь со статьями об алюминии и меди!
Классификация аргона в периодической таблицеАргон классифицируется как благородный газ в периодической таблице и является одним из наиболее часто и широко используемых благородных газов.
Атомная масса аргона равна 39,948. Температура плавления аргона составляет 83,81 К, что составляет -308,81 F (-189,34 C), а газ имеет температуру кипения 83,81 K, что составляет -308,81 F (-189,34 C). Аргон имеет низкую теплопроводность, потому что электронные оболочки в элементе заполнены. Аргон состоит из трех электронных оболочек, а третья оболочка состоит из восьми электронов.
Детали открытия аргонаАргон стал первым благородным газом, открытым в 1894 году сэром Уильямом Рамзи и лордом Рэлеем. Аргону давали символ элемента «А» до 1957 года, когда символ элемента был изменен с А на Аргон, и это атомный номер 18 в периодической таблице. До его открытия в 1894 году Генри Кавендиш верил в возможность существования газа, когда он взял образцы воздуха во время своего исследования в 1785 году.
Аргону давали символ элемента «А» до 1957 года, когда символ элемента был изменен с А на Аргон, и это атомный номер 18 в периодической таблице. До его открытия в 1894 году Генри Кавендиш верил в возможность существования газа, когда он взял образцы воздуха во время своего исследования в 1785 году.
Инертный газ «аргон» происходит от «аргос», греческого слова, которое переводится как «неактивный» или «ленивый». Название связано с тем фактом, что газообразный аргон химически инертен при комнатных давлении и температуре.
Рэлей и Рэмси официально обнаружили его, когда элемент был выделен из воздуха. Рэмси удалил кислород, азот, углекислый газ и воду, а оставшиеся газы исследовали.
Свойства аргона без вкуса, цвета и запаха наблюдаются в твердой и жидкой формах. Аргон как минимум на 38% плотнее воздуха, и его часто используют для вытеснения кислорода, чтобы предотвратить окисление.
До 1957 года буква А использовалась как символ Аргона. Символ был изменен на Ar Международным союзом теоретической и прикладной химии (IUPAC).
Символом элемента аргона является Ar, и ему приписывается атомный номер 18 в периодической таблице. Аргон принимает газообразную форму при комнатной температуре.
Газ аргон не имеет цвета, запаха и вкуса. Воздействие аргона не смертельно, так как газ совершенно не токсичен. Однако чрезмерное вдыхание газа вызывает удушье или приводит к рвоте, тошноте, головокружению, потере сознания, а в крайних случаях может привести к смерти. Смерть в основном является прямым результатом замешательства или ошибок в суждениях, которые могут блокировать достаточно быструю реакцию мозга, чтобы предотвратить любую операцию по самоспасению.
Как и другие благородные газы, аргон устойчив к соединениям с другими элементами. Часто это происходит из-за относительно тяжелого газа, и, в отличие от гелия, аргон не теряется в космосе, как другие благородные газы.
Аргон полностью стабилен и проявляет нереактивность при воздействии других химических веществ на высоком уровне. Газообразный аргон вытесняет кислород в замкнутых пространствах, потому что он плотнее воздуха.
Газообразный аргон вытесняет кислород в замкнутых пространствах, потому что он плотнее воздуха.
36Ar, 38Ar и 40Ar — три стабильных изотопа, из которых состоит природный аргон. Есть еще 21 радиоактивный изотоп в диапазоне от 30Ar до 53Ar.
Аргон-36 содержит 18 нейтронов и является стабильным изотопом. Около 0,3336% природного аргона состоит из аргона-36.
Аргон-38 содержит 20 нейтронов и является еще одним стабильным изотопом. Аргон-38 составляет около 0,0626% природного аргона.
Аргон-40 содержит 22 нейтрона и является еще одним стабильным изотопом и составляет большую часть природного аргона с содержанием 99,6035%.
Аргон-39 содержит 21 нейтрон и является радиоактивным изотопом. Космические излучения взаимодействуют с атмосферным аргоном-40, образуя аргон-39.
Известно, что аргон является наиболее распространенным благородным газом. Газ составляет около 1,6% атмосферы Марса и 0,94% атмосферы Земли. За исключением водяного пара, аргон занимает третье место по распространенности в атмосфере Земли после азота и кислорода. Аргон получают фракционной фильтрацией жидкого воздуха.
Аргон получают фракционной фильтрацией жидкого воздуха.
В атмосфере Земли практически весь аргон является радиогенным — аргон-40 (образуется в результате радиоактивного распада). Это взято из земной коры, которая разлагает калий-40. Аргон-36 известен как обычный изотоп аргона.
При возбуждении Аргон излучает красивое сине-фиолетовое свечение.
Аргон по сей день не имеет экологического ущерба. Это связано с тем, что газ естественным образом присутствует в окружающей среде и не содержит вредных элементов, которые могут вызвать разрушение озонового слоя.
Из-за химических элементов, входящих в состав аргона, газ негорюч. Однако резервуары с аргоном могут взорваться, если они окружены огнем, поскольку тепло увеличивает давление внутри резервуара, доводя его до точки кипения.
Использование аргона в повседневной жизниГаз аргон используется в повседневных товарах, таких как лампочки, сварочные экраны и другие предметы первой необходимости, чтобы обеспечить инертную среду для правильной работы газа. Аргон относительно доступен, так как стоит 50 центов за 3,5 унции (100 г)!
Аргон относительно доступен, так как стоит 50 центов за 3,5 унции (100 г)!
Поскольку аргон инертен и не образует стабильных соединений при комнатной температуре, он используется в промышленных процессах, требующих инертной атмосферы. Аргон также содержится в сухих костюмах глубоководных водолазов, поскольку атомная масса аргона делает его хорошим изолятором.
Аргон в жидкой форме используется во многих видах лечения. В криохирургии используется жидкий аргон для разрушения тканей, пораженных раком. Жидкий аргон также используется при поиске темной материи и экспериментах с нейтрино.
Аргон используется в неоновых вывесках, которые мы часто видим. Аргон излучает привлекательный синий свет, когда используется вместе с неоном.
Аргон используется в медицинских лазерах, в основном в офтальмологии, для коррекции глазных болезней, таких как глаукома, отслойка сетчатки и утечка кровеносных сосудов.
Аргон, инертный газ, часто используется в пищевой промышленности. Аргон используется в винных бочках для вытеснения воздуха, поскольку он оседает над жидкостью и защищает ее от окисления и закисания. То же самое относится к открытым бутылкам с жидкостью и вином в ресторанах и барах.
То же самое относится к открытым бутылкам с жидкостью и вином в ресторанах и барах.
Способность аргона вытеснять кислород из атмосферы — одна из причин, по которой этот элемент используется в системах пожаротушения по всему миру.
Вы знали?Аргон тяжелее воздуха и при вдыхании оседает на дно легких. Газ вытесняет кислород в легких, что в конечном итоге приводит к удушью или, по крайней мере, к потере сознания.
Наряду с гелием, криптоном, ксеноном, неоном, радоном и оганессоном аргон составляет семь благородных газов. В 1894 году немецкий химик Хьюго Эрдманн назвал «благородный газ». Термин произошел от «благородных металлов», используемых для описания нереакционноспособных металлов. Причина инертности благородных газов связана с присутствующими в них электронными конфигурациями.
В 1785 году Генри Кавендиш предположил, что в атмосфере существует аргон! Генри Кавендиш был влиятельным физиком-теоретиком и экспериментальным физиком и химиком и известен своим открытием водорода.
Головки ракет с тепловым наведением охлаждаются аргоном.
Аргон был обнаружен в атмосферах Меркурия и Титана (спутника Сатурна).
Ежегодно во всем мире производится около 771 миллиона тонн аргона.
Аргон, будучи инертным газом, используется в качестве консерванта, в котором хранится оригинал Декларации независимости Соединенных Штатов, чтобы защитить его от разложения!
Здесь, в Kidadl, мы тщательно подготовили множество интересных семейных фактов, которые понравятся всем! Если вам понравились наши предложения по 15 фактам об аргоне, которые необходимо знать, которые проливают свет на этот благородный газ! тогда почему бы не взглянуть на «Почему бородатые агамы машут?» Удивительные факты, которые должны знать все владельцы, или Кит эпохи: почему киты прорываются и выпрыгивают из воды?
химия для детей: элементы – аргон
Калий —> |
Аргон – третий элемент восемнадцатого столбца таблицы периодов. Классифицируется как благородный газ . У атома аргона 18 электронов и 18 протонов. Его внешняя оболочка заполнена восемью электронами.
Характеристики и свойства
В стандартных условиях аргон – это газ без запаха и цвета. Это также инертный газ, что означает, что он обычно не вступает в реакцию с другими элементами с образованием соединений.
Когда аргон возбуждается электрическим полем высокого напряжения, он светится фиолетовым цветом.
Было обнаружено, что аргон образует одно нейтральное соединение с фтором и водородом, называемое фторгидридом аргона (HArF). Однако это соединение стабильно только при очень низких температурах (-256 градусов C).
Однако это соединение стабильно только при очень низких температурах (-256 градусов C).
Где на Земле находится аргон?
Аргон – самый распространенный из благородных газов на Земле. атмосфера . Он составляет около 1% (0,94%) от объема воздуха, что делает его третьим по распространенности элементом в воздухе после азота и кислорода. Аргон также находится в небольших количествах в земной коре и океанских водах.
Аргон обычно получают из жидкого воздуха в качестве побочного продукта производства азота и кислорода.
Как сегодня используется аргон?
Поскольку аргон является наиболее распространенным и дешевым из благородных газов, его часто используют, когда требуется инертный газ. Одно из основных применений аргона – это газ в лампах накаливания. Поскольку аргон не вступает в реакцию с нитью накала, используемой в лампах, даже при высоких температурах, он помогает нити прослужить дольше и предохраняет стекло колбы от почернения.
Аргон также используется для сварки, медицинских инструментов, консервирования вина, теплоизоляции окон и в микроэлектронике.
Как это было обнаружено?
Английский химик Генри Кавендиш был первым ученым, который показал, что воздух содержит другие газы, кроме азота, кислорода и углекислого газа. Однако ему не удалось выяснить или выделить другой элемент.
В 1894 году английский ученый лорд Рэлей и шотландский химик сэр Уильям Рамзи начали проводить эксперименты с другими газами в воздухе. В конце концов они открыли аргон, а также большинство других благородных газов.
Откуда аргон получил свое название?
Название аргон происходит от греческого слова «аргос», означающего «ленивый» или «бездействующий».
Изотопы
У аргона есть три стабильных изотопа, включая аргон-36, 38 и 40. Несомненно, большая часть (более 99%) аргона, встречающегося в природе на Земле, составляет аргон-40. Самый распространенный изотоп аргона во Вселенной создается звездами – это аргон-36.
Интересные факты об аргоне
Подробнее об элементах и периодической таблице
Элементы
Периодическая таблица
| Щелочных металлов Литий Натрий Калий Переходные металлы | Постпереходные металлы Алюминий Галлий Полагать Вести Металлоиды Неметаллы | Галогены Фтор Хлор Йод Благородные газы Лантаноиды и актиниды |
Другие предметы химии
| Иметь значение Атом Молекулы Изотопы Твердые вещества, жидкости, газы Плавление и кипячение Химическая связь Химические реакции Радиоактивность и радиация | Смеси и Компаунды Именование соединений Смеси Разделение смесей Решения Кислоты и основания Кристаллы Металлы Соли и мыло Воды | Другой Глоссарий и термины Химическое лабораторное оборудование Органическая химия Известные химики |
Universal Industrial Gases, Inc.
 .. Свойства аргона, аргона, применение, применение Universal Industrial Gases, Inc… Свойства аргона Ar, использование, применение – газ
и жидкость
.. Свойства аргона, аргона, применение, применение Universal Industrial Gases, Inc… Свойства аргона Ar, использование, применение – газ
и жидкость Аргон (Ar) Свойства, Использование,
Приложения
Аргон Газовый и жидкий аргон
| Интересные факты | Физические свойства | Приложения и использование |
| Интересные факты и информация об аргоне (Ar): |
Аргон (Ar) является одноатомный, бесцветный, без запаха, вкуса и нетоксичный газ , присутствующий в
атмосферу при концентрации чуть менее 1% (0,934%) по объему. Аргон относится к особой группе газов, известных как редкие, благородные или инертные газы. Другими газами этой группы являются гелий, неон, криптон, ксенон и радон. Это одноатомные газы с полностью заполненная внешняя оболочка электронов. Термины «благородный» и «инертные» используются для обозначения того, что их способность химически взаимодействовать с другими материалами крайне слабо. Все члены этой группы излучают свет при электрическом возбуждении. Аргон дает бледный сине-фиолетовый свет.нормальное кипение аргона точка очень холодная 302,6F (185,9C), которая находится между температуры кипения азота и кислорода, двух основных составляющих воздуха. Газ примерно В 1,4 раза тяжелее воздуха и мало растворим в воде. Аргона температура замерзания всего на несколько градусов ниже, чем его нормальная температура кипения, 308,8F (199.3С). Аргон ценится за его полную инертность ,
особенно при высоких температурах. Аргон самый обилие действительно инертных или «редких» газов. Производится, как
коммерческий продукт, большинство
обычно в сочетании с производством кислорода высокой чистоты с использованием криогенная перегонка
воздуха.
Поскольку температура кипения аргона очень близка к температуре кипения кислорода (а
разница всего 5.3F
или 2,9C), отделяя чистый аргон от кислорода (при этом также достигая высокой
восстановление обоих продуктов) требует многих стадий дистилляции. Аргон может обозначаться как «PLAR» (чистая жидкость аргон) или “CLAR” (сырой жидкий аргон), или его химическое обозначение «Ar». Сырой аргон обычно рассматривается как промежуточный продукт на установке, производящей чистый аргон, но он может быть конечным продуктом для некоторых воздухоразделительных установок меньшей производительности, которые отправляют его в более крупные установки для окончательной очистки. Некоторое количество неочищенного аргона также продается как конечный продукт для применений, не требующих аргона высокой чистоты (например, некоторые сталеплавильное и сварочное производство). Коммерческий
количество аргона также может быть получено в сочетании с
производство аммиака. Воздух является основным источником аргона,
но в традиционном процессе производства аммиака “Kellogg” путь к аргону
восстановление совсем другое. Аргон можно восстановить и очистить с помощью продувочный газ
поток в качестве исходного газа. Требуется несколько шагов. Первый,
аммиак удаляют и извлекают, затем водород
удаляется и рециркулируется в сырье синтез-газа для процесса получения аммиака
повысить общую эффективность процесса. Большинство новых установок по производству аммиака не используют воздух в качестве прямой подачи аммиака.
производственный процесс . Вместо этого они сначала обрабатывают его через воздухоразделительную установку, с
аргон удаляется перед контуром синтеза аммиака. Высокий
исходные потоки чистого кислорода и азота, получаемые при разделении воздуха
установки по отдельности подаются на производство водорода и аммиака
производственные части завода по производству аммиака. Этот новый аммиак
производственный подход позволяет избежать накопления аргона в контуре синтеза аммиака,
и позволяет прямо извлекать аргон как ценный побочный продукт. |
| Свойства: |
| Английские единицы | Нормальная температура кипения (1 атм) | Свойства газовой фазы при 32F и при 1 атм | Свойства жидкой фазы @ B P& @ 1 атм | Тройная точка | Критическая точка | |||||||||
Темп.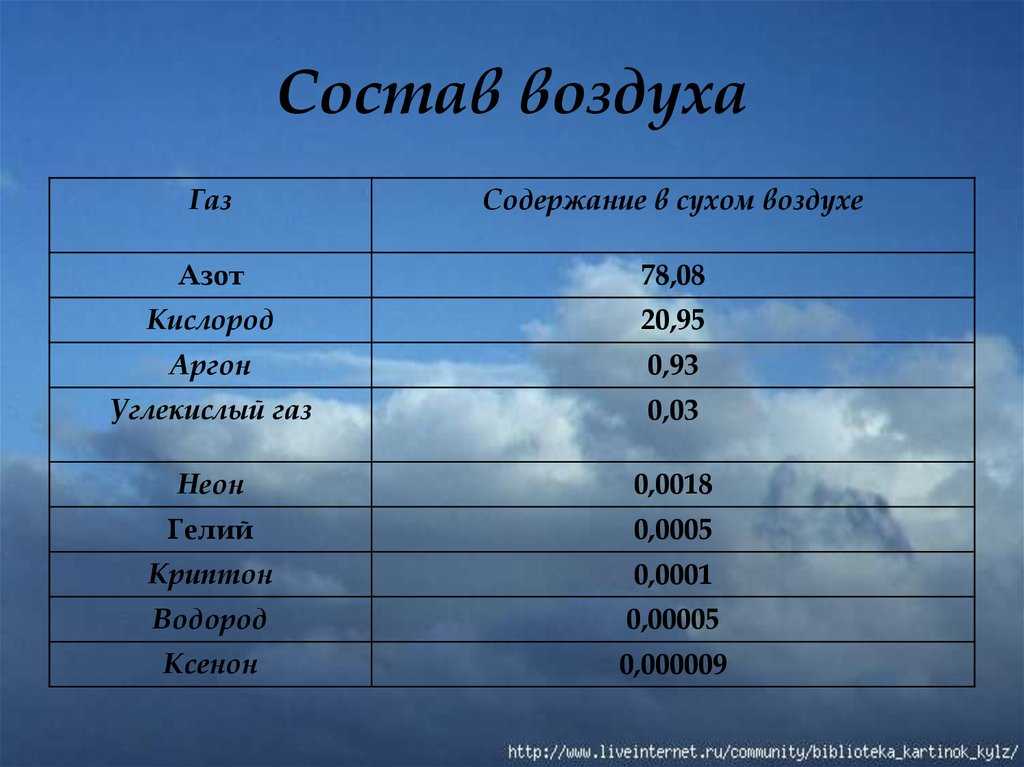 | Скрытый Теплота испарения | Удельный вес | Удельная теплоемкость (Cp) | Плотность | Удельный вес | Удельная теплоемкость (Cp) | Темп. | Давление | Темп. | Давление | Плотность | |||
| Вещество | Химический Символ | Мол. Вес | Ф | БТЕ/фунт | Воздух = 1 | БТЕ/фунт Ф | фунт/куб. футов футов | Вода = 1 | БТЕ/фунт F | Ф | пси | Ф | пси | фунт/куб. фут |
| Аргон | Ар | 39,95 | -302,6 | 69,8 | 1,39 | 0,125 | 0,11135 | 1,4 | 0,2575 | -308,8 | 9,99 | -188,1 | 711,5 | 33,44 |
| Метрические единицы | Температура кипения при 101,325 кПа | Свойства газовой фазы при 0°C и при 101,325 кПа | Свойства жидкой фазы при B.  P. и при 101,325 кПа P. и при 101,325 кПа | Тройная точка | Критическая точка | |||||||||
| Темп. | Скрытый Теплота испарения | Удельный вес | Удельная теплоемкость (Cp) | Плотность | Удельный вес | Удельная теплоемкость (Cp) | Темп. | Давление | Темп. | Давление | Плотность | |||
| Вещество | Химический Символ | Мол. Вес | С | кДж/кг | Воздух = 1 | кДж/кг С | кг/м3 | Вода = 1 | кДж/кг С | С | кПа абс. | С | кПа абс. | кг/м3 |
| Аргон | Ар | 39,95 | -185,9 | 162,3 | 1,39 | 0,523 | 1,7837 | 1.40 | 1,078 | -189,3 | 68,9 | -122,3 | 4905 | 535,6 |
| Аргон (Ар) Приложения и использование: |
| Многопрофильное использование аргона: Аргон является наиболее распространенным и наименее
дорогой, действительно инертный газ. Чистый аргон и аргон, смешанный с различными другие газы, используется в качестве защитного газа при сварке TIG («вольфрамовый инертный газ» или газовая вольфрамовая дуговая сварка), в которой используется неплавящийся вольфрамовый электрод. электродом, а в MIG («металлический инертный газ», также называемый газовой металлической дугой). сварка или сварка с подачей проволоки), в которой используется подача расходуемой проволоки электрод. Функция защитного газа заключается в защите электрода и сварочной ванны от окислительного действия воздуха. Чистый аргон часто используется с алюминием. Смесь аргона и углекислого газа часто используется для сварки MIG обычной конструкционной стали. При плазменно-дуговой резке и плазменно-дуговой сварке используется плазменный газ (аргон и водород)
для обеспечения очень высокой температуры при использовании специальной горелки. Металлы Использование аргона в производстве: Когда сталь производится в конвертере, кислород и аргон вдуваются в расплавленный металл. Добавление аргона снижает потери хрома, а желаемое содержание углерода достигается при более низкой температуре. Аргон используется в качестве продувочного газа при производстве стали более высокого качества, чтобы избежать образования нитридов. Аргон также используется в качестве защитного газа при литье и перемешивании. ковшей. Аргон используется в алюминии производство в помощь дегазация и удаление растворенного водорода и твердых частиц из расплавленный алюминий. Аргон это используется в качестве инертного газа при производстве титана, чтобы избежать окисления и реакция с азотом (титан — единственный металл, который горит в атмосфера 100% азота). Аргон
используется в производстве циркония. Использование аргона в производстве и строительстве: Аргон используется в качестве газа-наполнителя в люминесцентные и лампы накаливания. Это исключает кислород и другие химически активные вещества. газы и снижает скорость испарения (скорость сублимации) вольфрамовой нити, тем самым обеспечивая более высокую температуру нити. Самая распространенная из смесей 93% аргона и 7% азота при давлении 70 кПа (10,15 фунт/кв. дюйм изб.). Используется в качестве газа-наполнителя между стеклянные панели высокоэффективных стеклопакетов, так как они не только сухие и бесцветный, но относительно тяжелый газ, минимизирующий теплопередачу между панелями за счет уменьшения скорости конвективного движения газа-наполнителя между стеклянные панели в окне. Использование в электронике: Аргон используется с метаном в качестве газа-наполнителя,
и в качестве защитного инертного газа высокой чистоты при производстве кристаллов кремния и германия. Использование продуктов питания и напитков: Аргон используется в виноделии для вытеснения кислорода в бочках и, таким образом, предотвращения образование уксуса. Точно так же он используется в ресторане, баре и домашние винные раздатчики, позволяющие хранить открытые бутылки без деградация содержимого. Здоровье Уход Использование: Аргон используется для выполнения точных
криохирургия, которая представляет собой использование сильного холода для выборочного разрушения
небольшие участки пораженной или аномальной ткани, особенно на коже.
На объекте создается очень холодный аргон путем контролируемого расширения аргона.
газа, и направляется к месту лечения с помощью криоиглы. Это обеспечивает
лучший контроль над процессом, чем в более ранних методах с использованием жидкости
азот. Разное использование: Аргон Используется для создания защитной атмосферы для старых документов, чтобы предотвратить их деградация при хранении и при отображении. |
| Аргон: данные по безопасности материала Листы и сопутствующая информация: |
Свойства, приложения и использование прочих промышленных газов: |
Информация о технологии, Оптимизация поставок продукции, заводы и услуги UIG: |
| Разделение воздуха Технологии | Поставка продукта и доставка | УИГ Заводы и услуги | УИГ Новый Предложения растений | УГГ
На месте Газоснабжение |
Universal Industrial Gases, Inc.
ООО «Универсал Крио Газ»
3001 Emrick Blvd, Suite 320
Вифлеем, Пенсильвания 18020, США
Телефон (610) 559-7967 Факс (610) 515-0945
Все материалы, содержащиеся здесь, защищены авторскими правами, 2003 г. / 2016 УИГ.
Ваш браузер не поддерживает сценарий
Группа 18: Свойства нобелевских газов
Благородные газы (группа 18) расположены в крайней правой части периодической таблицы и ранее назывались «инертными газами» из-за того, что их заполненные валентные оболочки (октеты) делают их крайне нереакционноспособными. Благородные газы были охарактеризованы относительно поздно по сравнению с другими группами элементов.
Благородные газы были охарактеризованы относительно поздно по сравнению с другими группами элементов.
История
Первым, кто открыл благородные газы, был Генри Кавендиш в конце 180 века. Кавендиш выделил эти элементы, удалив химическим путем весь кислород и азот из сосуда с воздухом. Азот окисляли до \(NO_2\) электрическими разрядами и поглощали раствором едкого натра. Затем оставшийся кислород удаляли из смеси с помощью поглотителя. Эксперимент показал, что 1/120 часть объема газа осталась непрореагировавшей в сосуде. Вторым человеком, изолировавшим, но не типизировавшим их, был Уильям Фрэнсис (1855-1919 гг.).25). Фрэнсис заметил образование газа при растворении урановых минералов в кислоте.
Аргон
В 1894 году Джон Уильям Струтт обнаружил, что химически полученный чистый азот менее плотный, чем азот, выделенный из проб воздуха. Из этого прорыва он сделал вывод, что в воздухе присутствует другой неизвестный газ. С помощью Уильяма Рамзи Струтту удалось воспроизвести и изменить эксперимент Кавендиша, чтобы лучше понять инертный компонент воздуха в его первоначальном эксперименте. Процедура исследователей отличалась от процедуры Кавендиша: они удаляли кислород, реагируя с медью, и удаляли азот, реагируя с магнием. Оставшийся газ был должным образом охарактеризован, и новый элемент был назван «аргон», что происходит от греческого слова «инертный».
Процедура исследователей отличалась от процедуры Кавендиша: они удаляли кислород, реагируя с медью, и удаляли азот, реагируя с магнием. Оставшийся газ был должным образом охарактеризован, и новый элемент был назван «аргон», что происходит от греческого слова «инертный».
Гелий
Гелий был впервые обнаружен в 1868 году, проявляя себя в солнечном спектре в виде ярко-желтой линии с длиной волны 587,49 нанометров. Это открытие сделал Пьер Янсен. Янсен изначально предположил, что это натриевая линия. Однако более поздние исследования сэра Уильяма Рамзи (который выделил гелий на Земле путем обработки различных редких элементов кислотами) подтвердили, что ярко-желтая линия в его эксперименте совпадает с линией в спектре Солнца. Исходя из этого, британский физик Уильям Крукс идентифицировал этот элемент как гелий.
Неон, Криптон, Ксенон
Эти три инертных газа были открыты Моррисом У. Трэверсом и сэром Уильямом Рамзи в 1898 году. Рамзи открыл неон, охладив образец воздуха до жидкой фазы, нагрев жидкость и уловив газы. как они отварились. В ходе этого процесса также были обнаружены криптон и ксенон.
как они отварились. В ходе этого процесса также были обнаружены криптон и ксенон.
Радон
В 1900 году, изучая цепочку распада радия, Фридрих Эрнс Дорн открыл последний газ в группе 18: радон. В своих экспериментах Дорн заметил, что соединения радия выделяют радиоактивный газ. Первоначально этот газ был назван нитоном в честь латинского слова «сияющий» — «nitens». В 1923 марта Международный комитет по химическим элементам и Международный союз чистой прикладной химии (IUPAC) решили назвать этот элемент радоном. Все изотопы радона радиоактивны. Радон-222 имеет самый длинный период полураспада – менее 4 дней и является продуктом альфа-распада радия-226 (часть цепочки радиоактивного распада U-238 в Pb-206).
Электронные конфигурации благородных газов
| Атомный номер | Атомная масса | Температура кипения (К) | Температура плавления (К) | 1-я ионизация (E/кДж моль -1 ) | Плотность (г/дм 3 ) | Атомный радиус (пм) | |
|---|---|---|---|---|---|---|---|
| Он | 2 | 4. 003 003 | 4.216 | 0,95 | 2372,3 | 0,1786 | 31 |
| Не | 10 | 20.18 | 27,1 | 24,7 | 2080.6 | 0,9002 | 38 |
| Ар | 18 | 39,948 | 87,29 | 83,6 | 1520. 4 4 | 1,7818 | 71 |
| Кр | 36 | 83,3 | 120,85 | 115,8 | 1350.7 | 3.708 | 88 |
| Хе | 54 | 131,29 | 166,1 | 161,7 | 1170.4 | 5,851 | 108 |
| Р-н | 86 | 222,1 | 211,5 | 202,2 | 1037. 1 1 | 9,97 | 120 |
Атомные и физические свойства
Для ковалентно связанных двухатомных и многоатомных газов теплоемкость возникает в результате возможных поступательных, вращательных и колебательных движений. Поскольку одноатомные газы не имеют связей, они не могут поглощать тепло в виде колебаний связи. Поскольку центр масс одноатомных газов находится в ядре атома, а масса электронов пренебрежимо мала по сравнению с ядром, кинетическая энергия, обусловленная вращением, пренебрежимо мала по сравнению с кинетической энергией поступательного движения (в отличие от многоатомные молекулы, в которых вращение ядер вокруг центра масс молекулы вносит значительный вклад в теплоемкость). Следовательно, внутренняя энергия на моль одноатомного благородного газа равна его поступательному вкладу, \(\frac{3}{2}RT\), где \(R\) – универсальная газовая постоянная, а \(T\) – абсолютная температура.
Следовательно, внутренняя энергия на моль одноатомного благородного газа равна его поступательному вкладу, \(\frac{3}{2}RT\), где \(R\) – универсальная газовая постоянная, а \(T\) – абсолютная температура.
Для одноатомных газов при данной температуре средняя кинетическая энергия из-за поступательного движения практически одинакова независимо от элемента. Поэтому при данной температуре чем тяжелее атом, тем медленнее движутся его газообразные атомы. Средняя скорость одноатомного газа уменьшается с увеличением молекулярной массы, и, учитывая упрощенную ситуацию с теплоемкостью, теплопроводность благородных газов уменьшается с увеличением молекулярной массы.
Применение благородных газов
Гелий
Гелий используется в качестве компонента дыхательных газов из-за его низкой растворимости в жидкостях или липидах. Это важно, потому что другие газы поглощаются кровью и тканями тела, когда они находятся под давлением во время подводного плавания. Из-за пониженной растворимости гелий проникает в клеточные мембраны в небольшом количестве; при замещении им части дыхательной смеси гелий вызывает уменьшение наркотического действия газа на больших глубинах. Уменьшение количества растворенного газа в организме означает, что образуется меньше пузырьков газа, что снижает давление при всплытии. Гелий и Аргон используются для защиты сварочной дуги и окружающего основного металла от атмосферы.
Уменьшение количества растворенного газа в организме означает, что образуется меньше пузырьков газа, что снижает давление при всплытии. Гелий и Аргон используются для защиты сварочной дуги и окружающего основного металла от атмосферы.
Гелий используется в криогенике при очень низких температурах, в частности, для поддержания сверхпроводников (полезных для создания сильных магнитных полей) при очень низких температурах. Гелий также является наиболее распространенным газом-носителем в газовой хроматографии.
Неон
Неон имеет много распространенных и знакомых применений: неоновые огни, противотуманные фары, телевизионные прицелы, лазеры, детекторы напряжения, световые предупреждения и рекламные вывески. Наиболее популярным применением неона являются неоновые трубки, используемые в рекламе и сложных украшениях. Эти трубки наполняются неоном и гелием или аргоном под низким давлением и подвергаются электрическим разрядам. Цвет излучаемого света зависит от состава газовой смеси и от цвета стекла трубки. Чистый неон в бесцветной трубке поглощает красный свет и отражает синий свет, как показано на рисунке ниже. Этот отраженный свет известен как флуоресцентный свет.
Чистый неон в бесцветной трубке поглощает красный свет и отражает синий свет, как показано на рисунке ниже. Этот отраженный свет известен как флуоресцентный свет.
Один из многих цветов неоновых огней.
Аргон
Аргон широко применяется в электронике, освещении, производстве стекла и металла. Аргон используется в электронике в качестве защитной теплопередающей среды для сверхчистых полупроводниковых кристаллов кремния и для выращивания германия. Аргон также может наполнять люминесцентные лампы и лампы накаливания, создавая синий свет, характерный для «неоновых ламп». Используя низкую теплопроводность аргона, производители окон обеспечивают газонепроницаемость, необходимую для производства окон с двойным стеклопакетом. Этот изоляционный барьер повышает энергоэффективность окон. Аргон также создает защитный слой из инертного газа во время сварки, вымывает расплавленные металлы для устранения пористости при литье и обеспечивает бескислородную и азотную среду для отжига и прокатки металлов и сплавов.
Аргоновая плазменная лампа.
Криптон
Подобно аргону, криптон можно найти в энергосберегающих окнах. Из-за его превосходной тепловой эффективности криптон иногда выбирают для изоляции, а не аргона. Подсчитано, что 30% энергоэффективных окон, продаваемых в Германии и Англии, заполнены криптоном; в этих странах используется примерно 1,8 литра криптона. Криптон также содержится в источниках топлива, лазерах и фарах. В лазерах криптон служит регулятором желаемой оптической длины волны. Обычно его смешивают с галогеном (скорее всего, фтором) для производства эксимерных лазеров. Галогенные фары с закрытым светом, содержащие криптон, обеспечивают вдвое большую светоотдачу по сравнению со стандартными фарами. Кроме того, криптон используется в высокоэффективных лампах накаливания, которые имеют более высокую цветовую температуру и эффективность, поскольку криптон снижает скорость испарения нити накала.
Криптоновый лазер.
Ксенон
Ксенон имеет различные применения в лампах накаливания, проявке рентгеновских лучей, плазменных дисплеях (PDP) и т. д. В лампах накаливания используется ксенон, потому что можно использовать меньше энергии для получения того же светового потока, что и у обычной лампы накаливания. Ксенон также позволил получить более качественные рентгеновские лучи с меньшим количеством радиации. При смешивании с кислородом он может усиливать контраст при компьютерной томографии. Эти приложения оказали большое влияние на отрасли здравоохранения. Плазменные панели (PDP), использующие ксенон в качестве одного из заполняющих газов, могут когда-нибудь заменить большие кинескопы в телевизионных и компьютерных экранах.
д. В лампах накаливания используется ксенон, потому что можно использовать меньше энергии для получения того же светового потока, что и у обычной лампы накаливания. Ксенон также позволил получить более качественные рентгеновские лучи с меньшим количеством радиации. При смешивании с кислородом он может усиливать контраст при компьютерной томографии. Эти приложения оказали большое влияние на отрасли здравоохранения. Плазменные панели (PDP), использующие ксенон в качестве одного из заполняющих газов, могут когда-нибудь заменить большие кинескопы в телевизионных и компьютерных экранах.
Продукты ядерного деления могут включать несколько радиоактивных изотопов ксенона, которые поглощают нейтроны в активной зоне ядерных реакторов. Образование и удаление радиоактивных продуктов распада ксенона являются факторами контроля ядерных реакторов.
Радон
Радон считается второй наиболее частой причиной рака легких после курения сигарет. Тем не менее, он также имеет полезные применения в лучевой терапии, лечении артрита и купании. В лучевой терапии радон использовался в имплантируемых семенах, сделанных из стекла или золота, которые в основном использовались для лечения рака. Было сказано, что воздействие радона смягчает аутоиммунные заболевания, такие как артрит. Некоторые больные артритом пытались ограничить воздействие радиоактивной шахтной воды и радона, чтобы облегчить боль. «Радоновые курорты», такие как Бад-Гастерн в Австрии и Онсэн в Японии, предлагают терапию, при которой люди сидят от нескольких минут до нескольких часов в атмосфере с высоким содержанием радона, полагая, что низкие дозы радиации повысят их энергию.
В лучевой терапии радон использовался в имплантируемых семенах, сделанных из стекла или золота, которые в основном использовались для лечения рака. Было сказано, что воздействие радона смягчает аутоиммунные заболевания, такие как артрит. Некоторые больные артритом пытались ограничить воздействие радиоактивной шахтной воды и радона, чтобы облегчить боль. «Радоновые курорты», такие как Бад-Гастерн в Австрии и Онсэн в Японии, предлагают терапию, при которой люди сидят от нескольких минут до нескольких часов в атмосфере с высоким содержанием радона, полагая, что низкие дозы радиации повысят их энергию.
Внешние ссылки
Аргон — Энциклопедия Нового Света
Аргон (химический символ Ar , атомный номер 18) является членом семейства элементов благородных газов. Он присутствует в атмосфере Земли в количестве чуть менее одного процента (по объему), что делает его самым распространенным благородным газом на Земле.
Он присутствует в атмосфере Земли в количестве чуть менее одного процента (по объему), что делает его самым распространенным благородным газом на Земле.
Содержание
Инертность аргона является очень полезным свойством для ряда приложений. Например, он помогает защитить нити накаливания в лампах накаливания, обеспечивает инертный экран при различных видах сварки и при производстве реактивных элементов, а также обеспечивает защитное покрытие при выращивании кристаллов кремния и германия. Поскольку этот газ является плохим проводником тепла, его можно использовать для теплоизоляции энергосберегающих окон и для надувания костюмов для подводного плавания. Синие аргоновые лазеры используются в хирургии для сварки артерий, разрушения опухолей и исправления дефектов глаз. Изотоп аргон-39использовался для датирования подземных вод и отбора ледяных кернов.
Изотоп аргон-39использовался для датирования подземных вод и отбора ледяных кернов.
Возникновение
Аргон составляет 0,934 процента по объему и 1,29 процента по массе атмосферы Земли, а воздух является основным сырьем, используемым в промышленности для производства продуктов очищенного аргона. Обычно аргон выделяют методом фракционной перегонки сжиженного воздуха. Этот процесс также производит очищенный азот, кислород, неон, криптон и ксенон.
Марсианская атмосфера, напротив, содержит 1,6 процента аргона-40 и пять частей на миллион аргона-36. В 1973, космический зонд “Маринер” облет планеты Меркурий обнаружил, что Меркурий имеет очень тонкую атмосферу, содержащую 70 процентов аргона, которая, как полагают, является результатом выброса газа как продукта распада радиоактивных материалов на планете. В 2005 году зонд «Гюйгенс» также обнаружил присутствие аргона-40 на Титане, крупнейшем спутнике Сатурна. [1]
История
Аргон (от греческого слова αργός , что означает «неактивный») подозревался Генри Кавендишем в 1785 году в том, что он присутствует в воздухе. Однако он не был обнаружен до 189 года.4, когда лорд Рэлей и сэр Уильям Рамзи провели эксперимент, в котором они удалили весь кислород и азот из образца воздуха. Аргон также был обнаружен в 1882 году в ходе независимых исследований Х. Ф. Ньюолла и У. Н. Хартли. Каждый исследователь наблюдал новые линии в цветовом спектре воздуха, но не мог определить элемент, ответственный за эти линии. Аргон стал первым открытым представителем благородных газов.
Однако он не был обнаружен до 189 года.4, когда лорд Рэлей и сэр Уильям Рамзи провели эксперимент, в котором они удалили весь кислород и азот из образца воздуха. Аргон также был обнаружен в 1882 году в ходе независимых исследований Х. Ф. Ньюолла и У. Н. Хартли. Каждый исследователь наблюдал новые линии в цветовом спектре воздуха, но не мог определить элемент, ответственный за эти линии. Аргон стал первым открытым представителем благородных газов.
Примечательные характеристики
Аргон, крайне нереакционноспособный элемент, относится к ряду инертных газов в периодической таблице. Он расположен между неоном и криптоном в группе 18 (бывшая группа 8А) и расположен после хлора в третьем периоде.
Аргон бесцветен и не имеет запаха как в жидкой, так и в газообразной форме. Он инертен в большинстве условий и не образует подтвержденных стабильных соединений при комнатной температуре. О создании гидрофторида аргона (HArF) — метастабильного соединения аргона с фтором и водородом — впервые сообщили исследователи из Хельсинкского университета в 2000 году (см. Соединения ниже).
Соединения ниже).
Этот элемент также может образовывать «клатраты» (подобные клеткам молекулы) с водой, когда его атомы захвачены решеткой молекул воды. Кроме того, аргонсодержащие ионы (например, ArH + ) и комплексы в возбужденном состоянии (такие как ArF) хорошо известны. Теоретические расчеты (с помощью компьютера) показали несколько соединений аргона, которые должны быть стабильными, но пути синтеза которых в настоящее время неизвестны.
Аргон и кислород примерно одинаково растворимы в воде и в 2,5 раза более растворимы в воде, чем азот. [2]
Изотопы
Основными изотопами аргона, найденными на Земле, являются 40 Ar, 36 Ar и 38 Ar. В природе 40 K (калий-40), с периодом полураспада 1,250×10 9 лет, распадается до стабильного 40 Ar (11,2%) путем захвата электронов и испускания позитронов, а также превращается в стабильный 40 Ca (88,8%) через бета-распад. Эти свойства и соотношения используются для определения возраста горных пород.
Эти свойства и соотношения используются для определения возраста горных пород.
В атмосфере Земли 39 Ar образуется в результате активности космических лучей, в основном с 40 Ar. В подземной среде аргон также производится за счет захвата нейтронов 39 К или альфа-излучение кальция. 37 Ar образуется при распаде 40 Ca в результате подземных ядерных взрывов. Период полувыведения составляет 35 дней.
Соединения
Чрезвычайная инертность аргона и других благородных газов объясняется электронной структурой их атомов. Атом каждого из этих элементов имеет набор из восьми электронов («октет») в самой внешней оболочке, что придает атому стабильность и делает его устойчивым к связыванию с другими элементами.
До 1962 года считалось, что благородные газы совершенно не способны образовывать какие-либо соединения. Однако с тех пор были синтезированы соединения более тяжелых благородных газов. В 2000 году исследователи из Хельсинкского университета образовали первые соединения аргона. При освещении ультрафиолетовым светом замороженного аргона, содержащего небольшое количество фтористого водорода, образовывался гидрофторид аргона (HArF). [3] Было обнаружено, что он стабилен до температуры 40 кельвинов.
При освещении ультрафиолетовым светом замороженного аргона, содержащего небольшое количество фтористого водорода, образовывался гидрофторид аргона (HArF). [3] Было обнаружено, что он стабилен до температуры 40 кельвинов.
Приложения
Газоразрядная трубка, заполненная аргоном, ярко светится при пропускании через нее электрического тока.
Сноски
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
Внешние ссылки
Все ссылки получены 5 ноября 2021 г.
| Номера E | ||
|---|---|---|
| Красители (E100-199) • Консерванты (E200-299) • Антиоксиданты и регуляторы кислотности (E300-399) • Загустители, стабилизаторы и эмульгаторы (E400-499) • Регуляторы pH и агенты, предотвращающие слеживание (E500-59)9) • Усилители вкуса (E600-699) • Разное (E900-999) • Дополнительные химические вещества (E1100-1599) | ||
Восков (E900-909). агенты (E990-999) агенты (E990-999) | ||
| Аргон (Е938) • Гелий (Е939) • Дихлордифторметан (Е940) • Азот (Е941) • Закись азота (Е9)42) • Бутан (E943a) • Изобутан (E943b) • Пропан (E944) • Кислород (E948) • Водород (E949) | ||
Авторы
Энциклопедия Нового Света авторов и редакторов переписали и дополнили статью Википедии в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Кредит должен соответствовать условиям этой лицензии, которая может ссылаться как на Энциклопедия Нового Света участников и самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в New World Encyclopedia :
Примечание. На использование отдельных изображений, лицензированных отдельно, могут распространяться некоторые ограничения.
На использование отдельных изображений, лицензированных отдельно, могут распространяться некоторые ограничения.
Аргон (произносится как /ˈɑrgɒn/) — химический элемент, обозначаемый символом Ar . Дополнительные рекомендуемые знания
Характеристики Аргон имеет примерно такую же растворимость в воде, как газообразный кислород, и в 2,5 раза более растворим в воде, чем газообразный азот. Хотя аргон является инертным газом, было обнаружено, что он способен образовывать некоторые соединения. Например, исследователи Хельсинкского университета в 2000 г. сообщили о создании гидрофторида аргона (HArF), метастабильного соединения аргона с фтором и водородом. в настоящее время ограничены HArF, аргон может образовывать клатраты с водой, когда его атомы захвачены решеткой молекул воды. [2] Также аргонсодержащие ионы, напр. ArH+ и комплексы в возбужденном состоянии, например АрФ хорошо известны. Теоретические расчеты на компьютерах показали несколько соединений аргона, которые должны быть стабильными, но пути синтеза которых в настоящее время неизвестны. История Аргон (греч. αργόν означает «ленивый» в связи с его химической неактивностью) [3] [4] [5] не обнаружено до 1894 лорда Рэлея и сэра Уильяма Рамзи в эксперименте, в котором они удалили весь кислород и азот из образца воздуха. ПриложенияСуществует несколько различных причин, по которым аргон используется в конкретных приложениях: Другие инертные газы, вероятно, также подходят для большинства этих применений, но аргон намного дешевле. Аргон недорогой, поскольку он является побочным продуктом производства жидкого кислорода и жидкого азота, которые используются в больших промышленных масштабах. Следующей наиболее распространенной причиной использования аргона является его низкая теплопроводность. Используется для теплоизоляции в энергосберегающих окнах. Аргон также используется из-за особого способа его ионизации и излучения света. Он используется в плазменных шарах и калориметрии в экспериментальной физике элементарных частиц. Синие аргоновые лазеры используются в хирургии для сваривания артерий, разрушения опухолей и исправления дефектов глаз. [11] В микроэлектронике для распыления используются ионы аргона. Наконец, есть ряд различных применений. Аргон-39, с периодом полураспада 269 лет, использовался для ряда приложений, в первую очередь для датирования ледяных кернов и грунтовых вод. Соотношение аргон-40/калий-40 используется при датировании магматических пород. Процедуры криохирургии, такие как криоабляция, используют сжиженный аргон для разрушения раковых клеток. В хирургии он используется в процедуре, называемой «коагуляция с усилением аргоном», которая представляет собой форму электрохирургии с помощью аргонно-плазменного луча. ВозникновениеАргон составляет 0,934% по объему и 1,29% по массе атмосферы Земли, а воздух является основным сырьем, используемым в промышленности для производства продуктов очищенного аргона. Аргон выделяют из воздуха путем фракционирования, чаще всего путем криогенной фракционной перегонки — процесса, в ходе которого также получают очищенный азот, кислород, неон, криптон и ксенон. [13] Марсианская атмосфера, напротив, содержит 1,6% аргона-40 и 5 частей на миллион аргона-36. Облет планеты Меркурий космическим зондом “Маринер” в 19 г.73 обнаружил, что Меркурий имеет очень тонкую атмосферу с 70% аргона, которая, как полагают, является результатом выброса газа как продукта распада радиоактивных материалов на планете. В 2005 году зонд Huygens также обнаружил присутствие аргона-40 на Титане, крупнейшем спутнике Сатурна. СоединенияПолный октет электронов аргона указывает на полные подоболочки s и p. Этот полный внешний энергетический уровень делает аргон очень стабильным и чрезвычайно устойчивым к связыванию с другими элементами. До 1962, аргон и другие благородные газы считались химически инертными и неспособными образовывать соединения; однако с тех пор были синтезированы соединения более тяжелых благородных газов. В августе 2000 года исследователи из Хельсинкского университета образовали первые соединения аргона. При освещении ультрафиолетовым светом замороженного аргона, содержащего небольшое количество фтористого водорода, образовывался гидрофторид аргона (HArF). [15] Стабилен до 40 кельвинов (-233 °C). Открытие дифторида аргона (ArF 2 ) был объявлен в 2003 году. Но это не подтверждено и, скорее всего, неверно. Изотопы Основными изотопами аргона, обнаруженными на Земле, являются 40 Ar (99,6%), 36 Ar (0,34%) и 38 Ar (0,06%). В атмосфере Земли 39 Ar образуется под действием космических лучей, в основном с 40 Ar. В подземной среде он также образуется в результате захвата нейтронов 39 К или альфа-излучения кальцием. 37 Ar образуется при распаде 40 Ca в результате подземных ядерных взрывов. Период полувыведения составляет 35 дней. [16] Потенциальные опасности Хотя аргон нетоксичен, он не удовлетворяет потребности организма в кислороде и является простым удушающим средством. Люди по ошибке задохнулись, вдыхая аргон. 9 Миддо, Джон; Бледсо, Гэри. Дополнительная литература | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Эта статья находится под лицензией GNU Free Documentation License. Он использует материал из статьи Википедии «Аргон». Список авторов есть в Википедии. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Символ, Открытие, Свойства, Факты, Использование
Что такое аргон?
Аргон — это химический элемент, инертный или благородный газ группы 18 периодической таблицы с символом Ar и атомным номером 18. Это самый распространенный благородный газ, который широко используется в металлургии и других отраслях промышленности из-за его низкой цены. Из-за заполненной орбитали валентной оболочки степень окисления или состояние аргона равно нулю, а энергия ионизации очень высока.
Это бесцветный одноатомный газ без запаха и вкуса, который встречается в количестве 93 частей на миллион по объему в сухом воздухе и 4 × 10 −2 частей на миллион по весу в изверженных породах.
Название более легкого газа, аргона, происходит от греческого слова Аргос, означающего холостой ход. В твердом состоянии он образует гранецентрированную кубическую кристаллическую решетку.
Аргон в периодической таблице
Аргон находится в p-блоке периодической таблицы вместе с другими благородными газами, такими как гелий, неон, криптон, ксенон и радон.
Открытие аргона
Он был открыт почти через сто лет после наблюдения английского естествоиспытателя и ученого Генри Кэндэвиса. Он заметил, что проба воздуха всегда оставляет небольшой остаток, составляющий около 1/120 части инертных газов, после многократного искрообразования кислородом воздуха.
Британский ученый лорд Рэлей заметил, что азот, выделенный из атмосферных газов, примерно на 0,5 процента тяжелее азота, полученного химическим путем. Он определил новый элемент (аргон = холостой ход) в остатке, оставшемся после нагревания атмосферного азота с магнием.
Сэр Уильям Рамсей предположил, что гелий и аргон принадлежат к новой группе (группе нуль) в периодической таблице.
При спектроскопическом анализе остаточного газа был получен новый характеристический электромагнитный спектр. Британский ученый лорд Рэлей был удостоен Нобелевской премии по физике за исследование плотности газа и открытие аргона.
Сэр Уильям Рамзи получает благородную премию по химии за открытие инертного газа в воздухе и его место в периодической таблице.
Изотопы
Это самый распространенный благородный газ в воздухе, 93 ppm в сухом воздухе, в изверженных породах он присутствует в количестве 4 × 10 −2 по весу.
Природный аргон представляет собой смесь изотопов, таких как 40 Ar (99,6 процента), 36 Ar (0,063 процента) и 36 Ar (0,337 процента). 40 Ar, полученный ядерной реакцией или реакцией электронного захвата 40 K.
Свойства аргона
Самый распространенный инертный газ Ar имеет электронную конфигурацию валентной оболочки [Ne] 3s 2 3p 6 и отношение теплоемкости (Cp/Cv), близкое к 1,66 .
| Аргон | |||
| Символ | Ар | ||
| Дискавери | Лорд Рэлей и сэр Уильям Рамзи в 1894 году | ||
| Название производное от | Греческое слово argos означает праздный | ||
| Обычный изотоп | 18 Ар 40 | ||
| Степени окисления | 0 | ||
| Номер CAS | 7440-37-1 | ||
| Периодические свойства | |||
| Атомный номер | 18 | ||
| Относительная атомная масса | 39,948 | ||
| Электрон на ячейку | 2, 8, 8 | ||
| Электронная конфигурация | [Ne] 3s 2 3p 6 | ||
| Блок | р-блок | ||
| Группа | 18 | ||
| Период | 3 | ||
| Физические свойства | |||
| Состояние при 20 °C | Газ | ||
| Температура плавления | –189,34 °С, –308,81 °F, 83,81 К | ||
| Точка кипения | –185,85°С, –302,53°F, 87,30 К | ||
| Молярная теплоемкость | 20,85 Дж моль −1 К − 1 | ||
| Кристаллическая структура | гранецентрированная кубическая (ГЦК) | ||
| Плотность | 0,001633 г/см 3 | ||
| Критическая температура | 150,69 К | ||
| Атомные свойства | |||
| Атомный радиус (несвязанный) | 1,88 Å | ||
| Ковалентный радиус | 1,01 Å | ||
| Электроотрицательность | неизвестно | ||
| Сродство к электрону | неизвестно | ||
| Энергия ионизации (кДж/моль) | 1-й | 2-й | 3-й |
1520. 57 57 | 2665,86 | 3930.81 | |
Факты об аргоне
Химический состав аргона или других инертных газов отличается от других элементов периодической таблицы из-за их заполненной конфигурации валентной оболочки.
Для продвижения электронов на следующие доступные орбитали требуется очень большая энергия. Факты говорят о том, что ковалентная связь в Ar весьма неблагоприятна.
Ионные соединения с наиболее электроотрицательным фтором маловероятны из-за высокой положительной энтропии и свободной энергии для образования такой химической связи. Следовательно, истинные химические соединения Ar неизвестны.
Химические соединения
Единственные клатраты или каркасные соединения аргона, образованные парахинолом и водой. Молекула благородного газа захватывается полостями, образованными кристаллом хинола, через сеть водородных связей.
Вода и цеолит также образуют такие типы клатратных соединений с молекулой Ar. Эти соединения не называются истинными химическими соединениями, так как между молекулой газа и хинолом или водой действуют слабые силы Ван-дер-Ваальса.
Эти соединения не называются истинными химическими соединениями, так как между молекулой газа и хинолом или водой действуют слабые силы Ван-дер-Ваальса.
Для чего используется аргон?
Темы химии
Использование, изображения, характеристики, свойства, периодическая таблица
Главная | Продать предложения | Купить предложения | Поиск структуры | Поставщик аргона
18
Ар
39.948
Аргон
Аргон
Общие | Штаты | энергии | Окисление и электроны | Внешний вид и характеристики | Реакции | Соединения | Радиус | проводимость | Изобилие и изотопы
Аргон Общий
| Название: Аргон | Символ:Ар |
| Тип: Благородный газ | Атомный вес: 39,948 |
| Плотность при 293 К: 0,001784 г/см 3 | Атомный объем: 22,4 дм 3 /моль при 0 °С, 101,325 кПа. |
| Обнаруженный: Аргон был открыт в 1894 году лордом Рэлеем и сэром Уильямом Рамзи, которые стремились объяснить, почему азот из воздуха оказался тяжелее азота, выделяемого из соединений. Они обнаружили, что азот из воздуха содержит еще один газ, который почти в полтора раза плотнее азота. После выделения нового газа, первого из открытых благородных газов, ученые назвали его аргоном («неактивный») и обнаружили, что он составляет почти один процент воздуха. Рэлей сказал: «Аргон нельзя считать редким. Большой зал может легко вместить больше его веса, чем может унести человек». | |
Штаты Аргона
| Состояние (с, л, г):газ | |
| Температура плавления: 83,85 К (-189,3 ° С) | Температура кипения: 87,3 К (-185,8 ° С) |
Аргон Энерджис
| Удельная теплоемкость: 0,520 Дж/г·К | Теплота атомизации: 0 кДж моль -1 |
| Теплота плавления: 1,188 кДж моль -1 | Теплота испарения: 6,447 кДж моль -1 |
| 1 ст энергия ионизации: 1520,5 кДж моль -1 | 2 nd энергия ионизации: 2665,8 кДж моль -1 |
| 3 rd энергия ионизации: 3930,8 кДж моль -1 | Сродство к электрону: кДж моль -1 |
Окисление аргона и электроны
| Снаряды: 2,8,8 | Электронная конфигурация: [Ne] 3s 2 3p 6 |
| Минимальная степень окисления: 0 | Максимальная степень окисления: 0 |
Мин. общий номер окисления: 0 общий номер окисления: 0 | Максимум. общий номер окисления: 0 |
| Электроотрицательность (шкала Полинга): | Объем поляризуемости: 1,586 Å 3 |
Аргон Внешний вид и характеристики
| Структура: ГЦК: гранецентрированная кубическая в твердом состоянии | Цвет: Бесцветный |
| Твердость: Моос | |
| Вредное воздействие: Аргон считается нетоксичным. | |
| Характеристики: Аргон — благородный газ. Он бесцветен, не имеет запаха и крайне неактивен. Однако он не полностью инертен – фотолиз фтористого водорода в твердой матрице аргона при 7,5 Кельвина дает фторгидрид аргона, HArF. Аргон не образует устойчивых соединений при комнатной температуре. Использование: Из-за своей инертности аргон используется в лампочках для защиты нити накала и создания инертной атмосферы вблизи места сварки. Он также используется в полупроводниковой промышленности для создания инертной атмосферы для выращивания кристаллов кремния и германия. Аргон используется в медицинских лазерах, в офтальмологии, например, для исправления дефектов глаз, таких как просачивание кровеносных сосудов, отслоение сетчатки, глаукома и дегенерация желтого пятна. Аргон имеет низкую теплопроводность и используется в качестве газа между стеклами в высокоэффективных стеклопакетах с двойным и тройным остеклением. | |
Реакции с аргоном
| Реакция с воздухом: нет | Реакция с 6 М HCl: нет |
| Реакция с 15 М HNO 3 :нет | Реакция с 6 М NaOH: нет |
Соединения аргона
| Оксид (ы): нет | Хлориды: нет |
| Гидрид (ы): нет |
Аргон Радиус
| Атомный радиус: 71 пм (измерено) | Ионный радиус (1+ ион):pm |
| Ионный радиус (ион 2+):pm | Ионный радиус (ион 3+):pm |
| Ионный радиус (2- ион):pm | Ионный радиус (1- ион):pm |
Проводимость аргона
| Теплопроводность: 1,77 x 10 -2 Вт·м -1 К -1 | Электропроводность: 0 мСм см -1 |
Содержание аргона и изотопы
Содержание земной коры: 3,5 части на миллион по массе, 1,8 части на миллион по молям. | |
| Изобилие Солнечной системы: 0,01 процента по массе, 3,3 части на миллион по молям. | |
| Стоимость в чистом виде: 0,5$ за 100г. | |
| Стоимость, оптом:$ за 100г | |
| Источник: Аргон образуется, когда 40 К, естественно присутствующие в земной коре, подвергаются радиоактивному распаду до 40 Ar. Аргон уходит в атмосферу. Аргон производится в промышленных масштабах путем фракционной перегонки сжиженного воздуха с (для аргона высокой чистоты) каталитическим сжиганием оставшихся следов кислорода. | |
| Изотопы: 18, периоды полураспада которых известны, массовые числа от 30 до 47. | |




 Расследование FACE на Аляске 94AK012 (23 июня 1994 г.). «Помощник сварщика задохнулся в трубе с инертным аргоном – Аляска (FACE AK-94-012)». Департамент здравоохранения штата Аляска. Получено 29 января 2011.
Расследование FACE на Аляске 94AK012 (23 июня 1994 г.). «Помощник сварщика задохнулся в трубе с инертным аргоном – Аляска (FACE AK-94-012)». Департамент здравоохранения штата Аляска. Получено 29 января 2011.
 948
948
 Аргон используется в критически важных промышленных процессах, таких как производство
качественных нержавеющих сталей и производство чистых кристаллов кремния для
полупроводниковое производство. Аргон также используется в качестве инертного газа-наполнителя для ламп накаливания и
как сухой, тяжелее воздуха или азота наполнитель для пространства
между стеклянными панелями в высокоэффективных стеклопакетах.
Аргон используется в критически важных промышленных процессах, таких как производство
качественных нержавеющих сталей и производство чистых кристаллов кремния для
полупроводниковое производство. Аргон также используется в качестве инертного газа-наполнителя для ламп накаливания и
как сухой, тяжелее воздуха или азота наполнитель для пространства
между стеклянными панелями в высокоэффективных стеклопакетах.

 Природный газ «реформируется» с паром для получения «синтез-газа».
содержащие водород, окись углерода и двуокись углерода. “Среднее
риформинг» с воздухом и паром превращает CO в CO 2 и
дополнительный водород и добавляет азот, необходимый для производства аммиака (NH 3 ).
Смесь азота и водорода (вместе с небольшим количеством аргона)
затем сжимали до высокого давления и реагировали с помощью катализатора.
Аргон, будучи нереакционноспособным, накапливается в контуре синтеза аммиака и
он должен быть удален в потоке очистки для поддержания производственной мощности и
эффективность процесса.
Природный газ «реформируется» с паром для получения «синтез-газа».
содержащие водород, окись углерода и двуокись углерода. “Среднее
риформинг» с воздухом и паром превращает CO в CO 2 и
дополнительный водород и добавляет азот, необходимый для производства аммиака (NH 3 ).
Смесь азота и водорода (вместе с небольшим количеством аргона)
затем сжимали до высокого давления и реагировали с помощью катализатора.
Аргон, будучи нереакционноспособным, накапливается в контуре синтеза аммиака и
он должен быть удален в потоке очистки для поддержания производственной мощности и
эффективность процесса. Метан, образующийся в процессе аммиака, перерабатывается в топливо для
пламенный нагреватель, обеспечивающий тепло для производства синтез-газа
процесс. Аргон восстанавливается и очищается для продажи в коммерческих целях.
товар.
Метан, образующийся в процессе аммиака, перерабатывается в топливо для
пламенный нагреватель, обеспечивающий тепло для производства синтез-газа
процесс. Аргон восстанавливается и очищается для продажи в коммерческих целях.
товар.
 Используется там, где полностью
нужен инертный газ.
Используется там, где полностью
нужен инертный газ.

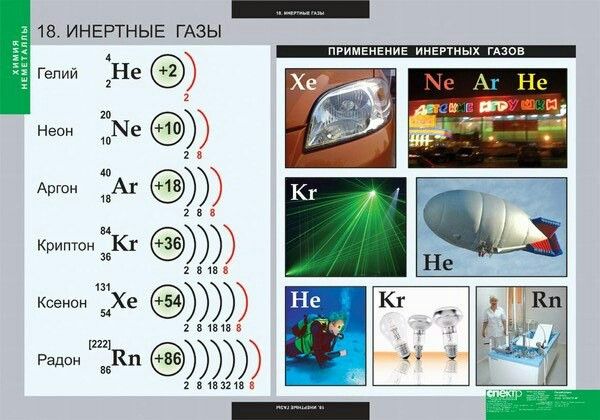 используется в полупроводниковой промышленности.
используется в полупроводниковой промышленности. Похожая методика криоаблация используется для лечения сердца.
аритмии, разрушая клетки, которые мешают нормальной
распределение электрических импульсов.
Похожая методика криоаблация используется для лечения сердца.
аритмии, разрушая клетки, которые мешают нормальной
распределение электрических импульсов. Таким образом, образование жидкостей и твердых тел более легко достижимо для этих более тяжелых элементов из-за их температур плавления и кипения.
Таким образом, образование жидкостей и твердых тел более легко достижимо для этих более тяжелых элементов из-за их температур плавления и кипения.
 J. Chem. Образовательный 1964 , 41 , 174.
J. Chem. Образовательный 1964 , 41 , 174. Wikipedia.org/wiki/XeF2
Wikipedia.org/wiki/XeF2 faidherbe.org/site/cours/dupuis/images4/xef6.gif
faidherbe.org/site/cours/dupuis/images4/xef6.gif

 3.3066
3.3066
 Аргон имеет атомный номер 18 и является третьим элементом в 18-й группе периодической таблицы (благородные газы). Аргон присутствует в атмосфере Земли в количестве чуть менее 1%, что делает его самым распространенным благородным газом на Земле. Его полная внешняя оболочка делает аргон стабильным и устойчивым к связыванию с другими элементами. Температура его тройной точки 83,8058 К является определяющей фиксированной точкой в Международной температурной шкале 19°.90.
Аргон имеет атомный номер 18 и является третьим элементом в 18-й группе периодической таблицы (благородные газы). Аргон присутствует в атмосфере Земли в количестве чуть менее 1%, что делает его самым распространенным благородным газом на Земле. Его полная внешняя оболочка делает аргон стабильным и устойчивым к связыванию с другими элементами. Температура его тройной точки 83,8058 К является определяющей фиксированной точкой в Международной температурной шкале 19°.90. Этот высокостабильный химический элемент не имеет цвета, запаха, вкуса и нетоксичен как в жидкой, так и в газообразной форме. Аргон инертен в большинстве условий и не образует подтвержденных стабильных соединений при комнатной температуре.
Этот высокостабильный химический элемент не имеет цвета, запаха, вкуса и нетоксичен как в жидкой, так и в газообразной форме. Аргон инертен в большинстве условий и не образует подтвержденных стабильных соединений при комнатной температуре. [6] Аргон также был обнаружен в 1882 году благодаря независимым исследованиям Х. Ф. Ньюолла и В. Н. Хартли. Каждый наблюдал новые линии в цветовом спектре воздуха, но не мог определить элемент, ответственный за эти линии. Аргон стал первым открытым представителем благородных газов. Символ аргона теперь Ar , но до 1957 года это было 9.0018 А . [7]
[6] Аргон также был обнаружен в 1882 году благодаря независимым исследованиям Х. Ф. Ньюолла и В. Н. Хартли. Каждый наблюдал новые линии в цветовом спектре воздуха, но не мог определить элемент, ответственный за эти линии. Аргон стал первым открытым представителем благородных газов. Символ аргона теперь Ar , но до 1957 года это было 9.0018 А . [7]  Другие инертные газы (кроме гелия) также производятся таким же образом, но аргон является наиболее обильным, так как его концентрация в атмосфере самая высокая.
Основная масса применений аргона возникает просто потому, что он инертен и относительно дешев. Аргон используется:
Другие инертные газы (кроме гелия) также производятся таким же образом, но аргон является наиболее обильным, так как его концентрация в атмосфере самая высокая.
Основная масса применений аргона возникает просто потому, что он инертен и относительно дешев. Аргон используется:
 [10] Аргон также используется в техническом подводном плавании с аквалангом для надувания сухого гидрокостюма, поскольку он инертен и имеет низкую теплопроводность.
[10] Аргон также используется в техническом подводном плавании с аквалангом для надувания сухого гидрокостюма, поскольку он инертен и имеет низкую теплопроводность. Процедура сопряжена с риском возникновения газовой эмболии у пациента и привела к смерти одного человека в результате несчастного случая такого типа. [12]
Процедура сопряжена с риском возникновения газовой эмболии у пациента и привела к смерти одного человека в результате несчастного случая такого типа. [12]  [14]
[14]  Встречающийся в природе 40 K с периодом полураспада 1,25×10 9 лет, распадается до стабильного 40 Ar (11,2%) путем захвата электронов и испускания позитронов, а также до стабильного 40 Ca (88,8%) через бета-распад. Эти свойства и соотношения используются для определения возраста горных пород. [16]
Встречающийся в природе 40 K с периодом полураспада 1,25×10 9 лет, распадается до стабильного 40 Ar (11,2%) путем захвата электронов и испускания позитронов, а также до стабильного 40 Ca (88,8%) через бета-распад. Эти свойства и соотношения используются для определения возраста горных пород. [16]  «Помощник сварщика задохнулся в инертной аргоном трубе (FACE AK-94-012)». Департамент общественного здравоохранения штата Аляска. 23 июня 1994 г. Проверено 3 сентября 2007 г.
«Помощник сварщика задохнулся в инертной аргоном трубе (FACE AK-94-012)». Департамент общественного здравоохранения штата Аляска. 23 июня 1994 г. Проверено 3 сентября 2007 г. Температуры плавления, кипения, тройной и критические температуры элементов”, Справочник CRC по химии и физике , 85-е издание, Бока-Ратон, Флорида: CRC Press.
Температуры плавления, кипения, тройной и критические температуры элементов”, Справочник CRC по химии и физике , 85-е издание, Бока-Ратон, Флорида: CRC Press.