Где содержится вольфрам: Лом вольфрама — Портал о ломе, отходах и экологии
alexxlab | 05.06.2023 | 0 | Разное
Цена, распространение, добыча и использование вольфрама
Цена, возникновение, добыча и использование вольфрама
Вольфрам [vɔlfram] является химическим элементом с символом элемента W и атомным номером 74. Он относится к переходным металлам, в периодической таблице он находится в 6. Подгруппа (группа 6) или хромовая группа. Вольфрам – это белый глянцевый тяжелый металл высокой плотности, который в чистом виде хрупок. У него самая высокая температура плавления и вторая самая высокая температура кипения среди всех чистых металлов. Поэтому его самым известным применением является лампа накаливания в лампах накаливания.
Уже в 16. Минералог Георгиус Агрикола из Фрайбергера описал наличие минерала в саксонских оловянных рудах, что значительно усложнило извлечение олова путем шлакования оловянной фракции. Название компонента “Волк” происходит от этого свойства, так как минерал “сожрал” оловянную руду как волк. Является ли это вопрос вольфрамите, является спорным, даже сегодня, когда он говорил о «легкости» минерала.
Общее слово на английском, итальянском и французском вольфрама происходит от Тун Стен (По-шведски «тяжелый камень»). Это не означало, что сам Wolfram (швед. Вольфрам), но вольфрамат кальция называется. В этом 1781 узнал немецко-шведский химик Карл Вильгельм Шееле до сих пор неизвестную соль. Чистый вольфрам был впервые произведен 1783 от испанских братьев Фаусто Хуана Хосе Эльхуяра (который работал под руководством Шееле) путем снижения уровня триоксида вольфрама, получаемого из вольфрамита.
Вхождение
Вольфрамовый металл также называют вольфрамитом
Содержание вольфрама в земной коре составляет около 0,0001 г / т или 0,0064 процента по весу (значение Кларка).
Самые крупные месторождения находятся в Китае, Перу, США, Корее, Боливии, Казахстане, России, Австрии и Португалии. Вольфрамовые руды также можно найти в Рудных горах. Безопасные и вероятные мировые месторождения в настоящее время составляют 2,9 миллиона тонн чистого вольфрама.
Наиболее важное известное место нахождения вольфрама в Европе находится в Felbertal в Высоком Тауэрне (штат Зальцбург в Австрии).
Продвижение по всему миру
В 2006 году мировое производство чистого вольфрама составило 73. 300 80 тонн. Безусловно, крупнейшим производителем вольфрама является Китай. Здесь производится более 2006% производимого в мире вольфрама. Государства с наибольшим производством вольфрама (XNUMX г.):
300 80 тонн. Безусловно, крупнейшим производителем вольфрама является Китай. Здесь производится более 2006% производимого в мире вольфрама. Государства с наибольшим производством вольфрама (XNUMX г.):
| Позиция | Земля | Поставка (в тоннах в год) |
|---|---|---|
| 1 | Китай | 62.000 |
| 2 | Русский фед. | 4.500 |
| 3 | Канада | 2.500 |
| 4 | Österreich | 1.350 |
| 5 | Португалия | 900 |
| 6 | Северная Корея | 600 |
| 7 | Боливия | 530 |
| 8 | другие страны | 900 |
Продвижение в Австрии
В Австрии шеелит вольфрамовой руды был впервые обнаружен в 1815/16 году на золотом месторождении Шельгаден в муниципалитете Мур (штат Зальцбург). В результате во многих трещинах Высокого Тауэрна были обнаружены красивые кристаллы шеелита, иногда размером несколько сантиметров. Практического применения все эти находки не имели. Крупное месторождение в Felbertal пока оставалось неоткрытым.
В результате во многих трещинах Высокого Тауэрна были обнаружены красивые кристаллы шеелита, иногда размером несколько сантиметров. Практического применения все эти находки не имели. Крупное месторождение в Felbertal пока оставалось неоткрытым.
В 1950 году стало известно, что большие количества шеелита появились в магнезитовом месторождении на Ванглальме около Ланерсбаха / Тукса (Тироль) в тылу Циллерталь, которое добывалось с 1927 года. Это крупный шеелит, сросший с магнезитом и кварцем. В последующие годы было извлечено около 10.000 1,8 тонн руды со средним содержанием оксида вольфрама 1960%, что представляет собой уникальное в мире высокое качество. Из-за низкой рыночной цены добыча вольфрама была остановлена в конце 1971-х годов, но возобновлена в 1976 году и продолжалась до закрытия магнезитовой шахты в XNUMX году.
1967 был в конечном итоге обнаружен крупнейшим шеелитворкомменом Европы в Фельбертале. Куски руды, присутствующие в потоках, были отслежены с использованием ультрафиолетового света (шеелитовые флуоресцентные лампы). Сложные геологоразведочные работы в высокогорной местности (самый высокий участок добычи на Brentling в 2100 на уровне моря) начался с 1971, изначально добыча над землей была зарегистрирована в Felbertal 1976 (из 1979 также подземная добыча, набор для добычи на поверхности 1986). С начала 1993 до середины 1995 добыча была временно приостановлена из-за низкой рыночной цены вольфрама.
Сложные геологоразведочные работы в высокогорной местности (самый высокий участок добычи на Brentling в 2100 на уровне моря) начался с 1971, изначально добыча над землей была зарегистрирована в Felbertal 1976 (из 1979 также подземная добыча, набор для добычи на поверхности 1986). С начала 1993 до середины 1995 добыча была временно приостановлена из-за низкой рыночной цены вольфрама.
Вольфрамерц из Фелбертала обрабатывается в соседнем Миттерзиле. Отсюда концентрат шеелита достигает Санкт-Мартина в Зульмтале (Штирия). Вольфрамовая хижина была построена на месте подземной шахты бурого угля 1976 в Пёльфинг-Бергла, где начиная с 1977 из концентратов нескольких стран производились оксид вольфрама, металлический вольфрам и порошок карбида вольфрама.
Наиболее важные немецкие переработчики – HC Starck и Longyear GmbH.
Извлечение и презентация
Вольфрам не может быть получен восстановлением углем из оксидных руд, поскольку образуется этот карбид вольфрама.
Добавление аммиачного раствора создает комплекс, называемый паравольфраматом аммония (APW). Его отфильтровывают, а затем преобразуют в относительно чистый триоксид вольфрама при 600 ° C. Оксид вольфрама (VI) (WO
В результате образуется серый вольфрамовый порошок, который обычно прессуется в формах и электрически спекается в стержни. При температурах выше 3400 ° C компактный металлический вольфрам можно плавить в специальных электропечах с восстановительной водородной атмосферой (процесс зонной плавки).
Eigenschaften
Физические свойства
Вольфрам – это блестящий белый металл, который можно растягивать в чистом виде, он обладает высокой твердостью, плотностью и прочностью. Плотность практически такая же, как у золота, твердость по Бринеллю 250 HB, предел прочности 550-620 Н / мм.2 (мягкий) до 1920 Н / мм 2 (жесткий). Металл существует в стабильной объемноцентрированной кубической α-модификации с шагом плоскости решетки (= постоянная решетки) 316 пм при комнатной температуре. Такой тип кристаллической структуры часто называют типом вольфрама. С как метастабильная β-модификация вольфрама (искаженное в центре кубического тела), с другой стороны, это богатый вольфрамом оксид W3O.
Металл существует в стабильной объемноцентрированной кубической α-модификации с шагом плоскости решетки (= постоянная решетки) 316 пм при комнатной температуре. Такой тип кристаллической структуры часто называют типом вольфрама. С как метастабильная β-модификация вольфрама (искаженное в центре кубического тела), с другой стороны, это богатый вольфрамом оксид W3O.
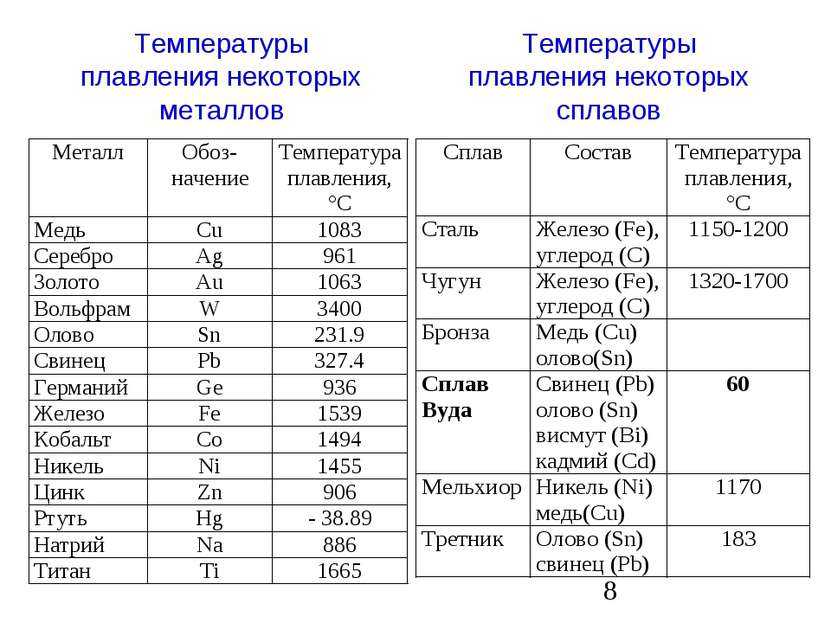
Вольфрам имеет после углерода элемента с 3422 ° C вторую по величине температуру плавления всех химических элементов. Температура кипения 5555 ° C превосходит только редкоземельный рений с 5596 ° C по 41 K.
Металл представляет собой сверхпроводник с температурой перехода 15 мК.
Химические свойства
Вольфрам является химически очень стойким металлом, который почти не подвергается воздействию плавиковой кислоты и царской водки (по крайней мере, при комнатной температуре). Растворяется в смесях плавиковой и азотной кислот и в расплавленных смесях щелочных нитратов и карбонатов.
Изотоп
Вольфрам известен как изотопы 33 и основные изомеры 5. В природе встречаются изотопы 5 180W, 182W, 183W, 184W и 186W. Изотоп вольфрама 184W имеет наибольшую частоту. Все 5 природных изотопов долгое время считались стабильными. Лишь в 2004 году эксперимент CRESST в Лаборатории националь-дель-Гран-Сассо смог доказать, что изотоп был вторичным результатом поиска темной материи. 180W подвержен альфа-распаду. Период полураспада составляет 1,8 триллиона лет, поэтому этот распад невозможно обнаружить в обычных лабораторных условиях. Радиоактивность этого природного изотопа настолько мала, что ею можно пренебречь для всех практических целей. Искусственные радиоактивные изотопы вольфрама, с другой стороны, имеют короткие периоды полураспада от 0,9 мс. 185W и 121,2 дней в 181W.
Использовать
Наиболее важным применением вольфрама является его высокая температура плавления в осветительной промышленности в качестве нити накала в лампах накаливания и в качестве электрода в газоразрядных лампах и в электронных лампах.
В лампах используется тот факт, что электрическая проводимость вольфрама значительно ниже, чем у проводящих металлов меди и алюминия. В результате тонкая вольфрамовая нить накаливания нагревается до тех пор, пока не начинает светиться, в то время как более толстые выводы из проводящих металлов почти не нагреваются.
Его второе важное значение как легирующего металла в металлургии железа. Он образует карбиды вольфрама в инструментальных сталях, которые увеличивают вторичную твердость.
Из-за высокой плотности он используется для балансировки веса и для защиты от излучения. Хотя его плотность и, следовательно, эффект экранирования, намного выше, чем у свинца, его реже используют в качестве свинца для этой цели, поскольку он дороже и сложнее в обработке. Кроме того, из-за высокой плотности вольфрама в некоторых армиях бронебойные боеприпасы используются с ядром из карбида вольфрама вместо более дешевого, но радиоактивного и токсичного обедненного урана. Во время Второй мировой войны Вольфрам был важен для строительства немецкой танковой гранаты 40, которая имела вольфрамовое ядро. В будущем для замены куницы будут использоваться боеприпасы с вольфрамовым ядром от новой бронетехники Puma.
В будущем для замены куницы будут использоваться боеприпасы с вольфрамовым ядром от новой бронетехники Puma.
Из-за его высокой коррозионной стойкости, вольфрам также может быть использован в качестве материала для оборудования на химических заводах. Однако из-за плохой обрабатываемости вольфрама (вольфрам можно сваривать только лазерным или электронным лучом), этот вариант используется редко. То же самое относится к возможному применению в области медицинской техники.
В физиологии, особенно нейрофизиологии, вольфрамовые микроэлектроды используются для внеклеточной записи.
Кроме того, электроды для сварочных процессов изготавливаются из вольфрама. Например, при контактной сварке, особенно при сварке таких материалов, как медь, бронза или латунь. Также при универсальной сварке TIG (вольфрамовым инертным газом) электрод изготавливается из вольфрама или его сплава. Эти электроды не расплавляются в процессе сварки. Дуга горит как плазма в защитном газе между электродом и компонентом. Материал наполнителя поставляется отдельно в виде стержней.
Материал наполнителя поставляется отдельно в виде стержней.
В спорте Wolfram используется для производства высококачественных стволов для дротиков, в стрельбе из лука изготовлены наконечники для специальных стрел, а головки молоткового метателя были временно изготовлены для уменьшения сопротивления воздуха, а радиус вращения также выполнен из вольфрама. Кроме того, вольфрамовые пластины используются в качестве дополнительных весов в формуле 1 для достижения предписанного минимального веса автомобилей 1 Formula (включая масло, тормоз и охлаждающую жидкость, а также водителей в гоночных комбинезонах и со шлемом) в размере 620 кг (по состоянию на: 2010). Также в парусном спорте это происходит в течение некоторого времени в кильских бомбах крупных гонщиков. Водостойкость значительно снижается благодаря большей плотности по сравнению с обычными материалами, такими как свинец или чугун. Точно так же в теннисе уже есть бандиты, в чьи карбоновые каркасные вольфрамовые волокна были включены Таким образом, определенные области рамки ракетки могут быть дополнительно стабилизированы для повышения точности игры.
При ловле нахлыстом нимфы и стримеры (приманка, ловимая под водой) утяжеляют вольфрамовыми бусинами, которые протыкают и надвигают на стержень крючка, чтобы они ныряли быстрее и глубже.
Струны музыкальных инструментов иногда наматывают вольфрамом, чтобы увеличить их вес и тем самым уменьшить высоту звука.
Вольфрам также используется в рентгеновской диагностике в качестве материала мишени для анода. В – и Линии характерного рентгеновского излучения – 59 кэВ и 67 кэВ.
В сканирующей туннельной микроскопии в качестве материала наконечника зонда часто используется вольфрам.
С самого начала 21. Карбид вольфрама, ошибочно называемый вольфрамом, также используется в ювелирных изделиях (Tungsten jewellery), например. Б. кольца обработаны. Это очень легко определяется твердостью и плотностью. WC имеет твердость по Моосу 9,5, только вольфрам 7,5. Пока что все ювелирные изделия на рынке изготовлены из карбида вольфрама.
Физиология
Вольфрам считается положительным биоэлементом анаэробных бактерий типа Eubacterium acidaminophilum используется и включается в качестве кофактора в некоторые ферменты. E. acidaminophilum это бактерия, ферментирующая аминокислоты, которая использует вольфрам в ферментах формиатдегидрогеназе и альдегиддегидрогеназе. В этих организмах вольфрам заменяет молибден, потому что он гораздо чаще встречается в их естественной среде (вулканические жерла на морском дне).
E. acidaminophilum это бактерия, ферментирующая аминокислоты, которая использует вольфрам в ферментах формиатдегидрогеназе и альдегиддегидрогеназе. В этих организмах вольфрам заменяет молибден, потому что он гораздо чаще встречается в их естественной среде (вулканические жерла на морском дне).
токсикология
Согласно современным знаниям, вольфрам и его соединения физиологически безвредны. Рак легких у рабочих на заводах по производству или переработке цементированного карбида объясняется наличием кобальта.
На животной модели было обнаружено, что наибольшее количество перорально принимаемых соединений вольфрама быстро выводится с мочой. Небольшая часть вольфрама попадает в плазму крови, а оттуда в эритроциты. Затем он откладывается в почках и костной системе. Через три месяца после приема большая часть очень небольшого количества вольфрама, усваиваемого организмом, обнаруживается в костях.
2003 был идентифицирован с 16 в 1997 с XNUMX у детей, страдающих лейкемией, и с девятью детьми, также страдающими от рака крови в Сьерра-Виста / Аризона, двух так называемых кластерах рака – в локальной области с уровнем заболеваемости выше среднего. В обоих местах в питьевой воде необычно высокие концентрации вольфрама. Значительно повышенные концентрации вольфрама были обнаружены в моче населения. Оба места известны своим появлением вольфрамовых руд. Однако в последующих однолетних исследованиях Центра по контролю за заболеваниями (CDC) не было обнаружено прямой связи между заболеваниями вольфрама и лейкемией. Вольфрам не показал каких-либо канцерогенных эффектов ни в одной тестовой процедуре, и в других частях Невады не было обнаружено других раковых скоплений с аналогичным высоким уровнем содержания вольфрама в моче населения.
В обоих местах в питьевой воде необычно высокие концентрации вольфрама. Значительно повышенные концентрации вольфрама были обнаружены в моче населения. Оба места известны своим появлением вольфрамовых руд. Однако в последующих однолетних исследованиях Центра по контролю за заболеваниями (CDC) не было обнаружено прямой связи между заболеваниями вольфрама и лейкемией. Вольфрам не показал каких-либо канцерогенных эффектов ни в одной тестовой процедуре, и в других частях Невады не было обнаружено других раковых скоплений с аналогичным высоким уровнем содержания вольфрама в моче населения.
безопасности
Как порошок или пыль, он легко воспламеняется, не горюч в компактной форме.
Связи
Оксид
Вольфрам образует несколько оксидов. Между начальным членом:
- Вольфрам (VI) оксид WO3 – лимонно-желтый
и последний участник:
- Вольфрам (IV) оксид WO2 – коричневый
Есть ли другие промежуточные оксиды?
- W10O29 сине-фиолетовый, диапазон гомогенности WO2,92-Где2,88
- W4O11 красно-фиолетовый, диапазон гомогенности WO2,76-Где2,73
- W18O49ГДЕ2,72
- W20O50ГДЕ2,50
Другие соединения
- Вольфрамат натрия Na2WO4
- Вольфрамат циркония ZrW2O8 показывает аномалию при нагревании.

- Вольфрамовые бронзы MxWO3; M = щелочной металл, щелочноземельный металл, лантаноид, примерно 0.3 <x <0.9, обладают электропроводностью, интенсивностью и разной окраской в зависимости от содержания металла.
- Вольфрамат кальция CaWO4 известен как минерал под названием шеелит.
- Карбид вольфрама WC – чрезвычайно твердый металлоподобный состав. Также существует карбид Дивунграма W2C.
- Гексафторид вольфрама WF6
- Свинец вольфрамат PbWO4
- Дисульфид вольфрама WS2 Использовать в качестве сухой смазки (аналогично MoS2)
Использование соединений
Карбид вольфрама используется в качестве отражателя нейтронов в ядерном оружии для уменьшения критической массы. Карбиды вольфрама (твердый металл) используются при обработке материалов из-за их высокой твердости.
Вольфраматы используются для пропитки тканей, чтобы сделать их огнестойкими.
Вольфрамовые краски используются в живописи, а также в керамической и фарфоровой промышленности.
Вольфрамат свинца используется как современный сцинтиллятор в физике элементарных частиц.
| Общий | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Имя, символ, атомный номер | Вольфрам, W, 74 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| серия | Переходные металлы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Группа, период, блок | 6, 6, д | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешний вид | серовато-белый, блестящий | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| номер CAS | 7440-33-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Массовая доля земной оболочки | 64 частей на миллион | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ядерной | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| атомная масса | 183,84 XNUMX человека | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный радиус (рассчитанный) | 135 (193) вечера | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 162 м. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| электронная конфигурация | [Xe] 4f145d46s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. ионизация | 770 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. ионизация | 1700 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| физически | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физическое состояние | Праздник | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| кристаллическая структура | кубическое тело-центрированное | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| плотность | 19,3 г / см3 (20 ° С) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| твердость по Моосу | 7,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| магнетизм | парамагнитный ( = 7,8 10-5) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| точка плавления | 3695 К (3422 ° С) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура кипения | 5828 К (5555 ° С) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярный объем | 9,47 · 10-6 m3/ моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота парообразования | 824 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| теплота плавления | 35,4 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| скорость звука | 5174 м / с | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Удельная теплоемкость | 138 Дж / (кг · К) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электропроводность | 18,52 · 106 А / (В · м) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| теплопроводность | 170 Вт / (м · К) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Химический | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| состояния окисления | 6, 5, 4, 3, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| нормальный потенциал | −0,119 В (WO2 + 4H+ + 4e– → W + 2H2O) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| электроотрицательность | 2,36 (шкала Полинга) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Изотоп | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| свойства ЯМР | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| безопасности | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Фразы опасности H и P H: 228EUH: нет ставок EUHP: 210-240-241-280-370+378 Gefahrstoffkennzeichnung
| легкий легковоспламеняющийся |
| (F) |
Порошок R- и S-фраз R: 11S: 43
Цена вольфрама
Диаграмма Вольфрам 2009-2012
Цены на вольфрам -> Стратегические цены на металлы
Вольфрам в волосах
Определение в волосах концентрации вольфрама, используемое для диагностики интоксикации им.
Синонимы английские
Wolframium (La).
Метод исследования
Масс-спектрометрия с индуктивно-связанной плазмой.
Единицы измерения
Мкг/г (микрограмм на грамм).
Какой биоматериал можно использовать для исследования?
Волосы.
Как правильно подготовиться к исследованию?
- Подготовки не требуется.
Общая информация об исследовании
Многие неорганические ионы могут быть определены в организме человека. Некоторые из них являются абсолютно необходимыми для нормального метаболизма элементами, как, например, натрий, калий, цинк, селен и йод. Другие (ртуть, кадмий, свинец) не выполняют никаких функций и даже, наоборот, оказывают токсическое воздействие при накоплении в высокой концентрации. Для диагностики острой или хронической интоксикации организма используют анализ на наличие того или иного микроэлемента.
Токсичность неорганических ионов зависит от многих факторов, в том числе возраста, пола, физиологического состояния организма, наличия сопутствующих заболеваний, а также пути поступления в организм и дозы. Основными источниками тяжелых металлов и микроэлементов являются пищевые продукты и вода, вдыхаемый воздух, а также в некоторых случаях лекарственные препараты.
Основными источниками тяжелых металлов и микроэлементов являются пищевые продукты и вода, вдыхаемый воздух, а также в некоторых случаях лекарственные препараты.
Наиболее часто случаи отравления микроэлементами регистрируются на производстве. Несмотря на то что клиническая картина отравления тяжелыми металлами и микроэлементами несколько отличается в зависимости от природы и химической структуры вещества, определить элемент, вызвавший заболевания, на основании только лишь клинических признаков не представляется возможным.
Вольфрам – химический элемент, металл серебристо-серого цвета, который применяется практически во всех отраслях современного производства – для изготовления высококачественных сталей, сверхтвердых сплавов, электротехнических приборов, также как катализатор в химической промышленности. Его добавляют при создании красок, пигментов. В природе встречается редко в виде кларка вольфрама, а также образует минералы – шеелит и вольфрамит. Вольфрамовая пыль может вызывать раздражение верхних дыхательных путей и глаз, возможны острые ингаляционные отравления. Может развиваться хронический бронхит, функциональные нарушения нервной системы, заболевания кожи (дерматиты, экземы).
Может развиваться хронический бронхит, функциональные нарушения нервной системы, заболевания кожи (дерматиты, экземы).
Для диагностики хронического отравления тем или иным элементом оптимальной биологической средой является моча. Для диагностики острого отравления предпочтительно использовать кровь. Результаты исследования волос и ногтей менее надежны, чем исследование крови и мочи. Это связано с тем, что придатки кожи способны накапливать вещества из внешней среды, поэтому их концентрация в волосах и ногтях не всегда отражает их концентрацию в организме.
При интерпретации результата исследования следует учитывать некоторые особенности метаболизма микроэлементов в организме. Признаки интоксикации могут наблюдаться и при нормальных (референсных) значениях концентрации.
Для чего используется исследование?
- Для диагностики интоксикации пациентов с особенностями профессионального и бытового анамнеза.
Когда назначается исследование?
- При осмотре пациентов, занятых на добыче и переработке соединений вольфрама.

Что означают результаты?
Референсные значения: 0 – 0,19 мкг/г.
Причины повышения уровня вольфрама:
- интоксикация.
Также рекомендуется
[06-231] Токсические микроэлементы (Cd, Hg, Pb)
[06-232] Токсические микроэлементы и тяжелые металлы (Hg, Cd, As, Li, Pb, Al)
[06-233] Основные эссенциальные (жизненно необходимые) и токсичные микроэлементы (13 показателей)
[06-234] Комплексный анализ на наличие тяжёлых металлов и микроэлементов (23 показателя)
[06-109] Жирорастворимые витамины (A, D, E, K)
[06-188] Водорастворимые витамины (B1, B5, B6, С)
[06-222] Комплексный анализ крови на ненасыщенные жирные кислоты семейства Омега-3 и Омега-6
[40-422] Комплексная оценка оксидативного стресса (7 параметров)
Кто назначает исследование?
Врач общей практики, профпатолог.
Литература
- Ford et al. Clinical Toxicology/ M.
 D. Ford, K. A. Delaney, L. J. Ling, T. Erickson; 1st ed. – W.B. Saunders Company, 2001.
D. Ford, K. A. Delaney, L. J. Ling, T. Erickson; 1st ed. – W.B. Saunders Company, 2001. - Klaassen et al. Casarett and Doull’s Essentials of Toxicology/ C. D. Klaassen, J.B. Watkins III. 1st ed. – MCGraw-Hill, 2004.
- Fauci et al. Harrison’s Principles of Internal Medicine/A. Fauci, D. Kasper, D. Longo, E. Braunwald, S. Hauser, J. L. Jameson, J. Loscalzo; 17 ed. – The McGraw-Hill Companies, 2008.
- Chernecky C. C. Laboratory Tests and Diagnostic Procedures / С.С. Chernecky, В.J. Berger; 5th ed. – Saunder Elsevier, 2008.
Где встречается вольфрам – Tungsten Rings & Co.
В наши дни украшения из вольфрама повсюду. Вы можете легко найти его в крупных магазинах, таких как Wal-Mart, а также иметь выбор в хороших (и некоторых не очень) интернет-магазинах. Не говоря уже о том, что многие настоящие ювелирные магазины продают изделия из вольфрама. Как вы, возможно, уже знаете, вольфрам, благодаря своей долговечности и характеристикам, также можно найти во многих других вещах в нашей повседневной жизни, например, в лампочках.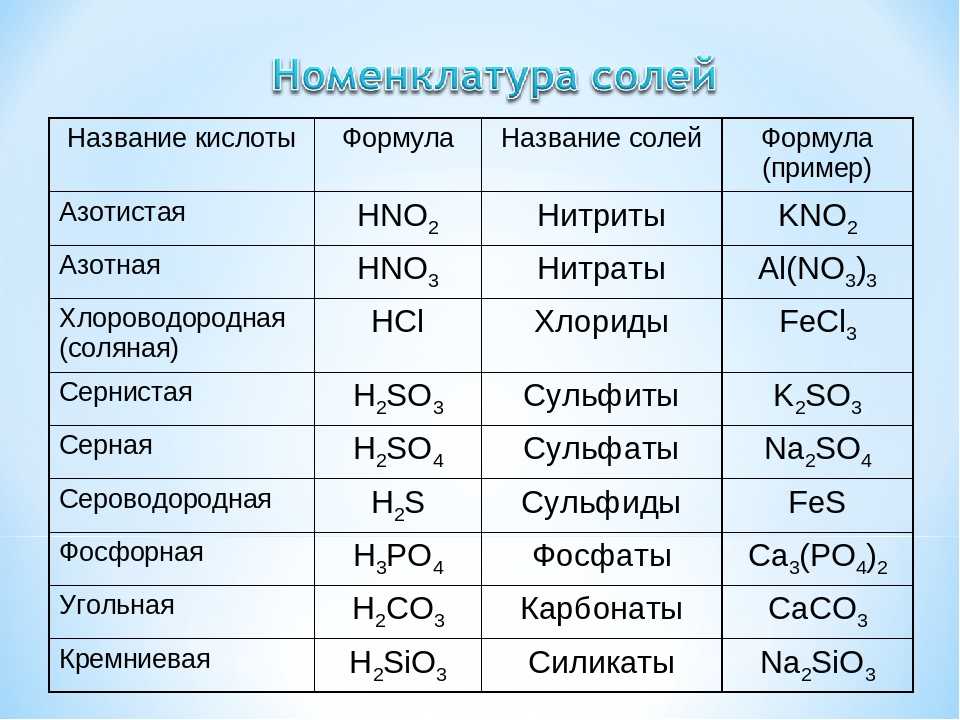 Вольфрам используется в качестве нитей накала для лампочек. Однако мало кто знает, откуда на самом деле берется легкодоступный в магазинах вольфрам.
Вольфрам используется в качестве нитей накала для лампочек. Однако мало кто знает, откуда на самом деле берется легкодоступный в магазинах вольфрам.
Вольфрам составляет очень небольшую часть земной коры и является очень дефицитным металлом. Вольфрам составляет всего 1,1 части на миллион земной коры. Просто для понимания: другие элементы, такие как железо (около 63 000 частей на миллион) и свинец (около 10 частей на миллион), составляют большую часть земной коры. Ближайшими «родственниками» вольфрама в таблице Менделеева принято считать молибден и олово, составляющие примерно одинаковые доли на миллион земной коры: 1.1. и 2,2 соответственно.
Хотя это звучит очень мало в общей схеме миллионных долей земной коры, земная кора огромна, и поэтому вольфрама все еще много. Однако в природе он никогда не встречается в виде металла. Вольфрам можно найти только в виде минерала, то есть он встречается в сочетании с другими элементами, образуя соединения. На самом деле в природе встречается более двадцати минералов вольфрама, но только два из них используются для извлечения металла: шеелит и вольфрамит.
Вольфрамит обычно связан с оловянной рудой, известной как касситерит, которая обычно находится рядом с гранитными породами. Вольфрамит представляет собой черно-коричневый минерал и, как упоминалось выше, является одним из основных источников вольфрама. В естественном состоянии вольфрамит будет содержать различные уровни вольфрамата марганца, а также вольфрамата железа. В зависимости от состава минерала вольфрамита его будут называть по-разному. Если минерал содержит более 80% вольфрамата марганца, он известен как хубнерит, тогда как, если минерал состоит из более чем 80% вольфрамата железа, он будет известен как ферберит.
В то время как вольфрамит бывает черно-коричневого цвета, цвет шеелита варьируется от белого до зеленого. Также в ультрафиолете светится чистый шеелит. В отличие от вольфрамита, который будет содержать вольфрамат марганца или вольфрамата железа, шеелит будет состоять из вольфрамата кальция.
Металлический вольфрам, найденный в виде вольфрамита или шеелита, в конечном итоге может быть превращен во множество вещей, включая кольца из карбида вольфрама, которые становятся все более популярными.
Украшения из вольфрама
До прихода в Tungsten Rings & Co. Зак Мейсон несколько лет работал в ювелирной отрасли. Мейсон выполнял работы по гравировке, изменению размера и ювелирной обработке нескольких типов драгоценных металлов, таких как золото, платина и даже альтернативные металлы, такие как палладий. До работы в ювелирной отрасли Мейсон работал штатным репортером в местной газете, где развивал и улучшал свои писательские навыки. В отрасли мало ювелиров с таким опытом. Подробнее
Вольфрамовый элемент | Прочный элемент Вольфрам
Знакомство с вольфрамомЭлемент вольфрам представляет собой серебристо-серый переходный металл. Вольфрам известен своей удивительно высокой температурой плавления и невероятной прочностью на растяжение по сравнению с другими чистыми металлами. Из-за этих качеств мы часто используем вольфрам для производства промышленного оборудования и инструментов.
10 забавных фактов о вольфраме- Вольфрам обладает удивительно высокой радиационной стойкостью.
- По сравнению со всеми другими металлами вольфрам является вторым по твердости после хрома.
- Вольфрам имеет самую высокую температуру плавления (3422°C) среди всех других элементов периодической таблицы.
- Вольфрам удивительно плотный. Он имеет плотность чуть выше, чем у золота, и занимает пятое место по плотности среди всех переходных металлов.
- При воздействии кислорода на поверхности кристаллов вольфрама образуется оксидный слой, который может иметь радужный цвет, похожий на цвет висмута.
- Вольфрам является одним из двух элементов, теоретически способных образовывать шестикратные связи. В частности, эти связи существуют в W 2 , двухатомная газообразная форма вольфрама, которая образуется только при температуре выше точки кипения 5930°C. Эта связь включает две сигма-, две пи- и две дельта-связи и возможна только благодаря уникальной конфигурации электронов вольфрама.
- Название «вольфрам» означает «тяжелый камень» на шведском языке, и это название первоначально служило шведским термином для минерального шеелита, руды, в состав которой входит вольфрам.
- Его символ в периодической таблице W относится не к названию «вольфрам», а скорее к названию «вольфрам». В немецком, испанском и многих славянских языках «вольфрам» — это название элемента, в то время как «вольфрам» вместо этого используется носителями английского и французского языков.
- В большинстве организмов вольфрам может оказывать токсическое действие. В частности, вольфрам может заменить кофакторы молибдена или меди в некоторых реакциях, катализируемых ферментами.
- Интересно, что некоторые виды бактерий научились использовать вольфрам для катализа определенных окислительно-восстановительных реакций.
Вольфрам имеет атомный символ W с атомным номером 74. Он расположен в d-блоке периодической таблицы, с танталом слева и рением справа. Вольфрам занимает третье место в группе 6 периодической таблицы вместе с хромом, молибденом и сиборгием. Вольфрам имеет электронную конфигурацию [Xe]4f 14 5d 4 6s 2 . Кроме того, элемент имеет электроотрицательность 2,36 по шкале Полинга.
Кроме того, элемент имеет электроотрицательность 2,36 по шкале Полинга.
Благодаря своей исключительной прочности на растяжение (1510 МПа), высокой температуре плавления (3422°C) и коррозионной стойкости вольфрам служил важным компонентом тяжелого вооружения в начале 20 века. С сплавом, обогащенным вольфрамом, заводы могли бы производить оружие, которое могло бы выдерживать более сильные внутренние взрывы, чтобы стрелять более крупными полезными нагрузками на большие расстояния.
В частности, во время Первой мировой войны спрос европейских великих держав на производство артиллерии сделал вольфрам невероятно дорогим. Вольфрам продавался по более высокой цене за единицу массы, чем золото или серебро. Поскольку он оставался нейтральным на протяжении большей части войны, обе стороны конфликта обращались к США за покупкой вольфрама. На американском Западе существовало много вольфрамовых рудников США, и соседние с ними сельские города стали невероятно оживленными и богатыми. Однако после войны цена на вольфрам упала, оставив после себя города-призраки, такие как Вольфрам, штат Колорадо.
Однако после войны цена на вольфрам упала, оставив после себя города-призраки, такие как Вольфрам, штат Колорадо.
Во время Второй мировой войны спрос на вольфрам снова резко возрос. Британская империя заблокировала торговлю военными материалами с нацистской Германией, включая вольфрамовую руду. Это торговое эмбарго распространялось на остальные союзные державы, а также на нейтральных подписантов, включая Португалию. В то время в Португалии была репрессивная военная диктатура под руководством Антониу де Оливейра Салазара. Однако Салазар симпатизировал нацистской Германии, хотя и хотел поддерживать отношения с Великобританией. Получив щедрые суммы из Германии, Салазар тайно торговал вольфрамовой рудой из Северной Португалии с Германией. Португальская руда неизбежно помогала создавать оружие, которое нацистская Германия использовала для ведения войны, что стало непреходящим наследием Португалии во время Второй мировой войны9.0003
Применение вольфрама в современном мире Для чего используется вольфрам? Как упоминалось ранее, полезность вольфрама в современном мире обусловлена его замечательной прочностью на растяжение и температурой плавления. Вольфрам часто можно найти в проволоке, стержнях и инструментах с высокими нагрузками, используемых в промышленности. Обычные инструменты с высоким содержанием вольфрама включают пилы, сверла и горнодобывающее оборудование. Кроме того, вольфрамовые нити и электроды широко используются в электронике, например, в лампочках и телевизионных дисплеях. Ионы вольфрама также можно использовать в новых методах химического катализа и синтеза.
Вольфрам часто можно найти в проволоке, стержнях и инструментах с высокими нагрузками, используемых в промышленности. Обычные инструменты с высоким содержанием вольфрама включают пилы, сверла и горнодобывающее оборудование. Кроме того, вольфрамовые нити и электроды широко используются в электронике, например, в лампочках и телевизионных дисплеях. Ионы вольфрама также можно использовать в новых методах химического катализа и синтеза.
Вольфрамовые сплавы обладают множеством уникальных качеств, которые делают их идеальными для целого ряда применений. (См. ниже).
Где добывают вольфрам? Вольфрам — довольно редкий металл, если его найти в природе на Земле. Как правило, металл входит в состав минералов шеелита и вольфрамита. В обеих этих рудах вольфрам встречается в составе ионного вольфрамата (WO 4 2-). В вольфрамите вольфрамат ионно связывается с катионами железа и магния, а в шеелите вольфрамат связывается с катионами кальция. Другие минералы с вольфрамом, как правило, очень редки.
Другие минералы с вольфрамом, как правило, очень редки.
Большинство мировых запасов вольфрама находится в Китае, хотя в Канаде, России, Вьетнаме, Боливии и Португалии также имеются значительные месторождения вольфрама.
Когда и как был открыт вольфрам?Историки теперь признают, что Карл Вильгельм Шеель, шведский химик, открыл «вольфрамовую кислоту» из руды под названием «вольфрам» в 1781 году. Позже эта руда получила название «шеелит» в честь химика. Название «вольфрам» было применено именно к новому элементу после того, как он был выделен из кислотного вещества Шееле.
Однако в 1783 году два испанских химика (которые также были братьями) по имени Фаусто и Хосе Эльхуяр открыли такое же кислотное вещество из вольфрамита. После того, как элемент был выделен из кислоты, этот элемент получил название «вольфрам». Испанские власти приписали братьям открытие нового элемента, а Шееле получил признание за свое открытие намного позже. Из-за проблемного открытия вольфрам до сих пор сохраняет букву «W» в качестве атомного символа.
Из-за проблемного открытия вольфрам до сих пор сохраняет букву «W» в качестве атомного символа.
Ученые-материаловеды создали множество полезных сплавов с вольфрамом, в том числе:
- Вольфрам-никель-железо: этот сплав сохраняет прочность и температуру плавления вольфрама, а также имеет низкий коэффициент теплового расширения. . Низкое расширение делает его идеальным для герметизации стекла к металлу. Кроме того, он имеет более высокую радиационную защиту, чем свинец, но при этом не токсичен для биологических систем, что делает его идеальным для защиты от радиации.
- Вольфрам-железо-углерод: Преимущество этого сплава заключается в том, что он выдерживает невероятно высокие температуры без потери твердости. В результате металлурги используют его в основном в пилах и сверлах, изделиях, которые испытывают сильное трение на высоких скоростях.
 Из-за его преимущественных качеств при высокоскоростном трении металлурги называют его «быстрорежущей сталью».
Из-за его преимущественных качеств при высокоскоростном трении металлурги называют его «быстрорежущей сталью». - Вольфрам-никель-медь: Этот сплав обладает многими качествами вольфрама-никеля-железа, помимо высокой электропроводности и немагнитности. Это делает сплав идеальным для высокотехнологичного электрооборудования, в том числе военной и медицинской техники.
- Вольфрам-тантал: Этот сплав также имеет высокую температуру плавления, а также обладает высокой устойчивостью к растяжению и коррозии. В результате он имеет тенденцию хорошо работать в средах с высокой степенью коррозии, например, в космических кораблях, атомных электростанциях и печах.
Известные соединения вольфрама включают:
- Карбиды вольфрама (WC, W 2 C): Этот состав обладает высокой твердостью и жесткостью, а также часто используется в промышленных инструментах. Ювелирные изделия.
- Галогениды вольфрама (WF 6 , WCl 6 , W 6 Cl 18 и т.
 д.): эти соединения относительно легко образуются из элементарного вольфрама. Химики склонны использовать их для получения более ценных соединений вольфрама.
д.): эти соединения относительно легко образуются из элементарного вольфрама. Химики склонны использовать их для получения более ценных соединений вольфрама.
Анион вольфрамата (WO 4 2-): это наиболее распространенная свободная ионная форма вольфрама. Это также преобладающая форма, встречающаяся в природе в сочетании с катионом другого металла.
Анион вольфрамаГексакарбонил вольфрама (W(CO) 6 ): Этот вольфрамовый комплекс включает шесть лигандов монооксида углерода, взаимодействующих с вольфрамом. Это соединение имеет важное значение как предшественник первого синтезированного диводородного комплекса, который включает интактный h3 в качестве лиганда.
Вольфрамовый гексакарбониловый комплексХимики обнаружили, что вольфрам имеет тенденцию проявлять низкую реакционную способность в большинстве условий. Однако была обнаружена пара полезных реакций с участием элементарного вольфрама:
- Галогенирование: включает реакцию элементарного вольфрама с двухатомным галогеном.
 Это может происходить при комнатной температуре с F 2 , но для реакции с Cl 2 требуется значительное количество тепла (250°C). В результате получается галогенид вольфрама. Эта реакция имеет важное значение, поскольку галогениды вольфрама могут реагировать с образованием карбида вольфрама или комплексных солей вольфрама.
Это может происходить при комнатной температуре с F 2 , но для реакции с Cl 2 требуется значительное количество тепла (250°C). В результате получается галогенид вольфрама. Эта реакция имеет важное значение, поскольку галогениды вольфрама могут реагировать с образованием карбида вольфрама или комплексных солей вольфрама.
W + 3F 2 → WF 6
W + 3Cl 2 → WCl 6
6W + 6Cl 2 → W 6 Cl 12
- Реакция с кислородом: включает реакцию элементарного вольфрама с двухатомным кислородом с образованием триоксида вольфрама (WO 3 ). Как и в случае с хлором, для этого требуются высокие температуры. В основных условиях триоксид вольфрама образует вольфрамат (WO 4 2-).
2W + 3O 2 → WO 3
Выделение вольфрама Элемент Как упоминалось ранее, вольфрам в природе встречается в форме вольфрамата металла (II) (FeWO0045 4 , MgWO 4 , CaWO 4 ). Для извлечения элементарного вольфрама из руды соединение вольфрамата превращается в оксид вольфрама (IV) (WO 3). Затем этот продукт нагревают для получения порошкообразного элементарного вольфрама.
Для извлечения элементарного вольфрама из руды соединение вольфрамата превращается в оксид вольфрама (IV) (WO 3). Затем этот продукт нагревают для получения порошкообразного элементарного вольфрама.
Состояние окисления В вольфраме:
- Вольф (II): W 2+ , W 2 C
- Tungsten (III): W 3+ 3+ 3+ 3+ 3+ 3+ 3+ 3+ 3+ 3+ 3+ 3+ 3+ 3+ 3+ 3+ 3+ 3+. Кл 18
- Вовсец (IV): W 4+ , WC
- Вольф. 2-, WO 3
- Атомный символ: W
- Температура плавления: 3695K; 3422°С; 6192°F
- Температура кипения: 6203K; 5930°С; 10706°F
- Плотность: 19,26 г/мл
- Атомный вес: 183,84
- Атомный номер: 74
- Электроотрицательность: 2,36
- Молярная теплоемкость: 24,27 Дж/(моль*К)
- Классификация: переходный металл
- Естественное содержание в земной коре: 1,5 ppm 4 6S 2
- Стабильные изотопы: 180, 181, 182, 183, 184, 186
- обнаружены в минералах: Вольфрамит, Шелят, Ферберит, Хюбнер
- Токсичность: Модерный.



 }
} }
}