Характеристика цинка химия: Дать характеристику элемента Zn – ответ на Uchi.ru
alexxlab | 13.04.2023 | 0 | Разное
Вопрос№62. Цинк. Общая характеристика. Амфотерность гидроксида. Комплексные соединения. Ферменты. Применение в животноводстве.
Цинк — элемент побочной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 30. Обозначается символом Zn. Простое вещество цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
Физические свойства
В чистом виде — довольно пластичный серебристо-белый металл. Обладает гексагональной решеткой с параметрами а = 0,26649 нм, с = 0,49468 нм. При комнатной температуре хрупок, при сгибании пластинки слышен треск от трения кристаллитов (обычно сильнее, чем «крик олова»). При 100—150 °C цинк пластичен.
Химические свойства
Типичный амфотерный металл. Стандартный электродный потенциал −0,76 В, в ряду стандартных потенциалов расположен до железа.
На воздухе цинк
покрывается тонкой пленкой оксида ZnO. При сильном нагревании сгорает с
образованием амфотерного белого оксида
ZnO:
При сильном нагревании сгорает с
образованием амфотерного белого оксида
ZnO:
2Zn + O2 = 2ZnO.
Оксид цинка реагирует как с растворами кислот:
ZnO + 2HNO3 = Zn(NO3)2 + h3O
так и щелочами:
ZnO + 2NaOH = Na2ZnO2 + Н2О,
Цинк обычной чистоты активно реагирует с растворами кислот:
Zn + 2HCl = ZnCl2 + h3↑,
Zn + h3SO4(разб.) = ZnSO4 + h3↑
и растворами щелочей:
Zn + 2NaOH + 2h3O = Na2[Zn(OH)4] + h3↑,
образуя гидроксоцинкаты. С растворами кислот и щелочей очень чистый цинк не реагирует. Взаимодействие начинается при добавлении нескольких капель раствора сульфата меди CuSO4.
При нагревании
цинк реагирует с галогенами с образованием
галогенидов ZnHal2. С фосфором цинк образует
фосфиды Zn3P2 и ZnP2. С серой и ее аналогами
— селеном и теллуром — различные
халькогениды, ZnS, ZnSe, ZnSe2 и ZnTe. Сульфид
цинка используется для синтеза люминофоров
временного действия и разного рода
люминесцентов на базе смеси ZnS и CdS.
Люминофоры на базе сульфидов цинка и
кадмия, так же применяются в электронной
промышленности для изготовления
светящихся гибких панелей и экранов в
качестве электролюминофоров и составов
с коротким временем высвечивания.
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует. Нитрид Zn3N2 получают реакцией цинка с аммиаком при 550—600 °C.
Гидрокси́д ци́нка — амфотерный гидроксид, имеющий формулу Zn(OH)2. Находит широкое применение в различных отраслях химии.
Получение
Химические свойства
Ртуть — элемент побочной подгруппы второй группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 80. Обозначается символом Hg. Простое вещество ртуть — переходный металл, при комнатной температуре представляет собой тяжёлую серебристо-белую жидкость, пары которой чрезвычайно ядовиты. Ртуть — один из двух химических элементов (и единственный металл), простые вещества которых при нормальных условиях находятся в жидком агрегатном состоянии.
Получение
Ртуть получают
сжиганием киновари (Сульфида ртути(II)).
Этот способ применяли алхимики древности. Уравнение реакции горения киновари:
HgS+O2→Hg+SO2
Уравнение реакции горения киновари:
HgS+O2→Hg+SO2
Химические свойства
При нагревании до 300 °C ртуть вступает в реакцию с кислородом: 2Hg + O2 → 2HgO Образуется оксид ртути(II) красного цвета. Эта реакция обратима: при нагревании выше 340 °C оксид разлагается до простых веществ. Реакция разложения оксида ртути исторически является одним из первых способов получения кислорода.
При нагревании ртути с серой образуется сульфид ртути(II).
Ртуть не растворяется в растворах кислот, не обладающих окислительными свойствами, но растворяется в царской водке и азотной кислоте, образуя соли двухвалентной ртути. При растворении избытка ртути в азотной кислоте на холоде образуется нитрат Hg2(NO3)2.
Соединения ртути
Ртуть и её соединения
применяются в технике, химической
промышленности, медицине. Желтый оксид
ртути(II) входит в состав глазной мази и
мазей для лечения кожных заболеваний.
Красный оксид ртути(II) применяется для
получения красок. Хлорид ртути(I), который
называется каломель, используется в
пиротехнике, а также в качестве фунгицида. В ряде стран каломель используется в
качестве слабительного. Токсическое
действие каломели проявляется особенно
тогда, когда после приема её внутрь не
наступает слабительное действие и
организм долгое время не освобождается
от этого препарата. Хлорид ртути(II),
который называется сулема, является
очень токсичным. Сулема применялась в
медицине как дезинфицирующее средство,
в технике она используется для обработки
дерева, получения некоторых видов
чернил, травления и чернения стали. В
сельском хозяйстве сулема применяется
как фунгицид. Амидохлорид ртути (белый
преципитат ртути) входит в состав
некоторых мазей. В ветеринарии амидохлорид
ртути применяется как средство против
паразитарных заболеваний кожи. Нитрат
ртути(II) применяется для отделки меха
и получения других соединений этого
металла. Токсичность нитрата ртути(II)
примерно такая же, как и токсичность
сулемы. Многие органические соединения
ртути используются в качестве пестицидов
и средств для обработки семян. Отдельные
органические соединения ртути применяются
как диуретические средства.
В ряде стран каломель используется в
качестве слабительного. Токсическое
действие каломели проявляется особенно
тогда, когда после приема её внутрь не
наступает слабительное действие и
организм долгое время не освобождается
от этого препарата. Хлорид ртути(II),
который называется сулема, является
очень токсичным. Сулема применялась в
медицине как дезинфицирующее средство,
в технике она используется для обработки
дерева, получения некоторых видов
чернил, травления и чернения стали. В
сельском хозяйстве сулема применяется
как фунгицид. Амидохлорид ртути (белый
преципитат ртути) входит в состав
некоторых мазей. В ветеринарии амидохлорид
ртути применяется как средство против
паразитарных заболеваний кожи. Нитрат
ртути(II) применяется для отделки меха
и получения других соединений этого
металла. Токсичность нитрата ртути(II)
примерно такая же, как и токсичность
сулемы. Многие органические соединения
ртути используются в качестве пестицидов
и средств для обработки семян. Отдельные
органические соединения ртути применяются
как диуретические средства.
Марганец, цинк и серебро, подготовка к ЕГЭ по химии
Марганец
Содержится в количестве 0,03% по массе в земной коре. Наряду с железом и его сплавами относится к черным металлам.
Для соединений марганца характерны степени окисления +2, +3, +4, +6 +7. В соединения +2 и +3 марганец проявляет основные свойства, +4 – амфотерные, +6, +7 – кислотные.
Наиболее известными минералами, в которых содержится марганец, являются:
- MnO2 – пиролюзит
- MnO(OH) – бурая марганцевая руда, манганит
- 3Mn2O3*MnSiO3 – браунит
Получают марганец алюминотермией, восстановлением коксом, электролизом.
MnO2 + Al = (t) Al2O3 + Mn
MnO2 + C = (t) Mn + CO
MnSO4 + H2O = (электролиз) Mn + O2 + H2SO
Химические свойства
- Реакции с неметаллами
- Реакция с водой
- Реакции с кислотами
На воздухе марганец вступает во взаимодействие с кислородом, пассивируется: на поверхности металла образуется оксидная пленка.
Mn + O2 = MnO2
При нагревании марганец реагирует с азотом, углеродом, кремнием, бором и фосфором.
Mn + N2 = (t) Mn3N2
Mn + C = (t) Mn3C
Mn + Si = (t) Mn2Si
Mn + P = (t) Mn3P2
При нагревании марганец вытесняет водород из воды.
Mn + H2O = (t) Mn(OH)2 + H2↑Марганец стоит в ряду напряжений до водорода и способен вытеснить его из кислот.
Mn + HCl = MnCl2 + H2↑
Под воздействием кислот, которые обладают окислительными свойствами, марганец окисляется.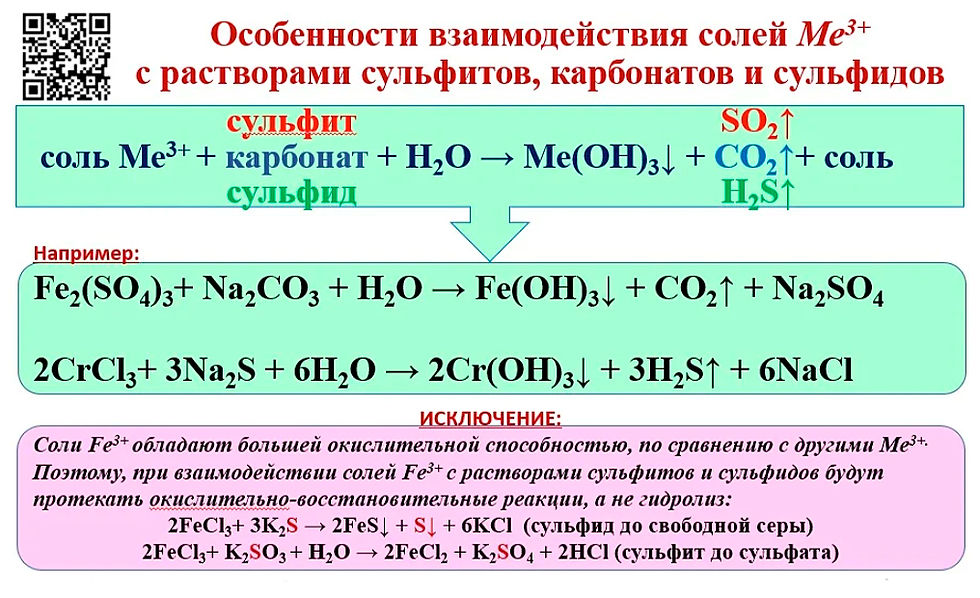
Mn + H2SO4(конц.) = MnSO4 + SO2 + H2O
Mn + HNO3(конц.) = (t) Mn(NO3)2 + NO2 + H2O
Mn + HNO3(разб.) = (t) Mn(NO3
Соединения марганца (II)
Для соединений марганца (II) характерны основные свойства. Оксид марганца (II) может быть получен разложением карбоната марганца, либо восстановлением оксида марганца (IV) до оксида марганца (II).
При растворении (и нагревании!) марганца в воде образуется гидроксид марганца (II).
Mn + H2O = (t) Mn(OH)2 + H2↑
MnSO4 + KOH = (t) Mn(OH)2 + K2SO4
Соединения марганца (II) на воздухе неустойчивы, Mn(OH)2 быстро буреет, превращаясь в оксид-гидроксид марганца (IV).
Mn(OH)2 + O 2 = MnO2 + H2O
Оксид и гидроксид марганца (II) проявляют основные свойства. При реакции с кислотами дает соответствующие соли.
Mn(OH)2 + HCl = MnCl2 + H2O
Соли марганца (II) получаются при его растворении в разбавленных кислотах. Эти соли способны вступать в реакции с другими солями, кислотами, если выпадает осадок, выделяется газ или образуется слабый электролит.
Mn + HCl = MnCl2 + H2
MnSO4 + (NH4)2S = MnS↓ + (NH4)2SO4
При действии сильных окислителей ион Mn2+ способен переходить в ион Mn7+
MnSO4 + PbO2 + HNO3
Соединения марганца (IV) проявляют амфотерный характер. Оксид марганца (IV) можно получить разложением нитрата марганца (II).
Оксид марганца (IV) можно получить разложением нитрата марганца (II).
Mn(NO3)2 = (t) MnO2 + NO2
Кислород в продуктах реакции не указываем, так как он участвует в окислении MnO до MnO2.
В реакциях с щелочами марганец переходит в СО +6, в кислой среде – принимает СО +2.
MnO2 + Na2CO3 + NaNO3 = Na2MnO4 + NaNO2 + CO2 (гидролиз карбоната натрия идет по аниону, среда – щелочная)
MnO2 + HCl = MnCl2 + Cl2 + H2O
Соединения марганца (VI) – MnO3, H2MnO4 – неустойчивы, в свободном виде не получены. Обладают кислотными свойствами.
Наиболее устойчивые соли – манганаты, окрашивающие раствор в зеленый цвет.
Манганаты получают в ходе разложения перманганатов, а также реакциями в щелочной среде.
KMnO4 = (t) K2MnO4 + MnO2 + O2↑ (способ получения кислорода)
Li2SO3 + KMnO4 + LiOH = Li2SO4 + K2MnO4 + H2O
MnO2 + NaOH + NaNO3 = Na2MnO4 + NaNO2 + H2O
MnSO4 + KClO3 + KOH = K2MnO4 + KCl + K2SO4 + H2O
В водной среде манганаты разлагаются на с.о. +7 и +4. Манганаты окисляют хлором.
K2MnO4 + H2O = KMnO4 + MnO2 + KOH
K2MnO4 + Cl2 = KMnO4 + KCl
Соединения марганца (VII) – неустойчивый Mn2O7, и относительно устойчивая в разбавленных растворах HMnO4 – проявляют
кислотные свойства. Соли марганцовой кислоты – перманганаты.
Соли марганцовой кислоты – перманганаты.
В различных средах – кислотной, нейтральной и щелочной – марганец принимает различные степени окисления. Внимательно изучите таблицу ниже.
Оксид марганца (VII) получают в реакции перманганата с сильными кислотами.
KMnO4 + H2SO4 = Mn2O7 + K2SO4 + H2O
При растворении оксида марганца (VII) (кислотного оксида) в щелочи образуются соли марганцовой кислоты – перманганаты.
Mn2O7 + KOH = KMnO4 + H2O
Марганцовая кислота получается в реакциях сильных окислителей с солями марганца (II).
Mn(NO3)2 + PbO2 + HNO3 = HMnO4 + Pb(NO3)2 + H2O
В растворах с концентрацией марганцовой кислоты более 20% происходит ее разложение.
HMnO4 = MnO + O2 + H2O
При нагревании перманганата калия (в быту – марганцовка) разлагается с образованием бурого MnO2, выделением кислорода.
KMnO4 = (t) K2MnO4 + MnO2 + O2↑
При стоянии в растворе постепенно разлагается водой.
KMnO4 + H2O = MnO2 + KOH + O2↑
В кислой среде марганец принимает наиболее устойчивую (для кислой среды) – Mn2+, в щелочной – Mn6+.
KMnO4 + H2O2 + H2SO4 = MnSO4 + O2↑ + K2SO4 + H2O
KMnO4 + KOH = K2MnO4 + O2 + H2O
Цинк
Название цинка, вероятно, связано формой его кристаллитов: в переводе с немецкого Zinke – зубец. С древнейших времен известен сплав
меди с цинком – латунь.
С древнейших времен известен сплав
меди с цинком – латунь.
Для цинка характерна постоянная степень окисления +2.
Наиболее известные минералы, в которых содержится цинк:
- ZnS – цинковая обманка, сфалерит
- ZnO – цинкит
- ZnCO3 – симсонит, цинковый шпат
- 2ZnO*SiO2*H2O – гемиморфит
Получение
Пирометаллургический метод получения цинка заключается в обжиге цинковой обманки, и последующем восстановлении оксида цинка различными восстановителями: чаще всего C, также возможно CO и H2.
ZnS + O2 = (t) ZnO + SO2
ZnO + C = (t) Zn + CO
ZnO + H2 = (t) Zn + H2O
ZnO + CO = (t) Zn + CO2
Гидрометаллургический метод получения основывается на электролизе сульфата цинка.
ZnSO4 + H2O = (электролиз) Zn + H2SO4 + O2
Химические свойства
- Реакции с неметаллами (и аммиаком 🙂
- Реакции с кислотами
- Реакции с щелочами
На воздухе цинк покрывается оксидной пленкой. При нагревании цинк реагирует с галогенами, фосфором, серой, селеном.
Zn + O2 = ZnO
Zn + Br2 = (t) ZnBr2
Zn + P = (t) Zn3P2
Zn + S = (t) ZnS
Для цинка не характерны реакции с водородом, бором, кремнием, азотом, углеродом. Нитрид цинка можно получить в ходе реакции цинка с аммиаком.
Zn + NH3 = (t) Zn3N2 + H2↑
Zn + HCl = ZnCl2 + H2↑
Zn + H2SO4(разб. ) = ZnSO4 + H2↑
) = ZnSO4 + H2↑
Zn + H2SO4(конц.) = ZnSO4 + H2S↑ + H2O
Цинк способен проявлять амфотерные (двойственные) свойства: реагирует как с кислотами, так и с основаниями. При добавлении цинка в раствор щелочи выделяется водород.
Zn + H2O + NaOH = Na2[Zn(OH)4] + H2↑ (тетрагидроксоцинкат натрия)
Соединения цинка (II)
Эти соединения обладают амфотерными свойствами. Оксид цинка (II) можно получить в ходе реакции горения цинка или при разложении нитрата цинка.
Zn + O2 = (t) ZnO
Zn(NO3)2 = (t) ZnO + NO2↑ + O2↑
Оксид цинка (II) проявляет амфотерные свойства, реагирует как с кислотами, так и с щелочами.
ZnO + HCl = ZnCl2 + H2O
ZnO + H2SO4 = ZnSO4 + H2O
ZnO + H2O + 2NaOH = Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
Комплексные соли образуются в растворе, при прокаливании они не образуются.
ZnO + 2NaOH = (t) H2O + Na2ZnO2 (цинкат натрия)
Оксид цинка (II) может быть восстановлен до чистого цинка различными восстановителями.
ZnO + C = (t) Zn + CO
ZnO + H2 = (t) Zn + H2O
ZnO + CO = (t) Zn + CO2
Гидроксид цинка (II) получается в ходе реакций между растворимыми солями цинка и щелочами.
ZnSO4 + NaOH = Na2SO4 + Zn(OH)2↓
Гидроксид цинка (II) обладает амфотерными свойствами, реагирует как с кислотами, так и с основаниями.
Zn(OH)2 + HCl = ZnCl2 + H2O
Zn(OH)2 + HNO3 = Zn(NO3)2 + H2O
Zn(OH)2 + NaOH = Na2[Zn(OH)4]
При прокаливании комплексные соли распадаются, вода испаряется.
Na2[Zn(OH)4] = (t) Na2ZnO2 + H2O
Zn(OH)2 + NaOH = (t) Na2ZnO2 + H2O
Серебро
Драгоценный металл, известный человеку с древнейших времен. Встречаемся в самородном виде. Будучи благородным металлом,
серебро обладает низкой реакционной способностью.
Встречаемся в самородном виде. Будучи благородным металлом,
серебро обладает низкой реакционной способностью.
Химические свойства
- Реакции с неметаллами
- Реакции с кислотами
- С солями
- С органическими веществами
Серебро не окисляется кислородом даже при высокой температуре. Галогены легко окисляют серебро до соответствующих галогенидов. При нагревании с серой получается сульфид серебра.
Ag + Cl2 = AgCl
Ag + S = (t) Ag2S
Серебро не растворяется в соляной и разбавленной серной кислотах, однако способно реагировать с концентрированными кислотами.
Ag + HNO3(конц.) = AgNO3 + NO2↑ + H2O
Потемнение серебряных изделий обусловлено реакцией серебра с сероводородом в присутствии кислорода.
Ag + H2S + O2 = Ag2S + H2O
Ag + FeCl3 = AgCl + FeCl2
В дальнейшем, при изучении органической химии, вы не раз столкнетесь с соединением серебра – аммиачным раствором оксида серебра.
Будет полезно, если вы уже сейчас познакомитесь с его формулой на примере реакции окисления уксусного альдегида до уксусной кислоты.
CH3CHO + [Ag(NH3)2]OH = CH3COOH + Ag + NH3 + H2O
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Характеристика комплексов цинка и аминокислот для доставки цинка in vitro с использованием клеток Caco-2 и энтероцитов из hiPSC
. 2017 Октябрь; 30 (5): 643-661.
doi: 10.1007/s10534-017-0033-y. Epub 2017 17 июля.
Энн Катрин Зауэр 1
2
3 , Стефани Пфендер 3 , Симона Хагмейер 1
2
3 , Лаура Тарана 3 , Энн-Кэтрин Маттес 3 , Франциска Бриэль 3 , Себастьян Кюри 4 , Тобиас М. Беккерс 3 , Андреас М. Грабрюкер 5
6
7
Беккерс 3 , Андреас М. Грабрюкер 5
6
7
Принадлежности
- 1 WG Клеточная нейробиология и нейронанотехнология, факультет биологических наук, Лимерикский университет, Лимерик, Ирландия.
- 2 Бернальский институт, Университет Лимерика, Лимерик, Ирландия.
- 3 Институт анатомии и клеточной биологии Ульмского университета, Ульм, Германия.
- 4 CHU Nantes, Service de Génétique Médicale, Нант, Франция.
- 5 WG Клеточная нейробиология и нейронанотехнология, Департамент биологических наук, Университет Лимерика, Лимерик, Ирландия.
 [email protected].
[email protected]. - 6 Бернальский институт, Университет Лимерика, Лимерик, Ирландия. [email protected].
- 7 Институт анатомии и клеточной биологии Ульмского университета, Ульм, Германия. [email protected].
- PMID: 28717982
- PMCID: PMC5646115
- DOI: 10.1007/с10534-017-0033-у
Бесплатная статья ЧВК
Энн Катрин Зауэр и др. Биометаллы. 2017 Октябрь
Бесплатная статья ЧВК
. 2017 Октябрь; 30 (5): 643-661.
2017 Октябрь; 30 (5): 643-661.
doi: 10.1007/s10534-017-0033-y. Epub 2017 17 июля.
Авторы
Энн Катрин Зауэр 1 2 3 , Стефани Пфендер 3 , Симона Хагмейер 1 2 3 , Лаура Тарана 3 , Энн-Кэтрин Маттес 3 , Франциска Бриэль 3 , Себастьян Кюри 4 , Тобиас М. Беккерс 3 , Андреас М. Грабрюкер 5 6 7
Принадлежности
- 1 WG Клеточная нейробиология и нейронанотехнология, факультет биологических наук, Лимерикский университет, Лимерик, Ирландия.

- 2 Бернальский институт, Университет Лимерика, Лимерик, Ирландия.
- 3 Институт анатомии и клеточной биологии Ульмского университета, Ульм, Германия.
- 4 CHU Nantes, Service de Génétique Médicale, Нант, Франция.
- 5 WG Клеточная нейробиология и нейронанотехнология, Департамент биологических наук, Университет Лимерика, Лимерик, Ирландия. [email protected].
- 6 Бернальский институт, Университет Лимерика, Лимерик, Ирландия. [email protected].
- 7 Институт анатомии и клеточной биологии Ульмского университета, Ульм, Германия.
 [email protected].
[email protected].
- PMID: 28717982
- PMCID: PMC5646115
- DOI: 10.1007/с10534-017-0033-у
Абстрактный
Zn необходим для роста и развития. Биодоступность Zn зависит от нескольких факторов, таких как другие компоненты пищи. Поэтому представляет интерес понять механизмы поглощения соединений, доставляющих Zn, чтобы определить способы обхода ингибирующих эффектов этих факторов. Здесь мы изучили влияние конъюгатов Zn-аминокислот (ZnAA) на биодоступность Zn. Мы использовали клетки Caco-2 и энтероциты, дифференцированные из индуцированных человеком плюрипотентных стволовых клеток от контрольной группы и пациента с энтеропатическим акродерматитом (AE), и провели анализы на основе флуоресценции, биохимию белков и атомно-абсорбционную спектрометрию, чтобы охарактеризовать клеточное поглощение и поглощение ZnAA. Результаты показывают, что ZnAA поглощаются транспортерами AA, что приводит к внутриклеточному обогащению Zn, в основном не ингибируемому антагонистами поглощения Zn. Энтероциты пациентов с АЭ не смогли получить значительное количество Zn при воздействии ZnCl 2 , но не показали различий в отношении ZnAA. Мы пришли к выводу, что ZnAA могут иметь преимущество перед классическими добавками Zn, такими как соли Zn, поскольку они могут повышать биодоступность Zn и могут быть более эффективными у пациентов с НЯ.
Результаты показывают, что ZnAA поглощаются транспортерами AA, что приводит к внутриклеточному обогащению Zn, в основном не ингибируемому антагонистами поглощения Zn. Энтероциты пациентов с АЭ не смогли получить значительное количество Zn при воздействии ZnCl 2 , но не показали различий в отношении ZnAA. Мы пришли к выводу, что ZnAA могут иметь преимущество перед классическими добавками Zn, такими как соли Zn, поскольку они могут повышать биодоступность Zn и могут быть более эффективными у пациентов с НЯ.
Ключевые слова: Поглощение; энтеропатический акродерматит; энтероцит; желудочно-кишечный тракт; почтовый индекс4; hIPSC.
Заявление о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
Цифры
Рис. 1
Поглощение Zn из ZnAA…
Рис. 1
Поглощение Zn из ZnAA в клетках Caco-2. a Уровни Zn в крови…
Рисунок 1 Поглощение Zn из ZnAA в клетках Caco-2. a Уровни Zn в крови мышей, получавших разные диеты, в течение 9 недель. Уровни Zn в цельной крови исследовали с помощью ААС у трех животных в группе. У животных на диете с дефицитом цинка (диета 2) наблюдается значительно сниженный уровень цинка по сравнению с мышами на контрольной диете (диета 1). Мыши на контрольной диете с повышенным уровнем антагонистов захвата цинка (диета 3) также демонстрируют значительное снижение уровня цинка в крови. b – h Интенсивность флуоресценции Zinpyr-1 клеток Caco-2, инкубированных в течение 30 минут с раствором ZnCl 2 (50 мкМ) или ZnAA, доставляющими эквивалент 50 мкМ Zn 2+ . b ZnCl 2 раствор, ZnGlu, ZnLys/Glu и ZnLys/Glu/Met значительно увеличивают внутриклеточный Zn. Тенденция к увеличению наблюдалась после применения ZnLys и ZnMet. Раствор ZnCl 2 значительно увеличивает внутриклеточные уровни Zn по сравнению с ZnLys и ZnMet ( n = 10 ячеек на группу). c Через 120 минут раствор ZnCl 2 и все ZnAA приводят к значительному увеличению внутриклеточного Zn ( n = 10 клеток на группу). d Применение только Glu и Lys не приводит к различиям в Zn по сравнению с необработанными контролями. Применение только Met приводит к значительному увеличению внутриклеточного Zn по сравнению с контролем, но значительно меньшему, чем при использовании раствора ZnCl 2 ( n = 10). e Значительное повышение внутриклеточного уровня Zn, обеспечиваемое раствором ZnCl 2 , не зависит от наличия избытка АК в среде. f Значительного увеличения внутриклеточного Zn после применения ZnGlu, ZnLys и ZnMet не наблюдалось, когда ZnGlu, ZnLys и ZnMet применялись вместе с Glu, Lys и Met соответственно.
b ZnCl 2 раствор, ZnGlu, ZnLys/Glu и ZnLys/Glu/Met значительно увеличивают внутриклеточный Zn. Тенденция к увеличению наблюдалась после применения ZnLys и ZnMet. Раствор ZnCl 2 значительно увеличивает внутриклеточные уровни Zn по сравнению с ZnLys и ZnMet ( n = 10 ячеек на группу). c Через 120 минут раствор ZnCl 2 и все ZnAA приводят к значительному увеличению внутриклеточного Zn ( n = 10 клеток на группу). d Применение только Glu и Lys не приводит к различиям в Zn по сравнению с необработанными контролями. Применение только Met приводит к значительному увеличению внутриклеточного Zn по сравнению с контролем, но значительно меньшему, чем при использовании раствора ZnCl 2 ( n = 10). e Значительное повышение внутриклеточного уровня Zn, обеспечиваемое раствором ZnCl 2 , не зависит от наличия избытка АК в среде. f Значительного увеличения внутриклеточного Zn после применения ZnGlu, ZnLys и ZnMet не наблюдалось, когда ZnGlu, ZnLys и ZnMet применялись вместе с Glu, Lys и Met соответственно. г Увеличение внутриклеточного Zn снижается зависимым от концентрации образом при одновременном применении 10, 50, 100, 150 и 200 мкМ Lys или Glu соответственно ( n = 10). h Показаны иллюстративные изображения клеток Caco-2, окрашенных Zinpyr-1. Нижняя строка показывает интенсивность сигнала Zinypr1 с цветовой кодировкой
г Увеличение внутриклеточного Zn снижается зависимым от концентрации образом при одновременном применении 10, 50, 100, 150 и 200 мкМ Lys или Glu соответственно ( n = 10). h Показаны иллюстративные изображения клеток Caco-2, окрашенных Zinpyr-1. Нижняя строка показывает интенсивность сигнала Zinypr1 с цветовой кодировкой
Рис. 2
Влияние антагонистических факторов на…
Рис. 2
Влияние антагонистических факторов на поглощение Zn из ZnAA в клетках Caco-2…
Рис. 2 Влияние антагонистических факторов на поглощение Zn из ZnAA в клетках Caco-2. Интенсивность флуоресценции Zinpyr-1 клеток Caco-2. a Применение антагонистов поглощения Zn кальция (поставляется как CaCl 2 ) и меди (поставляется как CuCl 2 ) вместе с раствором ZnCl 2 и ZnAA. Виден значительный ингибирующий эффект на поглощение Zn из раствора ZnCl 2 . Не наблюдалось значительного ингибирования поглощения Zn, доставляемого ZnGlu, ZnLys, ZnMet и ZnLys/Glu/Met. Поглощение ZnLys/Glu было значительно ингибировано. b Совместное применение антагониста захвата Zn фитиновой кислоты (PhytAc). Совместное применение ZnCl 2 и фитиновой кислоты приводит к значительно меньшему увеличению внутриклеточных уровней Zn по сравнению с клетками, обработанными только раствором ZnCl 2 . Не наблюдалось значительного антагонистического эффекта при совместном применении фитиновой кислоты и ZnGlu, ZnLys, ZnMet, ZnLys/Glu и ZnLys/Glu/Met. Поглощение ZnLys/Glu/Met было выше в присутствии фитиновой кислоты. Фитиновую кислоту использовали в молярном соотношении Zn:PhytAc = 1:50 ( n = 10). c Совместное применение фолиевой кислоты (FolAc). Наблюдается значительно меньшее поглощение Zn через раствор ZnCl 2 (использовали FolAc с концентрацией 100 мкМ).
Виден значительный ингибирующий эффект на поглощение Zn из раствора ZnCl 2 . Не наблюдалось значительного ингибирования поглощения Zn, доставляемого ZnGlu, ZnLys, ZnMet и ZnLys/Glu/Met. Поглощение ZnLys/Glu было значительно ингибировано. b Совместное применение антагониста захвата Zn фитиновой кислоты (PhytAc). Совместное применение ZnCl 2 и фитиновой кислоты приводит к значительно меньшему увеличению внутриклеточных уровней Zn по сравнению с клетками, обработанными только раствором ZnCl 2 . Не наблюдалось значительного антагонистического эффекта при совместном применении фитиновой кислоты и ZnGlu, ZnLys, ZnMet, ZnLys/Glu и ZnLys/Glu/Met. Поглощение ZnLys/Glu/Met было выше в присутствии фитиновой кислоты. Фитиновую кислоту использовали в молярном соотношении Zn:PhytAc = 1:50 ( n = 10). c Совместное применение фолиевой кислоты (FolAc). Наблюдается значительно меньшее поглощение Zn через раствор ZnCl 2 (использовали FolAc с концентрацией 100 мкМ). Наблюдался значительный ингибирующий эффект на поглощение ZnLys, ZnLys/Glu и ZnLys/Glu/Met. Не затрагиваются только ZnGlu и ZnMet, хотя ZnMet не вызывал значительного увеличения внутриклеточных уровней Zn в течение 30 минут ( н.с. незначительно)
Наблюдался значительный ингибирующий эффект на поглощение ZnLys, ZnLys/Glu и ZnLys/Glu/Met. Не затрагиваются только ZnGlu и ZnMet, хотя ZnMet не вызывал значительного увеличения внутриклеточных уровней Zn в течение 30 минут ( н.с. незначительно)
Рис. 3
Поглощение Zn энтероцитами человека…
Рис. 3
Поглощение Zn энтероцитами человека, отличающееся от здоровых людей и пациентов с Акродерматитом…
Рис. 3 Поглощение Zn энтероцитами человека, отличающееся от здоровых людей и пациентов с Энтеропатическим акродерматитом . a Обзор протокола получения энтероцитов из hIPSC здорового контроля и пациента с НЯ. b , c Энтероциты подвергали воздействию раствора ZnCl 2 (50 мкМ) или ZnAA, доставляющих эквивалент 50 мкМ Zn в течение 30 мин. Обработка Zn-хелатором TPEN подтвердила специфичность сигнала Zinpyr-1. b Внутриклеточные уровни Zn в энтероцитах здорового контроля значительно повышаются после обработки ZnCl 9раствор 0147 2 и ZnGlu. ZnLys, ZnMet, ZnLys/Glu и ZnLys/Glu/Met не вызывали значительного увеличения внутриклеточного Zn в течение 30 минут после нанесения. c Внутриклеточные уровни Zn в энтероцитах пациента AE не показали значительного увеличения после лечения ZnCl 2 . Применение ZnLys/Glu/Met (значительно) и ZnGlu (как тенденция) приводит к повышению внутриклеточного уровня Zn. d Значительная разница в поглощении Zn из ZnCl 2 раствор между энтероцитами из контроля и пациента с АЭ был обнаружен. Поглощение ZnAA в энтероцитах пациента AE незначительно ниже по сравнению с контролем. Поглощение ZnLys/Glu/Met было значительно выше в клетках пациента с AE. e Энтероциты, дифференцированные из hIPSC, высевали на фильтр системы Transwell ® .
Обработка Zn-хелатором TPEN подтвердила специфичность сигнала Zinpyr-1. b Внутриклеточные уровни Zn в энтероцитах здорового контроля значительно повышаются после обработки ZnCl 9раствор 0147 2 и ZnGlu. ZnLys, ZnMet, ZnLys/Glu и ZnLys/Glu/Met не вызывали значительного увеличения внутриклеточного Zn в течение 30 минут после нанесения. c Внутриклеточные уровни Zn в энтероцитах пациента AE не показали значительного увеличения после лечения ZnCl 2 . Применение ZnLys/Glu/Met (значительно) и ZnGlu (как тенденция) приводит к повышению внутриклеточного уровня Zn. d Значительная разница в поглощении Zn из ZnCl 2 раствор между энтероцитами из контроля и пациента с АЭ был обнаружен. Поглощение ZnAA в энтероцитах пациента AE незначительно ниже по сравнению с контролем. Поглощение ZnLys/Glu/Met было значительно выше в клетках пациента с AE. e Энтероциты, дифференцированные из hIPSC, высевали на фильтр системы Transwell ® . На супернатант наносили раствор ZnCl 2 или ZnAA. Через 120 мин супернатант и базальную среду удаляли. Клетки на фильтре выращивали до тех пор, пока они не становились 100% конфлюэнтными, и их визуализировали путем окрашивания ядер клеток DAPI. f После инкубации с ZnCl 2 или ZnAA было обнаружено значительное увеличение окрашивания Zinpyr-1 в клетках ( n = 10). г Слева: с использованием контрольных клеток все обработки привели к значительному увеличению концентрации цинка в основной среде (измерено с помощью ААС). Поглощение ZnGlu было значительно меньше по сравнению с раствором ZnCl 2 и ZnMet. Справа: при использовании клеток пациента AE инкубация с раствором ZnCl 2 не привела к значительному увеличению концентрации Zn в базальной среде по сравнению с необработанными контрольными клетками, в то время как применение всех ZnAA значительно увеличивало концентрацию Zn в исходной среде. базальная среда. Поглощение ZnLys было значительно выше по сравнению с ZnCl 2 раствор, ZnGlu и ZnMet.
На супернатант наносили раствор ZnCl 2 или ZnAA. Через 120 мин супернатант и базальную среду удаляли. Клетки на фильтре выращивали до тех пор, пока они не становились 100% конфлюэнтными, и их визуализировали путем окрашивания ядер клеток DAPI. f После инкубации с ZnCl 2 или ZnAA было обнаружено значительное увеличение окрашивания Zinpyr-1 в клетках ( n = 10). г Слева: с использованием контрольных клеток все обработки привели к значительному увеличению концентрации цинка в основной среде (измерено с помощью ААС). Поглощение ZnGlu было значительно меньше по сравнению с раствором ZnCl 2 и ZnMet. Справа: при использовании клеток пациента AE инкубация с раствором ZnCl 2 не привела к значительному увеличению концентрации Zn в базальной среде по сравнению с необработанными контрольными клетками, в то время как применение всех ZnAA значительно увеличивало концентрацию Zn в исходной среде. базальная среда. Поглощение ZnLys было значительно выше по сравнению с ZnCl 2 раствор, ZnGlu и ZnMet. ч При сравнении здорового контроля и патента АЕ были обнаружены значительные различия в абсорбции Zn из раствора ZnCl 2 и после применения ZnGlu и ZnMet
ч При сравнении здорового контроля и патента АЕ были обнаружены значительные различия в абсорбции Zn из раствора ZnCl 2 и после применения ZnGlu и ZnMet
Рис. 4
Физиологические реакции на поглощение Zn…
Рис. 4
Физиологические реакции на поглощение Zn клетками Caco-2. a Количественная оценка экспрессии генов…
Рис. 4 Физиологические реакции на поглощение Zn клетками Caco-2. a Количественная оценка уровней экспрессии генов с помощью qRT-PCR. Показана средняя экспрессия мРНК (значение Δct), нормализованная по HMBS, по сравнению с необработанными (контрольными) клетками. Клетки обрабатывали ZnCl 2 (50 мкМ), ZnGlu (доставляя эквивалент 50 мкМ), ZnGlu и Glu (200 мкМ) или Glu (200 мкМ) отдельно. Для транспортеров Zn ZIP2 и ZnT1 существенных изменений обнаружено не было. Экспрессия ZnT1 показывает высокую динамику и четкую тенденцию к повышающей регуляции. Уровни ZIP4 значительно различаются между клетками, обработанными Glu, и клетками, обработанными ZnCl 9.0147 2 и обработка ZnGlu. Обработка не влияет на транспортеры аминокислот (SLC1A1, SLC7A6, SLC7A8 и SLC6A14). SLC36A1 значительно активируется после обработки ZnGlu + Glu и демонстрирует значительно различную экспрессию в ответ на ZnGlu по сравнению с одним Glu. SLC36A2 демонстрирует значительно повышенную экспрессию после обработки ZnCl 2 и ZnGlu (как тенденция) ( n = 3 на состояние). b – d Экспрессия Zip2, Zip4 и ZnT1 на уровне белка с использованием вестерн-блоттинга. Измеряли интегральную плотность 3 иммунореактивных полос на одно состояние. b Через 30 минут после нанесения ZnCl 2 и ZnGlu на уровне белка не обнаруживается значительной регуляции. c Через 120 минут не обнаружено никаких изменений в отношении общего уровня Zip2 и Zip4.
Для транспортеров Zn ZIP2 и ZnT1 существенных изменений обнаружено не было. Экспрессия ZnT1 показывает высокую динамику и четкую тенденцию к повышающей регуляции. Уровни ZIP4 значительно различаются между клетками, обработанными Glu, и клетками, обработанными ZnCl 9.0147 2 и обработка ZnGlu. Обработка не влияет на транспортеры аминокислот (SLC1A1, SLC7A6, SLC7A8 и SLC6A14). SLC36A1 значительно активируется после обработки ZnGlu + Glu и демонстрирует значительно различную экспрессию в ответ на ZnGlu по сравнению с одним Glu. SLC36A2 демонстрирует значительно повышенную экспрессию после обработки ZnCl 2 и ZnGlu (как тенденция) ( n = 3 на состояние). b – d Экспрессия Zip2, Zip4 и ZnT1 на уровне белка с использованием вестерн-блоттинга. Измеряли интегральную плотность 3 иммунореактивных полос на одно состояние. b Через 30 минут после нанесения ZnCl 2 и ZnGlu на уровне белка не обнаруживается значительной регуляции. c Через 120 минут не обнаружено никаких изменений в отношении общего уровня Zip2 и Zip4. Значительное снижение общей концентрации ZnT1 в клетках наблюдается после обработки ZnCl 2 или ZnGlu. d Примеры полос вестерн-блоттинга для оценки уровней белков Zip2, Zip4, ZnT1 и SLC36A1, SLC36A2 и SLC6A14 через 120 мин. е Транспортер AA SLC6A14 демонстрирует повышение уровня общего белка через 120 минут только после обработки ZnGlu. Для SLC36A1 и SLC36A2 не обнаружено существенной разницы. f Иммуноцитохимию проводили на клетках Caco-2 ( n = 10 на условие), а интенсивность флуоресценции сигналов SLC6A14, Zip2, Zip4 и ZnT1 измеряли через 120 минут после обработки. Обнаружено значительное снижение сигналов SLC6A14 клеточной поверхности после обработки ZnLys, но не другими ZnAA. Применение только лизиса не вызывает этих изменений. Обработка Glu немного улучшает локализацию SLC6A14 на поверхности. Для Zip2 не обнаружено существенных различий в расположении клеточной поверхности, хотя тенденция к уменьшению после ZnCl 9Видна обработка 0147 2 и обработка ZnAA (значительно для ZnCl 2 по сравнению с Glu).
Значительное снижение общей концентрации ZnT1 в клетках наблюдается после обработки ZnCl 2 или ZnGlu. d Примеры полос вестерн-блоттинга для оценки уровней белков Zip2, Zip4, ZnT1 и SLC36A1, SLC36A2 и SLC6A14 через 120 мин. е Транспортер AA SLC6A14 демонстрирует повышение уровня общего белка через 120 минут только после обработки ZnGlu. Для SLC36A1 и SLC36A2 не обнаружено существенной разницы. f Иммуноцитохимию проводили на клетках Caco-2 ( n = 10 на условие), а интенсивность флуоресценции сигналов SLC6A14, Zip2, Zip4 и ZnT1 измеряли через 120 минут после обработки. Обнаружено значительное снижение сигналов SLC6A14 клеточной поверхности после обработки ZnLys, но не другими ZnAA. Применение только лизиса не вызывает этих изменений. Обработка Glu немного улучшает локализацию SLC6A14 на поверхности. Для Zip2 не обнаружено существенных различий в расположении клеточной поверхности, хотя тенденция к уменьшению после ZnCl 9Видна обработка 0147 2 и обработка ZnAA (значительно для ZnCl 2 по сравнению с Glu). Существенных различий в расположении Zip4 на клеточной поверхности не обнаружено. Уровни ZnT1 на поверхности клеток были значительно повышены после обработки как раствором ZnCl 2 , так и ZnAA, несмотря на снижение уровней общего белка ( c )
Существенных различий в расположении Zip4 на клеточной поверхности не обнаружено. Уровни ZnT1 на поверхности клеток были значительно повышены после обработки как раствором ZnCl 2 , так и ZnAA, несмотря на снижение уровней общего белка ( c )
См. это изображение и информацию об авторских правах в PMC
Похожие статьи
Zn-DTSM, ионофор цинка с терапевтическим потенциалом при энтеропатическом акродерматите?
Брей Л., Волитакис И., Эйтон С., Буш А.И., Адлард П.А. Брей Л. и соавт. Питательные вещества. 2019 21 января; 11 (1): 206. дои: 10.3390/nu11010206. Питательные вещества. 2019. PMID: 30669644 Бесплатная статья ЧВК.
Выяснение транспортного механизма H + Zn 2+ ZIP4; Последствия при энтеропатическом акродерматите.

Хох Э., Леви М., Хершфинкель М., Секлер И. Хох Э. и соавт. Int J Mol Sci. 2020 22 января; 21 (3): 734. дои: 10.3390/ijms21030734. Int J Mol Sci. 2020. PMID: 31979155 Бесплатная статья ЧВК.
Новый член семейства переносчиков цинка дефектен при энтеропатическом акродерматите.
Ван К., Чжоу Б., Куо Ю.М., Земанский Дж., Гитшир Дж. Ван К. и др. Am J Hum Genet. 2002 г., июль; 71 (1): 66–73. дои: 10.1086/341125. Epub 2002 24 мая. Am J Hum Genet. 2002. PMID: 12032886 Бесплатная статья ЧВК.
Поглощение цинка с пищей: игра Zips и ZnT в кишечнике.
Ван Х, Чжоу Б. Ван Х и др. Жизнь ИУБМБ. 2010 март; 62(3):176-82. doi: 10.1002/iub.291. Жизнь ИУБМБ. 2010. PMID: 20120011 Обзор.

Генетические причины и взаимодействие генов и питательных веществ при дефиците цинка у млекопитающих: энтеропатический акродерматит и транзиторный дефицит цинка у новорожденных в качестве примеров.
Касана С., Дин Дж., Марет В. Касана С. и др. J Трейс Элем Мед Биол. 2015 янв;29:47-62. doi: 10.1016/j.jtemb.2014.10.003. J Трейс Элем Мед Биол. 2015. PMID: 25468189 Обзор.
Посмотреть все похожие статьи
Цитируется
Оценка инновационного источника цинка по эффективности кормления, показателям роста, качеству кожи и костей бройлеров, страдающих тепловым стрессом.
Загари М., Мехрварз Х., Хаджати Х., Моравей Х. Загари М. и др. Животные (Базель).
 2022 24 ноября; 12 (23): 3272. дои: 10.3390/ани12233272.
Животные (Базель). 2022.
PMID: 36496791
Бесплатная статья ЧВК.
2022 24 ноября; 12 (23): 3272. дои: 10.3390/ани12233272.
Животные (Базель). 2022.
PMID: 36496791
Бесплатная статья ЧВК.Биодоступность различных источников цинка у свиней через 0-3 недели после отъема.
Нильсен Т.С., Энгельсманн М.Н., Хансен С.В., Марибо Х. Нильсен Т.С. и др. Животные (Базель). 2022 Окт 25;12(21):2921. doi: 10.3390/ani12212921. Животные (Базель). 2022. PMID: 36359046 Бесплатная статья ЧВК.
Обогащение цинком: современные тенденции и стратегии.
Холл АГ, Кинг Дж.К. Холл АГ и др. Питательные вещества. 2022 21 сентября; 14 (19): 3895. дои: 10.3390/nu14193895. Питательные вещества. 2022. PMID: 36235548 Бесплатная статья ЧВК. Обзор.
Хелатирование цинка биогенными аминокислотами: описание свойств с использованием индекса Балабана, оценка биологической активности на клеточном биосенсоре Spirostomum Ambiguum , влияние на биопленки и прямое антибактериальное действие.
Марухленко А.В., Морозова М.А., Мбарга А.М.Ю., Антипова Н.В., Сыроешкин А.В., Подопригора И.В., Максимова Т.В. Марухленко А.В. и соавт. Фармацевтика (Базель). 2022 9 августа; 15 (8): 979. doi: 10.3390/ph25080979. Фармацевтика (Базель). 2022. PMID: 36015127 Бесплатная статья ЧВК.
Относительная биодоступность микроэлементов в кормах для сельскохозяйственных животных: обзор.
Бирн Л., Мерфи Р.А. Бирн Л. и соавт. Животные (Базель). 2022 4 августа; 12 (15): 1981. doi: 10.3390/ani12151981. Животные (Базель). 2022. PMID: 35953970 Бесплатная статья ЧВК. Обзор.
Просмотреть все статьи “Цитируется по”
Рекомендации
- Эндрюс ГК. Регуляция и функция Zip4, гена энтеропатического акродерматита.
 Биохим Сок Транс. 2008; 36 (часть 6): 1242–1246. DOI: 10.1042/BST0361242.
–
DOI
–
ЧВК
–
пабмед
Биохим Сок Транс. 2008; 36 (часть 6): 1242–1246. DOI: 10.1042/BST0361242.
–
DOI
–
ЧВК
–
пабмед
- Эндрюс ГК. Регуляция и функция Zip4, гена энтеропатического акродерматита.
- Аргиратос В., Самман С. Влияние карбоната кальция и цитрата кальция на усвоение цинка у здоровых женщин. Eur J Clin Nutr. 1994;48(3):198–204. – пабмед
- Браун К.
 Х., Пирсон Дж.М., Аллен Л.Х. Влияние добавок цинка на рост детей: метаанализ интервенционных испытаний. Библ Нутр Диета. 1998; 54:76–83.
–
пабмед
Х., Пирсон Дж.М., Аллен Л.Х. Влияние добавок цинка на рост детей: метаанализ интервенционных испытаний. Библ Нутр Диета. 1998; 54:76–83.
–
пабмед
- Браун К.
- Burdette SC, Walkup GK, Spingler B, Tsien RY, Lippard SJ. Флуоресцентные сенсоры для Zn(2+) на основе флуоресцеиновой платформы: синтез, свойства и внутриклеточное распределение. J Am Chem Soc. 2001;123(32):7831–7841. дои: 10.1021/ja010059л. – DOI – пабмед
- Чакрабарти АС.
 Проницаемость мембран для аминокислот и модифицированных аминокислот: механизмы транслокации. Аминокислоты. 1994;6(3):213–229. дои: 10.1007/BF00813743.
–
DOI
–
пабмед
Проницаемость мембран для аминокислот и модифицированных аминокислот: механизмы транслокации. Аминокислоты. 1994;6(3):213–229. дои: 10.1007/BF00813743.
–
DOI
–
пабмед
- Чакрабарти АС.
термины MeSH
вещества
Дополнительные понятия
Грантовая поддержка
- 2014_A251/Else Kröner-Fresenius-Stiftung
- Juniorprofessurenprogramm/Ministerium für Wissenschaft, Forschung und Kunst Baden-Württemberg
Синтез и характеристика наночастиц оксида цинка с использованием химии полиолов на предмет их антимикробной и антибиопленочной активности
. 2018 12 декабря; 17:71-80.
2018 12 декабря; 17:71-80.
doi: 10.1016/j.bbrep.2018.11.007. Электронная коллекция 2019 март.
Пранджали П. Махамуни 1 , Пуджа М Патил 1 , Марути Дж. Дханаваде 2 , Манохар В Бадигер 3 , Прем Г Шадиджа 1 , Абхишек С Локханде 4 , Рагвендра А Бохара 1 5
Принадлежности
- 1 Центр междисциплинарных исследований им. Д.Ю. Университет Патила, Колхапур, Индия.
- 2 Кафедра микробиологии, Университет Шиваджи, Колхапур, Индия.

- 3 CSIR, Национальная химическая лаборатория, Пуна, Индия.
- 4 Факультет материаловедения и инженерии, Чоннамский национальный университет, Кванджу, Республика Корея.
- 5 CURAM, Центр исследований медицинских устройств, Ирландский национальный университет, Голуэй, Ирландия.
- PMID: 30582010
- PMCID: PMC6295600
- DOI: 10.1016/j.bbrep.2018.11.007
Бесплатная статья ЧВК
Пранджали П. Махамуни и др.
Биохим Биофиз Респ. .
Махамуни и др.
Биохим Биофиз Респ. .
Бесплатная статья ЧВК
. 2018 12 декабря; 17:71-80.
doi: 10.1016/j.bbrep.2018.11.007. Электронная коллекция 2019 март.
Авторы
Пранджали П. Махамуни 1 , Пуджа М Патил 1 , Марути Дж. Дханаваде 2 , Манохар V Бадигер 3 , Прем Г Шадиджа 1 , Абхишек С Локханде 4 , Рагвендра А Бохара 1 5
Принадлежности
- 1 Центр междисциплинарных исследований им.
 Д.Ю. Университет Патила, Колхапур, Индия.
Д.Ю. Университет Патила, Колхапур, Индия. - 2 Кафедра микробиологии, Университет Шиваджи, Колхапур, Индия.
- 3 CSIR, Национальная химическая лаборатория, Пуна, Индия.
- 4 Факультет материаловедения и инженерии, Чоннамский национальный университет, Кванджу, Республика Корея.
- 5 CURAM, Центр исследований медицинских устройств, Ирландский национальный университет, Голуэй, Ирландия.
- PMID: 30582010
- PMCID: PMC6295600
- DOI:
10.
 1016/j.bbrep.2018.11.007
1016/j.bbrep.2018.11.007
Абстрактный
Настоящее исследование посвящено легкому полиол-опосредованному синтезу и характеристике наночастиц ZnO и их антимикробной активности против патогенных микроорганизмов. Процесс синтеза проводили путем кипячения с обратным холодильником предшественника ацетата цинка в диэтиленгликоле (ДЭГ) и триэтиленгликоле (ТЭГ) в присутствии и в отсутствие ацетата натрия в течение 2 и 3 часов. Все синтезированные наночастицы ZnO были охарактеризованы методами рентгеновской дифракции (XRD), УФ-видимой спектроскопии (UV), термогравиметрического анализа (TGA), инфракрасной спектроскопии с преобразованием Фурье (FTIR), сканирующей электронной микроскопии с полевой эмиссией (FESEM), просвечивающей электронной микроскопии (TEM). ) и методом энергодисперсионной рентгеновской спектроскопии (EDX). Все наночастицы показали разную степень антибактериальной и антибиопленочной активности в отношении грамположительных Staphylococcus aureus (NCIM 2654) и грамотрицательный Proteus vulgaris (NCIM 2613). Антибактериальная и антибиопленочная активность обратно пропорциональна размеру синтезированных наночастиц ZnO. Среди всех приготовленных частиц наночастицы ZnO с наименьшим размером (~ 15 нм), приготовленные путем кипячения дигидрата ацетата цинка в диэтиленгликоле в течение 3 часов, проявили замечательную антибактериальную активность и антибиопленочную активность, которые могут служить потенциальными альтернативами в биомедицинском применении.
Антибактериальная и антибиопленочная активность обратно пропорциональна размеру синтезированных наночастиц ZnO. Среди всех приготовленных частиц наночастицы ZnO с наименьшим размером (~ 15 нм), приготовленные путем кипячения дигидрата ацетата цинка в диэтиленгликоле в течение 3 часов, проявили замечательную антибактериальную активность и антибиопленочную активность, которые могут служить потенциальными альтернативами в биомедицинском применении.
Ключевые слова: антибактериальный; Антибиопленочная активность; ZnO-полиольный метод.
Цифры
Схема 1
Схематическое изображение синтеза…
Схема 1
Схематическое изображение синтеза наночастиц ZnO, опосредованных ДЭГ и ТЭГ.
Схематическое изображение синтеза наночастиц ZnO, опосредованных ДЭГ и ТЭГ.
Рис. 1
(A) XRD DEG 2…
Рис. 1
(A) Рентгенограмма ДЭГ 2 ч(а), ДЭГ 2 ч с ацетатом натрия(б), ДЭГ…
рисунок 1(А) Рентгенограмма ДЭГ 2 ч(а), ДЭГ 2 ч с ацетатом натрия(б), ДЭГ 3 ч(в), ДЭГ 3 ч с ацетатом натрия(г), (Б) ТЭГ 2 ч(а), ТЭГ 2 ч с ацетатом натрия(б), ТЭГ 3 ч(в), ТЭГ 3 ч с ацетатом натрия(г).
Рис. 2
FESEM микрофотографии (а) DEG…
Рис. 2
2
Микрофотографии ФЭСЭМ (а) ДЭГ 2 ч, (б) ДЭГ 2 с ацетатом натрия,…
Рис. 2FESEM микрофотографии (а) ДЭГ 2 ч, (б) ДЭГ 2 с ацетатом натрия, (в) ДЭГ 3 ч, (г) ДЭГ 3 ч с ацетатом натрия, (д) ТЭГ 2 ч, (е) ТЭГ 2 ч с ацетатом натрия, (ж) ТЭГ 3 ч, (з) ТЭГ 3 ч с ацетатом натрия.
Рис. 3
Репрезентативные ПЭМ-изображения (а)…
Рис. 3
Репрезентативные ПЭМ-изображения (a) ДЭГ 2 ч, (b) ДЭГ 2 ч с…
Рис. 3 Репрезентативные ПЭМ-изображения (а) ДЭГ 2 ч, (б) ДЭГ 2 ч с ацетатом натрия, (в) ДЭГ 3 ч, (г) ДЭГ 3 ч с ацетатом натрия, (д) ТЭГ 2 ч, (е) ТЭГ 2 ч с ацетатом натрия, (ж) ТЭГ 3 ч, (з) ТЭГ 3 ч с ацетатом натрия.
Рис. 4
Антибактериальная активность ДЭГ и…
Рис. 4
Антибактериальная активность синтезированных НЧ ZnO, опосредованных ДЭГ и ТЭГ (1 мг/мл), в отношении…
Рис. 4Антибактериальная активность синтезированных НЧ ZnO, опосредованных ДЭГ и ТЭГ (1 мг/мл), в отношении грамположительных Staphylococcus aureus (NCIM 2654) (A) и грамотрицательных Proteus vulgaris (NCIM 2613) (B), в планшете (I) и (III) инокулированные образцы: (1) ДЭГ 3 ч, (2) ДЭГ 3 ч с ацетатом натрия, (3) ДЭГ 2 ч, (4) ДЭГ 2 ч с ацетатом натрия и в чашке (II) и (IV) инокулированные образцы: (1) ТЭГ 2 ч с ацетатом натрия, (2) ТЭГ 3 ч, (3) ТЭГ 3 ч с ацетатом натрия, (4) ТЭГ 2 ч.
Рис. 5
5
% ингибирования всех…
Рис. 5
% ингибирования всех образцов ZnO при разных концентрациях всего ZnO…
Рис. 5% ингибирования всех образцов ZnO при различных концентрациях всех наночастиц ZnO против Staphylococcus aureus (NCIM 2654) (A) и Proteus vulgaris (NCIM 2613) (B), (1) ДЭГ 3 ч, (2) ДЭГ 3 ч с ацетатом натрия, (3) ТЭГ 3 ч, (4) ТЭГ 3 ч с ацетатом натрия , 5 – ТЭГ 2 ч, 6 – ТЭГ 2 ч с ацетатом натрия, 7 – ДЭГ 2 ч, 8 – ДЭГ 2 ч с ацетатом натрия.
Рис. 6
% ингибирования биопленки…
Рис. 6
% ингибирования биопленки всех образцов ZnO при различных концентрациях всех…
Рис. 6
6 % ингибирования биопленки всех образцов ZnO при различных концентрациях всех наночастиц ZnO против Staphylococcus aureus (NCIM 2654) (A) и Proteus vulgaris (NCIM 2613) (B), (1) DEG 3 h, (2 ) ДЭГ 3 ч с ацетатом натрия, (3) ТЭГ 3 ч, (4) ТЭГ 3 ч с ацетатом натрия, (5) ТЭГ 2 ч, (6) ТЭГ 2 ч с ацетатом натрия, (7) ДЭГ 2 ч, ( 8) DEG 2 ч с ацетатом натрия.
Рис. 7
Антибактериальное и антибиопленочное действие…
Рис. 7
Антибактериальное и антибиопленочное действие ZnO на бактерии.
Рис. 7Антибактериальное и антибиопленочное действие ZnO на бактерии.
См. это изображение и информацию об авторских правах в PMC
Похожие статьи
Биосинтез, характеристика и антимикробная активность наночастиц оксида цинка из экстракта листьев Mentha pulegium (L.
 ).
).Рад С.С., Сани А.М., Мохсени С. Рад С.С. и др. Микроб Патог. 2019 июнь; 131: 239-245. doi: 10.1016/j.micpath.2019.04.022. Epub 2019 17 апр. Микроб Патог. 2019. PMID: 31002961
Нисходящее нанопроизводство бинарного (CdO) x (ZnO) 1-x наночастиц и их антибактериальная активность.
Аль-Хада Н.М., Мохамед Камари Х., Абдулла САС, Сайон Э., Шаари А.Х., Талиб З.А., Матори К.А. Аль-Хада Н.М. и др. Int J Наномедицина. 20 ноября 2017 г.; 12:8309-8323. дои: 10.2147/IJN.S150405. Электронная коллекция 2017. Int J Наномедицина. 2017. PMID: 29200844 Бесплатная статья ЧВК.
Легкий зеленый синтез наночастиц оксида цинка с использованием экстракта морских водорослей Ulva lactuca и оценка их фотокаталитической, антибиопленочной и инсектицидной активности.

Ишвария Р., Васихаран Б., Кальяни С., Банумати Б., Говиндараджан М., Альхарби Н.С., Кадайкуннан С., Аль-Анбр М.Н., Халед Дж.М., Бенелли Г. Ишвария Р. и соавт. J Photochem Photobiol B. 2018 Jan; 178: 249-258. doi: 10.1016/j.jphotobiol.2017.11.006. Epub 2017 7 ноября. Дж Фотохим Фотобиол Б. 2018. PMID: 29169140
Фитоопосредованный синтез наночастиц оксида цинка Berberis aristata: характеристика, антиоксидантная активность и антибактериальная активность с особым упором на патогены мочевыводящих путей.
Чандра Х., Патель Д., Кумари П., Джангван Дж.С., Ядав С. Чандра Х. и др. Mater Sci Eng C Mater Biol Appl. 2019 сен; 102: 212-220. doi: 10.1016/j.msec.2019.04.035. Epub 2019 13 апр. Mater Sci Eng C Mater Biol Appl. 2019. PMID: 31146992
Изготовление наночастиц металлов и оксидов металлов водорослями и их токсические эффекты.

Сиддики К.С., Хусен А. Сиддики К.С. и соавт. Nanoscale Res Lett. 2016 дек.; 11(1):363. дои: 10.1186/s11671-016-1580-9. Epub 2016 17 августа. Nanoscale Res Lett. 2016. PMID: 27530743 Бесплатная статья ЧВК. Обзор.
Посмотреть все похожие статьи
Цитируется
Комплексное исследование физико-химических свойств НК био-ZnO.
Крул-Гурняк А., Райлян В., Помастовский П., Плоциньский Т., Глок М., Добруцкая Р., Куржидловский К.Ю., Бушевский Б. Крул-Гурняк А. и соавт. Научный представитель 2023 11 января; 13 (1): 587. дои: 10.1038/s41598-023-27564-ж. Научный представитель 2023. PMID: 36631546 Бесплатная статья ЧВК.
Синтез наноразмерного оксида цинка водным золь-гель методом в полиольной среде.

Захра С., Бухари Х., Кайсар С., Шейх А., Амин А. Захра С. и др. BMC хим. 2022 24 ноября; 16 (1): 104. doi: 10.1186/s13065-022-00900-3. BMC хим. 2022. PMID: 36434647 Бесплатная статья ЧВК.
Антибактериальная активность в отношении Staphylococcus aureus и Escherichia coli экстрагированного листового материала Piper betle с помощью диско-диффузионного анализа и периодических экспериментов.
Нгамсурах П., Прайпипат П. Нгамсурах П. и др. RSC Adv. 2022 16 сентября; 12 (40): 26435-26454. doi: 10.1039/d2ra04611c. Электронная коллекция 2022 12 сентября. RSC Adv. 2022. PMID: 36275084 Бесплатная статья ЧВК.
Изучение физико-химических, механических и фотокаталитических антибактериальных свойств стоматологического материала на основе метакрилата с наночастицами ZnO.

Комо П., Берджесс Дж., Малекафзали Н., Лейте М.Л., Ли А., Мансо А. Комо П. и др. Материалы (Базель). 2022 21 июля; 15 (14): 5075. дои: 10.3390/ma15145075. Материалы (Базель). 2022. PMID: 35888540 Бесплатная статья ЧВК.
Rubus ellipticus См. Наночастицы оксида цинка, опосредованные фруктовым экстрактом: экологический подход к деградации красителей и биомедицинским применениям.
Дхатвалиа Дж., Кумари А., Чаухан А., Манси К., Такур С., Сайни Р.В., Гулерия И., Лал С., Кумар А., Бату К.М., Чой Б.Х., Маникум А.Е., Кумар Р. Дхатвалиа Дж. и др. Материалы (Базель). 2022 12 мая; 15 (10): 3470. дои: 10.3390/ma15103470. Материалы (Базель). 2022. PMID: 35629498 Бесплатная статья ЧВК.
Просмотреть все статьи “Цитируется по”
Рекомендации
- Лелуш Дж.
 , Кахана Э., Элиас С., Геданкен А., Банин Э. Антибиопленочная активность наноразмерного фторида магния. Биоматериалы. 2009; 30: 5969–5978.
–
пабмед
, Кахана Э., Элиас С., Геданкен А., Банин Э. Антибиопленочная активность наноразмерного фторида магния. Биоматериалы. 2009; 30: 5969–5978.
–
пабмед
- Лелуш Дж.
- Wu C., Labrie J., Tremblay YDN, Haine D., Mourez M., Jacques M. Цинк как средство для предотвращения образования биопленки патогенными бактериями. Дж. Заявл. микробиол. 2013; 115:30–40. – пабмед
- Донлан Р.М. Биопленки: микробная жизнь на поверхностях. Эмердж. Заразить. Дис. 2002; 8: 881–890. – ЧВК – пабмед
- Шакибай М.

- Шакибай М.

