Характеристика элемента аргон: Характеристика элемента аргон – ответ на Uchi.ru
alexxlab | 12.08.1988 | 0 | Разное
Химические свойства и роль аргона в производстве
| Аргон | |
| Атомный номер | 18 |
| Внешний вид простого вещества | инертный газ без цвета, вкуса и запаха |
| Свойства атома | |
| Атомная масса (молярная масса) | 39,948 а. е. м. (/моль) |
| Радиус атома | ? (71)[1] |
| Энергия ионизации (первый электрон) | 1519,6(15,75) кДж/моль () |
| Электронная конфигурация | [Ne] 3s2 3p6 |
| Химические свойства | |
| Ковалентный радиус | 106 пм |
| Радиус иона | 154 |
| Электроотрицательность (по Полингу) | 0,0 |
| Электродный потенциал | 0 |
| Степени окисления | 0 |
| Термодинамические свойства простого вещества | |
| Плотность | (при -186 °C) 1,40 /³ |
| Молярная теплоёмкость | 20,79[2]/(·моль) |
| Теплопроводность | 0,0177 /(·) |
| Температура плавления | 83,8 |
| Теплота плавления | n/a кДж/моль |
| Температура кипения | 87,3 |
| Теплота испарения | 6,52 кДж/моль |
| Молярный объём | 24,2 ³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 5,260 |
| Отношение c/a | — |
| Температура Дебая | 85 |
| Ar | 18 |
| 39,948 | |
| [Ne]3s23p6 | |
| Аргон | |
Аргон
— элемент главной подгруппы восьмой группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 18. Обозначается символом Ar (лат. Argon). Третий по распространённости элемент в земной атмосфере (после азота и кислорода) — 0,93 % по объёму. Простое вещество аргон (CAS-номер: 7440–37–1) — инертный одноатомный газ без цвета, вкуса и запаха.
И. Менделеева, с атомным номером 18. Обозначается символом Ar (лат. Argon). Третий по распространённости элемент в земной атмосфере (после азота и кислорода) — 0,93 % по объёму. Простое вещество аргон (CAS-номер: 7440–37–1) — инертный одноатомный газ без цвета, вкуса и запаха.
История
Схема атома аргона
История открытия аргона начинается в 1785 году, когда английский физик и химик Генри Кавендиш, изучая состав воздуха, решил установить, весь ли азот воздуха окисляется. С помощью электрофорной машины в течение многих недель он подвергал воздействию электрического разряда смесь воздуха с кислородом в U-образных трубках, в результате чего в них образовывались все новые порции бурых окислов азота, которые исследователь периодически растворял в щёлочи. Через некоторое время образование окислов прекращалось, но, после связывания оставшегося кислорода, оставался газовый пузырь, объём которого не уменьшался при длительном воздействии электрических разрядов в присутствии кислорода. Кавендиш оценил объём оставшегося газового пузыря в 1/120 от первоначального объёма воздуха[4][5]. Разгадать загадку пузыря Кавендиш не смог, поэтому прекратил свое исследование, и даже не опубликовал его результатов. Только спустя много лет английский физик Джеймс Максвелл собрал и опубликовал неизданные рукописи и лабораторные записки Кавендиша.
Кавендиш оценил объём оставшегося газового пузыря в 1/120 от первоначального объёма воздуха[4][5]. Разгадать загадку пузыря Кавендиш не смог, поэтому прекратил свое исследование, и даже не опубликовал его результатов. Только спустя много лет английский физик Джеймс Максвелл собрал и опубликовал неизданные рукописи и лабораторные записки Кавендиша.
Дальнейшая история открытия аргона связана с именем Рэлея, который несколько лет посвятил исследованиям плотности газов, особенно азота. Оказалось, что литр азота, полученного из воздуха, весил больше литра «химического» азота (полученного путём разложения какого-либо азотистого соединения, например, закиси азота, окиси азота, аммиака, мочевины или селитры) на 1,6 мг (вес первого был равен 1,2521, а второго 1,2505 г). Эта разница была не так уж мала, чтобы можно было её отнести на счет ошибки опыта. К тому же она постоянно повторялась независимо от источника получения химического азота
Не придя к разгадке, осенью 1892 года Рэлей в журнале «Nature» опубликовал письмо к учёным, с просьбой дать объяснение тому факту, что в зависимости от способа выделения азота он получал разные величины плотности. Письмо прочли многие учёные, однако никто не был в состоянии ответить на поставленный в нём вопрос.
Письмо прочли многие учёные, однако никто не был в состоянии ответить на поставленный в нём вопрос.
У известного уже в то время английского химика Уильяма Рамзая также не было готового ответа, но он предложил Рэлею свое сотрудничество. Интуиция побудила Рамзая предположить, что азот воздуха содержит примеси неизвестного и более тяжелого газа, а Дьюар обратил внимание Рэлея на описание старинных опытов Кавендиша (которые уже были к этому времени опубликованы)
Пытаясь выделить из воздуха скрытую составную часть, каждый из учёных пошел своим путём. Рэлей повторил опыт Кавендиша в увеличенном масштабе и на более высоком техническом уровне. Трансформатор под напряжением 6000 вольт посылал в 50-литровый колокол, заполненный азотом, сноп электрических искр. Специальная турбина создавала в колоколе фонтан брызг раствора щёлочи, поглощающих окислы азота и примесь углекислоты. Оставшийся газ Рэлей высушил, и пропустил через фарфоровую трубку с нагретыми медными опилками, задерживающими остатки кислорода. Опыт длился несколько дней
Опыт длился несколько дней
Рамзай воспользовался открытой им способностью нагретого металлического магния поглощать азот, образуя твёрдый нитрид магния. Многократно пропускал он несколько литров азота через собранный им прибор. Через 10 дней объём газа перестал уменьшаться, следовательно, весь азот оказался связанным. Одновременно путём соединения с медью был удален кислород, присутствовавший в качестве примеси к азоту. Этим способом Рамзаю в первом же опыте удалось выделить около 100 см³ нового газа.
Итак, был открыт новый элемент. Стало известно, что он тяжелее азота почти в полтора раза и составляет 1/80 часть объёма воздуха. Рамзай при помощи акустических измерений нашёл, что молекула нового газа состоит из одного атома — до этого подобные газы в устойчивом состоянии не встречались. Отсюда следовал очень важный вывод — раз молекула одноатомна, то, очевидно, новый газ представляет собой не сложное химическое соединение, а простое вещество.
Много времени затратили Рамзай и Рэлей на изучение его реакционной способности по отношению ко многим химически активным веществам. Но, как и следовало ожидать, пришли к выводу: их газ совершенно недеятелен. Это было ошеломляюще — до той поры не было известно ни одного настолько инертного вещества.
Но, как и следовало ожидать, пришли к выводу: их газ совершенно недеятелен. Это было ошеломляюще — до той поры не было известно ни одного настолько инертного вещества.
Большую роль в изучении нового газа сыграл спектральный анализ. Спектр выделенного из воздуха газа с его характерными оранжевыми, синими и зелёными линиями резко отличался от спектров уже известных газов. Уильям Крукс, один из виднейших спектроскопистов того времени, насчитал в его спектре почти 200 линий. Уровень развития спектрального анализа на то время не дал возможности определить, одному или нескольким элементам принадлежал наблюдаемый спектр. Несколько лет спустя выяснилось, что Рамзай и Рэлей держали в своих руках не одного незнакомца, а нескольких — целую плеяду инертных газов.
7 августа 1894 года в Оксфорде, на собрании Британской ассоциации физиков, химиков и естествоиспытателей, было сделано сообщение об открытии нового элемента, который был назван аргоном. В своём докладе Рэлей утверждал, что в каждом кубическом метре воздуха присутствует около 15 г открытого газа (1,288 вес. %). Слишком невероятен был тот факт, что несколько поколений ученых не заметили составной части воздуха, да еще и в количестве целого процента! В считанные дни десятки естествоиспытателей из разных стран проверили опыты Рамзая и Рэлея. Сомнений не оставалось: воздух содержит аргон.
%). Слишком невероятен был тот факт, что несколько поколений ученых не заметили составной части воздуха, да еще и в количестве целого процента! В считанные дни десятки естествоиспытателей из разных стран проверили опыты Рамзая и Рэлея. Сомнений не оставалось: воздух содержит аргон.
Через 10 лет, в 1904 году, Рэлей за исследования плотностей наиболее распространнённых газов и открытие аргона получает Нобелевскую премию по физике, а Рамзай за открытие в атмосфере различных инертных газов — Нобелевскую премию по химии.
Происхождение названия
По предложению доктора Медана (председателя заседания, на котором был сделан доклад об открытии) Рэлей и Рамзай дали новому газу имя «аргон» (от греч. αργός — ленивый, медленный, неактивный). Это название подчеркивало важнейшее свойство элемента — его химическую неактивность.
youtube.com/embed/x9b9l2lXb0w?feature=oembed” frameborder=”0″ allow=”accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture” allowfullscreen=””/>
Аргон: технические характеристики
Аргон представляет собой бесцветный газ, который не оказывает никакого действия на органы вкуса и обоняния. Этот одноатомный элемент является одним из самых распространённых инертных газообразных веществ на земле.
Аргон был открыт в конце XIX века британским учёным Джоном Стреттом. Исследователь проводил опыты по выделению азота из воздуха. В результате экспериментов было выяснено, что азот полученный таким образом имеет немного большую плотность, чем в случае, когда для получения этого газа использовались органические вещества. Учёный предположил, что азот из атмосферы содержит примесь неизвестного на тот момент газообразного вещества. Впоследствии, эти догадки были подтверждены, и аргон был получен в чистом виде и тщательно исследован.
Учёных, которые пытались произвести различные опыты с аргоном, ошеломил тот факт, что этот газ не вступал в реакцию с другими химическими элементами. Таким образом удалось впервые получить благородный газ с подобными характеристиками.
Таким образом удалось впервые получить благородный газ с подобными характеристиками.
Несмотря на отсутствие соединений аргон, как и другие вещества, обладает физическими свойствами. К наиболее важным характеристикам газа относятся:
- Плотность: 1,784 кг/м3.
- Температура кипения: -185,8 ˚С.
- Тройная точка: -189,8˚С.
- Содержание в воздухе: 0,9% объёма.
Аргон практически не растворяется в воде, а также абсолютно безопасен в плане пожарной активности. Этот газ не ядовит, поэтому при работе с ним не требуется использовать каких-либо средств защиты.
Распространённость
Во Вселенной
Содержание аргона
в мировой материи оценивается приблизительно в 0,02 % по массе.
Аргон (вместе с неоном) наблюдается на некоторых звездах и в планетарных туманностях. В целом его в космосе больше, чем кальция, фосфора, хлора, в то время как на Земле существуют обратные отношения.
Земная кора
Аргон — третий по содержанию после азота и кислорода компонент воздуха, его среднестатистическое содержание в атмосфере Земли составляет 0,934 % по объему и 1,288 % по массе, его запасы в атмосфере оцениваются в 4·1014 т. Аргон — самый распространённый инертный газ в земной атмосфере, в 1 м³ воздуха содержится 9,34 л аргона (для сравнения: в том же объеме воздуха содержится 18,2 см³ неона, 5,2 см³ гелия, 1,1 см³ криптона, 0,09 см³ ксенона).
Аргон — самый распространённый инертный газ в земной атмосфере, в 1 м³ воздуха содержится 9,34 л аргона (для сравнения: в том же объеме воздуха содержится 18,2 см³ неона, 5,2 см³ гелия, 1,1 см³ криптона, 0,09 см³ ксенона).
Содержание аргона в литосфере — 4·10-6 % по массе. В каждом литре морской воды растворено 0,3 см³ аргона, в пресной воде его содержится 5,5·10-5 — 9,7·10-5 %. Его содержание в Мировом океане оценивается в 7,5·1011 т, а в изверженных породах земной оболочки — 16,5·1011 т.
История открытия Аргона
Впервые неизвестный до этого газ, при химических и физических экспериментах, обнаружил в 1785 году Генри Кавендиш — английский физик и химик. Но он не смог разгадать загадку и прекратил исследования. Позднее на записи Кавендиша обратил внимание Джеймс Максвелл.
И лишь спустя более ста лет, в 1894 году, химик Уильям Рамзай и физик Джон Уильям Стретт (Лорд Рэлей) сделали доклад об открытии нового элемента, который, за свою химическую неактивность, назвали аргоном. Это случилось в Оксфорде на собрании Британской ассоциации естествоиспытателей, физиков и химиков. Название нового газа произошло от греческого слова ἀργός, что в переводе означает — неактивный, медленный.
Это случилось в Оксфорде на собрании Британской ассоциации естествоиспытателей, физиков и химиков. Название нового газа произошло от греческого слова ἀργός, что в переводе означает — неактивный, медленный.
Спустя еще 10 лет, эти ученые получили Нобелевские премии за исследования газов, открытие аргона и других инертных газов в атмосфере.
Определение
Качественно аргон обнаруживают с помощью эмиссионного спектрального анализа, основные характеристические линии — 434,80 и 811,53 нм. При количественном определении сопутствующие газы (O2, N2, h3, CO2) связываются специфичными реагентами (Ca, Cu, MnO, CuO, NaOH) или отделяются с помощью поглотителей (например, водных растворов органических и неорганических сульфатов). Отделение от других инертных газов основано на различной адсорбируемости их активным углём. Используются методы анализа, основанные на измерении различных физических свойств (плотности, теплопроводности и др.), а также масс-спектрометрические и хроматографические методы анализа.
Химические свойства
Пока известны только 2 химических соединения аргона — гидрофторид аргона и CU(Ar)O, которые существуют при очень низких температурах. Кроме того, аргон образует эксимерные молекулы, то есть молекулы, у которых устойчивы возбужденные электронные состояния и неустойчиво основное состояние. Есть основания считать, что исключительно нестойкое соединение Hg—Ar, образующееся в электрическом разряде, — это подлинно химическое (валентное) соединение. Не исключено, что будут получены другие валентные соединения аргона с фтором и кислородом, которые тоже должны быть крайне неустойчивыми. Например, при электрическом возбуждении смеси аргона и хлора возможна газофазная реакция с образованием ArCl.
Также со многими веществами, между молекулами которых действуют водородные связи (водой, фенолом, гидрохиноном и другими), образует соединения включения (клатраты), где атом аргона, как своего рода «гость», находится в полости, образованной в кристаллической решётке молекулами вещества-хозяина.
Соединение CU(Ar)O получено из соединения урана с углеродом и кислородом CUO. Вероятно существование соединений со связями Ar-Si и Ar-C: FArSiF3 и FArCCH.
Применение Аргона
Основными потребителями аргона являются:
Металлургия
. Применение аргона в современных технологических процессах выплавки стали — продувка расплава в ковше. Эта операция выполняет несколько функций: охлаждение металла, ускорение плавления вводимых в ковш лигатур и раскислителей, гомогенизация металла по химическому составу и температуре, очищение от неметаллических включений, образующихся от раскисляющих и легирующих добавок, углеродное раскисление металла и его обезуглероживание, удаление водорода и азота, ускорение десульфурации (удаление серы из расплава), вдувание раскисляющих и легирующих порошкообразных добавок.
В металлургии высококачественных сплавов аргон используется для защиты расплава от контакта с воздухом во время выплавки и разливки. Высокотемпературная обработка титана и его сплавов требует защитной аргоновой атмосферы. Незаменим аргон и в технологиях обработки таких редких металлов как цирконий, вольфрам, тантал, ниобий, бериллий, гафний и др.
Незаменим аргон и в технологиях обработки таких редких металлов как цирконий, вольфрам, тантал, ниобий, бериллий, гафний и др.
Металлообрабатывающая промышленность
. Основное использование аргона — создание защитной завесы при электродуговой (АРДЭС), контактной и лазерной сварке, термообработке. Аргон — плазмообразующий газ в установках сварки и резки активных, редких металлов, сплавов на их основе, например, алюминиевых и магниевых, нержавеющих, хромоникелевых, жаропрочных сплавов и легированных сталей.
Радиоэлектронная промышленность
. Здесь аргон незаменим для создания инертной среды в установках плазменного напыления, заполнение колб электрических и люминесцентных ламп, электровакуумных приборов, газосветной рекламы. Например, сине-голубое свечение получается при заполнении трубок аргоном с парами ртути.
Пищевая промышленность
. Благодаря своей химической нейтральности, аргон широко используют как пропеллтен («выталкивающий» газ) в аэрозольных упаковках, антифламинг (вещество снижающее образование пены) и «упаковочный» газ в пищевой промышленности.
Изотопы
Аргон представлен в земной атмосфере тремя стабильными изотопами: 36Ar (0,337 %), 38Ar (0,063 %), 40Ar (99,600 %). Почти вся масса тяжёлого изотопа 40Ar возникла на Земле в результате распада радиоактивного изотопа калия 40K (содержание этого изотопа в изверженных породах в среднем составляет 3,1 г/т). Распад радиоактивного калия идёт по двум направлениям одновременно:
Первый процесс (обычный β-распад) протекает в 88 % случаев и ведет к возникновению стабильного изотопа кальция. Во втором процессе, где участвуют 12 % атомов, происходит электронный захват, в результате чего образуется тяжёлый изотоп аргона. Одна тонна калия, содержащегося в горных породах или водах, в течение года генерирует приблизительно 3100 атомов аргона. Таким образом, в минералах, содержащих калий, постепенно накапливается 40Ar, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
Вероятные источники происхождения изотопов 36Ar и 38Ar — неустойчивые продукты спонтанного деления тяжёлых ядер, а также реакции захвата нейтронов и альфа-частиц ядрами лёгких элементов, содержащихся в урано-ториевых минералах.
Подавляющая часть космического аргона состоит из изотопов 36Ar и 38Ar. Это вызвано тем обстоятельством, что калий распространён в космосе примерно в 50 000 раз меньше, чем аргон (на Земле калий преобладает над аргоном в 660 раз). Примечателен произведенный геохимиками подсчёт: вычтя из аргона земной атмосферы радиогенный 40Ar, они получили изотопный состав, очень близкий к составу космического аргона.
Свойства атома аргона:
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 39,948(1) а.е.м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 |
| 203 | Электронная оболочка | K2 L8 M8 N0 O0 P0 Q0 R0 |
| 204 | Радиус атома (вычисленный) | 71 пм |
| 205 | Эмпирический радиус атома | |
| 206 | Ковалентный радиус* | 106 пм |
| 207 | Радиус иона | 154 пм |
| 208 | Радиус Ван-дер-Ваальса | 188 пм |
| 209 | Электроны, Протоны, Нейтроны | 18 электронов, 18 протонов, 22 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 3 |
| 212 | Группа в периодической таблице | 18-ая группа (по старой классификации – главная подгруппа 8-ой группы) |
| 213 | Эмиссионный спектр излучения |
Применение
Заполненная аргоном и парами ртути газоразрядная трубка
Применения аргона:
- в аргоновых лазерах
- в лампах накаливания и при заполнении внутреннего пространства стеклопакетов
- в качестве защитной среды при сварке (дуговой, лазерной, контактной и т.
 п.) как металлов, так и неметаллов
п.) как металлов, так и неметаллов - в качестве плазмаобразователя в плазматронах при сварке и резке
- в пищевой промышленности аргон зарегистрирован в качестве пищевой добавки E938, в качестве пропеллента и упаковочного газа
- в качестве огнетушащего вещества в газовых установках пожаротушения
Биологическая роль
Аргон не играет никакой биологической роли.
Теплопроводность аргона в газообразном состоянии при высоких температурах
В таблице приведены значения теплопроводности аргона в газообразном состоянии при нормальном атмосферном давлении при высоких температурах. Теплопроводность в таблице дана при температуре от 1500 до 5000 К (от 1227 до 4727 °С).
Из таблицы видно, что теплопроводность аргона при высоких температурах с ростом температуры также увеличивается и равна при 5000 К значению 0,131 Вт/(м·град). Примечание: Будьте внимательны! Теплопроводность указана в степени 103. Не забудьте разделить на 1000!
Аргон.
 «Ненужный маркетинговый ход» или изобретение века?
«Ненужный маркетинговый ход» или изобретение века?Для начала – цитата из «Википедии»: «Ма́рке́тинг (от англ. Marketing – в буквальном переводе означает «действие на рынке», «рыночную деятельность») – это организационная функция и совокупность процессов создания, продвижения и предоставления продукта или услуги. В широком смысле задачи маркетинга состоят в определении и удовлетворении человеческих и общественных потребностей».
«В широком-то да», наверняка подумали многие, а вот в «узком» благородное, казалось бы, дело, чуть ли не стало синонимом таких нелицеприятных слов, как обман, втюхивание ненужного, украшательство etc. Кто не сталкивался (да чего греха таить — и не поддавался на уговоры) с такими «необходимыми» вещами, как «средство для очистки плитки и раковин с минералами Мертвого моря» (WTF?), «агрессивный рисунок протектора» подошвы городских туфель (зачем эта агрессия?), «закачка газа в шины» (вы подумайте — ведь в «Формуле-1» тоже качают!) и прочая и прочая.
Недавно, в шоуруме одной оконной компании, заказывая окна на «свой» объект, я вновь (это случилось не впервые) стал свидетелем борьбы, так сказать, «разумного человека» с «вашим дурацким маркетингом», а именно, с попыткой милой девушки-консультанта «впарить» (а прозвучал именно такой термин) стеклопакет, заполненный аргоном.
«А ведь он неправ, – подумал я, – газ в шинах «Формулы-1» как раз нужен». Азот, которым заполняют шины болидов не поддерживает горение и взрыв, и, как минимум, не дает окисляться дискам, которые стоят десятки тысяч евро и т.д. Но «Формула-1» – спорт космический, там важны все эти миллисекунды и нанограммы, а вот нужен ли также он в шинах городских малолитражек? Конечно, нет. А что же с аргоном? Да, несомненно, он нужен в стеклопакетах на Международной Космической Станции, на станции «Восток» в Антарктиде или в альпинистской хижине Монте-Роза в сердце Альп… Но в быту? В Киеве? Львове? Одессе? Иными словами, стоит ли овчинка выделки, а газонаполненный стеклопакет удорожания? Попробуем разобраться, а заодно спасти растерявшуюся от аргументов клиента девушку, которая от стыда за свой «обман» не знала, куда девать глаза.
Аргон, вопреки уверенности покупателя – вовсе не «маркетинговый ход, который изобрели пару лет назад». Такому утверждению немало удивился бы английский физик Рэлей, аристократ и фундаментальный ученый, открывший аргон в 1894 году, а в 1904 получивший за это открытие Нобелевскую премию. Рэлей и его коллега Рамзай были немало удивлены свойствами нового элемента периодической таблицы. Вернее – их отсутствием! Чем же аргон такой «особенный»? Его «особенность» зашифрована Рэлеем в самом имени «аргон» (от др.-греч. Ἀργός – медленный, ленивый, неактивный). Название элемента было призвано подчеркнуть его важнейшее свойство – химическую неактивность. Как и «братья по несчастью» – криптон, ксенон и другие инертные (благородные) газы, аргон практически не вступает в химические соединения с другими элементами, в том числе и с металлами.
 Уберите «ненужный» аргон — и «точно такой же» пакет уже не будет соответствовать ДБН – ведь его теплофизические характеристики «просядут» на 10-12 и даже 15%!
Уберите «ненужный» аргон — и «точно такой же» пакет уже не будет соответствовать ДБН – ведь его теплофизические характеристики «просядут» на 10-12 и даже 15%!Чем еще может удивить нас «маркетинговый ход»? Звукоизоляцией – заполнение стеклопакета аргоном на 1-2 Дцб снижает уровень доносящегося с улиц шума, этого бича современных городов.
У аргона и других инертных газов (недаром их второе название – «благородные») полностью отсутствуют цвет и запах, он никак не влияет на уровень пропускания ультрафиолета, а значит, цветы и их хозяева в безопасности.
Он не «выветривается через полгода» – по тем же ДБН утечка аргона не может превышать более 1% в год, а значит, концентрация газа в камере стеклопакета составит более 50% даже через 40 лет эксплуатации. И это не пустые строки «формуляров» – группа компаний Glas Trösch выкупала у своих европейских клиентов «первые ласточки» – газонаполненные стеклопакеты производства 80-90-х годов прошлого века, и содержание аргона в них полностью соответствовало расчетному.

Перечень преимуществ аргона в качестве заполнителя межстекольного пространства поражает. Это вовсе не «фотофиниш болида», не миллисекунды и нанограммы. Плюс 40%, плюс 15%, минус 2 децибелла… Такое не может стоить дешево. Не может – но стоит. В среднем, наполнение стеклопакета аргоном ведет к его удорожанию на 5 (!) %. Минус (в кошельке) 5%, плюс (в окне) 15%, 40% – эта простейшая арифметика говорит сама за себя.
Аргоновые «братья по несчастью», кстати, тоже не пасут задних… Если для «обычных» пакетов с 12-14-16 мм дистанционными рамками экономически оправдано использование аргона, для «ультралайт-пакетов» (с междустекольным пространством 8-10 мм) специалисты Glas Trösch рекомендуют криптон – еще один благородный газ, с еще лучшими теплоизоляционными характеристиками (однако, неоправданно дорогими при нормальной толщине стеклопакета).
Ну и последний, неотразимый аргумент. Да, Украина сейчас – площадка агрессивного маркетинга. Ни в одном городе Европы или США вы не увидите таких мегатонн билбордов, ситилайтов, лайтбоксов. Реклама, например, лекарств в развитом мире запрещена, а в США они продаются только по рецепту в максимально обезличенной упаковке. Но, при всем при этом – в Западной Европе заполненные воздухом стеклопакеты не производятся уже 15 лет.
Иван Пономаренко
Архитектор
Другие статьи на эту тему
Аргон: температура, состояния, сварка
Аргон (обозначается как Ar) — наиболее часто встречающийся в воздухе инертный газ. Он отличается полной химической инертностью. Это свойство позволяет широко применять газ в таких областях, как сварка, упаковка, производство материалов высокой чистоты, а также для тушения пожаров.
Он отличается полной химической инертностью. Это свойство позволяет широко применять газ в таких областях, как сварка, упаковка, производство материалов высокой чистоты, а также для тушения пожаров.
Инертный газ аргон
Содержание
История открытия
Предыстория открытия Ar началась в 1785 году. Выдающийся ученый и естествоиспытатель из Великобритании Генри Кэвендиш исследовал состав воздуха. Он подвергал азот окислению и взвешивал получившиеся окислы. По окончании опыта в сосуде оставался газ. Кэвендиш определил его объем в 0,8% от начального объема воздуха.
Состав этого газа ученый определить не смог. Спустя столетие к проблеме вернулись сэры Джон Рэлей и Уильям Рэмзи. В ходе проведенных опытов они обнаружили, что азот, выделенный из воздуха, имеет большую плотность, нежели азот, получаемый в ходе реакции разложения нитрита аммония.
в 1884 году им удалось выделить из воздуха некий газ, более плотный, чем азот. Это вещество имело одноатомную молекулярную структуру и было крайне инертным — т. е. не реагировало с другими веществами.
е. не реагировало с другими веществами.
На заседании Королевского Общества новому газу было присвоено название «аргон», что в переводе с древнегреческого значило «спокойный, ленивый»
Аргон в природе
Ввиду практически полной инертности Ar представлен в естественной среде исключительно в несвязанном виде. Его процентная доля в различных частях Земли равна приблизительно:
- земная кора — 0,00012%;
- морская вода — 0,00045%;
- атмосфера — 0,926%.
Доля Ar в воздухе выше, чем суммарная доля всех остальных инертных газов. Основным источником для его добычи служит наша атмосфера.
Содержание газов в атмосфере
В коре Земли аргон содержится также в виде радиоактивного изотопа Аргон-40 и появляется в ходе реакции распада изотопов Калия.
Современная наука вместе с остальными инертными газообразными элементами относит Ar к VIII группе периодической системы.
Как добывают аргон
Благодаря значительному с промышленной точки зрения содержанию аргона в воздухе его получают в качестве дополнительного продукта криогенной ректификации O2 и N2.
Технология основана на том факте, что температура кипения (или сжижения) Ar лежит между температурами N2 и O2.
Перед началом процесса воздух подвергается тщательной очистке от пыли в многоступенчатых фильтрах, осушается от водяных паров, а далее мощными компрессорами сжимается до тех пор, пока не перейдет в жидкое состояние. Жидкость перегоняют в ректификационной колонне, чтобы разделить ее на отдельные вещества.
Установка для добычи аргона
Первым испаряется азот при -195 °С, его пары собираются на соответствующей тарелке ректификатора и отводятся в отдельный резервуар. Следующим по высоте (и при температуре кипения -185 °С) отбирается аргонная фракция, содержащая 12% Ar, менее полпроцента азота и кислород. Она подается в следующую ректификационную колонну, в которой процентная доля Ar доводится до 85, оставшееся приходится на кислород со следами азота. Такое вещество называется сырым аргоном, исходным материалом для получения очищенного газа.
В промышленности применяется несколько методов очистки сырого аргона от примесей.
Водород, добавляемый в состав сырья, окисляется на катализаторе и нагреве до 500 °С, таким образом, из состава смеси выводится кислород. Образовавшийся на катализаторе водяной пары удаляют при посредстве влагоотделителя. Газ после этого осушают. Аргон с оставшимся в нем азотом вновь ректифицируют.
Применяются и альтернативные методы получения Ar. Во время синтеза аммиака из азота и водорода в химических реакторах Ar получают как сопутствующий продукт производства. Технологический компонент это синтеза — продувочный газ — содержит до 20% Ar. Из этого газа и извлекают самый спокойный элемент. Стоимость производства, складывающаяся в основном из затрат на охлаждение и нагрев компонентов, делится между аммиаком и аргоном, и получается существенно ниже.
Качество газа, получаемого любым методом, определяется технологией очистки его от небольших количеств остаточного N2, O2, водяных паров и H2.
Аппарат, получающий ионные пучки аргона
Общая характеристика Ar
Ar входит в группу инертных газов. Заряд его ядра — 18, под таким же номером элемент располагается в таблице Менделеева.
Из всех участников VIIIA группы он является наиболее часто встречающимся в природе. Объемная доля Ar в атмосфере -0,93%, массовая доля составляет 1,28%.Элемент является газом без цвета, вкуса и запаха. Химически не активен – аргон не вступает в реакцию и практически не соединяется ни с какими элементами или веществами, за исключением CU(Ar)O, и гидрофторида аргона.
Весьма плохо растворим водой, чуть большая растворимость наблюдается при взаимодействии с органическими растворителям.
Виды аргона
Говоря о видах, или сортах Ar, надо понимать, что это одно и то же химическое вещество. Виды различаются по степени очистки от примесей.
- Высший сорт. Содержание Ar не менее 99,99% . Этот сорт особо высокой чистоты применяется для ответственных сварочных работ, таких, как сварка материалов, химически активных в нагретом состоянии: некоторые цветные сплавы, прежде всего титановые, нержавеющая сталь и др.
 Используется также для сварки высоконагруженных изделий из конструкционной стали.
Используется также для сварки высоконагруженных изделий из конструкционной стали. - Первый сорт. Содержание Ar не менее 99,98%, Применяется при сварке сплавов на основе алюминия с другими металлами и сплавами, для менее активных цветных металлов.
- Второй сорт. Содержание Ar не менее 99,95%. Используется при сваривании деталей из жаростойких стальных сплавов, алюминия и конструкционных сталей. Применение чистого Ar в этих случаях нежелательно, поскольку приводит к повышенной пористости материала шва и не позволяет защитить сварочную ванну от повышенной влажности и других загрязнений. Во избежание возникновения такого дефекта в состав смеси защитных газов добавляют углекислый газ и кислород, связывающие выделяющийся при сварке водород и другие примеси. Образующиеся в ходе этих реакций шлаки всплывают на поверхность сварочной ванны и после застывания удаляются вместе с окалиной.
Физические и химические свойства
Свойства аргона типичны для члена VIII группы.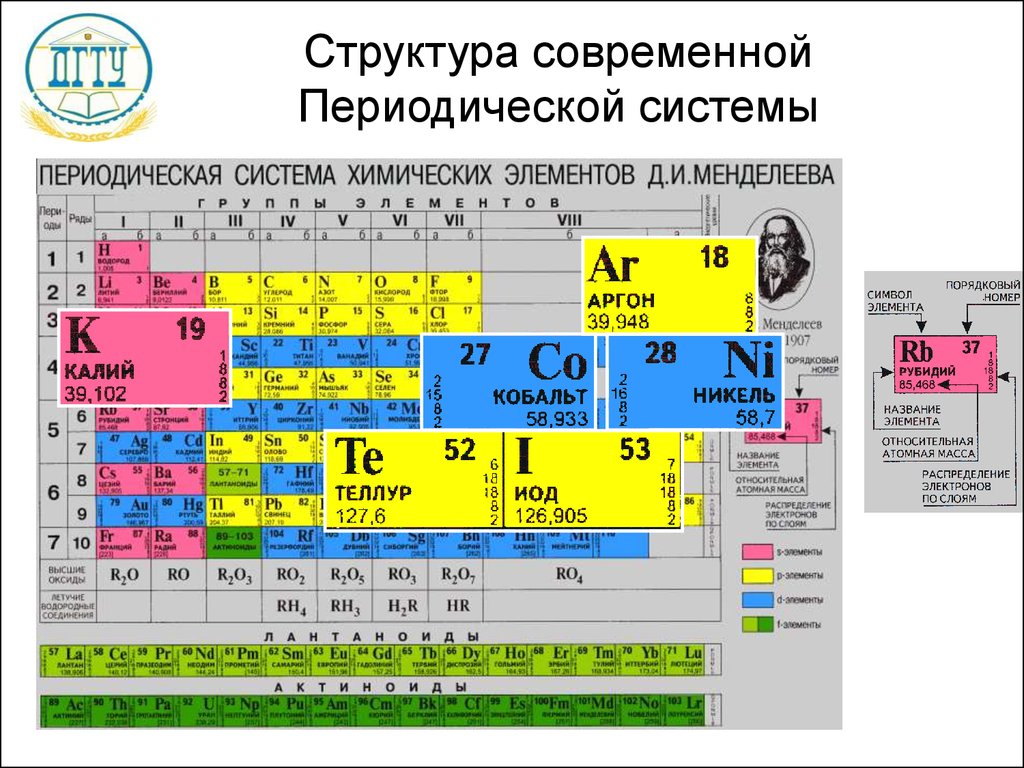
При обычной температуре Ar пребывает в газообразном состоянии. Молекула включает в себя единственный атома, химическая формула весьма простая: Ar. Температура кипения весьма низка : -185,8 °С при атмосферном уровне давления.
Растворимость в воде низкая — всего 3,29 мл на 100 мл жидкости
Плотность аргона при нормальных условиях составляет 1,78 кг/м3. Молярная теплоемкость газа- 20,7 Дж/Кмоль.
Характеристики аргона и других инертных газов
Газ практически полностью инертен. На сегодняшний день ученым удалось получить лишь два его соединения — CU(Ar)O, и гидрофторид аргона. Соединения существуют лишь при сверхнизких температурах. Предполагается, что Ar может входить в состав неустойчивых в нормальном состоянии молекул эксимерного типа. Такие молекулы могут существовать лишь в возбужденном состоянии, например, в ходе электроразряда высокой интенсивности. Такие соединения возможны с ртутью, кислородом и фтором.
Электроотрицательность по шкале Полинга равна 4,3.
Как степень окисления, так и электродный потенциал имеют нулевое значение, что характерно для инертного газа.
Ионный радиус составляет 154, радиус ковалентности — 106 Пм. Ионизационный порог- 1519 кдж/моль
Атомная и молекулярная масса
Такие важные параметры, как атомная и молекулярная массы, показывают, насколько масса молекулы вещества и масса его атома соответственно превышают значение, равное одной двенадцатой доле массы атома водорода.
Ввиду того, что молекула Ar состоит из единственного атома, молекулярная и атомная масса аргона идентичны и составляют 39,984.
Структура аргона и его свойства
Изотопы
В природных условиях Ar встречается в качестве трех устойчивых изотопов
- 36Ar– процентная доля этого изотопа составляет 0,337% в ядре 18 протонов и 18 нейтронов;
- 38Ar- его доля всего 0,063%, в ядре 18 протонов и 20 нейтронов;
- 40Ar – наиболее распространен, его доля составляет 99,6%, в ядре так же 18 протонов, но уже 22 нейтрона.

Искусственным путем удавалось получать изотопы с массовым индексом от 32 до 55, наиболее стабильным из них оказался 39Ar, период полураспада которого составляет 268 лет.
Большая процентная доля 40Ar среди изотопов, встречающихся в природе, вызвана постоянным образованием его в ходе реакции распада изотопа калий-40. На 1000 кг калия в ходе таких реакций за год образуется не более 3100 атомов 40Ar. Но, поскольку эти реакции идут постоянно в течение сотен миллионов лет, изотоп накопился в природе в существенных объемах.
Доминирование тяжелого изотопа в природе обуславливает тот факт, что атомный вес Ar превышает атомный вес калия, находящегося в таблице следом за ним. При создании Периодической системы такого противоречия не было, поскольку аргон был обнаружен и свойства его были исследованы значительно позже, в первом десятилетии XX века. Первоначально Ar был помещен в первую группу таблицы, восьмая группа была выделена позднее.
youtube.com/embed/6Lol_kZJQFY?feature=oembed” frameborder=”0″ allow=”autoplay; encrypted-media” allowfullscreen=””>Ионы
Как и другие инертные газы (такие, как He и Ne), Ar подвержен ионизации. При возбуждении атомов и сообщении им высоких энергий возникают молекулярные ионы Ar2+.
Молекула и атом
Для инертных газов эти понятия идентичны, поскольку эти элементы не желают вступать в химическую связь даже с себе подобными. Молекула включает в себя один атом, химическая формула газа не отличается от обозначения элемента: Ar.
Молярная масса
Молярная масса аргона составляет 39,95 г/моль.
Существуют несколько методов ее вычисления:
- С применением относительной атомной массы M и коэффициента пропорциональности к, выражающего соотношение между относительной массой и молярной. Этот коэффициент является универсальной константой и равен для всех элементов. Молярная масса M выражается как произведение коэффициента пропорциональности на относительную массу.

- С использованием молярного объема. Потребуется найти объем, занимаемый при обычных условиях некоторой массой газа, далее рассчитать массу 22,4 литров вещества при таких же условиях.
- С применением уравнения Менделеева-Клапейрона, моделирующего идеальный газ.
pV = mRT / M,
проведя преобразования, получим выражение для молярной массы:
M=mRT/pV
где
- p – давление в паскалях,
- V –объем в кубометрах
- m – масса в граммах,
- Т — температура в Кельвинах,
- R – константа, значение которой 8,314 Дж/(моль×К).
Область применения
Шире всего аргон применяется при сварочных работах. Он используется для создания защитной атмосферы вокруг сварочной ванны, вытесняя из рабочей зоны O 2 и N2, содержащиеся в атмосфере. Особенно важно это для сварки цветных металлов, многие из которых, к примеру, Ti, отличаются высокой химической активностью в нагретом состоянии. Незаменим инертный газ также для неразъемного соединения нержавеющих и высоколегированных сплавов.
Незаменим инертный газ также для неразъемного соединения нержавеющих и высоколегированных сплавов.
Также широко применяется при монтаже высоконагруженных строительных конструкций, таких, как каркасы высотных зданий, фермы мостов и многих других. Здесь его применение обеспечивает высокое качество, однородность и долговечность ответственных соединений. В строительной индустрии аргонная сварка доминирует среди других методов.
- Сварка аргоном
- Аргонно-дуговая сварка
Не менее широко применяется аргонная сварка в машиностроении, прежде всего химическом и пищевом. Швы получаются долговечные и надежные, даже в условиях воздействия агрессивных сред.
Нефтяная и газовая отрасли также применяют аргонная сварку при монтаже трубопроводов, газоперекачивающих станций и нефтеперегонных комбинатов.
Используется метод также в атомной промышленности, в транспортном машиностроении и в аэрокосмической отрасли.
В домохозяйствах аргонная сварка распространена не так широко. Это объясняется:
Это объясняется:
- высокой стоимостью оборудования и расходных материалов;
- необходимостью достаточной квалификации сварщика;
- меньшими нагрузками, испытываемыми домашними конструкциями;
- более низкими требованиями к прочности и долговечности сварных соединений.
Если в домохозяйстве возникает эпизодическая потребность в таких сварочных работах, то дешевле, быстрее и надежнее пригласить сварщика-специалиста.
- Стеклопакет с аргоном
- Принцип действия стеклопакета с аргоном
Характерным свойством Ar является его более высокая плотность по сравнению с воздухом. Поэтому максимальная эффективность аргонной сварки достигается при нижнем сварочном положении. В этом случае инертный раз растекается по поверхности детали и образует защитное облако значительной протяженности, позволяя вести сварку, как большими токами, так и на большой скорости. При сварке в наклонном и верхнем положении приходится учитывать «проваливание» аргона сквозь воздух. Чтобы компенсировать это явление, либо увеличивают подачу газа, либо проводят работы в герметичном помещении, заполненным инертным газом. В обоих случаях себестоимость работ возрастает.
Чтобы компенсировать это явление, либо увеличивают подачу газа, либо проводят работы в герметичном помещении, заполненным инертным газом. В обоих случаях себестоимость работ возрастает.
Поскольку потенциал ионизации Ar невысок, его использование обеспечивает идеальные геометрических характеристик сварочного шва, прежде всего, профиля. Возбужденная электродуга в аргоновой атмосфере также отличается высокой стабильностью своих параметров. С другой стороны, низкое значение потенциала ионизации обуславливает и более низкое напряжение розжига и поддержания дуги. Это сокращает ее тепловыделение и усложняет провар толстых листов металла.
Более высокая температура дуги в аргоновой атмосфере существенно повышает проплав сварочного шва. Это позволяет проводить сварку за один проход при условии точного соблюдения параметров зазора между заготовками.
В случае применения TIG-метода сварочных работ аргоновая атмосфера защищает от коррозионного влияния не только зону сварки, но и окончание неплавкого электрода.
В ряде специфических случаев в состав защитной газовой смеси добавляют гелий.
Кроме применения при сварочных работах, аргон используется:
- Как плазмоообразующее веществона установках плазменного раскроя металла.
- Для создания инертной среды в упаковках пищевых продуктов. Он вытесняет из пакетов и контейнеров кислород воздуха и водяные пары, пагубно влияющие на срок годности продуктов. Продукты в защитной атмосфере хранятся в несколько раз дольше, чем в обычной упаковке. Применяется этот метод и для упаковки медицинских изделий и препаратов, позволяя сохранить их в должной стерильности и химической чистоте.
- В качестве активного агента в противопожарных установках. Аргон вытесняет кислород (или другой газ) из очага горения, прекращая его.
- Для создания защитной среды в технологических установках при обработке полупроводниковых устройств, создании микросхем и других электронных компонентов или материалов высоких степеней чистоты.

- Наполнитель электроламп.
- В рекламных люминесцентных трубках.
Зависимость давления аргона в баллоне от температуры
По мере нагрева давление газообразного вещества в замкнутом объеме повышается. В таблице приведены примерные значения давления в баллоне в зависимости от температуры окружающего воздуха.
| T, °C | P, Мегапаскаль |
| -40 | 10,45 |
| -30 | 11,33 |
| -20 | 12,21 |
| -10 | 12,92 |
| 0 | 13,74 |
| +10 | 14,62 |
| +20 | 15,33 |
| +30 | 16,03 |
Следует учитывать, что баллонное давление изменяется не мгновенно, а по мере его прогрева или охлаждения.
Техника безопасности при работе с аргоном
Сам по себе не являясь ядовитым, аргон при неправильном использовании может нанести серьезный вред здоровью или даже создать угрозу жизни.
Аргон замещает кислород воздуха и создает смесь, непригодную для дыхания. Человек может пострадать или даже погибнуть от удушья. Сжиженный аргон имеет очень низкую температуру и при контакте с незащищенной кожей приводит к тяжелым обморожениям.
Человек может пострадать или даже погибнуть от удушья. Сжиженный аргон имеет очень низкую температуру и при контакте с незащищенной кожей приводит к тяжелым обморожениям.
Газоразрядная трубка с аргоном
Во избежание неприятных последствий при работе с газом следует неукоснительно соблюдать следующие правила:
- При работе в атмосфере аргона обязательно использовать изолирующий противогаз.
- При работе на полуавтоматах с подачей аргона обеспечить вентиляцию рабочей зоны.
- Использовать газоанализатор, содержание кислорода в воздухе должно быть не ниже 19%.
- Спецодежда должна полностью закрывать коду, быть чистой и целой.
Перед началом работы также следует осмотреть баллоны, шланги и запорную арматуру на предмет отсутствия механических повреждений и утечек газа.
Элемент аргона | Использование, факты, физические и химические характеристики
Аргон — редкий и инертный газ, относящийся к нобелевским газам. Он был открыт сэром Уильямом Рамзи и лордом Рэлеем в 1894 году. Он излучает уникальные и четкие спектральные линии и широко используется в высокоскоростной фотографии и лазерах.
Он излучает уникальные и четкие спектральные линии и широко используется в высокоскоростной фотографии и лазерах.
Аргон был открыт сэром Уильямом Рамзи и Моррисом Трэверсом в 1898 году в виде остаточного газа в камере после удаления всех компонентов жидкого воздуха, включая азот, углекислый газ и кислород. Рамзи получил Нобелевскую премию по химии в 1904 за вклад в открытие аргона и других благородных газов, кроме радона. До его открытия Рамзи считал, что в природе часто один элемент прячется в другом. А разрыв между обнаруженными элементами в таблице Менделеева заставил его внимательно вглядеться внутрь элементов. Название аргон произошло от греческого слова ἀργόν , , что означает ленивый , так как он неактивен и не реагирует с другими элементами [1]. Символ аргона – Ar [2].
| Классификация периодической таблицы | Группа 18 Период 3 |
|---|---|
| Состояние при 20°C | Газ |
| Цвет | Бесцветный газ, проявляющий сиренево-фиолетовое свечение при помещении в электрическое поле |
| Электронная конфигурация | [Ne] 3s2 3p6 |
| Электронный номер | 18 |
| Номер протона | 18 |
| Электронная оболочка | 2, 8, 8 |
| Плотность | 1,78 г. см-3 при 20°C см-3 при 20°C |
| Атомный номер | 18 |
| Атомная масса | 39,95 г.моль -1 |
| Электроотрицательность по Полингу | н/п |
Аргон является распространенным элементом и считается третьим по распространенности газом, присутствующим в атмосфере Земли. Аргон — самый распространенный газ среди благородных элементов, его в 500 раз больше, чем неона. Он присутствует примерно в 0,00015% (1,288% по массе) земной коры. жидкого воздуха. Аргон в земной атмосфере представляет собой аргон-40 и является радиогенным, поскольку он образуется во время цикла распада калия-40, присутствующего в земной коре. Аргон также в изобилии встречается в космосе. Аргон-36 является наиболее распространенным изотопом аргона и образуется в сверхновой в процессе звездного нуклеосинтеза. Аргон присутствует в морской воде в концентрации 0,45 ppm [2]. Аргон получают фракционной перегонкой жидкого воздуха [3].
Аргон — бесцветный газ без запаха. Аргон в твердом состоянии имеет белый цвет и кубическую гранецентрированную структуру. Аргон имеет плотность 1,784 г/л при стандартных условиях. На аргон действует внешнее магнитное поле, и он диамагнетичен. Аргон растворим в воде. Он негорюч и имеет очень низкую теплопроводность. Температура кипения аргона составляет -185,848°С, а температура плавления -189,34°С.
Химические характеристики Аргон химически неактивен. Его самая внешняя оболочка имеет восемь электронов, полный октет, который делает элемент неактивным и не связывается с другими элементами при комнатной температуре. Однако в экстремальных условиях он реагирует с водородом и фтором и образует фторгидрид аргона (HArF), который стабилен при температуре -256 °C. Это кристаллическое белое твердое вещество, стабильное при низкой температуре. Кристаллы гидрида могут образовываться при повышенном давлении, т.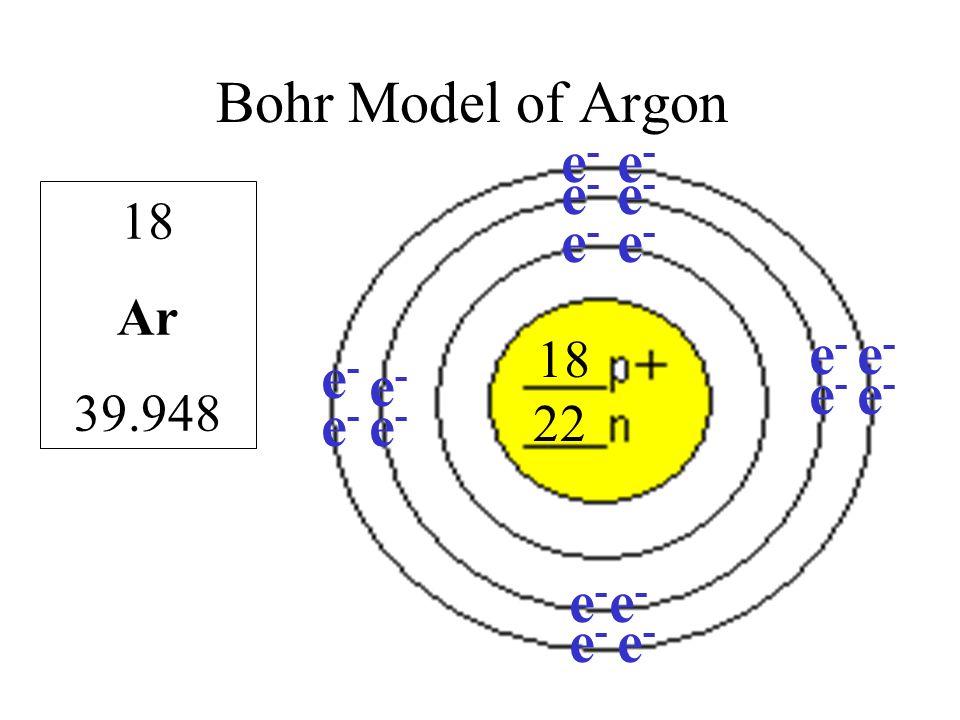 е. выше 5 ГПа. Аргон имеет нулевую степень окисления [4].
е. выше 5 ГПа. Аргон имеет нулевую степень окисления [4].
- Аргон широко используется в процессе сварки в качестве защитного газа. Он используется в графитовой электропечи, чтобы предотвратить горение графита.
- Аргон используется для изготовления люминесцентных ламп накаливания.
- Аргон также используется для изготовления лазеров и флуоресцентного светящегося оборудования.
- Аргоно-криптоновое датирование используется для определения возраста горных пород путем анализа характера эмиссии этих элементов.
- Аргон используется как дешевая альтернатива азоту в различных областях применения.
- Аргон широко используется в исследовательских областях, включая науку о темной материи и эксперименты с нейтрино.
- Аргон используется для увеличения срока годности различных пищевых продуктов.
- Аргон используется в медицине для уничтожения раковых клеток (криоабляция) и электрохирургии.

Аргон нетоксичен в природе во всех его формах, твердом, жидком или газообразном [4].
Изотопы аргонаИзвестно семь изотопов аргона, и три основных изотопа, присутствующих на Земле: аргон-38, аргон-36 и аргон-40. Наиболее стабильным изотопом является аргон-40 с периодом полураспада около 1,25×10 9 лет.
ССЫЛКИ[1]. Уильям Рамзи; Моррис В. Трэверс (1898 г.). «О новой составляющей атмосферного воздуха». Труды Лондонского королевского общества. 63 (1): 405–408. Дои: 10.1098/rspl.1898.0051.
[2]. Эмсли, Дж. (2001). Строительные блоки природы . Издательство Оксфордского университета. стр. 44–45. ISBN 978-0-19-960563-7.
[3]. «Аргон, Ар». Etacude.com. Архивировано из оригинала 7 октября 2008 г. Проверено 8 марта 2007 г.
[4] . Паспорт безопасности материала Газообразный аргон, Universal Industrial Gases, Inc. Дата обращения 14 октября 2013 г.
Паспорт безопасности материала Газообразный аргон, Universal Industrial Gases, Inc. Дата обращения 14 октября 2013 г.
[5]. Клеппе, Аннет К.; Амбоаж, Моника; Джефкоут, Эндрю П. (2014). «Новое соединение Ван-дер-Ваальса высокого давления Kr(H 2 ) 4 в двойной системе криптон-водород». Научные отчеты. 4. Бибкод: 2014NatSR…4E4989K. дои: 10.1038/srep04989.
Argon – wikidoc
Template:Infobox argon
Содержание
- 1 Обзор
- 2 Характеристики
- 3 История
- 4 Приложения
- 5 Возникновение
- 6 соединений
- 7 Изотопы
- 8 Потенциальные опасности
- 9 Каталожные номера
- 10 Дополнительная литература
- 11 Внешние ссылки
Краткий обзор Аргон имеет атомный номер 18 и является третьим элементом в 18-й группе периодической таблицы (благородные газы).
 Аргон присутствует в атмосфере Земли в количестве чуть менее 1%, что делает его самым распространенным благородным газом на Земле. Его полная внешняя оболочка делает аргон стабильным и устойчивым к связыванию с другими элементами. Температура его тройной точки 83,8058 К является определяющей фиксированной точкой в Международной температурной шкале 19°.90.
Аргон присутствует в атмосфере Земли в количестве чуть менее 1%, что делает его самым распространенным благородным газом на Земле. Его полная внешняя оболочка делает аргон стабильным и устойчивым к связыванию с другими элементами. Температура его тройной точки 83,8058 К является определяющей фиксированной точкой в Международной температурной шкале 19°.90.Характеристики[править]
Аргон имеет примерно такую же растворимость в воде, что и газообразный кислород, и в 2,5 раза более растворим в воде, чем газообразный азот. Этот высокостабильный химический элемент не имеет цвета, запаха, вкуса и нетоксичен как в жидкой, так и в газообразной форме. Аргон инертен в большинстве условий и не образует подтвержденных стабильных соединений при комнатной температуре.
Хотя аргон является инертным газом, было обнаружено, что он способен образовывать некоторые соединения. Например, в 2000 году исследователи из Хельсинкского университета сообщили о создании гидрофторида аргона (HArF), метастабильного соединения аргона с фтором и водородом. «Периодическая таблица элементов: аргон». Лентех. 1998. Проверено 3 сентября 2007 г. Хотя нейтральные химические соединения аргона в основном состоянии в настоящее время ограничиваются HArF, аргон может образовывать клатраты с водой, когда его атомы захвачены решеткой молекул воды. {{#invoke:citation/CS1|цитирование
|CitationClass=веб
}} Также аргонсодержащие ионы, т.е. ArH+ и комплексы в возбужденном состоянии, например АрФ хорошо известны. Теоретические расчеты на компьютерах показали несколько соединений аргона, которые должны быть стабильными, но пути синтеза которых в настоящее время неизвестны.
«Периодическая таблица элементов: аргон». Лентех. 1998. Проверено 3 сентября 2007 г. Хотя нейтральные химические соединения аргона в основном состоянии в настоящее время ограничиваются HArF, аргон может образовывать клатраты с водой, когда его атомы захвачены решеткой молекул воды. {{#invoke:citation/CS1|цитирование
|CitationClass=веб
}} Также аргонсодержащие ионы, т.е. ArH+ и комплексы в возбужденном состоянии, например АрФ хорошо известны. Теоретические расчеты на компьютерах показали несколько соединений аргона, которые должны быть стабильными, но пути синтеза которых в настоящее время неизвестны.
История Газ. В соединениях благородных газов; Хайман, HH, изд.; Издательство Чикагского университета: Чикаго, Иллинойс, 1963; стр. 3–20.
Трэверс, М.В. Открытие редких газов; Эдвард Арнольд и компания: Лондон, 1928 г .; стр. 1–7. Рэлей, лорд; Рамзи, В. Аргон: новый компонент атмосферы. хим. Новости 1895 (1 февраля), 71, 51–58. подозревался Генри Кавендишем в 1785 году в воздухе, но не был обнаружен до 1894 года лордом Рэлеем и сэром Уильямом Рамзи в эксперименте, в котором они удалили все кислород и азот из образца воздуха.{{#invoke:Citation/CS1|citation
|CitationClass=журнал
}} Аргон также был обнаружен в 1882 году благодаря независимым исследованиям Х. Ф. Ньюолла и В. Н. Хартли. Каждый наблюдал новые линии в цветовом спектре воздуха, но не мог определить элемент, ответственный за эти линии. Аргон стал первым открытым представителем благородных газов. Символ аргона теперь равен 9.0220 Ar , но до 1957 года это был A .{{#invoke:citation/CS1|citation
|CitationClass=веб
}}
подозревался Генри Кавендишем в 1785 году в воздухе, но не был обнаружен до 1894 года лордом Рэлеем и сэром Уильямом Рамзи в эксперименте, в котором они удалили все кислород и азот из образца воздуха.{{#invoke:Citation/CS1|citation
|CitationClass=журнал
}} Аргон также был обнаружен в 1882 году благодаря независимым исследованиям Х. Ф. Ньюолла и В. Н. Хартли. Каждый наблюдал новые линии в цветовом спектре воздуха, но не мог определить элемент, ответственный за эти линии. Аргон стал первым открытым представителем благородных газов. Символ аргона теперь равен 9.0220 Ar , но до 1957 года это был A .{{#invoke:citation/CS1|citation
|CitationClass=веб
}}Применение[править]
Файл:Argon.jpg
Канистры, содержащие аргон, для использования при тушении пожара без повреждения серверного оборудования
Существует несколько различных причин, по которым аргон используется в конкретных приложениях:
- Необходим инертный газ.
 В частности, аргон является самой дешевой альтернативой, когда двухатомный азот недостаточно инертен.
В частности, аргон является самой дешевой альтернативой, когда двухатомный азот недостаточно инертен. - Требуется низкая теплопроводность.
- Необходимы электронные свойства (ионизация и/или эмиссионный спектр).
Другие инертные газы, вероятно, также подходят для большинства этих применений, но аргон намного дешевле. Аргон недорогой, поскольку он является побочным продуктом производства жидкого кислорода и жидкого азота, которые используются в больших промышленных масштабах. Другие инертные газы (кроме гелия) также производятся таким же образом, но аргон является наиболее обильным, так как его концентрация в атмосфере самая высокая. Основная масса применений аргона возникает просто потому, что он инертен и относительно дешев. Аргон используется:
- В качестве заполняющего газа в лампах накаливания, поскольку аргон не вступает в реакцию с нитью накала ламп даже при высоких температурах.
- В качестве защиты от инертного газа при многих видах сварки, включая сварку металлов в среде инертного газа и сварку вольфрама в среде инертного газа.

- Для тушения пожаров, когда необходимо избежать повреждения оборудования (см. фото).
- В качестве предпочтительного газа для плазмы, используемой в ИСП-спектроскопии
- В качестве нереакционноспособного покрытия при обработке титана и других химически активных элементов,
- В качестве защитной атмосферы для выращивания кристаллов кремния и германия, а также в печах для термообработки при парциальном давлении.
- Реставраторами музеев для защиты старых материалов или документов, склонных к постепенному окислению в присутствии воздуха. Описание Национального архива США о том, как хранится и отображается Декларация независимости. Более подробную информацию можно найти в этом более техническом объяснении, особенно на странице 4, где говорится об аргоне, удерживающем кислород.
- Для предотвращения окисления открытых бутылок с вином, а также в ряде раздаточных устройств и систем крышек.
- В виноделии для доливки бочек, вытеснения кислорода и, таким образом, предотвращения превращения вина в уксус в процессе старения.

- В фармацевтической промышленности для доливки флаконов с внутривенными препаратами (например, парацетамол внутривенно), снова вытесняя кислород и, следовательно, продлевая срок годности лекарства.
- Используется для охлаждения головки ГСН версии AIM-9 ВВС США.Ракета Сайдвиндер. Газ хранится под высоким давлением, и расширение газа охлаждает ГСНОписание работы Aim-9.
Следующей наиболее распространенной причиной использования аргона является его низкая теплопроводность. Он используется для теплоизоляции в энергоэффективных окнах.{{#invoke:citation/CS1|citation |CitationClass=веб }} Аргон также используется в техническом подводном плавании с аквалангом для надувания сухого гидрокостюма, поскольку он инертен и имеет низкую теплопроводность.
Аргон также используется из-за особого способа его ионизации и излучения света. Он используется в плазменных шарах и калориметрии в экспериментальной физике элементарных частиц. Синие аргоновые лазеры используются в хирургии для сварки артерий, разрушения опухолей и исправления дефектов глаз. {{#invoke:citation/CS1|citation
|CitationClass=веб
}} В микроэлектронике для распыления используются ионы аргона.
{{#invoke:citation/CS1|citation
|CitationClass=веб
}} В микроэлектронике для распыления используются ионы аргона.
Наконец, есть ряд различных применений. Аргон-39 с периодом полураспада 269 лет использовался для ряда приложений, в первую очередь для датирования ледяных кернов и грунтовых вод. Соотношение аргон-40/калий-40 используется при датировании магматических пород.
Процедуры криохирургии, такие как криоабляция, используют сжиженный аргон для разрушения раковых клеток. В хирургии он используется в процедуре, называемой «коагуляция с усилением аргоном», которая представляет собой форму электрохирургии с помощью аргонно-плазменного луча. Процедура сопряжена с риском возникновения газовой эмболии у пациента и привела к смерти одного человека в результате несчастного случая такого типа. {{#invoke:citation/CS1|цитирование |CitationClass=веб }}
Возникновение[править]
Файл:ArTube.jpg
Трубка для разряда паров аргона и ртути.
Аргон составляет 0,934% по объему и 1,29% по массе атмосферы Земли, а воздух является основным сырьем, используемым в промышленности для производства продуктов очищенного аргона. Аргон выделяют из воздуха путем фракционирования, чаще всего путем криогенной фракционной перегонки, процесса, который также позволяет получать очищенный азот, кислород, неон, криптон и ксенон.{{#invoke:citation/CS1|citation |CitationClass=веб }}
Марсианская атмосфера, напротив, содержит 1,6% аргона-40 и 5 частей на миллион аргона-36. Космический зонд «Маринер», пролетевший над планетой Меркурий в 1973 году, обнаружил, что Меркурий имеет очень тонкую атмосферу с 70% аргоном, что, как полагают, является результатом выбросов газа в качестве продукта распада радиоактивных материалов на планете. В 2005 году зонд Huygens также обнаружил присутствие аргона-40 на Титане, крупнейшем спутнике Сатурна. |CitationClass=веб }}
Соединения[править]
Файл:Аргоновый лед 1. jpg
jpg
Небольшой кусочек быстро тающего аргонового льда.
Полный октет электронов Аргона указывает на полные подоболочки s и p. Этот полный внешний энергетический уровень делает аргон очень стабильным и чрезвычайно устойчивым к связыванию с другими элементами. До 1962 года аргон и другие благородные газы считались химически инертными и неспособными образовывать соединения; однако с тех пор были синтезированы соединения более тяжелых благородных газов. В августе 2000 года исследователи из Хельсинкского университета образовали первые соединения аргона. При освещении ультрафиолетовым светом замороженного аргона, содержащего небольшое количество фтористого водорода, образовывался гидрофторид аргона (HArF). |CitationClass=веб }}
Он стабилен до 40 кельвинов (-233 °C).Об открытии дифторида аргона (ArF 2 ) было объявлено в 2003 году. Но это не подтверждено и, скорее всего, неверно.
Изотопы Встречающийся в природе
40 K с периодом полураспада 1,25 года, распадается до стабильного 40 Ar (11,2%) за счет захвата электронов и испускания позитронов, а также до стабильного 40 Ca (88,8%) через бета-распад. Эти свойства и соотношения используются для определения возраста пород.{{#invoke:citation/CS1|citation
|CitationClass=веб
}}
Эти свойства и соотношения используются для определения возраста пород.{{#invoke:citation/CS1|citation
|CitationClass=веб
}} В атмосфере Земли 39 Ar образуется в результате активности космических лучей, в основном с 40 Ar. В подземной среде он также образуется в результате захвата нейтронов 39 К или альфа-излучения кальцием. 37 Ar образуется при распаде 40 Ca в результате подземных ядерных взрывов. Период полураспада составляет 35 дней.
Потенциальные опасности[править]
Хотя аргон нетоксичен, он не удовлетворяет потребность организма в кислороде и является простым удушающим средством. Люди по ошибке задохнулись, вдыхая аргон.Миддо, Джон; Бледсо, Гэри. «Помощник сварщика задохнулся в инертной аргоном трубе (FACE AK-94-012)». Департамент здравоохранения штата Аляска. 23 июня 1994 г. Проверено 3 сентября 2007 г.
Ссылки[править]
<ссылки/>
Дальнейшее чтение
 , Строительные блоки природы; Издательство Оксфордского университета: Оксфорд, Нью-Йорк, 2001; стр. 35-39.
, Строительные блоки природы; Издательство Оксфордского университета: Оксфорд, Нью-Йорк, 2001; стр. 35-39.|CitationClass=journal }}
- Давление в тройной точке: 69 кПа – {{#invoke:citation/CS1|citation
|CitationClass=book }}
Внешние ссылки[править]
- WebElements.com – Argon
- Применение для дайвинга: почему аргон?
- Аргон Ar Свойства, использование, применение
- Computational Chemistry Wiki
Template:E number infobox 930-949
аф:Аргон
ар: أرغون (عنصر)
аст: Аргон
аз:Аркон
бн: আর্গন
быть:Аргон
бс: аргон
бг:Аргон
ca: Арго
cs: аргон
со: Аргон
cy:Аргон
да: аргон
де: Аргон
эт: Аргун
эл: Αργό
Эо: Аргоно
fa:آرگون
мех:Аргон
gl:Аргон (элемент)
ко:아르곤
hy:Արգոն
привет: आर्गन
час:Аргон
ио: Аргоно
идентификатор: Аргон
есть:Аргон
это: Аргон
он: ארגון (יסוד)
sw: Аригон
ht: Агон
Ла: Аргон
lv:Аргоны
фунт: аргон
lt: Аргонас
ли: Аргон
jbo: лазнинавни
ху: аргон
мк:Аргон
мл:ആർഗൺ
ми: Аргон
мс: аргон
сущ. : аргон
нет: аргон
nn: аргон
oc:Аргон
uz:Аргон
nds: аргон
qu: Аргун
площадь: Аргони
сн:аргон
простой:аргон
ск:Аргон
сл:Аргон
ср:Аргон
ш: аргон
фи: аргон
св: аргон
th:อาร์กอน
uk:Аргон
: аргон
нет: аргон
nn: аргон
oc:Аргон
uz:Аргон
nds: аргон
qu: Аргун
площадь: Аргони
сн:аргон
простой:аргон
ск:Аргон
сл:Аргон
ср:Аргон
ш: аргон
фи: аргон
св: аргон
th:อาร์กอน
uk:Аргон
Аргон
Аргон (произносится /ˈɑrɡɒn/) — химический элемент, обозначаемый символом Ar. Аргон имеет атомный номер 18 и является третьим элементом в 18-й группе периодической таблицы (благородные газы). Аргон является третьим по распространенности газом в атмосфере Земли с его содержанием 0,93%, что делает его более распространенным, чем углекислый газ. Полный октет во внешней атомной оболочке делает ее стабильной и устойчивой к связыванию с другими элементами. Температура его тройной точки 83,8058 К является определяющей фиксированной точкой в Международной температурной шкале 19°.90.
Характеристики
Небольшой кусочек быстро тающего аргонового льда.
Аргон имеет примерно такую же растворимость в воде, как газообразный кислород, и в 2,5 раза более растворим в воде, чем газообразный азот. Аргон бесцветен, не имеет запаха и нетоксичен в твердом, жидком и газообразном состоянии. Аргон инертен в большинстве условий и не образует подтвержденных стабильных соединений при комнатной температуре.
Аргон бесцветен, не имеет запаха и нетоксичен в твердом, жидком и газообразном состоянии. Аргон инертен в большинстве условий и не образует подтвержденных стабильных соединений при комнатной температуре.
Хотя аргон является инертным газом, было обнаружено, что он способен образовывать некоторые соединения. Например, в 2000 году исследователи из Хельсинкского университета сообщили о создании фторгидрида аргона (HArF), предельно стабильного соединения аргона с фтором и водородом.[2] Хотя нейтральные химические соединения аргона в основном состоянии в настоящее время ограничиваются HArF, аргон может образовывать клатраты с водой, когда его атомы захвачены решеткой молекул воды. Известно также, что существуют аргонсодержащие ионы и комплексы в возбужденном состоянии, такие как ArH+ и ArF соответственно. Теоретические расчеты предсказали несколько соединений аргона, которые должны быть стабильными, [4] но пути синтеза которых в настоящее время неизвестны.
История
Метод лорда Рэлея для выделения аргона, основанный на эксперименте Генри Кавендиша.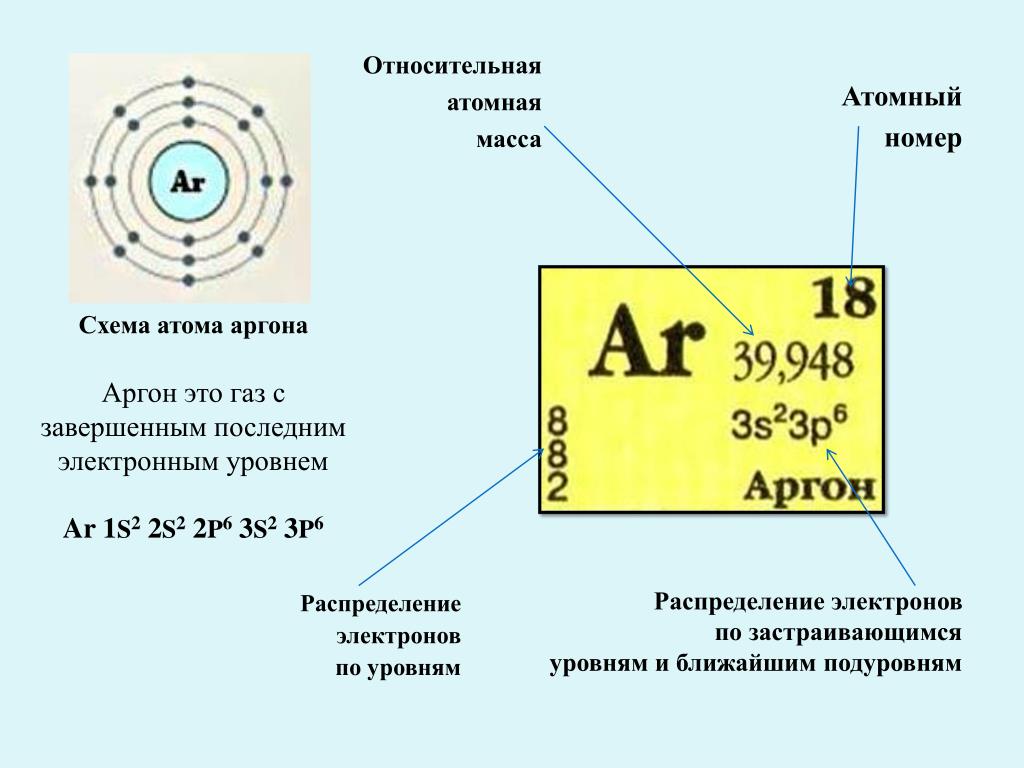 Газы находятся в пробирке (А), стоящей над большим количеством слабой щелочи (В), а ток передается по проводам, изолированным U-образными стеклянными трубками (СС), проходящими через жидкость и огибающими горловину пробирки. пробирка. На внутренние платиновые концы (DD) провода подается ток от батареи из пяти ячеек Гроува и катушки Румкорфа средних размеров.
Газы находятся в пробирке (А), стоящей над большим количеством слабой щелочи (В), а ток передается по проводам, изолированным U-образными стеклянными трубками (СС), проходящими через жидкость и огибающими горловину пробирки. пробирка. На внутренние платиновые концы (DD) провода подается ток от батареи из пяти ячеек Гроува и катушки Румкорфа средних размеров.
Аргон (αργος, греческое значение «неактивный», в связи с его химической неактивностью) [5] [6] подозревался Генри Кавендишем в 1785 году в воздухе, но не был выделен до 1894 года лордом Рэлеем и сэром Уильямом Рамзи. в Шотландии в эксперименте, в котором они удалили весь кислород, углекислый газ, воду и азот из образца чистого воздуха. Они определили, что азот, полученный из химических соединений, на полпроцента легче, чем азот из атмосферы. Разница казалась незначительной, но достаточно важной, чтобы привлечь их внимание на многие месяцы. Они пришли к выводу, что в воздухе был другой газ, смешанный с азотом.[10] Аргон также был обнаружен в 1882 году в результате независимых исследований Х. Ф. Ньюолла и У. Н. Хартли. Каждый наблюдал новые линии в цветовом спектре воздуха, но не мог определить элемент, ответственный за эти линии. Аргон стал первым открытым представителем благородных газов. Символ аргона теперь Ar, но до 1957 это был А.[11]
Ф. Ньюолла и У. Н. Хартли. Каждый наблюдал новые линии в цветовом спектре воздуха, но не мог определить элемент, ответственный за эти линии. Аргон стал первым открытым представителем благородных газов. Символ аргона теперь Ar, но до 1957 это был А.[11]
Распространение
Аргон составляет 0,934 % по объему и 1,29 % по массе атмосферы Земли, а воздух является основным сырьем, используемым в промышленности для производства продуктов очищенного аргона. Аргон выделяют из воздуха путем фракционирования, чаще всего путем криогенной фракционной перегонки, процесса, в ходе которого также получают очищенный азот, кислород, неон, криптон и ксенон.[12]
Изотопы
Основная статья: Изотопы аргона
Основными изотопами аргона, встречающимися на Земле, являются 40Ar (99,6%), 36Ar (0,34%) и 38Ar (0,06%). Встречающийся в природе 40K с периодом полураспада 1,25 × 109 лет распадается до стабильного 40Ar (11,2%) путем захвата электронов и испускания позитронов, а также до стабильного 40Ca (88,8%) посредством бета-распада. Эти свойства и соотношения используются для определения возраста горных пород.[13]
Эти свойства и соотношения используются для определения возраста горных пород.[13]
В атмосфере Земли 39Ar образуется под действием космических лучей, в основном с 40Ar. В подземной среде он также образуется за счет захвата нейтронов 39K или альфа-излучение кальцием. 37Ar образуется в результате нейтронного расщепления 40Ca в результате подземных ядерных взрывов. Период полураспада составляет 35 дней.[13]
Аргон примечателен тем, что его изотопный состав сильно различается в разных местах Солнечной системы. Там, где основным источником аргона является распад калия-40 в горных породах, аргон-40 будет преобладающим изотопом, как и на Земле. Напротив, в аргоне, полученном непосредственно в результате звездного нуклеосинтеза, преобладает нуклид альфа-процесса, аргон-36. Соответственно, солнечный аргон содержит 84,6% аргона-36 на основе измерений солнечного ветра.[14]
Преобладание радиогенного аргона-40 объясняет тот факт, что стандартный атомный вес земного аргона больше, чем у следующего элемента, калия. Это вызывало недоумение в то время, когда был открыт аргон, поскольку Менделеев расположил элементы в своей периодической таблице в порядке атомного веса, хотя инертность аргона подразумевает, что он должен быть помещен перед химически активным щелочным металлом калием. Позже Генри Мозли решил эту проблему, показав, что периодическая таблица на самом деле упорядочена по атомному номеру. (См. История периодической таблицы).
Это вызывало недоумение в то время, когда был открыт аргон, поскольку Менделеев расположил элементы в своей периодической таблице в порядке атомного веса, хотя инертность аргона подразумевает, что он должен быть помещен перед химически активным щелочным металлом калием. Позже Генри Мозли решил эту проблему, показав, что периодическая таблица на самом деле упорядочена по атомному номеру. (См. История периодической таблицы).
Марсианская атмосфера содержит 1,6% аргона-40 и 5 частей на миллион аргона-36. Космический зонд “Маринер”, пролетевший над планетой Меркурий в 1973 году, обнаружил, что Меркурий имеет очень тонкую атмосферу, содержащую 70% аргона, что, как полагают, является результатом выброса газа как продукта распада радиоактивных материалов на планете. В 2005 году зонд «Гюйгенс» также обнаружил присутствие аргона-40 на Титане, крупнейшем спутнике Сатурна.[15]
Соединения
См. также: h3-Ar
Полный октет электронов Аргона указывает на полные подоболочки s и p. Этот полный внешний энергетический уровень делает аргон очень стабильным и чрезвычайно устойчивым к связыванию с другими элементами. До 1962 года аргон и другие благородные газы считались химически инертными и неспособными образовывать соединения; однако с тех пор были синтезированы соединения более тяжелых благородных газов. В августе 2000 года исследователи из Хельсинкского университета образовали первые соединения аргона. При освещении ультрафиолетовым светом замороженного аргона, содержащего небольшое количество фтористого водорода, образовывался фторгидрид аргона (HArF). Он стабилен до 40 кельвинов (-233 ° C).
Этот полный внешний энергетический уровень делает аргон очень стабильным и чрезвычайно устойчивым к связыванию с другими элементами. До 1962 года аргон и другие благородные газы считались химически инертными и неспособными образовывать соединения; однако с тех пор были синтезированы соединения более тяжелых благородных газов. В августе 2000 года исследователи из Хельсинкского университета образовали первые соединения аргона. При освещении ультрафиолетовым светом замороженного аргона, содержащего небольшое количество фтористого водорода, образовывался фторгидрид аргона (HArF). Он стабилен до 40 кельвинов (-233 ° C).
Производство
Промышленный
Аргон производится в промышленных масштабах путем фракционной перегонки жидкого воздуха, процесса, при котором жидкий азот, кипящий при 77,3 К, отделяется от аргона, кипящего при 87,3 К, и кислорода, кипящего при 90,2 К. Около 700 000 тонн аргона производятся во всем мире каждый год.[17]
При радиоактивном распаде
40Ar, наиболее распространенный изотоп аргона, образуется при распаде 40K с периодом полураспада 1,25 × 109лет за счет захвата электронов или испускания позитронов. Из-за этого он используется при калий-аргоновом датировании для определения возраста горных пород.
Из-за этого он используется при калий-аргоновом датировании для определения возраста горных пород.
Приложения
Баллоны с аргоном для тушения пожара без повреждения серверного оборудования
Аргон используется в определенных целях по нескольким причинам:
* Требуется инертный газ. В частности, аргон является самой дешевой альтернативой, когда двухатомный азот недостаточно инертен.
* Требуется низкая теплопроводность.
* Необходимы электронные свойства (ионизация и/или эмиссионный спектр).
Другие инертные газы, вероятно, также подходят для большинства этих применений, но аргон, безусловно, является самым дешевым. Аргон недорогой, поскольку он является побочным продуктом производства жидкого кислорода и жидкого азота, которые используются в больших промышленных масштабах. Другие инертные газы (кроме гелия) также производятся таким же образом, но аргон является наиболее обильным, так как его концентрация в атмосфере самая высокая. Основная масса применений аргона возникает просто потому, что он инертен и относительно дешев.
Промышленные процессы
Аргон используется в некоторых высокотемпературных промышленных процессах, где обычно нереакционноспособные вещества становятся реакционноспособными. Например, в графитовых электропечах используется атмосфера аргона для предотвращения горения графита.
Для некоторых из этих процессов присутствие газообразного азота или кислорода может вызвать дефекты в материале. Аргон используется при различных типах сварки металлов в среде инертного газа, таких как сварка вольфрама в среде инертного газа, а также при обработке титана и других реактивных элементов. Атмосфера аргона используется также для выращивания кристаллов кремния и германия.
См. также: защитный газ
Аргон является удушающим веществом в птицеводстве, либо для массовой выбраковки после вспышек болезней, либо как средство убоя, более гуманное, чем электрическая баня. Относительно высокая плотность аргона заставляет его оставаться близко к земле во время выделения газа. Его нереактивная природа делает его пригодным для использования в пищевых продуктах, а поскольку он заменяет кислород в мертвой птице, аргон также увеличивает срок хранения. [18]
[18]
Аргон иногда используется для тушения пожаров, когда необходимо избежать повреждения оборудования (см. фото).
Консервант
Образец цезия упакован в атмосфере аргона во избежание реакций с воздухом
Аргон используется для вытеснения кислородо- и влагосодержащего воздуха в упаковочном материале с целью продления срока годности содержимого. Воздушное окисление, гидролиз и другие химические реакции, разлагающие продукты, замедляются или полностью предотвращаются. Бутылки с химическими веществами высокой чистоты и некоторые фармацевтические продукты доступны в запечатанных бутылках или ампулах, упакованных в аргон. В виноделии аргон используется для наполнения бочек, чтобы избежать окисления этанола в уксусную кислоту в процессе выдержки.
Аргон также доступен в баллончиках аэрозольного типа, которые можно использовать для консервации таких составов, как лак, полиуретан, краска и т. д., для хранения после вскрытия.[19]
С 2001 года Американский национальный архив хранит важные национальные документы, такие как Декларация независимости и Конституция, в контейнерах, наполненных аргоном, чтобы замедлить их деградацию. Использование аргона снижает утечку газа по сравнению с гелием, использовавшимся в предыдущие пять десятилетий.[20]
Использование аргона снижает утечку газа по сравнению с гелием, использовавшимся в предыдущие пять десятилетий.[20]
Лабораторное оборудование
Перчаточные боксы обычно заполнены аргоном, который циркулирует в скрубберах для поддержания атмосферы без кислорода и влаги
.
См. также: Безвоздушная техника
Аргон может использоваться в качестве инертного газа в линиях Шленка и перчаточных боксах. Использование аргона вместо сравнительно менее дорогого диазота предпочтительнее, когда азот может вступать в реакцию.
Аргон может использоваться в качестве газа-носителя в газовой хроматографии и масс-спектрометрии с ионизацией электрораспылением; это предпочтительный газ для плазмы, используемой в ICP-спектроскопии. Аргон предпочтителен для покрытия распылением образцов для сканирующей электронной микроскопии. Ионы аргона также используются для распыления в микроэлектронике.
Медицинское применение
Процедуры криохирургии, такие как криоабляция, используют сжиженный аргон для разрушения раковых клеток. В хирургии он используется в процедуре, называемой «коагуляция с усилением аргоном», которая представляет собой форму электрохирургии с помощью аргонно-плазменного луча. Процедура сопряжена с риском возникновения газовой эмболии у пациента и привела к смерти одного человека в результате несчастного случая такого типа.[21] Синие аргоновые лазеры используются в хирургии для сварки артерий, разрушения опухолей и исправления дефектов зрения.[22] Он также использовался экспериментально для замены азота в дыхательной или декомпрессионной смеси для ускорения выведения растворенного азота из крови. См. Аргокс (дышащий газ).
В хирургии он используется в процедуре, называемой «коагуляция с усилением аргоном», которая представляет собой форму электрохирургии с помощью аргонно-плазменного луча. Процедура сопряжена с риском возникновения газовой эмболии у пациента и привела к смерти одного человека в результате несчастного случая такого типа.[21] Синие аргоновые лазеры используются в хирургии для сварки артерий, разрушения опухолей и исправления дефектов зрения.[22] Он также использовался экспериментально для замены азота в дыхательной или декомпрессионной смеси для ускорения выведения растворенного азота из крови. См. Аргокс (дышащий газ).
Освещение
Трубка для разряда аргона
Аргоновая газоразрядная лампа, образующая символ аргона «Ar». Иногда в аргон добавляют небольшое количество ртути, что придает ему синий цвет.
Лампы накаливания заполнены аргоном, чтобы предохранить нити накала при высокой температуре от окисления. Он используется для особого способа ионизации и излучения света, например, в плазменных шарах и калориметрии в экспериментальной физике элементарных частиц. Газоразрядные лампы, наполненные аргоном, дают синий свет. Аргон также используется для создания синего лазерного излучения.
Газоразрядные лампы, наполненные аргоном, дают синий свет. Аргон также используется для создания синего лазерного излучения.
Разное использование
Используется для теплоизоляции в энергоэффективных окнах.[24] Аргон также используется в техническом подводном плавании с аквалангом для надувания сухого гидрокостюма, поскольку он инертен и имеет низкую теплопроводность.[25]
Сжатый аргон допускается для расширения для охлаждения головок ГСН ракеты AIM-9 Sidewinder и других ракет, использующих охлаждаемые тепловые головки ГСН. Газ хранится под высоким давлением.[26]
Аргон-39 с периодом полураспада 269лет, использовался для ряда приложений, в первую очередь для датирования ледяных кернов и грунтовых вод. Кроме того, калиево-аргоновое датирование используется для датирования магматических пород.
Безопасность
Хотя аргон не токсичен, он не удовлетворяет потребности организма в кислороде и поэтому является удушающим. Аргон на 25% плотнее воздуха и считается очень опасным в закрытых помещениях. Его также трудно обнаружить, потому что он бесцветен, не имеет запаха и вкуса. Известно, что в замкнутых пространствах это приводит к смерти из-за удушья. А 19Миддо, Джон (23 июня 1994 г.). «Помощник сварщика задохнулся в инертной аргоном трубе (FACE AK-94-012)». Департамент здравоохранения штата Аляска. http://www.hss.state.ak.us/dph/ipems/occupation_injury/reports/docs/94ak012.htm. Проверено 1 февраля 2009 г. .
Его также трудно обнаружить, потому что он бесцветен, не имеет запаха и вкуса. Известно, что в замкнутых пространствах это приводит к смерти из-за удушья. А 19Миддо, Джон (23 июня 1994 г.). «Помощник сварщика задохнулся в инертной аргоном трубе (FACE AK-94-012)». Департамент здравоохранения штата Аляска. http://www.hss.state.ak.us/dph/ipems/occupation_injury/reports/docs/94ak012.htm. Проверено 1 февраля 2009 г. .
Дополнительная литература
* Периодическая таблица Геологической службы США – аргон
* Эмсли Дж., Строительные блоки природы; Издательство Оксфордского университета: Оксфорд, Нью-Йорк, 2001; стр. 35–39.
* Браун, Т. Л.; Берстен, BE; LeMay, HE, In Chemistry: The Central Science, 10-е изд.; Чалис, Дж.; Дрейпер, П.; Фолчетти, Н. и др.; Ред.; Pearson Education, Inc.: Аппер-Сэдл-Ривер, Нью-Джерси, 2006 г.; стр. 276 и 289.
* Температура тройной точки: 83,8058 К – Престон-Томас, Х. (1990). «Международная температурная шкала 1990 г. (МТС-90)». Метрология 27: 3–10.


 п.) как металлов, так и неметаллов
п.) как металлов, так и неметаллов Используется также для сварки высоконагруженных изделий из конструкционной стали.
Используется также для сварки высоконагруженных изделий из конструкционной стали.



 В частности, аргон является самой дешевой альтернативой, когда двухатомный азот недостаточно инертен.
В частности, аргон является самой дешевой альтернативой, когда двухатомный азот недостаточно инертен.
