Характеристика элемента цинк: Дать характеристику элемента Zn – ответ на Uchi.ru
alexxlab | 17.03.2023 | 0 | Разное
Цинк — описание ингредиента, инструкция по применению, показания и противопоказания
16 Апреля 2020
15 Декабря 2022
3 минуты
17268
ProWellness
Оглавление
- Описание цинка
- Биологические функции
- Нормы потребления
- Дефицит цинка
- Переизбыток цинка
- Пищевые источники
- Профилактическое и лечебное применение
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте
Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста.
Описание цинка
Цинк – это микроэлемент, присутствующий в организме в составе более чем 300 гормонов и ферментов и выполняющий жизненно важные функции.
Цинк накапливается в клетках, волосах, мышцах, коже, костях. Общая масса элемента в человеческом теле небольшая – от 1,5 до 3 г. Однако его значение для человека трудно переоценить.
Биологические функции
Цинк есть в каждой клетке тела. Он важен для синтеза ДНК, РНК, углеводов, жиров, белков. Влияет на активность более чем 300 ферментов, которые участвуют в метаболизме, нервной функции, пищеварении и множестве других процессов.
Без этого микроэлемента невозможно полноценное развитие иммунных клеток и клеточное деление.
Помимо перечисленных функций, цинк:
- важен для здоровья простаты;
- стимулирует регенерацию тканей;
- необходим для выработки инсулина;
- улучшает усвоение токоферола;
- ответственен за здоровье зубов;
- устраняет воспалительные процессы;
- обеспечивает правильную структуру рибосом;
- нормализует функционирование печени;
- улучшает состояние органов зрения.
Цинк снижает окислительный стресс и понижает риск пневмонии, макулодистрофии, инфекций. Он участвует в синтезе коллагена, иммунном и воспалительном ответе, поэтому его используют в терапии язв и ожогов.
Внимание! С помощью препаратов цинка можно лечить угревую сыпь. Они подавляют воспалительные реакции, активность сальных желез и рост пропионибактерий акне.Согласно результатам многочисленных исследований, люди с акне часто имеют недостаток цинка.
Нормы потребления
Новая порция цинка нужна организму ежедневно, поскольку в нем отсутствует депо для его хранения. Суточная норма потребления микроэлемента для младенцев – 0,8 мг, для детей – 3–10 мг, для взрослых – 15 мг, для беременных – 25 мг.
Дефицит цинка
При дефиците микроэлемента наблюдаются такие симптомы:
- ощущается нервозность;
- нарушается сон;
- отсутствует аппетит;
- снижается острота зрения;
- развивается малокровие;
- поражаются ногтевые пластины;
- возникает депрессия;
- проявляются психические расстройства;
- образуется перхоть;
- выпадают волосы;
- падает уровень тестостерона;
- ухудшается потенция;
- возникают кожные болезни.

Переизбыток цинка
Передозировка цинком сопровождается тошнотой, анемией, кишечными коликами, рвотой, кровавой диареей, нарушениями в работе почек, металлическим привкусом во рту, желтухой.
Пищевые источники
Продуктами-лидерами по содержанию цинка являются устрицы, тыквенные и кунжутные семена, говядина, чечевица, злаки, миндаль, грецкие орехи, арахис, курица, свинина.
Профилактическое и лечебное применение
Препараты цинка выпускают в форме капсул, таблеток, мазей, растворов, шипучек и жевательных пастилок, капель для приема внутрь. Активное вещество входит в них в виде оксида, сульфата, цитрата или ацексамата.
Оптимальная профилактическая дозировка цинка – 8 мг для женщин и 11 мг для мужчин. Если микроэлемент используется для лечения различных состояний, дозы повышаются. К примеру, при угревой сыпи – 135 мг, при проблемах с зачатием – 50 мг, при простуде – 150 мг.
К примеру, при угревой сыпи – 135 мг, при проблемах с зачатием – 50 мг, при простуде – 150 мг.
Внимание! Цинк принимают за час до еды или через 2 часа после приема пищи. Нельзя совмещать его с антибиотиками.
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте
Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Цинк (Zn) и его соединения, получение и применение цинка
Что такое цинк? Цинк – серебристо-белый металл с голубоватым оттенком. В чистом виде в природе цинк, как химический элемент, практически не встречается. Согласно таблице Менделеева
Цинк — химический элемент 12-й группы (по устаревшей классификации — побочной подгруппы второй группы), четвёртого периода периодической системы, Символ обозначения Zn (лат. Zincum)
В настоящее время хорошо исследованы пять стабильных изотопов цинка, с массовыми числами соответственно 64,66,67,68,70. Самым распространённым среди стабильных изотопов цинка считается Zn 64 (48.89%). Девять радиоактивных цинковых изотопов получены искусственным путем. К ним относится 65 Zn. Это самый долгоживущий цинковый изотоп, период полураспада которого составляет 245 суток, поэтому он используется в качестве изотопного индикатора.
| Название, символ, номер | Цинк / Zincum (Zn), 30 |
| Атомная масса (молярная масса) | 65,38(2)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d10 4s2 |
| Радиус атома | 138 пм |
Цинк при стандартных климатических условиях хрупкий металл. После нагревания цинка до 100 градусов и выше (до 150 градусов С) происходят изменения в кристаллической решетке, в результате чего металл становится пластичным, гибким, его можно подвергать дополнительной механической обработке. Строение кристаллической решетки – гексагональное.
| Структура решётки | гексагональная |
| Параметры решётки | a=2,6648 c=4,9468 Å |
| Отношение c/a | 1,856 |
| Температура Дебая | 234 K |
История открытия.

Известно, что цинк, в качестве композиционного материала, использовался с древних времен. Самые первые находки латунных предметов (латунь – сплав меди +цинка) относятся к 1500 году до н.э. (раскопки производились в Палестине). Упоминания о процессах выплавки латуни можно найти в трудах Аристотеля и Гомера, Плиния (Старшего). В трактатах древности описываются различные способы литья. В одном из них подробно разбирается способ приготовления латуни путем восстановления углем особого цинкового камня (т.н. кадмея) в присутствии медной составляющей. Особо отмечалось в научном труде, что добавление цинк в сплав может решить сразу несколько вопросов:
- изменение цветовой гаммы готового медного изделия (в результате осветления оттенок изменялся до «золотого»),
- кардинально менялись в лучшую сторону механические свойства готового выплавляемого изделия, возрастала пластичность, упругость, полученный сплав можно было раскатать в лист. При этом, меняя процентное соотношение цинка к меди в латуни, можно было изменять диапазон механических характеристик.

Первые упоминания о процессе получения металлического цинка были найдены в Индии (5 век до н.э.). Также методику выплавки «фальшивого серебра» можно найти в исторических трактатах Страбопа (Рим, 60 – 20 г.г. до н.э.). В конце 13 века знаменитый путешественник Марко Поло в своих заметках подробно описывал процесс получения металлического цинка, который наблюдал в Персии. Еще в16 веке Парацельс и Агрикола пытались организовать в своей лаборатории плавильное цинковое производство. Однако попытки закончились неудачей.
До середины 18 века чистый цинк в Европе считался редкостью. Его в основном ввозили из стран Востока, Китая, Индии.
В 1738 году Чемпион У. разработал и запатентовал способ получения металлического цинка методом дистилляции.
В 1743 г. в городе Бристоле им же был построен первый в Европе завод по производству металлического цинка.
Слово «цинк» впервые встречается в трудах Парацельса, который назвал этот металл словом «zincum» или «zinken» в книге Liber Mineralium . Это слово, вероятно, происходит от немецкого Zinke, означающее «зубец» (кристаллиты металлического цинка похожи на иглы).
Это слово, вероятно, происходит от немецкого Zinke, означающее «зубец» (кристаллиты металлического цинка похожи на иглы).
Маргграф А.С. в 1746 г. в Германии опубликовал новый способ получения чистого металлического цинка. Сущность метода заключалось в том, что смесь угля с оксидом цинка прокаливалась в специальных сосудах без доступа воздуха с последующим охлаждением в холодильнике. В результате пары цинка конденсировались, образуя чистый цинк. В качестве герметичных сосудов для опытов использовались реторты, изготовленные из огнеупорной глины.
В 1805 г. был изобретен очередной способ получения цинка – прокат в температурном диапазоне от 100- 150 градусов С. Разработчиками новой технологической методики стали Гобсон Ч. и СильвестрЧ. (Шеффилд).
Электролитический способ литья начали использовать в 1915 г. (Канада, США).
Биологическая роль
Что такое цинк с точки зрения медицины и биологии? Имеет ли он значение для жизни организмов и насколько оно велико? Оказывается, ионы цинка просто обязательно должны присутствовать в живых существах. Иначе дефицит приведет к следующим последствиям:
Иначе дефицит приведет к следующим последствиям:
- анемии;
- снижению инсулина;
- аллергии;
- потере веса и памяти;
- утомляемости;
- депрессии;
- ухудшению зрения;
- раздражительности и другим.
Основные места концентрации ионов цинка в организме человека — это поджелудочная железа, печень и мышцы. Также именно этот металл входит в состав большинства ферментов (например, карбоангидраза). Поэтому большинство реакций катализа происходит при участии цинка.
Что именно делают ионы?
- Участвуют в синтезе мужских гормонов и семенной жидкости.
- Способствуют усвоению витамина Е.
- Участвуют в расщеплении молекул алкоголя в организме.
- Являются непосредственными участниками синтеза многих гормонов (инсулина, гормона роста, тестостерона и других).
- Принимает участие в кроветворении и заживлении поврежденных тканей.
- Регулирует секрецию сальных желез, поддерживает нормальный рост волос и ногтей, способствует регенерационным процессам в коже.

- Обладает способностью устранять из организма токсины и укреплять иммунитет.
- Влияет на формирование вкусовых ощущений, а также обоняния.
- Принимает участие в процессах транскрипции, обмене витамина А, нуклеиновых синтезах и распадах.
- Является участником всех стадий роста и развития клетки, а также сопровождает процесс экспрессии гена.
Все это еще раз доказывает, насколько важным элементом является данный металл. Роль его в биологических системах была выяснена только в XX веке. Многих неприятностей и недугов в прошлом можно было бы избежать, если бы люди знали о лечении при помощи препаратов на основе цинка.
Каким же образом можно поддерживать нужное количество этого элемента в организме? Ответ очевиден. Необходимо употреблять продукты, содержащие цинк. Список может быть длинным, поэтому укажем только те, в которых максимальное количество рассматриваемого элемента:
- орехи и семечки;
- бобовые;
- мясо;
- морепродукты, особенно, устрицы;
- злаки и хлеб;
- молочная продукция;
- зелень, овощи и фрукты.

Цинк в природе
Чистый металлический цинк можно получить только промышленным путем. В природе цинк встречается в виде минералов. На данный момент известно более 60 природных минеральных соединений. Наиболее распространенные цинковые минералы — это виллемит, цинкит, сфалерит, каламин, франклинит. Самыми многочисленными считаются залежи сфалерита. Данный минерал состоит из
- сульфида цинка (ZnS) – основной компонент,
- различных примесей – дополнительные составляющие.
Дополнительные компоненты определяют окончательный цвет минерала. В простонародье минерал именуют «цинковой обманкой» (из-за трудности определения в природе, в переводе с др. греческого «обманчивый»). Так, например, смесь цинковой «обманки» и бурого шпата представляет собой полосатую структуру. Залежи такой «бурундучной» руды часто находят геологи в Алтайском крае (Россия).
Читайте также: Тату колючая проволока. Значение на ноге, запястье, шее, ноге, с цветами, розой, сердцем, крестом
Цинк в различных соединениях присутствует
- в земной каре,
- в воде,
- в живых организмах.

Приблизительно около 10% цинка (в различном составе) содержится в земной коре. При этом исследования показали, что в основных породах извержения вулканов содержание цинковых соединений составляет от 1,5% до 10%, в кислых породах процент колеблется от 6 до 10.
Исследования выявили большое наличие цинка в водах термальных источников (в основном это были различные соединения цинка со свинцом). В промышленности в настоящее время активно используются сульфиды цинка, добываемые из термальных вод.
Цинк присутствует в растворенном виде, как в поверхностных, так и в подземных водах. В водной среде в качестве адсорбирующего элемента для «мигрирующего» цинка является сероводород, глина и многое др.
Наличие цинка в живых организмах колеблется от 5 до 10-4 %.
Свойства атома цинка:
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 65,38(2) а. е.м. (г/моль) е.м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 |
| 203 | Электронная оболочка | K2 L8 M18 N2 O0 P0 Q0 R0 |
| 204 | Радиус атома (вычисленный) | 142 пм |
| 205 | Эмпирический радиус атома* | 135 пм |
| 206 | Ковалентный радиус* | 122 пм |
| 207 | Радиус иона (кристаллический) | Zn2+ 74 (4) пм, 88 (6) пм, 104 (8) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 139 пм |
| 209 | Электроны, Протоны, Нейтроны | 30 электронов, 30 протонов, 35 нейтронов |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 4 |
| 212 | Группа в периодической таблице | 12-ая группа (по старой классификации – побочная подгруппа 2-ой группы) |
| 213 | Эмиссионный спектр излучения |
Цинк — химический элемент.
 Области применения
Области применения- Цинк активно используется при добыче и извлечении благородных металлов (золото, серебро) из обогащенных пород. Так, например, если добыча драгоценных металлов производится методом подземного выщелачивания, то металлический цинк используется в качестве восстановителя.
- В машиностроении используются различные способы цинкового покрытия для защиты металлического изделия от коррозионного разрушения.
- При производстве аккумуляторов и батареек цинк используют в качестве материала для отрицательно заряженного электрода. Самой высокой удельной энергоемкостью обладают цинк-воздушные аккумуляторные батареи.
- В полиграфии применяются пластины для печати, выполненные из цинка.
- Производство краски – цинковые белила (окись цинка).
- Цинковые соединения используют в производстве по изготовлению п/проводников.
- Для изготовления люминесцирующего состава используются сульфид цинка.
- В приборостроении цинк специально вводят в некоторые виды твердых припоев для того, чтобы снизить температуру плавления.

- Производство фибры – во флюс для пайки металлов и различных компонентов вводят хлорид цинка.
- Широка область применения сплава цинка с медью – латуни. Чаще всего данный сплав используют в машиностроении при производстве особо ответственных деталей (точное литье).
- Цинковые соединения применяют при изготовлении автомобильных резиновых шин.
- В оптике цинк используется при изготовлении специальных оптических стекол, которые имеют низкий коэффициент поглощения (в среднем инфракрасном спектральном диапазоне).
- Медицина. Цинк. Для производства антисептиков и противовоспалительных препаратов используют окись цинка.
- В отраве для грызунов также используются цинковые соединения (фосфид цинка).
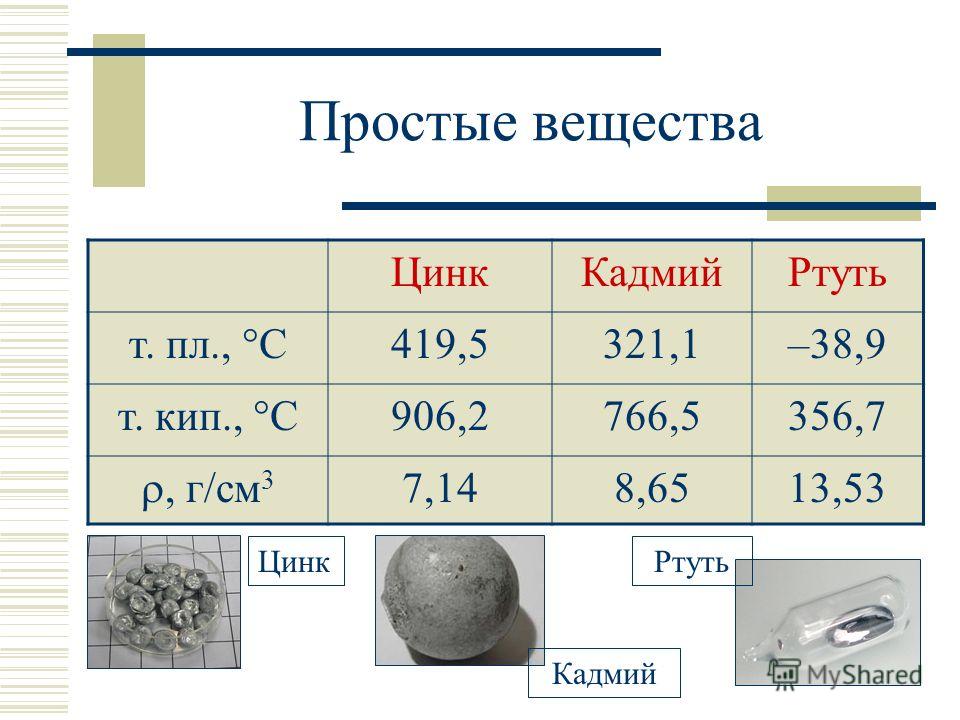
Физические свойства цинка:
| 400 | Физические свойства | |
| 401 | Плотность* | 7,14 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 6,57 г/см3 (при температуре плавления 419,53 °C и иных стандартных условиях, состояние вещества – жидкость), 6,4 г/см3 (при 800 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 419,53 °C (692,68 K, 787,15 °F) |
| 403 | Температура кипения* | 907 °C (1180 K, 1665 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 7,32 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 115 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость* | 25,47 Дж/(K·моль) |
| 411 | Молярный объём | 9,16092 см³/моль |
| 412 | Теплопроводность | 116 Вт/(м·К) (при стандартных условиях), 116 Вт/(м·К) (при 300 K) |
| 413 | Коэффициент теплового расширения | 30,2 мкм/(М·К) (при 25 °С) |
| 414 | Коэффициент температуропроводности | |
| 415 | Критическая температура | |
| 416 | Критическое давление | |
| 417 | Критическая плотность | |
| 418 | Тройная точка | |
| 419 | Давление паров (мм. рт.ст.) рт.ст.) | |
| 420 | Давление паров (Па) | |
| 421 | Стандартная энтальпия образования ΔH | |
| 422 | Стандартная энергия Гиббса образования ΔG | |
| 423 | Стандартная энтропия вещества S | |
| 424 | Стандартная мольная теплоемкость Cp | |
| 425 | Энтальпия диссоциации ΔHдисс | |
| 426 | Диэлектрическая проницаемость | |
| 427 | Магнитный тип | |
| 428 | Точка Кюри | |
| 429 | Объемная магнитная восприимчивость | |
| 430 | Удельная магнитная восприимчивость | |
| 431 | Молярная магнитная восприимчивость | |
| 432 | Электрический тип | |
| 433 | Электропроводность в твердой фазе | |
| 434 | Удельное электрическое сопротивление | |
| 435 | Сверхпроводимость при температуре | |
| 436 | Критическое магнитное поле разрушения сверхпроводимости | |
| 437 | Запрещенная зона | |
| 438 | Концентрация носителей заряда | |
| 439 | Твёрдость по Моосу | |
| 440 | Твёрдость по Бринеллю | |
| 441 | Твёрдость по Виккерсу | |
| 442 | Скорость звука | |
| 443 | Поверхностное натяжение | |
| 444 | Динамическая вязкость газов и жидкостей | |
| 445 | Взрывоопасные концентрации смеси газа с воздухом, % объёмных | |
| 446 | Взрывоопасные концентрации смеси газа с кислородом, % объёмных | |
| 446 | Предел прочности на растяжение | |
| 447 | Предел текучести | |
| 448 | Предел удлинения | |
| 449 | Модуль Юнга | |
| 450 | Модуль сдвига | |
| 451 | Объемный модуль упругости | |
| 452 | Коэффициент Пуассона | |
| 453 | Коэффициент преломления |
Цинк и сталь
Практически в каждом доме можно встретить оцинкованные вещи: ведра, кастрюли, выварки и пр. Все они надежно защищены от ржавчины именно благодаря цинку. Образно выражаясь, конечно, на сталь наносится напыление этого металла, и по логике вещей речь не идет о сплаве. С другой стороны, зная, как происходит оцинкование, можно утверждать обратное. Дело в том, что цинк плавится при очень низкой температуре (около 400°С), а когда он в жидком состоянии попадает на поверхность стали, то диффундирует в неё.
Все они надежно защищены от ржавчины именно благодаря цинку. Образно выражаясь, конечно, на сталь наносится напыление этого металла, и по логике вещей речь не идет о сплаве. С другой стороны, зная, как происходит оцинкование, можно утверждать обратное. Дело в том, что цинк плавится при очень низкой температуре (около 400°С), а когда он в жидком состоянии попадает на поверхность стали, то диффундирует в неё.
Атомы обоих веществ очень крепко связываются между собой, образуя железоцинковый сплав. По этой причине можно смело сказать, что Zn не «уложен» на изделие, а «внедрен» в него. Это можно наблюдать в обычной бытовой ситуации. К примеру, на оцинкованном ведре появляется царапина. Начинает ли оно в этом месте ржаветь? Ответ однозначный – нет. Это происходит потому, что при попадании влаги начинают разрушаться соединения цинка, но при этом они образуют некую защиту для стали. Так, в большинстве случаев такие цинковые сплавы предназначены для защиты изделий от коррозии. Конечно, для этих целей можно использовать и другие вещества, такие как хром или никель, но стоимость этих изделий будет в разы больше.
Факты о цинке (внешний вид, свойства и многое другое)
Пожалуйста, напишите или поделитесь этой статьей!
- Электронная почта
- ФБ
Цинк — переходный металл, находящийся в первой строке двенадцатого столбца периодической таблицы элементов.
Атомный номер цинка равен 30, так как он содержит 30 протонов, 30 электронов и 34 нейтрона.
Химический символ цинка — Zn, а его атомный вес — 65,38.
При комнатной температуре цинк выглядит как твердый металл, хотя его температура плавления составляет 419 градусов Цельсия, а температура кипения – 907 градусов Цельсия.
Характеристики и свойства
В своей стандартной, наиболее типичной форме цинк представляет собой твердый хрупкий металл сине-белого цвета, очень похожий на кобальт.
КобальтОднако хрупкость цинка переходит в более податливое, подвижное вещество всего лишь при 100 градусах Цельсия.
Большинство металлов имеют очень высокие температуры плавления и кипения, обычно выше 1000 градусов Цельсия. Тем не менее, температуры плавления и кипения цинка, как правило, примерно вдвое ниже, чем у металлов.
Тем не менее, температуры плавления и кипения цинка, как правило, примерно вдвое ниже, чем у металлов.
Таким образом, несмотря на то, что цинк может сохранять свою структуру и свойства при достаточно высоких температурах, он подвергается воздействию гораздо раньше, чем это наблюдается в других металлах.
Цинк также является относительно хорошим проводником электричества.
Вступает в реакцию при контакте с двуокисью углерода в воздухе: образуется карбонат цинка, который защищает цинк от коррозии под действием других элементов.
Однако цинк не вступает в реакцию при контакте с чистым кислородом, хотя он определенно будет реагировать на большинство типов кислот: известно, что он растворяется в большинстве типов кислот и даже в некоторых основаниях.
История
Интересно, что цинк использовался людьми со времен древних цивилизаций, и поэтому он использовался так долго, что мы не знаем, кто первым открыл цинк и когда это было.
Цинк можно найти среди других минералов во внешнем слое земной коры.
Однако, в отличие от кобальта и меди, он не встречается в чистом виде без предварительной очистки от других металлов.
Интересно, что цинк является двадцать четвертым по распространенности элементом на Земле, и небольшое количество его можно обнаружить в атмосфере Земли и в океане.
Цинк также можно добывать для использования человеком, а страны, которые добывают и распространяют больше всего цинка, включают Китай, Австралию и Перу.
Как цинк используется сегодня
Большая часть цинка, специально добываемого для использования, в основном используется для изготовления других инструментов из других металлов.
Фактически, цинк обычно используется для гальванизации стали и железа, а это означает, что цинк используется для покрытия и защиты других металлов, чтобы эти инструменты не ржавели и не подвергались коррозии.
Цинк также является одним из металлов, который чаще всего комбинируют с другими металлами для получения металлического сплава, который можно использовать для создания всех видов инструментов и оборудования для использования.
Сплавы, обычно изготавливаемые из цинка, включают латунь, которая представляет собой комбинацию цинка и меди.
Веселая викторина по цинку!
- Какая стандартная форма цинка?
- Какова температура плавления цинка?
- Какой атомный номер у цинка?
- Какого цвета обычно бывает цинк?
- Что такое общий сплав цинка?
Ответы:
- Твердый, твердый, хрупкий металл
- 419 градусов Цельсия
- 30
- Сине-белый
- Латунь (цинк и медь)
Химия
Характеристики цинка | ВМЦИНК Великобритания
Цинк и жизнь
Цинк и живые организмы
Цинк является важным элементом для всех живых организмов. Цинк необходим и незаменим для жизни человека, животных и растений.
Для каждого живого организма существует оптимальный диапазон концентрации цинка. В этом диапазоне концентраций живые организмы могут регулировать свою внутреннюю концентрацию, чтобы удовлетворить потребности своего метаболизма.
Если эти оптимальные условия не соблюдены и возникает дефицит, может возникнуть дефицит цинка, а в случае его избытка возникают экотоксикологические проблемы.
Люди обычно не подвергаются избытку цинка, но могут испытывать дефицит цинка.
Цинк и человек
Цинк является важным элементом. Это важный металлический элемент для человечества, так как он занимает 3-е место после магния и железа.
Цинк играет важную роль для здоровья. Он необходим для роста, развития мозга, защиты кожи, правильного функционирования иммунной системы, пищеварения, воспроизводства, вкуса, обоняния и многих других естественных процессов.
Организм человека не может синтезировать необходимый ему цинк. Поэтому он получает цинк из пищи. Всемирная организация здравоохранения (ВОЗ) рекомендует ежедневное потребление цинка 10 мг/день для детей, 12 мг/день для женщин и 15 мг/день для мужчин. Определенные группы населения имеют более высокую потребность в цинке и поэтому более подвержены риску дефицита цинка: дети и подростки, беременные женщины, пожилые люди и т.
Основные симптомы, связанные с риском дефицита: снижение вкусовых ощущений и запах, проблемы с кожей, умственная вялость и снижение фертильности.
Разнообразие рациона человека зависит прежде всего от его культуры и уровня жизни. Поскольку количество цинка варьируется в зависимости от типа пищи, в глобальном масштабе многие взрослые и дети придерживаются диеты с низким содержанием цинка. В развивающихся странах дефицит цинка занимает 5-е место среди 10 ведущих факторов риска для здоровья человека; Всемирная организация здравоохранения (ВОЗ) ежегодно связывает 800 000 смертей во всем мире с дефицитом цинка и потерей более 28 миллионов лет здоровой жизни (¹).
Цинк и экотоксикология
Цинк естественно присутствует в окружающей среде: горные породы, почва, вода и воздух всегда естественным образом содержали его различные концентрации. В ходе своей эволюции все живые организмы использовали цинк, доступный в окружающей среде, для определенных функций своего метаболизма.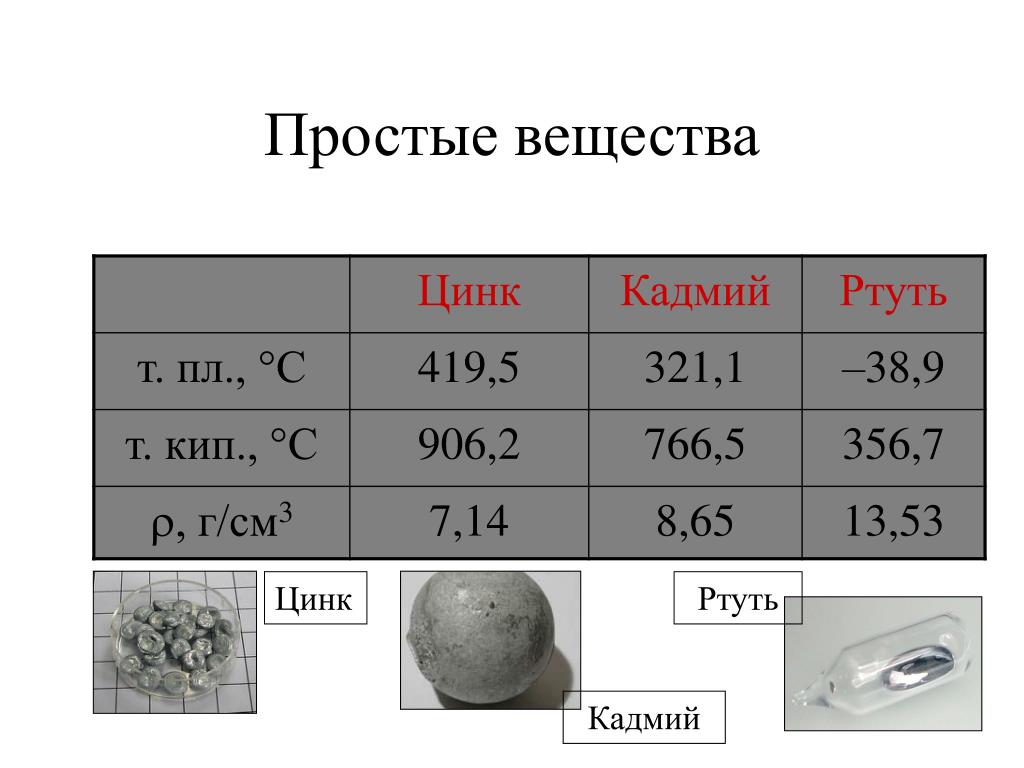
Живые организмы приспособлены к естественной концентрации цинка в их экосистеме. Кроме того, они разработали механизмы для поддержания оптимальных условий жизни, когда этот уровень концентрации отличается от естественной нормы. Но если концентрация цинка радикально изменится, условия жизни перестанут быть оптимальными, и это может повлиять на функционирование экосистемы.
К счастью, концентрации цинка в европейских экосистемах возникают либо в результате деятельности человека (например, атмосферная коррозия цинкового проката и оцинкованной стали, износ автомобильных шин, удобрений и кормов для животных и т. д.), либо в результате естественных выбросов (в основном из-за вулканических активности), остаются в пределах оптимальных условий существования. Хорошим примером этого являются текущие уровни цинка в Рейне (экстремальные значения от 3 до 25 мкг/л), которые находятся в пределах оптимального диапазона для цинка (²,³).
(¹) Международная ассоциация цинка (IZA) – Справочник по цинку 2003
(²) «Воздействие цинка и его компонентов на человека и окружающую среду», P.Ciarletta et F.Van Assche, Colloque CEFRACOR – Le center du цинка – Сент-Уан – март 1993 г.
(³) “Цинк в окружающей среде”, Международная ассоциация цинка, 1997 г. Издание
Состав цинка
Сплав с лучшими характеристиками
Состав сплаваНаш цинковый прокат легирован медью и титаном для получения материала с оптимальными механическими и физическими характеристиками для применения в строительстве, особенно в отношении механической прочности и сопротивления ползучести. .
Состоит из цинка очень высокого качества Z1 (чистота цинка 99,995 %), согласно стандарту EN 1179, с добавлением титана и меди. Медь повышает механическую стойкость сплава, делая его более твердым и прочным.
Титан повышает сопротивление ползучести, обеспечивая большее тепловое расширение и сжатие материала, не вызывая усталости металла.
Европейский стандарт EN 988 применяется с 1997 года в 18 европейских странах. Этот стандарт устанавливает очень строгие требования к составу цинкового проката и его физическим, механическим и размерным характеристикам, что делает его международным эталоном.
| Physical properties of titanium zinc by VMZINC | |
|---|---|
| Density | 7.2 kg/dm³ |
| Thermal expansion coefficient (parallel to the rolling direction) | 0.022 mm/m/°C |
| Печатию плавления | 420 ° C |
| Точка рекристаллизации | 300 ° C |
| Ожи для оборонительного производства | |
| Ожи для тепла.0174 Электропроводность | 17 МС/м |
| Опасность искрения | Безыскровость |
| Магнитные свойства | 90274 Диамагнитные00 90274|


 Согласно результатам многочисленных исследований, люди с акне часто имеют недостаток цинка.
Согласно результатам многочисленных исследований, люди с акне часто имеют недостаток цинка.






