Характеристика элемента цинка по плану: Строение атома цинка (Zn), схема и примеры
alexxlab | 25.09.1990 | 0 | Разное
Ответы на контрольную работу по теме «Характеристика элемента по его положению в Периодической системе химических элементов Д. И. Менделеева. Химические реакции»(Габриелян)
Первый уровень
Вариант 1
1. Дано уравнение реакции нейтрализации гидроксида натрия соляной кислотой:
NaOH + НСl = NaCl + Н20 + Q.
Дайте характеристику реакции по следующим признакам:
• число и состав исходных веществ и продуктов реакции;
• тепловой эффект;
• агрегатное состояние веществ;
• участие катализатора;
• изменение степеней окисления элементов;
• направление.
Рассмотрите данную химическую реакцию с точки зрения теории электролитической диссоциации. Запишите полное и сокращенное ионные уравнения.
NaOH + HCl = NaCl + h3O + Q
Исходные вещества: 1 моль гидроксида натрия тв.(1 атом натрия, 1 атом водорода, 1 атом кислорода), 1 моль соляной кислоты ж.(1 атом водорода, 1 атом хлора).
Продукты реакции: 1 моль хлорида натрия тв. (1 атом натрия, 1 атом хлора), 1 моль воды ж.(1 атом кислорода, 2 атом водорода).
(1 атом натрия, 1 атом хлора), 1 моль воды ж.(1 атом кислорода, 2 атом водорода).
Реакция экзотермическая
Без катализатора
Без изменения степеней окисления
Необратимая реакция
Na+ + OH- + H+ + Cl- = Na+ + Cl- + h3O
OH- + H+ = h3O
2. Дайте характеристику химического элемента магния по плану:
• положение элемента в ПСХЭ;
• строение атома;
• формулы оксида и гидроксида, их характер.
Магний — Mg
Порядковый номер Z=12; массовое число А= 24, заряд ядра + 12, число протонов =12, нейтронов( N= A-Z= 12) 24 – 12=12 нейтронов, электронов = 12, период – 3, энергетических уровней – 3,
Строение электронной оболочки: 12 М g 2е; 8е; 2е.
12 М g ) ) )
2 8 2
Степень окисления +2;
Восстановительные свойства у магния выражены сильнее, чем у бериллия, но слабее, чем у кальция, что связано с увеличением радиусов атомов Ве – М g — Са;
Ион магния М g 2+
МgО – оксид магния является основным оксидом и проявляет все характерные свойства оксидов.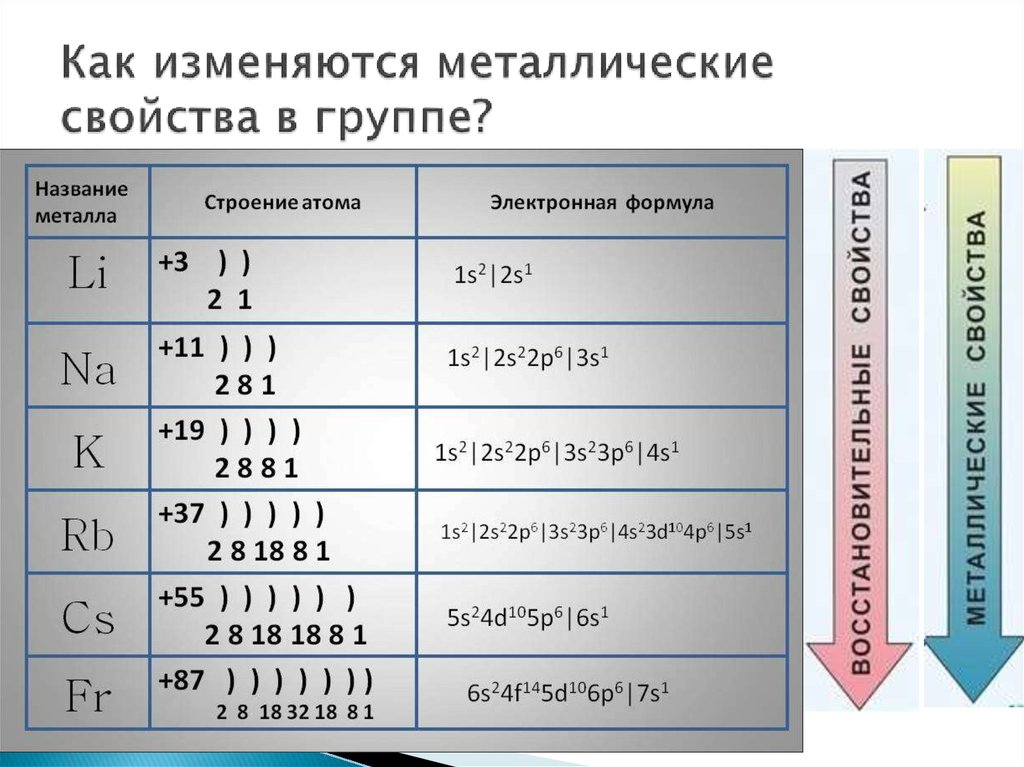
3. Напишите уравнения реакций оксида и гидроксида магния с соляной кислотой в молекулярном и ионном виде.
MgO+2HCl=MgCl₂ + H₂O
MgO+2H+=Mg2+ + H₂O
Mg(OН)2+2HCl= MgCl₂ + 2H₂O
Mg(OН)2+2H+= Mg2+ + 2H₂O
Вариант 2
1. Дана схема реакции горения алюминия
Аl + 02 → А1203 + Q.
Составьте уравнение данной реакции, расставив коэффициенты в нем методом электронного баланса. Укажите окислитель и восстановитель.
Дайте характеристику реакции по следующим признакам:
• число и состав исходных веществ и продуктов реакции;
• тепловой эффект;
• агрегатное состояние веществ;
• участие катализатора;
• изменение степеней окисления элементов;
• направление.
0 0 +3 –2
Al + O2 = Al2O3+Q
Алюминий восстановитель, а кислород – окислитель.
Исходные вещества: 4 моль алюминия, 3 моль кислорода (3 молекулы из 2 атомов кислорода).
 Продукт реакции: 2 моль оксида алюминия (2 атома алюминия, 3 атома кислорода в одной молекуле).
Продукт реакции: 2 моль оксида алюминия (2 атома алюминия, 3 атома кислорода в одной молекуле).Реакция экзотермическая.
Алюминия – тв., кислород – г., оксид алюминия – тв.
Без участия катализатора
С изменением степеней окисления.
Необратимая.
2. Дайте характеристику химического элемента натрия по плану:
• положение элемента в ПСХЭ;
• строение атома;
• формулы оксида и гидроксида, их характер.
Натрий — Na
Порядковый номер Z=11; массовое число А= 23, заряд ядра + 11, число протонов =11, нейтронов( N= A-Z= 11) 23 – 11=12 нейтронов, электронов = 11, период – 3, энергетических уровней – 3,
Строение электронной оболочки: 11 Na 2е; 8е; 1е.
2 8 1
Степень окисления +1;
Восстановительные свойства у натрия выражены сильнее, чем у лития, но слабее, чем у калия, что связано с увеличением радиусов атомов;
Ион натрия Na +
Na 2О – оксид натрия является основным оксидом и проявляет все характерные свойства оксидов.
 Натрий образует гидроксид NaОН (щелочь), который проявляет все характерные свойства оснований.
Натрий образует гидроксид NaОН (щелочь), который проявляет все характерные свойства оснований.3. Напишите уравнения реакций оксида и гидроксида натрия с раствором серной кислоты в молекулярном и ионном виде.
2NaOH+h3SO4=2h3O+Na2SO4
2OH-+2H+=2h3O
Na2O+h3SO4=h3O+Na2SO4
Na2O+2H+=h3O+2Na+
Вариант 3
1. Дана схема реакции получения оксида серы (VI) из оксида серы (IV)
S02 + 02 S03 + Q.
Составьте уравнение данной реакции, расставив коэффициенты в нем методом электронного баланса. Укажите окислитель и восстановитель.
• число и состав исходных веществ и продуктов реакции;
• тепловой эффект;
• агрегатное состояние веществ;
• участие катализатора;
• изменение степеней окисления элементов;
• направление.
2S+4O2 + O02 = 2S+6O-23+ Q
S+4 -2e →S+6 восстановитель
O02 +4e→2O-2 окислитель
Исходные вещества – 2 моль оксида серы 4 (в одной молекуле 1 атом серы, 2 атома кислорода) и 1 моль кислорода (в одной молекуле 2 атома кислорода).

Продукт реакции – 2 моль оксида серы 6 (в одной молекуле 1 атом серы, 3 атома кислорода)
Реакция экзотермическая.
Оксид серы 4 и кислород – газы, Оксид серы (VI) жидкость
С катализатором
С изменением степеней окисления
Обратимая.
2. Дайте характеристику химического элемента лития по плану:
• положение элемента в Периодической системе;
• строение атома;
• формулы оксида и гидроксида, их характер.
Литий Li
Порядковый номер Z=3; массовое число А= 7, заряд ядра + 3, число протонов =3, нейтронов( N= A-Z= 4) 7 – 3=4 нейтронов, электронов = 3, период – 2, энергетических уровней – 2
Строение электронной оболочки: 3 Li 2е; 1е.
3 Li ) )
2 1
Степень окисления +1;
Восстановительные свойства у лития выражены слабее, чем у натрия и калия, что связано с увеличением радиусов атомов;
Ион лития Li +
Li 2О – оксид лития является основным оксидом и проявляет все характерные свойства оксидов. Литий Li образует гидроксид Li ОН (щелочь), который проявляет все характерные свойства оснований.
3. Напишите уравнения реакций оксида и гидроксида лития с серной кислотой в молекулярном и ионном виде.
2OH-+2H+=2h3O
Li 2O+h3SO4=h3O+ Li 2SO4
Li 2O+2H+=h3O+2Li +
Вариант 4
1. Дано уравнение реакции цинка с соляной кислотой:
Zn + 2НСl = ZnCl2 + Н2↑ + Q.
Дайте характеристику реакции по следующим признакам:
• число и состав исходных веществ и продуктов реакции;
• тепловой эффект;
• агрегатное состояние участвующих в реакции веществ;
• участие катализатора;
• изменение степеней окисления химических элементов;
• направление.
Рассмотрите данную химическую реакцию с точки зрения теории электролитической диссоциации: запишите полное и сокращенное ионные уравнения.
2HCl+Zn=ZnCl2+h3↑ + Q
Исходные вещества: 1 моль цинк, 2 моль соляной кислоты (1 атом водорода, 1 атом хлора в молекуле). Продукты реакции: 1 моль хлорида цинка (1 атом цинка, 2 атома хлора в ФЕ), 1 моль водорода (2 атома водорода).
Экзотермическая реакция
Цинк – тв., соляная кислота – ж., хлорид цинка тв. (раствор), водород – г.
Без катализатора
С изменением степеней окисления
Необратимая
2H++2Cl-+Zn0=Zn2++2Cl-+h30
2H++Zn0=Zn2++h30
2. Дайте характеристику химического элемента кальция по плану:
• положение элемента в Периодической системе;
• строение атома;
• формулы высшего оксида и гидроксида, их характер.
Кальций Са
Порядковый номер Z=20; массовое число А= 40, заряд ядра + 20, число протонов =20, нейтронов( N= A-Z= 20) 40 – 20=20 нейтронов, электронов = 20, период – 4, энергетических уровней – 4,
Строение электронной оболочки: 20 М g 2е; 8е; 8е; 2е.
20 Са ) ) ) )
2 8 8 2
Степень окисления +2;
Восстановительные свойства у кальция выражены сильнее, чем у магния, но слабее, чем у стронция, что связано с увеличением радиусов атомов
Ион кальция Са 2+
 Кальций образует гидроксид Са (ОН)2, который проявляет все характерные свойства оснований.
Кальций образует гидроксид Са (ОН)2, который проявляет все характерные свойства оснований.3. Напишите уравнения реакций оксида и гидроксида кальция с азотной кислотой в молекулярном и ионном виде.
СаO+2HNO3= Са(NO3)₂ + H₂O
СаO+2H+= Са 2+ + H₂O
Са(OН)2+2HNO3= Са(NO3)₂ + 2H₂O
Са(OН)2+2H+= Са 2+ + 2H₂O
Второй уровень
Вариант 1
1. Дано уравнение реакции получения оксида азота (II):
N2 + 02 2NO – Q.
Дайте характеристику реакции по всем изученным вами классификационным признакам.
Рассмотрите данную реакцию с точки зрения ОВР. Укажите окислитель и восстановитель.
N20 + O20 2N+2O-2 – Q
N20 – 2*2е = 2N+2 восстановитель
O20+2*2е = 2O-2 окислитель
Исходные вещества: азот 1 моль, 2 атома N, кислород 1 моль (2 атома О).
Исходные вещества и продукты реакции – газы.
Реакция эндотермическая.

Обратимая.
Без катализатора.
С изменением степеней окисления.
2. Дайте характеристику химического элемента углерода по его положению в Периодической системе.
Углерод С – химический элемент IV группы периодической системы Менделеева: атомный номер 6, атомная масса 12,011.
Порядковый номер Z=6; массовое число А= 12, заряд ядра + 6 число протонов =6, нейтронов( N= A-Z= 6) 12 – 6=6 нейтронов, электронов = 6, период – 2, энергетических уровней – 2,
Строение электронной оболочки: 6 С 2е; 4е
6 С ) )
2 4
Степень окисления +4;
Окислительные свойства у углерода выражены сильнее, чем у бора, но слабее, чем у азота, что связано с увеличением заряда ядра.
3. Составьте формулы высшего оксида и гидроксида углерода, укажите их характер. Напишите уравнения всех реакций, характерных для этих веществ, в ионной и молекулярной формах.
СО2 + Н2О ↔ Н2СО3
СО2 + Н2О ↔ 2Н+ + СО32-
Na2O + CO2 → Na2CO3
Na2O + CO2 → 2Na+ + CO32-
2NaOH + CO2 → Na2CO3 + h3O
OH- + CO2 → CO32- + h3O
Ca(OH)2 + CO2 → CaCO3 ↓+ h3O
Ca2+ +2OH- + CO2 → CaCO3 ↓+ h3O
h3CO3 + Ca = CaCO3 + h3↑
2H+ +CO32- + Ca = CaCO3 ↓+ h3↑
h3CO3 + CaO = CaCO3 ↓+ h3O
2H+ +CO32- + CaO = CaCO3 ↓+ h3O
h3CO3 + 2NaOH = Na2CO3 + 2h3O
2H+ + CO32- + 2Na+ +OH- = 2Na++CO32- + 2h3O
2H+ +OH- = 2h3O
Вариант 2
1. Дано уравнение реакции синтеза аммиака:
N2 + 3Н2 2Nh4 + Q.
Дайте характеристику реакции по всем изученным вами классификационным признакам.
Рассмотрите данную реакцию с точки зрения ОВР. Укажите окислитель и восстановитель.
3h3 + N2 2Nh4 + Q
N20 +2*3е→2N-3 окислитель
h30 -2*1е→2H+1 восстановитель
Исходные вещества: 1 моль азота (молекула из 2 атомов азота), 3 моль водорода (молекула из 2 атомов водорода). Продукт реакции – аммиак, 2 моль. Молекула из 1 атома азота и 2 атомов водорода. Исходные вещества продукты реакции – газы.
Исходные вещества продукты реакции – газы.
Реакция:
Экзотермическая.
Окислительно-восстановительная.
Прямая.
Каталитическая.
Обратимая.
2. Дайте характеристику химического элемента серы по его положению в Периодической системе.
Сера – S
Порядковый номер Z=16 и массовое число А= 32, заряд ядра + 16, число протонов =16, нейтронов( N= A-Z= 12) 32 – 16=16 нейтронов, электронов = 16, период – 3, энергетических уровней – 3
16 S ) ) )
Строение электронной оболочки: 16 S 2е; 8е; 6е.
16 S ) ) )
2 8 6
Степень окисления – (-2) и (+ 2; +4; +6)
Окислительные свойства у серы выражены сильнее, чем у селена, но слабее, чем у кислорода, что связано с увеличением радиусов атомов от кислорода к селену
SО 3 – оксид серы является кислотным оксидом и проявляет все характерные свойства оксидов.
Сера образует гидроксид Н2SО4, который проявляет все характерные свойства кислот.
Сера из водородных соединений образует Н2S.
3. Составьте формулы высшего оксида и гидроксида серы, укажите их характер. Напишите уравнения всех реакций, характерных для этих веществ, в ионной и молекулярной формах.
SO3 + h3O → h3SO4
2NaOH + SO3 → Na2SO4 + h3O
2ОН- + SO3 → SO42- + h3O
Na2O + SO3 → Na2SO4
Na2O + SO3 → 2Na+ +SO42-
Zn0 + h3+1SO4(разб) → Zn+2SO4 + h30↑
Zn0 + 2H+ → Zn2+ + h30↑
CuO + h3SO4 → CuSO4 + h3O
CuO + 2H+ → Cu2+ + h3O
h3SO4 + 2NaOH → Na2SO4 + 2h3O (реакция нейтрализации)
H+ + OH- → h3O
h3SO4 + Cu(OH)2 → CuSO4 + 2h3O
2H+ + Cu(OH)2 → Cu2+ + 2h3O
BaCl2 + h3SO4 → BaSO4↓ + 2HCl
Ba2+ + SO42- → BaSO4↓
MgCO3 + h3SO4 → MgSO4 + h3O + CO2↑
MgCO3 + 2H+ → Mg2+ + h3O + CO2¬↑
Вариант 3
1. Дано уравнение реакции хлорида меди (II) с гидроксидом натрия:
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl.
Дайте характеристику реакции по всем изученным вами классификационным признакам.
Рассмотрите реакцию с точки зрения ТЭД: запишите полное и сокращенное ионные уравнения.
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
Cu2+ + 2OH- = Cu(OH)2↓
Исходные вещества: 1 моль хлорида меди (1 атом меди, 2 атома хлора), 2 моль гидроксида натрия (1 атом натрия, 1 атом кислорода, 1 атом водорода в ФЕ).
Продукты реакции: 1 моль гидроксида меди (1 атом меди, 2 атома кислорода, 2 атома водорода), 2 моль хлорид натрия (1 атом натрия, 1 атом хлора в ФЕ).
Продукты реакции и исходные вещества – твердые растворенные. Cu(OH)2 – твердый осадок.
Реакция:
Экзотермическая
Без изменения степеней окисления
Прямая
Без участия катализатора
Необратимая.
2. Дайте характеристику химического элемента фосфора по его положению в Периодической системе Д. И. Менделеева.
Характеристика Р (фосфор)
Элемент с порядковым №15 находится в 3 периоде 5 группе, главной подгруппы.
Атомная масса=31.Заряд ядра атома Р+15,т. к. в ядре находится 15 протонов. Схема:
15Р 2е)8е)5е)
В ядре атома 16 нейтронов . В атоме 15 электронов, т. к. их число равно числу протонов и порядковому номеру. В атоме фосфора 3 электронных слоя, т. к. Р стоит в 3 периоде. На последнем слое 5 электронов, т. к. фосфор стоит в 5 группе. Последний слой не завершен. Р-неметалл, т. к. в хим. реакции с металлами принимает 3 электрона до завершения слоя. Его оксид Р2О5-кислотный. Он взаимод. с Н2О, основаниями и основными оксидами. Его гидроксид Н3РО4-кислота. Она взаимод. с металлами, стоящими до Н (водорода), с основными оксидами, основаниями.
их число равно числу протонов и порядковому номеру. В атоме фосфора 3 электронных слоя, т. к. Р стоит в 3 периоде. На последнем слое 5 электронов, т. к. фосфор стоит в 5 группе. Последний слой не завершен. Р-неметалл, т. к. в хим. реакции с металлами принимает 3 электрона до завершения слоя. Его оксид Р2О5-кислотный. Он взаимод. с Н2О, основаниями и основными оксидами. Его гидроксид Н3РО4-кислота. Она взаимод. с металлами, стоящими до Н (водорода), с основными оксидами, основаниями.
3. Составьте формулы высшего оксида и гидроксида фосфора, укажите их характер. Напишите уравнения всех реакций, характерных для этих веществ, в ионной и молекулярной формах.
P2O5 + 3h3O = 2h4PO4
P2O5 + 3h3O = 6H+ +2PO43-
3CaO + P2O5 = Ca3(PO4)2
3Ca(OH)2 + P2O5 = Ca3(PO4)2 + 3h3O.
3Mg + 2h4PO4 = Mg3(PO4)2↓ + 3h3↑
3Mg + 6H++ 2PO43- = Mg3(PO4)2↓ + 3h3↑
2h4PO4+3Na2CO3 = 2Na3PO4 + 3h3O + 3CO2↑
6H++ 3CO3 2-= 3h3O + 3CO2↑
3NaOH + h4PO4 = Na3PO4 + 3h3O
3OH- + 3H+= 3h3O
Вариант 4
1. Дано уравнение реакции карбоната калия с соляной кислотой:
Дано уравнение реакции карбоната калия с соляной кислотой:
К2С03 + 2НСl = 2КСl + С02↑ + Н20.
Дайте характеристику реакции по всем изученным вами классификационным признакам.
Рассмотрите данную реакцию с точки зрения ТЭД: запишите полное и сокращенное ионные уравнения.
K2CO3 + 2HCl = 2KCl + h3O + CO2 ↑
2К+ +СО32- + 2Н+ + 2Сl-= 2К+ 2Сl-+ h3O + CO2
СО32- + 2Н+= h3O + CO2
Исходные вещества: 1 моль карбоната калия (2 атома калия, 1 атом углерода, 3 атома кислорода) тв., 2 моль соляной кислоты (в молекуле 1 атом водорода, 1 атом хлора) жидк.
Продукты реакции: 2 моль хлорида калия (в ФЕ 1 атом калия, 1 атом хлора) тв., 1 моль воды (2 тома водорода, 1 атом кислорода) жидк., 1 моль углекислого газа (1 атом углерода, 2 атома кислорода) – газ.
Реакция:
Экзотермическая.
Без изменения степеней окисления.
Прямая.
Без участия катализатора.
Необратимая.
2. Дайте характеристику химического элемента азота по его положению в Периодической системе.
Азот N- неметалл, II период (малый) , V группа, главная подгруппа.
Атомная масса=14, заряд ядра – +7, число энергетических уровней=2
p=7, e=7,n=Ar-p=14-7=7.
Строение электронной оболочки: 7 N 2е; 5е
7 N ) )
2 5
Степень окисления +5;
Окислительные свойства выражены сильнее, чем у углерода, но слабее, чем у кислорода, что связано с увеличением заряда ядра.
N2О5 оксид азота является кислотным оксидом и проявляет все характерные свойства оксидов. Азот образует кислоту НNО3, которая проявляет все характерные свойства кислот.
Летучее водородное соединение – Nh4
3. Составьте формулы высшего оксида и гидроксида азота, укажите их характер.
Напишите уравнения всех реакций, характерных для этих веществ, в ионной и молекулярной формах.
N2O5 + h3O = 2НNO3
N2O5 + h3O = 2Н+ +NO3-
N2O5 + BaO = Ba(NO3)2
N2O5 + BaO = Ba2+ +2NO3-
N2O5 + 2KOH (р-р) = 2KNO3 + h3O
N2O5 + 2K+ +2OH- = 2K+ +NO32- + h3O
N2O5 + 2OH- = NO32- + h3O
K2O + 2HNO3 → 2KNO3 + h3O
K2O + 2H+ + 2NO3- → 2K+ + 2NO3- + h3O
K2O + 2H+ → 2K+ + h3O
HNO3 + NaOH → NaNO3 + h3O
H+ + NO3- + Na+ + OH- → Na+ + NO3- + h3O
H+ + OH- → h3O
2HNO3 + Na2CO3 → 2NaNO3 + h3O + CO2¬
2H+ + 2NO3- + 2Na+ + СO32- → 2Na+ + 2NO3- + h3O + CO2¬
2H+ + СO32- → h3O + CO2¬
S0 + 6HNO3(конц) → h3S+6O4 + 6NO2 + 2h3O
B0 + 3HNO3 → h4B+3O3 + 3NO2
3P0 + 5HNO3 + 2h3O → 5NO + 3h4P+5O4
С разб.
4Zn + 9HNO3 = Nh4 ↑ + 4Zn(NO3)2 + 3h3O
4Zn + 9H+ + 9NO3- = Nh4 ↑ + 4Zn2+ + 8NO3- + 3h3O
3Cu + 8HNO3 = 2NO ↑ + 3Cu(NO3)2+ 4h3O
3Cu + 8H+ +8NO3-= 2NO ↑ + 3Cu2+ +6NO3-+ 4h3O
конц.
Zn + 4HNO3 = 2NO2↑ + 2h3O + Zn(NO3)2
Zn + 4H+ +4NO3-= 2NO2↑ + 2h3O + Zn2+ +2NO3-
Cu + 4HNO3 = 2NO2↑ + 2h3O + Cu(NO3)2
Cu + 4H+ +4NO3- = 2NO2↑ + 2h3O + Cu2+ +2NO3-
Третий уровень
Вариант 1
1. Дано уравнение реакции получения азотной кислоты:
4N02 + 02 + 2Н20 = 4HN03 + Q.
Дайте характеристику реакции по всем изученным вами классификационным признакам.
Рассмотрите реакцию с точки зрения процессов окисления-восстановления. Укажите окислитель и восстановитель.
4N+4O2 + О02 + 2h3O ↔ 4HN+5O-23
N+4 -1e = N+5 восстановитель
O20 +4e = 2O-2 окислитель
Реакция:
Экзотермическая.
С изменением степени окисления (ОВР).
Без участия катализатора.
Прямая.
Обратимая.
Исходные вещества: 4 моль оксида азота 4 (1 атом азота, 2 атома кислорода в молекуле) – газ, 1 моль кислорода (2 атома кислорода в молекуле) – газ, 2 моль воды (1 атом кислорода, 2 атома водорода в молекуле) – жидк.
Продукт реакции – 4 моль азотной кислоты (1 атом азота, 1 атом водорода, 3 атома кислорода в молекуле) – жидкость.
2. Дайте характеристику химического элемента магния по его положению в Периодической системе.
Магний – порядковый номер в Периодической системе Z = 12 и массовое число А = 24. Заряд ядра +12 (число протонов). Число нейтронов в ядре N = А – Z = 12. Число электронов = 12.
Элемент магний находится в 3-м периоде Периодической системы. Строение электронной оболочки:
12 Mg ) ) )
2 8 2
Степень окисления +2.
Восстановительные свойства у магния выражены сильнее, чем у бериллия, но слабее, чем у кальция (элементы IIА группы), что связано с увеличением радиусов атомов при переходе от Be к Mg и Са.
Оксид магния MgO является основным оксидом и проявляет все типичные свойства основных оксидов. В качестве гидроксида магнию соответствует основание Mg(OH)2, которое проявляет все характерные свойства оснований.
3. Составьте формулы оксида и гидроксида магния, укажите их характер.
Напишите уравнения всех реакций, характерных для этих веществ, в ионной и молекулярной формах.
Оксид магния MgO – основной оксид, основание Mg(OH)2 проявляет все характерные свойства оснований.
MgO + h3O = Mg(OH)2
MgO + CO2 = MgCO3
MgO + CO2 = Mg2+ +CO32-
MgO + h3SO4 = MgSO4 +h3O
MgO + 2H+ = Mg2+ +h3O
Mg(OH)2 + 2HCl = MgCl2 + 2h3O
Mg(OH)2 + 2H+ = Mg2+ + 2h3O
Mg(OH)2 + CO2 = Mg2+ +CO32- + h3O
3Mg(OH)2 + 2FeCl3 = 2Fe(OH)3 + 3MgCl2
3Mg(OH)2 + 2Fe3+ = 2Fe(OH)3 + 3Mg2+
Mg(OH)2 + 2Nh5Cl = MgCl2 + 2Nh4 + 2h3O
Mg(OH)2 + 2Nh5+= Mg2+ + 2Nh4 + 2h3O
MgSO4 + 2NaOH = Mg(OH)2 + Na2SO4
Mg2+ + 2OH- = Mg(OH)2
Вариант 2
1. Дано уравнение реакции железа с хлором:
2Fe + 3Сl2 = 2FeCl3 + Q.
Дайте характеристику химической реакции по всем изученным вами классификационным признакам.
Рассмотрите реакцию с точки зрения процессов окисления-восстановления. Укажите окислитель и восстановитель.
2Fe + 3Cl2 = 2FeCl3 + Q
2
3 Fe – 3e– = Fe+III,
Cl2 + 2e– = 2Cl–I
2Fe – 6e– = 2Fe+III,
3Cl2 + 6e– = 6Cl–I.
Fe – 3e– = Fe+III восстановитель
Cl2 + 2e– = 2Cl–I окислитель
Экзотермическая
ОВР
Прямая
Необратимая
Некаталитическая
Исходные вещества: 2 моль железа – тв., 2 моль хлора (молекула из 2 атомов) – газ
Продукт: 2 моль хлорида железа (из 1 атома железа, 2 атомов хлора в ФЕ) – тв.
2. Дайте характеристику химического элемента натрия по его положению в Периодической системе Д. И. Менделеева.
Натрий — Na
Порядковый номер Z=11; массовое число А= 23, заряд ядра + 11, число протонов =11, нейтронов( N= A-Z= 11) 23 – 11=12 нейтронов, электронов = 11, период – 3, энергетических уровней – 3,
Строение электронной оболочки: 11 Na 2е; 8е; 1е.
11 Na ) ) )
2 8 1
Степень окисления +1;
Восстановительные свойства у натрия выражены сильнее, чем у лития, но слабее, чем у калия, что связано с увеличением радиусов атомов;
Ион натрия Na +
Na 2О – оксид натрия является основным оксидом и проявляет все характерные свойства оксидов. Натрий образует гидроксид NaОН (щелочь), который проявляет все характерные свойства оснований.
Натрий образует гидроксид NaОН (щелочь), который проявляет все характерные свойства оснований.
3. Составьте формулы оксида и гидроксида натрия, укажите их характер. Напишите уравнения всех реакций, характерных для этих веществ, в ионной и молекулярной формах.
2NaOH+h3SO4=2h3O+Na2SO4
2OH-+2H+=2h3O
2NaOH + CO2 —> Na2CO3 + h3O
2OH(-) + CO2 —> CO3(2-) + h3O
2NaOH + SO2 —> Na2SO3 + h3O
2OH(-) + SO2 —> SO3(2-) + h3O
NaOH+ Al(OH)3 —> Na[Al(OH)4]
OH(-) + Al(OH)3 —> Al(OH)4 (-)
Na2O+h3SO4=h3O+Na2SO4
Na2O+2H+=h3O+2Na+
Na2O + h3O —> 2NaOH
Na2O + h3O —> 2Na+ +2OH-
Na2O + 2HCl —-> 2NaCl + h3O
Na2O + 2H+ —-> 2Na+ + h3O
Na2O + CO2 —> Na2CO3
Na2O + CO2 —> 2Na++CO32-
Na2O + SO2 —> Na2SO3
Na2O + SO2 —> 2Na++SO32-
Вариант 3
1. Дано уравнение реакции разложения нитрата калия:
2KN03 = 2KN02 + О2 – Q.
Дайте характеристику реакции по всем изученным вами классификационным признакам.
Рассмотрите реакцию с точки зрения процессов окисления-восстановления. Укажите окислитель и восстановитель.
2КNO3 = 2KNO2 + O2- Q
окислитель: N5+ + 2e− = N=3+|2| восстановление
восстановитель: O2− − 4e− = O20 |1| окисление
Исходные вещества: 2 моль нитрата калия (в ФЕ 1 атом калия, 1 атом азота, 3 атома кислорода) – тв.
Продукты реакции – 2 моль нитрита калия (в ФЕ 1 атом калия, 1 атом азота, 2 атома кислорода) – тв., 1 моль кислорода (2 атома кислорода) – газ.
Эндотермическая
ОВР
Прямая
Необратимая
Некаталитическая
2. Дайте характеристику химического элемента углерода по его положению в Периодической системе.
Углерод С – химический элемент IV группы периодической системы Менделеева: атомный номер 6, атомная масса 12,011.
Порядковый номер Z=6; массовое число А= 12, заряд ядра + 6 число протонов =6, нейтронов( N= A-Z= 6) 12 – 6=6 нейтронов, электронов = 6, период – 2, энергетических уровней – 2,
Строение электронной оболочки: 6 С 2е; 4е
6 С ) )
2 4
Степень окисления +4;
Окислительные свойства у углерода выражены сильнее, чем у бора, но слабее, чем у азота, что связано с увеличением заряда ядра.
СО2 кислотный оксид, Н2СО3 кислота.
3. Составьте формулы оксида и гидроксида углерода, укажите их характер.
Напишите уравнения всех реакций, характерных для этих веществ, в ионной и молекулярной формах.
СО2 оксид углерода является кислотным оксидом и проявляет все характерные свойства оксидов. Углерод образует кислоту Н2СО3, которая проявляет все характерные свойства кислот.
СО2 + Н2О ↔ Н2СО3
СО2 + Н2О ↔ 2Н+ + СО32-
Na2O + CO2 → Na2CO3
Na2O + CO2 → 2Na+ + CO32-
2NaOH + CO2 → Na2CO3 + h3O
OH- + CO2 → CO32- + h3O
Ca(OH)2 + CO2 → CaCO3 ↓+ h3O
Ca2+ +2OH- + CO2 → CaCO3 ↓+ h3O
h3CO3 + Ca = CaCO3 + h3↑
2H+ +CO32- + Ca = CaCO3 ↓+ h3↑
h3CO3 + CaO = CaCO3 ↓+ h3O
2H+ +CO32- + CaO = CaCO3 ↓+ h3O
h3CO3 + 2NaOH = Na2CO3 + 2h3O
2H+ + CO32- + 2Na+ +OH- = 2Na++CO32- + 2h3O
2H+ +OH- = 2h3O
Ca(OH)2 + h3CO3 → CaCO3 ↓+ 2h3O
Ca2+ +2OH- + 2H+ +CO32- → CaCO3 ↓+ 2h3O
Вариант 4
1. Дано уравнение реакции образования гидроксида железа (III):
Дано уравнение реакции образования гидроксида железа (III):
4Fe(OH)2 + 2Н20 + 02 = 4Fe(OH)3.
Дайте характеристику реакции по всем изученным вами классификационным признакам.
Рассмотрите реакцию с точки зрения процессов окисления-восстановления. Укажите окислитель и восстановитель.
4Fe(OH)2 + O2 + 2h3O = 4Fe(OH)3↓
Fe2+ -1е→ Fe3+ восстановитель
O20 + 4е→ 2O2- окислитель
Исходные вещества: 4 моль гидроксида железа 2 (в ФЕ 1 атом железа, 2 атома кислорода, 2 атома водорода) – тв., 1 моль кислорода (2 атома кислорода) – газ, 2 моль воды (2 атома водорода, 1 атом кислорода в молекуле) – ж.
Продукт реакции – 4 моль гидроксида железа 3 (в ФЕ 1 атом железа, 3 атома кислорода, 3 атома водорода) – тв.
Экзотермическая
ОВР
Прямая
Необратимая
Некаталитическая.
2. Дайте характеристику химического элемента фосфора по его положению в Периодической системе.
Характеристика Р (фосфор)
Элемент с порядковым №15 находится в 3 периоде 5 группе, главной подгруппы.
Атомная масса=31.Заряд ядра атома Р+15,т. к. в ядре находится 15 протонов.
Схема 15Р 2е)8е)5е)
В ядре атома 16 нейтронов . В атоме 15 электронов, т. к. их число равно числу протонов и порядковому номеру. В атоме фосфора 3 электронных слоя, т. к. Р стоит в 3 периоде. На последнем слое 5 электронов, т. к. фосфор стоит в 5 группе. Последний слой не завершен. Р-неметалл, т. к. в хим. реакции с металлами принимает 3 электрона до завершения слоя. Его оксид Р2О5-кислотный. Он взаимод. с Н2О, основаниями и основными оксидами. Его гидроксид Н3РО4-кислота. Она взаимод. с металлами, стоящими до Н (водорода), с основными оксидами, основаниями.
3. Составьте формулы оксида и гидроксида фосфора, укажите их характер.
Напишите уравнения всех реакций, характерных для этих веществ, в ионной и молекулярной формах.
P2O5 + 3h3O = 2h4PO4
P2O5 + 3h3O = 6H+ +2PO43-
3CaO + P2O5 = Ca3(PO4)2
3Ca(OH)2 + P2O5 = Ca3(PO4)2 + 3h3O.
3Mg + 2h4PO4 = Mg3(PO4)2↓ + 3h3↑
3Mg + 6H++ 2PO43- = Mg3(PO4)2↓ + 3h3↑
2h4PO4+3Na2CO3 = 2Na3PO4 + 3h3O + 3CO2↑
6H++ 3CO3 2-= 3h3O + 3CO2↑
3NaOH + h4PO4 = Na3PO4 + 3h3O
3OH- + 3H+= 3h3O
Курс Подготовка к ЕГЭ по Химии – Онлайн обучение
Наш курс создан для тех, кто собирается сдавать ЕГЭ по химии с нуля до поступления в ВУЗ. И для тех, кто просто хочет улучшить знания и успеваемость по предмету химия в школе или лучше понять какую-то «химическую» тему.
И для тех, кто просто хочет улучшить знания и успеваемость по предмету химия в школе или лучше понять какую-то «химическую» тему.
67 ВИДЕОУРОКОВ — только вся самая нужная информация на ЕГЭ
В уроках представлена теория и задания всем разделам-темам химии, необходимым для сдачи экзамена:
- ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
- ОРГАНИЧЕСКАЯ ХИМИЯ
- МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ
ВИДЕО-РАЗБОР всех типов заданий ЕГЭ
В видео-уроках по каждой теме включен разбор решений всех типов заданий и тестов ЕГЭ по химии:
– Задания ЕГЭ Часть 1 (задания 1-28 ЕГЭ)
– Задания ЕГЭ Часть 2 (задания 29-34 ЕГЭ)
410 ЗАДАНИЙ И ТЕСТОВЫХ ВОПРОСОВ ДЛЯ ПРАКТИКИ – с ответами и решениями
24 КОНТРОЛЬНЫХ И МИНИ-ТЕСТОВ
– с автопроверкой ответов – для закрепления и оценки знаний
67 КОНСПЕКТОВ К УРОКАМ
Конспекты-презентации ко всем темам-урокам, по которым удобно повторять материал
ИНДВИДУАЛЬНАЯ ПОДДЕРЖКА ОТ ПРЕПОДАВАТЕЛЯ
– вы получите ответы от преподавателя на все возникшие вопросы и рекомендации в процессе подготовки к ЕГЭ!
Подробнее смотрите в программе обучения по курсу ЕГЭ по Химии ниже.
При подготовке к экзаменам выпускникам требуется «перелопатить» много материала и занимает это огромное количество времени – формат онлайн курса подготовки к ЕГЭ по химии оптимально подходит для качественной подготовки к экзаменам на высокие баллы.
Мы сделали подготовку к ЕГЭ максимально эффективной и интересной. Изучаете подробные видео-уроки и выполняете практические задания.
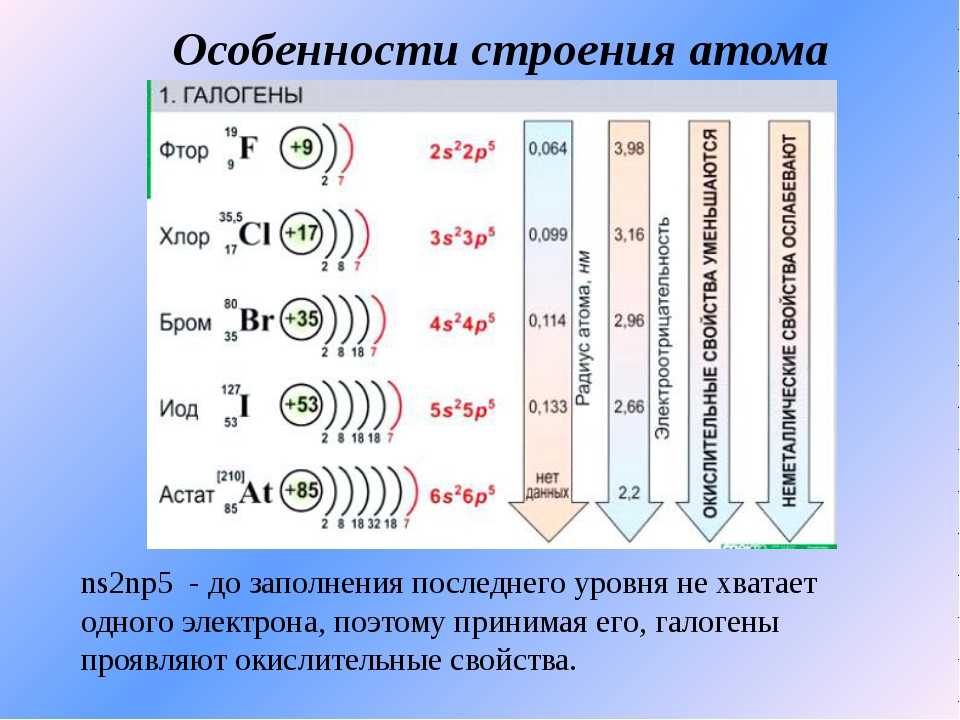
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ. Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов (1)
Закономерности изменения химических свойств элементов и их соединений по периодам и группам. Общая характеристика металлов и неметаллов (2)
Общая характеристика металлов и неметаллов (2)
Гибридизация атомных орбиталей углерода
Программа обучения включает видео уроки подготовки по химии к ЕГЭ, а интерактивные тесты и задания помогут закрепить полученные знания по каждой отдельной теме и эффективно подготовиться к сдаче экзаменов по химии на максимальный балл.
Мы собрали отзывы учеников, прошедших онлайн курс.
Поделись своими впечатлениями после прохождения Курса подготовки к ЕГЭ по химии – напиши отзыв.
Начал изучать химию практически с нуля на этом сайте. Все оформлено очень удобно, особенно в начале, когда нам позволяют решать тесты самим. Начиная с органики отдельные тесты пропадают, но решение заданий появляется непосредственно в видеоуроках. Преподаватель дает информацию достойным языком и сами занятия в принципе не кажутся скучными. Учитывая невысокую цену курса и полученные мною знания, могу с уверенностью рекомендовать данный курс.
Учитывая невысокую цену курса и полученные мною знания, могу с уверенностью рекомендовать данный курс.
ari7my7
Спасибо, очень понравился курс, много нового узнала и разобралась с заданиями!!!
Лена Сарина
Все 11 лет в школе я думала, что химия это непроходимые дебри, но оказалось, что нет, талантливый педагог + упорство в итоге дали мне 73 балла, что для человека который еще в октябре не знал формулу гидрокарбоната натрия довольно хороший результат)) Пересматривала прошедшие занятия, перед экзаменом и восхищалась профессионализмом. Курс просто потрясающий, я ни разу не пожалела о его приобретении. Исчерпывающий материал, хороший микрофон, качество видео, приятный голос и отличная дикция.
Аня Сватухина
Как мне повезло найти такого замечательного педагога! Араксия – потрясающий человек! Очень любит свой предмет и детально в нем разбирается. Очень интересные уроки, подача материала проста, понятна и занимательна. Каждое занятие пролетало мгновенно, на одном дыхании! Мне очень помогли эти занятия повторить весь курс химии за кратчайшие сроки.
Эльнара Уразбахтина
Огромного человеческое спасибо, Араксия, за ваш труд. Вы хороший учитель! Желаю, чтобы ваш курс становился еще популярнее! Начала учить химию в феврале, мой результат – 77 баллов (могло бы быть и больше, но моя невнимательность помешала, всем рекомендую – проверяйте часть a и b внимательно!). Очень удобный формат занятий, когда можно учиться в любое время, конспекты содержат всю необходимую информацию, нужно только учить всё, что дается на уроках. В общем одни плюсы, минусов я не нашла.
Роман Варыпаев
Хочу сказать Вам огромное спасибо!!!! записался на ваш курс по химии не зная химию вообще!! В итоге набрал 83 балла. Вы делаете благое дело! Желаю вам продвижения, море учеников и всего самого-самого наилучшего! СПАСИБО!!!
Злата Балыкова
Замечательный курс подготовки к ЕГЭ по химии. Здесь даётся всё необходимое для сдачи экзамена на отлично. Никакой воды – только важные и глубокие знания! Большую роль в подготовке играет самостоятельная работа, успешное применение даваемых знаний зависит индивидуально от каждого. Спасибо Вам большое, Араксия!
Спасибо Вам большое, Араксия!
Anna Basova
Араксия, я хотела бы сказать вам огромное спасибо! Ваше уникальное мастерство преподавания помогло мне поверить в свои собственные силы, искренне полюбить эту науку – химия. За время подготовки ваш голос стал настолько родным и знакомым)). Сегодня, узнав свой результат ЕГЭ по химии 97 баллов, я без сомнения скажу, что такими высокими баллами я обязана именно вам! Еще раз большое-пребольшое спасибо!!!
Виктор Штельмашенко
Я всерьез начал заниматься в конце марта. Мне посчастливилось найти этот курс подготовки к ЕГЭ по химии. Я классно подготовился и получил массу удовольствия от процесса подготовки! Доступное и понятное объяснение материала небольшими порциями, план занятий на весь курс, тесты, задания – в общем идеальные условия для подготовки, что придает уверенности при сдачи реального экзамена! Главное помнить, что без труда не вытащить и рыбку из пруда. Араксия, спасибо Вам! Вас и ваши уроки я не забуду!
Медь,цинк и их соединения
Дата урока:
Тема урока. Медь, цинк и их важнейшие соединения.
Медь, цинк и их важнейшие соединения.
Цель урока. Сформировать знания учащихся о химических элементах: меди, цинке, об их основных свойствах, об их получении и практическом применении, на основе самостоятельного поиска материала.
Задачи урока:
Образовательные:
1) углубление знаний о положении меди, цинка, в периодической системе химических элементов, о строении их атомов, о физических и химических свойствах металлов, об их получении, о наиболее важных природных соединениях меди, цинка, об их сплавах, об их применении и практической значимости. Рассмотрение биологической роли металлов и их влияние на окружающую среду.
2) повторение характеристик изученных веществ, развитие умений составлять уравнения химических реакций, определять их тип;
Развивающие: развитие речи, внимания, памяти, познавательного интереса, потребности в приобретении и применении знаний.
Воспитательные: воспитание у учащихся культуры речи, поведения, манеры.
Тип урока. Комбинированный
Оборудование урока. Дидактический материал, медные стружки, цинковые гранулы
Виды работы учащихся:
1. Групповая и индивидуальная.
2. Ответы на теоретические вопросы.
3. Написание уравнений реакций
План урока:
Организационный момент
Актуализация знаний учащихся по теме общая характеристика d-элементов
Изучение нового материала
Закрепление знаний
Задание на дом
Ход урока
Урок начинаем с сообщения темы, которую учащиеся записывают в тетради. Уточняем цель урока, представляем, друг другу группы учащихся, которые будут “двигаться” по двум маршрутам.
Приступая к работе, учащиеся записывают в тетради название своего маршрута и каждого этапа следования.
1-ряд учащихся «Группа Cu»
2-ряд учащихся «Группа Zn»
Фронтальный опрос по теме «Общая характеристика d-элементов»
В связи с чем d-элементы так называются? (валентные электроны заполняют d-подуровень)
Почему d-элементы можно назвать переходными элементами? (располагаются между типичными металлами и типичными неметаллами)
Где располагаются d-элементы в ПСХЭ Д.
 И.Менделеева? (во всех побочных подгруппах)
И.Менделеева? (во всех побочных подгруппах)d-элементы по химическим свойствам являются окислителями или восстановителями? (восстановители)
Назовите d-элементы (Cu, Zn, Cr, Fe, Mn и т.д.)
Изучение нового материала
Каждому участнику группы раздаются одинаковые задания, только по своей теме.
Задание 1 участнику (легкий уровень)
Описать элемент по расположению его в ПСХЭ по предложенному плану:
Название элемента и его обозначение
Порядковый номер
Атомная масса
Номер периода
Номер группы и подгруппа
Строение атома элемента (количество протонов, нейтронов, электронов)
Количество энергетических уровней
Электронная формула атома элемента
Описать нахождение элемента в природе
Задание 2 участнику (средний уровень)
Описать физические свойства элемента
Написать химические реакции, лежащие в основе получения элемента
Задание 3 участнику группы (сложный уровень)
Описать химические свойства элемента и его соединений
Составить кластер на применение элементов
Задание 1 (легкий уровень)
Описать элемент по расположению его в ПСХЭ
№
Характеристика
Cu
Zn
1
Название элемента и его обозначение
Медь Cu
Цинк Zn
2
Порядковый номер
29
30
3
Атомная масса
64
65
4
Номер периода
4
4
5
Номер группы и подгруппа
IB
IIB
6
Строение атома элемента (количество протонов, нейтронов, электронов)
6429Cu (29p+35n0)29e–
6530Zn (30p+35n0)30e–
7
Количество энергетических уровней
+29Cu )2 e–)8e–)18e–)1e–
+30Zn )2 e–)8e–)18e–)2e–
8
Электронная формула атома элемента
29Cu 1s22s22p63s23p63d104s1
30Zn 1s22s22p63s23p63d104s2
Нахождение в природе
Медь: в земной коре содержание меди составляет 0,01% по массе. Она встречается в виде самородков, но чаще в виде соединений. В настоящее время известно свыше 170 медьсодержащих минералов, из них только 10-15имеют практическое значение: халькопирит CuFeS2 (30% меди), халькозин – медный блеск Cu2S (79,8% меди), ковеллин CuS (64,4% меди), малахит CuCO3∙Cu(OH)2 (57,4% меди), азурит 2CuCO3∙Cu(OH)2 (55,5% меди), куприт Cu2O (81,8%).
Она встречается в виде самородков, но чаще в виде соединений. В настоящее время известно свыше 170 медьсодержащих минералов, из них только 10-15имеют практическое значение: халькопирит CuFeS2 (30% меди), халькозин – медный блеск Cu2S (79,8% меди), ковеллин CuS (64,4% меди), малахит CuCO3∙Cu(OH)2 (57,4% меди), азурит 2CuCO3∙Cu(OH)2 (55,5% меди), куприт Cu2O (81,8%).
Цинк: по содержанию в земной коре цинк занимает 23-е место среди других элементов, в земной коре содержание его по массе 0,01%. Обычно цинковые руды – полиметаллические. Они содержат также минералы меди, свинца, кадмия и других металлов. Важнейшие минералы: цинковая обманка ZnS, цинкит ZnO, цинковый шпат (галмей) ZnCO3 и др.
Задание 2 (средний уровень)
Описать физические свойства элемента
Медь – блестящий металл светло-розового цвета, тягучий, вязкий, легко прокатывается.
Tплавления= 10830С, ρ=8,9г/см3. Отличный проводник электрического тока (уступает только серебру)
Отличный проводник электрического тока (уступает только серебру)
Цинк – металл синевато-белого цвета с сильным металлическим блеском, металл средней твердости. ρ=7,13 г/см3,цинк легко плавится Tплавления= 419,40С и принадлежит к числу летучих металлов Ткипения=905,70С. Его теплопроводность 60% от теплопроводности серебра, а электрическая проводимость в 4 раза меньше.
Написать химические реакции, лежащие в основе получения элемента
Медь: Из сульфидных руд медь получают пирометаллургическим методом, а из кислородосодержащих – гидрометаллургическим.
2Cu2S + 3O2 = 2Cu2O + 2SO2
2Cu2O + Cu2S = 6Cu + SO2
Цинк: для получения металлического цинка из руд используются пирометаллургические и гидрометаллургические процессы.
2ZnS + 3O2 = 2ZnO + 2 SO2↑
ZnO + C = Zn + CO↑
Задание 3 (сложный уровень)
Описать химические свойства элемента и его соединений
Взаимодействие меди с простыми веществами
Cu + Cl2 = CuCl2
2Cu + O2 = 2CuO
Cu + S = CuS
Взаимодействие со сложными веществами
t
Cu + 2H2SO4(конц.
 ) = CuSO4 + SO2↑ + 2H2O
) = CuSO4 + SO2↑ + 2H2O
t
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
t
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO↑ + 4H2O
2Cu + 4HCl + O2 = 2CuCl2 + 2H2O
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
Химические свойства соединений меди:
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2 = CuO + H2O
CuO + 2HNO3 = Cu(NO3)2 + H2O
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
Взаимодействие цинка с простыми веществами
Zn + Cl2 = ZnCl2
2Zn + O2 = 2ZnO
Zn + S = ZnS
Взаимодействие со сложными веществами
Zn + H2O = ZnO + H2↑
Zn + 2HCl = ZnCl2 + H2↑
t
Zn + 2 NaOH(крист.
 ) = Na2ZnO2 + H2↑
) = Na2ZnO2 + H2↑Zn(OH)2 + 2 NaOH + 2 H2O = Na2[Zn(OH)4] + H2↑
тетрагидроксоцинкат
(II) натрия
Химические свойства соединений цинка
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Zn(OH)2 + 2 NaOH = Na2[Zn(OH)4]
Составить кластер на применение элементов
Применение меди
Применение цинка
Закрепление материала
Каждая группа получает задания для закрепления темы противоположной группы. «Группа Cu» выполняет задания по теме «Цинк и его соединения», а «Группа Zn» выполняет задания по теме «Медь и его соединения»
Задания для закрепления для «Группы Cu»:
Выпишите формулы веществ в состав которых входит цинк:
CrO, ZnS, Na2CrO4, Na2ZnO2, (CuOH)2CO3, ZnCO3, Cu2S, Cr2O3, Cu2O, Cu(NO3)2, Fe(CrO2)2, Cr(OH)2, ZnCl2, CuFeS2, ZnO, H2CrO4, CrO3, Zn(OH)2, Cu(OH)2, CuO.
Задания для закрепления для «Группы Zn»:
Выпишите формулы веществ в состав которых входит медь:
CrO, ZnS, Na2CrO4, Na2ZnO2, (CuOH)2CO3, ZnCO3, Cu2S, Cr2O3, Cu2O, Cu(NO3)2, Fe(CrO2)2, Cr(OH)2, ZnCl2, CuFeS2, ZnO, H2CrO4, CrO3, Zn(OH)2, Cu(OH)2, CuO.
Домашнее задание: §6.2-6.3 упр.5,6 стр.174, упр.5,6 стр.180
Описать биологическое значение этих элементов
Цинк в рационе: Медицинская энциклопедия MedlinePlus
Цинк является важным микроэлементом, который необходим людям для поддержания здоровья. Из микроэлементов этот элемент по концентрации в организме уступает только железу.
Цинк содержится в клетках по всему телу. Он необходим для правильной работы защитной (иммунной) системы организма. Он играет роль в делении клеток, росте клеток, заживлении ран и расщеплении углеводов.
Цинк также необходим для обоняния и вкуса. Во время беременности, младенчества и детства организм нуждается в цинке для правильного роста и развития. Цинк также усиливает действие инсулина.
Информация экспертного обзора пищевых добавок с цинком показала, что:
- При приеме в течение не менее 5 месяцев цинк может снизить риск простуды.
- Начало приема добавок цинка в течение 24 часов после появления симптомов простуды может сократить продолжительность симптомов и сделать их менее серьезными. Тем не менее, в настоящее время не рекомендуется принимать добавки сверх рекомендованной диетической нормы (RDA – см. ниже).
Животные белки являются хорошим источником цинка. Говядина, свинина и баранина содержат больше цинка, чем рыба. Темное мясо курицы содержит больше цинка, чем светлое.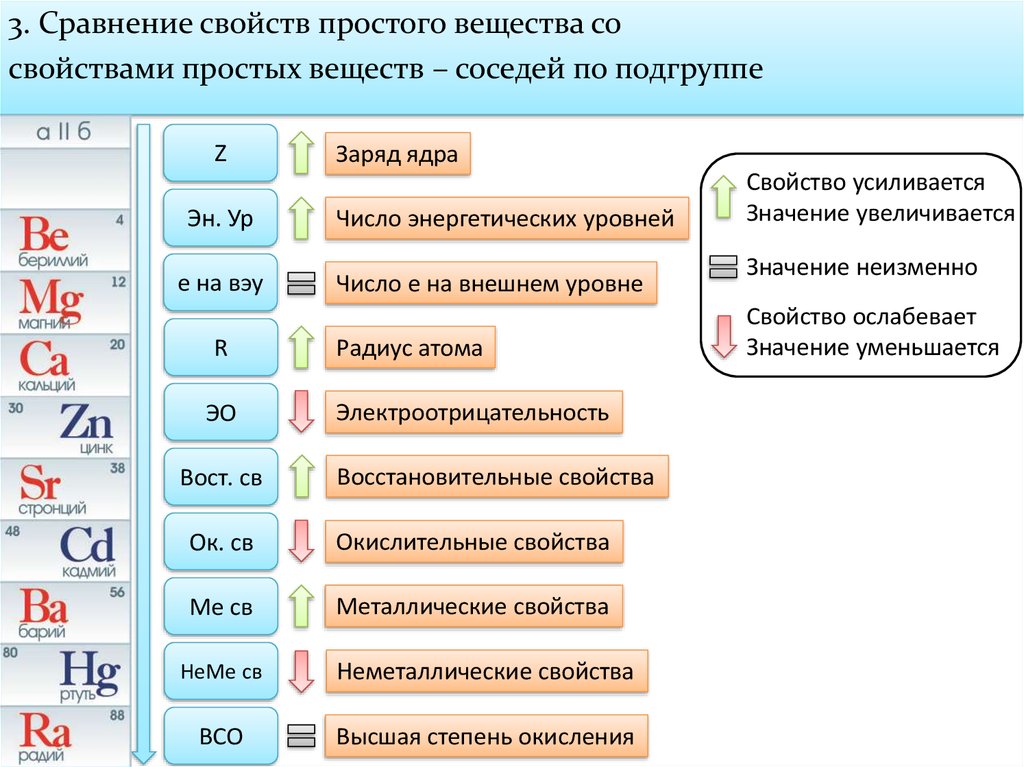
Другими хорошими источниками цинка являются орехи, цельное зерно, бобовые и дрожжи.
Фрукты и овощи не являются хорошими источниками, потому что цинк в растительных продуктах не так доступен для использования организмом, как цинк из животных источников. Поэтому диеты с низким содержанием белка и вегетарианские диеты, как правило, содержат мало цинка.
Цинк входит в состав большинства мультивитаминных и минеральных добавок. Эти добавки могут содержать глюконат цинка, сульфат цинка или ацетат цинка. Неясно, лучше ли одна форма, чем другие.
Цинк также содержится в некоторых безрецептурных лекарствах, таких как леденцы от простуды, назальные спреи и назальные гели.
Симптомы дефицита цинка включают в себя:
- Частые инфекции
- Гипогонадизм у мужчин
- Потеря волос
- Плохой аппетит
- Проблемы с чувством вкуса
- С Злонами
- Sode Sorre
- с ощущением
- Sode Sorre
- .
 рост
рост - Проблемы со зрением в темноте
- Раны, которые долго не заживают
Добавки цинка, принимаемые в больших количествах, могут вызвать диарею, спазмы в животе и рвоту. Эти симптомы чаще всего появляются в течение 3-10 часов после приема добавки. Симптомы исчезают в течение короткого периода времени после прекращения приема добавок. Избыточное потребление цинка может привести к дефициту меди или железа.
Люди, которые используют назальные спреи и гели, содержащие цинк, могут иметь побочные эффекты, такие как потеря обоняния.
ЭТАЛОННЫЕ ВПУСКИ
Дозировки цинка, а также других питательных веществ приведены в Справочных нормах потребления пищи (DRI), разработанных Советом по пищевым продуктам и питанию Национальной академии наук, инженерии и медицины. DRI — это термин для набора эталонных значений потребления, которые используются для планирования и оценки потребления питательных веществ здоровыми людьми. Эти значения, которые различаются в зависимости от возраста и пола, включают:
- Рекомендуемая диетическая норма (RDA) — средний дневной уровень потребления, достаточный для удовлетворения потребностей в питательных веществах почти всех (9от 7% до 98%) здоровых людей.
 RDA — это уровень потребления, основанный на данных научных исследований.
RDA — это уровень потребления, основанный на данных научных исследований. - Адекватное потребление (AI) — этот уровень устанавливается, когда недостаточно данных научных исследований для разработки RDA. Он установлен на уровне, который, как считается, обеспечивает достаточное питание.
Справочная диетическая норма потребления цинка:
Младенцы (AI)
- От 0 до 6 месяцев: 2 мг/день0012
- от 1 до 3 лет: 3 мг/день
- от 4 до 8 лет: 5 мг/день
- от 9 до 13 лет: 8 мг/день
Подростки и взрослые (RDA)
- старше: 11 мг/день
- Женщины в возрасте от 14 до 18 лет: 9 мг/день
- Женщины в возрасте 19 лет и старше: 8 мг/день
- Беременные женщины в возрасте 19 лет и старше: 11 мг/день (от 14 до 18 лет) лет: 12 мг/день)
- Кормящие женщины в возрасте 19 лет и старше: 12 мг/день (от 14 до 18 лет: 13 мг/день)
придерживайтесь сбалансированной диеты, включающей разнообразные продукты.
Маркелл М., Сиддики Х.А. Витамины и микроэлементы. В: Макферсон Р.А., Пинкус М.Р., ред. Клиническая диагностика Генри и лечение с помощью лабораторных методов . 24-е изд. Филадельфия, Пенсильвания: Elsevier; 2022: глава 27.
Мейсон Дж. Б., Бут С. Л. Витамины, микроэлементы и другие микроэлементы. В: Goldman L, Schafer AI, ред. Медицина Гольдмана-Сесиля. 26-е изд. Филадельфия, Пенсильвания: Elsevier; 2020: глава 205.
Раму А., Нейлд П. Диета и питание. В: Naish J, Syndercombe Court D, ред. Медицинские науки . 3-е изд. Филадельфия, Пенсильвания: Elsevier; 2019: глава 16.
Обновлено: Миган Бриджес, доктор медицинских наук, Система здравоохранения Университета Вирджинии, Шарлоттсвилль, Вирджиния. Также рассмотрены Дэвидом Зивом, доктором медицины, MHA, медицинским директором, Брендой Конауэй, редакционным директором, и A.D.A.M. Редакционная коллегия. Редакционное обновление 29.09.2021.
Цинк | The Nutrition Source
The Nutrition Source
Цинк является микроэлементом, а это означает, что организму требуется лишь небольшое его количество, но при этом почти 100 ферментов необходимы для осуществления жизненно важных химических реакций.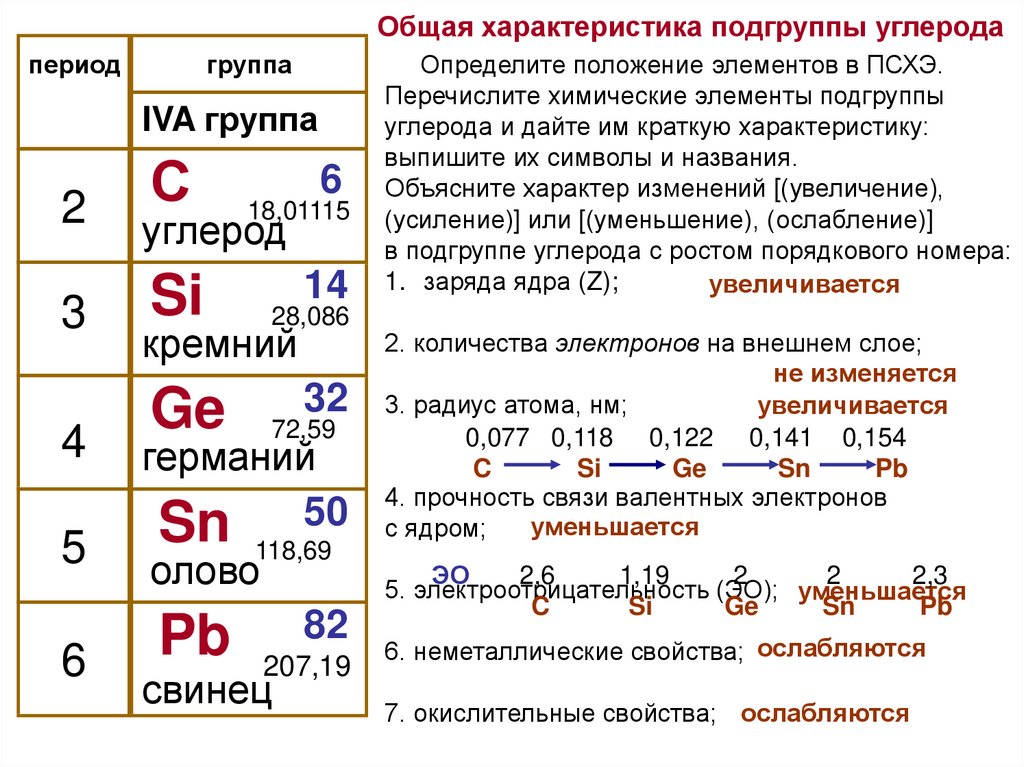 Он играет важную роль в создании ДНК, росте клеток, построении белков, заживлении поврежденных тканей и поддержании здоровой иммунной системы. [1] Поскольку он помогает клеткам расти и размножаться, достаточное количество цинка требуется в периоды быстрого роста, например, в детстве, подростковом возрасте и беременности. Цинк также связан с чувствами вкуса и запаха.
Он играет важную роль в создании ДНК, росте клеток, построении белков, заживлении поврежденных тканей и поддержании здоровой иммунной системы. [1] Поскольку он помогает клеткам расти и размножаться, достаточное количество цинка требуется в периоды быстрого роста, например, в детстве, подростковом возрасте и беременности. Цинк также связан с чувствами вкуса и запаха.
RDA: Рекомендованная норма потребления (RDA) для взрослых старше 19 лет составляет 11 мг в день для мужчин и 8 мг для женщин. При беременности и в период лактации требуется немного больше на 11 мг и 12 мг соответственно.
UL: Верхний допустимый уровень потребления — это максимальное суточное потребление, которое вряд ли окажет вредное воздействие на здоровье. UL для цинка составляет 40 мг в день для всех мужчин и женщин в возрасте 19 лет.+ лет.
Цинк и здоровье Иммунитет Поскольку цинк поддерживает рост и нормальное функционирование иммунных клеток, даже легкий или умеренный дефицит может замедлить активность лимфоцитов, нейтрофилов и макрофагов, которые защищают организм от вирусов и бактерий. Дефицит цинка — распространенная проблема со здоровьем у детей из стран с низким и средним уровнем дохода, которая способствует задержке роста, диарее, пневмонии и малярии. [2] Пожилые люди, у которых может быть низкое потребление цинка из-за плохого аппетита из-за множества заболеваний и приема лекарств, подвержены риску инфекций, таких как пневмония и кожные язвы, как описано в следующем разделе.
Дефицит цинка — распространенная проблема со здоровьем у детей из стран с низким и средним уровнем дохода, которая способствует задержке роста, диарее, пневмонии и малярии. [2] Пожилые люди, у которых может быть низкое потребление цинка из-за плохого аппетита из-за множества заболеваний и приема лекарств, подвержены риску инфекций, таких как пневмония и кожные язвы, как описано в следующем разделе.
Достаточное количество цинка необходимо для создания новых клеток, особенно коллагена и волокнистых тканей, необходимых для восстановления поврежденных клеток. Цинк также поддерживает активность иммунных клеток, которые борются с воспалением от раны. Следовательно, наибольшая польза от цинка оказывается людям с дефицитом этого минерала и тяжелыми ранами, такими как пролежни или обширные ожоги. Поскольку люди с этими состояниями имеют более высокие потребности в цинке и могут иметь плохой аппетит, вместо того, чтобы полагаться только на прием пищи, используются добавки или кремы для местного применения. В этих случаях цинк часто сочетают с другими питательными веществами, такими как белок, витамин С и L-аргинин, которые также способствуют заживлению ран, например, в пищевом коктейле. [3] Тем не менее, у людей с кожными язвами и нормальным уровнем цинка в крови польза от добавок цинка не доказана. [4]
В этих случаях цинк часто сочетают с другими питательными веществами, такими как белок, витамин С и L-аргинин, которые также способствуют заживлению ран, например, в пищевом коктейле. [3] Тем не менее, у людей с кожными язвами и нормальным уровнем цинка в крови польза от добавок цинка не доказана. [4]
Мясо, птица и морепродукты богаты цинком. Некоторые растительные продукты, такие как бобовые и цельнозерновые, также являются хорошими источниками цинка, но они также содержат фитаты, которые могут связываться с минералом, снижая его усвоение.
- Моллюски: устрицы, крабы, омары
- Говядина
- Птица
- Свинина
- Бобовые
- Орехи, семена
- Цельнозерновые
- Обогащенные сухие завтраки
Цинк доступен в форме добавок в виде пилюль и леденцов. Избыток цинка может мешать усвоению железа и меди. Высокие дозы также могут вызывать тошноту и даже рвоту. Поэтому важно не принимать добавки цинка, если не известно, что в рационе мало продуктов, содержащих цинк, или подтвержден дефицит цинка. Зарегистрированный диетолог может помочь оценить диету и определить, является ли потребление цинка низким.
Поэтому важно не принимать добавки цинка, если не известно, что в рационе мало продуктов, содержащих цинк, или подтвержден дефицит цинка. Зарегистрированный диетолог может помочь оценить диету и определить, является ли потребление цинка низким.
Как насчет использования пастилок с цинком при простуде?
В 1990-х новое предложенное средство от простуды в виде пастилок с цинком стало почти таким же популярным, как куриный суп. Форма для рассасывания была важна, потому что цинк должен был медленно растворяться, чтобы покрыть рот и горло, где процветает вирус простуды. Другие формы, такие как назальные спреи и спреи для горла, не использовались из-за того, что у некоторых людей они вызывали потерю обоняния.
Считается, что цинк предотвращает распространение вирусов простуды и уменьшает воспаление, что может сократить продолжительность простуды. Исследования показали неоднозначные результаты их эффективности из-за различий в форме цинка, дозировке и продолжительности его использования. Тем не менее, некоторые клинические испытания подтверждают его эффективность. Кокрановский обзор клинических испытаний показал, что леденцы с цинком не предотвращают простуду, но если принимать их в течение дня после появления симптомов простуды (боль в горле, насморк), леденцы могут укротить ее тяжесть. [5] Однако отмечается, что некоторые испытания финансировались фармацевтическими компаниями, которые могли иметь финансовую заинтересованность в таблетках с цинком или производить их.
Тем не менее, некоторые клинические испытания подтверждают его эффективность. Кокрановский обзор клинических испытаний показал, что леденцы с цинком не предотвращают простуду, но если принимать их в течение дня после появления симптомов простуды (боль в горле, насморк), леденцы могут укротить ее тяжесть. [5] Однако отмечается, что некоторые испытания финансировались фармацевтическими компаниями, которые могли иметь финансовую заинтересованность в таблетках с цинком или производить их.
Цинковые леденцы могут иметь несколько неприятных побочных эффектов, таких как металлический привкус и тошнота, но некоторые люди с радостью променяют эти симптомы на приступ неприятной простуды.
Признаки дефицита и токсичности Дефицит Дефицит цинка встречается редко и чаще всего наблюдается у людей, которые плохо усваивают цинк из-за расстройств пищеварения, таких как воспалительные заболевания кишечника, или перенесших желудочно-кишечные заболевания. операция. В группу риска также входят люди с хроническими заболеваниями печени или почек. Чрезмерная или продолжительная диарея может привести к дефициту цинка, а также к тяжелым состояниям с повышенной потребностью в цинке, таким как ожоги и сепсис (инфекция, вызванная попаданием вредных бактерий в кровь). Цинк более эффективно усваивается при приеме в меньших дозах и у людей с дефицитом этого минерала.
операция. В группу риска также входят люди с хроническими заболеваниями печени или почек. Чрезмерная или продолжительная диарея может привести к дефициту цинка, а также к тяжелым состояниям с повышенной потребностью в цинке, таким как ожоги и сепсис (инфекция, вызванная попаданием вредных бактерий в кровь). Цинк более эффективно усваивается при приеме в меньших дозах и у людей с дефицитом этого минерала.
Другие группы риска дефицита цинка:
- Беременные женщины. Повышенная потребность плода в цинке и в период лактации.
- Низкое содержание цинка в человеческом грудном молоке. Большое количество кальция и фосфора в коровьем молоке может снизить усвоение цинка.
- Вегетарианцы/веганы. Потребление цинка ограничено растительными продуктами, такими как цельные зерна, биодоступность которых ниже, чем в продуктах животного происхождения.
- Снижение всасывания и повышенная потеря цинка с мочой.
Признаки дефицита включают:
- Потеря вкуса или обоняния
- Плохой аппетит
- Подавленное настроение
- Снижение иммунитета
- Замедленное заживление ран
- Диарея
- Выпадение волос
Токсичность возникает почти исключительно из-за добавок цинка, а не пищи. Сообщений о потреблении слишком большого количества цинка только из рациона не поступало. [1]
Сообщений о потреблении слишком большого количества цинка только из рациона не поступало. [1]
Признаки токсичности включают:
- Тошнота, рвота
- Плохой аппетит
- Боль в животе или спазмы
- Головные боли
- Диарея
Оксид цинка использовался в мазях для лечения ран, как отмечено в древнегреческих медицинских текстах. Сегодня оксид цинка по-прежнему является популярным безрецептурным средством для ухода за кожей. Он может защищать от солнечных ожогов, отражая и рассеивая ультрафиолетовые лучи, чтобы они не проникали в кожу. Он также используется для лечения воспаленных состояний кожи, таких как ожоги, экзема, пролежни и опрелости. Соединение образует защитный барьер на поверхности кожи, отталкивая влагу и позволяя коже заживать. Это также может помочь ферментам разрушить поврежденную коллагеновую ткань, чтобы можно было сформировать новую ткань. О негативных побочных эффектах не сообщалось.
- Медицинский институт. Совет по продовольствию и питанию. Справочное потребление витамина А, витамина К, мышьяка, бора, хрома, меди, йода, железа, марганца, молибдена, никеля, кремния, ванадия и цинка: отчет группы по микроэлементам. Вашингтон, округ Колумбия: Издательство Национальной академии; 2001. https://www.ncbi.nlm.nih.gov/books/NBK222317/ По состоянию на 17.10.2019.
- Mayo-Wilson E, Junior JA, Imdad A, Dean S, Chan XH, Chan ES, Jaswal A, Bhutta ZA. Добавки цинка для предотвращения смертности, заболеваемости и задержки роста у детей в возрасте от 6 месяцев до 12 лет. Кокрановская база данных систематических обзоров . 2014(5).
- Ellinger S, Stehle P. Эффективность витаминных добавок в ситуациях с нарушениями заживления ран: результаты клинических интервенционных исследований. Текущее мнение в области клинического питания и метаболической помощи . 2009 1 ноября; 12 (6): 588-95.
- Уилкинсон Э.А. Пероральный цинк при артериальных и венозных язвах нижних конечностей.
 Кокрановская база данных систематических обзоров . 2014(9).
Кокрановская база данных систематических обзоров . 2014(9). - Сингх М., Дас Р.Р. Цинк от простуды. Кокрановская система базы данных, ред. . 2011 г., 16 февраля; (2): CD001364.
Условия использования
Содержание этого веб-сайта предназначено для образовательных целей и не предназначено для предоставления личных медицинских консультаций. Вам следует обратиться за советом к своему врачу или другому квалифицированному поставщику медицинских услуг по любым вопросам, которые могут у вас возникнуть относительно состояния здоровья. Никогда не пренебрегайте профессиональным медицинским советом и не откладывайте его поиск из-за чего-то, что вы прочитали на этом сайте. Источник питания не рекомендует и не поддерживает какие-либо продукты.
Пикантный элемент Цинк | ChemTalk
Знакомство с цинком
Цинк — это элемент, известный науке уже некоторое время и нашедший применение на протяжении всей истории. Сегодня цинк остается важнейшим элементом для функционирования современных технологий и биологии человека.
10 интересных и забавных фактов о цинке
- Латунь — это сплав цинка и меди, который в древние времена был одним из важнейших соединений металлов.
- Цинк используется в различных повседневных продуктах, включая краски, шампуни и дезодоранты.
- Современные ученые используют различные изотопы цинка для изучения пищевых сетей и экосистем, почти как углеродный анализ!
- Пенни США сделаны в основном из цинка, только тонкое внешнее покрытие сделано из меди.
- Цинк — 24 й наиболее распространенный элемент в земной коре, около 0,01%.
- Название цинк происходит от немецкого слова zinke , означающего «зубец» или «зуб».
- Дефицит цинка затрагивает более 2 миллиардов человек во всем мире, что делает его важной частью глобальных целей в области здравоохранения.
- Диэтилцинк был первым известным соединением, содержащим сигма-связь углерод-металл.
- Очистка цинка представляет опасность для окружающей среды, поскольку при этом выделяется диоксид серы.

- Простуда на самом деле лечится добавками цинка.
Цинк в периодической таблице
Цинк, атомный символ Zn, имеет атомный номер 30 и является последним переходным металлом четвертого периода. Он лежит справа от меди и слева от галлия и выше кадмия. Он имеет электронную конфигурацию [Ar]4s 2 3д 10 .
Цинк является одним из немногих переходных металлов, имеющих только одну основную степень окисления: +2. Хотя технически он может формировать состояние +1, эта конфигурация чрезвычайно нестабильна и сложна в обслуживании. С электроотрицательностью 1,65 по шкале Полинга элемент легко связывается с большинством электроотрицательных неметаллов, включая кислород, хлор и азот.
Электронная структура элемента цинка (Источник: Wikimedia Commons)Цинк в электрохимии
В области электрохимии некоторым элементам уделяется большое внимание. Хорошие и электрически активные элементы полезны в конструкции гальванических элементов — цинк идеально подходит для этой цели, потому что он в изобилии и легко окисляется (восстановительный потенциал -0,76 В).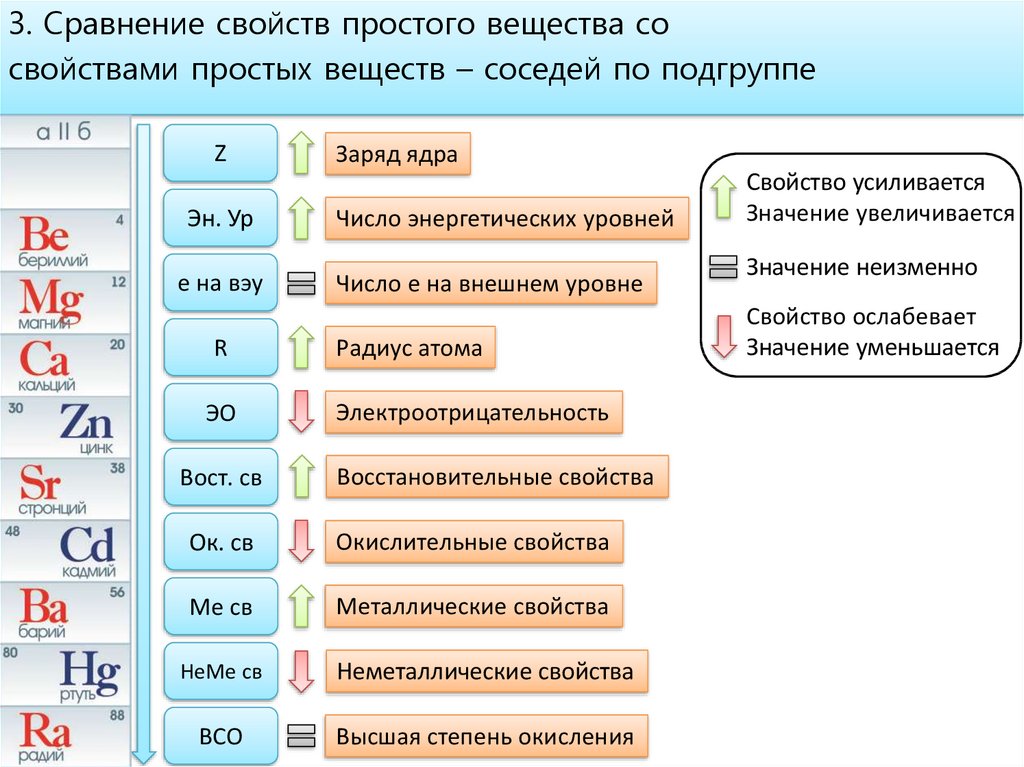 Ячейки Zn / Cu чаще всего встречаются при изучении основной электрохимии. Как и в этом научном контексте, именно электрохимические свойства цинка делают его таким полезным в реальном мире, как мы обсудим позже.
Ячейки Zn / Cu чаще всего встречаются при изучении основной электрохимии. Как и в этом научном контексте, именно электрохимические свойства цинка делают его таким полезным в реальном мире, как мы обсудим позже.
Цинк в организме
Цинк — один из самых важных металлов в организме. Он имеет решающее значение для функционирования около 10% белков в нашем организме, играя роль в передаче сигналов клетками, экспрессии генов и апоптозе (контролируемая гибель клеток). В макромасштабе цинк важен для правильной иммунной функции и пищеварения, а также для роста детей.
Цинк доказал свою эффективность в лечении различных заболеваний. Помимо простуды, цинк помогает набрать вес тем, кто страдает анорексией, а также предотвращает дегенерацию желтого пятна (процесс потери зрения с возрастом). Этот элемент является дешевым и эффективным способом улучшения здоровья, особенно в развивающихся странах, где распространен дефицит.
Применение цинка в современном мире
Защита от непогоды (буквально)
Одной из самых больших угроз общественной инфраструктуре является ржавчина. Из-за солей, воды или старого воздуха открытое железо и сталь со временем разлагаются, в результате чего транспортные сети и большие здания становятся ненадежными. Цинк помогает нам, предотвращая это окисление. В настоящее время цинк в основном применяется в качестве расходуемого анода . Покрытие железа или стали слоем цинка (так называемая гальванизация ) предотвратит окисление (ржавление) металла под ним, потому что цинк более «охотно» окисляется, чем металл, который он покрывает. Большая часть открытого металла, который мы видим изо дня в день, в том числе в заборах, мостах, крышах и кузовах автомобилей, защищена этим тонким слоем металлического цинка.
Из-за солей, воды или старого воздуха открытое железо и сталь со временем разлагаются, в результате чего транспортные сети и большие здания становятся ненадежными. Цинк помогает нам, предотвращая это окисление. В настоящее время цинк в основном применяется в качестве расходуемого анода . Покрытие железа или стали слоем цинка (так называемая гальванизация ) предотвратит окисление (ржавление) металла под ним, потому что цинк более «охотно» окисляется, чем металл, который он покрывает. Большая часть открытого металла, который мы видим изо дня в день, в том числе в заборах, мостах, крышах и кузовах автомобилей, защищена этим тонким слоем металлического цинка.
В дополнение к физическому покрытию металлической поверхности цинк может обеспечивать электрохимическую защиту через провод. Открытые и недоступные металлические поверхности, такие как подземные трубопроводы и корпуса кораблей, часто защищаются цинком, который заменяет электроны, потерянные при окислении. Структурная целостность современного мира не в последнюю очередь благодаря цинку.
Структурная целостность современного мира не в последнюю очередь благодаря цинку.
Аккумулятор энергии
Помимо инфраструктуры, легкость окисления цинка используется в батареях. Поскольку это просто гальванические элементы, характеристики, которые мы видели ранее, делают их идеальными в качестве анода в одноразовых батареях. В качестве восстановителя используется порошок металла — белая паста, которая иногда вытекает из старых аккумуляторов, часто представляет собой смесь этого цинка с графитом и другими электролитами.
Где содержится цинк?
Цинк можно найти по всему миру. Его основная руда, сфалерит (ZnS), встречается довольно часто, часто в смеси с другими серосодержащими рудами. Китай вносит наибольший вклад в производство, за ним следуют австралийские и перуанские горнодобывающие предприятия.
Когда и как был открыт этот элемент?
Цинк был известен на протяжении тысячелетий и широко использовался в древнем мире. Сплавы цинка, особенно латунь (Zn + Cu), использовались различными древними цивилизациями — иудейская латунь была найдена еще в 14 веке до нашей эры.
Цинк был выделен в Индии около 1300 г. н.э. После этого его завезли на Запад, но серьезное научное изучение металла не начиналось еще несколько сотен лет. Швейцарский врач Парацельс был первым жителем Запада, который примерно в 1526 году идентифицировал этот элемент как уникальный металл. Его название происходит от немецкого 9.0101 цинке , или зуб, благодаря игольчатой структуре чистого металла. В последующие столетия различные европейцы внесли свой вклад в изучение этого элемента. Братья Уильям и Джон Чэмпион открыли новые и эффективные способы очистки цинка, которые будут использоваться в течение многих лет.
В конце 18 века Луиджи Гальвани использовал цинк в своих экспериментах, которые проложили путь к современному электричеству. Его друг, Алессандро Вольта, использовал ставшее уже классическим сочетание цинка и меди для создания мощной, но примитивной батареи, которая тогда называлась Вольтова батарея. Названия гальванического элемента и процесса гальванизации отдают дань уважения работе Гальвани. Наследие Вольты продолжается в самой единице электрического потенциала, Вольте.
Наследие Вольты продолжается в самой единице электрического потенциала, Вольте.
Биологическое значение цинка было открыто только в двадцатом веке. В настоящее время он признан ключевым игроком в структуре и функции ферментов.
Химия цинка
Степени окисления
Переходные металлы, находящиеся ближе к концу d-блока, нарушают традиционные правила электронной конфигурации. В своих ионных состояниях эти металлы часто сохраняют свои d-орбитальные электроны в пользу потери своих s-орбитальных электронов. Вот почему медь, серебро и золото имеют степень окисления +1. По той же причине цинк (почти) всегда будет терять свои s-электроны, а не d-электроны, придавая ему степень окисления +2. С химической точки зрения это заставляет его вести себя очень похоже на щелочноземельный элемент, такой как кальций или магний. Электронная конфигурация Zn 9Ион 0304 2+ представляет собой [Ar]3d 10 , то же, что и кальций, если игнорировать электроны d-оболочки.
Хотя технически возможно иметь степень окисления +1, эта форма нестабильна. Подобно ртути, предпочтительным является ионный димер Zn 2 2+ . Без тщательной стабилизации этот ион распадается на Zn 2+ и металлический цинк. Во всех смыслах этот элемент находится только в степени окисления +2.
Химические свойства
Будучи электроположительным металлом, цинк легко окисляется многими элементами. Образцы металла будут быстро покрыты слоем ZnO под воздействием газообразного кислорода в результате реакции 2Zn (т) + O 2 (г) → 2ZnO (т).
Металл может реагировать с водой при высоких температурах с образованием ZnO и газообразного водорода: Zn (т) + H 2 O (г) → ZnO (т) + H 2 (г).
Он также реагирует с серой, образуя зеленое пламя.
При горении цинка появляется зеленое пламяСоединения цинка
Глюконат цинка
Это соединение является основной добавкой цинка, используемой сегодня.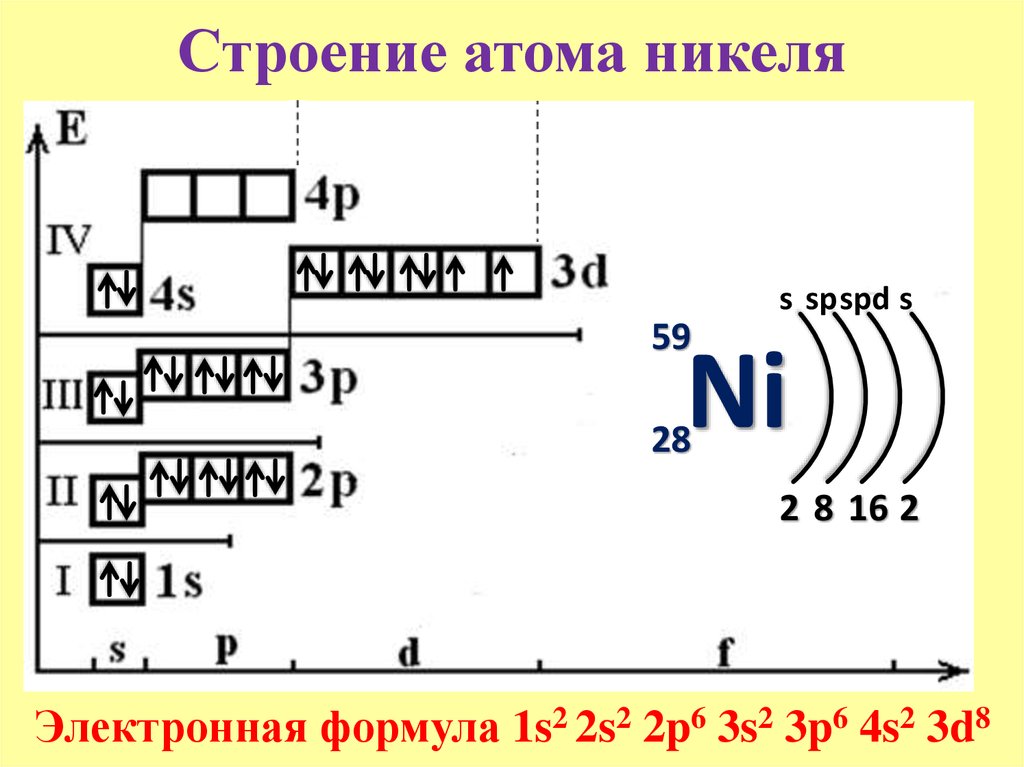 Он поставляет свободный цинк для использования в организме, дешев и прост в производстве.
Он поставляет свободный цинк для использования в организме, дешев и прост в производстве.
Хлорид цинка
ZnCl 2 — очень распространенная и полезная форма этого элемента. Он полезен в качестве флюса и осушителя, хотя есть и более эффективные варианты. Он также используется в органической химии в качестве кислоты Льюиса, являясь обычной альтернативой AlCl 3 в реакции Фриделя-Крафтса.
Гидроксид цинка
Zn(OH) 2 используется в медицине в качестве хирургической повязки для ускорения заживления. Это также побочный продукт обычного процесса, используемого для обнаружения минералов цинка.
Сульфид цинка
ZnS в основном используется для взаимодействия со светом. Большинство светящихся в темноте пигментов представляют собой ZnS со следовыми количествами другого металла. Классический зеленоватый светящийся в темноте цвет исходит от ZnS, легированного медью. Марганец и серебро используются для получения оранжевого и синего цветов соответственно. В дополнение к своим фосфоресцентным свойствам ZnS используется в таких пигментах, как литопон, один из наиболее распространенных белых пигментов. ZnS также является фотокатализатором, что означает, что он может позволить протекать некоторым реакциям в присутствии света, включая образование газообразного водорода из воды.
В дополнение к своим фосфоресцентным свойствам ZnS используется в таких пигментах, как литопон, один из наиболее распространенных белых пигментов. ZnS также является фотокатализатором, что означает, что он может позволить протекать некоторым реакциям в присутствии света, включая образование газообразного водорода из воды.
Оксид цинка
И последнее, но не менее важное: оксид цинка играет ключевую роль в существующих и новых технологиях. Он используется в производстве вулканизированной резины, основного материала. Он также очень полезен благодаря своим свойствам полупроводника. Новые технологии, такие как тонкопленочные транзисторы и спинтроника, а также новые светодиодные и ЖК-дисплеи, зависят от среды ZnO. Кроме того, ZnO перспективен в качестве анода в литий-ионных батареях, поскольку он более эффективен и безвреден для окружающей среды, чем традиционные материалы, такие как кобальт. Оксид цинка также можно использовать в микроволокнах для выработки электричества, открывая путь к электрически автономным наномашинам.
Изоляция цинка
Цинковые руды, такие как сфалерит, добываются по всему миру. После сбора эти материалы тонко измельчаются, а затем разделяются, используя различия в их гидрофобности. После выделения руда (на данном этапе в основном ZnS) обжигается, превращаясь в ZnO. Оттуда он либо восстанавливается до металлического цинка углеродом и монооксидом углерода, либо выделяется электролизом после обработки серной кислотой. Стоит отметить, что на стадии обжига, превращающей ZnS в ZnO, выделяются оксиды серы, наносящие вред окружающей среде. Таким образом, рафинация предлагает некоторые проблемы, поскольку мир движется к более экологичным и более зависимым от цинка методам.
К сожалению, не существует эффективного и практичного способа выделения этого элемента в лабораторных условиях.
Физические свойства
- Символ: ZN
- Печата плавления: 419,5 ° C
- Точка кипячения: 907,0 ° C
- Плотность: 7,14 г/см 3
- ATMIC WASE: 65.



 И.Менделеева? (во всех побочных подгруппах)
И.Менделеева? (во всех побочных подгруппах) ) = CuSO4 + SO2↑ + 2H2O
) = CuSO4 + SO2↑ + 2H2O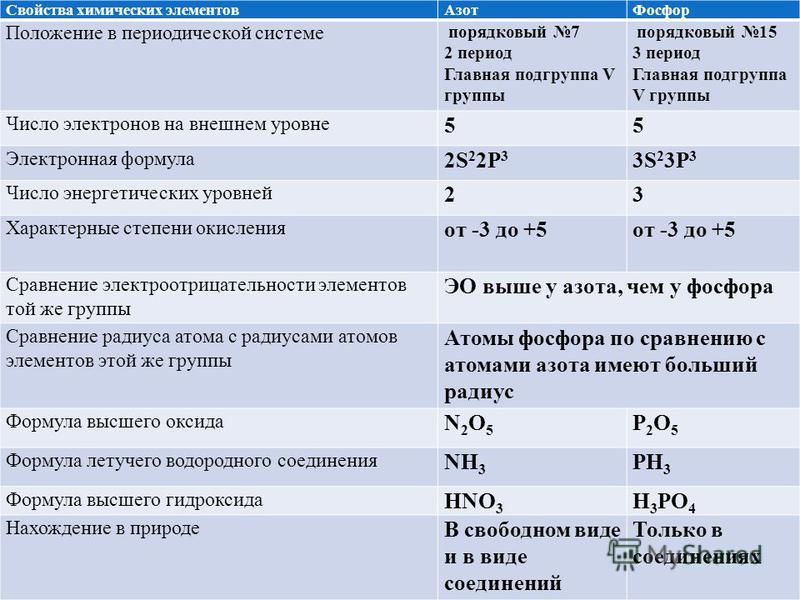 ) = Na2ZnO2 + H2↑
) = Na2ZnO2 + H2↑ рост
рост RDA — это уровень потребления, основанный на данных научных исследований.
RDA — это уровень потребления, основанный на данных научных исследований. Кокрановская база данных систематических обзоров . 2014(9).
Кокрановская база данных систематических обзоров . 2014(9).
