Характеристика химического элемента аргон: Характеристика элемента аргон – ответ на Uchi.ru
alexxlab | 16.03.2023 | 0 | Разное
Общая химия
Общая химия
ОглавлениеВВЕДЕНИЕГлава I. АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ 4. Закон сохранения массы. 5. Основное содержание атомно-молекулярного учения. 6. Простое вещество и химический элемент. 7. Закон постоянства состава. 8. Закон объемных отношений. 9. Атомные и молекулярные массы. Моль. 10. Определение молекулярных масс веществ, находящихся в газообразном состоянии.  11. Парциальное давление газа. 12. Эквивалент. Закон эквивалентов. 13. Определение атомных масс. Валентность. 14. Химическая символика. 15. Важнейшие классы и номенклатура неорганических веществ. 16. Химические расчеты. Глава II ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА 17. Периодический закон Д. И. Менделеева. 18. Периодическая система элементов. 19. Значение периодической системы. Глава III СТРОЕНИЕ АТОМА. РАЗВИТИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА 20. Радиоктивность. 21. Ядерная модель атома. 22. Атомные спектры. 23. Квантовая теория света. 24. Строение электронной оболочки атома по Бору. 25. Исходные представления квантовой механики. 26. Волновая функция. 27. Энергетическое состояние электрона в атоме. 29. Орбитальное квантовое число. Формы электронных облаков. 30. Магнитное и спиновое квантовые числа. 31. Многоэлектронные атомы. 32. Принцип Паули. Электронная структура атомов и периодическая система элементов.  33. Размеры атомов и ионов. 34. Энергия ионизации и сродство к электрону. 35. Строение атомных ядер. Изотопы. 36. Радиоактивные элементы и их распад. 37. Искусственная радиоктивность. Ядерные реакции. Глава IV. ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ 38. Теория химического строения. 39. Ковалентная связь. Метод валентных связей. 40. Неполярная и полярная ковалентная связь. 41. Способы образования ковалентной связи. 42. Направленность ковалентной связи. 43. Гибридизация атомных электронных орбиталей. 44. Многоцентровые связи. 45. Метод молекулярных орбиталей. 46. Ионная связь. 47. Водородная связь. Глава V. СТРОЕНИЕ ТВЕРДОГО ТЕЛА И ЖИДКОСТИ 48. Межмолекулярное взаимодействие. 49. Кристаллическое состояние вещества. 51. Реальные кристаллы. 52. Аморфное состояние вещества. 53. Жидкости. Глава VI. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ 54. Превращения энергии при химических реакциях.  55. Термохимия. 56. Термохимические расчеты. 57. Скорость химической реакции. 59. Зависимость скорости реакции от температуры и от природы реагирующих веществ. 60. Катализ. 61. Скорость реакции в гетерогенных системах. 62. Цепные реакции. 63. Необратимые и обратимые реакции. Химическое равновесие. 64. Смещение химического равновесия. Принцип Ле Шателье. 65. Факторы, определяющие направление протекания химических реакций. 66. Термодинамические величины. Внутренняя энергия и энтальпия. 67. Термодинамические величины. Энтропия и энергия Гиббса. 68. Стандартные термодинамические величины. Химико-термодинамические расчеты. Глава VII. ВОДА, РАСТВОРЫ 69. Вода в природе. 70. Физические свойства воды. 71. Диаграмма состояния воды. 72. Химические свойства воды. 73. Характеристика растворов. Процесс растворения. 74. Способы выражения состава растворов. 75. Гидраты и кристаллогидраты. 76. Растворимость. 77.  Пересыщенные растворы. Пересыщенные растворы.78. Осмос. 79. Давление пара растворов. 80. Замерзание и кипение растворов. Глава VIII. РАСТВОРЫ ЭЛЕКТРОЛИТОВ 81. Особенности растворов солей, кислот и оснований. 82. Теория электролитической диссоциации. 83. Процесс диссоциации. 84. Степень диссоциации. Сила электролитов. 85. Константа диссоциации. 86. Сильные электролиты. 87. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации. 88. Ионно-молекулярные уравнения. 89. Произведение растворимости. 91. Смещение ионных равновесий. 92. Гидролиз солей. Глава IX. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. ОСНОВЫ ЭЛЕКТРОХИМИИ 93. Окисленность элементов. 94. Окислительно-восстановительные реакции. 95. Составление уравнений окислительно-восстановительных реакций. 96. Важнейшие окислители и восстановители. 97. Окислительно-восстановительная двойственность. 98.  Химические источники электрической энергии. Химические источники электрической энергии.99. Электродные потенциалы. 100. Ряд напряжений металлов. 101. Электролиз. 102. Законы электролиза. 103. Электролиз в промышленности. 104. Электрохимическая поляризация. Глава X. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДЫ 105. Дисперсное состояние вещества. 106. Состояние вещества на границе раздела фаз. 107. Коллоиды и коллоидные растворы. 108. Дисперсионный анализ. 109. Сорбция и сорбционные процессы. 110. Ионообменная адсорбция. 111. Хроматография. 112. Электрокинетические явления. 113. Устойчивость и коагуляция дисперсных систем. 114. Структурообразование в дисперсных системах. Глава XI. ВОДОРОД 115. Водород в природе. Получение водорода. 116. Свойства и применение водорода. 117. Пероксид водорода Глава XII. ГАЛОГЕНЫ 118. Галогены в природе. Физические свойства галогенов. 119. Химические свойства галогенов. 120. Получение и применение галогенов. 121.  Соединения галогенов с водородом. Соединения галогенов с водородом.122. Кислородсодержащие соединения галогенов. Глава XIII. ГЛАВНАЯ ПОДГРУППА ШЕСТОЙ ГРУППЫ 123. Кислород в природе. Воздух. 124. Получение и свойства кислорода. 125. Озон. 126. Сера в природе. Получение серы. 127. Свойства и применение серы. 129. Диоксид серы. Сернистая кислота. 130. Триоксид серы. Серная кислота. 131. Получение и применение серной кислоты. 132. Пероксодвусерная кислота. 133. Тиосерная кислота. 134. Соединения серы с галогенами. 135. Селен (Selenium). Теллур (Tellurium). Глава XIV. ГЛАВНАЯ ПОДГРУППА ПЯТОЙ ГРУППЫ 136. Азот в природе. Получение и свойства азота. 137. Аммиак. Соли аммония. 138. Фиксация атмосферного азота. Получение аммиака. 139. Гидразин. Гидроксиламин. Азидоводород. 140. Оксиды азота. 141. Азотистая кислота. 142. Азотная кислота. 143. Промышленное получение азотной кислоты. 144. Круговорот азота в природе. 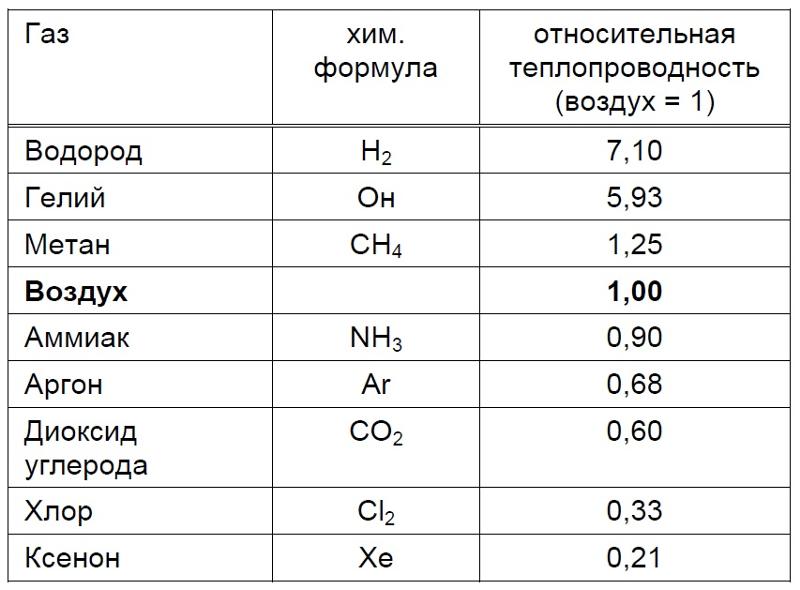 145. Фосфор в природе. Получение и свойства фосфора. 146. Соединения фосфора с водородом и галогенами. 147. Оксиды и кислоты фосфора. 148. Минеральные удобрения. 149. Мышьяк (Arsenicum). 150. Сурьма (Stibium). 151. Висмут (Bismuthum). Глава XV. ГЛАВНАЯ ПОДГРУППА ЧЕТВЕРТОЙ ГРУППЫ 152. Углерод в природе. 153. Аллотропия углерода. 154. Химические свойства углерода. Карбиды. 155. Диоксид углерода. Угольная кислота. 156. Оксид углерода (II). 157. Соединения углерода с серой и азотом. 158. Топливо и его виды. 159. Газообразное топливо. 160. Общая характеристика органических соединений. 161. Отличительные особенности органических соединений. 162. Теория химического строения органических соединений. 163. Классификация органических соединений. 164. Предельные (насыщенные) углеводороды. 165. Непредельные (ненасыщенные) углеводороды. 166. Предельные циклические углеводороды. 167. Ароматические углеводороды.  168. Галогенпроизводные углеводородов. 170. Простые эфиры. 171. Альдегиды и кетоны. 172. Карбоновые кислоты. 173. Сложные эфиры карбоновых кислот. Жиры. 174. Углеводы. 175. Амины. 176. Аминокислоты и белки. 177. Природные и синтетические высокомолекулярные соединения (полимеры). 178. Кремний в природе. Получение и свойства кремния. 179. Соединения кремния с водородом и галогенами. 180. Диоксид кремния. 181. Кремниевые кислоты и их соли. 182. Стекло. 183. Керамика. 184. Цемент. 185. Кремнийорганические соединения. 186. Германий (Germanium). 187. Олово (Stannuin). 188. Свинец (Plumbum). 189. Свинцовый аккумулятор. Глава XVI. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ. СПЛАВЫ 190. Физические и химические свойства металлов. Электронное строение металлов, изоляторов и полупроводников. 191. Кристаллическое строение металлов. 192. Добывание металлов из руд. 193. Получение металлов высокой чистоты.  194. Сплавы. 195. Диаграммы состояния металлических систем. 196. Коррозия металлов. Глава XVII. ПЕРВАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ 197. Щелочные металлы в природе. 198. Натрий (Natrium). 199. Калий (Kalium). ПОДГРУППА МЕДИ 200. Медь. (Cuprum). 201. Серебро (Argentum). 202. Золото (Aurum). Глава XVIII. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ 203. Основные положения координационной теории. 204. Основные типы и номенклатура комплексных соединений. 205. Пространственное строение и изомерия комплексных соединений. 206. Природа химической связи в комплексных соединениях. 207. Диссоциация комплексных соединений в растворах. 208. Влияние координации на свойства лигандов и центрального атома. Глава XIX. ВТОРАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ 209. Бериллий (Beryllium). 210. Магний (Magnesium). 211. Кальций (Calcium). 212. Жесткость природных вод и ее устранение. 214. Цинк (Zincum).  215. Кадмий (Cadmium). 216. Ртуть (Hydrargyrum). Глава XX. ТРЕТЬЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ 217. Бор (Borum). 218. Алюминий (Aluminium). 219. Галлий (Gallium). Иидий (Indium). Таллий (Thallium). ПОБОЧНАЯ ПОДГРУППА ТРЕТЬЕЙ ГРУППЫ. ЛАНТАНОИДЫ. АКТИНОИДЫ 220. Подгруппа скандия. 221. Лантаноиды. 222. Актиноиды. Глава XXI. ПОБОЧНЫЕ ПОДГРУППЫ ЧЕТВЕРТОЙ, ПЯТОЙ, ШЕСТОЙ И СЕДЬМОЙ ГРУПП ПОДГРУППА ТИТАНА 224. Титан (Titanium). 225. Цирконий (Zirconium). Гафний (Hafnium). ПОДГРУППА ВАНАДИЯ 226. Ванадий (Vanadium). 227. Ниобий (Niobium). Тантал (Tantalum). ПОДГРУППА ХРОМА 228. Хром (Chromium). 229. Молибден (Mollbdenium). 230. Вольфрам (Wolfram). ПОДГРУППА МАРГАНЦА 231. Марганец (Manganum). 232. Рений (Rhenium). Глава XXII. ВОСЬМАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ 233. Общая характеристика благородных газов. 234. Гелий (Helium). 235. Неон. Аргон. ПОБОЧНАЯ ПОДГРУППА ВОСЬМОЙ ГРУППЫ 236. 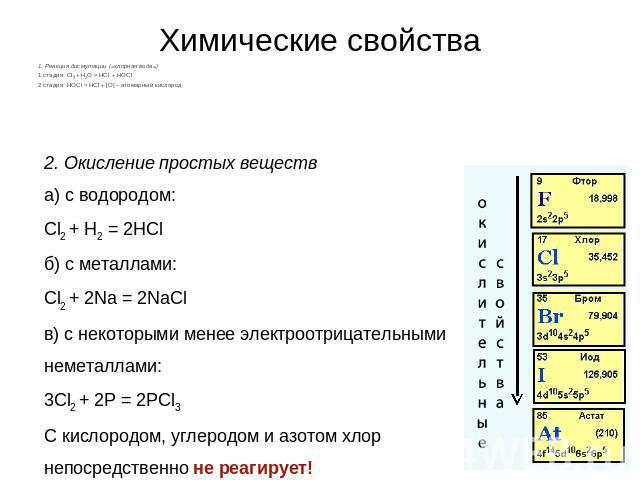 Железо (Ferrum). Железо (Ferrum).237. Значение железа и его сплавов в технике. Развитие металлургии в СССР. 238. Физические свойства железа. Диаграмма состояния системы железо — углерод. 239. Производство чугуна и стали. 240. Термическая обработка стали. 241. Сплавы железа. 242. Химические свойства железа. Соединения железа. 243. Кобальт (Cobaltum). 244. Никель (Niccolum). 245. Общая характеристика платиновых металлов. 246. Платина (Platinum). 247. Палладий (Palladium). Иридий (Iridium). ПРИЛОЖЕНИЕ Некоторые единицы СИ Множители и приставки для образования десятичных кратных и дольных единиц и их наименований Соотношения между некоторыми внесистемными единицами и единицами СИ Литература для углубленного изучения общей и неорганической химии |
Ксенон, Xenon, Xe – Актуальные публикации на сайте компании «НИИ КМ»
Этот газ, названный «чужим», практически перевернул с ног на голову представления химиков об инертных газах. С самого начала он проявил «странные» свойства: в отличие от других инертных газов, ксенон первым вступил в химическую реакцию, первым же образовал устойчивое соединение. И заодно сделал неуместным сам термин «инертные газы». Благодаря вновь открытому веществу ранее созданная «нулевая» группа периодической системы перестала существовать.
С самого начала он проявил «странные» свойства: в отличие от других инертных газов, ксенон первым вступил в химическую реакцию, первым же образовал устойчивое соединение. И заодно сделал неуместным сам термин «инертные газы». Благодаря вновь открытому веществу ранее созданная «нулевая» группа периодической системы перестала существовать.
В поисках «чужого»
После того как были открыты гелий, неон, аргон и криптон, завершающие четыре первых периода таблицы Менделеева, уже не вызывало сомнений, что пятый и шестой периоды тоже должны оканчиваться инертным газом. Но найти их удалось не сразу. Это и неудивительно: в 1 м3 воздуха 9,3 л аргона и всего лишь 0,08 мл ксенона.
Но к тому времени стараниями ученых, прежде всего англичанина Траверса, появилась возможность получать значительные количества жидкого воздуха. Стал доступен даже жидкий водород. Благодаря этому Рамзай совместно с Траверсом смог заняться исследованием наиболее труднолетучей фракции воздуха, получающейся после отгонки гелия, водорода, неона, кислорода, азота и аргона. Остаток содержал сырой (то есть неочищенный) криптон. Однако после откачки его в сосуде неизменно оставался пузырек газа. Этот газ голубовато светился в электрическом разряде и давал своеобразный спектр с линиями в областях от оранжевой до фиолетовой. В поисках нового элемента и для изучения его свойств Рамзай и Траверс переработали около ста тонн жидкого воздуха. Индивидуальность ксенона как нового химического элемента они установили, оперируя всего 0,2 см3 этого газа. Необычайная для того времени тонкость эксперимента!
Остаток содержал сырой (то есть неочищенный) криптон. Однако после откачки его в сосуде неизменно оставался пузырек газа. Этот газ голубовато светился в электрическом разряде и давал своеобразный спектр с линиями в областях от оранжевой до фиолетовой. В поисках нового элемента и для изучения его свойств Рамзай и Траверс переработали около ста тонн жидкого воздуха. Индивидуальность ксенона как нового химического элемента они установили, оперируя всего 0,2 см3 этого газа. Необычайная для того времени тонкость эксперимента!
Характерные спектральные линии — визитная карточка элемента. У Рамзая и Траверса были все основания считать, что открыт новый инертный газ. Его назвали ксеноном, что в переводе с греческого значит «чужой»: в криптоновой фракции воздуха он действительно выглядел чужаком. Любопытно, что с точки зрения химика ксенон на самом деле оказался «чужим» среди инертных газов. Он первым вступил в химическую реакцию, первым образовал устойчивое соединение. И потому сделал неуместным сам термин «инертные газы».
Синтез первых соединений ксенона поставил перед химиками вопрос о месте инертных газов в периодической системе. Прежде благородные газы были выделены в отдельную нулевую группу, что вполне отвечало представлению об их валентности. Но, когда ксенон вступил в химическую реакцию, когда стал известен его высший фторид, в котором валентность ксенона равна восьми (а это вполне согласуется со строением его электронной оболочки), инертные газы решили перенести в VIII группу. Нулевая группа перестала существовать.
Свойства ксенона
Ксенон, как и все инертные газы VIII группы таблицы Менделеева, состоит из одноатомных молекул, не имеет ни запаха, ни цвета, не горит и не поддерживает горение, не взрывоопасен, слабо растворяется в воде и очень быстро выделяется из организма через легкие.
Как инертный газ он благороден, никакой биотрансформации в организме не подвергается, не вступает ни в какие химические реакции. Инертность Хе обусловлена насыщенностью внешней электронной оболочки, электронные конфигурации его предельно замкнуты и максимально прочны. Порядковый номер Хе — 54, молекулярный вес —131,29. Плотность при 0 °С и 1 Ата составляет 5,89 кг/м3, что в 4 раза выше, чем у воздуха и в З,2 раза выше, чем у N2О.
Порядковый номер Хе — 54, молекулярный вес —131,29. Плотность при 0 °С и 1 Ата составляет 5,89 кг/м3, что в 4 раза выше, чем у воздуха и в З,2 раза выше, чем у N2О.
Ксенон в природе
Ксенон находится в земной атмосфере в крайне незначительных количествах, 0.087±0.001 миллионной доли (μL/L), а также встречается в газах, испускаемых некоторыми минеральными источниками. Некоторые радиоактивные виды ксенона, например, 133Xe и 135Xe, получаются как результат нейтронного облучения ядерного топлива в реакторах.
Ксенон относительно редок в атмосфере Солнца, на Земле, в составе астероидов и комет. Концентрация ксенона в атмосфере Марса аналогична земной: 0,08 миллионной доли, хотя содержание 129Xe на Марсе выше, чем на Земле или Солнце. Поскольку данный изотоп образуется в процессе радиоактивного распада, полученные данные могут свидетельствовать о потере Марсом первичной атмосферы, возможно, в течение первых 100 миллионов лет после формирования планеты. У Юпитера, напротив, необычно высокая концентрация ксенона в атмосфере — почти в два раза выше, чем у Солнца.
У Юпитера, напротив, необычно высокая концентрация ксенона в атмосфере — почти в два раза выше, чем у Солнца.
Получение ксенона
Основным источником промышленного производства ксенона является воздух, где в 1000 м3 содержится 86 см3 ксенона. В России и странах СНГ уровень годового промышленного производства чистого ксенона составляет около 1500 м3.
В промышленности ксенон получают как побочный продукт разделения воздуха на кислород и азот. После такого разделения, которое обычно проводится методом ректификации, получившийся жидкий кислород содержит небольшие количества криптона и ксенона. Дальнейшая ректификация обогащает жидкий кислород до содержания 0,1–0,2% криптоноксеноновой смеси, которая отделяется адсорбированием на силикагель или дистилляцией. Как заключение, ксеноно-криптоновый концентрат может быть разделен дистилляцией на криптон и ксенон.
Основными поставщиками сырья (криптон-ксенонового концентрата) являются крупные промышленные центры металлургической промышленности России.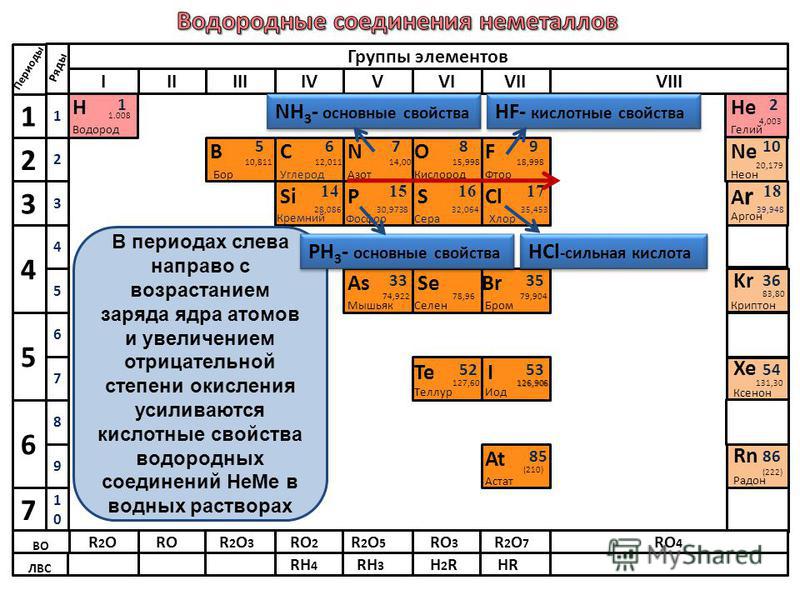 Для получения чистого ксенона используется криптон-ксеноновый концентрат, который подвергается криогенной ректификации на газоразделительных установках, обеспечивающих получение ксенона высокой чистоты (99,999%). Из-за своей малой распространенности ксенон гораздо дороже более легких инертных газов.
Для получения чистого ксенона используется криптон-ксеноновый концентрат, который подвергается криогенной ректификации на газоразделительных установках, обеспечивающих получение ксенона высокой чистоты (99,999%). Из-за своей малой распространенности ксенон гораздо дороже более легких инертных газов.
Ксенон на практике
Несмотря на высокую стоимость, ксенон незаменим в ряде случаев. Ксенон используют для наполнения ламп накаливания, мощных газоразрядных и импульсных источников света (высокая атомная масса газа в колбах ламп препятствует испарению вольфрама с поверхности нити накаливания).
Радиоактивные изотопы (127 Xe, 133Xe, 137Xe и др.) применяют в качестве источников излучения в радиографии и для диагностики в медицине, для обнаружения течи в вакуумных установках. Фториды ксенона используют для пассивации металлов.
Ксенон как в чистом виде, так и с небольшой добавкой паров цезия-133, является высокоэффективным рабочим телом для электрореактивных (главным образом — ионных и плазменных) двигателей космических аппаратов.
С конца XX века ксенон стал применяться как средство для общего наркоза (достаточно дорогой, но абсолютно нетоксичный, точнее — не вызывает химических последствий — как инертный газ). Первые диссертации о технике ксенонового наркоза в России появились в 1993 г. В качестве лечебного наркоза ксенон эффективно применяется для снятия острых абстинентных состояний и лечения наркомании, а также психических и соматических расстройств.
Фториды и оксиды ксенона предложены в качестве мощнейших окислителей ракетного топлива, а также в качестве компонентов газовых смесей для лазеров.
В изотопе ксенон-129 возможно поляризовать значительную часть ядерных спинов для создания состояния с сонаправленными спинами — состояния, называемого гиперполяризацией.
Аргон – Химические элементы
Аргон является третьим по распространенности природным газом в атмосфере Земли. Он не имеет ни цвета, ни запаха, ни вкуса. С химическим символом Ar и атомным номером 18 аргон представляет собой инертный газ, принадлежащий к семейству одноатомных благородных газов в периодической таблице элементов. Этот химический элемент также является первым обнаруженным среди элементов благородных газов.
С химическим символом Ar и атомным номером 18 аргон представляет собой инертный газ, принадлежащий к семейству одноатомных благородных газов в периодической таблице элементов. Этот химический элемент также является первым обнаруженным среди элементов благородных газов.
Блок фактов
Химические и физические свойства аргона
The symbol in the periodic table of elements: Ar
Atomic number: 18
Atomic weight (mass): 39.948 g.mol -1
Group number: 18
Период: 3
Цвет: бесцветный
Физическое состояние: газ без запаха при комнатной температуре
Период полураспада:
Электроотрицательность: неизвестно по Полингу
: 0,192 нм
Ионовый радиус: Неизвестный
Изотопы: 6
Наиболее характерные изотоп: 40AR (с полураспадом
Электронная оболочка: [Ne] 9005
Electronic Shell: [Ne] 9005
. 3р 6
3р 6
Энергия первой ионизации: 1520 кДж.моль -1
Энергия второй ионизации: 2665,8 кДж.моль -1
Энергия третьей ионизации: 3931 кДж.моль -1 1
Дата открытия: В 1894 году сэром Уильямом Рамзи и лордом Рэлеем
Аргон представляет собой инертный газ без запаха, вкуса, цвета и молекулярной плотностью 1,784 грамма на литр. Этот химический элемент с атомной массой 390,948 г.моль -1 достигает точки кипения при -185,7 °С, а его температура плавления составляет -189 °С. Благодаря радиусу Ван-дер-Ваальса 0,192 нм аргон разделяет свойства растворимости кислорода, что делает этот газ более растворимым в воде, чем азот.
При температуре -185,86°C (-302,55°F) этот природный газ, отличающийся своей инертностью, меняет свое агрегатное состояние с газообразного на жидкое. Физические свойства аргона сохраняются в обеих его формах.
Склонность молекулы этого инертного газа притягивать электроны к своей атомной оболочке неизвестна:
Ar + e– → Ar– – ∆H = сродство = — кДж/моль
Теплопроводность аргона составляет 17,72 мВт·м-1K-1 при комнатной температуре. Когда электричество пропускается через аргон под низким давлением, он приобретает бледно-красный цвет. С другой стороны, когда аргон подвергается высокому давлению, высвобождаемый электрический ток имеет стальной синий цвет.
Когда электричество пропускается через аргон под низким давлением, он приобретает бледно-красный цвет. С другой стороны, когда аргон подвергается высокому давлению, высвобождаемый электрический ток имеет стальной синий цвет.
Как был открыт аргон?
История открытия аргона начинается в 1785 году. Это был год, когда английский ученый дворянского происхождения Генри Кавендиш (10 октября 1731 – 24 февраля 1810) начал исследовать атмосферный воздух. Один из его экспериментов с газовыми элементами привел этого великого химика в замешательство. А именно, Генри Кавендиш заметил, что после извлечения кислорода и азота из пробы атмосферного воздуха остается 1/120 остатка азота.
Столетие спустя, в 1892 году, когда шотландский химик сэр Уильям Рамзи работал над научными проектами в лаборатории Университетского колледжа Лондона, его любопытство было вызвано работой британского физика Джона Уильяма Струтта, 3-го барона Рэлея. А именно лорд Рэлей заметил, что плотность азота, выделенного из воздуха, отличается от плотности химического элемента, выделенного из соединений. В этот момент осознания сэр Уильям Рамсей начал прослеживать путь открытия нового химического элемента периодической таблицы, обозначенного как аргон.
В этот момент осознания сэр Уильям Рамсей начал прослеживать путь открытия нового химического элемента периодической таблицы, обозначенного как аргон.
Пытаясь обнаружить аргон в ураносодержащем минерале, сэр Уильям Рамсей обнаружил элемент, который, как считается, существует только на Солнце – гелий (He). Благодаря этому открытию лорд Рэлей и сэр Уильям Рамсей попутно раскрыли целое новое семейство элементов в периодической таблице, семейство элементов, обозначенных как благородные газы.
В 1894 году этим двум химикам из Университетского колледжа Лондона удалось выделить благородный газ из воздуха. Они сделали это, отделив кислород, углекислый газ, воду и азот от воздуха, которым мы дышим. Аргон был побочным продуктом производства азота и кислорода. В первой попытке сэр Уильям Рамсей пошел по стопам Генри Кавендиша, воспроизведя его эксперимент. В отличие от Кавендиша, сэр Рамзи применил спектроскопию в своих научных исследованиях, что привело его к открытию нового природного газа.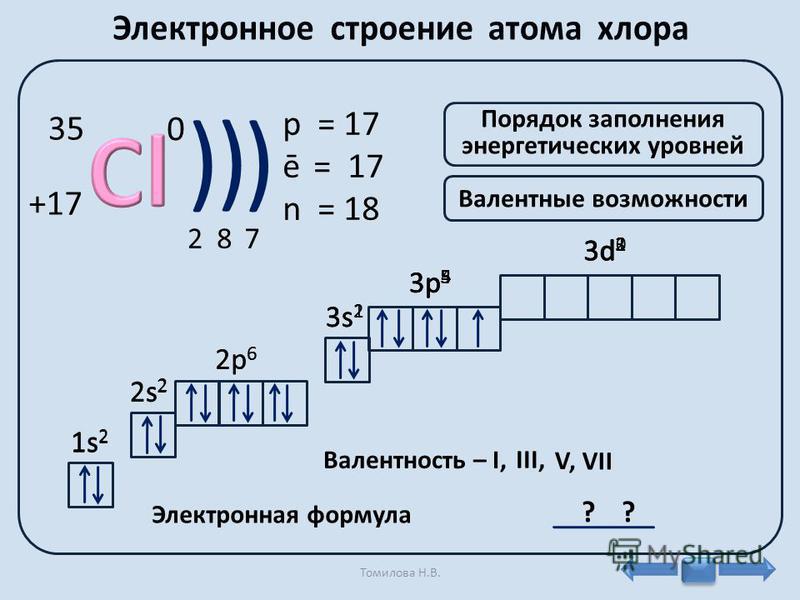
Поскольку сэр Уильям Рамсей и лорд Рэлей открыли новый элемент практически одновременно, они договорились разделить великое достижение и вместе объявили о первом благородном газе и новом элементе периодической таблицы.
Как Аргон получил свое название?
В результате инертности атомов аргона название этого благородного газа произошло от греческого слова «ἀργόν» (аргон), что означает «ленивый».
Где найти аргон?
Около 1% атмосферы нашей планеты Земля состоит из аргона. После кислорода и азота аргон является третьим природным газом, который в изобилии содержится в воздухе. Земная кора, а также воды океана также содержат небольшое количество аргона. В природе большая часть аргона образуется в результате радиоактивного распада, то есть распада радиоактивных изотопов калия-40 (40Ar).
Аргон выделяют методом фракционной перегонки из жидкого воздуха. Тот же метод применяется для производства азота, неона, ксенона, кислорода и криптона в их очищенных формах.
Где используется аргон в повседневной жизни?
Использование аргона в промышленных процессах и производстве
Этот инертный газ используется всякий раз, когда требуется инертная атмосфера. Примерами такого использования могут быть системы пожаротушения, электрические лампочки, графитовые электропечи и производство титана (Ti). Лампы накаливания и люминесцентные лампы содержат аргон как средство для предотвращения кислородной коррозии горячей нити накала.
Кроме того, аргон используется в различных промышленных процессах (например, в металлургии). В частности, этот химический элемент используется в качестве инертного защитного газа при дуговой сварке металлов (нержавеющая сталь, алюминий). Кроме того, для роста кристаллов германия и кремния требуется инертная атмосфера аргона.
Использование аргона в геохронологии
Аргон также применяется в практике датирования истории Земли. Происхождение горных пород, окаменелостей, инертных газов и минералов можно определить с помощью метода, использующего аргон, известного как аргоновая датировка . Аргоновое датирование — это радиометрический метод определения происхождения некоторых структур или образований Земли путем однократного измерения изотопов аргона.
Аргоновое датирование — это радиометрический метод определения происхождения некоторых структур или образований Земли путем однократного измерения изотопов аргона.
Использование аргона в медицине
Жидкий аргон используется в качестве вещества в аргоновых лазерах и в хирургии. Лазер зеленой волны использует это газообразное вещество в жидкой форме в качестве активной среды, в основном используемой в офтальмологии.
Насколько опасен аргон?
Несмотря на то, что аргон как газ не токсичен, плотность этого газообразного вещества может привести к удушью при вдыхании. Симптомы поглощения более высоких количеств аргона при вдыхании варьируются от потери сознания, головокружения и тошноты до фатальных последствий.
Воздействие аргона на окружающую среду
Поскольку аргон является газом, естественным образом присутствующим в атмосфере, он не представляет никакой экологической угрозы для окружающей среды.
Изотопы аргона
Этот химический элемент с атомной массой 39,948 г. моль -1 имеет 26 изотопов (29Ar-54Ar), три из которых являются природными изотопами: 36Ar, 38Ar, 40Ar. Есть только один известный изомер — 32mAr. Период полураспада 269 лет делает 39Ar самым долгоживущим радиоактивным изотопом аргона. В отличие от периода полураспада вышеупомянутого изотопа, некоторые изотопы аргона имеют период полураспада всего несколько минут.
моль -1 имеет 26 изотопов (29Ar-54Ar), три из которых являются природными изотопами: 36Ar, 38Ar, 40Ar. Есть только один известный изомер — 32mAr. Период полураспада 269 лет делает 39Ar самым долгоживущим радиоактивным изотопом аргона. В отличие от периода полураспада вышеупомянутого изотопа, некоторые изотопы аргона имеют период полураспада всего несколько минут.
Источник: Википедия | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
Химические соединения аргона
Соединения аргона встречаются редко из-за инертности его атомов. Некоторые из наиболее важных соединений аргона включают фторгидрид аргона (HArF) и водный аргон. Также молекулы, связывающие аргон, могут появляться в виде двухатомных, трехатомных и многоатомных молекул Ван-дер-Ваальса.
Некоторые из наиболее важных соединений аргона включают фторгидрид аргона (HArF) и водный аргон. Также молекулы, связывающие аргон, могут появляться в виде двухатомных, трехатомных и многоатомных молекул Ван-дер-Ваальса.
5 Интересные факты и пояснения Xe), радон (Rn) и оганесон (Og). Среди них только радон (Rn) обладает радиоактивными свойствами. Термин « лондонские дисперсионные силы » относится к типу молекулярной силы, возникающей между молекулами и атомами. Это молекулярное действие было открыто немецким химиком Фрицем Лондоном, в честь которого эта химическая активность и получила свое название. Теплоизоляционные свойства аргона делают этот химический элемент пригодным для надувания гидрокостюмов подводного плавания благодаря его низкой теплопроводности. Роскошные автомобили имеют шины с аргоновой изоляцией, что придает дополнительную изюминку демонстрации богатства. В 1904 году сэр Уильям Рамзи (1852–1916) получил Нобелевскую премию по химии за открытие благородных газов.

Химические свойства и физические свойства элемента Аргон
| Символ Аргона: | Ар |
| Имя: | Аргон |
| Атомный номер аргона: | 18 |
| Группа Аргона: | Благородный газ |
| Кристаллическая структура аргона: | Кубический: по центру грани |
| Атомный вес аргона: | 39,948 |
| Снаряды аргона: | 2,8,8 |
| Орбиты Аргона: | [Не] 3с2 3п6 |
| Валентность аргона: | 0 |
| Температура плавления аргона: | 83,77 |
| Температура кипения аргона: | 87,28 |
| Электроотрицательность аргона: | 0 |
| Ковалентный радиус аргона: | 0,98 Å |
| Ионный радиус аргона: | — |
| Атомный радиус аргона: | 0,88 Å |
| Атомный объем аргона: | 23,9 см³/моль |
| Имя Происхождение аргона: | Греческий: аргос (неактивный). |
| Обнаружен Аргон Автор: | Сэр Уильям Рэмси, барон Рэлей |
| Год: | 1894 |
| Местонахождение: | Шотландия |
| Произносится как Аргон: | АР-гон |
| Степени окисления аргона: | 0 |
| Плотность аргона: | 0,0017824 г/см³ |
| Использование аргона: | Используется в светотехнической продукции. Его часто используют для наполнения ламп накаливания. Некоторые смешиваются с криптоном в люминесцентных лампах. Кристаллы в полупроводниковой промышленности выращивают в атмосфере аргона. |
| Описание аргона: | Мягкий восковой металл серебристо-белого цвета. Восьмой по распространенности элемент в земной коре (20,900 частей на миллион). Встречается только в соединениях. |
Аргон | Подкаст | Мир химии
Крис Смит
Привет, на этой неделе элемент настолько ленивый, что ученые одно время думали, что он ни с чем не будет реагировать, но в химическом мире лень может иметь свои преимущества, особенно если это супертихие автомобильные шины. или безопасное химическое вещество, с помощью которого можно накачать гидрокостюм, который вам нужен.
или безопасное химическое вещество, с помощью которого можно накачать гидрокостюм, который вам нужен.
Это Джон Эмсли.
Джон Эмсли
Ленивый, трудолюбивый, бесцветный, красочный – это аргон!
Название аргона происходит от греческого слова argos , означающего ленивый, и более ста лет после его открытия химики не могли заставить его сочетаться с какими-либо другими элементами. Но в 2000 году химики Хельсинкского университета во главе с Маркку Рясаненом объявили о первом в истории соединении: фторгидриде аргона. Они сделали его путем конденсации смеси аргона и фтористого водорода с йодидом цезия при температуре -265°C и воздействия на нее ультрафиолетового излучения. При нагревании выше -246°C он вновь превращается в аргон и фтористый водород. И ни один другой процесс никогда не вызывал реакцию аргона — поистине ленивого элемента.
В атмосфере Земли циркулирует 50 триллионов тонн аргона, и он медленно накапливался в течение миллиардов лет, почти весь из-за распада радиоактивного изотопа калия-40, период полураспада которого составляет 12,7. миллиард лет. Хотя аргон составляет 0,93% атмосферы, он не был открыт до 1894 года, когда физик лорд Рэлей и химик Уильям Рамсей идентифицировали его. В 1904 году Рэлей получил Нобелевскую премию по физике, а Рамзи получил Нобелевскую премию по химии за свою работу.
миллиард лет. Хотя аргон составляет 0,93% атмосферы, он не был открыт до 1894 года, когда физик лорд Рэлей и химик Уильям Рамсей идентифицировали его. В 1904 году Рэлей получил Нобелевскую премию по физике, а Рамзи получил Нобелевскую премию по химии за свою работу.
- Предыдущий
- Следующий
Джон Уильям Стратт, 3-й барон Рэлея, британский физик
Генри Кавендиш, химик. 1731-1810
Источник: Wellcome Collection / CC-BY 4.0
Карикатура Уильяма Рамзи в приложении Vanity Fair
Источник: © Royal Society of Chemistry Рэлей обнаружил, что азот, извлеченный из воздуха, имеет более высокую плотность, чем азот, полученный при разложении аммиака. Разница была небольшая, но реальная. Рамзи написал Рэлею, предлагая ему искать более тяжелый газ в азоте, полученном из воздуха, а Рэлею следует искать более легкий газ в азоте, полученном из аммиака. Рамзи удалил весь азот из своего образца, многократно пропуская его над нагретым магнием, с которым азот реагирует с образованием нитрида магния. У него остался один процент, который не реагировал, и обнаружил, что он плотнее азота. Его атомный спектр показал новые красные и зеленые линии, подтверждающие, что это новый элемент. Хотя на самом деле в нем были следы и других благородных газов.
У него остался один процент, который не реагировал, и обнаружил, что он плотнее азота. Его атомный спектр показал новые красные и зеленые линии, подтверждающие, что это новый элемент. Хотя на самом деле в нем были следы и других благородных газов.
Аргон был впервые выделен Генри Кавендишем в 1785 году в Клэпеме, Южный Лондон. Он пропускал через воздух электрические искры и поглощал образовавшиеся газы, но был озадачен тем, что остался нереакционноспособный 1%. Он не понял, что наткнулся на новый газообразный элемент.
Источник: © Shutterstock
При сварке алюминия требуется поток аргона
Большая часть аргона идет на изготовление стали, где он вместе с кислородом продувается через расплавленное железо. Аргон перемешивает, а кислород удаляет углерод в виде углекислого газа. Он также используется, когда необходимо исключить доступ воздуха для предотвращения окисления горячих металлов, например, при сварке алюминия и производстве титана для исключения доступа воздуха. Сварка алюминия производится электрической дугой, для чего требуется поток аргона 10-20 литров в минуту. Топливные элементы атомной энергии защищаются аргоновой атмосферой при рафинировании и переработке.
Сварка алюминия производится электрической дугой, для чего требуется поток аргона 10-20 литров в минуту. Топливные элементы атомной энергии защищаются аргоновой атмосферой при рафинировании и переработке.
Сверхтонкие металлические порошки, необходимые для изготовления сплавов, получают путем направления струи жидкого аргона на струю расплавленного металла.
Источник: © Andy Brunning/Royal Society of Chemistry, 2019 г. от выхода в окружающую среду, вентилируя их через аргоновую плазменную горелку. При этом атомы аргона электрически заряжаются до температуры 10 000°C, а проходящие через него частицы токсичной пыли превращаются в каплю расплавленного лома.
В качестве химически ленивого газа аргон оказался чрезвычайно пригодным для использования. Знаки с подсветкой светятся синим, если они содержат аргон, и ярко-синим, если присутствует небольшое количество паров ртути. Двойное остекление еще более эффективно, если зазор между двумя стеклами заполнен аргоном, а не только воздухом, потому что аргон является худшим проводником тепла. Теплопроводность аргона при комнатной температуре (300 К) составляет 17,72 мВт м -1 К -1 (милливатт на метр на градус), тогда как для воздуха она составляет 26 мВт м -1 К -1 . По той же причине аргон используется для надувания гидрокостюмов. Старые документы и другие вещи, подверженные окислению, можно защитить, храня их в атмосфере аргона. Синие аргоновые лазеры используются в хирургии для сваривания артерий, разрушения опухолей и исправления дефектов глаз.
Теплопроводность аргона при комнатной температуре (300 К) составляет 17,72 мВт м -1 К -1 (милливатт на метр на градус), тогда как для воздуха она составляет 26 мВт м -1 К -1 . По той же причине аргон используется для надувания гидрокостюмов. Старые документы и другие вещи, подверженные окислению, можно защитить, храня их в атмосфере аргона. Синие аргоновые лазеры используются в хирургии для сваривания артерий, разрушения опухолей и исправления дефектов глаз.
Источник: © Shutterstock
Самое экзотическое применение аргона — в шинах роскошных автомобилей. Он не только защищает резину от воздействия кислорода, но и обеспечивает меньший шум шин при движении автомобиля на высокой скорости. В случае с этим элементом лень может оказаться полезной. Его высокотехнологичные применения варьируются от двойного остекления и лазерной хирургии глаза до нанесения вашего имени в свет.
Крис Смит
Джон Эмсли раскрывает секреты благородного газа аргона тяжелее воздуха.

