Характеристика меди по химии: Медь – свойства, применение, характеристики медных сплавов
alexxlab | 12.12.1985 | 0 | Разное
Медь – свойства, применение, характеристики медных сплавов
Медь – это пластичный металл с золотисто-розовым оттенком, занимает 29 место в периодической таблице химических элементов Д. И. Менделеева и обозначается как Cu (Cuprum). Латинское название меди пошло от острова Кипр, где в древности находились крупнейшие медные рудники.
История меди
Человечество начало добывать медь несколько тысячелетий назад. Самые древние изделия, найденные из этого металла, датируются 7-6 веками до нашей эры. Среди них – украшения, инструменты, посуда и орудия труда.
Большим шагом вперед в развитии металлургии было открытие сплава меди с оловом – бронзы. Этот материал отличался повышенной прочностью и способностью к ковке, благодаря чему все изделия из данного медного сплава получались более качественными.
На территории нашей страны медь издавна добывают на Урале, Алтае и в Сибири. Из нее отлиты известнейшие культурные памятники: Царь-пушка, Царь-колокол, Медный всадник.
Физические характеристики
Характерный цвет медь приобретает в результате взаимодействия с кислородом и образования тонкой оксидной пленки. Более тонкие пластины на просвет выглядят зеленовато-голубыми. Наиболее ярко выраженные физические свойства меди:
- высокая электро- и теплопроводность (уступает только серебру),
- мягкость,
- пластичность,
- легко поддается вытягиванию и обработке,
- коррозионная стойкость.
Из прочих характеристик меди стоит отметить хорошую невосприимчивость к внешним природным факторам (температура, ультрафиолет, химическое воздействие) и приятный внешний вид (возможность патирования). В случаях, когда необходимо использовать более твердый материал, в ход идут латунь и бронза – сплавы меди с цинком и оловом соответственно. Медная продукция обладают высокой плотностью, может прокатываться в проволоку, пруток или лист любой толщины.
Химические свойства
В условия низкой влажности медь почти не демонстрирует каких-либо особенных химических свойств.
Металл вступает в активную реакцию с неметаллами галогеновой группы, селеном и серой. В паре с последней, к примеру, он воспламеняется. Медь с валентностью I и II участвует в создании комплексных соединений (двойных солей и аммиачных смесей), обладающих высокой стойкостью и применяемых во многих промышленных сферах.
Методы добычи
Медь добывают открытым и закрытым способом. Первый актуален, если руда находится в толще до 500 метров. Для более глубоких залежей строят специальные подземные шахты. Чистую медь получают в основном пирометаллургическим способом, реже – гидрометаллургическим.
Пирометаллургическая методика условно подразделяется на два этапа, и в качестве исходного сырья использует халькопирит (медный купорос). Первая стадия – флотация или окислительный обжиг.
Химические формулы процесса:
- ZnS + 1.5O2 = ZnO + SO2 + Q – реакция протекает при температуре, превышающей +800 градусов;
- ZnS + 2O2 = ZnSO2 + Q – оптимальная температура варьируется в пределах +600/+700 градусов.
После этого, обогащённая руда плавится в шахтных печах при температуре + 14 500 градусов, преобразуясь в сплав, состоящий из сульфидов железа и меди (штейн). Чтобы повысить качество, проводится конвертерный обдув без подачи топлива. Содержание меди в таком сплаве составляет примерно 91%. Вторая стадия – рафинирование, после чего медная составляющая увеличивается до 99.9%.
Гидрометаллургический способ основывается на выщелачивании. Для этого руду дробят на небольшие куски, и заливают растворителями:
- Nh5OH;
- h3SO4;
- Fe (SO4).

В результате получается раствор, в котором выделяется медь и другие металлы. Формулы процесса:
- CuO+h3SO4>CuSO4+h3O – выщелачивание серной кислотой;
- CuSO4+2Fe2SO4>4FeSO4+2CuSO+S – применение сульфата железа;
- Cu2S + 2 Fe2 (SО4)3>2 СuSO4 + 4 FeSO4 + S – выщелачивание сернокислым железом.
Полученный раствор проходит последующую обработку для извлечения металла. Например, может использоваться методика цементации: CuSО4 + Fe>FeSО4 + Cu. Здесь в состав добавляются куски железа, заменяющие медную составляющую в сернокислых солях.
Область применения
Медная плита находит широкое применение в строительстве, автомобильной, корабельной и железнодорожной промышленности.
Медный лист применяется при возведении кровель, фасадов, заборов и ограждений. А из-за бактерицидности металлической поверхности изделий из меди делают предметы для использования в больницах: двери, ручки, поручни, перила и даже посуду.
Медная труба предназначена для транспортировки жидких и воздушных сред в системах водо- и газоснабжения, отопления, кондиционирования, а также в теплообменниках и холодильных установках. Помимо бытовых инженерных коммуникаций, такие трубы применяются в судостроении и энергетике.
Помимо бытовых инженерных коммуникаций, такие трубы применяются в судостроении и энергетике.
Медная проволока идет на производство кабельной продукции и проводов с невысоким сопротивлением и особенными магнитными свойствами.
Медная лента используется в приборостроении, электротехнике и радиоэлектронике, при изготовлении проводников, обмотков, силовых трансформаторов.
Медный пруток также нередко применяется в строительной и промышленной отрасли. Из него могут готовить подшипники, стеклоподъемники, водозапорную арматуру, декоративные конструкции в архитектуре и интерьере зданий.
Особенности популярных медных сплавов
Сплав М1 изготавливается в соответствии с ГОСТ 859-2014, является высокопластичным и хорошо обрабатываемым металлом, отличается наибольшим содержанием меди (99,9%). В качестве дополнительных элементов встречаются цинк, никель, фосфор, железо, мышьяк, кислород, олово, висмут (суммарно не более 0,1%). Удельное электрическое сопротивление составляет 0,018 мкОм. Сплав может быть двух типов – твердый (М1т) и мягкий (М1м), они различаются по пределам прочности и текучести. Металлопрокат востребован в автомобиле- и авиастроении, при создании проводников тока, криогенной техники, проволоки и прутков.
Сплав может быть двух типов – твердый (М1т) и мягкий (М1м), они различаются по пределам прочности и текучести. Металлопрокат востребован в автомобиле- и авиастроении, при создании проводников тока, криогенной техники, проволоки и прутков.
Сплав М2 имеет меньший коэффициент меди в составе (99,7%). Остальные 0,3% приходятся на никель, железо, сурьму, кислород, олово, свинец, серу, мышьяк. Данная марка пластична и не поддается ржавлению, превосходно обрабатывается под давлением и применяется для изготовления сплавов на медной основе и деталей холодильной техники.
Сплав М3 – это медь техническая, она включает наименьший процент металла среди представленных (99,5%). В качестве легирующих компонентов используются те же элементы, что и в М2, только в большей пропорции (до 0,5%), что делает этот сплав самым доступным по стоимости. Оптимально подходит для металлических изделий, которые реализуются прокатным способом, а также литейных сплавов.
Биологическая ценность для человека
Медь относится к категории жизненно-необходимых элементов, и в организме взрослого человека, содержится около 100 граммов этого металла.
Бактерицидность меди известна давно, а последние исследования в этой области подтвердили эффективность металла в профилактике свиного гриппа, поражения золотистым стафилококком. В экспериментах было установлено, что на медной поверхности погибает 99% болезнетворных бактерий в течение 2-х часов. Поэтому медь и её сплавы широко применяется для обеззараживания воды. В Европе из этого металла изготавливаются дверные ручки, замки, петли и перила, которые устанавливаются в медучреждениях и местах общего пользования.
Характеристики меди, реакция металла с азотной кислотой
It looks like you are visiting our site from Germany. Please switch to our regional site for more relevant pricing, product details, and special offers.
Please switch to our regional site for more relevant pricing, product details, and special offers.
Choose another country
Устойчивый металл Vs. сильный окислитель
Твитнуть
Отправить
[Deposit Photos]Медь — старейший металл, используемый людьми с давних времен. Медь имеет латинское название — cuprum. Ее порядковый номер — 29. В периодической системе Менделеева медь расположена в четвертом периоде, в первой группе.
Физические и химические свойства меди
Медь — это тяжелый металл розово-красного цвета с ковкой и мягкой структурой. Температура кипения меди — более 1000 °С. Сuprum — хороший электро- и теплопроводник, плавится при 1084 °С, плотность металла — 8,9 г/см³, в природе встречается в самородном виде.
Атом меди имеет 4 уровня. На валентной 4s-орбитали расположен один электрон. Во время химического взаимодействия с другими веществами от атома отщепляется 1—3 отрицательно заряженные частицы, в результате чего образуются соединения меди со степенью окисления «+3», «+2», «+1». Максимальной устойчивостью обладают двухвалентные производные меди.
На валентной 4s-орбитали расположен один электрон. Во время химического взаимодействия с другими веществами от атома отщепляется 1—3 отрицательно заряженные частицы, в результате чего образуются соединения меди со степенью окисления «+3», «+2», «+1». Максимальной устойчивостью обладают двухвалентные производные меди.
Медь обладает низкой реакционной способностью. Существует две основные степени окисления металла, проявляющиеся в соединениях: «+1» и «+2». Вещества, в которых данные значения заменяются на «+3», встречаются редко. Медь взаимодействует с углекислым газом, воздухом, соляной кислотой и другими соединениями при очень высоких температурах. На поверхности металла образуется защитная оксидная пленка, которая предохраняет медь от дальнейшего окисления и делает металл стабильным и малоактивным.
Медь взаимодействует с простыми веществами: галогенами, селеном, серой. Металл способен формировать двойные соли или комплексные соединения. Почти все сложные соединения этого химического элемента (кроме оксидов) — это ядовитые вещества. Вещества, которые образовала одновалентная медь, легко окисляются до двухвалентных аналогов.
Металл способен формировать двойные соли или комплексные соединения. Почти все сложные соединения этого химического элемента (кроме оксидов) — это ядовитые вещества. Вещества, которые образовала одновалентная медь, легко окисляются до двухвалентных аналогов.
В химических реакциях медь выступает в качестве малоактивного металла. Металл не растворяется в воде в обычных условиях. В сухом воздухе не протекает коррозия металла, но при нагревании медь покрывается черным оксидным налетом. Химическая устойчивость элемента проявляется при действии углерода, безводных газов, нескольких органических соединений, спиртов и фенольных смол. Для меди характерны реакции комплексообразования, в результате которых выделяются окрашенные соединения. Медь имеет сходства с металлами щелочной группы, связанные с формированием производных одновалентного ряда.
Взаимодействие с азотной кислотой
Медь растворяется в азотной кислоте. Эта реакция осуществляется из-за окисления металла сильным реагентом. Азотная кислота (разбавленная и концентрированная), проявляет окислительные свойства с растворением меди.
Азотная кислота (разбавленная и концентрированная), проявляет окислительные свойства с растворением меди.
При реакции металла с разбавленной кислотой образуется нитрат меди и двухвалентный оксид азота в соотношении 75%:25%. Уравнение реакции:
8HNO₃ + 3Cu → 3Cu(NO₃)₂ + 2NO + 4H₂O
В реакции участвует 1 моль меди и 3 моля концентрированной азотной кислоты. При растворении меди раствор сильно разогревается, в результате чего происходит термическое разложение окислителя и наблюдается выделение дополнительного объема азотных оксидов. Уравнение реакции:
4HNO₃ + Cu → Cu(NO₃) + 2NO₂ + 2H₂O
Такой способ растворения меди имеет недостаток: во время реакции меди с азотной кислотой происходит выделение большого количества азотных оксидов. Для улавливания (или нейтрализации) азотных оксидов требуется специальное оборудование, потому процесс этот слишком затратный. Растворение меди в азотной кислоте считается завершенным, когда полностью прекращается выработка летучих азотистых оксидов. Температура реакции — 60—70 °С. Следующий этап — спуск раствора из химического реактора. После этого на дне реактора остаются куски меди, не вступившие в реакцию. К полученной жидкости добавляется вода и проводится фильтрация. Нажмите здесь, чтобы изучить свойства меди на примере взаимодействия с другими веществами.
Растворение меди в азотной кислоте считается завершенным, когда полностью прекращается выработка летучих азотистых оксидов. Температура реакции — 60—70 °С. Следующий этап — спуск раствора из химического реактора. После этого на дне реактора остаются куски меди, не вступившие в реакцию. К полученной жидкости добавляется вода и проводится фильтрация. Нажмите здесь, чтобы изучить свойства меди на примере взаимодействия с другими веществами.
Азотная кислота и медь: реакция на примере опыта
Проследить всю реакцию азотной кислоты и меди можно на примере опыта, положив в концентрированную азотную кислоту пластинку меди. Происходит выделение бурого газа: сначала медленное, затем более сильное. Раствор приобретает зеленую окраску. Если в избытке добавлять медь в процессе реакции, раствор постепенно окрасится в голубой цвет. Реакция меди с азотной кислотой происходит с выделением тепла и токсичного газа, имеющего резкий запах.
Взаимодействие меди с концентрированной азотной кислотой относится к окислительно-восстановительным реакциям. Восстановителем здесь является металл, а окислителем — азотная кислота. Уравнение реакции:
Восстановителем здесь является металл, а окислителем — азотная кислота. Уравнение реакции:
Cu + 4HNO₃ = Cu(NO₃)₂ + 2NO₂↑ + 2H₂O
Реакция экзотермическая, поэтому при самопроизвольном разогреве смеси реакция ускоряется.
Реакция меди с азотной кислотой начинается при комнатной температуре. Металл покрывается пузырьками, они всплывают и наполняют пробирку бурым газом — NO₂ (токсичным ядовитым диоксидом азота с резким запахом). Этот газ в 1,5 раза тяжелее воздуха.
Реакция меди с азотной кислотой протекает в два этапа:
- на первом этапе кислота окисляет медь до оксида меди, выделяя диоксид азота;
- на втором этапе оксид меди реагирует с новыми порциями кислоты, образуя нитрат меди Cu(NO₃)₂. Смесь разогревается, и реакция протекает быстрее.
Итог: металл растворился и образовался раствор нитрата меди. Благодаря нитрату меди полученный раствор имеет зеленый или голубой цвет (оттенок будет зависеть от количества использованной воды).
Благодаря нитрату меди полученный раствор имеет зеленый или голубой цвет (оттенок будет зависеть от количества использованной воды).
Твитнуть
Отправить
Больше статей о химии:
- Опыт «Золотой дождь» Как получить блестящие золотистые кристаллы
- Эксперимент «Реакция Дюма» Самый простой способ получить метан
Делайте эксперименты дома!
Трансмутация
Узнать больше
Попробовать
цвет, физические свойства купрум, характеристика, как определить, химический элемент (металл)
В нашей статье мы описали все основные физические и химические свойства меди, ее отличия от множества похожих металлов и сплавов. Вы узнаете, как можно отличить медь в домашних условиях от бронзы, латуни и других металлов.
Содержание
- Что представляет собой медь
- Основные свойства меди
- Физические свойства меди
- Химические свойства
- Оптические свойства
- Кристаллографические свойства
- Как идентифицировать медь на глаз
- Как определить медь в домашних условиях
- Проверить цвет
- Тестировать магнитом
- Применить нагрев
- Как отличить медь от других металлов
- Как отличить медь от бронзы
- Как отличить медь от латуни
- Как отличить медь от алюминия
- Медь в природе
- Способы получения
- Пирометаллургический
- Гидрометаллургический
- Интересное о меди
Что представляет собой медь
Хотя она не является ни редким, ни драгоценным металлом ее ценность как химического элемента достаточно высока. В первую очередь это связано с тем, что она широко применяется в медицине, полупроводниковых приборах, фотоэлементах, на производствах и даже оборонной промышленности.
Цвет меди является основным признаком, по которому можно выделить ее среди похожих металлов. В природе встречается в чистом виде как мягкий материал светловато оранжевого цвета, при контакте с воздухом покрывающийся зеленоватой оксидной пленкой. К характеристикам меди также относится исключительная пластичность.
В природе встречается в чистом виде как мягкий материал светловато оранжевого цвета, при контакте с воздухом покрывающийся зеленоватой оксидной пленкой. К характеристикам меди также относится исключительная пластичность.
Основные свойства меди
Все свойства характеризующее медь как ценный для человека химический элемент подразделяются на четыре основные группы – физические, химические, оптические и кристаллографические. Рассмотрим последовательно каждое свойство.
Физические свойства меди
Обладает ярко выраженным красновато оранжевым цветом и хорошо взаимодействует с различными примесями, улучшающими или дополняющими ее физические свойства.
Хорошо проводит тепло и электрический ток (именно благодаря этому свойству получила широкое распространение в электротехнике). Теплопроводные свойства меди нашли применение в системах охлаждения, радиаторах и теплообменниках.
Теплопроводные свойства меди нашли применение в системах охлаждения, радиаторах и теплообменниках.
Подробнее о физических свойствах меди в таблице.
Химические свойства
Химический состав меди слабо взаимодействует с неметаллами и практически не реагирует на внешние окислители. В нормальном состоянии, в помещении с сухим воздухом медь не подвержена быстрому окислению. Также слабо реагирует на кислоты и щелочи. Более подробную информацию о химических свойствах этого металла можно узнать из представленной таблицы.
Читать также: Как заварить глушитель электросваркой самостоятельно
Оптические свойства
Спектральный анализ меди показывает, что зависимость преломления оптического показателя под влиянием увеличения длины волны настолько малозначима, что может не приниматься в расчет на производствах. В спектральном диапазоне от 200 нм до 900 нм не наблюдается серьезных изменений коэффициента поглощения.
Теплоемкость отдельно взятого медного изделия такова, что поглощение энергии светового импульса на единицу площади не приводит к сколько нибудь значимому нагреву при испытаниях в естественных условиях эксплуатации.
Кристаллографические свойства
Основные кристаллографические свойства меди можно узнать из представленной таблицы.
Как идентифицировать медь на глаз
Метод визуальной идентификации самый простой и как ни странно наиболее действенный из доступных. Медные изделия, очищенные от грязи и окислов должны иметь ярко выраженный красноватый или розоватый цвет. При рассмотрении металла в первую очередь стоит вспомнить какие еще химические элементы имеют схожую с медью окраску.
Визуально похожи на медь следующие металлы:
- осмий и металлы на его основе;
- цезий и сплавы, в которых он составляет большую часть процентного соотношения;
- различные сплавы золота.
Очевидно, что если рассматриваемое изделие представляет собой предмет домашнего обихода или деталь электроинструмента, то маловероятно, что для его изготовления использовали большое количество золота или цезия.
Полезная статья: Электрическая дуговая сварка — что это
Как определить медь в домашних условиях
В домашних условиях, где могут попасться медные изделия совершенно различного предназначения, существуют несколько простых, но действенных методов как распознать медь без сложных спектральных анализов и химических лабораторий.
Кроме чистой меди, вполне могут встретиться и сплавы очень похожие по виду, но совершенно отличающиеся по структуре металла и его физико-химическим свойствам. Рассмотренные ниже домашние методы помогут выяснить истинный состав металла даже в таких случаях.
Всего различают три основных способа определения меди.
- Визуальный анализ цвета.
- Тест на магнитные свойства.
- «Тепловой» метод идентификации.
Рассмотрим подробнее каждый из методов.
Проверить цвет
Практически все знают как должна выглядеть медь, но мало кто представляет это цвет визуально. Если есть сомнения в составе представленного металла, то для начала нужно добиться блеска — очистить от следов окислов, пыли, грязи (при наличии).
Если есть возможность и это не повредит самому изделию, то пройтись по видимой части детали мелкозернистой наждачной бумагой.
Полученный результат идентифицируют «на глаз» или же сравнивают с цветом эталонного изделия о котором совершенно точно известно, что это медь. Если такого изделия под рукой не оказалось, то в качестве эталона можно применить токопроводящую жилу от любого силового кабеля.
Как правило, электрические провода изготавливают из чистой меди без примесей.
Тестировать магнитом
Тест на магнитные свойства считается одним из самых надежных методов проверки, но увы не может быть единственным. Чистая медь не магнитится и не намагничивается. Так же не магнитятся и различные медные сплавы. Если смысл только в этом, то на данном этапе тестирование металла можно завершить.
Если же исследуемое металлическое тело пойдет на вторичную переработку, переплавку или как заготовка для самостоятельного изделия, имеет смысл проверить чистоту металла еще и визуальным методом на срезе торца. Делается это для того, чтобы не спутать чистый металл с например – омедненным алюминием или оловом, которые тоже не реагируют на поднесенное магнитное поле.
Делается это для того, чтобы не спутать чистый металл с например – омедненным алюминием или оловом, которые тоже не реагируют на поднесенное магнитное поле.
Применить нагрев
Кроме всего перечисленного есть и еще один способ проверить медь перед вами или что-то другое. Данный метод применяют только в тех случаях, когда сильный нагрев предположительно медного изделия никак не повлияет на его дальнейшую эксплуатацию.
Исследуемый металл накаляют на открытом огне до температуры в 150 — 200 °C и наблюдают за его состоянием. Чистая медь в процессе нагрева начинает тускнеть и постепенно приобретает буроватый цвет похожий на черные следы окисления.
По мере нагрева вещество не должно выделять резких неприятных запахов, дыма или копоти. Чтобы исключить ошибки, деталь перед нагреванием очищают от внешних загрязнений или моют водой.
Полезная статья: Как выбрать электроды по нержавейке
Как отличить медь от других металлов
Существует ряд металлов со схожими свойствами (цветом, химической реакцией на окислители и магнитными свойствами). Все эти металлы настолько похожи друг на друга, что порой даже специалисты не могут с первого взгляда описать характеристики каждого.
Все эти металлы настолько похожи друг на друга, что порой даже специалисты не могут с первого взгляда описать характеристики каждого.
На практике, чаще всего происходит путаница со следующими металлами:
- бронзой;
- латунью;
- алюминием или его сплавами.
Каждый из этих металлов визуально похож, но обладает одним или несколькими свойствами по наличию которых можно однозначно судить о его составе.
Разберем подробнее как отличить медь от бронзы, алюминия или латуни.
Как отличить медь от бронзы
Бронза наиболее часто путаемый металл. По сути это и есть медь, но в сплаве с оловом. В связи с тем, что бронзовые изделия обладают почти тем же набором характеристик, что и медные, отличить их с помощью визуального, магнитного или теплового способа не получится.
Для достижения гарантированного результата проверяемую деталь необходимо слегка деформировать (конечно только в тех случаях, где это допустимо). Медь намного более мягкий и пластичный металл и на изделии из чистой меди однозначно останется вмятина или глубокая царапина. Бронза обладает большей твердостью и останется невредимой.
Бронза обладает большей твердостью и останется невредимой.
Второй способ основан на химическом взаимодействии меди с солью. Необходимо приготовить концентрированный раствор обычной поваренной соли, нагреть до температуры 50 – 80 °C и погрузить в него исследуемое изделие (или его часть) на некоторое время (обычно 15-20 минут). Бронзовое изделие не изменит своего первоначального цвета, тогда как медь быстро потемнеет.
Третий способ основан на визуальном восприятии временных изменений. Если перед вами лежит изделие про которое точно известно. Видно, что оно изготовлено достаточно давно и при этом на нем нет ни следа зеленоватого налета, вероятнее всего оно изготовлено не из чистой меди.
Полезная статья — Как варить вертикальный шов инвертором
Как отличить медь от латуни
Латунью называется металл, кристаллическая решетка которого состоит из сплава меди с цинком. При высоком содержании в сплаве цинка (от 40% и выше) отличить латунь можно даже визуальным методом – она имеет желтоватый оттенок. В случае, когда примесь цинка не более 10%, на глаз отличия уже не видны. В таких случаях прибегают к «народным» методам.
В случае, когда примесь цинка не более 10%, на глаз отличия уже не видны. В таких случаях прибегают к «народным» методам.
- Проверка на слух. В связи с тем, что медь более мягкий металл при ударе в него металлическим прутом издает глухой звук похожий на стук упавшего яблока. Латунь звучит более звонче и дольше.
- Если изделие тонкостенное, то можно попробовать его на изгиб. Медь согнется, а латунь будет упругой.
Существуют и другие методы – растворение в соляной кислоте, снятие стружки высокооборотистым фрезером, определение удельной плотности и подобные. Ввиду сложности применения в быту рассматривать их не имеет смысла.
Как отличить медь от алюминия
При наличии двух изделий из чистых металлов различить их не составит труда даже в условиях плохого освещения. Совсем другое дело, когда имеется сплав в непонятном соотношении.
Совсем другое дело, когда имеется сплав в непонятном соотношении.
Чаще всего такие сплавы используют для изготовления электрических проводов. Понять из какого металла состоит провод просто, достаточно измерить его сопротивление.
У чистой меди сопротивление всегда меньше чем у алюминия и на сто метров провода не будет превышать 10 Ом. Алюминиевый провод или провод из сплава выдаст гораздо большие показатели.
Также можно попробовать провод на изгиб – алюминиевый быстро сломается уже после нескольких перегибов, медный выдержит.
Медь в природе
В природе встречается как в соединениях, так и в виде самородков. Большая часть этого металла лежит в поверхностных слоях грунта и добывается открытым способом. Металлургическая руда содержит от 0.25 % до 1.5 % самородной меди на объем грунта.
Металлургическая руда содержит от 0.25 % до 1.5 % самородной меди на объем грунта.
Полезная статья — Чем заварить нержавейку
Способы получения
Так как даже в «богатой» руде содержание меди не превышает 1.5% плавить такую руду экономически не целесообразно. В целях оптимизации процесса руда предварительно обогащается и далее добывается одним из двух основных методов.
Пирометаллургический
Сложный процесс включающий в себя ряд взаимоувязанных этапов:
- обогащение. Суть метода основана на водной флотации, грунт помещается в водяную ванну, где микрочастицы меди увлекаются на поверхность воздушными пузырьками. Данный процесс обогащения позволяет добиться концентрации меди в 35%;
- обжиг.
 Применяется в основном к руде с большим содержанием серы. После сильного температурного воздействия более половины серы «сгорает», чем также достигается повышение доли меди в руде;
Применяется в основном к руде с большим содержанием серы. После сильного температурного воздействия более половины серы «сгорает», чем также достигается повышение доли меди в руде; - плавка. Полученную обогащенную руду помещают в плавильные печи и на выходе получают спекшийся медный штейн;
- рафинирование. Штейн обрабатывают открытым огнем и электролитом, газовой продувкой удаляются химические примеси. Концентрация чистой меди на этом этапе может достигать 99.97%.
Полезная статья — Поксипол клей двухкомпонентный
Гидрометаллургический
Процесс применяют для руды с критически малым содержанием меди. Суть процесса заключается в химическом растворении руды в концентрате серной кислоты после которой извлекается только медь без содержания других примесей.
Интересное о меди
Медь является неотъемлемым химическим элементом, участвующим в жизненно важных процессах организма. Способствует образованию кровяных телец и замедляет старение организма.
Недостаток меди в организме проявляется в слабой костной структуре и различных патологиях крови. Восполнить недостаток элемента можно употребляя в пищу следующие виды продуктов – любые из видов орехов (лесной, грецкий, миндаль и т.д.), крупы, мясо, говяжья печень, какао и множество других.
Учитывая полезные свойства меди, она очень востребована в медицине, из нее изготавливаются трубопроводы для питательных жидкостей. К примеру, в Японии трубопровод из меди несет в себе сразу две полезные функции – он химически безопасен для организма и сейсмоустойчив, что для острова является важным фактором.
Да
77.94%
Нет
22.06%
Проголосовало: 68
Задавайте свои вопросы в комментариях под статьей. Расскажите, была ли Вам полезна наша статья.
Химические свойства переходных металлов (меди, цинка, хрома, железа)
Что такое химические свойства переходных металлов (меди, цинка, хрома, железа)
Основные химические свойства и характеристики меди, цинка, хрома и железа — переходных металлов, краткая справка:
Медь
химический элемент. символьное обозначение элемента:
символьное обозначение элемента:
Cu
, латинское название
Cuprum
, элемент относится к периоду, группе:
4, 11
, (atomic mass of matter) атомная масса вещества Медь составляет
63,546 (3)
(а.е.м.) плотность элемента:
8,92
г/ см³ (при 20 градусах Цельсия), температура плавления
1083,5
(°C), температура кипения
2595
(°C). Первооткрывателем зарегистрирован:
неизвестен
, год открытия:
доисторический период
— Cuprum
Цинк
химический элемент. символьное обозначение элемента:
Zn
, латинское название
Zincum
, элемент относится к периоду, группе:
4, 12
, (atomic mass of matter) атомная масса вещества Цинк составляет
65,409 (4)
(а.е.м.) плотность элемента:
7,14
г/ см³ (при 20 градусах Цельсия), температура плавления
419,6
(°C), температура кипения
907
(°C). Первооткрывателем зарегистрирован:
Первооткрывателем зарегистрирован:
неизвестен
, год открытия:
доисторический период
— Zincum
Хром
химический элемент. символьное обозначение элемента:
Cr
, латинское название
Chromium
, элемент относится к периоду, группе:
4, 6
, (atomic mass of matter) атомная масса вещества Хром составляет
51,9961 (6)
(а.е.м.) плотность элемента:
7,14
г/ см³ (при 20 градусах Цельсия), температура плавления
1857
(°C), температура кипения
2482
(°C). Первооткрывателем зарегистрирован:
Воклен
, год открытия:
1797
— Chromium
Железо
химический элемент. символьное обозначение элемента:
Fe
, латинское название
Ferrum
, элемент относится к периоду, группе:
4, 8
, (atomic mass of matter) атомная масса вещества Железо составляет
55,845 (2)
(а.е.м.) плотность элемента:
7,87
г/ см³ (при 20 градусах Цельсия), температура плавления
1535
(°C), температура кипения
2750
(°C). Первооткрывателем зарегистрирован:
Первооткрывателем зарегистрирован:
неизвестен
, год открытия:
доисторический период
— Ferrum
Медь (Cu) относится к d-элементам и расположена в IB группе периодической таблицы Электронная конфигурация атома меди в основном состоянии записывается виде 1s22s22p63s23p63d104s1 вместо предполагаемой формулы 1s22s22p63s23p63d94s2. Другими словами, в случае атома меди наблюдается так называемый «проскок электрона» с 4s-подуровня на 3d-подуровень. Для меди, кроме нуля, возможны степени окисления +1 и +2.
Степень окисления +1 склонна к диспропорционированию и стабильна лишь в нерастворимых соединениях типа CuI, CuCl, Cu2O и т. д., а также в комплексных соединениях, например, [Cu(Nh4)2]Cl и [Cu(Nh4)2]OH.
Соединения меди в степени окисления +1 не имеют конкретной окраски. Так, оксид меди (I) в зависимости от размеров кристаллов может быть темно-красный (крупные кристаллы) и желтый (мелкие кристаллы), CuCl и CuI — белыe, а Cu2S — черно-синий. Более химически устойчивой является степень окисления меди, равная +2. Соли, содержащие медь в данной степени окисления, имеют синюю и сине-зеленую окраску.
Более химически устойчивой является степень окисления меди, равная +2. Соли, содержащие медь в данной степени окисления, имеют синюю и сине-зеленую окраску.
Медь является очень мягким, ковким и пластичным металлом с высокой электро- и теплопроводностью. Окраска металлической меди красно-розовая. Медь находится в ряду активности металлов правее водорода, т.е. относится к малоактивным металлам.
Взаимодействие с простыми веществами
с кислородом
В обычных условиях медь с кислородом не взаимодействует. Для протекания реакции между ними требуется нагрев. В зависимости от избытка или недостатка кислорода и температурных условий может образовать оксид меди (II) и оксид меди (I):
***
с серой
Реакция серы с медью в зависимости от условий проведения может приводить к образованию как сульфида меди (I), так и сульфида меди (II). При нагревании смеси порошкообразных Cu и S до температуры 300-400оС образуется сульфид меди (I):
***
При недостатке серы и проведении реакции при температуре более 400оС образуется сульфид меди (II). Однако, более простым способом получения сульфида меди (II) из простых веществ является взаимодействие меди с серой, растворенной в сероуглероде:
Однако, более простым способом получения сульфида меди (II) из простых веществ является взаимодействие меди с серой, растворенной в сероуглероде:
***
Данная реакция протекает при комнатной температуре.
с галогенами
С фтором, хлором и бромом медь реагирует, образуя галогениды с общей формулой CuHal2, где Hal – F, Cl или Br:
Cu + Br2 = CuBr2
В случае с йодом — самым слабым окислителем среди галогенов — образуется иодид меди (I):
***
С водородом, азотом, углеродом и кремнием медь не взаимодействует.
Взаимодействие со сложными веществами
с кислотами-неокислителями
Кислотами-неокислителями являются практически все кислоты, кроме концентрированной серной кислоты и азотной кислоты любой концентрации. Поскольку кислоты-неокислители в состоянии окислить только металлы, находящиеся в ряду активности до водорода; это означает, что медь с такими кислотами не реагирует.
***
с кислотами-окислителями
— концентрированной серной кислотой
С концентрированной серной кислотой медь реагирует как при нагревании, так и при комнатной температуре. При нагревании реакция протекает в соответствии с уравнением:
При нагревании реакция протекает в соответствии с уравнением:
***
Поскольку медь не является сильным восстановителем, сера восстанавливается в данной реакции только до степени окисления +4 (в SO2).
— с разбавленной азотной кислотой
Реакция меди с разбавленной HNO3 приводит к образованию нитрата меди (II) и монооксида азота:
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO↑ + 4h3O
— с концентрированной азотной кислотой
Концентрированная HNO3 легко реагирует с медью при обычных условиях. Отличие реакции меди с концентрированной азотной кислотой от взаимодействия с разбавленной азотной кислотой заключается в продукте восстановления азота. В случае концентрированной HNO3 азот восстанавливается в меньшей степени: вместо оксида азота (II) образуется оксид азота (IV), что связано с большей конкуренцией между молекулами азотной кислоты в концентрированной кислоте за электроны восстановителя (Cu):
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2h3O
с оксидами неметаллов
Медь реагирует с некоторыми оксидами неметаллов. Например, с такими оксидами, как NO2, NO, N2O медь окисляется до оксида меди (II), а азот восстанавливается до степени окисления 0, т.е. образуется простое вещество N2:
Например, с такими оксидами, как NO2, NO, N2O медь окисляется до оксида меди (II), а азот восстанавливается до степени окисления 0, т.е. образуется простое вещество N2:
***
В случае диоксида серы, вместо простого вещества (серы) образуется сульфид меди(I). Связано это с тем, что медь с серой, в отличие от азота, реагирует:
***
с оксидами металлов
При спекании металлической меди с оксидом меди (II) при температуре 1000-2000 оС может быть получен оксид меди (I):
***
Также металлическая медь может восстановить при прокаливании оксид железа (III) до оксида железа (II):
***
с солями металлов
Медь вытесняет менее активные металлы (правее нее в ряду активности) из растворов их солей:
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag↓
Также имеет место интересная реакция, в которой медь растворяется в соли более активного металла – железа в степени окисления +3. Однако противоречий нет, т.к. медь не вытесняет железо из его соли, а лишь восстанавливает его со степени окисления +3 до степени окисления +2:
Fe2(SO4)3 + Cu = CuSO4 + 2FeSO4
Cu + 2FeCl3 = CuCl2 + 2FeCl2
Последняя реакция используется при производстве микросхем на стадии травления медных плат.
Коррозия меди
Медь со временем подвергается коррозии при контакте с влагой, углекислым газом и кислородом воздуха:
2Cu + h3O + СО2 + О2 = (CuOН)2СO3
В результате протекания данной реакции медные изделия покрываются рыхлым сине-зеленым налетом гидроксокарбоната меди (II).
Запасы, добыча
Глобальные объемы медной руды оцениваются в миллиард тонн (разведанные). Наличие половины подтверждено. Ученые полагают, что земная кора таит еще три миллиарда тонн меденосной руды.
Самородная медь
Богатыми запасами располагают страны на всех континентах:
- Америка – Чили, Канада, США.
- Азия – Казахстан, Иран.
- Африка – ЮАР, Замбия, Заир.
На Россию приходится 3% мировых запасов. Месторождения сосредоточены на Урале. Основной добытчик – концерн «Норильский никель».
Руду добывают открытым либо закрытым способом, в зависимости от глубины залегания.
Ежегодный мировой объем добычи руды – 15-20 млн.
тонн.
Химические свойства цинка
Цинк Zn находится в IIБ группе IV-го периода. Электронная конфигурация валентных орбиталей атомов химического элемента в основном состоянии 3d104s2. Для цинка возможна только одна единственная степень окисления, равная +2. Оксид цинка ZnO и гидроксид цинка Zn(ОН)2 обладают ярко выраженными амфотерными свойствами.
Цинк при хранении на воздухе тускнеет, покрываясь тонким слоем оксида ZnO. Особенно легко окисление протекает при высокой влажности и в присутствии углекислого газа вследствие протекания реакции:
2Zn + h3O + O2 + CO2 → Zn2(OH)2CO3
Пар цинка горит на воздухе, а тонкая полоска цинка после накаливания в пламени горелки сгорает в нем зеленоватым пламенем:
***
При нагревании металлический цинк также взаимодействует с галогенами, серой, фосфором:
***
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует.
Цинк реагирует с кислотами-неокислителями с выделением водорода:
Zn + h3SO4 (20%) → ZnSO4 + h3↑
Zn + 2HCl → ZnCl2 + h3↑
Особенно легко растворяется в кислотах технический цинк, поскольку содержит в себе примеси других менее активных металлов, в частности, кадмия и меди. Высокочистый цинк по определенным причинам устойчив к воздействию кислот. Для того чтобы ускорить реакцию, образец цинка высокой степени чистоты приводят в соприкосновение с медью или добавляют в раствор кислоты немного соли меди.
Высокочистый цинк по определенным причинам устойчив к воздействию кислот. Для того чтобы ускорить реакцию, образец цинка высокой степени чистоты приводят в соприкосновение с медью или добавляют в раствор кислоты немного соли меди.
При температуре 800-900oC (красное каление) металлический цинк, находясь в расплавленном состоянии, взаимодействует с перегретым водяным паром, выделяя из него водород:
Zn + h3O = ZnO + h3↑
Цинк реагирует также и с кислотами-окислителями: серной концентрированной и азотной.
Цинк как активный металл может образовывать с концентрированной серной кислотой сернистый газ, элементарную серу и даже сероводород.
Zn + 2h3SO4 = ZnSO4 + SO2↑ + 2h3O
Состав продуктов восстановления азотной кислоты определяется концентрацией раствора:
Zn + 4HNO3(конц.) = Zn(NO3)2 + 2NO2↑ + 2h3O
3Zn + 8HNO3(40%) = 3Zn(NO3)2 + 2NO↑ + 4h3O
4Zn +10HNO3(20%) = 4Zn(NO3)2 + N2O↑ + 5h3O
5Zn + 12HNO3(6%) = 5Zn(NO3)2 + N2↑ + 6h3O
4Zn + 10HNO3(0,5%) = 4Zn(NO3)2 + Nh5NO3 + 3h3O
На направление протекания процесса влияют также температура, количество кислоты, чистота металла, время проведения реакции. Цинк реагирует с растворами щелочей, при этом образуются тетрагидроксоцинкаты и водород:
Цинк реагирует с растворами щелочей, при этом образуются тетрагидроксоцинкаты и водород:
Zn + 2NaOH + 2h3O = Na2[Zn(OH)4] + h3↑
Zn + Ba(OH)2 + 2h3O = Ba[Zn(OH)4] + h3↑
С безводными щелочами цинк при сплавлении образует цинкаты и водород:
***
В сильнощелочной среде цинк является крайне сильным восстановителем, способным восстанавливать азот в нитратах и нитритах до аммиака:
4Zn + NaNO3 + 7NaOH + 6h3O → 4Na2[Zn(OH)4] + Nh4↑
Благодаря комплексообразованию цинк медленно растворяется в растворе аммиака, восстанавливая водород:
Zn + 4Nh4·h3O → [Zn(Nh4)4](OH)2 + h3↑ + 2h3O
Также цинк восстанавливает менее активные металлы (правее него в ряду активности) из водных растворов их солей:
Zn + CuCl2 = Cu + ZnCl2
Zn + FeSO4 = Fe + ZnSO4
Сферы применения
Свойства металла обусловили его применение разными сферами. Главный потребитель – промышленный комплекс.
Промышленность
Металл и сплавы разбирают следующие отрасли:
- Электротехника, радиоэлектроника.
 Кабели (силовые, другие), провода. Обмотка в трансформаторах. Теплообменные устройства (радиаторы отопления, кондиционеры, кулеры компьютеров, тепловые трубки ноутбуков).
Кабели (силовые, другие), провода. Обмотка в трансформаторах. Теплообменные устройства (радиаторы отопления, кондиционеры, кулеры компьютеров, тепловые трубки ноутбуков). - Приборо-, машиностроение. Из сплавов меди с цинком, оловом, алюминием делают детали, узлы машин. Без нее невозможно создание гальванических элементов и батарей.
- Трубы. Для транспортировки пара, воды, газа. В энергетике, судостроении, для бытовых потребностей.
Система охлаждения из меди на тепловых трубках в ноутбуке
В Японии медные трубопроводы признаны сейсмоустойчивыми, что для этой страны жизненно важно.
Медные трубы
Строительство
Крыши из медного листа экологичны, их можно не красить, поскольку влага, погодные катаклизмы не страшны. Срок службы – до 100 лет.
Медицина
Медициной востребованы характеристики металла как антисептика и вяжущего средства.
Это компонент глазных капель и смесей для лечения ожогов.
Медные ручки дверей, другие поверхности – атрибут лечебных учреждений.
Соединения меди подавляют вирус свиного гриппа.
Ювелирное дело
Ювелиры используют сплавы на основе меди.
Кольцо из меди
Красное или розовое золото – это конгломерат благородного металла с медью.
Ее количество в составе определяет финальный оттенок:
- 25% – розовый;
- 50% – красный.
Эти виды золота – самые любимые ювелирами. Медь делает изделия прочнее, попутно удешевляя стоимость.
Второй популярный ювелирный сплав – мельхиор (медь + никель).
Другие отрасли
- Оксид меди – основа купрата, используемого в сверхпроводниках.
- Латунь идет на изготовление гильз для винтовок и артиллерии.
- Из мельхиора чеканят монеты, создают интерьерные украшения, столовые приборы.
- Медь задействована при синтезе хлорофилла. Ее всегда добавляют в минеральные удобрения для растений.
Химические свойства хрома
Хром — элемент VIB группы таблицы Менделеева. Электронная конфигурация атома хрома записывается как 1s 22s 22p 63s 23p63d54s1, т.е. в случае хрома, также как и в случае атома меди, наблюдается так называемый «проскок электрона»
Электронная конфигурация атома хрома записывается как 1s 22s 22p 63s 23p63d54s1, т.е. в случае хрома, также как и в случае атома меди, наблюдается так называемый «проскок электрона»
Наиболее часто проявляемыми степенями окисления хрома являются значения +2, +3 и +6. Их следует запомнить, и в рамках программы ЕГЭ по химии можно считать, что других степеней окисления хром не имеет.
При обычных условиях хром устойчив к коррозии как на воздухе, так и в воде.
Взаимодействие с неметаллами
с кислородом
Раскаленный до температуры более 600 oС порошкообразный металлический хром сгорает в чистом кислороде образуя окcид хрома (III):
4Cr + 3O2 =ot=> 2Cr2O3
с галогенами
С хлором и фтором хром реагирует при более низких температурах, чем с кислородом (250 и 300 oC соответственно):
2Cr + 3F2 =ot=> 2CrF3
2Cr + 3Cl2 =ot=> 2CrCl3
С бромом же хром реагирует при температуре красного каления (850-900 oC):
2Cr + 3Br2 =ot=> 2CrBr3
с азотом
С азотом металлический хром взаимодействует при температурах более 1000 oС:
2Cr + N2 =ot=> 2CrN
с серой
С серой хром может образовывать как сульфид хрома (II) так и сульфид хрома (III), что зависит от пропорций серы и хрома:
Cr + S =ot=> CrS
2Cr + 3S =ot=> Cr2S3
С водородом хром не реагирует.
Взаимодействие со сложными веществами
Взаимодействие с водой
Хром относится к металлам средней активности (расположен в ряду активности металлов между алюминием и водородом). Это означает, что реакция протекает между раскаленным до красного каления хромом и перегретым водяным паром:
2Cr + 3h3O =ot=> Cr2O3 + 3h3↑
Взаимодействие с кислотами
Хром при обычных условиях пассивируется концентрированными серной и азотной кислотами, однако, растворяется в них при кипячении, при этом окисляясь до степени окисления +3:
Cr + 6HNO3(конц.) =to=> Cr(NO3)3 + 3NO2↑ + 3h3O
2Cr + 6h3SO4(конц) =to=> Cr2(SO4)3 + 3SO2↑ + 6h3O
В случае разбавленной азотной кислоты основным продуктом восстановления азота является простое вещество N2:
10Cr + 36HNO3(разб) = 10Cr(NO3)3 + 3N2↑ + 18h3O
Хром расположен в ряду активности левее водорода, а это значит, что он способен выделять h3 из растворов кислот-неокислителей. В ходе таких реакций в отсутствие доступа кислорода воздуха образуются соли хрома (II):
Cr + 2HCl = CrCl2 + h3↑
Cr + h3SO4(разб. ) = CrSO4 + h3↑
) = CrSO4 + h3↑
При проведении же реакции на открытом воздухе, двухвалентный хром мгновенно окисляется содержащимся в воздухе кислородом до степени окисления +3. При этом, например, уравнение с соляной кислотой примет вид:
4Cr + 12HCl + 3O2 = 4CrCl3 + 6h3O
При сплавлении металлического хрома с сильными окислителями в присутствии щелочей хром окисляется до степени окисления +6, образуя хроматы: ****
Сплавы
Номенклатура сплавов меди с другими компонентами насчитывает десятки позиций.
Сплавы меди и их применение
Они применяются чаще чистого металла, поскольку уменьшают недостатки, присущие чистому металлу. То есть делают продукт прочнее, устойчивее, дешевле.
Медные соединения подразделяются на две группы:
- Бронза – с оловом.
- Латунь – с цинком.
Помимо этих главных легирующих компонентов, в составе соединения алюминий, никель, висмут, титан, серебро, золото, неметаллические элементы.
Химические свойства железа
Железо Fe, химический элемент, находящийся в VIIIB группе и имеющий порядковый номер 26 в таблице Менделеева. Распределение электронов в атоме железа следующее 26Fe1s22s22p63s23p63d64s2, то есть железо относится к d-элементам, поскольку заполняемым в его случае является d-подуровень. Для него наиболее характерны две степени окисления +2 и +3. У оксида FeO и гидроксида Fe(OH)2 преобладают основные свойства, у оксида Fe2O3 и гидроксида Fe(OH)3 заметно выражены амфотерные. Так оксид и гидроксид железа (lll) в некоторой степени растворяются при кипячении в концентрированных растворах щелочей, а также реагируют с безводными щелочами при сплавлении. Следует отметить что степень окисления железа +2 весьма неустойчива, и легко переходит в степень окисления +3. Также известны соединения железа в редкой степени окисления +6 – ферраты, соли не существующей «железной кислоты» h3FeO4. Указанные соединения относительно устойчивы лишь в твердом состоянии, либо в сильнощелочных растворах. При недостаточной щелочности среды ферраты довольно быстро окисляют даже воду, выделяя из нее кислород.
Распределение электронов в атоме железа следующее 26Fe1s22s22p63s23p63d64s2, то есть железо относится к d-элементам, поскольку заполняемым в его случае является d-подуровень. Для него наиболее характерны две степени окисления +2 и +3. У оксида FeO и гидроксида Fe(OH)2 преобладают основные свойства, у оксида Fe2O3 и гидроксида Fe(OH)3 заметно выражены амфотерные. Так оксид и гидроксид железа (lll) в некоторой степени растворяются при кипячении в концентрированных растворах щелочей, а также реагируют с безводными щелочами при сплавлении. Следует отметить что степень окисления железа +2 весьма неустойчива, и легко переходит в степень окисления +3. Также известны соединения железа в редкой степени окисления +6 – ферраты, соли не существующей «железной кислоты» h3FeO4. Указанные соединения относительно устойчивы лишь в твердом состоянии, либо в сильнощелочных растворах. При недостаточной щелочности среды ферраты довольно быстро окисляют даже воду, выделяя из нее кислород.
Взаимодействие с простыми веществами
С кислородом
При сгорании в чистом кислороде железо образует, так называемую, железную окалину, имеющую формулу Fe3O4 и фактически представляющую собой смешанный оксид, состав которого условно можно представить формулой FeO∙Fe2O3. Реакция горения железа имеет вид:
Реакция горения железа имеет вид:
3Fe + 2O2 =to=> Fe3O4
С серой
При нагревании железо реагирует с серой, образуя сульфид двухвалентого железа:
Fe + S =to=> FeS
Либо же при избытке серы дисульфид железа:
Fe + 2S =to=> FeS2
С галогенами
Всеми галогенами кроме йода металлическое железо окисляется до степени окисления +3, образуя галогениды железа (lll):
2Fe + 3F2 =to=> 2FeF3 – фторид железа (lll)
2Fe + 3Cl2 =to=> 2FeCl3 – хлорид железа (lll)
2Fe + 3Br2 =to=> 2FeBr3 – бромид железа (lll)
Йод же, как наиболее слабый окислитель среди галогенов, окисляет железо лишь до степени окисления +2:
Fe + I2 =to=> FeI2 – йодид железа (ll)
| Соединения трехвалентного железа легко окисляют иодид-ионы в водном растворе до свободного йода I2 при этом восстанавливаясь до степени окисления +2. Примеры, подобных реакций из банка ФИПИ: 2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl 2Fe(OH)3 + 6HI = 2FeI2 + I2 + 6h3O Fe2O3 + 6HI = 2FeI2 + I2 + 3h3O |
С водородом
Железо с водородом не реагирует (с водородом из металлов реагируют только щелочные металлы и щелочноземельные):
***
Взаимодействие со сложными веществами
Взаимодействие с кислотами
С кислотами-неокислителями
Так как железо расположено в ряду активности левее водорода, это значит, что оно способно вытеснять водород из кислот-неокислителей (почти все кислоты кроме h3SO4 (конц. ) и HNO3 любой концентрации):
) и HNO3 любой концентрации):
Fe + h3SO4 (разб.) = FeSO4 + h3↑
Fe + 2HCl = FeCl2 + h3↑
Нужно обратить внимание на такую уловку в заданиях ЕГЭ, как вопрос на тему того до какой степени окисления окислится железо при действии на него разбавленной и концентрированной соляной кислоты. Правильный ответ – до +2 в обоих случаях.
Ловушка здесь заключается в интуитивном ожидании более глубокого окисления железа (до с.о. +3) в случае его взаимодействия с концентрированной соляной кислотой.
Медь в природе
В природе выявлено два проявления элемента – самородки и компонент соединений с другими элементами.
Самородок меди
Чаще это соединения: оксиды, сульфиды, гидрокарбонаты. Самое распространенное сырье – медный колчедан.
Медь придает глубокие синие, голубые, зеленоватые оттенки малахиту, бирюзе, хризоколле, другим минералам ювелирно-декоративного сегмента.
Общая характеристика d-элементов. Месторождения меди, цинка, железа, хрома и их соединений в Казахстане.
 10 класс
10 классУрок 45 10 класс Дата _________
Тема: Общая характеристика d-элементов. Месторождения меди, цинка, железа, хрома и их соединений в Казахстане
Цель: изучить общую характеристику d-элементов.
Задачи:
1. Образовательная: актуализировать знания учащихся о положении d-элементов в Периодической системе химических элементов Д.И. Менделеева, особенностях строении их атомов, систематизировать и углубить знания об особенностях d-элементов; на основе ранее изученного материала познакомить учащихся с основными месторождениями соединений меди, цинка, железа, хрома на территории Республики Казахстан;
2. Развивающая: способствовать совершенствованию у учащихся умений работать с Периодической системой химических элементов Д.И. Менделеева, с картой Казахстана, делать выводы;
3. Воспитательная: способствовать
развитию навыков сотрудничества с взрослыми и со сверстниками, совершенствовать
умения осуществлять планирование и рефлексию своей деятельности.
Воспитательная: способствовать
развитию навыков сотрудничества с взрослыми и со сверстниками, совершенствовать
умения осуществлять планирование и рефлексию своей деятельности.
Оборудование: ПСХЭ Д.И.Менделеева, карта полезные ископаемые Казахстана, презентация.
Ход работы
I. Организационный – 2 мин (психологический настрой)
II. Проверка д/з – 8 мин
1. Фронтальный опрос.
На прошлых занятиях мы говорили с вами о важнейших s-элементов и их соединений. Давайте вспомним общую характеристику этих элементов.
· Где расположены s–элементы в ПСХЭ Д.И.Менделева (в I и II группе главной подгруппе).
· Какие свойства проявляют эти элементы? (они легко отдают свои электроны, проявляя сильные восстановительные свойства)
· Что общего у элементов IA? (на внешнем уровне у них 1 электрон, их называют щелочными металлами)
· Что общего у элементов IIA? (на внешнем уровне у них 2 электрона: последние 4 элемента называют щелочноземельными металлами)
III. Изучение
нового материала – 25 мин
Изучение
нового материала – 25 мин
Сегодня мы с вами начинаем изучение нового раздела «Важнейшие d-элементы и их соединения».
Тема нашего урока «Общая характеристика d-элементов» (запись в тетрадь).
Цель нашего урока: изучить особенности d-элементов.
Посмотрите, пожалуйста, все в Периодическую систему химических элементов Д.И. Менделеева и вспомните, где располагаются металлы. (Если провести диагональ с верхнего левого угла в правый нижний угол периодической системы химических элементов Д.И. Менделеева, то металлы располагаются в нижнем левом углу)
Но если сказать точнее, то к металлам относятся также d-элементы, или их иначе называют «вставная декада», которые выходят за пределы диагонали. А почему их называют «декадой»? (Потому что в каждом периоде по десять d-элементов)
d-элементы также называют
переходными элементами, посмотрите в ПСХЭ, и определите почему? (они
расположены между s–элементами
и p–элементами).
То есть, d-элементы расположены между типичными металлами и типичными неметаллами.
Запишите в тетради:
d-элементы – переходные элементы в периодах, расположенные между типичными металлами и типичными неметаллами. В каждом периоде расположено по 10 d-элементов. Все они проявляют свойства металлов, причем с ростом атомного номера металлические свойства уменьшаются.
Теперь давайте определим строение внешнего электронного уровня.
Прежде чем приступить, давайте вспомним правило Клечковского: Электроны заполняют орбитали последовательно в порядке увеличения суммы главного и орбитального квантовых чисел. Тогда последовательность заполнения орбиталей электронами выглядит следующим образом: 1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p и т.д.
Задание: напишите электронную и графическую формулу скандия, хрома и железа.
Сколько электронов находится на внешнем
уровне? (2 электрона). На каком подуровне происходит изменение
количества электронов? (на d-подуровне).
Запишите в тетради:
Внешнее строение электронного слоя у d-элементов остается неизменным, у них идет заполнение предпоследнего энергетического уровня, d-подуровня.
Так как все d-элементы металлы, какую степень окисления они будут проявлять в соединениях? (положительную)
Задание: определите степень окисления хрома в следующих соединениях: CrO, Cr2O3, CrO3. (+2; +3; +6). Исходя из данного задания, какой вывод можно сделать? (d-элементы могут проявлять различные степени окисления).
Запишите в тетрадь:
В соединениях d-элементы могут иметь различные положительные степени окисления.
Еще одна особенность d-элементов – их биологическая роль. d-элементы входят в состав микроэлементов необходимых для нормальной жизнедеятельности живого организма. Назовите d-элементы необходимые для человека (цинк, железо, медь, марганец, серебро)
Разминка видеоролик
Работа в группе (Изучить основные месторождения меди, цинка, железа, хрома)
Задания для групп(1группа-медь, 2-цинк, 3-железо, 4-хром)
1 задание: Напишите электронную формулу
———————————————————————————————————————-
2 задание: Назовите природные соединения, содержащие данный металл
———————————————————————————————————————-
3 задание: Назовите основные месторождения
Для групп предлагается технологическая карта
Сообщение учащихся (биологическая роль металлов)
Добытые
из недр соединения металлов подвергаются дальнейшей обработке. Предлагаю
просмотреть видео (Получение железа алюминотермией). Проанализируйте его и
запишите уравнения реакции. Что происходит при этом с металлом? Напишите
окислительно-восстановительную реакцию данного процесса:
Предлагаю
просмотреть видео (Получение железа алюминотермией). Проанализируйте его и
запишите уравнения реакции. Что происходит при этом с металлом? Напишите
окислительно-восстановительную реакцию данного процесса:
Fe2O3 + 2Al = 2Fe + Al2O3
Fe23+ + 6e→ 2 Fe0
Теперь давайте решим задачу.
1.Вычислите массу хрома, который получают алюминотермическим способом на Аксуском заводе ферросплавов из 20 кг руды, содержащей оксид хрома(III) и 12% других примесей.
IV. Закрепление – 5 мин
1. Фронтальный опрос.
Давайте повторим, какова общая характеристика d-элементов, назовите их месторождения в Казахстане.
2. Решение задач
Задание 1: Установите соответствие между формулой частицы и общим числом электронов,
содержащейся в ней.
1. Cr+3 2. Cu0 3. Mn+7 4. Ag0 | a) 29 b) 21 c) 47 d) 18 | Ответы: 1-b, 2-a, 3-d, 4-c |
Задание 2: Определите степень окисления железа в следующих соединениях: Fe, FeO, FeCl3.
V. Рефлексия – 2 мин
VI. Подведение итогов – 2 мин
VII. Д/з – 1 мин
§ 6.1 стр. 169 № 2, 4
Технологическая карта
Работа в группе (Изучить основные месторождения меди, цинка, железа, хрома)
Задания для групп(1группа-медь, 2-цинк, 3-железо, 4-хром)
1 задание: Напишите электронную формулу
———————————————————————————————————————-
2 задание: Назовите природные соединения, содержащие данный металл
———————————————————————————————————————-
3 задание: Назовите основные месторождения
Задача:
1. Вычислите
массу хрома, который получают алюминотермическим способом на Аксуском заводе
ферросплавов из 20 кг руды, содержащей оксид хрома(III)
и 12% других примесей.
Вычислите
массу хрома, который получают алюминотермическим способом на Аксуском заводе
ферросплавов из 20 кг руды, содержащей оксид хрома(III)
и 12% других примесей.
Закрепление
Решение задач
Задание 1: Установите соответствие между формулой частицы и общим числом электронов, содержащейся в ней.
5. Cr+3 6. Cu0 7. Mn+7 8. Ag0 | e) 29 f) 21 g) 47 h) 18 |
|
Задание 2: Определите степень окисления железа в следующих соединениях: Fe, FeO, FeCl3.
Казахстан обладает
разнообразными полезными ископаемыми. Из 105 элементов таблицы Менделеева в
недрах Казахстана выявлено 99, разведаны запасы по 70, вовлечено в производство
более 60 элементов.
Из 105 элементов таблицы Менделеева в
недрах Казахстана выявлено 99, разведаны запасы по 70, вовлечено в производство
более 60 элементов.
В. Казахстан занимает первое место в мире по разведанным запасам цинка, вольфрама и барита, второе — серебра, свинца и хромитов, третье — меди и флюорита, четвёртое — молибдена, шестое — золота.
По объёму запасов полезных ископаемых Казахстан занимает первое место среди
стран СНГ по хромовым рудам и свинцу, второе — по запасам нефти, серебра, меди,
марганца, цинка, никеля и фосфорного сырья, третье — по газу, углю, золоту и
олову. По добыче серебра, хромитов, свинца и цинка республика занимает первое
место, второе — по добыче нефти, угля, меди, никеля и фосфатного сырья, третье
— по добыче золота. Казахстан располагает значительными запасами нефти и газа,
сосредоточенными в западном регионе, позволяющими отнести республику к разряду
крупнейших нефтедобывающих государств мира. Открытие нового нефтеносного района
в пределах Южно-Тургайской впадины расширяет перспективы дальнейшего развития
нефтедобычи республики. По результатам геолого-экономической оценки имеющихся
запасов полезных ископаемых Казахстана, наибольший вес по экономической
значимости имеют уголь, нефть, медь, железо, свинец, цинк, хромиты, золото,
марганец. Руды чёрных и цветных металлов, добываемые в Казахстане, идут на
экспорт в Японию, Южную Корею, США, Канаду, Россию, Китай и страны ЕС.
По результатам геолого-экономической оценки имеющихся
запасов полезных ископаемых Казахстана, наибольший вес по экономической
значимости имеют уголь, нефть, медь, железо, свинец, цинк, хромиты, золото,
марганец. Руды чёрных и цветных металлов, добываемые в Казахстане, идут на
экспорт в Японию, Южную Корею, США, Канаду, Россию, Китай и страны ЕС.
Давайте рассмотрим, какие полезные ископаемые можно найти в разных регионах
Казахстана:
Рудные полезные ископаемые.
Железо
Казахстан занимает третье место после России и Украины в СНГ по запасам железной
руды (16,6 млрд т). Месторождения находятся в основном в Северном Казахстане.
Особое значение играют Качарское и Соколовско-Сарбайское месторождения.
Марганец
К наиболее крупным месторождениям марганца относятся Атасуское и Жездинское,
расположенные в Центральном Казахстане. В местных рудах содержание марганца
27%. Месторождения марганца были также обнаружены в Сарыарке.
Хром
99% месторождений хрома встречается в Мугоджарских горах. Большой
известностью пользуются Кемпирсайская и Донская группы месторождений,
содержащий высококачественные руды. Месторождения хромитов также открыты в
Костанайской и Восточно-Казахстанской областях.
Большой
известностью пользуются Кемпирсайская и Донская группы месторождений,
содержащий высококачественные руды. Месторождения хромитов также открыты в
Костанайской и Восточно-Казахстанской областях.
Никель
Значительные запасы никеля сосредоточены в Мугоджарах. Более 40 крупных
месторождений расположены на северо-востоке Сарыарки (окрестности Астаны) и в
Тургайском прогибе (Амангельдинская группа). В них запасы бокситов
незначительны. Казахстан занимает одно из первых мест СНГ по производству
алюминия.
Медь
Казахстан обладает огромными запасами медной руды. Основные промышленные
типы руд – медистые песчаники (71%) и медно-порфировые (24%). Самым крупным
месторождением руды медистых песчаников является Жезказган. Казахстан по добыче
меди занимает седьмое место в мире. 92% меди экспортируется в зарубежные страны.
Полиметаллы
Эти руды содержат ценные минералы – свинец и цинк, а также медные
соединения, золото, серебро и другие металлы. Богатейшие месторождения свинца и
цинка – Риддерское, Зыряновское и другие – находятся на Рудном Алтае. В местных
рудах много металлов, полиметаллические месторождения имеются в Текели – в
Жунгарском Алатау, Ачисае и Мыргалымсае – в горах Каратау.
Богатейшие месторождения свинца и
цинка – Риддерское, Зыряновское и другие – находятся на Рудном Алтае. В местных
рудах много металлов, полиметаллические месторождения имеются в Текели – в
Жунгарском Алатау, Ачисае и Мыргалымсае – в горах Каратау.
Золото
В Казахстане имеется 190 месторождений золота. Оно добывается на востоке
республики – на Алтае, в районе Калбинского хребта, на северо-западе – в
Жетыгаринском районе Костанайской области. Золотоносные месторождения на
северной окраине Центрального Казахстана (Степняк, Аксу, Майкаин) представлены
кварцевые жилы и россыпи. Небольшие залежи есть в Жунгарском и Заилийском
Алатау.
Редкие металлы К этим металлам относятся: вольфрам, молибден, ванадий, висмут, сурьма и прочие. Некоторые редкие метталлы имеются в полиметаллических месторождениях Жунгарии и Алтая.
Сообщение
d-элементы.
Ионы d-элементов (Zn, Mn, Fe, Cu, Co, Mo, Ni) имеют незаполненные
d-электронные слои. Это обуславливает различные степени окисления d-элементов,
их способность участвовать в различных окислительно-восстановительных
превращениях, возможность образовывать комплексные соединения. По сравнению с
рассмотренными выше s-элементами, d-элементы содержатся в организме в
значительно меньших количествах. Однако их роль в течении физиологических и
патологических процессов в организме человека огромна.
Это обуславливает различные степени окисления d-элементов,
их способность участвовать в различных окислительно-восстановительных
превращениях, возможность образовывать комплексные соединения. По сравнению с
рассмотренными выше s-элементами, d-элементы содержатся в организме в
значительно меньших количествах. Однако их роль в течении физиологических и
патологических процессов в организме человека огромна.
Цинк.
Цинк входит в состав большого числа ферментов и гормона инсулина. В
последние годы Zn особенно “повезло” в смысле обнаружения его новых
физиологических функций. Доказано, что он необходим для поддержания нормальной
концентрации витамина А в плазме. Дефицит Zn вызывает замедление роста
животных, нарушение кожного и волосяного покрова. Высказано предположение, что
постоянный недостаток цинка в рационе очень разнообразно и сказывается главным
образом на росте, образовании крови и функции половых желёз. В избыточных
против нормы количествах марганцовые соединения действуют как яды, вызывая
хроническое отравление. Последнее может быть обусловлено вдыханием содержащей
эти соединения пыли.
Последнее может быть обусловлено вдыханием содержащей
эти соединения пыли.
Железо.
В организме человека железо встречается в виде двух катионов: Fe2+
и Fe3+. Оно в основном входит в состав гемоглобина, содержащегося в эритроцитах
(80% от количества). Таким образом, общее содержание железа определяется
главным образом объёмом крови. Кроме того, в организме существует
депонированное (запасное) железо в виде высокомолекулярного железосодержащего
белка (ферритина), находящегося в клетках печени и селезёнки. Клеточный фонд
железа представляет железо клеточных ферментов дыхания, а в мышцах железо
гемоглобина. Обмен железа между плазмой крови и лимфой происходит при помощи
транспортного белка (трансферрина). Одна молекула трансферрина связывает 2
атома железа. Основной путь обмена железа таков: железо плазмы железо
эритроцитовгемолиз железо плазмы. Обычно среднее содержание железа в организме
не превышает 5 г. В случае потерь крови потребность в железе превышает его
поступление в организм с пищей. При внутривенных инъекциях железо вводится в
виде аскорбата, цитрата или коллоидных комплексов с углеводами, т.е. в виде
слабо ионизированных соединений.
При внутривенных инъекциях железо вводится в
виде аскорбата, цитрата или коллоидных комплексов с углеводами, т.е. в виде
слабо ионизированных соединений.
Медь.
Важное биологическое значение имеют катионы Cu+ и Cu2+. В таком
виде медь входит в важнейшие комплексные соединения с белками (медь-протеиды).
Медь-протеиды, подобно гемоглобину, участвуют в переносе кислорода. Число
атомов меди в них различное: 2- в молекуле цереброкуперина, участвующего в
хранении запаса кислорода в мозгу, и 8- в молекуле церулоплазмина,
способствующего переносу кислорода в плазме. Медь активирует синтез
гемоглобина, участвует в процессах клеточного дыхания, в синтезе белка,
образовании костной ткани и пигмента кожных покровов. Ионы меди входят в состав
медьсодержащих ферментов. Наиболее используемым в медицине соединением меди
является сульфат меди CuSO4 • 5h3O, называемый медным купорсом. Сульфат меди
(II) обладает вяжущим и прижигающим действаием. Применяется в виде глазных
капель при отравлении белым фосфором. Все соли меди ядовиты, поэтому медную
посуду лудят, т.е. покрывают слоем олова, чтобы предотвратить возможность
образования медных солей.
Все соли меди ядовиты, поэтому медную
посуду лудят, т.е. покрывают слоем олова, чтобы предотвратить возможность
образования медных солей.
Биологическая роль хрома
В 1973 г канадский доктор Эдвард Конецко сообщил о том, что хром, принимаемый по 1 мг через день, цинк (50 мг ежедневно) и циствин (5 мг ежедневно) способны предупредить и даже лечить катаракту. Однако хром и цинк должны сочетаться с аминокислотами, так как только таким образом они могут переходить в усвояемую форму. Это означает, что микроэлементы усваиваются только в органических соединениях. Поэтому все эти источники надо искать в натуральных продуктах, а не в лекарственных препаратах.
Хром – один из биогенных элементов,
постоянно входит в состав тканей растений и животных. У животных хром участвует
в обмене липидов, белков (входит в состав фермента трипсина), углеводов. Хром
необходим нашему организму в определенных дозах, но если его слишком много, он
опасен.
Хром
необходим нашему организму в определенных дозах, но если его слишком много, он
опасен.
Шестивалентный хром транспортируется в клетки человеческого организма с помощью сульфатного транспортного механизма благодаря своей близости к сульфатам и хроматам по структуре и заряду. Трёхвалентный хром, более часто встречающийся, не транспортируется в клетки. Усваивается только в составе органических соединений.Хром занимает центральное место в метаболизме сахара.
Лучшим средством для
диетологического лечения многих болезней, связанных с обменом сахара является
хром. При регулярном приеме этот микроэлемент оказывает значительное лечебное
воздействие на целый спектр нарушений здоровья, которые вызывает или отягощает резистентность
к инсулину, включая ожирение, гипогликемию (неустойчивый уровень сахара в
крови), инсульт, гипертонию, болезнь Крона и колит, язвы, гастрит, рассеянный
склероз, болезнь Миньера, мигрени, предменструальный синдром, эпилепсию и
множество психических расстройств.
Направления, по которым действует хром в организме человека:
1. Уменьшает тягу к сахару, позволяет легче придерживаться низкоуглеводного режима питания;
2. Даже без соблюдения диеты может увеличивать общую костно-мышечную массу тела; ускоряет обмен веществ и сжигает лишний жир;
3. Помогает предотвратить потерю мышечной ткани при намеренном ограничении калорийности рациона питания;
4. Поддерживает структурную целостность РНК, ДНК, защищает от разрушения, являясь их компонентом;
5. Участвует в жировом обмене, координирует содержание холестерина в крови. Также он вовлечен в процесс регуляции работы сердца, кровеносных сосудов. Способствует поддержанию оптимального давления крови;
6. Содействует выведению токсических веществ, радионуклидов;
Терапевтическая ценность хрома в
других областях не так твердо установлена, как в случаях диабета,
сердечно-сосудистых заболеваний и гипертонии, однако она может распространяться
и на многие другие заболевания. Например, он может облегчать хронические
головные боли и помогать лечению угревой сыпи, которая, по-видимому, отчасти
обусловлена нарушением обмена инсулина. Хром укрепляет кости, повышая уровень
дегидроэпиандростерона (ДГЭА), и потому он может входить в программу лечения
остеопороза. И хотя мы не можем утверждать, что хром предотвращает глаукому, он
может (вместе с витамином С) сдерживать рост внутриглазного давления.
Например, он может облегчать хронические
головные боли и помогать лечению угревой сыпи, которая, по-видимому, отчасти
обусловлена нарушением обмена инсулина. Хром укрепляет кости, повышая уровень
дегидроэпиандростерона (ДГЭА), и потому он может входить в программу лечения
остеопороза. И хотя мы не можем утверждать, что хром предотвращает глаукому, он
может (вместе с витамином С) сдерживать рост внутриглазного давления.
Важнейшая биологическая роль
микроэлемента хрома состоит в регуляции углеводного обмена и уровня глюкозы
крови, поскольку хром является компонентом низкомолекулярного органического
комплекса – «фактора толерантности к глюкозе». Он нормализует проницаемость
клеточных мембран для глюкозы, процессы использования ее клетками и
депонирования, и в этом плане функционирует совместно с инсулином.
Предполагают, что они образуют комплекс, регулирующий уровень глюкозы в крови.
Хром увеличивает чувствительность клеточных рецепторов тканей к инсулину,
облегчая их взаимодействие и уменьшая потребность организма в инсулине. Он
способен усиливать действие инсулина во всех метаболических процессах,
регулируемых этим гормоном. Поэтому хром необходим больным сахарным диабетом,
поскольку уровень его в крови у таких больных понижен. Более того, высокий
дефицит этого микроэлемента может стать причиной диабетоподного состояния .
Он
способен усиливать действие инсулина во всех метаболических процессах,
регулируемых этим гормоном. Поэтому хром необходим больным сахарным диабетом,
поскольку уровень его в крови у таких больных понижен. Более того, высокий
дефицит этого микроэлемента может стать причиной диабетоподного состояния .
Гидроксид меди (II), характеристика, свойства и получение, химические реакции
Гидроксид меди (II), характеристика, свойства и получение, химические реакции.
Гидроксид меди (II) – неорганическое вещество, имеет химическую формулу Cu(OH)2.
Краткая характеристика гидроксида меди (II)
Физические свойства гидроксида меди (II)
Получение гидроксида меди (II)
Химические свойства гидроксида меди (II)
Химические реакции гидроксида меди (II)
Применение и использование гидроксида меди (II)
Краткая характеристика гидроксида меди (II):
Гидроксид меди (II) – неорганическое кристаллическое или аморфное вещество ярко-голубого цвета.
Химическая формула гидроксида меди (II) Cu(OH)2.
Не растворяется в воде. Растворимость в воде 0,000673 г/100 мл.
Не горит. Термически неустойчивый. При нагревании до 70-90 °C порошка Cu(ОН)2 или его водных суспензий разлагается на оксид меди (II) и воду.
Гидроксид меди токсичен.
Физические свойства гидроксида меди (II):
| Наименование параметра: | Значение: |
| Химическая формула | Cu(OH)2 |
| Синонимы и названия иностранном языке | сopper(II) hydroxide (англ.) |
| Тип вещества | неорганическое |
| Внешний вид | ярко-голубые кристаллы либо ярко-голубая водная суспензия (аморфное состояние) |
| Цвет | ярко-голубой |
| Вкус | —* |
| Запах | — |
Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм. ) ) | твердое вещество |
| Плотность (состояние вещества – твердое вещество – кристаллы, при 20 °C), кг/м3 | 3370 |
| Плотность (состояние вещества – твердое вещество – кристаллы, при 20 °C), г/см3 | 3,37 |
| Температура разложения, °C | 70 |
| Гигроскопичность | отсутствует |
| Молярная масса, г/моль | 97,561 |
* Примечание:
— нет данных.
Получение гидроксида меди (II):
В лаборатории гидроксид меди (II) получается действием на холоде растворимых гидроксидов металлов на растворимые соли меди в результате следующих химических реакций:
- 1. в результате взаимодействия нитрата меди (II) с гидроксидом натрия:
Cu(NO3)2 + 2NaOH → Cu(OH)2 + 2NaNO3.
При этом гидроксид меди (II) выпадает в осадок.
- 2. в результате взаимодействия сульфата меди (II) и гидроксида калия:
2KOH + CuSO4 → Cu(OH)2 + K2SO4.
При этом гидроксид меди (II) выпадает в осадок.
- 3. в результате взаимодействия нитрата меди (II) с гидроксидом калия:
Cu(NO3)2 + 2KOH → Cu(OH)2 + 2KNO3.
При этом гидроксид меди (II) выпадает в осадок.
- 4. в результате взаимодействия сульфата меди (II) с гидроксидом кальция:
Ca(OH)2 + CuSO4 → Cu(OH)2 + CaSO4.
При этом гидроксид меди (II) выпадает в осадок.
- 5. в результате взаимодействия хлорида меди (II) с гидроксидом натрия:
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl.
При этом гидроксид меди (II) выпадает в осадок.
Химические свойства гидроксида меди (II). Химические реакции гидроксида меди (II):
Гидроксид меди (II) – слабое основание. Проявляет амфотерные свойства.
Химические свойства гидроксида меди (II) аналогичны свойствам гидроксидов других амфотерных металлов. Поэтому для него характерны следующие химические реакции:
Поэтому для него характерны следующие химические реакции:
1. реакция гидроксида меди (II) с ортофосфорной кислотой:
Cu(OH)2 + H3PO4 → Cu3(PO4)2 + 6H2O.
В результате реакции образуются фосфат меди (II) и вода. В качестве исходного вещества используется разбавленный раствор ортофосфорной кислоты.
2. реакция гидроксида меди (II) с азотной кислотой:
Cu(OH)2 + 2HNO3 → Cu(NO3)2 + 2H2O.
В результате реакции образуются нитрат меди (II) и вода. В качестве исходного вещества используется разбавленный раствор азотной кислоты.
Аналогично проходят реакции гидроксида меди (II) и с другими кислотами.
3. реакция гидроксида меди (II) и сероводорода:
Cu(OH)2 + H2S → CuS + 2H2O.
В результате реакции образуются сульфид меди (II) и вода. В ходе реакции используется суспензия гидроксида меди (II) и насыщенный раствор сероводорода.
В ходе реакции используется суспензия гидроксида меди (II) и насыщенный раствор сероводорода.
4. реакция гидроксида меди (II) и оксида углерода:
2Cu(OH)2 + CO2 → Cu2(OH)2CO3 + H2O.
В результате реакции образуются карбонат-дигидроксид димеди (II) и вода.
5. реакция гидроксида меди (II) и оксида селена:
SeO2 + Cu(OH)2 → CuSeO3 + 2H2O (to).
В результате реакции образуются селенит меди (II) и вода. Реакция протекает при нагревании.
6. реакция гидроксида меди (II) и гидроксида натрия:
Cu(OH)2 + 2NaOH → Na2[Cu(OH)4].
В результате реакции образуется тетрагидроксокупрат натрия.
7. реакция гидроксида меди (II), аммиака и воды:
Cu(OH)2 + 4NH3 + 2H2O → [Cu(NH3)4(H2O)2](OH)2.
В результате реакции образуется гидроксид диакватетрааммин меди (I).
8. реакция гидроксида меди (II) и гидрата аммиака:
Cu(OH)2 + 4(NH3•H2O) → [Cu(NH3)4](OH)2 + 4H2O.
В результате реакции образуются гидроксид тетрааммин меди (II) и вода. Гидрат аммиака используется в ходе реакции в виде концентрированного раствора.
Гидроксид тетрааммин меди (II) имеет интенсивный сине-фиолетовый цвет, поэтому его используют в аналитической химии для определения малых количеств ионов Cu2+ в растворе.
9. реакция гидроксида меди (II) с кислородом:
4Cu(OH)2 + O2 ⇄ 4Cu2O3 + 2H2O.
При длительном нахождении на воздухе, обогащённом кислородом, гидроксид меди (II) вступает в обратимую реакцию с кислородом, образуя грязно-красный оксид меди (III). В результате реакции образуется оксид меди (III) и вода.
4Cu(OH)2 + O2 → 4CuО(ОН) + H2O.
При избытке влаги может образоваться гидроксид куприла (III) и вода.
10. реакция термического разложения гидроксида меди (II):
Cu(OH)2 → CuO + H2O (t = 70-90 oC).
В результате реакции образуются оксид меди (II) и вода.
Применение и использование гидроксида меди (II):
Гидроксид меди (II) используется:
– как пигмент при производстве стекол, керамики, красок,
– как катализатор в химической промышленности.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
гидроксид меди (II) реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие гидроксида меди (II) реакции
Коэффициент востребованности 12 084
Что такое медь? – Определение, местонахождение, свойства, использование
Соли меди(II) представляют собой обычно встречающиеся соединения, которые часто придают синий или зеленый цвет минералам, таким как азурит, малахит и бирюза, и исторически широко использовались в качестве пигментов. Медь, используемая в строительстве, обычно для кровли, окисляется с образованием зеленой зелени. Соединения меди используются для изготовления бактериостатических средств, фунгицидов и консервантов для древесины.
Медь, используемая в строительстве, обычно для кровли, окисляется с образованием зеленой зелени. Соединения меди используются для изготовления бактериостатических средств, фунгицидов и консервантов для древесины.
Это мягкий, ковкий и пластичный металл с высокой тепло- и электропроводностью. Цвет свежеобнаженной поверхности чистой меди розовато-оранжевый. Медь используется в качестве проводника тепла и электричества, строительного материала и компонента нескольких металлических сплавов, в том числе стерлингового серебра в ювелирных изделиях, мельхиора в морском оборудовании и монетах, а также константана в тензодатчиках и термопарах для измерения температуры.
Медь имеет химический символ Cu и атомный номер 29. Медь требуется всем живым организмам в качестве микроэлемента в рационе, поскольку она является компонентом комплекса дыхательных ферментов цитохром-с-оксидазы. Медь в основном содержится в печени, мышцах и костях человека.
Наличие меди
- Медь образуется в массивных звездах и содержится в земной коре в концентрации около 50 ppm.

- Медь содержится в различных минералах, включая самородную медь, сульфиды меди, такие как халькопирит, борнит, дигенит, ковеллит и халькоцит, сульфосоли меди, карбонаты меди, такие как азурит и малахит, а также медь (I) или медь (II) оксиды, такие как куприт.
- Медь является 25-м -м -м самым распространенным элементом в земной коре, на долю которого приходится 50 частей на миллион (ppm), по сравнению с 75 частями на миллион для цинка и 14 частями на миллион для свинца.
Свойства меди
- Медь представляет собой красноватый металл с гранецентрированной кубической кристаллической структурой.
- Благодаря своей полосчатой структуре он отражает красный и оранжевый свет и поглощает другие частоты в видимом спектре, придавая ему красивый красноватый цвет.
- Он податлив, пластичен и является отличным проводником тепла и электричества.
- Он мягче цинка и может быть отполирован до блестящего блеска.
- Медь представляет собой металл с низкой химической активностью.

- Во влажном воздухе образует на поверхности зеленоватую пленку, называемую патиной, которая защищает металл от дальнейшего окисления.
Использование меди
Сульфат меди широко используется в качестве яда в сельском хозяйстве и в качестве альгицида при очистке воды. Хотя многие люди не думают, что медь используется для чего-либо, кроме монет, она является важным компонентом в производстве бронзы.
Медь была первым металлом, над которым работали люди в истории. Бронзовый век был назван в честь открытия, что его можно закалить с небольшим количеством олова, чтобы образовать легированную бронзу. Он используется в широком спектре продуктов, включая банки, фольгу для приготовления пищи и кастрюли, а также электрические кабели, самолеты и космические аппараты.
Электропроводность особенно важна, поскольку на проволоку приходится более половины мирового потребления меди. Химическое осаждение из паровой фазы, которое используется в производстве полупроводников, представляет собой процесс осаждения тонких медных пленок из газофазного прекурсора. Медь в основном используется в виде сплава золота и серебра, и ее часто покрывают тем или иным сплавом.
Медь в основном используется в виде сплава золота и серебра, и ее часто покрывают тем или иным сплавом.
Медь в основном используется в электрооборудовании (60%) и строительстве (20%), а также в промышленном оборудовании, таком как теплообменники (15%) и сплавы (5%). Бронза, латунь (медно-цинковый сплав), медь-олово-цинк, который был достаточно прочным для изготовления ружей и пушек и был известен как бронза, а также медь и никель, известный как мельхиор, который был предпочтительным металлом для мелких купюр. монеты, являются основными давно зарекомендовавшими себя медными сплавами. Медь — отличный выбор для электропроводки, потому что с ней легко работать, ее можно вытянуть в тонкую проволоку и она обладает высокой электропроводностью.
Медь в окружающей среде
Медь является очень распространенным веществом, которое естественным образом встречается в окружающей среде и распространяется в результате естественных процессов. Медь широко используется человеком.
Производство меди в мире продолжает расти. По сути, это означает, что все большее количество меди попадает в окружающую среду. Реки откладывают на своих берегах загрязненные медью шламы в результате сброса медьсодержащих сточных вод. Медь попадает в атмосферу в основном при сжигании ископаемого топлива. Медь в воздухе будет оставаться там в течение длительного периода времени, прежде чем осядет, когда начнется дождь. Затем он в первую очередь попадет в почву. В результате почвы могут содержать значительное количество меди после осаждения меди из воздуха.
Медь может попадать в окружающую среду как из природных, так и из антропогенных источников. Переносимая ветром пыль, гниющая растительность, лесные пожары и морские брызги являются примерами природных источников. Уже выявлено несколько видов деятельности человека, которые способствуют выбросу меди. Горнодобывающая промышленность, производство металлов, производство древесины и производство фосфорных удобрений являются некоторыми другими примерами.
Медь очень распространена в окружающей среде, потому что она выделяется как естественным путем, так и в результате деятельности человека. Медь часто обнаруживают вблизи шахт, промышленных объектов, свалок и мест захоронения отходов.
Примеры вопросов
Вопрос 1: Как можно использовать медь?
Ответ:
Медь в основном используется в электропроводке, кровле, сантехнике и промышленном оборудовании. Медь в чистом виде используется в большинстве этих приложений. Однако его можно легировать другими металлами для достижения более высоких уровней твердости. Медные провода использовались в производстве, распределении, передаче и электронных схемах электроэнергии. На самом деле электропроводка потребляет более половины всей добываемой меди.
Вопрос 2. Почему компания Copper не следует принципу Ауфбау?
Ответ:
Из-за относительно небольшой энергетической щели между 3d- и 4s-орбиталями, а также дополнительной стабильности, обеспечиваемой полностью заполненной d-орбиталью, электронная конфигурация меди не подчиняется принципу Ауфбау.
.
Вопрос 3. Что такое принцип Ауфбау?
Ответ:
Принцип Ауфбау определяет, как электроны заполняются на атомных орбиталях атома в его основном состоянии. Согласно этой теории, электроны заполняют атомные орбитали в порядке возрастания орбитального энергетического уровня. Согласно принципу Ауфбау, в первую очередь заполняются самые низкие энергетические уровни доступных атомных орбиталей, а затем более высокие энергетические уровни.
Вопрос 4. Как медь влияет на человека?
Ответ:
Длительное воздействие меди может вызвать воспаление носа, горла и глаз, а также головные боли, боли в животе, головокружение, рвоту и диарею. Чрезмерно высокое поглощение меди может вызвать повреждение печени и почек, а также смерть. Пока не установлено, является ли медь канцерогенной.
Вопрос 5. Является ли медь токсичной для человека?
Ответ:
Медь необходима для хорошего здоровья.
С другой стороны, более высокие дозы могут быть вредными. Медная пыль может вызывать головные боли, головокружение, тошноту и диарею, раздражая нос, рот и глаза.
Элемент Медь — Атом Меди
| |||||
| Общий | |||||
|---|---|---|---|---|---|
| Имя, символ, номер | медь, Cu, 29 | ||||
| Химическая серия | переходные металлы | ||||
| Группа, период, блок | 11 , 4, д | ||||
| Плотность, твердость | 8920 кг/м 3 , 3,0 | ||||
| Внешний вид | медь, металлик | ||||
| Атомный недвижимость | |||||
| Атомный вес | 63,546 а. е.м. е.м. | ||||
| Атомный радиус (расч.) | 135 (145) м. | ||||
| Ковалентный радиус | 138 вечера | ||||
| Радиус Ван-дер-Ваальса | 140 часов | ||||
| Электронная конфигурация | [Ar]3d 10 4s 1 | ||||
| e – на уровень энергии | 2, 8, 18, 1 | ||||
| Степени окисления (оксид) | 2 ,1 (умеренно основной) | ||||
| Кристаллическая структура | кубический, гранецентрированный | ||||
| Физический недвижимость | |||||
| Состояние вещества | твердый (диамагнитный) | ||||
| Температура плавления | 1357,6 К (1084,6 С / 1984,3 F) | ||||
| Точка кипения | 2840 К (2567,2°С / 4653°F) | ||||
| Молярный объем | 7. 11 10 -6 м 3 /моль 11 10 -6 м 3 /моль | ||||
| Теплота парообразования | 300,3 кДж/моль | ||||
| Теплота плавления | 13,05 кДж/моль | ||||
| Давление паров | 0,0505 Па при 1358 К | ||||
| Скорость звука | 3570 м/с при 293,15 К | ||||
| Разное | |||||
| Электроотрицательность | 1,9 (шкала Полинга) | ||||
| Удельная теплоемкость | 380 Дж/(кг*К) | ||||
| Электропроводность | 59,6 10 6 /(м*Ом) | ||||
| Теплопроводность | 401 Вт/(м*К) | ||||
| 1 st потенциал ионизации | 745,5 кДж/моль | ||||
| 2 nd потенциал ионизации | 1957,9 кДж/моль | ||||
| 3 rd потенциал ионизации | 3555 кДж/моль | ||||
| 4 й потенциал ионизации | 5536 кДж/моль | ||||
СИ
единицы и STP используются, если не указано иное. | |||||
Медь — химический элемент в периодической таблице, который имеет символ Cu и атомный номер 29.
Примечательно характеристики
Медь – металл красноватого цвета с высоким
электро- и теплопроводность (среди чистых
металлов при комнатной температуре только серебро имеет
более высокая электропроводность). Медь вполне может
быть самым старым используемым металлом, как медные артефакты
датируемые 8700 г. до н.э. Помимо того
входит в состав различных руд, медь можно найти в
металлическая форма (т.е. самородная медь )
в некоторых местах.
В греческие времена металл был известен под названием Чалкос . В римские времена стало известно как aes Cyprium , потому что его очень много был добыт на Кипре. Отсюда и пошла фраза упрощенный до cuprum , а затем англизированный на английский медь .
Применение
Медь ковкая и ковкая, используется широко, в таких продуктах, как:
- Медная проволока.
- Медная сантехника.
- Дверные ручки и прочая арматура в домах.
- Скульптура: Статуя Свободы, например, содержит 179 000 фунтов меди.
- Электромагниты.
- Двигатели, особенно электромагнитные двигатели.

- Паровая машина Уатта.
- Реле электрические, электрические шины и электрические выключатели.
- Вакуумные трубки, электронно-лучевые трубки и магнетроны в микроволновых печах.
- Волноводы для микроволнового излучения.
- Медь все чаще используется в интегрированных цепей, заменив алюминий из-за его превосходная проводимость.
- В качестве компонента монет.
- В кухонной посуде, такой как сковороды.
- Большинство столовых приборов (ножи, вилки, ложки) содержат немного меди (нейзильбер).
- Стерлинговое серебро, если оно будет использоваться в столовой посуде,
должен содержать несколько процентов меди.

- В качестве компонента керамических глазурей и для окрашивания стакан.
- Музыкальные инструменты, особенно духовые.
- В качестве биостатической поверхности в больницах и для линейные части кораблей для защиты от ракушек и мидии.
- Соединения, такие как раствор Фелинга, имеют приложения по химии.
- Сульфат меди (II) используется как яд и очиститель воды.
История
Медь была известна некоторым древнейшим цивилизациям
зарегистрирована и имеет историю использования, которая находится на
не менее 10 000 лет. Медный кулон был найден
на территории нынешнего северного Ирака, датируемого 8700 г.
ДО Н.Э. К 5000 г. до н.э. появляются следы выплавки меди,
рафинирование меди из простых оксидов меди
Например, малахит или азурит. Самые ранние признаки
использования золота, напротив, появляются около 4000 г. до н.э.
Медный кулон был найден
на территории нынешнего северного Ирака, датируемого 8700 г.
ДО Н.Э. К 5000 г. до н.э. появляются следы выплавки меди,
рафинирование меди из простых оксидов меди
Например, малахит или азурит. Самые ранние признаки
использования золота, напротив, появляются около 4000 г. до н.э.
Есть медные и бронзовые артефакты из Шумера
города, датируемые 3000 г. до н.э., и египетские артефакты
в меди и меди, легированной оловом, почти как
старый. В одной пирамиде медная водопроводная система
было обнаружено, что ему 5000 лет. Египтяне
обнаружил, что добавление небольшого количества олова сделало
металл легче отливать, поэтому встречаются бронзовые сплавы
в Египте почти сразу после обнаружения меди. Использовать
меди в древнем Китае датируется как минимум 2000 г.
ДО Н.Э. К 1200 г. до н.э. производились превосходные изделия из бронзы.
в Китае. Обратите внимание, что на эти даты влияет
войны и завоевания, так как медь легко плавится
вниз и повторно использовать. В Европе Эци Ледяной Человек,
был найден хорошо сохранившийся мужчина, датируемый 3200 г. до н.э.
топором с медным наконечником из металла 99,7%
чистый. Высокий уровень мышьяка в его волосах предполагает
занимался выплавкой меди.
Использовать
меди в древнем Китае датируется как минимум 2000 г.
ДО Н.Э. К 1200 г. до н.э. производились превосходные изделия из бронзы.
в Китае. Обратите внимание, что на эти даты влияет
войны и завоевания, так как медь легко плавится
вниз и повторно использовать. В Европе Эци Ледяной Человек,
был найден хорошо сохранившийся мужчина, датируемый 3200 г. до н.э.
топором с медным наконечником из металла 99,7%
чистый. Высокий уровень мышьяка в его волосах предполагает
занимался выплавкой меди.
Использование бронзы было настолько
эпоха цивилизации, которую он назвал
Бронзовый век. Переходный период в некоторых
регионы между предшествующим периодом неолита
а бронзовый век называют энеолитом,
с использованием некоторых инструментов из меди высокой чистоты
рядом с каменными орудиями.
Латунь, сплав цинка и меди, была известна грекам, но впервые широко использовалась римляне.
Медь ассоциировалась с богиней Афродитой/Венерой в мифологии и алхимии, благодаря своему блестящему красота, его древнее использование в производстве зеркал, и его ассоциация с Кипром, которая была священной к богине. В алхимии символ меди был также символом планеты Венера.
Биологическая роль
Медь необходима всем высшим растениям и
животные. Медь содержится в различных ферментах,
включая медные центры цитохром с оксидазы,
Cu-Zn-содержащий фермент супероксиддисмутаза,
и является центральным металлом в переносчике кислорода
пигмент гемоцианин. Кровь подковы
краб, Limulus polyphemus использует медь
а не железо для транспорта кислорода.
Кровь подковы
краб, Limulus polyphemus использует медь
а не железо для транспорта кислорода.
Рекомендуемая суточная доза меди для здоровых взрослых составляет 0,9 мг/день.
Медь в основном переносится кровотоком на белок плазмы, называемый церулоплазмином. Хотя когда медь впервые всасывается в кишечнике, транспортируется в печень в связанном виде с альбумином.
Наследственное заболевание, называемое болезнью Вильсона. заставляет организм удерживать медь, так как она не выделяется печенью с желчью. Это заболевание, при отсутствии лечения может привести к повреждению головного мозга и печени.
Распространение
Медь встречается в виде самородной меди в минеральной форме. Минералы, такие как карбонаты азурита и малахита
являются источниками меди, как и сульфиды, такие как
халькопирит (CuFeS 2 ), борнит (Cu 5 FeS 4 ),
ковеллит (CuS), халькоцит (Cu 2 S)
и оксиды типа куприта (Cu 2 O).
Минералы, такие как карбонаты азурита и малахита
являются источниками меди, как и сульфиды, такие как
халькопирит (CuFeS 2 ), борнит (Cu 5 FeS 4 ),
ковеллит (CuS), халькоцит (Cu 2 S)
и оксиды типа куприта (Cu 2 O).
Соединения
Существуют многочисленные сплавы меди – зеркало металл представляет собой сплав меди/олова, а латунь представляет собой сплав меди/цинка. сплав, а бронза представляет собой сплав меди с оловом.
Обычные степени окисления меди включают медь (I) состояние, Cu +1 и медь (II) состояние, Cu +2 .
Карбонат меди зеленого цвета, из которого
неповторимый внешний вид покрытых медью крыш или куполов
на некоторых зданиях.
Оксиды меди (например, оксид иттрия-бария-меди (YBa 2 Cu 3 O 7-´ ) или YBCO) составляют основу многих нетрадиционных сверхпроводники
Другие соединения: сульфид меди (II)
Изотопы
Два стабильных изотопа, 63 Cu и 65 Cu вместе с парой десятков радиоизотопы. Подавляющее большинство радиоизотопов имеют период полураспада порядка минут или меньше, самый долгоживущий, 64 Cu, имеет половину срок службы 12,7 часов, с двумя режимами затухания, ведущий на два отдельных продукта.
Меры предосторожности
Все соединения меди, кроме
иначе известные, должны рассматриваться как если бы они
были токсичны. Металл в порошкообразном состоянии
опасность пожара. 30 г сульфата меди потенциально
смертелен для человека. Медь в питьевой воде на
концентрации выше 1 мг/л могут окрашивать
одежду и предметы, выстиранные в воде. Предлагаемый
безопасный уровень меди в питьевой воде для человека
варьируется в зависимости от источника, но, как правило,
ориентировочно 1,5-2 мг/л. DRI терпимо
Верхний уровень потребления диетической меди для взрослых
из всех источников составляет 10 мг/сут.
Металл в порошкообразном состоянии
опасность пожара. 30 г сульфата меди потенциально
смертелен для человека. Медь в питьевой воде на
концентрации выше 1 мг/л могут окрашивать
одежду и предметы, выстиранные в воде. Предлагаемый
безопасный уровень меди в питьевой воде для человека
варьируется в зависимости от источника, но, как правило,
ориентировочно 1,5-2 мг/л. DRI терпимо
Верхний уровень потребления диетической меди для взрослых
из всех источников составляет 10 мг/сут.
Горнодобывающая промышленность
Открытый медный рудник Эль-Чино в Нью-Мексико.
Большая часть меди в настоящее время добывается на крупных открытых
шахты в месторождениях, которые содержат менее одного
процентов меди. Примеры включают: Chuquicamata,
Шахта Чили и Эль Чино в Нью-Мексико.
Примеры включают: Chuquicamata,
Шахта Чили и Эль Чино в Нью-Мексико.
Медный концентрат обычно содержит от 25 до 30 процентов меди. Медный концентрат получается продукт после шахтной руды (содержащий менее 1 процентов меди) измельчали, измельчали и концентрировали.
Катодная медь состоит из 99,97% меди в листах размеры: 96 см х 95 см х 1 см, с массой около 100 кг. Это настоящий товар и продукт доставляется на биржи металлов в Нью-Йорке, Лондон и Шанхай. Химическая спецификация для электролитической меди – ASTM B 115-00.
Каталожные номера
- Лос-Аламосская национальная лаборатория – Медь ( http://periodic.lanl.gov/elements/29.html )
Внешняя ссылка
- EnvironmentalChemistry.
 com
Медь ( http://environmentalchemistry.com/yogi/periodic/Cu.html )
com
Медь ( http://environmentalchemistry.com/yogi/periodic/Cu.html ) - Синдром отравления медью ( http://www.healingedge.net/briefs_copper_tox.html )
- The Copper Page ( http://www.copper.org/)
- Фотографии Медный рудник Пэрис-Маунтин недалеко от Амлуха, Англси, Уэльс ( http://y2u.co.uk/&002_Images/Parys_Mountain_01.htm )
Медный минерал | Использование и свойства
Медь: Медь из Бисби, Аризона. Этот экземпляр имеет диаметр примерно 2,5 дюйма (6,4 сантиметра).
Что такое медь?
Родная медь элемент и минерал. Встречается в окисленных зонах месторождений меди; в гидротермальных жилах; в полостях базальта, контактировавших с гидротермальными растворами; а также в качестве заполнителей и заменителей пор в конгломератах, которые находились в контакте с гидротермальными растворами. Его редко можно найти в больших количествах, поэтому он редко является основной целью добычи полезных ископаемых. Большая часть производимой меди добывается из сульфидных месторождений.
Его редко можно найти в больших количествах, поэтому он редко является основной целью добычи полезных ископаемых. Большая часть производимой меди добывается из сульфидных месторождений.
РЕКЛАМА
Использование меди
Самородная медь, вероятно, была одним из первых металлов, обработанных древними людьми. Самородки металла можно было найти в ручьях в нескольких местах, а его свойства позволяли легко обрабатывать его без обязательной стадии обработки. Металлический блеск меди привлекал внимание людей. Сегодня большая часть меди производится из сульфидных руд.
Медь является отличным проводником электричества. Большая часть добываемой сегодня меди используется для проведения электричества — в основном в качестве проводки. Он также является отличным проводником тепла и используется в кухонной утвари, радиаторах и теплообменниках. Большие количества также используются для изготовления сплавов, таких как латунь (медь и цинк) и бронза (медь, олово и цинк). Медь также сплавляется с драгоценными металлами, такими как золото и серебро. Медь имеет много других применений.
Большие количества также используются для изготовления сплавов, таких как латунь (медь и цинк) и бронза (медь, олово и цинк). Медь также сплавляется с драгоценными металлами, такими как золото и серебро. Медь имеет много других применений.
Физические свойства меди | |
| Химическая классификация | Родной элемент |
| Цвет | Медно-красный на свежей поверхности, тускло-коричневый на потускневшей поверхности |
| Полоса | Медно-красный металлик |
| Блеск | Металлик |
| Прозрачность | Непрозрачный |
| Декольте | Нет |
| Твердость по Моосу | от 2,5 до 3 |
| Удельный вес | 8,9 |
| Диагностические свойства | Цвет, блеск, удельный вес, пластичность, пластичность |
| Химический состав | Медь, Cu |
| Кристаллическая система | Изометрия |
| Использование | Проводит электричество и тепло; проводка, электрические контакты и цепи; чеканка, сплавы |
Лучший способ узнать о минералах — изучить коллекцию небольших образцов, которые можно брать в руки, исследовать и наблюдать за их свойствами. Недорогие коллекции минералов доступны в магазине Geology.com. Правообладатель иллюстрации iStockphoto / Анна Усова.
Недорогие коллекции минералов доступны в магазине Geology.com. Правообладатель иллюстрации iStockphoto / Анна Усова.
| Другие минералы |
Найдите другие темы на Geology.com:
|
| ||
|
| ||
|
| ||
|
Cu: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
Кристаллическая структура меди
Твердотельная структура меди Гранецентрированная кубическая .
Кристаллическая структура может быть описана с точки зрения ее элементарной ячейки. Единичные Клетки повторяются в трехмерном пространстве, образуя структуру.
Параметры элементарной ячейки
Элементарная ячейка представлена параметрами решетки, которые являются длинами ребер ячейки. Постоянные решетки (a, b и c)
| a | b | c |
|---|---|---|
| 361.49 pm | 361.49 pm | 361.49 pm |
and the angles between them Lattice Angles (alpha, beta and gamma).
| alpha | beta | gamma |
|---|---|---|
| π/2 | π/2 | π/2 |
The positions of the atoms inside the unit cell are described by the set атомных позиций ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможные симметричные расположения частиц в трехмерном пространстве описываются 230 пространственными группами (219 различных типов или 230, если киральные копии считаются различными). Степени окисления
Степени окисления
| Атомный номер | 29 |
| Число электронов (без заряда) | 29 |
| Number of Protons | 29 |
| Mass Number | 64 |
| Number of Neutrons | 35 |
| Shell structure (Electrons per energy level) | 2, 8, 18, 1 |
| Электронная конфигурация | [AR] 3D10 4S1 |
| Валентность электроны | 3D10 4S1 |
| 3D10 4S1 | |
| 3D10 4S1 | |
| 3D10 4S1 | |
| 3D10 4S1 | |
| 3D10 4S1 | |
| )0133 | |
| Основные состояния окисления | 1, 2 |
| Состояния окисления | -2, 0, 1, 2, 3, 4 |
| Atomic Symbly Symbly (квант -номера) | |
(квант. /2 /2 |
Атомная модель меди Бора – количество электронов на энергетический уровень
Электронная конфигурация меди в основном состоянии – нейтральный атом меди
Сокращенная электронная конфигурация меди
Сокращенная электронная конфигурация нейтрального атома меди в основном состоянии [Ar] 3d10 4s1. Часть конфигурации меди, эквивалентная благородному газу предыдущего периода, обозначается аббревиатурой [Ar]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 3d10 4s1, электроны в самой внешней оболочке, определяют химические свойства элемента.
Полная электронная конфигурация нейтральной меди
Полная электронная конфигурация атома меди в основном состоянии. Полная электронная конфигурация
1s2 2s2 2p6 3s2 3p6 3d10 4s1
Электроны заполняются атомными орбиталями в порядке, определяемом принципом Ауфбау, принципом исключения Паули и правилом Хунда.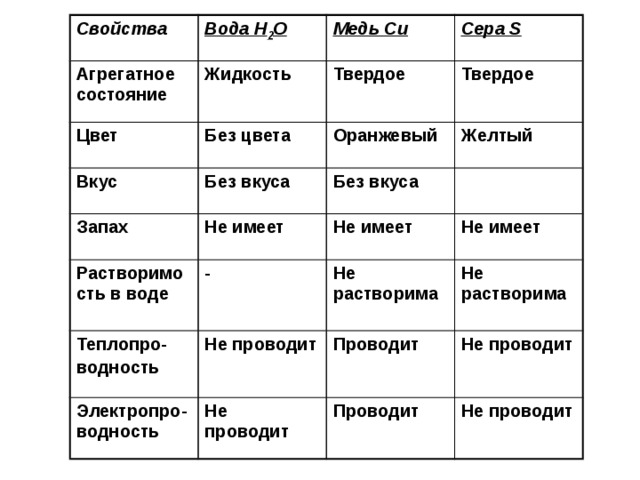
Атомная структура меди
Атомный радиус меди составляет 145 пм, а ковалентный радиус — 138 пм.
| Вычисленный атомный радиус | 145 пм (1,45 Å) |
| Atomic Radius Empirical | 135 pm (1.35 Å) |
| Atomic Volume | 7.124 cm3/mol |
| Covalent Radius | 138 pm (1. 38 Å) 38 Å) |
| Van der Waals Radius | 140 pm |
| Neutron Cross Section | 3.78 |
| Neutron Mass Absorption | 0.0021 |
Atomic Spectrum of Copper
Медь Химические свойства: Энергия ионизации меди и сродство к электрону
Сродство меди к электрону составляет 118,4 кДж/моль.
| Valence | 2 |
| Electronegativity | 1.9 |
| ElectronAffinity | 118.4 kJ/mol |
Ionization Energy of Copper
Refer to table below for Ionization energies of Copper
| Ionization energy number | Enthalpy – kJ/mol |
|---|---|
| 1st | 745.5 |
| 2nd | 1957.9 |
| 3rd | 3555 |
| 4th | 5536 |
| 5th | 7700 |
| 6th | 9900 |
| 7th | 13400 |
| 8th | 16000 |
| 9th | 19200 |
| 10th | 22400 |
| 11th | 25600 |
| 12th | 35600 |
| 13th | 38700 |
| 14th | 42000 |
| 15th | 46700 |
| 16th | 50200 |
| 17th | 53700 |
| 18th | 61100 |
| 19th | 64702 |
| 20th | 163700 |
| 21st | 174100 |
| 22nd | 184900 |
| 23rd | 198800 |
| 24th | 210500 |
| 25th | 222700 |
| 26th | 239100 |
| 27th | 249660 |
| 28th | 1067358 |
| 29th | 1116105 |
Медные физические свойства
См. Ниже таблицы для меди.
Ниже таблицы для меди.
Elastic Properties
| Young Modulus | 130 |
| Shear Modulus | 48 GPa |
| Bulk Modulus | 140 GPa |
| Poisson Ratio | 0.34 |
Hardness of Copper – Tests to Measure of Hardness of Element
| Mohs Hardness | 3 MPa |
| Твердость по Виккерсу | 369 МПа |
| Твердость по Бринеллю | 874 МПа |
| Electrical Conductivity | 500 S/m |
| Resistivity | 1.7e-8 m Ω |
| Superconducting Point | – |
Copper Теплопроводность
| Теплопроводность | 400 Вт/(м·К) |
| Тепловое расширение | 0. 0000165 /K 0000165 /K |
Copper Magnetic Properties
| Magnetic Type | Diamagnetic |
| Curie Point | – |
| Mass Magnetic Susceptibility | -1.08e-9 m3/kg |
| Молярная магнитная восприимчивость | -6,86e-11 м3/моль |
| Объемная магнитная восприимчивость | -0,00000963 |
| Refractive Index | – |
Acoustic Properties of Copper
| Speed of Sound | 3570 m/s |
Copper Thermal Properties – Enthalpies and thermodynamics
Refer to table ниже для тепловых свойств меди
| Температура плавления | 1357,77 K (1084,62°C, 1984,3159999999996 °F) |
| Температура кипения | 3200 K (2926. 85°C, 5300.33 °F) 85°C, 5300.33 °F) |
| Critical Temperature | – |
| Superconducting Point | – |
Enthalpies of Copper
| Heat of Fusion | 13.1 кДж/моль |
| Теплота испарения | 300 кДж/моль |
| Теплота сгорания | – |
Свойства ядерной меди Iso0411
Медь состоит из 29 изотопов, содержащих от 52 до 80 нуклонов. Медь имеет 2 стабильных природных изотопа.
Изотопы меди – Встречающиеся в природе стабильные изотопы: 63Cu, 65Cu.
| Isotope | Z | N | Isotope Mass | % Abundance | T half | Decay Mode |
|---|---|---|---|---|---|---|
| 52Cu | 29 | 23 | 52 | Synthetic | ||
| 53Cu | 29 | 24 | 53 | Synthetic | ||
| 54Cu | 29 | 25 | 54 | Synthetic | ||
| 55Cu | 29 | 26 | 55 | Synthetic | ||
| 56Cu | 29 | 27 | 56 | Synthetic | ||
| 57Cu | 29 | 28 | 57 | Synthetic | ||
| 58Cu | 29 | 29 | 58 | Synthetic | ||
| 59Cu | 29 | 30 | 59 | Синтетический | ||
| 60CU | 29 | 31 | 60 | Синтетик | 33333333333333333333333333333333333333333333333333333333333333333333333339н. | 61 | Synthetic |
| 62Cu | 29 | 33 | 62 | Synthetic | ||
| 63Cu | 29 | 34 | 63 | 69.17% | Stable | N/A |
| 64Cu | 29 | 35 | 64 | Synthetic | Stable | |
| 65Cu | 29 | 36 | 65 | 30.83% | Stable | N/A |
| 66Cu | 29 | 37 | 66 | Synthetic | ||
| 67Cu | 29 | 38 | 67 | Synthetic | ||
| 68Cu | 29 | 39 | 68 | Synthetic | ||
| 69Cu | 29 | 40 | 69 | Synthetic | ||
| 70Cu | 29 | 41 | 70 | Synthetic | ||
| 71Cu | 29 | 42 | 71 | Synthetic | ||
| 72Cu | 29 | 43 | 72 | Synthetic | ||
| 73Cu | 29 | 44 | 73 | Synthetic | ||
| 74Cu | 29 | 45 | 74 | Synthetic | ||
| 75Cu | 29 | 46 | 75 | Synthetic | ||
| 76Cu | 29 | 47 | 76 | Synthetic | ||
| 77Cu | 29 | 48 | 77 | Synthetic | ||
| 78Cu | 29 | 49 | 78 | Synthetic | ||
| 79Cu | 29 | 50 | 79 | Synthetic | ||
| 80Cu | 29 | 51 | 80 | Synthetic |
Химическая формула меди Свойства и степень окисления
Жасмин Гровер
Старший специалист по содержанию | Обновлено — 10 июня 2022 г.
Медь – это материал, который мы ежедневно используем как непосредственно в виде проводки и двигателей, так и косвенно в сплавах . Вокруг нас очень много вещей, сделанных из меди и сплавов на ее основе. Медь окружает нас повсюду, независимо от того, открываете ли вы кран или используете какие-либо бытовые приборы в своем доме, именно медь помогает доставлять нам воду и электричество. Поскольку это хороший проводник р электричества, он в основном используется в генераторах и двигателях для электропроводки, а также используется в электротоварах. Медь также используется в водопроводных трубах, поскольку она не подвержена коррозии, а также из-за ее высокой пластичности медные трубы можно легко согнуть и придать форму, не ломая. 9Элемент 0003 Медь , обозначаемая Cu, является важным металлом в нашей жизни. В этой статье мы рассмотрим химическую формулу меди, ее свойства и степень окисления.
Содержание
|
27 Что такое медь?
Медь представляет собой химический элемент, который обозначается символом Cu (происходит от латинского слова cuprum) и имеет атомный номер 29. Он присутствует в группе 11) периодической таблицы. Медь является очень хорошим проводником электричества, а также тепла, она мягкая, ковкая и пластичная по своей природе. Медь имеет красновато-золотистый цвет, но свежеобнаженная чистая медь имеет розовато-оранжевый цвет. Если говорить об удобстве использования, то медь является одним из немногих металлов, которые можно непосредственно использовать в природной металлической форме.
Он присутствует в группе 11) периодической таблицы. Медь является очень хорошим проводником электричества, а также тепла, она мягкая, ковкая и пластичная по своей природе. Медь имеет красновато-золотистый цвет, но свежеобнаженная чистая медь имеет розовато-оранжевый цвет. Если говорить об удобстве использования, то медь является одним из немногих металлов, которые можно непосредственно использовать в природной металлической форме.
Медь
- Это первый металл, который был выплавлен в 5000 г. до н.э. из сульфидных руд.
- Медь – первый металл, которому придали форму с помощью формы в 4000 г. до н.э.
- Это также самый первый металл, который был сплавлен с другим металлом, оловом, для получения бронзы (3500 г. до н.э.).
Подробнее: Теплопроводность меди
Степень окисления меди
Состояние окисления относится к числу, присвоенному элементу в соединении, которое представляет собой количество электронов, приобретенных или потерянных атомом .
Атомная структура меди
Электронная конфигурация меди [Ar] 3d 10 4s 1 . Чтобы достичь конфигурации благородного газа , требуется, чтобы медь потеряла один электрон. Энергия, необходимая для потери еще одного электрона, очень мала, поэтому медь теряет 2 электрона и образует Cu 2+ ион, поэтому медь имеет степени окисления +1 и +2. Степень окисления +1 и +2 часто называют медным и медным соответственно.
Медь также образует координационных комплекса с лигандами. Простейшими соединениями меди являются бинарные соединения, которые содержат только два элемента. Примерами являются оксиды, сульфиды и галогениды.
Читайте также: Электрофильное ароматическое замещение
Химическая формула меди
- Медь обладает высокой тепло- и электропроводностью, пластичностью и пластичностью.
- Поскольку медь является элементом, у нее нет химической формулы, хотя она представлена символом Cu.

- Когда он сочетается с другими элементами или радикалами, его можно представить формулами типа CuSO 4 .
Отъезд :
Производство и добыча
Медь добывается из сульфидов меди, содержащих только 0,5-1,0% меди, из крупных карьеров медно-порфировых месторождений. Большинство этих участков и рудников расположены в Чили, штат Юта, США и Мексике.
Для извлечения меди из конкреций используются такие методы, как серное выщелачивание, плавка , за которой следует медеплавильный процесс. Чтобы удалить большую часть железа из рудного взвеси, проводят плавление материала с кремнеземом для удаления железа в виде шлака. Сульфиды железа теперь превращаются в оксиды, которые реагируют с кремнеземом с образованием силикатного шлака, всплывающего на поверхность нагретого материала.
Извлечение меди из медного колчедана
Остается медный штейн в виде сульфида меди. Название соединения Cu2S. Это соединение затем подвергают обжигу для превращения сульфидов в оксид меди (I), который представляет собой другую формулу оксида меди со стадией окисления +1, которая нестабильна по своей природе и легко разлагается при нагревании до чистой меди.
Название соединения Cu2S. Это соединение затем подвергают обжигу для превращения сульфидов в оксид меди (I), который представляет собой другую формулу оксида меди со стадией окисления +1, которая нестабильна по своей природе и легко разлагается при нагревании до чистой меди.
2CU 2 S + 3O 2 → 2CU 2 O + 2SO 2
2CU 2 O → 4CU + O 2 2 O → 4CU + O 2
9000 2 . лаборатория. Этот процесс также называют гидролизом CuO, так как в этой реакции оксид меди восстанавливается в присутствии водород , где он теряет свой кислород, который присоединяется к водороду с образованием воды.
CuO + H 2 → Cu + H 2 O
В другом процессе сульфат меди помещают в контейнер, известный как автоклав, а затем подвергают его воздействию газообразного водорода при давлении 25 бар. Затем раствор сульфата меди (соединение CuSO4) нагревают при температуре около 150 градусов Цельсия в течение часа, что приводит к образованию порошка меди.
Затем раствор сульфата меди (соединение CuSO4) нагревают при температуре около 150 градусов Цельсия в течение часа, что приводит к образованию порошка меди.
CuSO 4 (водн.) + H 2 (г) → Cu(s) + H 2 SO 4 (водн.)
Подробнее:
Характеристики меди
Физические и химические свойства меди приведены ниже:
Физические свойства
- Золото, медь и серебро попадают в группу 11 периодической таблицы . Эти металлы также имеют один s-орбитальный электрон поверх заполненной d-электронной оболочки. Все эти три металла обладают высокими пластическими характеристиками. Также мал вклад заполненных d-оболочек в межатомные взаимодействия.
- Медь — мягкий металл, поэтому обладает высокой тепло- и электропроводностью. Медь имеет 2-е место среди чистых металлов по электрической и теплопроводности при комнатной температуре.
- Чистая медь естественно имеет оранжево-красный цвет.
 Но после воздействия на воздухе приобретает красноватый оттенок. Причиной его цвета является электронный переход заполненной оболочки атома 3d и полупустой оболочки атома 4s.
Но после воздействия на воздухе приобретает красноватый оттенок. Причиной его цвета является электронный переход заполненной оболочки атома 3d и полупустой оболочки атома 4s.
Химические свойства
- Медь образует коричнево-черный слой оксида меди при взаимодействии с кислородом воздуха. Этот коричнево-черный оксидный слой защищает нижележащий металл от дальнейшей коррозии и вовсе не является той ржавчиной, которая образуется на железе во влажном воздухе.
- Кроме того, медь не реагирует с водой.
- Медь тускнеет под воздействием некоторых соединений серы. Следовательно, он образует различные сульфиды меди, когда реагирует с этими соединениями серы.
Подробнее:
Плотность меди
Всякий раз, когда мы говорим, что медь является более тяжелым металлом, чем алюминий, мы говорим об их плотности. Плотность относится к массе вещества на единицу его объема.
Если обычно не указано иное, при комнатной температуре плотность чистого твердого химического элемента всегда нумеруется как плотность равновесного кристаллического состояния этого элемента.
Плотность меди 8,96 г/см 3 .
Плотность меди в неструктурированном твердом состоянии при данной комнатной температуре можно предсказать по доле упаковки.
Read More:
Properties of Copper
The various properties of copper are as tabulated below:
Properties | Values | |||
|---|---|---|---|---|
Atomic weight | 63.546 g/mol | |||
Atomic number | 29 | |||
Phase | Solid | |||
Melting point | 1084. | |||
Температура кипения | 2562oC или 2835 K | |||
| 2 Плотность0005 | 8,96 г/см 3 8,02 г/см 3 , когда в жидкости | |||
Heat of Fusion | . | 300.4 KJ/mol | ||
Molar heat capacity | 24.440 J (mol.K) | |||
Electronegativity | 1.90 at Pauling scale | |||
Ionization energy | 1st: 745.5 KJ/mol 2nd: 1957.9 KJ/mol 3rd: 3555 KJ/mol | |||
Atomic radius | 128 pm | |||
Thermal expansion | 16.5 μm / (m.K) at 25 o C | |||
Thermal conductivity | 401 W/(m. | |||
Hardness | 3.0 Mohs scale | |||
Molar magnetic susceptibility | -5.46 x 10 -6 cm3/mol | |||
Электрическое удельное сопротивление | 16,78 Nω • M при 20 O C | |||
Модуль Янга | 10-128 GPA | 0-128 GPA | 0-128 GPA | |
| 0005 |
Подробнее: Ковалентные связи
Что следует помнить
- Медь — это химический элемент, который обозначается символом Cu (происходит от латинского слова cuprum) и имеет атомный номер 029. Медь — это материал, который мы используем ежедневно, будь то непосредственно в виде проводки и двигателей или косвенно в виде сплавов.
- Степени окисления +1 и +2 меди часто называют медным и медным соответственно.

- Медь обладает ковкими и пластичными свойствами.
- Медь имеет 2-е место среди чистых металлов по электро- и теплопроводности при комнатной температуре.
- Плотность меди 8,96 г/см 3 .
Примеры вопросов
Вопросы. Почему идеально использовать медь при изготовлении проводов? (5 баллов)
Ответ. Свойства меди, которые делают ее идеальной для домашней электропроводки:
- Высокая электропроводность
- Высокая прочность на растяжение
- Высокая пластичность
- Отличная устойчивость к деформации и ползучести
- Не подвергается коррозии
- Высокая теплопроводность
- Высокая пластичность, поэтому используется в электропроводке 9003 Ques
3
3 Какова электронная конфигурация Cu? (2 балла)
Ответ. Атомный номер. Cu равно 29. Электронная конфигурация меди записывается как [Ar]3d¹º 4s¹.
 Это не соответствует принципу Ауфбау. Это объясняется относительно небольшой энергетической щелью между 3d- и 4s-орбиталями и стабильностью, добавляемой полностью заполненной d-орбиталью.
Это не соответствует принципу Ауфбау. Это объясняется относительно небольшой энергетической щелью между 3d- и 4s-орбиталями и стабильностью, добавляемой полностью заполненной d-орбиталью.Вопрос. Каково влияние Cu на человека? (2 балла)
Отв. При длительном контакте с Cu может возникнуть жжение в носу, горле, головная боль, головокружение, диарея. Интенсивно высокое поглощение меди может повредить печень и почки, что приведет к смерти. Является ли медь канцерогенным или нет, еще предстоит определить.
Вопросы. Как называются медные руды? (2 балла)
Ответ. Редко можно найти медь в естественном состоянии. Существуют различные процессы, необходимые для извлечения меди из руды. У него есть несколько руд в мире. Куприт, борнит, халькопирит — некоторые примеры медных руд.
Ques.Name сульфидная руда меди. Напишите метод, необходимый для очистки меди от ее руд? (1 балл)
Ответ.
 Халькозин — сульфидная руда меди. Для извлечения меди из руд необходимо несколько процессов, включая обжиг (нагрев в присутствии воздуха), рафинирование, плавку, дробление и т. д.
Халькозин — сульфидная руда меди. Для извлечения меди из руд необходимо несколько процессов, включая обжиг (нагрев в присутствии воздуха), рафинирование, плавку, дробление и т. д.Ques. Какие факторы заставляют медь выбирать между степенью окисления +1 или +2? (3 балла)
Ответ. “Для большей стабильности медь предпочитает всегда находиться в состоянии +1” это утверждение не совсем верно. В химии меди стабильность степеней окисления +1 и +2 полностью зависит от того, имеем ли мы раствор или твердое тело.
Медь (I) стабильна только в твердом состоянии (например, Cu2O, CuI, CuCl), тогда как медь (II) более стабильна в растворе или в воде, например, в воде. в гидратированных солях меди(II). Более высокие степени окисления (+3 и +4) можно стабилизировать в сочетании с O2 или F.
Вопрос. Объясните вкратце Металлургия меди. (5 баллов)
Ответ.
 Извлечение меди
Извлечение медиМедь в основном извлекают из пирита (CuFeS 2 ). Сульфидная руда имеет очень низкое содержание и содержит много примесей. Различные этапы извлечения меди:
- Дробление и обогащение
В этом процессе руда измельчается в щековой дробилке, а затем превращается в порошок и концентрируется путем пенной флотации. Земляные и кремнистые примеси удаляются, и они оседают на дне емкости.
- Обжиг
В этом процессе концентрированная руда затем обжигается, т.е. сильно нагревается в присутствии воздуха. Во время обжига
- Затем влага удаляется, и руда становится сухой
- Поскольку примеси металлов представляют собой летучие оксиды, они удаляются.
- Медный пирит превращается в сульфид железа (FeS) и сульфид меди (Cu 2 S), которые частично окисляются.
2CuFeS 2 + О 2 → CU 2 S + FES + SO 2
Медный пирит
.
 2
2 - Плавка
В этом процессе обожженная руда затем смешивается с коксом и кремнеземом SiO2 и подается в доменную печь. Затем горячий воздух продувается и FeO превращается в силикат железа (FeSiO 3 ).
FeO + SiO 2 → FeSiO 3
Cu 2 O + FeS → Cu 2 S + FeO
Шлак, т.е.
- Бессемеризация
Бессемеризация – это процесс извлечения металлической меди из расплавленного штейна. Штейн помещают в конвертер Бессемера, который поддерживается фурмами. Воздух продувается через расплавленный штейн. Порывы воздуха частично превращают Cu 2 S в Cu2O, который затем вступает в реакцию с оставшейся Cu 2 S для выдачи расплавленной меди.
2CU 2 S + 3O 2 → 2CU 2 O + 2SO 2
2CU 2 O + CU 2 SOL + . называется «черновая медь».

- Рафинирование меди
Черновая медь рафинируется электролизом. Тонкие листы чистой меди служат катодами, а блоки черновой меди используются в качестве анодов. Для удаления отложений меди катодные пластины покрывают графитом. Электролит – медный купорос (CuSO 4 ) смешанный с небольшим количеством H 2 SO 4 . Это делается для увеличения электропроводности. Для этого электролитического процесса оптимальная разность потенциалов составляет 1,3 вольта. В процессе электролиза чистая медь осаждается на катодных пластинах, а растворимые примеси оседают на дно электролизера в виде анодного шлама или шлама.
ЭЛЕКТРОХИМИЧЕСКИЕ ИЗМЕНЕНИЯ ПРИ ЭЛЕКТРОЛИЗЕ
Cu –> Cu +2 + 2e- (на аноде)
Cu+2 + 2e – → Cu (на катоде)
Ques. Расскажите о нанесении цинка на медь. (5 баллов)
Ответ. Во время гальваники Электроды из меди и цинка помещают в химический стакан, содержащий сульфат цинка, цитрат аммония и хлорид аммония в качестве электролита.
 Электроды подключаются к источнику питания постоянного тока и подается напряжение, плюс перемещается на цинковый электрод, а минус движется на медный электрод. На медном электроде начинает покрываться белый налет цинка, а через некоторое время на медном электроде появляется тонкое цинковое покрытие. Для демонстрации этого используется эксперимент Фарадея.
Электроды подключаются к источнику питания постоянного тока и подается напряжение, плюс перемещается на цинковый электрод, а минус движется на медный электрод. На медном электроде начинает покрываться белый налет цинка, а через некоторое время на медном электроде появляется тонкое цинковое покрытие. Для демонстрации этого используется эксперимент Фарадея.Полуреакция восстановления
Zn2 + + 2e – → Zn
Zn2 + + 2e – → Zn
2 Ques 9. Объясните вкратце об изменении поверхности меди с течением времени. (3 балла)Отв. Более шероховатая поверхность металла; чем больше контактная поверхность агрессивных сред. Затем поверхность подвергается динамической и более быстрой коррозии. Это общее правило для большинства случаев. Кроме того, коррозия шероховатых поверхностей усиливается из-за длительной выдержки металла с задержкой воды во впадинах. В этих случаях это может привести к точечной коррозии.
 Другой характеристикой коррозии шероховатых поверхностей является состояние продуктов коррозии. Шероховатость поверхности прямо пропорциональна слою продуктов коррозии и тем лучше этот слой сцепляется с металлом.
Другой характеристикой коррозии шероховатых поверхностей является состояние продуктов коррозии. Шероховатость поверхности прямо пропорциональна слою продуктов коррозии и тем лучше этот слой сцепляется с металлом.Подробнее:
Медь и ее свойства
Дом | Бесплатные практические тесты
Основными рудами меди являются медный пирит (CuFeS 2 ), куприт (Cu 2 O), сульфид меди (I) (Cu 2 S) и малахит (CuCO 3 .Cu(OH) ). 2 ).
Медь очень стабильна на воздухе, поэтому ее можно свободно найти в виде металла в нескольких местах.
Добыча меди
Руда, из которой обычно извлекают медь, представляет собой медный колчедан CuFeS 2 . Сначала его концентрируют в процессе флотации, а затем обжигают на воздухе для получения сульфида меди (I).
2CuFeS 2(т) + 4O 2(г) → Cu2S (т) + 3SO 2(г) + 2FeO (т)
Добавление SiO 2 и нагревание в отсутствие воздуха удаляет оксид железа(II) в виде шлака триоксосиликата(IV) железа(II), FeSiO 3 .
 Затем остается сульфид меди(I), Cu 2 S.
Затем остается сульфид меди(I), Cu 2 S.Медь извлекают из Cu 2 S нагреванием в регулируемой подаче воздуха.
Cu 2 S (т) + O 2(г) → 2Cu (т) + SO 2(г)
Примечание:
*Подача воздуха должна регулироваться, так как медь может реагировать с кислородом с образованием оксидов.
*Производимая медь очень нечистая, поэтому она очищают с помощью электролитических средств. Анодом служит нечистая медь, а катодом служит полоска чистой меди.
Электролит – раствор CuSO 4 – см. более подробную информацию об этом процессе здесь: электролитический Ячейки
Свойства меди (физ. и химическая)
Медь проявляет следующие физические и химические свойства:
Физические свойства
1. Медь представляет собой мягкое твердое вещество красного цвета с блеском.
2. Плотность 8,95 г/см 3 .

3. Он очень податлив и пластичен.
4. Обладает относительно высокой прочностью на растяжение.
5. Температура плавления 1080 o С.
6. Это очень хороший проводник тепла и электричества.
Химические свойства
Медь, серебро и золото часто называют элементами чеканки, потому что они используются для изготовления монет в мире из-за того, что они не реакционноспособны и устойчивы к коррозии.
1. Воздействие воздуха – медь очень устойчива на чистом воздухе (напомним, что медь менее реакционноспособна, стоя в ряду реакционной способности значительно ниже).
На влажном воздухе постепенно покрывается зеленым налетом основного сульфата меди(II), CuSO 4 .3Cu(OH) 2 и карбоната. При воздействии влажного морского воздуха на нем образуется налет основного хлорида.
Медь при нагревании на воздухе легко окисляется с образованием оксида меди (II) (черного цвета).

2Cu (т) + O 2(г) → 2CuO (т)
2. С кислотами – медь не вытеснит водород разбавленных кислот (будучи ниже водорода в ряду активности).
Поэтому он не реагирует с разбавленной HCl или H 2 SO 4 . Однако медь реагирует с растворами окисляющие кислоты, такие как HNO 3 и горячая конц. H 2 SO 4 . С HNO 3 – концентрация кислоты будет определять образующиеся продукты.
С горячей конц. HNO 3 – образуются оксид азота(IV) и соль триоксонитрата(V) меди(II).
Cu (с) + 4HNO 3(водн.) → Cu(NO 3 ) 2(водн.) + 2H 2 O (л) + 2NO 2(г)
С разбавленной HNO 3 образуются оксид азота(II) и соль триоксонитрата(V) меди(II).
3Cu (т) + 8HNO 3(водн.) → 3Cu(NO 3 ) 2(водн.
 ) + 4H 2 O (л) + 2NO 4
) + 4H 2 O (л) + 2NO 448
С горячей конц. H 2 SO 4 – CuSO 4 формируется и SO 2 освобождается.
Cu(т) + 2H 2 SO 4(водн.) → CuSO 4(водн.) + 2h3O (л) + SO 2(г)
Соль CuSO 4 кристаллизуется в виде синего пентагидрата. – CuSO 4 .5H 2 O
Примечание: реакция между металлической медью и H 2 SO 4 происходит только при горячей и концентрированной кислоте.
Со щелочами – медь не вступает в реакцию со щелочами.
Использование CuSO
4CuSO 4 можно использовать следующим образом:
(1). В качестве фунгицида для опрыскивания винограда, цитрусовых деревьев и картофеля.
(2). При производстве некоторых пигментов.
(3). При приготовлении промывок, таких как «Бордоская смесь».

(4). В гальванике.
(5). В окрашивании.
(6). При получении других соединений меди.
(7). Для сохранения древесины.
Тест на ион меди(II), Cu
2+Растворы солей меди(II) обычно синего цвета. Следующие тесты выявят и подтвердят их:
1. Тест на пламя. Соли меди(II) горят в несветящемся пламени, образуя голубовато-зеленый цвет.
2. С гидроксидом натрия – при добавлении нескольких капель NaOH к раствору соли Cu 2+ образуется синий студенистый осадок.
Осадок нерастворим в избытке NaOH.
Cu 2+ (водн.) + 2NaOH (водн.) → Cu(OH) 2(т) + 2Na + (водн.)
3. С водным раствором аммиака – выпадает синий осадок. Синий осадок фактически представляет собой гидроксид меди(II), Cu 2+ (водн.) + 2OH – (водн.) → Cu(OH) 2(т) который будет растворяться в избытке водного аммиака, давая темно-синий раствор.




 Применяется в основном к руде с большим содержанием серы. После сильного температурного воздействия более половины серы «сгорает», чем также достигается повышение доли меди в руде;
Применяется в основном к руде с большим содержанием серы. После сильного температурного воздействия более половины серы «сгорает», чем также достигается повышение доли меди в руде; тонн.
тонн. Кабели (силовые, другие), провода. Обмотка в трансформаторах. Теплообменные устройства (радиаторы отопления, кондиционеры, кулеры компьютеров, тепловые трубки ноутбуков).
Кабели (силовые, другие), провода. Обмотка в трансформаторах. Теплообменные устройства (радиаторы отопления, кондиционеры, кулеры компьютеров, тепловые трубки ноутбуков).

 Производство меди в мире продолжает расти. По сути, это означает, что все большее количество меди попадает в окружающую среду. Реки откладывают на своих берегах загрязненные медью шламы в результате сброса медьсодержащих сточных вод. Медь попадает в атмосферу в основном при сжигании ископаемого топлива. Медь в воздухе будет оставаться там в течение длительного периода времени, прежде чем осядет, когда начнется дождь. Затем он в первую очередь попадет в почву. В результате почвы могут содержать значительное количество меди после осаждения меди из воздуха.
Производство меди в мире продолжает расти. По сути, это означает, что все большее количество меди попадает в окружающую среду. Реки откладывают на своих берегах загрязненные медью шламы в результате сброса медьсодержащих сточных вод. Медь попадает в атмосферу в основном при сжигании ископаемого топлива. Медь в воздухе будет оставаться там в течение длительного периода времени, прежде чем осядет, когда начнется дождь. Затем он в первую очередь попадет в почву. В результате почвы могут содержать значительное количество меди после осаждения меди из воздуха. Медь очень распространена в окружающей среде, потому что она выделяется как естественным путем, так и в результате деятельности человека. Медь часто обнаруживают вблизи шахт, промышленных объектов, свалок и мест захоронения отходов.
Медь очень распространена в окружающей среде, потому что она выделяется как естественным путем, так и в результате деятельности человека. Медь часто обнаруживают вблизи шахт, промышленных объектов, свалок и мест захоронения отходов. .
. С другой стороны, более высокие дозы могут быть вредными. Медная пыль может вызывать головные боли, головокружение, тошноту и диарею, раздражая нос, рот и глаза.
С другой стороны, более высокие дозы могут быть вредными. Медная пыль может вызывать головные боли, головокружение, тошноту и диарею, раздражая нос, рот и глаза.

 com
Медь ( http://environmentalchemistry.com/yogi/periodic/Cu.html )
com
Медь ( http://environmentalchemistry.com/yogi/periodic/Cu.html )
 0162 32
0162 32
 Но после воздействия на воздухе приобретает красноватый оттенок. Причиной его цвета является электронный переход заполненной оболочки атома 3d и полупустой оболочки атома 4s.
Но после воздействия на воздухе приобретает красноватый оттенок. Причиной его цвета является электронный переход заполненной оболочки атома 3d и полупустой оболочки атома 4s. 62oC или 1357,77 K
62oC или 1357,77 K K)
K)
 Это не соответствует принципу Ауфбау. Это объясняется относительно небольшой энергетической щелью между 3d- и 4s-орбиталями и стабильностью, добавляемой полностью заполненной d-орбиталью.
Это не соответствует принципу Ауфбау. Это объясняется относительно небольшой энергетической щелью между 3d- и 4s-орбиталями и стабильностью, добавляемой полностью заполненной d-орбиталью. Халькозин — сульфидная руда меди. Для извлечения меди из руд необходимо несколько процессов, включая обжиг (нагрев в присутствии воздуха), рафинирование, плавку, дробление и т. д.
Халькозин — сульфидная руда меди. Для извлечения меди из руд необходимо несколько процессов, включая обжиг (нагрев в присутствии воздуха), рафинирование, плавку, дробление и т. д.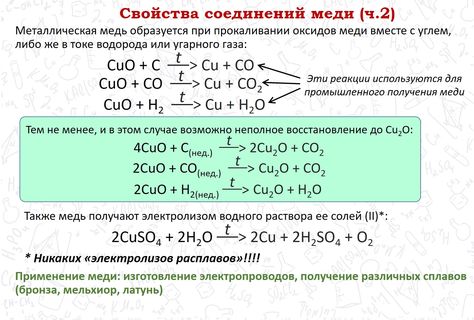 Извлечение меди
Извлечение меди 2
2 
 Электроды подключаются к источнику питания постоянного тока и подается напряжение, плюс перемещается на цинковый электрод, а минус движется на медный электрод. На медном электроде начинает покрываться белый налет цинка, а через некоторое время на медном электроде появляется тонкое цинковое покрытие. Для демонстрации этого используется эксперимент Фарадея.
Электроды подключаются к источнику питания постоянного тока и подается напряжение, плюс перемещается на цинковый электрод, а минус движется на медный электрод. На медном электроде начинает покрываться белый налет цинка, а через некоторое время на медном электроде появляется тонкое цинковое покрытие. Для демонстрации этого используется эксперимент Фарадея. Другой характеристикой коррозии шероховатых поверхностей является состояние продуктов коррозии. Шероховатость поверхности прямо пропорциональна слою продуктов коррозии и тем лучше этот слой сцепляется с металлом.
Другой характеристикой коррозии шероховатых поверхностей является состояние продуктов коррозии. Шероховатость поверхности прямо пропорциональна слою продуктов коррозии и тем лучше этот слой сцепляется с металлом. Затем остается сульфид меди(I), Cu 2 S.
Затем остается сульфид меди(I), Cu 2 S.

 ) + 4H 2 O (л) + 2NO 4
) + 4H 2 O (л) + 2NO 4
