Характеристика zn по плану: Ошибка 403 — доступ запрещён
alexxlab | 22.05.2023 | 0 | Разное
Записать электронные формулы элементов с порядковым номером 4,7,11,12,14,16,30,27,30. Дать характеристику элемента по его положению ПСХЭ.
1). Химический элемент с порядковым номером 4 – бериллий.
Ве находится во II периоде, II – А – группе. Порядковый номер 4. Атомная масса 9. Заряд ядра +4. Число протонов 4, электронов 4, нейтронов 5 (N = Ar – Z, 10 – 5 = 5).
Степень окисления +2, валентность II.
Ве – амфотерный элемент. Металлические свойства выражены сильнее , чем у бора, но слабее, чем у лития и магния.
Высший оксид бора имеет формулу ВеО – амфотерный оксид.
Высший гидроксид Ве(ОН)2 – амфотерный.
Летучего водородного соединения не имеет.
Схема расположения электронов по орбиталям : 1s 2 2s 2 .
2). Химический элемент с порядковым номером 7 – азот.
Азот находится во II периоде, V – А – группе. Порядковый номер 7. Атомная масса 14. Заряд ядра +7. Число протонов 7, электронов 7, нейтронов 7 (N = Ar – Z, 14 – 7 = 7).
Степень окисления +1 – +5, -3; высшая валентность V.
N – неметалл. Окислительные свойства выражены сильнее , чем у углерода, фосфора, но слабее, чем у кислорода .
Высший оксид бора имеет формулу ВеО – амфотерный оксид.
Высший гидроксид HNO3 – азотная кислота.
Летучее водородное соединение NH3 -аммиак .
Схема расположения электронов по орбиталям : 1s2 2s2 2p3.
3). Химический элемент с порядковым номером 11 – натрий.
Натрий находится во III периоде, I – А – группе. Порядковый номер 11. Атомная масса 23. Заряд ядра +11. Число протонов 11, электронов 11, нейтронов 12 (N = Ar – Z, 23 – 11 = 12).
Степень окисления +1; высшая валентность I.
Nа – металл. Металлические свойства выражены сильнее , чем магния, но слабее, чем у калия. Высший оксид натрия имеет формулу Na2О – основный оксид.
Высший гидроксид NaOH – основание.
Летучего водородного соединения не имеет.
Схема расположения электронов по орбиталям : 1s2 2s2 2p6 3s1.
4). Химический элемент с порядковым номером 12 – магний.
Магний находится во III периоде, II – А – группе. Порядковый номер 12. Атомная масса 24. Заряд ядра +12. Число протонов 12, электронов 12, нейтронов 12 (N = Ar – Z, 24 – 12 = 12).
Степень окисления +2; высшая валентность II.
Mg – металл. Металлические свойства выражены сильнее , чем у бериллия,алюминия, но слабее, чем у натрия, кальция .
Высший оксид магния имеет формулу Mg О – основный оксид.
Высший гидроксид Mg (OH)2 – основание.
Летучего водородного соединения не имеет.
Схема расположения электронов по орбиталям : 1s2 2s2 2p6 3s2.
5). Химический элемент с порядковым номером 14 – кремний.
Кремний находится в III периоде, IV – А – группе. Порядковый номер 14. Атомная масса 28. Заряд ядра +14. Число протонов 14, электронов 14, нейтронов 14 (N = Ar – Z, 28 – 14 = 14).
Число протонов 14, электронов 14, нейтронов 14 (N = Ar – Z, 28 – 14 = 14).
Степень окисления +4 ; высшая валентность IV.
Si – неметалл. Окислительные свойства выражены сильнее , чем у алюминия, но слабее, чем у фосфора,углерода .
Высший оксид кремния имеет формулу SiО2 – кислотный оксид.
Высший гидроксид H2SiО3 – кремниевая кислота.
Летучее водородное соединение SiН4.
Схема расположения электронов по орбиталям : 1s2 2s2 2p6 3s2 p2.
6). Химический элемент с порядковым номером 16 – cера.
Сера находится в III периоде, VI – А – группе. Порядковый номер 16. Атомная масса 32. Заряд ядра +1. Число протонов 16, электронов 16, нейтронов 16 (N = Ar – Z, 32 – 16 = 16).
Высшая степень окисления +6 ; высшая валентность VI.
S – неметалл. Окислительные свойства выражены сильнее , чем у фосфора, но слабее, чем у хлора, кислорода.
Высший оксид серы имеет формулу SО3 – кислотный оксид.
Высший гидроксид H2SО4 – серная кислота.
Летучее водородное соединение Н2S.
Схема расположения электронов по орбиталям : 1s2 2s2 2p6 3s2 p6.
7). Химический элемент с порядковым номером 27 – кобальт.
Кобальт находится во IV периоде, VIII -B – группе. Порядковый номер 27. Атомная масса 59. Заряд ядра +27. Число протонов 27, электронов 27, нейтронов 32 (N = Ar – Z, 59 – 27 = 32).
Высшая степень окисления +2 ; +3 высшая валентность III .
Co – имеет слабо выраженные амфотерные свойства.
Схема расположения электронов по орбиталям : 1s2 2s2 2p6 3s2 p6 3 d7 4 s2 .
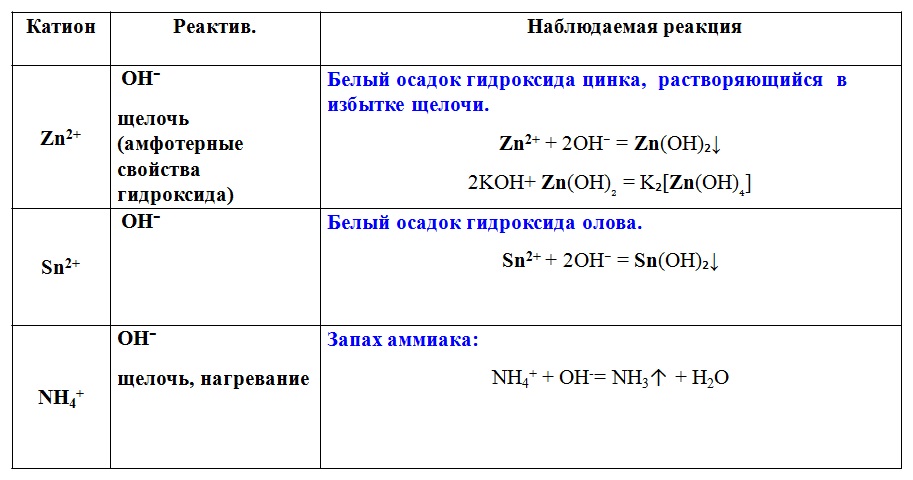
8).Химический элемент с порядковым номером 30 – цинк.
Цинк находится во IV периоде, II – А – группе. Порядковый номер 30. Атомная масса 65. Заряд ядра +30. Число протонов 30, электронов 30, нейтронов 35 (N = Ar – Z, 65 – 30 = 35).
Атомная масса 65. Заряд ядра +30. Число протонов 30, электронов 30, нейтронов 35 (N = Ar – Z, 65 – 30 = 35).
Высшая степень окисления +2 ; высшая валентность II .
Zn – амфотерный элемент. Металлические свойства выражены сильнее , чем у меди, но слабее, чем у кальция.
Высший оксид цинка имеет формулу ZnО– амфотерный оксид.
Амфотерный гидроксид – Zn(ОН)2 .
Летучее водородное соединение не образует.
Схема расположения электронов по орбиталям : 1s2 2s2 2p6 3s2 p6 d10 4 s2 .
Контрольная работа на тему «Характеристика элемента по его положению в Периодической системе химических элементов Д. И. Менделеева. Химические реакции» (9 класс Габриелян – 1 уровень)
Вариант 1
ЗАДАНИЕ 1
Дано уравнение реакции нейтрализации гидроксида натрия соляной кислотой:
NaOH + НСl = NaCl + Н20 + Q.
Дайте характеристику реакции по следующим признакам:
• число и состав исходных веществ и продуктов реакции;
• тепловой эффект;
• агрегатное состояние веществ;
• участие катализатора;
• изменение степеней окисления элементов;
• направление.
Рассмотрите данную химическую реакцию с точки зрения теории электролитической диссоциации. Запишите полное и сокращенное ионные уравнения.
ЗАДАНИЕ 2
Дайте характеристику химического элемента магния по плану:
• положение элемента в ПСХЭ;
• строение атома;
• формулы оксида и гидроксида, их характер.
ЗАДАНИЕ 3
Напишите уравнения реакций оксида и гидроксида магния с соляной кислотой в молекулярном и ионном виде.
Вариант 2
ЗАДАНИЕ 1
Дана схема реакции горения алюминия
Аl + 02 → А1203 + Q.
Составьте уравнение данной реакции, расставив коэффициенты в нем методом электронного баланса. Укажите окислитель и восстановитель.
Дайте характеристику реакции по следующим признакам:
• число и состав исходных веществ и продуктов реакции;
• тепловой эффект;
• агрегатное состояние веществ;
• участие катализатора;
• изменение степеней окисления элементов;
• направление.
ЗАДАНИЕ 2
Дайте характеристику химического элемента натрия по плану:
• положение элемента в ПСХЭ;
• строение атома;
• формулы оксида и гидроксида, их характер.
ЗАДАНИЕ 3
Напишите уравнения реакций оксида и гидроксида натрия с раствором серной кислоты в молекулярном и ионном виде.
Вариант 3
ЗАДАНИЕ 1
Дана схема реакции получения оксида серы (VI) из оксида серы (IV)
S02 + 02 -> S03 + Q.
Составьте уравнение данной реакции, расставив коэффициенты в нем методом электронного баланса. Укажите окислитель и восстановитель.
Дайте характеристику реакции по следующим признакам:
• число и состав исходных веществ и продуктов реакции;
• тепловой эффект;
• агрегатное состояние веществ;
• участие катализатора;
• изменение степеней окисления элементов;
• направление.
ЗАДАНИЕ 2
Дайте характеристику химического элемента лития по плану:
• положение элемента в Периодической системе;
• строение атома;
• формулы оксида и гидроксида, их характер.
ЗАДАНИЕ 3
Напишите уравнения реакций оксида и гидроксида лития с серной кислотой в молекулярном и ионном виде.
Вариант 4
ЗАДАНИЕ 1
Дано уравнение реакции цинка с соляной кислотой:
Zn + 2НСl = ZnCl2 + Н2↑ + Q.
Дайте характеристику реакции по следующим признакам:
• число и состав исходных веществ и продуктов реакции;
• тепловой эффект;
• агрегатное состояние участвующих в реакции веществ;
• участие катализатора;
• изменение степеней окисления химических элементов;
• направление.
Рассмотрите данную химическую реакцию с точки зрения теории электролитической диссоциации: запишите полное и сокращенное ионные уравнения.
ЗАДАНИЕ 2
Дайте характеристику химического элемента кальция по плану:
• положение элемента в Периодической системе;
• строение атома;
• формулы высшего оксида и гидроксида, их характер.
ЗАДАНИЕ 3
Напишите уравнения реакций оксида и гидроксида кальция с азотной кислотой в молекулярном и ионном виде.
Качества цинка | ВМЦИНК Мир
История VMZINC — это традиция, насчитывающая более 180 лет. История, которая охватывает века и отражает образ благородного, прочного и прочного металла с исключительной прочностью и большой пластичностью.
В VMZINC мы полностью заинтересованы в вашем успехе в применении универсальных и долговечных решений для творческих строительных проектов от индивидуальных домов до коммерческих комплексов, общественных зданий и частных проектов по всему миру.
Все, что вам нужно знать о цинке, прежде чем дать волю своему творчеству.
- Исполнительский сплав
- Пластичность
- Адаптивность
- Цинк и патина
- Низкие расходы
- Акустические свойства
- Цинк, натуральный и перерабатываемый
- Цинк и экотоксикология
Состав сплава
VMZINC Цинковый прокат легирован медью и титаном для получения материала с оптимальными механическими и физическими характеристиками для применения в строительстве, особенно в отношении механической прочности и сопротивления ползучести.
Состоит из цинка очень высокого качества Z1 (чистота цинка 99,995 %), согласно стандарту EN 1179, к которому добавляются титан и медь для получения цинкового проката в соответствии с европейским стандартом EN 988. Медь увеличивает механическое сопротивление сплава, что делает его более твердым и прочным. Этот стандарт устанавливает очень строгие требования к составу цинкового проката и его физическим, механическим и размерным характеристикам, что делает его международным эталоном. Титан увеличивает сопротивление ползучести, обеспечивая большее тепловое расширение и сжатие материала, не вызывая усталости металла.
Норма EN988
Европейский стандарт EN 988 применяется с 1997 года в 18 европейских странах. Этот стандарт устанавливает очень строгие требования к составу цинкового проката и его физическим, механическим и размерным характеристикам, что делает его международным эталоном.
Физические свойства цинка титана по VMZINC | |
|---|---|
Плотность | 9 9 м³ 7,20052 |
Thermal expansion coefficient (parallel to the rolling direction) | 0. |
Melting point | 420°C |
Recrystallization point | 300 ° C |
Теплопроводности | 110 Вт/(M.K) |
Проводящая проводимость | |
.0049 17 MS/m | |
Danger of sparking | Non-sparking |
Magnetic properties | Diamagnetic |
Whilst the VMZINC brand complies with all the specifications стандарта EN 988, мы вышли за рамки требований этого стандарта, чтобы создать систему качества PREMIUMZINC. Он предлагает еще более высокий уровень качества, чем сертификация EN 988.
Пластичность
Архитекторы обладают неограниченным творческим потенциалом, который можно прекрасно выразить с помощью VMZINC.
VMZINC дает свободу создавать архитектурные шедевры, которые трудно создать из других строительных материалов. Он очень податлив и поэтому может удовлетворить практически все архитектурные требования и предоставить решения, которые не могут быть недоступны для менее гибких материалов. Архитекторы ценят эту универсальность, которая дает им большую свободу самовыражения при проектировании здания.
Адаптивность
Цинк решает множество дизайнерских задач, помогая создавать практически бесконечное разнообразие форм: прямые, изогнутые, выпуклые или вогнутые с более или менее выраженными узлами без видимых застежек. Это позволяет разнообразить планировку конструкции и управлять сложными деталями, которые невозможно реализовать с другими материалами.
Цинк и патина для длительного срока службы
Для образования светло-серой патины требуется от шести месяцев до двух лет, в зависимости от климата, экспозиции участка и состава атмосферы. Он защищает себя от наружной коррозии, образуя патину, которая обеспечивает ему исключительно долгий срок службы. При средней скорости коррозии 1 мкм/год даже очень тонкий (0,7 мм) цинковый прокат может прослужить от 70 до 100 лет в зависимости от окружающей среды (от 60 лет в агрессивной среде до более 100 лет в более мягкой среде). Цинк продолжает формировать защитный слой на протяжении всего срока службы и самостоятельно восстанавливает дефекты и царапины.
 Этот первый слой полностью защищает цинк и замедляет его взаимодействие с кислородом воздуха. Также образуется второй, менее однородный слой, состоящий из оксида или гидроксида цинка, менее клейкий и более пористый. Хотя он играет менее важную роль, он все же полезен, так как нейтрализует воздействие дождя и других внешних факторов на цинк.
Этот первый слой полностью защищает цинк и замедляет его взаимодействие с кислородом воздуха. Также образуется второй, менее однородный слой, состоящий из оксида или гидроксида цинка, менее клейкий и более пористый. Хотя он играет менее важную роль, он все же полезен, так как нейтрализует воздействие дождя и других внешних факторов на цинк.Низкие расходы
В дополнение к длительному сроку службы цинк не требует особого ухода. Он не имеет покрытия или лака, который со временем изнашивается и требует повторного нанесения. Фактически, цинк продолжает образовывать защитный слой (патину) на протяжении всей своей жизни и самостоятельно восстанавливает дефекты или царапины. Этот благородный материал с годами улучшается благодаря естественному окислению, что придает ему превосходную долговечность и требует минимального обслуживания.
Акустические свойства
Традиционные системы VMZINC обеспечивают высокоэффективную звукоизоляцию от воздушных шумов (дорожный транспорт, самолеты и т. д.). Их акустические характеристики дополнительно улучшаются за счет увеличенной толщины теплоизоляции из-за более строгих правил теплоизоляции ограждающих конструкций. Цинк также имеет лучшие акустические характеристики при ударных шумах, таких как дождь, чем более жесткие сплавы (алюминий, нержавеющая сталь и т. д.).
д.). Их акустические характеристики дополнительно улучшаются за счет увеличенной толщины теплоизоляции из-за более строгих правил теплоизоляции ограждающих конструкций. Цинк также имеет лучшие акустические характеристики при ударных шумах, таких как дождь, чем более жесткие сплавы (алюминий, нержавеющая сталь и т. д.).
Цинк, натуральный и перерабатываемый
Цинк — это нетоксичный, прочный, пригодный для повторного использования и доступный в изобилии материал. Как важный микроэлемент, цинк также жизненно важен для биологического равновесия и роста. Цинк, используемый в строительной промышленности, на 100 % пригоден для вторичной переработки и может перерабатываться бесконечно долго, что значительно превосходит многие другие материалы, которые только делают первые шаги в переработке.
В Европе более 95 % старого цинкового проката перерабатывается. 100 % проката или формованных изделий из цинка в конце их жизненного цикла подлежат вторичной переработке, а 95 % фактически подлежат вторичной переработке.
Успех вторичной переработки цинкового проката обусловлен очень хорошо организованным рынком вторичной переработки. Основными потребителями старого цинкового проката являются предприятия вторичного рафинирования цинка, производители латуни и оксидов.
Цинк – экологически чистый металл с благоприятным общим энергетическим балансом. Для производства цинка требуется меньше энергии, чем для производства других основных металлов в строительной отрасли. Энергетический баланс еще более благоприятен в переработанном цинке.
Цинк и живые организмы
Цинк является важным элементом для всех живых организмов. Цинк необходим и незаменим для жизни человека, животных и растений.
Для каждого живого организма существует оптимальный диапазон концентрации цинка. В этом диапазоне концентраций живые организмы могут регулировать свою внутреннюю концентрацию, чтобы удовлетворить потребности своего метаболизма.
Если эти оптимальные условия не соблюдены и возникает дефицит, может возникнуть дефицит цинка, а в случае его избытка возникают экотоксикологические проблемы.
Люди обычно не подвергаются избытку цинка, но могут испытывать дефицит цинка.
С другой стороны, экосистемы редко испытывают недостаток цинка, но могут испытывать избыток цинка.
Цинк и человек
Цинк является важным металлическим элементом для человечества, поскольку он занимает 3-е место после магния и железа.
Цинк играет важную роль для здоровья. Он необходим для роста, развития мозга, защиты кожи, правильного функционирования иммунной системы, пищеварения, воспроизводства, вкуса, обоняния и многих других естественных процессов.
Организм человека не может синтезировать необходимый ему цинк. Поэтому он получает цинк из пищи. Всемирная организация здравоохранения (ВОЗ) рекомендует ежедневное потребление цинка 10 мг/день для детей, 12 мг/день для женщин и 15 мг/день для мужчин. Определенные группы населения имеют более высокую потребность в цинке и, следовательно, более подвержены риску дефицита цинка: дети и подростки, беременные женщины, пожилые люди и т. д.
Определенные группы населения имеют более высокую потребность в цинке и, следовательно, более подвержены риску дефицита цинка: дети и подростки, беременные женщины, пожилые люди и т. д.
Симптомы, связанные с риском дефицита: снижение вкусовых ощущений и запах, проблемы с кожей, умственная вялость и снижение фертильности.
Разнообразие рациона человека зависит прежде всего от его культуры и уровня жизни. Поскольку количество цинка варьируется в зависимости от типа пищи, в глобальном масштабе многие взрослые и дети придерживаются диеты с низким содержанием цинка. В развивающихся странах дефицит цинка занимает 5-е место среди 10 ведущих факторов риска для здоровья человека; Всемирная организация здравоохранения (ВОЗ) ежегодно связывает 800 000 смертей во всем мире с дефицитом цинка и потерей более 28 миллионов лет здоровой жизни (¹).
Цинк и экотоксикология
Цинк естественным образом присутствует в окружающей среде: горные породы, почва, вода и воздух всегда естественным образом содержали его в различных концентрациях. В ходе своей эволюции все живые организмы использовали цинк, доступный в окружающей среде, для определенных функций своего метаболизма. Итак, цинк является эссенциальным элементом, который необходим и незаменим для всех живых организмов во всех экосистемах.
В ходе своей эволюции все живые организмы использовали цинк, доступный в окружающей среде, для определенных функций своего метаболизма. Итак, цинк является эссенциальным элементом, который необходим и незаменим для всех живых организмов во всех экосистемах.
Живые организмы приспособлены к естественной концентрации цинка в их экосистеме. Кроме того, они разработали механизмы для поддержания оптимальных условий жизни, когда этот уровень концентрации отличается от естественной нормы. Но если концентрация цинка радикально изменится, условия жизни перестанут быть оптимальными, и это может повлиять на функционирование экосистемы.
По этой причине можно проводить экотоксикологические исследования для оценки риска для окружающей среды, связанного с избытком цинка.
В этих экотоксикологических исследованиях следует принимать во внимание только концентрацию растворенного цинка, поскольку нерастворимая часть не оказывает никакого действия. На концентрацию растворенного цинка влияют такие свойства окружающей среды, как pH, жесткость воды, растворенный органический углерод и температура. Таким образом, любое исследование воздействия цинка на окружающую среду должно учитывать особенности рассматриваемой экосистемы и концентрацию растворенного цинка, а не общую концентрацию цинка.
Таким образом, любое исследование воздействия цинка на окружающую среду должно учитывать особенности рассматриваемой экосистемы и концентрацию растворенного цинка, а не общую концентрацию цинка.
Экотоксикологические исследования показали, что концентрации цинка в европейских экосистемах, обусловленные либо деятельностью человека (например, атмосферная коррозия цинкового проката и оцинкованной стали, износ автомобильных шин, удобрения и корма для животных и т. д.), либо естественными выбросами (в основном от вулканическая деятельность Земли), остаются в пределах оптимальных условий жизни. Хорошим примером этого являются текущие уровни цинка в Рейне (экстремальные значения от 3 до 25 мкг/л), которые находятся в пределах оптимального диапазона для цинка (3).
Перейти на обзорную страницу
Характеристики химических реакций — GeeksforGeeks
Химическая реакция — это процесс, в котором реагенты превращаются в продукты. Химические уравнения используются для иллюстрации химических реакций.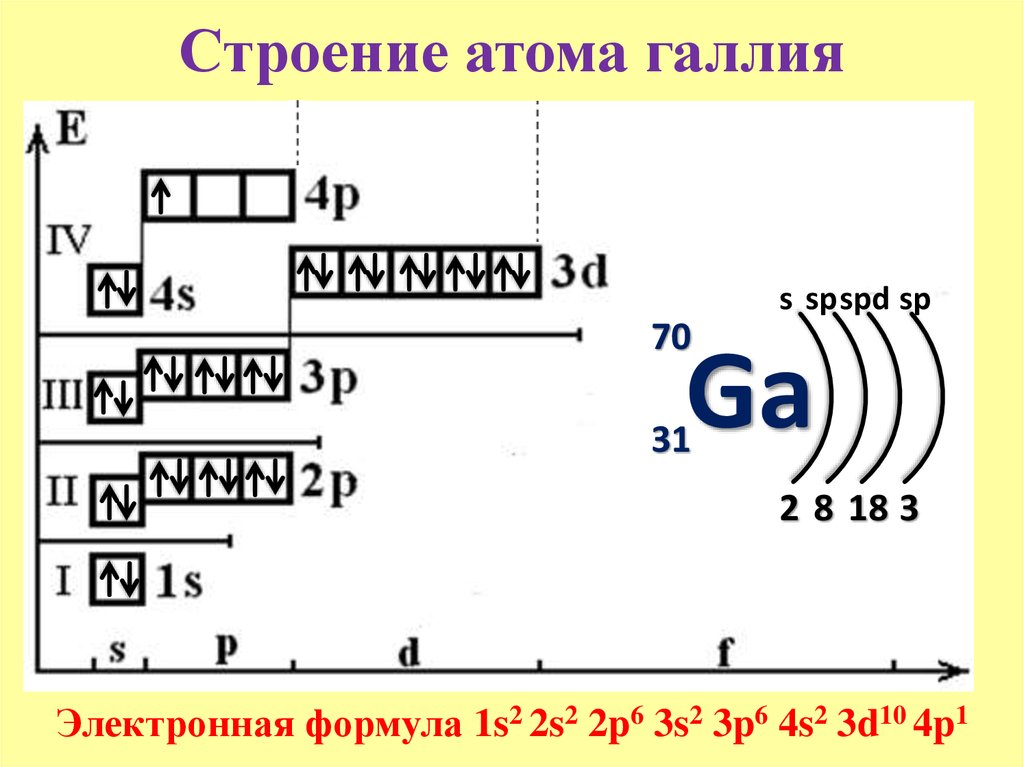 В химической реакции превращение реагентов в продукты приводит к некоторым наблюдаемым особенностям, известным как характеристики химических реакций. Важными характеристиками являются выделение газа, образование осадка, изменение цвета, изменение температуры и изменение состояния. Любая из этих общих характеристик может сказать нам, имела ли место реакция или нет.
В химической реакции превращение реагентов в продукты приводит к некоторым наблюдаемым особенностям, известным как характеристики химических реакций. Важными характеристиками являются выделение газа, образование осадка, изменение цвета, изменение температуры и изменение состояния. Любая из этих общих характеристик может сказать нам, имела ли место реакция или нет.
Что такое химическая реакция?
Когда две или более молекул объединяются для производства нового продукта, это называется химической реакцией (реакцией). Реагенты — это химические вещества, которые объединяются с образованием новых соединений, тогда как продукты — это новые соединения.
Химические реакции играют важную роль в различных сферах деятельности, культурах и даже в нашей повседневной жизни. Они всегда происходят в нашей среде, такие как ржавление железа, керамики и брожения вина, и это лишь некоторые из них. Химическое изменение должно происходить в результате химической реакции, которая обычно наблюдается при физических изменениях, таких как осаждение, выделение тепла, изменение цвета и т. д.
д.
Между двумя атомами, ионами или молекулами может происходить реакция, в которой они устанавливают новую связь, не разрушая и не создавая атом, но из реагентов образуется новый продукт. На скорость реакции влияют такие переменные, как давление, температура и концентрация реагента.
Характеристики химических реакций
В химической реакции превращение реагентов в продукты часто сопровождается специфическими характеристиками, которые можно увидеть. Химические реакции обладают рядом важных свойств, таких как:
Выделение газа
Некоторые химические реакции характеризуются выделением газа.
- Химическая реакция между сульфитом натрия и разбавленной соляной кислотой характеризуется выделением газообразного диоксида серы.
Na 2 SO 3 + 2HCl ⇢ 2NaCl + H 2 O + SO 2
- Химическая реакция между серной кислотой и двуокисью цинка.

Zn + H 2 SO 4 ⇢ ZnSO 4 + H 2
ФОРМАЦИЯ АПИДИКА.
- Химическая реакция между сульфатом меди и гидроксидом натрия характеризуется образованием синего осадка гидроксида меди.
CuSO 4 + 2NaOH ⇢ Na 2 SO 4 + Cu(OH) 2
- Химическая реакция между нитратом серебра и хлоридом натрия характеризуется образованием белого осадка хлорида серебра.
AgNO 3 + NaCl ⇢ NaNO 3 + AgCl
Изменение цвета
Некоторые химические реакции характеризуются изменением цвета.
- Химическая реакция между лимонной кислотой и раствором перманганата калия характеризуется изменением цвета от пурпурного до бесцветного. Лимонная кислота окисляет перманганат калия, поскольку является восстановителем.
3KMnO 4 + C 6 H 8 O 7 ⇢ 3HMnO 4 + C 6 H 5 K 3 O 7
- The chemical reaction между диоксидом серы и подкисленным раствором бихромата калия характеризуется изменением окраски с оранжевой на зеленую.

SO 2 + K 2 Cr 2 O 7 + 3H 2 SO 4 ⇢ K 2 SO 4 + CR 2 (SO 4 ) 3 + 3H 2 o 6 . характеризуется сменой повышения температуры. CaO + H 2 O ⇢ Ca(OH) 2 BACL 2 + NH 4 OH ⇢ BA (OH) 2 + NH 4 CL . C X H Y + O 2 ⇢ CO 2 + H 2 O + Тепло и свет Вопрос 1: Назовите различные характеристики химических реакций. Ответ: Характеристиками химической реакции являются: выделение газа, образование осадка, изменение цвета, изменение температуры, изменение состояния и т. д. Вопрос 2: Назовите две характеристики Химическая реакция, происходящая при поливании гранул цинка разбавленной серной кислотой. Ответ: Когда разбавленной серной кислотой поливают гранулы цинка, выделяется газообразный водород, и смесь нагревается. Следовательно, «выделение газа» и «изменение температуры» являются двумя характеристиками этой химической реакции. Вопрос 3: Приведите две характеристики химической реакции, происходящей при добавлении раствора йодида калия к раствору нитрата свинца. Ответ: При добавлении раствора йодида калия к раствору нитрата свинца образуются желтые осадки йодида свинца, а окраска раствора меняется с бесцветной на желтую. Вопрос 4: Укажите одну характеристику химической реакции, происходящей при постепенном добавлении лимонного сока к раствору перманганата калия. Ответ: При постепенном добавлении лимонного сока к раствору перманганата калия происходит изменение цвета с фиолетового на бесцветный. Следовательно, эта реакция характеризуется «изменением окраски». Вопрос 5: Назовите одну характеристику химической реакции, происходящей при обработке негашеной извести водой. Ответ: При обработке негашеной извести водой образуется гашеная известь с выделением большого количества тепла. Следовательно, эта реакция характеризуется «изменением температуры». Вопрос 6: Назовите одну характеристику химической реакции, происходящей при сжигании воска в виде свечи.
 Следовательно, «образование осадка» и «изменение цвета» являются двумя характеристиками этой химической реакции.
Следовательно, «образование осадка» и «изменение цвета» являются двумя характеристиками этой химической реакции.


 022 mm/m/°C
022 mm/m/°C