Характеристики д816: Стабилитрон Д816 Д816А, Д816Б, Д816В, Д816Г, Д816Д
alexxlab | 10.12.2022 | 0 | Разное
Стабилитрон Д816 Д816А, Д816Б, Д816В, Д816Г, Д816Д
ОТ КАТОДА ДО АНОДА
Поиск по сайту Новости Галогенным лампам снова нашли замену | ГЛАВНАЯ » СТАБИЛИТРОНЫ » Д816 Стабилитрон Д816 (Д816А, Д816Б, Д816В, Д816Г, Д816Д) – диффузионно-сплавной, кремниевый, большой и средней мощности. Основное назначение – стабилизация напряжений в диапазоне от 22 В до 47 В. Ток стабилизации имеет диапазон от 10 мА до 230 мА. Имеет жёсткие выводы и металлостеклянный корпус. На корпусе стабилитрона наносится его тип и цоколёвка. В рабочем режиме корпус стабилитрона является катодом (отрицательным выводом). С комплектующими деталями стабилитрон весит 6 г. Электрические параметры Д816 (Д816А, Д816Б, Д816В, Д816Г, Д816Д)
Предельные характеристики стабилитрона Д816
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Стабилитрон Д816 — DataSheet
Перейти к содержимому
Корпус стабилитронов Д816, Д816, Д817
Описание
Стабилитроны кремниевые, диффузионно-сплавные, средней и большой мощности. Предназначены для стабилизации номинального напряжения 5, 6…100 В в диапазоне токов стабилизации 5 мА…1,4 А. Выпускаются в металлостеклянном корпусе с жесткими выводами. Тип стабилитрона приводится на корпусе. Корпус стабилитрона в рабочем режиме служит отрицательным электродом (катодом). Масса стабилитрона с комплектующими деталями не более 6 г.
Стабилитрон должен крепиться к теплоотводящему радиатору, обеспечивающему сохранение температуры корпуса при работе не выше +130 °С Рекомендуется применение алюминиевого радиатора черного цвета толщиной 3…4 мм, площадью не менее 100 см2. При креплении стабилитрона к радиатору крутящий момент, воздействующий на вывод катода, не должен превышать 1,17 Н·м. Запрещается прилагать к анодному выводу растягивающую силу более 14,7 Н и изгибающее усилие, превышающее 7,35 Н·м в месте просечки.
Запрещается прилагать к анодному выводу растягивающую силу более 14,7 Н и изгибающее усилие, превышающее 7,35 Н·м в месте просечки.
Пайка анодного вывода допускается не ближе 5 мм от корпуса; время пайки не более 3 с при температуре жала паяльника не выше +280 °С.
Допускается последовательное соединение любого числа стабилитронов. Параллельное включение стабилитронов разрешается при условии, что суммарная рассеиваемая на всех стабилитронах мощность не превышает допустимую для одного стабилитрона.
| Обозначение | Значение для: | Ед. изм. | |||||
| Д816А | Д816Б | Д816В | Д816Г | Д816Д | |||
| Аналог | — | — | — | — | — | — | |
| Uст | мин. | 19.6 | 24.2 | 29.5 | 35 | 42.5 | В |
| ном. | — | — | — | — | — | ||
| макс. | 29.5 | 36 | 43 | 51.5 | |||
| при Iст | 150 | 150 | 150 | 150 | 150 | мА | |
| αUст | 0.12 | 0.12 | 0.12 | 0.12 | 0.12 | %/°C | |
| δUст | 5 | 5 | 5 | 5 | 5 | % | |
| Uпр (при Iпр, мА) | 1.5 (500) | 1.5 (500) | 1.5 (500) | 1.5 (500) | 1.5 (500) | В | |
| rст (при Iст, мА) | 7 (150) | 8 (150) | 10 (150) | 12 (150) | 15 (150) | Ом | |
| Iст | мин. | 10 | “>10 | 10 | 10 | 10 | мА |
| макс. | 230 | 180 | 150 | 130 | 110 | ||
| Pпp | 5 | 5 | 5 | 5 | 5 | Вт | |
| T | -60…+130 | -60…+130 | -60…+130 | -60…+130 | -60…+130 | °C | |
- Uст — Напряжение стабилизации.

- αUст — Температурный коэффициент напряжения стабилизации.
- δUст — Временная нестабильность напряжения стабилизации.
- Uпр — Постоянное прямое напряжение.
- Iпр — Постоянный прямой ток.
- rст — Дифференциальное сопротивление стабилитрона.
- Iст — Ток стабилизации.
- Pпp — Прямая рассеиваемая мощность.
- T — Температура окружающей среды.
Зависимость максимальной рассеиваемой мощности от температуры | Зависимость максимального тока стабилизации от температуры |
Зависимость максимального тока стабилизации от температуры | Зависимость максимального тока стабилизации от температуры |
| Зависимость дифференциального сопротивления от тока стабилизации | |
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
KIT D816 мутантный/CBF-негативный острый миелоидный лейкоз: подтип низкого риска, связанный с системным мастоцитозом
1. Valent P, Akin C, Escribano L, Fodinger M, Hartmann K, Brockow K, et al. Стандарты и стандартизация при мастоцитозе: консенсусные заявления по диагностике, рекомендации по лечению и критерии ответа. Евро Джей Клин Инвест. 2007; 37: 435–53. doi: 10.1111/j.1365-2362.2007.01807.x. [PubMed] [CrossRef] [Google Scholar]
2. Valent P, Horny HP, Escribano L, Longley BJ, Li CY, Schwartz LB, et al. Диагностические критерии и классификация мастоцитоза: консенсусное предложение. Лейк Рез. 2001; 25: 603–25. doi: 10.1016/S0145-2126(01)00038-8. [PubMed] [CrossRef] [Академия Google]
3. Theoharides TC, Valent P, Akin C. Тучные клетки, мастоцитоз и родственные расстройства. N Engl J Med. 2015; 373:163–72. doi: 10.1056/NEJMra1409760. [PubMed] [CrossRef] [Google Scholar]
4. Парданани А. Системный мастоцитоз у взрослых: обновленная информация о диагностике, стратификации риска и лечении, 2013 г. Am J Гематол. 2013; 88: 612–24. doi: 10.1002/ajh.23459. [PubMed] [CrossRef] [Google Scholar]
Am J Гематол. 2013; 88: 612–24. doi: 10.1002/ajh.23459. [PubMed] [CrossRef] [Google Scholar]
5. Gleixner KV, Mayerhofer M, Cerny-Reiterer S, Hormann G, Rix U, Bennett KL, et al. KIT-D816V-независимая передача онкогенных сигналов в опухолевых клетках при системном мастоцитозе: роль Lyn и Btk в активации и разрушении дазатинибом и бозутинибом. Кровь. 2011; 118: 1885–9.8. doi: 10.1182/blood-2010-06-289959. [PubMed] [CrossRef] [Google Scholar]
6. Garcia-Montero AC, Jara-Acevedo M, Teodosio C, Sanchez ML, Nunez R, Prados A, et al. Мутация KIT в тучных клетках и других линиях гемопоэтических клеток костного мозга при системных заболеваниях тучных клеток: проспективное исследование Испанской сети по мастоцитозу (REMA) в серии из 113 пациентов. Кровь. 2006; 108: 2366–72. doi: 10.1182/blood-2006-04-015545. [PubMed] [CrossRef] [Google Scholar]
7. Sotlar K, Marafioti T, Griesser H, Theil J, Aepinus C, Jaussi R, et al. Обнаружение мутации c-kit Asp 816 в Val в микрорассеченных инфильтратах костного мозга при системном мастоцитозе, ассоциированном с хроническим миеломоноцитарным лейкозом.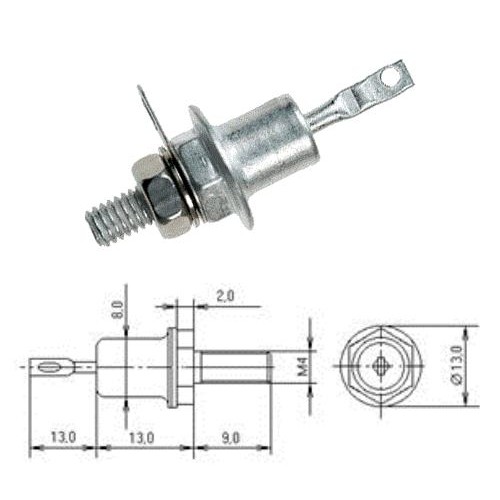 Дж. Клин Патол Мол Патол. 2000; 53: 188–9.3. doi: 10.1136/mp.53.4.188. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Дж. Клин Патол Мол Патол. 2000; 53: 188–9.3. doi: 10.1136/mp.53.4.188. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
8. Sotlar K, Colak S, Bache A, Berezowska S, Krokowski M, Bultmann B, et al. Вариабельное присутствие KITD816V при клональных гематологических заболеваниях, не связанных с тучными клетками, связанных с системным мастоцитозом (SM-AHNMD) J Pathol. 2010; 220:586–95. doi: 10.1002/path.2677. [PubMed] [CrossRef] [Google Scholar]
9. Schwaab J, Schnittger S, Sotlar K, Walz C, Fabarius A, Pfirrmann M, et al. Комплексное мутационное профилирование при прогрессирующем системном мастоцитозе. Кровь. 2013; 122:2460–6. doi: 10.1182/blod-49 апреля 2013 г.6448. [PubMed] [CrossRef] [Google Scholar]
10. Jawhar M, Schwaab J, Schnittger S, Meggendorfer M, Pfirrmann M, Sotlar K, et al. Дополнительные мутации в SRSF2, ASXL1 и/или RUNX1 определяют группу высокого риска пациентов с прогрессирующим системным мастоцитозом KIT D816V(+). Лейкемия. 2016;30:136–43. doi: 10.1038/leu.2015.284. [PubMed] [CrossRef] [Google Scholar]
doi: 10.1038/leu.2015.284. [PubMed] [CrossRef] [Google Scholar]
11. Pardanani A, Lasho T, Elala Y, Wassie E, Finke C, Reichard KK, et al. Секвенирование следующего поколения при системном мастоцитозе: создание клинической прогностической модели с дополненной мутацией для выживания. Am J Гематол. 2016;91:888–93. doi: 10.1002/ajh.24426. [PubMed] [CrossRef] [Google Scholar]
12. Jawhar M, Schwaab J, Schnittger S, Sotlar K, Horny HP, Metzgeroth G, et al. Молекулярное профилирование миелоидных клеток-предшественников при запущенном системном мастоцитозе с множественными мутациями идентифицирует KIT D816V как отчетливое и позднее событие. Лейкемия. 2015;29:1115–22. doi: 10.1038/leu.2015.4. [PubMed] [CrossRef] [Google Scholar]
13. Kim HJ, Ahn HK, Jung CW, Moon JH, Park CH, Lee KO и др. Мутация KIT D816 связана с неблагоприятными исходами при остром миелоидном лейкозе, особенно в подгруппе с реаранжировкой RUNX1/RUNX1T1. Энн Хематол. 2013;92: 163–71. doi: 10.1007/s00277-012-1580-5. [PubMed] [CrossRef] [Google Scholar]
[PubMed] [CrossRef] [Google Scholar]
14. Yui S, Kurosawa S, Yamaguchi H, Kanamori H, Ueki T, Uoshima N, et al. Мутация D816 гена KIT при остром миелоидном лейкозе связана с более плохим прогнозом, чем другие мутации гена KIT. Энн Хематол. 2017;96:1641–52. doi: 10.1007/s00277-017-3074-y. [PubMed] [CrossRef] [Google Scholar]
15. Hilmi FAI, Al-Sabbagh A, Soliman DS, Sabah HA, Ismail OM, Yassin M, et al. Острый миелоидный лейкоз с Inv(16)(p13q22), связанный со скрытым системным мастоцитозом: клинический случай и обзор литературы. Clin Med Insights Заболевания крови. 2017;10. 10.1117/1179545X17700858. [Бесплатная статья PMC] [PubMed]
16. Escribano L, Garca-Montero A, Nunez-Lopez R, Lopez-Jimenez J, Almeida J, Prados A, et al. Системный мастоцитоз, связанный с острым миелоидным лейкозом: клинический случай и последствия для патогенеза заболевания. J Аллергия Клин Иммунол. 2004; 114:28–33. doi: 10.1016/j.jaci.2004.02.042. [PubMed] [CrossRef] [Google Scholar]
17. Cornet E, Dumezy F, Roumier C, Lepelley P, Jouy N, Philippe N, et al. Участие общей клетки-предшественника в развитии острого миелоидного лейкоза, связывающего основной фактор, связанного с мастоцитозом. Лейк Рез. 2012;36:1330–3. doi: 10.1016/j.leukres.2012.07.001. [PubMed] [CrossRef] [Академия Google]
Cornet E, Dumezy F, Roumier C, Lepelley P, Jouy N, Philippe N, et al. Участие общей клетки-предшественника в развитии острого миелоидного лейкоза, связывающего основной фактор, связанного с мастоцитозом. Лейк Рез. 2012;36:1330–3. doi: 10.1016/j.leukres.2012.07.001. [PubMed] [CrossRef] [Академия Google]
18. Пулларкат В., Беделл В., Ким Ю., Бхатия Р., Накамура Р., Форман С. и др. Неопластические тучные клетки при системном мастоцитозе, связанном с острым миелоидным лейкозом t(8;21), происходят из лейкемического клона. Лейк Рез. 2007; 31: 261–5. doi: 10.1016/j.leukres.2006.03.006. [PubMed] [CrossRef] [Google Scholar]
19. Pullarkat ST, Pullarkat V, Kroft SH, Wilson CS, Ahsanuddin AN, Mann KP, et al. Системный мастоцитоз, ассоциированный с t(8;21)(q22; q22) острым миелоидным лейкозом. Дж Гематоп. 2009 г.;2:27–33. doi: 10.1007/s12308-009-0023-2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
20. Jawhar M, Schwaab J, Horny HP, Sotlar K, Naumann N, Fabarius A, et al. Влияние централизованной оценки гистологии костного мозга при системном мастоцитозе. Евро Джей Клин Инвест. 2016;46:392–7. doi: 10.1111/eci.12607. [PubMed] [CrossRef] [Google Scholar]
Влияние централизованной оценки гистологии костного мозга при системном мастоцитозе. Евро Джей Клин Инвест. 2016;46:392–7. doi: 10.1111/eci.12607. [PubMed] [CrossRef] [Google Scholar]
21. Horny HPAC, Metcalfe DD, Swerdlow SH, Campo E, Harris NL, et al. Патология и генетика. Опухоли кроветворной и лимфоидной тканей. Лион, Франция: IARC Press; 2008. Классификация опухолей Всемирной организации здравоохранения (ВОЗ). Мастоцитоз (заболевание тучных клеток), стр. 54–63. [Академия Google]
22. Арбер Д.А., Орази А., Хассерджян Р., Тиле Дж., Боровиц М.Дж., Ле Бо М.М. и соавт. Пересмотренная в 2016 г. классификация миелоидных новообразований и острого лейкоза Всемирной организации здравоохранения. Кровь 2016; 2391–405. [PubMed]
23. Парданани А. Системный мастоцитоз у взрослых: обновленная информация о диагностике, стратификации риска и лечении, 2017 г. Am J Гематол. 2016;91:1146–59. doi: 10.1002/ajh.24553. [PubMed] [CrossRef] [Google Scholar]
24. Erben P, Schwaab J, Metzgeroth G, Horny HP, Jawhar M, Sotlar K, et al. KIT D816V экспрессирует аллельную нагрузку для диагностики и мониторинга системного мастоцитоза. Энн Хематол. 2014;93:81–8. doi: 10.1007/s00277-013-1964-1. [PubMed] [CrossRef] [Google Scholar]
KIT D816V экспрессирует аллельную нагрузку для диагностики и мониторинга системного мастоцитоза. Энн Хематол. 2014;93:81–8. doi: 10.1007/s00277-013-1964-1. [PubMed] [CrossRef] [Google Scholar]
25. Simons A, Shaffer LG, Hastings RJ. Цитогенетическая номенклатура: изменения в ISCN 2013 г. по сравнению с изданием 2009 г. Цитогенет Геном Res. 2013; 141:1–6. doi: 10.1159/000353118. [PubMed] [CrossRef] [Google Scholar]
26. Schoch C, Schnittger S, Bursch S, Gerstner D, Hochhaus A, Berger U, et al. Сравнение анализа хромосомных полос, интерфазной и гиперметафазной FISH, качественной и количественной ПЦР для диагностики и наблюдения за хроническим миелоидным лейкозом: исследование 350 случаев. Лейкемия. 2002; 16: 53–9. doi: 10.1038/sj.leu.2402329. [PubMed] [CrossRef] [Google Scholar]
27. Dohner H, Estey E, Grimwade D, Amadori S, Appelbaum FR, Buchner T, et al. Диагностика и лечение ОМЛ у взрослых: рекомендации ELN 2017 г. от международной группы экспертов. Кровь. 2017; 129:424–47. doi: 10.1182/blod-2016-08-733196. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
doi: 10.1182/blod-2016-08-733196. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Papaemmanuil E, Gerstung M, Bullinger L, Gaidzik VI, Paschka P, Roberts ND, et al. Геномная классификация и прогноз при остром миелоидном лейкозе. N Engl J Med. 2016;374:2209–21. doi: 10.1056/NEJMoa1516192. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Jawhar M, Schwaab J, Meggendorfer M, Naumann N, Horny HP, Sotlar K, et al. Клиническое и молекулярное разнообразие тучноклеточного лейкоза с ассоциированным гематологическим новообразованием или без него. Гематология. 2017; 102:1035–43. doi: 10.3324/гематол.2017.163964. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Jawhar M, Schwaab J, Naumann N, Horny HP, Sotlar K, Haferlach T, et al. Ответ и прогрессирование на мидостаурин при прогрессирующем системном мастоцитозе: KIT D816V и другие молекулярные маркеры. Кровь. 2017; 130:137–45. doi: 10.1182/blood-2017-01-764423. [PubMed] [CrossRef] [Академия Google]
31. Naumann N, Jawhar M, Schwaab J, Kluger S, Lubke J, Metzgeroth G, et al. Частота и прогностическое значение цитогенетических аберраций у пациентов с системным мастоцитозом. Гены Хромосомы Рак. 2018;57:252–9. doi: 10.1002/gcc.22526. [PubMed] [CrossRef] [Google Scholar]
Naumann N, Jawhar M, Schwaab J, Kluger S, Lubke J, Metzgeroth G, et al. Частота и прогностическое значение цитогенетических аберраций у пациентов с системным мастоцитозом. Гены Хромосомы Рак. 2018;57:252–9. doi: 10.1002/gcc.22526. [PubMed] [CrossRef] [Google Scholar]
32. Mossner M, Jann JC, Wittig J, Nolte F, Fey S, Nowak V, et al. Мутационные иерархии при миелодиспластических синдромах динамично адаптируются и развиваются в зависимости от ответа на терапию и ее неудачи. Кровь. 2016; 128:1246–59. doi: 10.1182/blood-2015-11-679167. [PubMed] [CrossRef] [Google Scholar]
33. Walter MJ, Shen D, Ding L, Shao J, Koboldt DC, Chen K, et al. Клональная архитектура вторичного острого миелоидного лейкоза. N Engl J Med. 2012; 366:1090–8. doi: 10.1056/NEJMoa1106968. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
34. Падрон Э., Абдель-Вахаб О. Важность генетики в клиническом лечении хронического миеломоноцитарного лейкоза. Дж. Клин Онкол. 2013;31:2374–6. doi: 10. 1200/JCO.2013.48.9120. [PubMed] [CrossRef] [Google Scholar]
1200/JCO.2013.48.9120. [PubMed] [CrossRef] [Google Scholar]
35. Papaemmanuil E, Gerstung M, Malcovati L, Tauro S, Gundem G, Van Loo P, et al. Клинические и биологические последствия драйверных мутаций при миелодиспластических синдромах. Кровь. 2013; 122:3616–27. doi: 10.1182/blood-2013-08-518886. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
36. Bernd HW, Sotlar K, Lorenzen J, Osieka R, Fabry U, Valent P, et al. Острый миелоидный лейкоз с t(8;21), ассоциированный со «скрытым» мастоцитозом. Отчет о необычном случае и обзор литературы. Джей Клин Патол. 2004; 57: 324–8. doi: 10.1136/jcp.2003.012864. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
37. Pardanani A, Lim KH, Lasho TL, Finke C, McClure RF, Li CY, et al. Прогностически значимая разбивка 123 пациентов с системным мастоцитозом, ассоциированным с другими миелоидными новообразованиями. Кровь. 2009; 114:3769–72. doi: 10.1182/blood-2009-05-220145. [PubMed] [CrossRef] [Google Scholar]
38. Wang SA, Hutchinson L, Tang G, Chen SS, Miron PM, Huh YO, et al. Системный мастоцитоз с ассоциированным клональным гематологическим заболеванием не тучноклеточного происхождения: клиническое значение и сравнение хромосомных аномалий в компонентах SM и AHNMD. Am J Гематол. 2013;88:219–24. doi: 10.1002/ajh.23380. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Wang SA, Hutchinson L, Tang G, Chen SS, Miron PM, Huh YO, et al. Системный мастоцитоз с ассоциированным клональным гематологическим заболеванием не тучноклеточного происхождения: клиническое значение и сравнение хромосомных аномалий в компонентах SM и AHNMD. Am J Гематол. 2013;88:219–24. doi: 10.1002/ajh.23380. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
39. Haferlach T, Nagata Y, Grossmann V, Okuno Y, Bacher U, Nagae G, et al. Ландшафт генетических поражений у 944 пациентов с миелодиспластическими синдромами. Лейкемия. 2014; 28: 241–7. doi: 10.1038/leu.2013.336. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
40. Lindsley RC, Saber W, Mar BG, Redd R, Wang T, Haagenson MD, et al. Прогностические мутации при миелодиспластическом синдроме после трансплантации стволовых клеток. N Engl J Med. 2017; 376: 536–47. doi: 10.1056/NEJMoa1611604. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
41. Itzykson R, Kosmider O, Renneville A, Gelsi-Boyer V, Meggendorfer M, Morabito M, et al. Прогностическая оценка, включая генные мутации при хроническом миеломоноцитарном лейкозе. Дж. Клин Онкол. 2013;31:2428–36. doi: 10.1200/JCO.2012.47.3314. [PubMed] [CrossRef] [Google Scholar]
Прогностическая оценка, включая генные мутации при хроническом миеломоноцитарном лейкозе. Дж. Клин Онкол. 2013;31:2428–36. doi: 10.1200/JCO.2012.47.3314. [PubMed] [CrossRef] [Google Scholar]
42. Tefferi A, Lasho TL, Finke CM, Elala Y, Hanson CA, Ketterling RP, et al. Целевое глубокое секвенирование при первичном миелофиброзе. Кровь Adv. 2016;1:105–11. doi: 10.1182/bloodadvances.2016000208. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
43. Теффери А., Лашо Т.Л., Гульельмелли П., Финке К.М., Ротунно Г., Элала И. и соавт. Целевое глубокое секвенирование при истинной полицитемии и эссенциальной тромбоцитемии. Кровь Adv. 2016; 1:21–30. doi: 10.1182/bloodadvances.2016000216. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
44. Lasho TL, Mudireddy M, Finke CM, Hanson CA, Ketterling RP, Szuber N, et al. Целевое секвенирование нового поколения при миелопролиферативных новообразованиях бластной фазы. Кровь Adv. 2018;2:370–80. doi: 10.1182/bloodadvances. 2018015875. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2018015875. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
45. Buchner T, Schlenk RF, Schaich M, Dohner K, Krahl R, Krauter J, et al. Острый миелоидный лейкоз (ОМЛ): разные стратегии лечения по сравнению с общим стандартным методом — комбинированный проспективный анализ немецкой межгрупповой группы по ОМЛ. Дж. Клин Онкол. 2012;30:3604–10. doi: 10.1200/JCO.2012.42.2907. [PubMed] [CrossRef] [Google Scholar]
46. Gotlib J, Kluin-Nelemans HC, George TI, Akin C, Sotlar K, Hermine O, et al. Эффективность и безопасность мидостаурина при прогрессирующем системном мастоцитозе. N Engl J Med. 2016; 374:2530–41. дои: 10.1056/NEJMoa1513098. [PubMed] [CrossRef] [Google Scholar]
47. DeAngelo DJ, George TI, Linder A, Langford C, Perkins C, Ma J, et al. Эффективность и безопасность мидостаурина у пациентов с прогрессирующим системным мастоцитозом: 10-летнее медианное наблюдение за исследованием фазы II. Лейкемия. 2018;32:470–8. doi: 10.1038/leu.2017.234. [PubMed] [CrossRef] [Google Scholar]
48. Gotlib J, Berube C, Growney JD, Chen CC, George TI, Williams C, et al. Активность ингибитора тирозинкиназы PKC412 у больного тучноклеточным лейкозом с мутацией D816V KIT. Кровь. 2005; 106: 2865–70. doi: 10.1182/blood-2005-04-1568. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Gotlib J, Berube C, Growney JD, Chen CC, George TI, Williams C, et al. Активность ингибитора тирозинкиназы PKC412 у больного тучноклеточным лейкозом с мутацией D816V KIT. Кровь. 2005; 106: 2865–70. doi: 10.1182/blood-2005-04-1568. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
49. Gotlib J, George T, Akin C, Sotlar K, et al. Мидостаурин (PKC412) Демонстрирует высокую частоту стойких ответов у пациентов с прогрессирующим системным мастоцитозом: результаты полностью накопленного глобального исследования 2 фазы CPKC412D2201. Кровь. 2014;124:21. doi: 10.1182/blood-2013-12-544197. [CrossRef] [Google Scholar]
50. Falchi L, Verstovsek S. Мутации набора: новые идеи и диагностическая ценность. Иммунол Аллергия Клин Норт Ам. 2018; 38: 411–28. doi: 10.1016/j.iac.2018.04.005. [PubMed] [CrossRef] [Академия Google]
51. DeAngelo DJ, Quiery AT, Radia D, Drummond MW, Gotlib J, Robinson WA, et al. Клиническая активность в исследовании фазы 1 BLU-285, мощного высокоселективного ингибитора KIT D816V при далеко зашедшем системном мастоцитозе. Кровь. 2017;130:2. doi: 10.1182/blood-2017-05-781278. [CrossRef] [Google Scholar]
Кровь. 2017;130:2. doi: 10.1182/blood-2017-05-781278. [CrossRef] [Google Scholar]
KIT D816, анализ мутаций (мастоцитоз): 91772
Мед фьюжн |
Список тестов | А Б С Д Е Ф грамм ЧАС я Дж К л М Н О п Вопрос р С Т U В Вт Икс Д Z # |
Тестовый код
KIT816 или 91772
Коды CPT
81273
Альтернативный вариант: цельная кровь в пробирке ACD-B (желтая верхняя часть) или пробирка с гепарином натрия (зеленая верхняя часть); костный мозг в пробирке с ЭДТА (лиловая верхняя часть) или пробирке с гепарином натрия (зеленая верхняя часть); Фиксированный формалином парафиновый блок тканей; 10 предметных стекол,
Транспортный контейнер
Транспортировка: 5 мл цельной крови (минимум 2 мл) ИЛИ 2 мл костного мозга (минимум 0,5 мл) ИЛИ блок ИЛИ 10 предметных стекол (минимум 6 предметных стекол).
Температура при транспортировке
Температура окружающей среды.
Стабильность образцов
Цельная кровь или костный мозг: Комнатная температура: 7 дней; В холодильнике: 7 дней; Замороженные: неприемлемо
Фиксированные формалином ткани или предметные стекла, залитые в парафин: Комнатная температура: Неопределенный срок; Охлажденный: бессрочный; Замороженный: неприемлемо
Критерии отклонения (например, гемолиз? Липемия? Оттаивание/другое?)
Получено замороженным.
Методология
Секвенирование ДНК
Расписание установки
Воскресенья – Суббота
Доступный
5 дней (из получения по получению лаборатории. и его аналитические рабочие характеристики были определены Quest Diagnostics. Он не был очищен или одобрен FDA. Этот анализ прошел валидацию в соответствии с правилами CLIA и используется в клинических целях.
Референтный диапазон
Не обнаружено
Клиническая значимость
Точечная мутация онкогена KIT в кодоне 816 (D816V) наблюдается в >90% случаев системного мастоцита (СММ). Наличие мутации KIT D816V является одним из второстепенных критериев для диагностики СМ, и тестирование мутации может помочь в диагностике, особенно в ограниченном количестве образцов. Мутации KIT D816, включая D816V, D816H и D816Y, также являются наиболее распространенными мутациями KIT, наблюдаемыми при остром миелоидном лейкозе (ОМЛ) основного связывающего фактора. Как при t(8;21), так и при inv(16)/t(16;16) ОМЛ случаи с мутацией KIT D816 связаны с худшими исходами, чем случаи без мутаций.
Этот метод пиросеквенирования ДНК на основе ПЦР чувствителен к обнаружению мутации KIT D816V до 2%.
Перформанс-лаборатория
Диагностика квеста
Коды CPT, представленные в этом документе, основаны на рекомендациях AMA и предназначены только для информационных целей.



 ..+120°C
..+120°C