Химическая формула углекислого газа: Углекислый газ (диоксид углерода) – Что такое Углекислый газ (диоксид углерода)?
alexxlab | 15.02.2023 | 0 | Разное
Страница не найдена
2022 №6, Статьи →
Измайлова Гульнара Ришадовна ФГБОУ ВО «Уфимский государственный нефтяной технический университет» Институт нефти и газа (филиал), Октябрьск, Россия Доцент кафедры «Разведка и разработка нефтяных и газовых месторождений» Кандидат физико-математических наук E-mail: [email protected] Аннотация. В работе рассматривается эффект нагрева нефтенасыщенного пласта при …
30.12.2022
Читать далее…
2022 №6, Статьи →
Прохоров Алексей Васильевич ФГБОУ ВО «Алтайский государственный технический университет имени И.И. Ползунова», Барнаул, Россия Аспирант кафедры «Основания, фундаменты, инженерная геология и геодезия» E-mail: [email protected] Носков Игорь Владиславович ФГБОУ ВО «Алтайский государственный технический университет имени И.И. Ползунова», Барнаул, Россия Заведующий кафедры …
30.12.2022
Читать далее.
2022 №6, Статьи →
Деловая Анастасия Валерьевна ФГБОУ ВО «Кубанский государственный технологический университет», Краснодар, Россия Институт строительства и транспортной инфраструктуры Магистрант кафедры «Технологии, организации, экономики строительства и управления недвижимостью» E-mail: [email protected] Ковтуненко Марина Георгиевна ФГБОУ ВО «Кубанский государственный технологический университет», Краснодар, Россия Институт строительства …
30.12.2022
Читать далее…
2022 №6, Статьи →
Носков Игорь Владиславович ФГБОУ ВО «Алтайский государственный технический университет имени И.И. Ползунова», Барнаул, Россия Заведующий кафедры «Основания, фундаменты, инженерная геология и геодезия» Кандидат технических наук, доцент E-mail: [email protected] Ананьев Сергей Анатольевич ФГБОУ ВО «Алтайский государственный технический университет имени И.И. Ползунова», …
30.12.2022
Читать далее. ..
..
2022 №6, Статьи →
Муслова Дарья Дмитриевна ФГБОУ ВО «Тюменский индустриальный университет», Тюмень, Россия Магистрант E-mail: [email protected] Пронозин Яков Александрович ФГБОУ ВО «Тюменский индустриальный университет», Тюмень, Россия Профессор Доктор технических наук, профессор E-mail: [email protected] ORCID: https://orcid.org/0000-0002-6173-2796 РИНЦ: https://www.elibrary.ru/author_profile.asp?id=415568 SCOPUS: https://www.scopus.com/authid/detail.url?authorId=55390829400 Web of Science: https://www.webofscience.com/wos/author/rid/B-1824-2018 …
22.12.2022
Читать далее…
2022 №5, Статьи →
Яковлев Владимир Михайлович АНО ВО «Университет мировых цивилизаций имени В.В. Жириновского», Москва, Россия Старший научный сотрудник Доктор экономических наук, профессор E-mail: [email protected] РИНЦ: https://elibrary.ru/author_profile.asp?id=624372 Аннотация. В статье раскрываются условия, причины и особенности возникновения рисков теневой и коррупционной деятельности и их …
21. 12.2022
12.2022
Читать далее…
2022 №6, Статьи →
Гукетлова Алёна Артуровна ФГОБУ ВО «Финансовый университет при Правительстве Российской Федерации», Москва, Россия «Юридический» факультет Бакалавр E-mail: [email protected] Аннотация. Автор публикации рассматривает договор каршеринга как относительно нового явления, из которого вытекают отношения еще не до конца урегулированные национальным законодательством. Автор …
21.12.2022
Читать далее…
2022 №6, Статьи →
Бабаян Арег Мартикович ФГБОУ ВО «Финансовый университет при Правительстве Российской Федерации», Москва, Россия Факультет «Налогов, аудита и бизнес-анализа» Бакалавр E-mail: [email protected] Аннотация. В настоящее время вопрос таможенного регулирования является одним из более актуальных в экономике. В рамках данной статьи автор …
21.12.2022
Читать далее…
2022 №6, Статьи →
Саушева Оксана Сергеевна ФГБОУ ВО «Национальный исследовательский Мордовский государственный университет имени Н.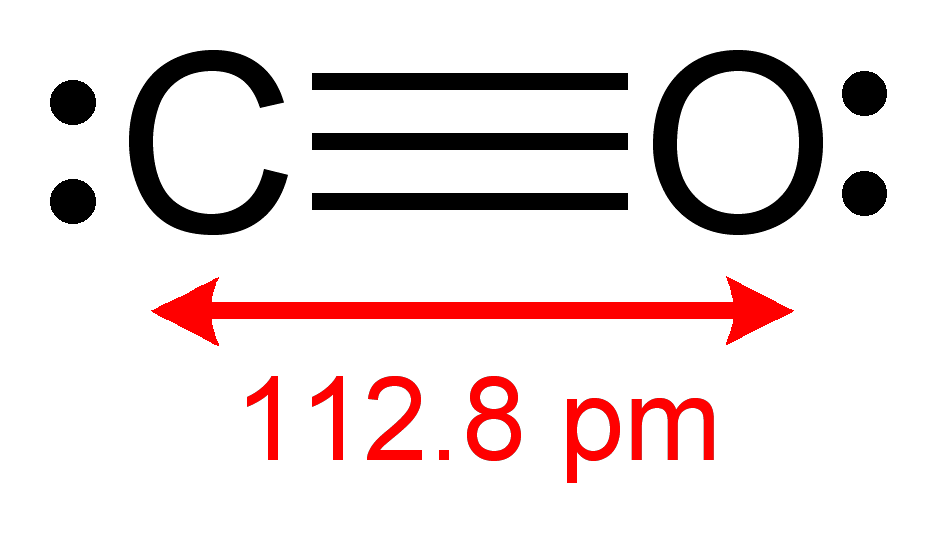 П. Огарёва», Саранск, Россия Доцент кафедры «Теоретической экономики и экономической безопасности» Кандидат экономических наук, доцент E-mail: [email protected] ORCID: https://orcid.org/0000-0003-2901-9584 РИНЦ: https://elibrary.ru/author_profile.asp?id=624372 SCOPUS: https://www.scopus.com/authid/detail.url?authorId=55916347600 Аннотация. В статье рассмотрены современные тенденции …
П. Огарёва», Саранск, Россия Доцент кафедры «Теоретической экономики и экономической безопасности» Кандидат экономических наук, доцент E-mail: [email protected] ORCID: https://orcid.org/0000-0003-2901-9584 РИНЦ: https://elibrary.ru/author_profile.asp?id=624372 SCOPUS: https://www.scopus.com/authid/detail.url?authorId=55916347600 Аннотация. В статье рассмотрены современные тенденции …
21.12.2022
Читать далее…
2022 №6, Статьи →
Добряхина Олеся Павловна ФГБОУ ВО «Заполярный государственный университет имени Н.М. Федоровского», Норильск, Россия Аспирант E-mail: [email protected] ORCID: https://orcid.org/0000-0001-8760-8315 РИНЦ: https://www.elibrary.ru/author_profile.asp?id=1152255 Аннотация. Статья посвящена вопросам управления рисками при реализации мегапроектов в российских условиях. Рассмотрена сущность мегапроектов и их роль в развитии …
16.12.2022
Читать далее…
RealGaz
Диоксид углерода (химическая формула C02) представляет собой природный химический состав, состоящий из 2-х атомов кислорода, каждый ковалентно связан двойной связью с одним атомом углерода. Он представляет собой газ при стандартной температуре и давлении, и существует в атмосфере Земли в таком состоянии, в качестве микропримеси газа при концентрации 0,04 процента (400 частей на миллион) по объему на 2014 г. Диоксид углерода используется в пищевой, нефтяной, химической промышленностях.
Он представляет собой газ при стандартной температуре и давлении, и существует в атмосфере Земли в таком состоянии, в качестве микропримеси газа при концентрации 0,04 процента (400 частей на миллион) по объему на 2014 г. Диоксид углерода используется в пищевой, нефтяной, химической промышленностях.
Является одним из наиболее часто используемых сжатых газов для пневматических (газ под давлением) систем в переносных инструментах. Диоксид углерода также используется в качестве атмосферы при сварке, хотя в сварочной дуге он вступает в реакцию с окислением большинства металлов. Использование в автомобильной промышленности является распространенным, несмотря на значительные доказательства того, что сварные швы, сделанные в двуокиси углерода, являются более хрупкими, чем сделанные в более инертных атмосферах, и что такие сварные швы ухудшаются с течением времени из-за образования угольной кислоты. Он используется в качестве сварочного газа в первую очередь потому, что он гораздо дешевле, чем более инертные газы, такие как аргон или гелий. Он используется во многих потребительских продуктах, которые требуют сжатого газа, поскольку он является недорогим и негорючим, и потому что он претерпевает фазовый переход из газа в жидкость при комнатной температуре при достижимом давлении приблизительно 60 бар (870 фунтов на квадратный дюйм, 59 атм), что позволяет значительно большему количеству углекислого газа поместиться в данном контейнере, чем было бы в противном случае. Спасательные жилеты часто содержат канистры сжатого углекислого газа для быстрого надувания. Алюминиевые капсулы CО2 также продаются как сжатый газ для пневматики, пейнтбольных маркеров, велосипедных шин, а также для изготовления газированной воды. Быстрое испарение жидкого диоксида углерода используется для производства взрывных работ в угольных шахтах. Высокие концентрации двуокиси углерода также могут быть использованы против вредителей. Жидкий диоксид углерода используется в сверхкритической сушке некоторых пищевых продуктов и технологических материалов, при подготовке образцов для растровой электронной микроскопии и в пяти декофеинизациях кофейных зерен.
Он используется во многих потребительских продуктах, которые требуют сжатого газа, поскольку он является недорогим и негорючим, и потому что он претерпевает фазовый переход из газа в жидкость при комнатной температуре при достижимом давлении приблизительно 60 бар (870 фунтов на квадратный дюйм, 59 атм), что позволяет значительно большему количеству углекислого газа поместиться в данном контейнере, чем было бы в противном случае. Спасательные жилеты часто содержат канистры сжатого углекислого газа для быстрого надувания. Алюминиевые капсулы CО2 также продаются как сжатый газ для пневматики, пейнтбольных маркеров, велосипедных шин, а также для изготовления газированной воды. Быстрое испарение жидкого диоксида углерода используется для производства взрывных работ в угольных шахтах. Высокие концентрации двуокиси углерода также могут быть использованы против вредителей. Жидкий диоксид углерода используется в сверхкритической сушке некоторых пищевых продуктов и технологических материалов, при подготовке образцов для растровой электронной микроскопии и в пяти декофеинизациях кофейных зерен.
Диоксид углерода тушит огонь, и некоторые огнетушители, особенно те, которые предназначены для электрических пожаров, содержат жидкий углекислый газ под давлением. Углекислотные огнетушители хорошо работают на небольших легковоспламеняющихся “жидких” и электрических пожарах, но не на обычных горючих пожарах, потому что, хотя они и исключают кислород, они не охлаждают горящие вещества значительно и когда рассеивается диоксид углерода, они могут свободно загореться под воздействием атмосферного кислорода.
Углекислый газ также широко используется в качестве огнетушащего вещества в стационарных системах противопожарной защиты для местного применения к конкретным опасностям и полного затопления охраняемого пространства. Стандарты Международной морской организации также признают системы двуокиси углерода для противопожарной защиты трюмов и машинного отделения. Системы противопожарной защиты на основе двуокиси углерода были связаны с гибелью нескольких человек, потому что они могут привести к удушью в достаточно высоких концентрациях. Обзор систем CО2 выявил 51 случай в период между 1975 и датой доклада, в результате чего произошло 72 смерти и 145 травм.
Обзор систем CО2 выявил 51 случай в период между 1975 и датой доклада, в результате чего произошло 72 смерти и 145 травм.
Жидкий диоксид углерода является хорошим растворителем для многих липофильных органических соединений и используется для удаления кофеина из кофе. Диоксид углерода привлек к себе внимание в фармацевтической и других химических промышленностях в качестве менее токсичной альтернативы для более традиционных растворителей, таких как хлорорганические соединения. Он используется некоторыми химчистками по этой причине.
Диоксид углерода используется при добыче нефти, где он вводится в или рядом с нефтедобывающими скважинами, как правило, в сверхкритических условиях. Такой подход позволяет повысить первоначальную нефтеотдачу за счет снижения остаточной нефтенасыщенности в пределах от 7 процентов до 23 процентов в дополнение к первичной добыче. Он действует и как нагнетающий агент и, когда растворяется в подземной сырой нефти, значительно снижает его вязкость, и, изменяя химию поверхности, позволяет нефти течь более быстро через резервуар к скважине удаления. В зрелых нефтяных месторождениях, обширные сети трубопроводов используются для перевозки диоксида углерода к точкам введения.
В зрелых нефтяных месторождениях, обширные сети трубопроводов используются для перевозки диоксида углерода к точкам введения.
Жидкий и твердый диоксид углерода являются важными хладагентами, особенно в пищевой промышленности, где они работают во время транспортировки и хранения мороженого и других замороженных продуктов. Твердый диоксид углерода называют “сухим льдом” и используется для небольших партий груза, где холодильное оборудование не практично. Твердый диоксид углерода всегда ниже -78.5°C при регулярном атмосферном давлении, независимо от температуры окружающего воздуха.
Анализ горения
Получение эмпирических и молекулярных формул из Данные о сжигании
Эмпирические и молекулярные
формулы соединений, содержащих только углерод и водород (C a H b )
или углерод, водород и кислород (C a H b O c )
можно определить с помощью процесса, называемого анализом горения.
Взвесьте образец анализируемое соединение и поместите его в прибор, показанный на рис. изображение ниже.
Сжечь компаунд полностью. Единственные продукты сгорания соединения, содержит только углерод и водород (C a H b ) или углерод, водород и кислород (C a H b O c ) являются углекислый газ и вода.
Н 2 О
и CO 2 проходят через две трубы. Одна трубка содержит
вещество, поглощающее воду, а другое содержит вещество
который поглощает углекислый газ. Взвесьте каждую из этих пробирок до и
после сгорания. Увеличение массы в первой пробирке
масса H
Предположим, что все
углерод в соединении был преобразован в CO 2 и
попал во вторую трубку. Вычислите массу углерода в
соединение от массы углерода в измеренной массе CO 2 сформировался.
Вычислите массу углерода в
соединение от массы углерода в измеренной массе CO 2 сформировался.
Предположим, что все водород в соединении превратился в H 2 О и попал в первую трубку. Вычислите массу водорода в соединения от массы водорода в измеренной массе воды.
Если соединение содержит кислород, а также углерод и водород, рассчитайте массу кислорода путем вычитания массы углерода и водорода из общая масса исходного образца соединения.
Используйте эти данные для определить эмпирическую и молекулярную формулы обычным способом.
Прибор для анализа горения A
соединение, содержащее углерод и водород (C a H b ) или
углерод, водород и кислород (C a H b O c )
полностью сгорел с образованием H 2 O и CO 2 . Продукты
протягивается через две трубки. Первая трубка поглощает воду, а вторая трубка
поглощает углекислый газ.
Продукты
протягивается через две трубки. Первая трубка поглощает воду, а вторая трубка
поглощает углекислый газ.
Чтобы проиллюстрировать, как эмпирические и молекулярные формулы могут быть
определяется по данным, полученным в результате анализа горения, давайте рассмотрим
вещество под названием триоксан. Формальдегид, СН 2 O, неустойчив в чистом виде
газ, легко образующий смесь вещества, называемого триоксаном, и полимера
называется параформальдегидом. Вот почему формальдегид растворяют в растворителе, таких как вода, прежде чем она будет продана и использована. Молекулярная формула триоксана, который
содержит углерод, водород и кислород, можно определить по данным двух
разные эксперименты. В первом опыте сжигается 17,471 г триоксана.
в аппарате, показанном выше, и 10,477 г H
Мы можем получить
молекулярная формула соединения из его эмпирической формулы и его молекулярной
масса. (См. в тексте напоминание о том, как это делается.) Чтобы получить эмпирическую формулу, нам нужно определить массу в граммах
углерод, водород и кислород в 17,471 г триоксана. Таким образом, нам нужно
выполните эти общие действия.
(См. в тексте напоминание о том, как это делается.) Чтобы получить эмпирическую формулу, нам нужно определить массу в граммах
углерод, водород и кислород в 17,471 г триоксана. Таким образом, нам нужно
выполните эти общие действия.
Во-первых, преобразовать из данные приведены в граммах углерода, водорода и кислорода.
Во-вторых, определите эмпирическая формула из граммов углерода, водорода и кислорода.
В-третьих, определите молекулярная формула из эмпирической формулы и заданной молекулярной массы.
Поскольку мы предполагаем, что весь углерод в триоксане прореагировал чтобы образовалось в CO 2 , мы можем найти массу углерода в 17,471 г триоксана путем расчета массы углерода в 25,612 г CO 2 .
Поскольку мы предполагаем, что весь водород в триоксане прореагировал с образованием H 2 О,
мы можем найти массу водорода в 17,471 г триоксана, вычислив массу
водорода в 10,477 г H 2 O.
Поскольку триоксан содержит только углерод, водорода и кислорода, мы можем вычислить массу кислорода, вычитая масс углерода и водорода от общей массы триоксана.
? г О = 17,471 г триоксана – 6,9899 г С – 1,1724 г H = 9,309 г О
Теперь вычислим эмпирическую формулу, эмпирическая формула массы и молекулярная формула.
Образец Учебный лист : Расчет молекулярных формул на основе данных о горении
Предупреждение – Вы хотите рассчитать молекулярную формулу соединения содержащие только углерод и водород (C a H b ) или углерод, водород и кислород (C a H b O c ), и вы учитывая его молекулярную массу и массы CO 2 и H 2 О образуется при сгорании данной массы соединения.
Общие Процедура
Расчет количества
граммов углерода в соединении путем расчета количества граммов углерода
в данном количестве CO 2 .
Рассчитать количество граммов водорода в соединении, рассчитав количество граммов водород в данном количестве H 2 O.
Если соединение содержит кислород, рассчитайте количество граммов кислорода в нем путем вычитания масс углерода и водорода из заданной общей массы соединения.
? г О = (данные) г всего – (расчетное) г C – (расчетное) г Н
Расчет эмпирического Формула соединения из граммов углерода, водорода и кислорода.
Рассчитать формулу массы для эмпирической формулы и разделите заданную молекулярную массу на эмпирическая формула массы, чтобы получить n.
ПРИМЕР – Получение молекулярной формулы из Данные о сгорании:
Дианабол — один из анаболических стероидов, который использовался некоторыми
спортсменам для увеличения размеров и силы мышц. Это похоже на
мужской гормон тестостерон. Некоторые исследования показывают, что желаемые эффекты
препарата минимальны, а побочные эффекты, к которым относятся бесплодие и
повышенный риск рака печени и сердечных заболеваний, удерживает большинство людей от употребления
Это. Молекулярная формула Дианабола, состоящая из углерода, водорода и
кислорода, можно определить, используя данные двух разных экспериментов. в
В первом эксперименте сжигается 14,765 г Дианабола, 43,257 г CO2 и 12,39 г.Образуется 5 г Н3О.
Во втором эксперименте молекулярная масса Дианабола оказалась равной 300,44.
Какова молекулярная формула Дианабола?
Это похоже на
мужской гормон тестостерон. Некоторые исследования показывают, что желаемые эффекты
препарата минимальны, а побочные эффекты, к которым относятся бесплодие и
повышенный риск рака печени и сердечных заболеваний, удерживает большинство людей от употребления
Это. Молекулярная формула Дианабола, состоящая из углерода, водорода и
кислорода, можно определить, используя данные двух разных экспериментов. в
В первом эксперименте сжигается 14,765 г Дианабола, 43,257 г CO2 и 12,39 г.Образуется 5 г Н3О.
Во втором эксперименте молекулярная масса Дианабола оказалась равной 300,44.
Какова молекулярная формула Дианабола?
Решение:
Угарный газ — New World Encyclopedia
Угарный газ, с химической формулой CO, представляет собой бесцветный газ без запаха и вкуса. Это продукт неполного сгорания углеродсодержащих соединений, особенно в двигателях внутреннего сгорания. Он состоит из одного атома углерода, ковалентно связанного с одним атомом кислорода. Это газ при комнатной температуре. Он имеет значительную топливную ценность, горит на воздухе характерным голубым пламенем с выделением углекислого газа.
Это газ при комнатной температуре. Он имеет значительную топливную ценность, горит на воздухе характерным голубым пламенем с выделением углекислого газа.
Содержание
- 1 Производство
- 2 Структура
- 3 Основные химические реакции
- 3.1 Промышленное использование
- 3.2 Координационная химия
- 3.3 Органическая химия и химия основных групп
- 4 Оксид углерода в атмосфере
- 5 Роль в физиологии и питании
- 6 История
- 7 Токсичность
- 8 Примечания
- 9 Каталожные номера
- 10 Внешние ссылки
- 11 кредитов
Несмотря на свою серьезную токсичность, CO чрезвычайно полезен и лежит в основе многих современных технологий, являясь предшественником множества полезных и даже спасающих жизнь продуктов.
Производство
Оксид углерода настолько важен, что для его производства было разработано множество методов. [1]
[1]
Генераторный газ образуется при сгорании углерода в кислороде при высоких температурах при избытке углерода. В печи воздух пропускается через слой кокса. Первоначально произведенный CO 2 уравновешивается с оставшимся горячим углеродом с образованием CO. Реакция CO 2 с углеродом с образованием CO описывается как равновесие Будуара. При температуре выше 800 °C CO является преобладающим продуктом:
- O 2 + 2 C → 2 CO ΔH = -221 кДж/моль
Недостатком этого метода является то, что при использовании воздуха остается смесь, состоящая в основном из азота.
Синтез-газ или Водяной газ получают в результате эндотермической реакции пара и углерода:
- H 2 O + C → H 2 + CO ΔH = 131 кДж/моль
CO также является побочным продуктом восстановления руд оксидов металлов углеродом, что показано в упрощенной форме следующим образом:
- MO + C → M + CO ΔH = 131 кДж/моль
Поскольку CO представляет собой газ, процесс восстановления можно проводить путем нагревания, используя положительную (благоприятную) энтропию реакции. Диаграмма Эллингема показывает, что при высоких температурах образование CO предпочтительнее, чем CO 2 .
Диаграмма Эллингема показывает, что при высоких температурах образование CO предпочтительнее, чем CO 2 .
CO представляет собой ангидрид муравьиной кислоты. Как таковой его удобно получать дегидратацией муравьиной кислоты, например, серной кислотой. Еще одна лабораторная подготовка к угарному газу заключается в нагревании однородной смеси порошкообразного металлического цинка и карбоната кальция.
- Zn + CaCO 3 → ZnO + CaO + CO
Структура
Молекула CO характеризуется длиной связи 0,1128 нм. [2] Разница в формальном заряде и электроотрицательности компенсирует друг друга. В результате получается небольшой дипольный момент с отрицательным концом на атоме углерода. [3] Это расстояние соответствует частичной тройной связи. Молекула имеет малый дипольный момент и может быть представлена тремя резонансными структурами:
Крайняя левая форма резонанса является наиболее важной.
Азот изоэлектронен монооксиду углерода, что означает, что эти молекулы имеют одинаковое количество электронов и аналогичные связи. Физические свойства N 2 и CO схожи, хотя CO более реакционноспособен.
Основные химические реакции
Промышленное использование
Оксид углерода является основным промышленным газом, который находит множество применений в производстве сыпучих химикатов. [4]
Альдегиды большого объема получают реакцией гидроформилирования алкенов, CO и H 2 . В одном из многих применений этой технологии гидроформилирование сочетается с процессом Shell Higher Olefin Process для получения прекурсоров моющих средств.
Метанол получают путем гидрирования CO. В родственной реакции гидрирование CO связано с образованием связи C-C, как в процессе Фишера-Тропша, где CO гидрогенизируется до жидкого углеводородного топлива. Эта технология позволяет превращать уголь в бензин.
В процессе Монсанто монооксид углерода и метанол реагируют в присутствии гомогенного родиевого катализатора и HI с образованием уксусной кислоты. Этот процесс отвечает за большую часть промышленного производства уксусной кислоты.
Этот процесс отвечает за большую часть промышленного производства уксусной кислоты.
Координационная химия
ВЗМО СО представляет собой σ МО
НСМО СО представляет собой π* разрыхляющую МО
Большинство металлов образуют координационные комплексы, содержащие ковалентно присоединенный монооксид углерода. Только те, которые находятся в более низких степенях окисления, будут образовывать комплексы с лигандами монооксида углерода. Это связано с тем, что должна быть достаточная плотность электронов, чтобы облегчить обратное донорство от металла d xz -орбиталь на молекулярную орбиталь π * от CO. Неподеленная пара на атоме углерода в CO также отдает электронную плотность d x²-y² на металле, образуя сигма-связь. В карбониле никеля Ni(CO) 4 образуется в результате прямого соединения монооксида углерода и металлического никеля при комнатной температуре. По этой причине никель в любой трубке или детали не должен подвергаться длительному контакту с окисью углерода (коррозия). Карбонил никеля легко разлагается обратно на Ni и CO при контакте с горячими поверхностями, и этот метод когда-то использовался для промышленной очистки никеля в процессе Монда. [5]
Карбонил никеля легко разлагается обратно на Ni и CO при контакте с горячими поверхностями, и этот метод когда-то использовался для промышленной очистки никеля в процессе Монда. [5]
В карбониле никеля и других карбонилах электронная пара на углероде взаимодействует с металлом; окись углерода отдает электронную пару металлу. В этих ситуациях монооксид углерода называют карбонильным лигандом. Одним из наиболее важных карбонилов металлов является пентакарбонил железа, Fe(CO) 5 :
Многие комплексы металл-CO получают путем декарбонилирования органических растворителей, а не из CO. Например, трихлорид иридия и трифенилфосфин реагируют в кипящем метоксиэтаноле или ДМФА с образованием IrCl(CO)(PPh 3 ) 2 .
Органическая химия и химия основных групп
В присутствии сильных кислот и воды монооксид углерода реагирует с олефинами с образованием карбоновых кислот в процессе, известном как реакция Коха-Хаафа. [6] В реакции Гаттермана-Коха арены превращаются в производные бензальдегида в присутствии AlCl 3 и HCl. [7] Литийорганические соединения, такие как бутиллитий, реагируют с CO, но эта реакция используется редко.
[6] В реакции Гаттермана-Коха арены превращаются в производные бензальдегида в присутствии AlCl 3 и HCl. [7] Литийорганические соединения, такие как бутиллитий, реагируют с CO, но эта реакция используется редко.
Хотя CO реагирует с карбокатионами и карбанионами, он относительно не реагирует с органическими соединениями без вмешательства металлических катализаторов. [8]
С реагентами основной группы CO вступает в несколько заслуживающих внимания реакций. Хлорирование CO — это промышленный путь получения важного соединения фосгена. С бораном CO образует аддукт H 3 BCO, изоэлектронный с ацилиевым катионом [H 3 CCO] + . CO реагирует с натрием с образованием продуктов, образующихся в результате сочетания CC, таких как Na 2 C 2 O 2 (ацетилендиолат натрия) и Na 2 C 4 O 4 (натрий квадратный).
Угарный газ в атмосфере
MOPITT 2000 глобальный угарный газ
Угарный газ, который сегодня считается загрязняющим веществом, всегда присутствовал в атмосфере, в основном как продукт вулканической активности. Он растворяется в расплавленной вулканической породе при высоком давлении в мантии Земли. Содержание оксида углерода в вулканических газах варьируется от менее 0,01 процента до 2 процентов, в зависимости от вулкана. Это также происходит в природе при лесных пожарах. Поскольку естественные источники окиси углерода настолько изменчивы из года в год, чрезвычайно трудно точно измерить естественные выбросы газа.
Он растворяется в расплавленной вулканической породе при высоком давлении в мантии Земли. Содержание оксида углерода в вулканических газах варьируется от менее 0,01 процента до 2 процентов, в зависимости от вулкана. Это также происходит в природе при лесных пожарах. Поскольку естественные источники окиси углерода настолько изменчивы из года в год, чрезвычайно трудно точно измерить естественные выбросы газа.
Оксид углерода оказывает косвенное радиационное воздействие, повышая концентрацию метана и тропосферного озона в результате химических реакций с другими компонентами атмосферы (например, гидроксильным радикалом, OH . ), которые в противном случае разрушили бы их. Угарный газ образуется при неполном сгорании углеродосодержащих топлив. В результате естественных процессов в атмосфере он в конечном итоге окисляется до углекислого газа. Концентрации окиси углерода недолговечны в атмосфере и изменчивы в пространстве.
Антропогенный CO от автомобилей и промышленных выбросов может способствовать парниковому эффекту и глобальному потеплению. В городских районах угарный газ вместе с альдегидами вступает в фотохимическую реакцию с образованием перекисных радикалов. Перекисные радикалы реагируют с оксидом азота, увеличивая отношение NO 2 к NO, что снижает количество NO, доступного для реакции с озоном. Угарный газ также входит в состав табачного дыма.
В городских районах угарный газ вместе с альдегидами вступает в фотохимическую реакцию с образованием перекисных радикалов. Перекисные радикалы реагируют с оксидом азота, увеличивая отношение NO 2 к NO, что снижает количество NO, доступного для реакции с озоном. Угарный газ также входит в состав табачного дыма.
Роль в физиологии и питании
Монооксид углерода используется в системах упаковки с модифицированной атмосферой в США, в основном, со свежими мясными продуктами, такими как говядина и свинина. CO соединяется с миоглобином с образованием карбоксимиоглобина, ярко-вишнево-красного пигмента. Карбоксимиоглобин более стабилен, чем кислородсодержащая форма миоглобина, оксимиоглобин, который может окисляться до коричневого пигмента, метмиоглобина. Этот устойчивый красный цвет может сохраняться намного дольше, чем у обычно упакованного мяса, и, таким образом, увеличивает срок хранения. [9] Типичные уровни содержания CO составляют от 0,4 до 0,5 процента.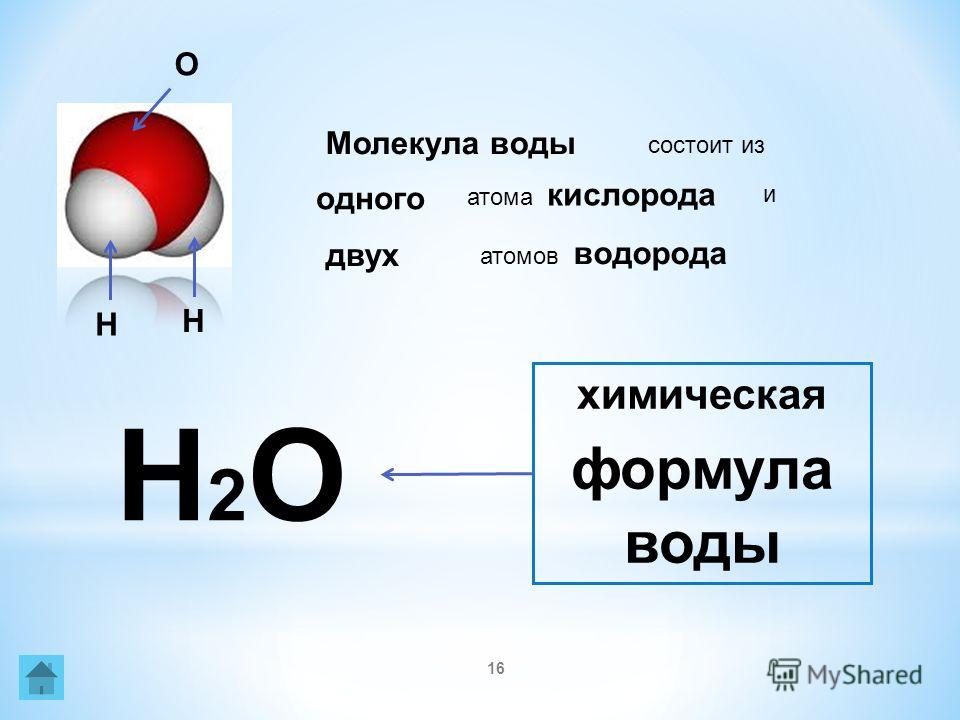
FDA впервые присвоило этой технологии статус «общепризнанной безопасности» в 2002 году для использования в качестве системы вторичной упаковки. В 2004 году FDA одобрило CO в качестве основного метода упаковки, заявив, что CO не маскирует запах порчи. Несмотря на это решение, эта технология остается спорной в США из-за опасений, что она вводит в заблуждение и маскирует порчу. [10]
В результате одной реакции в организме образуется CO. Окись углерода образуется естественным образом при распаде гемоглобина, гема, является субстратом для фермента гемоксигеназы, который производит CO и биливердин. Биливердин превращается в билирубин под действием биливердинредуктазы в макрофагах ретикулоэндотелиальной системы. Растворимый в липидах неконъюгированный билирубин транспортируется кровью в связанном с альбумином, поглощается гепатоцитами, конъюгируется с глюкуроновой кислотой и транспортируется в желчные канальцы для выведения из организма. Эндогенно продуцируемый CO может играть важную физиологическую роль в организме (например, в качестве нейротрансмиттера).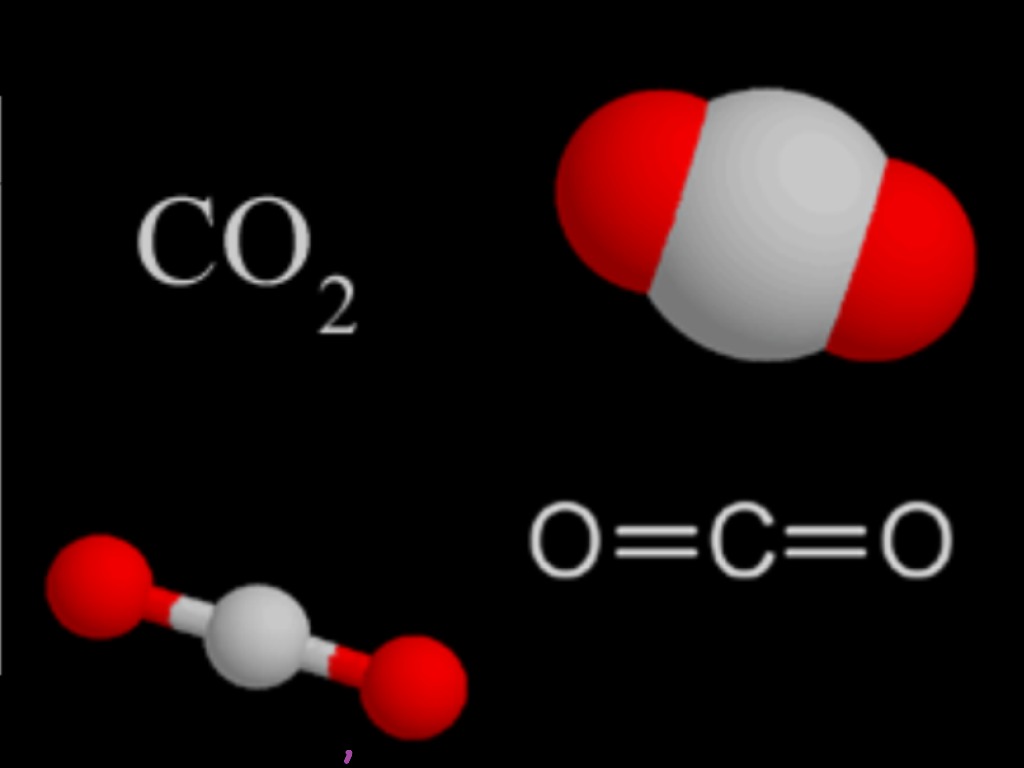
CO является питательным веществом для метаногенных бактерий, строительным блоком для ацетилкоэнзима А. Эта тема является предметом новой области биоорганометаллической химии. В бактериях CO образуется путем восстановления углекислого газа под действием фермента дегидрогеназы моноксида углерода, белка, содержащего Fe-Ni-S. [11]
Известен СО-сенсорный белок на основе гема, CooA. Объем его биологической роли до сих пор не ясен, он, по-видимому, является частью сигнального пути у бактерий и архей, но его встречаемость у млекопитающих не установлена.
CO также в настоящее время изучается на предмет его противовоспалительных свойств и свойств защиты трансплантата в области иммунологии трансплантатов.
История
Угарный газ впервые был получен французским химиком де Лассоном в 1776 году путем нагревания оксида цинка с коксом. Он ошибочно заключил, что газообразный продукт был водородом, так как он горел голубым пламенем. Газ был идентифицирован как соединение, содержащее углерод и кислород, английским химиком Уильямом Круикшенком в 1800 году.
Токсические свойства СО были впервые тщательно исследованы французским физиологом Клодом Бернаром около 1846 года. Он отравил этим газом собак и заметил, что их кровь была более рутилантной во всех сосудах. « Rutilant » — это французское слово, но в англоязычных словарях оно также имеет значение, означающее румяный, мерцающий или золотой. Однако в то время он переводился как малиновый, алый, а теперь широко известен как «вишнево-розовый».
Во время Второй мировой войны угарный газ использовался для поддержания работы автомобилей в тех частях мира, где не хватало бензина. Были установлены внешние угольные или дровяные горелки, а угарный газ, образующийся в результате газификации, подавался в карбюратор. CO в этом случае известен как «древесный газ». Сообщается, что угарный газ также использовался в небольших масштабах во время Холокоста в некоторых нацистских лагерях смерти.
Токсичность
Угарный газ является очень токсичным газом и является наиболее распространенным типом отравления со смертельным исходом во многих странах. Воздействие может привести к значительной токсичности центральной нервной системы и сердца. После отравления часто возникают долгосрочные последствия. Угарный газ также может оказывать серьезное воздействие на плод беременной женщины. Симптомы легкого отравления включают головные боли и головокружение при концентрациях менее 100 частей на миллион. Концентрации всего 667 частей на миллион могут привести к тому, что до 50 процентов гемоглобина в организме будет преобразовано в карбоксигемоглобин (HbCO) и неэффективно для доставки кислорода. Воздействие такого уровня может быть опасным для жизни. В Соединенных Штатах OSHA ограничивает уровни воздействия на рабочем месте до 35 частей на миллион.
Воздействие может привести к значительной токсичности центральной нервной системы и сердца. После отравления часто возникают долгосрочные последствия. Угарный газ также может оказывать серьезное воздействие на плод беременной женщины. Симптомы легкого отравления включают головные боли и головокружение при концентрациях менее 100 частей на миллион. Концентрации всего 667 частей на миллион могут привести к тому, что до 50 процентов гемоглобина в организме будет преобразовано в карбоксигемоглобин (HbCO) и неэффективно для доставки кислорода. Воздействие такого уровня может быть опасным для жизни. В Соединенных Штатах OSHA ограничивает уровни воздействия на рабочем месте до 35 частей на миллион.
Механизмы, с помощью которых монооксид углерода оказывает токсическое действие, еще полностью не изучены, но считается, что гемоглобин, миоглобин и митохондриальная цитохромоксидаза подвергаются риску. Лечение в основном состоит из введения 100-процентного кислорода или гипербарической оксигенотерапии, хотя оптимальное лечение остается спорным. Бытовое отравление угарным газом можно предотвратить с помощью бытовых детекторов угарного газа.
Бытовое отравление угарным газом можно предотвратить с помощью бытовых детекторов угарного газа.
Примечания
- ↑ А. Ф. Холлеман и Э. Виберг, Неорганическая химия (Сан-Диего: Academic Press, 2001, ISBN 0123526515).
- ↑ О.Р. Гиллиам, К.М. Джонсон и В. Горди, Микроволновая спектроскопия в области от двух до трех миллиметров, Physical Review 78 (2): 140.
- ↑ W. Kutzelnigg, Einführung in die Theoretische Chemie (Wiley-VCH, ISBN 3527306099).
- ↑ К. Эльшенбройх и А. Зальцер, Металлоорганические соединения: краткое введение, 2-е издание (Wiley-VCH: Weinheim, 2006, ISBN 3527281657).
- ↑ Л. Монд, К. Лангер и Ф. Квинке, Действие окиси углерода на никель, Journal of the Chemical Society 1890: 749-753.
- ↑ H. Koch и W. Haaf, «1-Адамантанкарбоновая кислота», Organic Syntheses 5 (1973): 20.
- ↑ Г. Х. Коулман и Д. Крейг, “, стр. – Толуальдегид”, Organic Syntheses 2 (1943): 583.

- ↑ Н. Чатани и С. Мураи, «Угарный газ», в Энциклопедии реагентов для органического синтеза Л. Пакетт (ред.) (Нью-Йорк: Дж. Вили, 2004 г.).
- ↑ С. Сорхейм, Х. Ниссена и Т. Несбаккен, Срок хранения говядины и свинины, упакованных в атмосфере с низким содержанием монооксида углерода и высоким содержанием диоксида углерода, Journal of Meat Science 52(2): 157-64.
- ↑ Журнал по безопасности пищевых продуктов, Упаковка с низким содержанием кислорода и CO: исследование пищевой политики, требующее экспертной оценки. Проверено 10 июня 2015 г.
- ↑ Г. Жауэн (ред.), Биоорганометаллы: биомолекулы, маркировка, медицина (Вайнхайм: Wiley-VCH, 2006, ISBN 352730990X).
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Чанг, Рэймонд. Химия, 9-е издание. Нью-Йорк: McGraw-Hill Science/Engineering/Math, 2006. ISBN 0073221031 .
- Коттон, Ф. Альберт, Джеффри Уилкинсон, Карлос А.
 Мурильо и Манфред Бохманн. Высшая неорганическая химия, , 6-е издание. Нью-Йорк: Wiley, 1999. ISBN 0471199575 .
Мурильо и Манфред Бохманн. Высшая неорганическая химия, , 6-е издание. Нью-Йорк: Wiley, 1999. ISBN 0471199575 . - Эльшенбройх, К., и А. Зальццер. Металлоорганические соединения: краткое введение . Wiley-VCH: Вайнхайм, 2006. ISBN 3527281657
- Холлеман А.Ф. и Э. Виберг. Неорганическая химия . Сан-Диего: Academic Press, 2001. ISBN 0-123526515- .
- Жауэн, Г. (ред.). Биоорганометаллы: биомолекулы, маркировка, медицина . Вайнхайм: Wiley-VCH, 2006. ISBN 352730990X .
- Kutzelnigg, W. Einführung in die Theoretische Chemie . Wiley-VCH, 2011. ISBN 3527306099
- Лиде, Дэвид Р. CRC Справочник по химии и физике . 87 выпуск. Бока-Ратон, Флорида: CRC Press, 2006. ISBN 0-849304873-
- Отвелл, В. Стивен, Хордур Г. Кристинссон и Мурат О. Балабан (ред.). Обработка и упаковка рыбы в модифицированной атмосфере: упаковка с фильтрованным дымом, угарным газом и пониженным содержанием кислорода . Эймс, Айова: паб Blackwell, 2006.
 ISBN 0-813807689- .
ISBN 0-813807689- . - Пенни, Дэвид Г. Токсичность угарного газа . Бока-Ратон: CRC Press, 2000. ISBN 0-849320658-
Внешние ссылки
Все ссылки получены 10 января 2017 г.
- Угарный газ. Карманный справочник NIOSH по химическим опасностям .
- CID 281 от PubChem
- Угарный газ убивает.
- Опасности угарного газа при походных печах.
Авторы
Энциклопедия Нового Света авторов и редакторов переписали и дополнили статью Википедии в соответствии с Энциклопедия Нового Света 9Стандарты 0438. Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Упоминание должно осуществляться в соответствии с условиями этой лицензии, которая может ссылаться как на авторов New World Encyclopedia , так и на самоотверженных добровольных участников Фонда Викимедиа.


 Мурильо и Манфред Бохманн. Высшая неорганическая химия, , 6-е издание. Нью-Йорк: Wiley, 1999. ISBN 0471199575
Мурильо и Манфред Бохманн. Высшая неорганическая химия, , 6-е издание. Нью-Йорк: Wiley, 1999. ISBN 0471199575 ISBN 0-813807689-
ISBN 0-813807689-