Химическая характеристика алюминия: Характеристика алюминия – ответ на Uchi.ru
alexxlab | 23.04.2023 | 0 | Разное
Таблица характеристик алюминия
Алюминий относится к минералам, встречающимся в природе в виде небольших мелкозернистых скоплений. Входит в группу парамагнитных металлов. Податливость сплава к обработке обуславливает широкое использование в литье и формовке. Благодаря высоким эксплуатационным характеристикам алюминиевый металлопрокат популярен во всех сферах хозяйства.
Характеристики
Естественный цвет алюминия обладает металлическим серебристо-белым оттенком. В природе чистый элемент отсутствует ввиду активного взаимодействия с другими веществами. Он существует в виде бокситов и минеральных пород – нефелинов, полевого шпата, глиноземов, синего и красного корунда. Минерал корунд известен в ювелирном деле под названиями сапфира и рубина и представляет собой оксид алюминия, формула которого Al2O3.
Физические и химические свойства алюминия приведены в таблице.
|
Физические характеристики |
||||
|
Показатель |
Алюминий |
|||
|
Химическая формула |
Al |
|||
|
Расположение в хим. |
3 период, 3 группа, №13 |
|||
|
ГОСТ |
4784-2019 |
|||
|
Расшифровка |
Алюминий и сплавы, получаемые из алюминия |
|||
|
Плотность алюминия, кг/м3 |
2700 |
|||
|
Твердость по Бринеллю |
240 |
|||
|
Температура кипения, °С |
2518 |
|||
|
Температура плавления алюминия, °С |
660 |
|||
| Параметр удельной теплоемкости, кДж/кг·K |
90 |
|||
|
Теплопроводность при 100°С, кВт/(м·К) |
20 |
|||
|
Электропроводность, см/м |
37·106 |
|||
|
Значение температурного электрического сопротивления, (10−3 K−1) |
4,3 |
|||
|
Коэффициент удельного сопротивления, Ом·мм²/м |
0,026 |
|||
|
Значение линейного теплового расширения, при t=20-200°С (10−6 К−1) |
24 |
|||
Ударная вязкость, t = 20°С |
140 |
|||
|
Модуль упругости |
710000 |
|||
|
Показатель предела прочности |
70 |
|||
|
Величина предела текучести |
7-11 |
|||
|
Значение относительного удлинения |
40 |
|||
|
Коэффициент Пуассона |
0,34 |
|||
|
Химические характеристики алюминия и его соединений |
||||
|
Реакции |
Образуемое вещество |
Особенности проведения |
||
|
С простыми элементами: С кислородом С галогенами С фосфором С серой С азотом С углеродом |
оксид алюминия иодид бромид хлорид фосфиды сульфид нитрид метанид или карбид алюминия |
Применяется мелкодисперсный порошок металла Катализатор в реакции с йодом – капля воды Металл смешивается с жидким бромом Применяется нагретая фольга либо мелкий порошок вещества Протекает при температуре в 500-800 градусов Цельсия Нагревание до 200 С Нагревание до 1000 градусов по Цельсию Нагрев до 2000 градусов по Цельсию |
||
|
Со сложными веществами: С водой С оксидами металлов С минеральными кислотами С концентриров. Со щелочами |
гидроксид чистый расплавленный металл соли алюминия и газообразный водород сульфат алюминия нитрат алюминия тетрагидроксоалюминат с водородом |
Предварительное удаление оксидной пленки раствором щелочи, солями ртути или хлоридом аммония Смесь поджигается, метод алюмотермии Применяются все кислоты за исключением концентратов серной и азотной Требуется сильный нагрев Взаимодействует с водными щелочными растворами и чистыми щелочами |
||
|
Химические реакции гидроксида алюминия: С растворами кислот С оксидами и карбонатами Со щелочами |
соли соли метаалюминаты комплексные соли |
В условиях сплавления – нагрева до высокой температуры Гидроксид алюминия растворяется в щелочи |
||
|
Процесс алюмотермии – восстановления металлов из оксидов (на примере хрома) |
хром и оксид алюминия |
Сильный экзотермический процесс, требует нагрева |
||
|
Химические свойства солей алюминия |
||||
|
Реакции |
Образуемое вещество |
Особенности проведения |
||
|
Разложение на оксиды: нитрат сульфат |
оксид алюминия, кислород, оксид азота оксид алюминия, кислород, сернистый газ |
Выполняется при нагревании |
||
|
Гидролиз алюминия: растворимых солей сульфида, сульфата, карбоната |
Гидроксид алюминия с белым осадком Нерастворимый гидроксид алюминия |
Двойной обратимый гидролиз, протекает ступенчато Необратимый гидролиз |
||
При соприкосновении с воздухом металл образует устойчивые оксидные пленки. Это обуславливает отличные показатели сопротивляемости сплавов коррозии.
Это обуславливает отличные показатели сопротивляемости сплавов коррозии.
Свойства алюминия:
- прочность;
- малый вес;
- легкоплавкость, податливость резке, штамповке;
- коррозийная стойкость;
- хорошие показатели теплопроводности и электропроводности.
Металл относится к элементам высокой химической активности. Из-за быстрой реакции с воздухом на поверхности формируется оксидная пленка.
Она отличается высокой температурой плавления в 2000 градусов Цельсия, в то время как температура плавления алюминия составляет 660°С. Этим обуславливаются сложные характеристики сварки алюминия – текучесть сплава создает трудности в образовании ровного и прочного шва.
Сварку металлопроката выполняют полуавтоматическим способом в инертной среде либо с помощью вольфрамового электрода и инертного газа. Популярной технологией при отсутствии газов является сварка плавящимися электродами.
Получение
В лабораториях чистый элемент получают, соединяя раствор хлорида алюминия с металлическим калием при нагревании.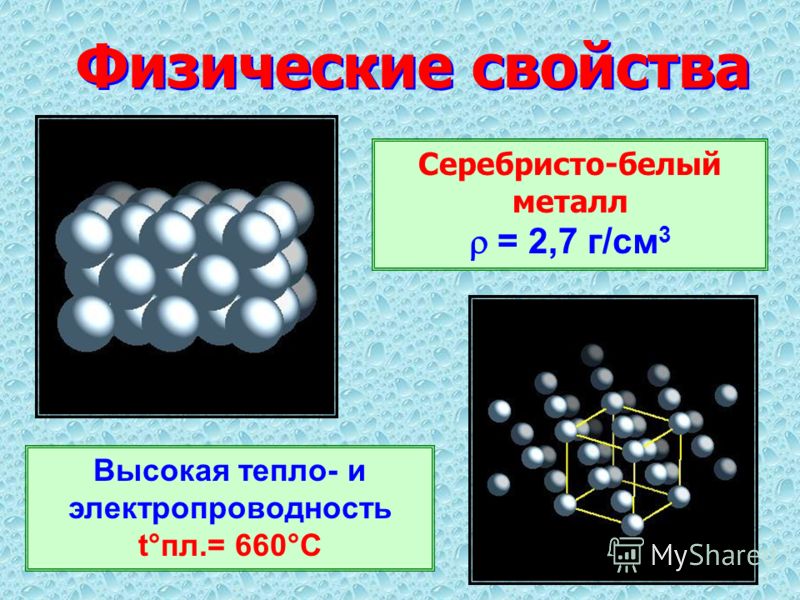 Промышленное получение предусматривает применение метода диссоциации сульфата элемента. Бокситы или глиноземы смешивают с серной кислотой и в условиях нагрева проводят электролиз с электродами углерода.
Промышленное получение предусматривает применение метода диссоциации сульфата элемента. Бокситы или глиноземы смешивают с серной кислотой и в условиях нагрева проводят электролиз с электродами углерода.
Популярным сырьем для промышленности выступает вторичный алюминий. В качестве материала применяются товары и металлопрокат, вышедшие из эксплуатации. Поступающий в переработку лом алюминия отличается большим количеством загрязнителей и примесей, что требует проведения тщательной очистки и сортировки.
Источники металла:
- детали автомобилей, судов, самолетов;
- строительные конструкции;
- стоматологическое оборудование;
- бытовая техника, кухонная утварь, приборы домашнего пользования.
В больших количествах химический элемент содержится в холодильниках, посудомоечных и стиральных машинах, сушилках. Сплавы широко используются в деталях автомобилей – бамперах, элементах рам, крыльях, дверях, капотах, радиаторах. Источниками вторичного алюминия служат и предметы быта – посуда, телевизионные антенны, утюги, светильники, элементы окон и дверей.
Применение
Конструкционный металл востребован в авиастроении, автомобильной и космической отрасли, приборостроении, пищевой промышленности. Легкость сплава обеспечивает маневренность судов при низкой массе. Коррозийная стойкость обуславливает многолетнюю эксплуатацию транспортных средств, оборудования, посуды. Свойства проводника позволяют применять его в производстве микросхем. Для повышения прочности в процессе выплавки в сплав добавляют магний и медь.
Металл применяется в следующих сферах:
- авиастроении – изготовление насосов, элементов корпусов и двигателей;
- судостроении – для палубных комплектующих, трапов, радарных мачт, корпусов судов;
- ракетостроении – в качестве компонента ракетного топлива;
- строительстве – изготовление рам, конструкций, столярных изделий;
- автомобилестроении – производство элементов корпусов, бамперов, радиаторов;
- электронике – для микросхем, проводов и кабелей;
- оборонной промышленности – выпуск автоматов и пистолетов, установок, танков;
- железнодорожной сфере – для рам и деталей вагонов, цистерн.

Металл популярен в производстве бытовых предметов массового потребления – крупной и мелкой техники, зеркал, фольги, посуды. В металлургии элемент задействуется в качестве восстановителя, с его помощью из галогенидов и оксидов получают хром, марганец, калий. Стойкость к агрессивным средам и отсутствие токсичности обуславливают применение вещества в изготовлении емкостей для хранения кислот и щелочей, удобрений, пищевых продуктов. Используется в стекловарении и пиротехнике, изготовлении ювелирной бижутерии, служит пищевой добавкой. Применяется в производстве медикаментов, в сочетании с другими компонентами служит основой для обезболивающих и антацидных препаратов.
Химия в действии, Ч.2
Химия в действии, Ч.2
Оглавление11. ПЕРИОДИЧЕСКИЙ ЗАКОН ПЕРИОДИЧЕСКИЙ ЗАКОН11.1 Периодичность СОВРЕМЕННАЯ ФОРМА ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ ПЕРИОДИЧНОСТЬ ПЕРИОДИЧНОСТЬ В ХИМИЧЕСКИХ СВОЙСТВАХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 12. ВОДОРОД И ВОДА 12.1. ВОДОРОД ПОЛУЧЕНИЕ ВОДОРОДА В ЛАБОРАТОРНЫХ УСЛОВИЯХ РАЗЛИЧНЫЕ ФОРМЫ ВОДОРОДА ФИЗИЧЕСКИЕ СВОЙСТВА ВОДОРОДА ХИМИЧЕСКИЕ СВОЙСТВА ВОДОРОДА ТИПЫ СОЕДИНЕНИЙ ВОДОРОДА РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ, ПОЛУЧЕНИЕ И ИСПОЛЬЗОВАНИЕ ВОДОРОДА 12.2 Вода ХИМИЧЕСКИЕ РЕАКЦИИ С УЧАСТИЕМ ВОДЫ ИСТОЧНИКИ ПРЕСНОЙ ВОДЫ И ЕЕ ИСПОЛЬЗОВАНИЕ КАЧЕСТВО ВОДЫ ЗАГРЯЗНЕНИЕ ВОДЫ ОЧИСТКА И ПОДГОТОВКА ВОДЫ ОКЕАНЫ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 13. s-Металлы 13.1 Структура и свойства s-металлов СТРУКТУРА ФИЗИЧЕСКИЕ СВОЙСТВА РЕАКЦИОННАЯ СПОСОБНОСТЬ S-МЕТАЛЛОВ 13.2 Соединения, образуемые s-металлами ДРУГИЕ БИНАРНЫЕ СОЕДИНЕНИЯ ГИДРОКСИДЫ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ ТЕРМИЧЕСКАЯ УСТОЙЧИВОСТЬ ОКСОСОЕДИНЕНИЙ S-МЕТАЛЛОВ РАСТВОРИМОСТЬ СОЛЕЙ И ГИДРОКСИДОВ МЕТАЛЛОВ I И II ГРУПП В ВОДЕ АНОМАЛЬНЫЕ СВОЙСТВА ЛИТИЯ И БЕРИЛЛИЯ, А ТАКЖЕ ИХ СОЕДИНЕНИЙ 13.  3. Распространенность в природе, получение и применение 3. Распространенность в природе, получение и применениеПОЛУЧЕНИЕ S-МЕТАЛЛОВ ПОЛУЧЕНИЕ СОЕДИНЕНИЙ S-МЕТАЛЛОВ ПРИМЕНЕНИЕ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 14. d-ЭЛЕМЕНТЫ 14.1. Структура и свойства d-элементов d-ЭЛЕМЕНТЫ ФИЗИЧЕСКИЕ СВОЙСТВА ХИМИЧЕСКИЕ СВОЙСТВА 14.2 Химия семи d-элементов МАРГАНЕЦ ЖЕЛЕЗО КОБАЛЬТ НИКЕЛЬ МЕДЬ ЦИНК 14.3. Распространенность в природе, получение и применения ПРОИЗВОДСТВО ЖЕЛЕЗА И СТАЛИ ПОЛУЧЕНИЕ ДРУГИХ МЕТАЛЛОВ ПЕРВОГО ПЕРЕХОДНОГО РЯДА ПРИМЕНЕНИЯ d-ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 15. ЭЛЕМЕНТЫ III-VI ГРУПП 15.1. Алюминий и другие элементы III группы БОР ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА АЛЮМИНИЯ РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ И ПОЛУЧЕНИЕ АЛЮМИНИЯ ПРИМЕНЕНИЯ АЛЮМИНИЯ И ЕГО СОЕДИНЕНИЙ 15.2. IV группа периодической системы СОЕДИНЕНИЯ РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ И ПОЛУЧЕНИЕ ИЗ РУД ПРИМЕНЕНИЯ УГЛЕРОДА ПРИМЕНЕНИЯ КРЕМНИЯ ПРИМЕНЕНИЯ ГЕРМАНИЯ, ОЛОВА И СВИНЦА 15.  3. Элементы V группы 3. Элементы V группыРАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. ПОЛУЧЕНИЕ И ПРИМЕНЕНИЯ АЗОТА И ФОСФОРА СОЕДИНЕНИЯ АЗОТА СОЕДИНЕНИЯ ФОСФОРА 15.4. Элементы VI группы. Кислород и сера КИСЛОРОД СОЕДИНЕНИЯ КИСЛОРОДА СЕРА СОЕДИНЕНИЯ СЕРЫ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 16. ГАЛОГЕНЫ И БЛАГОРОДНЫЕ ГАЗЫ 16.1. Галогены ЭЛЕКТРОННАЯ СТРУКТУРА АТОМОВ ГАЛОГЕНОВ ЛАБОРАТОРНЫЕ МЕТОДЫ ПОЛУЧЕНИЯ ГАЛОГЕНОВ ФИЗИЧЕСКИЕ И БИОЛОГИЧЕСКИЕ СВОЙСТВА РЕАКЦИОННАЯ СПОСОБНОСТЬ ГАЛОГЕНОВ 16.2. Соединения галогенов ГАЛОГЕНОВОДОРОДЫ КИСЛОРОДСОДЕРЖАЩИЕ СОЕДИНЕНИЯ ГАЛОГЕНОВ 16.3. Распространенность, получение и применение галогенов и их соединений ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ ХЛОРА ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ ДРУГИХ ГАЛОГЕНОВ ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ СОЕДИНЕНИЙ ХЛОРА ПРИМЕНЕНИЯ ГАЛОГЕНОВ И ИХ СОЕДИНЕНИЙ ТОКСИЧНОСТЬ ХЛОРСОДЕРЖАЩИХ ПРОДУКТОВ 16.4. Благородные газы СОЕДИНЕНИЯ БЛАГОРОДНЫХ ГАЗОВ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 17. ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ 7.1.  Органическая химия Органическая химияНОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ УГЛЕВОДОРОДЫ ФУНКЦИОНАЛЬНЫЕ ГРУППЫ ФИЗИЧЕСКИЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ ПОЛУЧЕНИЕ И ИДЕНТИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ 17.2. Молекулярная структура органических соединений КОНФОРМАЦИИ СТЕРЕОИЗОМЕРИЯ 17.3. Механизмы органических реакций ФАКТОРЫ, ВЛИЯЮЩИЕ НА РЕАКЦИОННУЮ СПОСОБНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ НУКЛЕОФИЛЫ И ЭЛЕКТРОФИЛЫ ТИПЫ ОРГАНИЧЕСКИХ РЕАКЦИЙ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 18. УГЛЕВОДОРОДЫ 18.1. Алифатические углеводороды АЛКАНЫ АЛКЕНЫ АЛКИНЫ 18.2. Арены БЕНЗОЛ МЕТИЛБЕНЗОЛ 18.3. Природные источники, получение и применения ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ УГЛЕВОДОРОДОВ ПЕРЕРАБОТКА НЕФТИ ПРИМЕНЕНИЯ УГЛЕВОДОРОДОВ ЗАГРЯЗНЕНИЕ ОКРУЖАЮЩЕЙ СРЕДЫ НЕФТЬЮ И ПРОДУКТАМИ ЕЕ СГОРАНИЯ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 19. ФУНКЦИОНАЛЬНЫЕ ГРУППЫ 19.1. Органические галогенсодержащие соединения ГАЛОГЕНОАЛКЕНЫ ГАЛОГЕНОАРЕНЫ ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ ОРГАНИЧЕСКИХ ГАЛОГЕНСОДЕРЖАЩИХ СОЕДИНЕНИЙ 19.  2. Спирты, фенолы и эфиры 2. Спирты, фенолы и эфирыФЕНОЛЫ ПРОСТЫЕ ЭФИРЫ ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ СПИРТОВ, ФЕНОЛОВ И ПРОСТЫХ ЭФИРОВ 19.3. Карбонильная группа ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ КАРБОНОВЫЕ КИСЛОТЫ ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ АМИДЫ РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ, ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ КАРБОНОВЫХ КИСЛОТ И ИХ ПРОИЗВОДНЫХ 19.4 Амины и родственные соединения СОЛИ ДИАЗОНИЯ ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 20. ПРИРОДНЫЕ СОЕДИНЕНИЯ И ПОЛИМЕРЫ 20.1. Аминокислоты, пептиды и белки АМИНОКИСЛОТЫ ПЕПТИДЫ БЕЛКИ 20.2. Углеводы и нуклеиновые кислоты НУКЛЕИНОВЫЕ КИСЛОТЫ 20.3. Жиры, масла и другие природные соединения ЖИРНЫЕ КИСЛОТЫ И ТРИГЛИЦЕРИДЫ ВОСКИ ФОСФОЛИПИДЫ И ГЛИКОЛИПИДЫ ВИТАМИНЫ АЛКАЛОИДЫ 20.4. Полимеры ПОЛИМЕРИЗАЦИЯ НАТУРАЛЬНЫЕ И СИНТЕТИЧЕСКИЕ КАУЧУКИ ЦЕЛЛЮЛОЗНОЕ ВОЛОКНО ВОПРОСЫ ДЛЯ ПРОВЕРКИ ПРИЛОЖЕНИЯ |
Физические и химические свойства алюминия 丨CHAL
Часы
Алюминий — мягкий и легкий металл. Поскольку он подвергается воздействию воздуха для быстрого образования тонкого слоя оксидного слоя, он имеет матово-серебристый вид. Алюминий не токсичен (как металл), не магнитится и не образует искр.
Поскольку он подвергается воздействию воздуха для быстрого образования тонкого слоя оксидного слоя, он имеет матово-серебристый вид. Алюминий не токсичен (как металл), не магнитится и не образует искр.
Алюминий используется во многих отраслях промышленности для производства миллионов различных продуктов и играет очень важную роль в мировой экономике. Благодаря использованию различных комбинаций своих доминирующих характеристик, таких как прочность, легкий вес, коррозионная стойкость, восстанавливаемость и формуемость, алюминий используется все чаще. Ассортимент продукции варьируется от конструкционных материалов до тонкой упаковочной пленки. Подробнее о применении алюминия вы можете просмотреть в этой статье: Чего вы не знаете об алюминиевой трубке
Физические свойства алюминия Каковы физические свойства алюминия? Физические свойства обычно являются характеристиками, которые можно наблюдать с помощью органов чувств, таких как цвет, плотность, твердость, коррозионная стойкость, теплопроводность, проводимость и т. д. Физические свойства алюминия следующие:
д. Физические свойства алюминия следующие:
| Свойства | Описание |
| Цвет | Алюминий представляет собой серебристо-белый металл без запаха. |
| Плотность | Плотность алюминия составляет около одной трети плотности стали или меди, что делает его одним из самых легких коммерческих металлов. |
| Прочность | Прочность на растяжение чистого алюминия невысокая. Однако легирующие элементы, такие как марганец, кремний, медь и магний, могут повысить прочность алюминия и получить сплав со свойствами, подходящими для конкретного применения. Алюминий очень подходит для холодных условий. По сравнению со сталью его преимущество заключается в том, что его прочность на растяжение увеличивается с понижением температуры при сохранении его ударной вязкости. С другой стороны, сталь становится хрупкой при низких температурах. |
| Коррозионная стойкость | При контакте с воздухом поверхность алюминия почти сразу покрывается оксидом алюминия. Этот слой обладает отличной коррозионной стойкостью. Обладает значительной устойчивостью к большинству кислот, но устойчивость к основаниям низкая. Этот слой обладает отличной коррозионной стойкостью. Обладает значительной устойчивостью к большинству кислот, но устойчивость к основаниям низкая. |
| Теплопроводность | Теплопроводность алюминия примерно в три раза выше, чем у стали. Это приводит к тому, что алюминий становится важным материалом для систем охлаждения и обогрева (например, для теплообменников). В сочетании с его нетоксичностью эта особенность означает, что алюминий широко используется в кухонной посуде и кухонной утвари. |
| Электропроводность | Алюминий имеет достаточно высокую электропроводность и может использоваться в качестве электрических проводников. |
| Отражательная способность | От УФ до инфракрасного излучения алюминий является отличным отражателем энергии излучения. Те же самые характеристики отражения делают алюминий теплоизоляционным материалом, который предотвращает солнечный свет летом и предотвращает потери тепла зимой. |
Химические свойства относятся к тому, что вещество вступает в реакцию с другими веществами или изменяется от одного вещества к другому. В общем, химические свойства можно наблюдать только во время химической реакции. Реакция вещества может быть вызвана изменениями, вызванными горением, ржавчиной, нагревом, взрывом, обесцвечиванием и т.п. Ниже приведены химические свойства алюминия:
В общем, химические свойства можно наблюдать только во время химической реакции. Реакция вещества может быть вызвана изменениями, вызванными горением, ржавчиной, нагревом, взрывом, обесцвечиванием и т.п. Ниже приведены химические свойства алюминия:
| Свойства | Описание |
| Окисление | Как правило, алюминиевые металлы не реагируют на эрозию воздуха, поскольку воздух покрывает их металл тонким слоем оксидов. Однако, если оксидный слой поврежден и оголен металлический алюминий, он снова вступит в реакцию с образованием амфотерного оксида. |
| Реакция с кислотой | Алюминий легко реагирует с неорганической кислотой с образованием раствора, содержащего гидратированные ионы алюминия, при этом выделяется водород. В случае реакции с азотной кислотой он пассивно реагирует, образуя защитный оксидный слой на поверхности оксида алюминия |
| Реакция со щелочью | Алюминий реагирует с основанием с образованием алюмината с выделением водорода. |
| Реакция с водой | Реакция с горячей водой. |
| Соединение | Смеси алюминия, кислорода и других элементов производят алюминиевые рудники, алюминиевый рудник является основным источником алюминия. |
| Сплав | В сочетании с такими элементами, как медь, кремний или магний, образует сплавы с высокой прочностью. |
Благодаря физическим и химическим свойствам алюминия его можно смешивать с другими металлами в алюминиевых сплавах, которые используются в различных алюминиевых сплавах. Алюминиевый сплав имеет характеристики, отличные от характеристик одного металла, и алюминиевый сплав классифицируется в соответствии с другими содержащимися элементами. Ниже приводится серия алюминиевого сплава и его основное использование:
| Series | Alloy Element | Application |
| 1xxx | Almost pure aluminum | Decoration, chemical equipment, heat reflector |
| 2xxx | Copper | Truck panel , детали самолетов |
| 3xxx | Марганец | Посуда, дорожный знак, холодильник |
| 4xxx | Кремний | Ship, bridge |
| 5xxx | Magnesium | Aircraft fuel tank |
| 6xxx | Magnesium + silicon | Low-pressure weapon, aircraft connector |
| 7xxx | Zinc | Aircraft structure |
| 8xxx | Другие элементы представляют собой элементы из основных сплавов | Алюминиевая фольга, радиатор |
Алюминий не потеряет своих характеристик после сильной деформации. Благодаря этому из алюминия можно изготавливать различные формы алюминиевых изделий путем прокатки, экструзии, волочения, механической обработки и других механических процессов, таких как алюминиевые трубы, алюминиевые пластины, алюминиевые пластины, алюминиевая фольга и т.п. Легирование, холодная обработка и термическая обработка могут использоваться для настройки характеристик алюминия. Посмотреть Технологии обработки алюминиевых сплавов
Благодаря этому из алюминия можно изготавливать различные формы алюминиевых изделий путем прокатки, экструзии, волочения, механической обработки и других механических процессов, таких как алюминиевые трубы, алюминиевые пластины, алюминиевые пластины, алюминиевая фольга и т.п. Легирование, холодная обработка и термическая обработка могут использоваться для настройки характеристик алюминия. Посмотреть Технологии обработки алюминиевых сплавов
CHAL Aluminium Corporation специализируется на производстве и исследованиях композитных материалов из алюминия и алюминиевых сплавов, высокоточных алюминиевых труб, полос, фольги и пайки алюминиевых сплавов. Мы искренне приветствуем вас связаться с нами для любого делового сотрудничества! Мы более чем рады тесно сотрудничать с друзьями дома и за рубежом, чтобы создать лучшее будущее.
Похожие статьиКаковы основные свойства алюминия?
Категории
Алюминий
Алюминий входит в нашу повседневную жизнь и является одним из самых популярных и универсальных металлов. Вы когда-нибудь задумывались об использовании алюминия и о том, где и в каких отраслях он мог использоваться?
Вы когда-нибудь задумывались об использовании алюминия и о том, где и в каких отраслях он мог использоваться?
Здесь мы собираемся обсудить некоторые важные и хорошо известные свойства алюминиевого сплава. Хотя алюминий имеет широкий спектр применений, он является одним из самых простых металлов для формовки и обработки.
Физические свойства алюминиевого сплава:
| Физическая собственность | Состояние |
| . | |
| Стойкий | Стойкий к коррозии |
| Токсичность | Нетоксичный | Conducting | Electrically conducting |
| Magnetic | Non-magnetic |
| Sparking | Non-sparking |
| Combustible | Non-combustible |
| Пластичность | Высокая пластичность |
Связано с: Путь к ответственному алюминию
Chemical Properties of Aluminium Alloy:
| Chemical Property | State |
| Occurrence | Compound |
| Oxidation | Help when exposed to влажный воздух |
| Элементы | железо, медь, марганец, кремний, магний и цинк |
| Reactivity | High |
Mechanical Properties of Aluminium Alloy:
| Mechanical Property | State |
| Tensile strength ultimate | 13,000 Psi |
| Предел текучести | 5000 фунтов на квадратный дюйм |
| Предел текучести подшипника | 23100 фунтов на квадратный дюйм |
| Elongation at break | 15-28% |
| Shear Strength | 9000 Psi |
| Fatigue strength | 5000 Psi |
Did Вы знаете: нет никакой разницы в качестве между первичными и переработанными алюминиевыми сплавами.


 таблице Менделеева
таблице Менделеева кислотами
кислотами
 Ч. 2: Пер. с англ. — М.: Мир, 1998 – 620 с.
Ч. 2: Пер. с англ. — М.: Мир, 1998 – 620 с.
