Химическая и электрохимическая коррозия металлов это: Химическая коррозия
alexxlab | 16.02.2023 | 0 | Разное
Химическая коррозия – основные виды, факторы формирования, стадии протекания
Химическая коррозия металлов – это опасное явление, способное привести к их полному разрушению. Процесс напрямую связан со способностью материала вступать во взаимодействие со средой, представляющей повышенную химическую опасность.
Среди важных свойств протекания химической коррозии металла – параллельный процесс окисления и восстановления. Ученые не отмечают прямой связи с электрическим током, который потенциально может образовываться или воздействовать на участвующие в реакции материалы.
Если рассматривать первопричину распространения такого процесса, то мы быстро придем к выводу – она кроется в термической нестабильности металлов разных типов.
Они склонные под воздействием окислительных компонентов среды быстро переходить в устойчивое состояние и зачастую это происходит полностью непроизвольно.
Процесс окисления и восстановления при протекании химической коррозии происходит на фоне уменьшения потенциала системы. При этом нужно учитывать знаки изменения потенциала, чтобы предсказать риск произвольного запуска такого процесса и его интенсивного протекания внутри материала.
При этом нужно учитывать знаки изменения потенциала, чтобы предсказать риск произвольного запуска такого процесса и его интенсивного протекания внутри материала.
Ученые определяют основным критерием, который стимулирует самопроизвольный процесс, такой показатель, как изобарно-изотермический потенциал G.
Когда реакция начинает протекать произвольно, он значительно убывает. При этом скорость уменьшения может меняться в зависимости от типа материалов, условий коррозионной среды и ряда других ключевых параметров.
Основные виды химической коррозии
Ученые выделяют два основных типа химической коррозии. Газовая протекает при контакте поверхности металла с газами. Она усиливается по мере изменения температуры среды.
Также химическая коррозия способна активно протекать в жидкостях-электролитах, если для этого формируются необходимые внешние условия.
Рассмотрим особенности обоих описанных процессов более подробно, чтобы понять, как можно создать дополнительную защиту от них.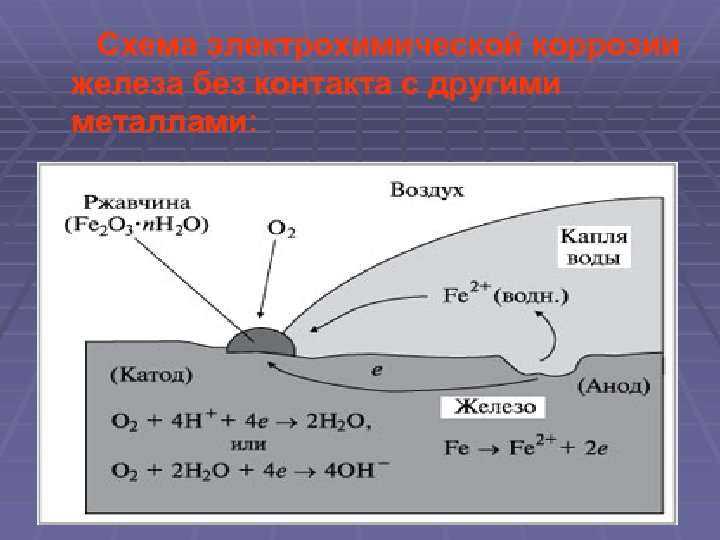
Газовая коррозия металлов
Научная статистика показывает, что газовая коррозия металлов протекает наиболее часто. При рассмотрении химической порчи она значительно более распространена, чем жидкостное ржавение при контакте с электролитами.
Важный фактор здесь – высокая температура. Если металл сильно нагрет и на него начинает воздействовать газ, происходит разрушение.
Так как уровень температур должен быть достаточно высок, а при обычном использовании создать условия для протекания такой химической коррозии довольно сложно, процесс часто наблюдается в металлургии.
Из-за этого страдает оборудование, используемое при штамповке, ковке, горячей прокатке и других процессах. Без дополнительной защиты длительность использования подобной техники станет значительно меньше.
Опасность представляет и контакт металла с кислородом. Формула реакции, которая запускается в таком случае, выглядит следующим образом: Ме + 1/2О2 – МеО.
Эта реакция имеет четкое окислительное направление, потому напрямую связана с показателями парциального кислородного давления. Стоит обратить внимание на то, что реакция может быть равновесной, смещенной к образованию оксида, либо протекающей в обратном направлении.
Стоит обратить внимание на то, что реакция может быть равновесной, смещенной к образованию оксида, либо протекающей в обратном направлении.
Очень важно понимать, с какой газовой смесью контактирует металл в той области, где вы его используете. Хорошее понимание парциального давления кислорода в смеси даст нам температурный интервал.
Именно в нем будет запускаться окислительный процесс, приводящий к разрушению материала или значительному ухудшению уровня его качества.
Факторы скорости протекания газовой химической коррозии
По мере исследования особенностей процесса протекания химической коррозии, ученые смогли определить важные факторы, которые влияют на ее скорость и другие особенности. К ним относятся такие, как:
- Температура среды, в которую погружен металл.
- Состав сплава и другие особенности металла.
- Особенности газовой среды, ее состав, преобладающие элементы.
- Длительность контактирования материала с коррозийной средой.

- Появляющийся продукт коррозии.
Как и в случае с другими типами коррозийных поражений, большое значение имеет тип и особенности создающейся на поверхности оксидной пленки.
Особенности формирования оксидных пленок при газовой коррозии
Весь процесс формирования оксидной пленки на поверхности металла можно разделить на две крупные стадии:
Абсорбирование молекул кислорода на поверхности металлического изделия
Это происходит на тех участках, которые находятся в непосредственном контакте с атмосферой. Заметно появление ионной связи – атом кислорода забирает у металла по два электрода.
Можно предположить, что формирование очень сильной и стабильной связи при протекании такой реакции связано с попаданием кислорода в особое поле атомов металла.
Когда поверхность материала будет полностью наполнена окислителем, окажется сформирована мономолекулярная пленка. Она имеет склонность к утолщению со временем. Это уменьшает дальнейший контакт с кислородом, но сам опасный коррозийный процесс уже оказывается запущен.
Формирование химического соединения
Это явление характерно для ситуации, в которой происходит активное взаимодействие металла и газа. Из-за воздействия окислительных компонентов сплав начинает активно терять валентные электроны. Стремительно формируются и накапливаются продукты коррозии.
Дальнейшее протекание процесса будет во многом характеризоваться особенностями оксидной пленки. Так если она отличается повышенным уровнем защиты, сам коррозийный процесс будет замедляться.
Виды оксидных пленок
Когда химическая коррозия происходит под действием температуры и газовой среды, могут сформироваться три вида пленок:
- Тонкие. Со стороны заметить их будет невозможно. Они одни из самых не прочных, могут легко стираться под действием механического давления.
- Средние. Могут быть замечены, потому что со стороны металл слегка меняет цвет.
- Толстые. Хорошо заметны невооруженным глазом.
Чтобы не допустить протекание опасных процессов разрушения материала, важно сделать пленку защитной.
Факторы формирования защитной пленки
Оксидная пленка способна оказывать выраженное защитное воздействие на материал. Но для этого требуется, чтобы она соответствовала нескольким важным требованиям:
- Сплошность. На поверхности пленка распределяется ровным слоем, без пор и участков, которые не затронуты ею.
- Хорошее сцепление с поверхностью материала. Это требуется для удержания подобного защитного барьера на месте и исключения ухудшения его свойств.
- Химическая инертность. Пленка будет защищать металл только в том случае, если она вступает в химические реакции с окружающей средой. В противном случае, есть большая опасность, что весь защитный эффект окажется сведен к нулю.
Так как материал будет использоваться на протяжении длительного времени и сложно предсказать, что станет воздействовать на него, большое значение имеет стойкость к износу и повышенный уровень твердости.
Не менее важен и тот факт, чтобы пленка не была пористой и рыхлой. Когда она плохо контактируется с поверхностью, риск протекания разрушающих процессов становится значительно выше.
Когда она плохо контактируется с поверхностью, риск протекания разрушающих процессов становится значительно выше.
При изучении различных свойств оксидных пленок, ученые особенно пристально рассматривают сплошность. Отмечается, что на нее влияет молекулярный объем. Его показатели должны быть выше атомного объема металла.
Сплошность не ставится на первое место при определении защитных свойств оксидной пленки только для небольшой группы металлов. В их числе щелочно-земельные и щелочные.
При проведении работ по защите от химической коррозии, большое внимание уделяется методу замера толщины. Анализ характеристик происходит на разных стадиях формирования. Большое значение имеют получаемые показатели скорости окисления металла и характер протекания подобного процесса.
Когда окислы оказываются сформированными, специалисты рекомендуют проверить, какую пленку они создали на поверхности, обладает ли она нужными защитными свойствами.
Химическая коррозия в жидкостях-неэлектролитах
Хотя газовая коррозия считается наиболее распространенной, порчу металла при контакте с различными жидкостями-электролитами также не стоит сбрасывать со счетов.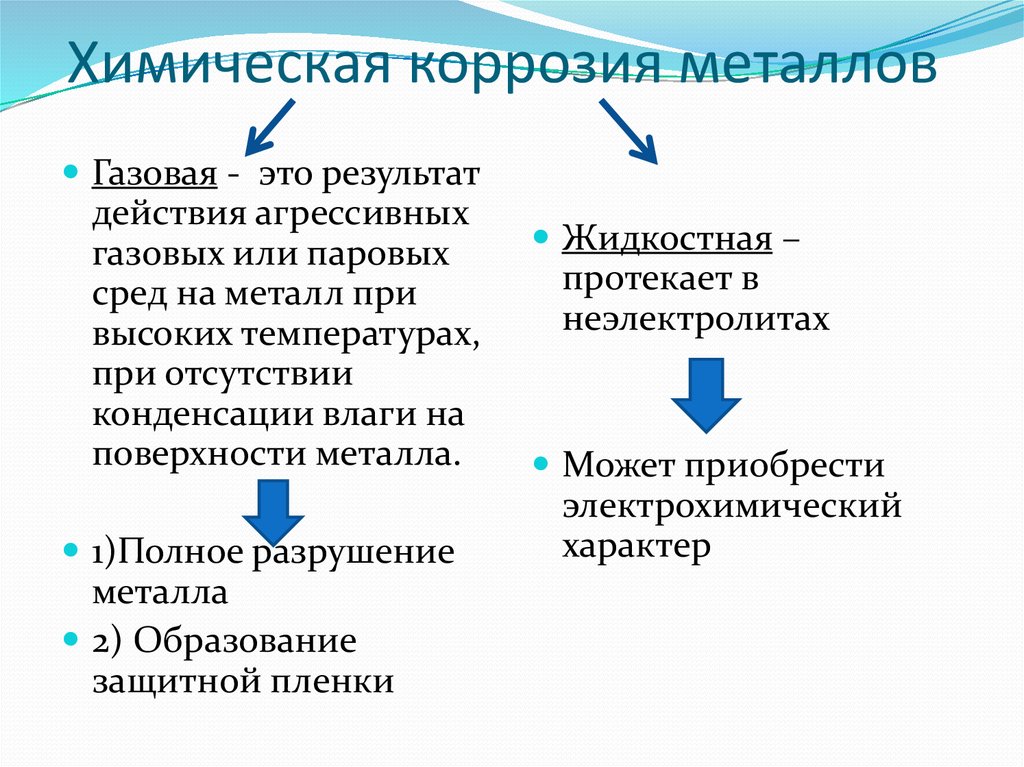 Большую опасность представляет контакт материала с веществами, способными проводить электричество.
Большую опасность представляет контакт материала с веществами, способными проводить электричество.
Их делят на две крупные группы – органические и неорганические. Электролитов, представляющих большую опасность для металла, много – от расплавленной серы и бензола до жидкого брома, спирта, керосина, нефти и других.
Большое значение при протекании химической реакции играет чистота электролита. Когда он полностью чист, взаимодействия не наблюдается. Но стоит только попасть в состав небольшому количеству примесей, реакция начинает развиваться особенно стремительно.
Еще один дополнительный фактор риска – присутствие влаги. Тогда к опасности химической коррозии также прибавляется и угроза электрохимической.
Стадии протекания коррозии в жидкостях-неэлектролитах
Если рассматривать весь процесс более подробно и анализировать, что влияет на скорость химической коррозии, можно выделить несколько стадий ее протекания:
- Контакт окислителя с поверхностью материала.

- Запуск процесса хемосорбции реагента на поверхности.
- Протекание реакции металла и окислителя, формирование оксидной пленки.
Условия среды, состав сплава и самого электролита могут повлиять на протекание нескольких основных процессов. К ним относятся такие, как десорбция оксидов с металлом и диффузия оксидов в неэлектролит. Но оба процесса также могут и не наблюдаться.
Чтобы не допустить запуска коррозии в жидкостях-электролитах, стоит позаботиться о нанесении на поверхность специальных защитных составов. Важно, чтобы на протяжении всего времени использования изделия они полностью сохраняли свою целостность.
Факторы протекания химической коррозии
Большое значение при рассмотрении процесса химической коррозии металлов имеет определение факторов, оказывающих на нее влияние. К ним относятся такие, как:
Температура
Все окислительные процессы протекают быстрее, если температура сильно увеличивается.
Температурный режим
В особой группе риска оказываются металлические изделия, которые на протяжении определенного времени начинают охлаждаться и нагреваться попеременно. В таком случае сильно страдает защитная пленка. Она начинает трескаться, в местах, где это происходит, металл контактирует со средой, запускается повторное окисление. Новая пленка также формируется на фоне постепенного отслоения старой.
Состав среды
Это относится как к газам, так и к электролитам в жидком виде. Как уже было отмечено выше, даже небольшие загрязнения жидкости могут привести к тому, что скорость коррозийного повреждения станет значительно выше.
Состав сплава
В сплав металла добавляют различные компоненты, которые могут, как затормозить, так и ускорить окисление. К примеру, сильными замедлителями признаны такие добавки, как титан, медь и кобальт. Хорошо влияют на уменьшение скорости протекания процесса хром и алюминий.
Тип обработки поверхности
Ученые во время исследований показали, что гладкая поверхность отличается заметно более высокой устойчивостью к окислению, процесс протекает медленнее. Если же на поверхности металла много бугров, есть выраженные дефекты, стоит готовиться к более быстрому протеканию.
Если же на поверхности металла много бугров, есть выраженные дефекты, стоит готовиться к более быстрому протеканию.
Структура материала
Уравнение химической коррозии показывает, что значительное замедление коррозийного процесса характерно для металлов с аустенитной структурой.
Подведем итоги
В этой статье мы рассмотрели виды химической коррозии и то, чем она отличается от электрохимической. При условии соблюдения ряда требований, удается заметно уменьшить риск разрушения металла. К ним относятся такие, как:
- Контроль формирования защитной оксидной пленки.
- Исключение контакта определенных материалов с агрессивными средами.
- Использование дополнительных защитных покрытий.
- Отслеживание состава газовой смеси или электролита.
- Применение металлов с компонентами сплава, замедляющими реакцию.
Соблюдение перечисленных требований позволит значительно увеличить длительность использования вашего металлического изделия.
Вернуться к статьям
Поделиться статьей
Коррозия металлов. Основные виды коррозии. Электрохимическая коррозия металлов
Коррозия металлов. Основные виды коррозии. Электрохимическая коррозия металлов. Скорость коррозии. Методы защиты металлов от коррозии.
Коррозией называется разрушение металлов в результате их физико-химического взаимодействия с окружающей средой. При этом металлы окисляются и образуются продукты коррозии, состав которых зависит от условий коррозии.
Коррозия приводит к большим потерям металлов в результате разрушения трубопроводов, цистерн, металлических частей машин, корпусов судов, морских сооружений и пр. Безвозвратные потери металлов от коррозии составляют 10% от ежегодного их выпуска. По ориентировочным подсчетам, мировая потеря металла от коррозии выражается величиной 20 миллионов тонн в год. Однако, затраты на ремонт или на замену деталей судов, автомобилей, аппаратуры химических производств, приборов во много раз превышают стоимость металла, из которого они изготовлены. Таким образом, борьба с коррозией представляет собой важную народнохозяйственную проблему.
Таким образом, борьба с коррозией представляет собой важную народнохозяйственную проблему.
Различают химическую и электрохимическую коррозию.
Химическая коррозия характерна для сред, не проводящих электрический ток. По условиям протекания коррозионного процесса различают: а) газовую коррозию – в газах и парах без конденсации влаги на поверхности металла, обычно при высоких температурах; б) коррозию в неэлектролитах – агрессивных органических жидкостях, таких как, например, сернистая нефть и др.
Газовая коррозия протекает по схеме: n Me + m/2O2 = MenOm;
Коррозию в серусодержащих неэлектролитах можно выразить схемой: Me + S = MeS.
Электрохимическая коррозия может протекать: а) в водных растворах электролитов, то есть солей, кислот и щелочей; б) в атмосфере любого влажного газа; в) в почве.
В воде обычно содержится растворенный кислород, способный к восстановлению по схеме: О2 + 4Н+ + 4е = 2 Н2О, или в нейтральной среде: 2Н2О +О2 + 4е = 4ОН– (1);
Кроме того, в воде присутствуют ионы водорода, также способные к восстановлению: 2Н+ + 2е = Н2 или (в нейтральной среде) Н2О + 2е = Н2 + ОН–(2). Коррозия с участием кислорода называется коррозией с поглощением кислорода, или коррозией с кислородной деполяризацией. Коррозия с участием ионов водорода называется коррозией с водородной деполяризацией.
Коррозия с участием кислорода называется коррозией с поглощением кислорода, или коррозией с кислородной деполяризацией. Коррозия с участием ионов водорода называется коррозией с водородной деполяризацией.
Потенциал, отвечающий электродному процессу (1), равен 1,229в – 0,059рН. В нейтрально среде он равен около 0,8в. Следовательно, растворенный в воде или нейтральных растворах кислород будет окислять те металлы, потенциал которых меньше, чем 0,8в. Эти металлы расположены в ряду напряжений, начиная от его начала, до серебра.
Потенциал электродного процесса (2) в нейтральной среде равен приблизительно –0,41в. Следовательно, ионы водорода в нейтральных водных растворах могут окислить только те металлы, потенциал которых меньше, чем 0,41в. Это металлы от начала ряда напряжений до кадмия.
Пример 1. Рассмотрим электрохимическую коррозию железа в кислой среде.
На анодных участках происходит окисление железа: (а) Fe – 2e = Fe+2;
На катодных участках происходит восстановление водорода: 2Н+ + 2е = Н2.
Пример 2. Если гвоздь вбить во влажное дерево, то коррозии подвергается (покрывается ржавчиной) та его часть, которая находится внутри дерева. Это объясняется тем, что влага древесины содержит растворенный кислород, то есть, происходит коррозия железа по схеме:
(а) Fe –2e = Fe2+; (к) О2 + 2Н+ + 4е = 2Н2О;
Продуктами коррозии являются вода и оксид железа (II), который в присутствии кислорода окисляется до оксида трехвалентного железа Fe2O3.
Кадмий и металлы, близкие к нему в ряду напряжений, имеют на своей поверхности защитную оксидную пленку, которая препятствует взаимодействию этих металлов с водой. Поэтому количество металлов, которые может окислить водород в нейтральной среде, еще меньше.
Таким образом, вода, содержащая растворенный кислород (в воде его обычно содержится от 0 до 14 мг/л), значительно опаснее в коррозионном отношении, чем вода, способная окислять металлы только за счет ионов водорода.
При использовании металлических материалов очень важным является вопрос о скорости их коррозии. Кроме природы металла и окислителя и содержания последнего, на скорость коррозии могут влиять различные примеси, содержащиеся как в самом металле, так и в коррозионной среде: атмосфере или растворе. Могут иметь место различные случаи электрохимической коррозии.
Атмосферная коррозия – это коррозия во влажном воздухе при обычных температурах. Поверхность металла, находящегося во влажном воздухе, бывает покрыта пленкой воды, содержащей различные газы и, в первую очередь, кислород. Скорость атмосферной коррозии зависит от многих факторов. В частности, на нее влияет влажность воздуха и содержание в нем газов, образующих с водою кислоты (например, СО2 или SО2). Большое значение имеет также состояние поверхности металла: скорость атмосферной коррозии резко возрастает при наличии на поверхности шероховатостей, микрощелей, пор, зазоров и других мест, облегчающих конденсацию в них влаги.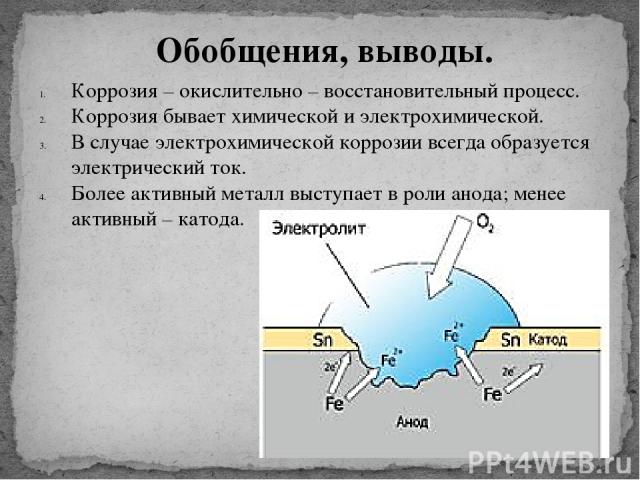
Коррозия в грунте (почвенная коррозия) приводит к разрушению проложенных под землей трубопроводов, оболочек кабелей, деталей строительных сооружений. Металл в этих условиях соприкасается с влагой грунта, содержащей растворенный кислород. В зависимости от состава грунтовых вод, а также минералогического состава грунта, скорость этого вида коррозии может быть весьма различной.
Контактная коррозия протекает, когда два металла в различными потенциалами соприкасаются друг с другом либо в влажной среде, либо при наличии влаги, конденсирующейся из воздуха. Если изделие состоит из различных металлов, то при наличии контакта между ними в присутствии растворителя изделие становится подобным работающему гальваническому элементу. Электрохимическая коррозия включает процессы анодного растворения металла и катодного восстановления окислителя. При этом металл, обладающий более отрицательным электродным потенциалом (более активный металл), окисляется (разрушается) так, словно он является анодом работающего гальванического элемента.
Пример 3. Хром находится в контакте с медью. Какой из металлов будет окисляться, если эта пара металлов попадет в кислую среду? Составьте схему образующегося при этом гальванического элемента.
Хром более активный металл, чем медь (потенциал хрома равен –0,744в, а меди +0,337в), поэтому в образующейся гальванической паре он будет анодом, а медь – катодом. Хромовый анод растворяется: (а) 2Cr – 6e = 2Cr3+;
на медном катоде выделяется водород: (к) 6Н+ + 6е = 3Н2.
Схема образующегося гальванического элемента:
(-) 2Cr/Cr3+//HCl/(Cu)3H2/6H+ (+)
Основным отличием процессов контактной электрохимической коррозии от процессов, происходящих в гальваническом элементе, является отсутствие внешней электрической цепи. Электроны в процессе коррозии не выходят за пределы коррозирующего металла, а двигаются внутри него. Химическая энергия преобразуется в данном случае не в электрохимическую энергию, а в тепловую. Если изделие состоит из различных металлов, то при наличии контакта между ними в присутствии растворителя изделие становится подобным работающему гальваническому элементу. Электрохимическая коррозия включает процессы анодного растворения металла и катодного восстановления окислителя. При этом металл, обладающий более отрицательным электродным потенциалом (более активный металл), окисляется (разрушается) так, словно он является анодом работающего гальванического элемента.
Электроны в процессе коррозии не выходят за пределы коррозирующего металла, а двигаются внутри него. Химическая энергия преобразуется в данном случае не в электрохимическую энергию, а в тепловую. Если изделие состоит из различных металлов, то при наличии контакта между ними в присутствии растворителя изделие становится подобным работающему гальваническому элементу. Электрохимическая коррозия включает процессы анодного растворения металла и катодного восстановления окислителя. При этом металл, обладающий более отрицательным электродным потенциалом (более активный металл), окисляется (разрушается) так, словно он является анодом работающего гальванического элемента.
На поверхности металла могут быть участки, на которых катодные процессы протекают быстрее (катализируются). Такие участки называют катодными. На других участках будет происходить анодное растворение металла, поэтому они называются анодными участками. Катодные и анодные участки имеют очень малые размеры, однако, они чередуются и образуют коррозионные микроэлементы. Таким образом, при наличии неоднородности поверхности металла коррозионный процесс заключается в работе огромного числа коррозионных микроэлементов. Если металл включения имеет больший потенциал, чем основной металл, то последний становится анодом в образующемся гальваническом микроэлементе и скорость его коррозии возрастает. Так, например, алюминий, содержащий включения железа или меди, коррозирует значительно быстрее, чем алюминий высокой чистоты.
Таким образом, при наличии неоднородности поверхности металла коррозионный процесс заключается в работе огромного числа коррозионных микроэлементов. Если металл включения имеет больший потенциал, чем основной металл, то последний становится анодом в образующемся гальваническом микроэлементе и скорость его коррозии возрастает. Так, например, алюминий, содержащий включения железа или меди, коррозирует значительно быстрее, чем алюминий высокой чистоты.
Пример 4. Атмосферная коррозия алюминия в нейтральной среде протекает по схеме:
(а) 2Al – 6e = 2Al 3+; (к) 3Н2О + 3е = 3Н2 + 3ОН–. Продуктами коррозии являются в данном случае водород и гидроксид алюминия.
Пример 5. Медь не вытесняет водород из разбавленных кислот вследствие того, что ее потенциал более положительный, чем потенциал водорода. Однако если к медной пластинке, опущенной в кислоту, прикоснуться цинковой пластинкой, то на меди начинается бурное выделение водорода. Это происходит потому, что образуется гальваническая пара, в которой более активный металл (цинк) служит анодом. На аноде происходит окисление цинка по схеме: (а) Zn – 2e = Zn2+; На меди, ставшей катодом, происходит восстановление водорода: (к) 2H+ + 2e = H2.
Это происходит потому, что образуется гальваническая пара, в которой более активный металл (цинк) служит анодом. На аноде происходит окисление цинка по схеме: (а) Zn – 2e = Zn2+; На меди, ставшей катодом, происходит восстановление водорода: (к) 2H+ + 2e = H2.
Соотношение между потенциалами контактирующих металлов зависит не только от природы металлов, но и от природы растворенных в воде веществ и температуры. Так, в случае контакта железо-цинк, последний интенсивно коррозирует при комнатной температуре, но в горячей воде полярность металлов изменяется, и коррозировать начинает железо.
Для защиты от коррозии и предупреждения ее применяются различные методы. К важнейшим из них относятся следующие методы:
1) Легирование металлов. При легировании в состав сплава вводят компоненты, вызывающие пассивацию основного металла и повышение его устойчивости к коррозии. В качестве таких легирующих компонентов применяют хром, никель, вольфрам и другие металлы. Легирование металлов – эффективный, хотя и дорогой способ защиты от коррозии.
В качестве таких легирующих компонентов применяют хром, никель, вольфрам и другие металлы. Легирование металлов – эффективный, хотя и дорогой способ защиты от коррозии.
2) Защитные покрытия. Слои различных материалов, создаваемые на поверхности металлических изделий и сооружений для защиты от коррозии называются защитными покрытиями. Материалами для защитных покрытий могут быть как чистые металлы цинк, кадмий, алюминий, никель, медь, хром, серебро, так и их сплавы (бронза, латунь и др.).
Защитные покрытия делятся на катодные и анодные покрытия. К катодным покрытиям относятся такие металлические покрытия, потенциалы которых имеют более положительное значение, чем потенциал основного металла. Примерами катодного покрытия на стальных изделиях являются медь, серебро, никель. При повреждении покрытия или при наличии в нем пор возникает коррозионный элемент, в котором основной материал служит анодом и растворяется (коррозирует), а материал – катодом, на котором выделяется водород или поглощается кислород. Таким образом, катодные покрытия могут защищать основной металл от коррозии лишь при отсутствии на нем повреждений или пор.
Таким образом, катодные покрытия могут защищать основной металл от коррозии лишь при отсутствии на нем повреждений или пор.
Анодные покрытия имеют более отрицательный потенциал, чем потенциал основного металла. Примером анодного покрытия может служить цинковое покрытие на стальных изделиях. При повреждении покрытия анодом будет служить металл покрытия, а основной металл, в качестве катода, разрушению подвергаться не будет. Потенциалы металлов зависят от состава растворов, поэтому, например, покрытие стали оловом (лужение) в растворе серной кислоты является катодным, а в растворе органических кислот – анодным.
Пример 6. Железное изделие покрыли кадмием. Какое это покрытие – катодное или анодное? Составьте уравнения анодного и катодного процессов коррозии этого изделия во влажном воздухе и в соляной кислоте. Какие продукты коррозии образуются в первом и во втором случае?
Кадмий (потенциал –0,403в) менее активный металл, чем железо, (потенциал –0,440в) и в случае образование коррозионного элемента будет служить катодом поэтому данное покрытие является катодным. При коррозии происходит анодное растворение железа:
При коррозии происходит анодное растворение железа:
(а) Fe – 2e = Fe2+;
Катодным процессом в случае атмосферной коррозии во влажном воздухе будет восстановление кислорода:
(к) H2O +O2 + 4e = 4OH–;
Продуктами коррозии в данном случае являются гидроксид железа.
В кислой среде происходит катодное восстановление ионов водорода:
(к) 2Н+ +2е = Н2.
Продуктами коррозии в этом случае являются хлорид железа (II) и водород.
Пример 7. Две железные пластинки, частично покрытые одна оловом, другая медью, находятся во влажном воздухе. На какой из этих пластинок быстрее образуется ржавчина? Составьте уравнения анодного и катодного процессов коррозии и укажите, какие продукты коррозии образуются.
Ржавчиной быстрее покроется железная пластинка, покрытая медью, так как в паре железо (потенциал –0,440в) – медь (потенциал +0,337в) железо является анодом и разрушается по схеме:
(а) Fe – 2e = Fe2+;
На катоде происходит восстановление растворенного в воде кислорода по схеме:
(к) H2O + O2 + 4e = 4OH–;
Продуктами коррозии является гидроксид железа.
В паре железо-олово (потенциал +0,150в) железо также является более активным металлом, а, следовательно, анодом. Анодный процесс состоит в окислении железа по схеме:
(а) Fe –2e = Fe2+;
Вместе с этой лекцией читают “5 Сетевые модели”.
Катодный процесс протекает аналогично предыдущему. Продуктами коррозии является гидроксид железа.
ЭДС первого коррозионного элемента равен +0,337 – (-0,440) = +0,777 в. ЭДС второго коррозионного элемента равен +0,150 – (-0,440) = +0,590 в. Следовательно, в первом случае коррозия железа будет протекать быстрее.
3) Электрохимическая защита. Этот метод защиты от коррозии основан на торможении анодных или катодных реакций коррозионных процессов. К защищаемой конструкции присоединяют металл с более отрицательным электродным потенциалом, чем потенциал металла конструкции. Этот металл называется протектором, а защита от коррозии – протекторной защитой. При хорошем контакте защищаемый металл (например, железо) и металл протектора (например, цинк) оказывают друг на друга поляризующее действие в соответствии с их положением в ряду активности металлов. Железо поляризуется катодно, а цинк – анодно. В результате на железе идет процесс окисления того окислителя, который вызывает коррозию (это обычно растворенный в воде кислород), а цинк окисляется. Протекторы широко применяются для защиты морских судов. Ясно, что убытки, связанные с ремонтом громадного судна вследствие коррозии его конструкций во много раз превысили бы стоимость протекторов.
При хорошем контакте защищаемый металл (например, железо) и металл протектора (например, цинк) оказывают друг на друга поляризующее действие в соответствии с их положением в ряду активности металлов. Железо поляризуется катодно, а цинк – анодно. В результате на железе идет процесс окисления того окислителя, который вызывает коррозию (это обычно растворенный в воде кислород), а цинк окисляется. Протекторы широко применяются для защиты морских судов. Ясно, что убытки, связанные с ремонтом громадного судна вследствие коррозии его конструкций во много раз превысили бы стоимость протекторов.
Используется также катодная или анодная поляризация за счет приложенного извне тока. Сущность катодной защиты заключается в том, что защищаемое изделие присоединяется к отрицательному полюсу внешнего источника постоянного тока и становится вследствие этого катодом. Анодом обычно служит стальной вспомогательный электрод, который растворяется. Анодную защиту применяют к металлам, способным легко пассивироваться (образовывать оксидную пленку) при смещении их потенциала в положительную сторону. Анодную защиту применяют, например, для предотвращения коррозии нержавеющих сталей в серной кислоте.
Анодную защиту применяют, например, для предотвращения коррозии нержавеющих сталей в серной кислоте.
4) Изменение свойств коррозионной среды. Для снижения агрессивности среды уменьшают концентрацию в ней компонентов, опасных в коррозионном отношении. В нейтральных средах, например, коррозия протекает обычно с поглощением кислорода. Кислород удаляют кипячением или вытеснением его из раствора при помощи инертного газа (барботаж инертным газом) или восстанавливают соответствующими реагентами (сульфиты, гидразин). Агрессивность кислых сред можно снизить подщелачиванием (нейтрализацией).
Для защиты от коррозии широко применяют вещества, при добавлении которых в соответствующую среду значительно уменьшается скорость коррозии. Такие вещества называются ингибиторами коррозии. По составу ингибиторы делятся на органические и неорганические. Так как активность ингибиторов зависит от рН среды, их также делят на кислотные, щелочные и нейтральные. По механизму действия ингибиторы можно разделить на анодные, катодные и экранирующие. Анодные замедлители, например, нитрит натрия или дихромат калия, тормозят анодные процессы. Катодные замедлители снижают скорость коррозионного процесса за счет снижения интенсивности катодного процесса. К ним относятся такие органические вещества, как диэтиламин, уротропин, формальдегид и пр. Экранирующие ингибиторы (амины с небольшой молекулярной массой с добавлением группы -NO3 или -СО3) адсорбируются на поверхности металла, предохраняя его от контакта с агрессивными средами, вызывающими коррозию металла.
Анодные замедлители, например, нитрит натрия или дихромат калия, тормозят анодные процессы. Катодные замедлители снижают скорость коррозионного процесса за счет снижения интенсивности катодного процесса. К ним относятся такие органические вещества, как диэтиламин, уротропин, формальдегид и пр. Экранирующие ингибиторы (амины с небольшой молекулярной массой с добавлением группы -NO3 или -СО3) адсорбируются на поверхности металла, предохраняя его от контакта с агрессивными средами, вызывающими коррозию металла.
Типы коррозии – ZfP – TUM Wiki
Анжелика Ретт, зимний семестр 2018/19
Введение
«Коррозия – это необратимая межфазная реакция материала (металла, керамики, полимера) с окружающей средой, в результате которой происходит потребление материала или при растворении в материале компонента окружающей среды. Часто, но не обязательно, коррозия приводит к последствиям, наносящим ущерб использованию рассматриваемого материала».[1]
Коррозия возникает на границе между материалом и окружающей средой. Материал необратимо растворяется. Часто этот процесс приводит к потере стабильности и других важных свойств, и материал становится непригодным для дальнейшего использования. В гражданском строительстве очень опасна коррозия железобетонных элементов. Для обнаружения коррозии в этих компонентах можно использовать различные методы неразрушающего контроля.
Физические принципы
Электрохимическая коррозия
Электрохимическая коррозия представляет собой сумму нескольких химических реакций, называемых окислением и восстановлением. Сочетание этих двух процессов называется окислительно-восстановительной реакцией. Это происходит там, где металлические материалы встречаются с электролитами. Электролиты могут проводить заряды, примерами являются вода, кислоты, основания и атмосфера. [2] Место, где происходит окисление, называется анодом. Металл окисляется и становится положительно заряженным ионом. Максимальное количество электронов, которое может высвободить атом, равно количеству его валентных электронов. Многие ионы металлов могут находиться в различных заряженных состояниях, поэтому для одного атома металла возможны разные реакции. В примере железа два возможных окисления 9-
Максимальное количество электронов, которое может высвободить атом, равно количеству его валентных электронов. Многие ионы металлов могут находиться в различных заряженных состояниях, поэтому для одного атома металла возможны разные реакции. В примере железа два возможных окисления 9-
Окислительно-восстановительная реакция не может привести к накоплению заряда, все освободившиеся электроны должны быть поглощены реакциями восстановления. [2]
Серия стандартных ЭДС
Различные возможные реакции для одного атома не равновероятны, что изображается стандартным рядом ЭДС (рядом ЭДС). Различные реакции восстановления перечислены для разных материалов в зависимости от вероятности их протекания. Благородные материалы становятся все более инертными, тогда как менее благородные материалы становятся все более активными и, следовательно, находятся дальше в конце списка. 9- \rightleftharpoons Li
Химическая коррозия
Химическая коррозия происходит без электролитов, часто при высоких температурах. Должен иметь место прямой перенос электрона между партнерами по реакции. Следовательно, окисление и восстановление происходят в одном и том же месте. Свойства продуктов реакции могут влиять на скорость протекания коррозионных процессов. Например, гидрофильные продукты вызывают электрохимическую коррозию. [3] Химическая коррозия во многих случаях представляет собой реакцию между металлом и кислородом, в результате которой образуется оксид металла, например [5]
Должен иметь место прямой перенос электрона между партнерами по реакции. Следовательно, окисление и восстановление происходят в одном и том же месте. Свойства продуктов реакции могут влиять на скорость протекания коррозионных процессов. Например, гидрофильные продукты вызывают электрохимическую коррозию. [3] Химическая коррозия во многих случаях представляет собой реакцию между металлом и кислородом, в результате которой образуется оксид металла, например [5]
2Mg + O_2 \rightarrow 2MgO
Типы коррозии
Коррозия может происходить как равномерно распределенной по открытой поверхности, так и локально. Если разрушение материала происходит равномерно, то процесс называется равномерной коррозией. Если затронуты только определенные области, это называется локализованной коррозией. Наиболее известным случаем равномерной коррозии является ржавление стали, подвергающейся воздействию атмосферы. Эффект можно уменьшить, покрыв открытые участки менее реактивными материалами. [6] Разрывы таких покрытий приводят к локальной коррозии на открытом участке. [7]
[6] Разрывы таких покрытий приводят к локальной коррозии на открытом участке. [7]
Ниже будут описаны формы локальной коррозии.
Гальваническая коррозия
Если два различных металлических материала соединяются вместе в присутствии электролита и соединяются электрически, образуется элемент коррозии. Более благородный металл действует как катод, а менее благородный – как анод и, следовательно, подвергается коррозии. Освобожденные от окисления электроны распространяются к катоду, где реагируют с ионами, циркулирующими в электролите. Создается замкнутая цепь, которая используется для измерения потенциального поля. Этот процесс изображен на рис. 1. [2] [5]
Гальваническая коррозия также может использоваться для предотвращения коррозии. Компонент, который нуждается в защите, электрически соединен с менее благородным металлом, который будет действовать как анод в этом созданном таким образом коррозионном элементе и предотвратит коррозию компонента. Менее благородный металл называется жертвенным анодом. [2]
Менее благородный металл называется жертвенным анодом. [2]
| Рисунок 1: Гальваническая коррозия. Только менее благородный материал подвергается коррозии, благородная часть защищена. Штриховая линия указывает исходный объем анода |
Селективное выщелачивание
Также известное как: Селективная коррозия, Селективное травление
Селективное выщелачивание возникает в сплавах, когда корродирует только один компонент сплава (рис. 2). Согласно ряду ЭДС, корродирует менее благородный компонент. Иногда поражается только поверхностный слой, а структурных повреждений не происходит. Но есть известные случаи, такие как графитизация чугуна или децинкификация латуни, когда затрагивается весь компонент и остается только пористая основа, что делает компонент менее стабильным. [2] [6]
| Рисунок 2: Селективная коррозия в спланировании, где только компонент А затронут коррозион и растворяется (показано в серию) | 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9007 9.
Точечная коррозия
Точечная коррозия – это форма локальной коррозии, которая часто вызывается трещинами или отверстиями в защитном покрытии. Питтинговая коррозия распространяется под поверхностью, что очень затрудняет ее обнаружение, поэтому эффект дефекта очень опасен, поскольку небольшой дефект приводит к значительной потере стабильности. Пример точечной коррозии показан на рис. 3. [7]
Рисунок 3: Коррозия пит – щели из-за разницы в концентрации кислорода. Концентрация внутри щели меньше, чем снаружи, что делает щель анодной частью реакции. Это называется концентрационной ячейкой. Электроны, освобожденные в результате окисления, распространяются по материалу в соседние области, где происходит восстановление, и эти электроны связываются. Положительно заряженные ионы металлов реагируют с другими ионами, содержащимися в воздухе. Щели могут быть небольшими дефектами на поверхности, но часто они возникают из-за особенностей конструкции, например, в болтовых или заклепочных соединениях (как показано на рис. 4). [2] [5] [7] 4). [2] [5] [7]
|




 [1]
[1] 
 Как только размер трещины достигает критического предела, приложенные напряжения приводят к разрушению компонента. Опасность SCC заключается в величине напряжений, необходимых для возникновения и распространения. Они намного ниже критических напряжений самого компонента. Эта форма коррозии не дает никаких видимых продуктов коррозии и поэтому часто ошибочно принимается за хрупкое разрушение, но материалы, подверженные SCC, в основном пластичны. [2] [5] [6]
Как только размер трещины достигает критического предела, приложенные напряжения приводят к разрушению компонента. Опасность SCC заключается в величине напряжений, необходимых для возникновения и распространения. Они намного ниже критических напряжений самого компонента. Эта форма коррозии не дает никаких видимых продуктов коррозии и поэтому часто ошибочно принимается за хрупкое разрушение, но материалы, подверженные SCC, в основном пластичны. [2] [5] [6]  Коррозионная среда снизит количество циклов до отказа за счет сокращения времени до появления первых трещин. Скорость распространения этих трещин ускоряется из-за коррозионного воздействия. Этот процесс называется коррозионной усталостью и, в отличие от SCC, не зависит от типа материала. [6] [8]
Коррозионная среда снизит количество циклов до отказа за счет сокращения времени до появления первых трещин. Скорость распространения этих трещин ускоряется из-за коррозионного воздействия. Этот процесс называется коррозионной усталостью и, в отличие от SCC, не зависит от типа материала. [6] [8]  Это может произойти только в том случае, если применяется растяжение ((Механические напряжения|напряжения]] и материал находится в коррозионной среде, что делает явление очень похожим на коррозионное растрескивание под напряжением. Разница в том, что водородное охрупчивание может иметь место даже при наличии отсутствие существующих трещин. Атомарный водород, образующийся в результате восстановительных процессов, диффундирует через поверхность к участкам с дефектами и затем будет реагировать различными способами. Если два атома водорода соединятся вместе, они могут образовать молекулу водорода. Эта молекула будет примерно в 600 раз больше, чем два отдельных атома и, следовательно, давление внутри металла резко увеличится. Это приведет к образованию в основном межкристаллитных трещин. Атомы водорода также могут реагировать с углеродом внутри металла и образовывать молекулы метана, которые будут собираться в пузыри. Эти пузыри приводят к потеря прочности и образование трещин [2] [5] [6] [8]
Это может произойти только в том случае, если применяется растяжение ((Механические напряжения|напряжения]] и материал находится в коррозионной среде, что делает явление очень похожим на коррозионное растрескивание под напряжением. Разница в том, что водородное охрупчивание может иметь место даже при наличии отсутствие существующих трещин. Атомарный водород, образующийся в результате восстановительных процессов, диффундирует через поверхность к участкам с дефектами и затем будет реагировать различными способами. Если два атома водорода соединятся вместе, они могут образовать молекулу водорода. Эта молекула будет примерно в 600 раз больше, чем два отдельных атома и, следовательно, давление внутри металла резко увеличится. Это приведет к образованию в основном межкристаллитных трещин. Атомы водорода также могут реагировать с углеродом внутри металла и образовывать молекулы метана, которые будут собираться в пузыри. Эти пузыри приводят к потеря прочности и образование трещин [2] [5] [6] [8]  Поэтому ее называют соответственно эрозионной или кавитационной коррозией.
Поэтому ее называют соответственно эрозионной или кавитационной коррозией. На примере стали этот оксидный порошок представляет собой красную ржавчину, которую легко увидеть при эндоскопическом исследовании. [5] [6] [8]
На примере стали этот оксидный порошок представляет собой красную ржавчину, которую легко увидеть при эндоскопическом исследовании. [5] [6] [8] 
 67-76.
67-76. Это безжалостная естественная сила разрушения. Коррозия приводит к:
Это безжалостная естественная сила разрушения. Коррозия приводит к: Коррозия способна удалить один из составляющих металлов сплава или компонентов бетона, оставив слабый и разрушающийся остаток.
Коррозия способна удалить один из составляющих металлов сплава или компонентов бетона, оставив слабый и разрушающийся остаток. Анализ добытой железной руды показывает, что это тоже оксид железа. Коррозию можно объяснить как металлургию наоборот.
Анализ добытой железной руды показывает, что это тоже оксид железа. Коррозию можно объяснить как металлургию наоборот.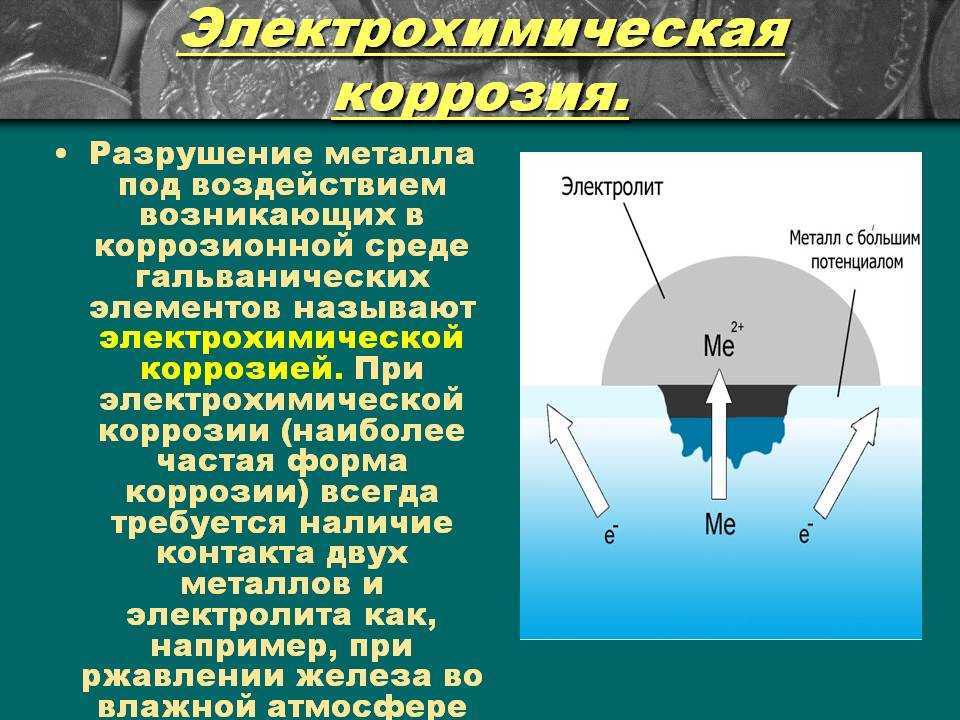 Эта электродвижущая сила запускает процесс коррозии на стальной поверхности.
Эта электродвижущая сила запускает процесс коррозии на стальной поверхности.
 Магнетит образуется путем восстановления Fe 2 O 3 до Fe 3 O 2 . Образование FeO может происходить либо при нагревании проржавевшей стали до высоких температур, либо при восстановлении. В кислой среде, даже без присутствия кислорода, металл на аноде быстро разрушается, в то время как на катоде водородная пленка постоянно разрушается, образуя газообразный водород. Когда коррозия кислотой приводит к образованию соли, реакция значительно замедляется, потому что на поверхности, подвергающейся воздействию, образуется пленка соли.
Магнетит образуется путем восстановления Fe 2 O 3 до Fe 3 O 2 . Образование FeO может происходить либо при нагревании проржавевшей стали до высоких температур, либо при восстановлении. В кислой среде, даже без присутствия кислорода, металл на аноде быстро разрушается, в то время как на катоде водородная пленка постоянно разрушается, образуя газообразный водород. Когда коррозия кислотой приводит к образованию соли, реакция значительно замедляется, потому что на поверхности, подвергающейся воздействию, образуется пленка соли.
 Чтобы гальваническая коррозия имела место, два металла должны находиться в контакте друг с другом, а также должен быть электролит, обеспечивающий протекание тока.
Чтобы гальваническая коррозия имела место, два металла должны находиться в контакте друг с другом, а также должен быть электролит, обеспечивающий протекание тока. Если на поверхности стали присутствует ржавчина или прокатная окалина, произойдет гальваническая коррозия из-за несхожести металлов с основным металлом, являющимся анодом.
Если на поверхности стали присутствует ржавчина или прокатная окалина, произойдет гальваническая коррозия из-за несхожести металлов с основным металлом, являющимся анодом. Наиболее распространенным примером является термическое воздействие (сварка) аустенитной нержавеющей стали.
Наиболее распространенным примером является термическое воздействие (сварка) аустенитной нержавеющей стали.
 Щелевая коррозия (или коррозия концентрационной камеры) может быть устранена за счет правильной конструкции резервуара. Если используется сварка внахлестку, нахлесты должны быть заполнены угловой сваркой или подходящим герметиком для предотвращения щелевой коррозии. Использование надлежащей стыковой сварки избавит от необходимости дальнейшего обслуживания.
Щелевая коррозия (или коррозия концентрационной камеры) может быть устранена за счет правильной конструкции резервуара. Если используется сварка внахлестку, нахлесты должны быть заполнены угловой сваркой или подходящим герметиком для предотвращения щелевой коррозии. Использование надлежащей стыковой сварки избавит от необходимости дальнейшего обслуживания.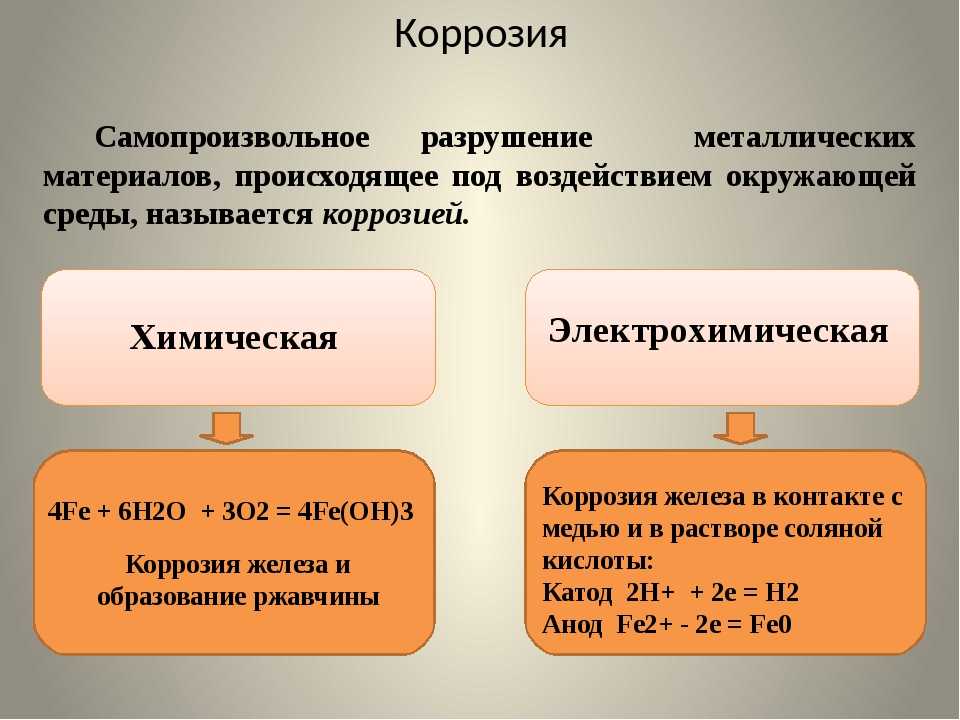
 Электролит, конечно, необходим для правильного потока электронов. Этот метод нашел широкое применение в подводных трубопроводах, морских сооружениях и оборудовании, резервуарах для воды. Тем не менее, этот метод не работает со многими химическими веществами или при отсутствии электролита.
Электролит, конечно, необходим для правильного потока электронов. Этот метод нашел широкое применение в подводных трубопроводах, морских сооружениях и оборудовании, резервуарах для воды. Тем не менее, этот метод не работает со многими химическими веществами или при отсутствии электролита. Грунтовки из красного свинца, вероятно, самые старые, за ними следуют хроматы, молибдаты, субоксид свинца и метаборат бария. Многие из них теряют свои позиции в борьбе с коррозией из-за личных и экологических проблем, возникающих в последнее десятилетие. Ингибирующие пигменты выделяют в воду растворимые ионы, которые проникают в пленку покрытия. Эти ионные частицы переносятся на поверхность металла и увеличивают поляризацию анода или катода. Этот процесс способствует развитию микроскопических защитных поверхностных слоев.
Грунтовки из красного свинца, вероятно, самые старые, за ними следуют хроматы, молибдаты, субоксид свинца и метаборат бария. Многие из них теряют свои позиции в борьбе с коррозией из-за личных и экологических проблем, возникающих в последнее десятилетие. Ингибирующие пигменты выделяют в воду растворимые ионы, которые проникают в пленку покрытия. Эти ионные частицы переносятся на поверхность металла и увеличивают поляризацию анода или катода. Этот процесс способствует развитию микроскопических защитных поверхностных слоев. Таким образом, сталь становится полностью катодной по отношению к цинку и защищена.
Таким образом, сталь становится полностью катодной по отношению к цинку и защищена.