Химические свойства al: Химические свойства алюминия — урок. Химия, 9 класс.
alexxlab | 27.04.2023 | 0 | Разное
Алюминий — химические и физические свойства, сферы применения
Алюминий — химические и физические свойства, сферы применения
Алюминий (Al) от латинского Aluminium — лёгкий парамагнитный металл, серебристо-белого цвета, плотностью 2712 кг/м³, легко поддающийся формовке, литью и механической обработке. Металл с повышенной тепло- и электропроводностью, и стойкостью к коррозии, за счёт образования оксидной защищающей плёнки Al2O3. Температура плавления технического алюминия 658°C, с повышенной чистотой 660°C. Сопротивление литого алюминия 10-12 кг/мм², деформируемого 18-25 кг/мм², сплавов 38-42 кг/мм². Пластичность технического алюминия 35%, чистого 50%. Прокат с повышенной электропроводностью 37·106 cм/м, теплопроводностью 203,5 Вт/(м·К), и повышенной светоотражаемостью.
Масса доли элементов в сплавах алюминия
- Дуралюмин — дюраль, дюралюминий, от названия немецкого города, где было начато промышленное производство сплава. Сплав алюминия (основа) с медью (Cu: 2,2-5,2%), магнием (Mg: 0,2-2,7%) марганцем (Mn: 0,2-1%).
 Подвергается закалке и старению, часто плакируется алюминием. Является конструкционным материалом для авиационного и транспортного машиностроения.
Подвергается закалке и старению, часто плакируется алюминием. Является конструкционным материалом для авиационного и транспортного машиностроения. - Силумин — легкие литейные сплавы алюминия (основа) с кремнием (Si: 4-13%), иногда до 23% и некоторыми другими элементами: Cu, Mn, Mg, Zn, Ti, Be). Изготавливают детали сложной конфигурации, главным образом в авто- и авиастроении.
- Магналии — сплавы алюминия (основа) с магнием (Mg: 1-13%) и другими элементами, обладающие высокой коррозийной стойкостью, хорошей свариваемостью, высокой пластичностью. Изготавливают фасонные отливки (литейные магналии), листы, проволоку, заклепки и т.д. (деформируемые магналии).
Основные достоинства всех сплавов алюминия состоят в их малой плотности (2,5-2,8 г/см3), высокая прочность (в расчете на единицу веса), удовлетворительная стойкость против атмосферной коррозии, сравнительная дешевизна и простота получения и обработка.
Модули упругости алюминия и коэффициент Пуассона
| Наименование материала | Модуль Юнга, кГ/мм2 | Модуль сдвига, кГ/мм2 | Коэффициент Пуассона |
|---|---|---|---|
| Алюминиевая бронза, литье | 10500 | 4200 | — |
| Алюминиевая проволока тянутая | 7000 | — | — |
| Алюминий катаный | 6900 | 2600-2700 | 0,32-0,36 |
Физические свойства алюминия
Алюминий характеризуется высокой электропроводностью, теплопроводностью, стойкостью к коррозии и морозу, пластичностью.
По степени очистки различают алюминий высокой и технической чистоты. Практическое различие заключается в отличии коррозионной устойчивости к некоторым средам. Чем чище металл, тем он дороже. Технический алюминий используется для изготовления сплавов, проката и кабельно-проводниковой продукции. Металл высокой чистоты применяют в специальных целях.
По показателю электропроводности алюминий уступает только золоту, серебру и меди. А сочетание малой плотности и высокой электропроводности позволяет конкурировать в сфере кабельно-проводниковой продукции с медью.
Теплопроводность алюминия повышается с увеличением чистоты металла. Примеси марганца, магния и меди снижают это свойство. Алюминий обладает высокой удельной теплоёмкостью и теплотой плавления. Эти показатели значительно больше, чем у большинства металлов.
Чем выше степень чистоты алюминия, тем больше он способен отражать свет от поверхности. Металл хорошо полируется и анодируется.
Алюминий имеет большое сродство к кислороду и покрывается на воздухе тонкой прочной плёнкой оксида алюминия. Эта плёнка защищает металл от последующего окисления и обеспечивает его хорошие антикоррозионные свойства.
Металл обладает стойкостью к атмосферной коррозии, морской и пресной воде, практически не вступает во взаимодействия с органическими кислотами, концентрированной или разбавленной азотной кислотой.
На нашем сайте, в каталоге алюминиевого проката, вы можете ознакомится и приобрести следующие виды продукции из алюминия:
Области применения алюминия
Широко применяется как конструкционный профиль, при изготовлении кухонной посуды, фольги в пищевой промышленности. Также в авиационной и авиакосмической промышленности. Недостаток алюминия как конструкционного материала — малая прочность, поэтому для упрочнения алюминий сплавляют с медью и магнием, получая дюралюминий.
Алюминий применяется в электротехнике для изготовления проводов, экранирования и даже в микроэлектронике при напылении проводников на поверхности кристаллов микросхем. Благодаря комплексу свойств алюминиевые трубы широко распространены в тепловом оборудова6нии. Профильные трубы используются в строительстве и производственных сборках конструкций, при изготовлении мебели. Сплавы алюминия не приобретают хрупкость при сверхнизких температурах, используется в криогенной технике. Повышенный коэффициент отражения в сочетании с дешевизной и лёгкостью вакуумного напыления делает алюминий оптимальным материалом для изготовления зеркал.
Для декора входных и лестничных конструкций используется рифленые листы. При изготовлении облицовочных, противоскользящих и декоративных покрытий. В автомобилестроении для производства порогов и ступеней. Листовой прокат применяются в конструкциях, топливной, пищевой и химической промышленностях, также в строительстве и машиностроении. Производиться при помощи горячего, а затем холодного деформирования. Лист производят из сплава алюминия, и покрывают тонким слоем чистого алюминия. Материал обретает особую пластичность, прочность и устойчивость к негативным внешним факторам. Благодаря своим эксплуатационным характеристикам листы используются в строительстве чаще всего применяют как изоляционный или отделочный материал.
Лист производят из сплава алюминия, и покрывают тонким слоем чистого алюминия. Материал обретает особую пластичность, прочность и устойчивость к негативным внешним факторам. Благодаря своим эксплуатационным характеристикам листы используются в строительстве чаще всего применяют как изоляционный или отделочный материал.
В авиастроении алюминий используется как базовый материал, из-за своей легкости. Из прутков изготавливают детали силового каркаса самолетов и других узлов. Также прутки востребованы в автомобильной промышленности.
Проволока применяется главным образом в сварочных работах и электротехники. Также используется в строительстве, машиностроении, пищевой и мебельной промышленности. Как универсальный крепеж, применяется при изготовлении сеток, мебельной фурнитуры, пружин, заклёпок, различных декоративных элементов.
Для изготовления легких и прочных конструкций не заменим уголок. Он используется для элементов морских, речных и воздушных судов, комплектующих для автомобилей. Уголок применяют для ограждающих сооружений, декоративных и умеренно нагруженных несущих конструкций. Как заготовка для изготовления деталей посредством последующей обработки. Прочность увеличивается за счет термической обработки, для увеличения срока службы подвергают анодному оксидированию.
Уголок применяют для ограждающих сооружений, декоративных и умеренно нагруженных несущих конструкций. Как заготовка для изготовления деталей посредством последующей обработки. Прочность увеличивается за счет термической обработки, для увеличения срока службы подвергают анодному оксидированию.
Швеллера выполняют функцию стыковочного, базового элемента, встречаются в различных перемычках, карнизах, дверных и оконных профилях. Конструкции, изготовленные с их применением, отличают высокая жесткость, прочность и легкость. Благодаря пластичности, из него можно создавать инженерные, дизайнерские системы разных форм. Анодированный швеллер обладает высокими электроизоляционными свойствами и не подвержен накапливанию статического заряда, что важно при возведении высотных зданий. Благодаря швеллерам возможно изготавливать конструкции без применения сварки. Получая разборные сооружения, которые можно перенести частично или полностью на другое место. Данная технология, к примеру, используется при создании сезонных или временных складов, построек.
Полосы используются для закрывания соединительных швов между плитами. Как материал для изготовления декоративных элементов в производстве автомобилей, из них штампуют элементы отделки салона. Также используют в авиастроении, промышленности и других областях. Полосы обладают водо- и паронепроницаемостью. Не токсичны, можно использовать в сложных климатических условиях. В электротехнике из полос делают экранирующие и токопроводящие изделия.
Без использования алюминия невозможно было бы создать современных сооружений, мощных и легких машин, сверхбыстрых ракет и самолетов, а также предметов быта.
Назад в блог статей
Химические свойства алюминия и основные реакции
Нахождение в природе
Алюминий впервые получен химическим путем немецким химиком Ф. Велером в 1827 г., а в 1856 г. французский химик Сен-Клер Девиль выделил его электрохимическим методом.
Алюминий является самым распространенным в природе металлом. Содержание его в земной коре составляет 7,45% (по массе). Важнейшие природные соединения алюминия — алюмосиликаты, боксит, корунд и криолит.
Важнейшие природные соединения алюминия — алюмосиликаты, боксит, корунд и криолит.
Алюмосиликаты составляют основную массу земной коры. Продукт их выветривания — глина и полевые шпаты (ортоклаз, альбит, анортит). Основной состав глин (каолин) соответствует формуле Аl2O3•2SiO2•2Н2O.
Боксит — горная порода, из которой получают алюминий. Состоит главным образом из гидратов оксида алюминия Аl2O3•nН2O.
Физические свойства
Физические свойства алюминия хорошо изучены. Это — серебристо-белый легкий металл, плавящийся при 660°С. Он очень пластичен, легко вытягивается в проволоку и раскатывается в листы. Из алюминия можно изготовить фольгу толщиной менее 0,01мм. Алюминий обладает очень большой тепло- и электропроводностью. Сплавы алюминия с различными металлами обладают большой прочностью и легкостью.Химические свойства
Алюминий очень активный металл. В ряду напряжений он стоит после щелочных и щелочноземельных металлов. Однако на воздухе он довольно устойчив, так как его поверхность покрывается очень плотной пленкой оксида, предохраняющей его от дальнейшего контакта с воздухом. Если с алюминиевой проволоки снять защитную оксидную пленку, то алюминий начнет энергично взаимодействовать с кислородом и водяными парами воздуха, превращаясь в рыхлую массу гидроксида алюминия. Эта реакция сопровождается выделением тепла. Очищенный от защитной оксидной пленки алюминий взаимодействует с водой с выделением водорода:
Однако на воздухе он довольно устойчив, так как его поверхность покрывается очень плотной пленкой оксида, предохраняющей его от дальнейшего контакта с воздухом. Если с алюминиевой проволоки снять защитную оксидную пленку, то алюминий начнет энергично взаимодействовать с кислородом и водяными парами воздуха, превращаясь в рыхлую массу гидроксида алюминия. Эта реакция сопровождается выделением тепла. Очищенный от защитной оксидной пленки алюминий взаимодействует с водой с выделением водорода:
2Аl + 6Н2O = 2Аl(OН)3 + 3H2↑
Алюминий хорошо растворим в разбавленных серной и соляной кислотах:
2Al + 6НС1= 2AlС13 + 3H2↑
2AI + 3H2SO4 = Al2(SO4)3 + 3H2↑
Разбавленная азотная кислота на холоду пассивирует алюминий, но при нагревании алюминий растворяется в ней с выделением монооксида азота, гемиоксида азота, свободного азота или аммиака, например:
8Al + 30HNO3 = 8Al(NO3)3 + 3N2O + 15Н2O
Концентрированная азотная кислота пассивирует алюминий.
Так как оксид и гидроксид алюминия обладают амфотерными свойствами, то алюминий легко растворяется в водных растворах всех щелочей, кроме гидроксида аммония:
2AI + 6NaOH + 6Н2O = 2Na3[A1ОН)6] + 3H2↑
Порошкообразный алюминий легко взаимодействует с галогенами, кислородом и всеми неметаллами. Для начала реакций необходимо нагревание. В дальнейшем реакции протекают очень интенсивно и сопровождаются выделением большого количества тепла:
2Al + 3Вr2 — 2AlBr3 (бромид алюминия)
4Al + 3O2 = 2Al2O3 (оксид алюминия)
2Al + 3S = A12S3 (сульфид алюминия)
2Al + N2 = 2A1N (нитрид алюминия)
4Al + ЗС = Al4С3 (карбид алюминия).
Сульфид алюминия может существовать только в твердом виде. В водных растворах он подвергается полному гидролизу с образованием гидроксида алюминия и сероводорода:
A12S3 + 6H2O = 2A1(OН)3 + 3H2S.
Алюминий легко отнимает кислород и галогены у оксидов и солей других металлов. Реакция сопровождается выделением большого количества тепла:
8Al + 3Fe3O4 = 9Fe + 4Al2O3
Процесс восстановления металлов из их оксидов алюминием называется алюмотермией. Алюмотермией пользуются при получении некоторых редких металлов, которые образуют прочную связь с кислородом (ниобий, тантал, молибден, вольфрам и др.).
Смесь мелкого порошка алюминия и магнитного железняка называется термитом. После поджигания термита с помощью специального запала реакция протекает самопроизвольно и температура смеси повышается до 3500°С. Железо при такой температуре находится в расплавленном состоянии. Эту реакцию используют для сваривания рельсов.
Получение
Впервые алюминий был получен восстановлением хлорида алюминия металлическим натрием:
AlС13 + 3Na = Al + 3NaCl
В настоящее время его получают электролизом расплавленных солей. В качестве электролита служит расплав, содержащий 85— 90% комплексной соли 3NaF • A1F3 (или Na3AlFe) — криолита и 10–15% оксида алюминия Al2O3 — глинозема. Такая смесь плавится при температуре около 1000°С. При растворении в расплавленном криолите глинозем ведет себя как соль алюминия и алюминиевой кислоты и диссоциирует на катионы алюминия и анионы кислотного остатка алюминиевой кислоты:
В качестве электролита служит расплав, содержащий 85— 90% комплексной соли 3NaF • A1F3 (или Na3AlFe) — криолита и 10–15% оксида алюминия Al2O3 — глинозема. Такая смесь плавится при температуре около 1000°С. При растворении в расплавленном криолите глинозем ведет себя как соль алюминия и алюминиевой кислоты и диссоциирует на катионы алюминия и анионы кислотного остатка алюминиевой кислоты:
Al2O3 ⇔ Al3+ + АlO33−
Криолит диссоциирует:
Na3 [AlF6]⇔ 3Na+ + [A1F6]
При пропускании электрического тока катионы алюминия и натрия движутся к катоду — графитовому корпусу ванны, покрытому на дне слоем расплавленного алюминия, получаемого в процессе электролиза. Так как алюминий менее активен, чем натрий, то он восстанавливается в первую очередь. Восстановленный алюминий в расплавленном состоянии собирается на дне ванны, откуда его периодически выводят.
Анионы AlO33− и A1F63− движутся к аноду — графитовым стержням или болванкам. На аноде в первую очередь разряжается анион AlO33−:
AlO33− — 12е = 2Al2O3 + 3O2
Оксид алюминия вновь диссоциирует, и процесс повторяется. Расход глинозема все время восполняется. Количество криолита практически не меняется. Незначительные потери криолита происходят вследствие образования на аноде тетрафторида углерода CF4 . Электролитическое производство алюминия требует больших затрат электроэнергии (на получение 1 т алюминия расходуется около 20 тыс. квт • ч электроэнергии), поэтому алюминиевые заводы строят вблизи электростанций.
Применение
Алюминий находит самое широкое применение. Он используется в электротехнике, его сплавы, отличаясь большой легкостью и прочностью, применяются в самолето- и машиностроении, он все больше вытесняет стали в производстве теплообменных аппаратов, из него изготовляют фольгу, применяемую в радиотехнике и для упаковки пищевых продуктов. Алюминием покрывают стальные и чугунные изделия в целях предохранения их от коррозии: изделия нагревают до 1000° С в смеси алюминиевого порошка (49%), оксида алюминия (49%) и хлорида аммония (2%). Этот процесс называется алитированием. Алитированные изделия выдерживают нагревание°С, не подвергаясь коррозии.
Алюминием покрывают стальные и чугунные изделия в целях предохранения их от коррозии: изделия нагревают до 1000° С в смеси алюминиевого порошка (49%), оксида алюминия (49%) и хлорида аммония (2%). Этот процесс называется алитированием. Алитированные изделия выдерживают нагревание°С, не подвергаясь коррозии.
Оксид алюминия Al
2O3 Представляет собой белое вещество, обладающее высокой температурой плавления (2050°С). В природе оксид алюминия встречается в виде корунда и глинозема. Иногда встречаются прозрачные кристаллы корунда красивой формы и окраски. Корунд, окрашенный соединениями хрома в красный цвет, называют рубином, а окрашенный соединениями титана и железа в синий цвет — сапфиром. Рубин и сапфир являются драгоценными
камнями. В настоящее время их довольно легко получают искусственно.
Оксид алюминия обладает амфотерными свойствами, но он не растворяется в воде, кислотах и щелочах. При кипячении оксида алюминия в концентрированном растворе щелочи он частично переходит в раствор. Оксид алюминия переводят в растворимое состояние сплавлением со щелочами или с пиросульфатом калия:
Оксид алюминия переводят в растворимое состояние сплавлением со щелочами или с пиросульфатом калия:
Al2O3 + 2NaOH = 2NaA1O2 + Н2O
Al2O3 + 3K2S2O7 = Al2(SO4)3 + 3K2SO4.
Полученные сплавы растворяются в воде. При сплавлении оксида алюминия с поташом или содой образуются алюминаты, которые легко растворяются в воде:
Al2O3 + Na2CO3 = 2NaA1O2 + CO2,
Природный корунд — очень твердое вещество. Он применяется для изготовления наждачных кругов и шлифовальных порошков. Рубин используют для изготовления втулок часовых и других точных механизмов.
Глинозем используется как сырье для получения алюминия. Обезвоженный оксид алюминия применяется как адсорбент при очистке и разделении органических веществ методом хроматографии.
Гидроксид алюминия Al (ОН)
3Представляет собой белое вещество, которое при нагревании теряет воду, превращаясь оксид алюминия.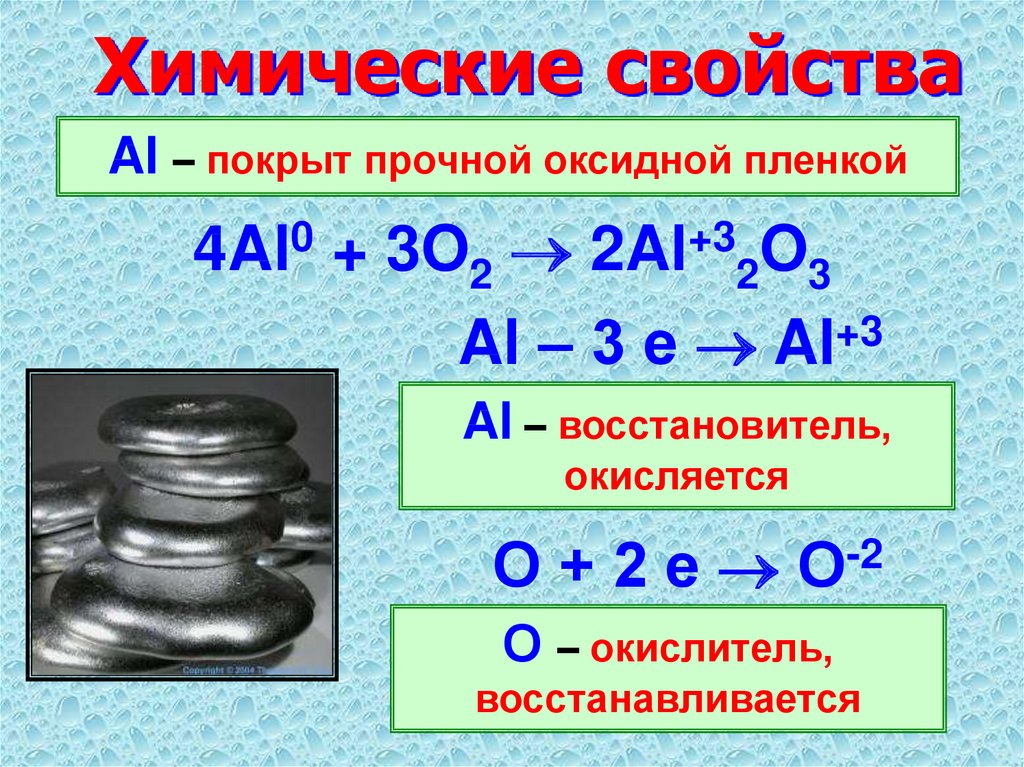 Гидроксид алюминия обладает амфотерными свойствами. Свежеосажденный гидроксид легко растворяется в кислотах и щелочах (кроме гидроксида аммония):
Гидроксид алюминия обладает амфотерными свойствами. Свежеосажденный гидроксид легко растворяется в кислотах и щелочах (кроме гидроксида аммония):
Al(ОН)3 + ЗНС1 = AlС13 + ЗН2O
Al(ОН)3 + 3NaOH= Na3 [Al(OH)6].
Гидроксид алюминия является слабым основанием и еще более слабой кислотой, поэтому соли алюминия находятся в растворе только в присутствии избытка кислоты, а алюминаты — только в присутствии избытка щелочи. При разбавлении растворов водой эти соединения сильно гидролизуют.
Высушенный гидроксид алюминия теряет часть воды, не растворяется ни в кислотах, ни в щелочах и этим напоминает оксид алюминия.
Гидроксид алюминия обладает свойством поглощать различные вещества, поэтому его применяют при очистке воды.
Физические и химические свойства алюминия 丨CHAL
Часы
Алюминий — мягкий и легкий металл. Поскольку он подвергается воздействию воздуха для быстрого образования тонкого слоя оксидного слоя, он имеет матово-серебристый вид. Алюминий не токсичен (как металл), не магнитится и не образует искр.
Поскольку он подвергается воздействию воздуха для быстрого образования тонкого слоя оксидного слоя, он имеет матово-серебристый вид. Алюминий не токсичен (как металл), не магнитится и не образует искр.
Алюминий используется во многих отраслях промышленности для производства миллионов различных продуктов и играет очень важную роль в мировой экономике. Благодаря использованию различных комбинаций своих доминирующих характеристик, таких как прочность, легкий вес, коррозионная стойкость, восстанавливаемость и формуемость, алюминий используется все чаще. Ассортимент продукции варьируется от конструкционных материалов до тонкой упаковочной пленки. Подробнее о применении алюминия вы можете просмотреть в этой статье: Чего вы не знаете об алюминиевой трубке
Физические свойства алюминия Каковы физические свойства алюминия? Физические свойства обычно являются характеристиками, которые можно наблюдать с помощью органов чувств, таких как цвет, плотность, твердость, коррозионная стойкость, теплопроводность, проводимость и т. д. Физические свойства алюминия следующие:
д. Физические свойства алюминия следующие:
| Свойства | Описание |
| Цвет | Алюминий представляет собой серебристо-белый металл без запаха. |
| Плотность | Плотность алюминия составляет около одной трети плотности стали или меди, что делает его одним из самых легких коммерческих металлов. |
| Прочность | Прочность на растяжение чистого алюминия невысокая. Однако легирующие элементы, такие как марганец, кремний, медь и магний, могут повысить прочность алюминия и получить сплав со свойствами, подходящими для конкретного применения. Алюминий очень подходит для холодных условий. По сравнению со сталью его преимущество заключается в том, что его прочность на растяжение увеличивается с понижением температуры при сохранении его ударной вязкости. С другой стороны, сталь становится хрупкой при низких температурах. |
| Коррозионная стойкость | При контакте с воздухом поверхность алюминия почти сразу покрывается оксидом алюминия. Этот слой обладает отличной коррозионной стойкостью. Обладает значительной устойчивостью к большинству кислот, но устойчивость к основаниям низкая. Этот слой обладает отличной коррозионной стойкостью. Обладает значительной устойчивостью к большинству кислот, но устойчивость к основаниям низкая. |
| Теплопроводность | Теплопроводность алюминия примерно в три раза выше, чем у стали. Это приводит к тому, что алюминий становится важным материалом для систем охлаждения и обогрева (например, для теплообменников). В сочетании с его нетоксичностью эта особенность означает, что алюминий широко используется в кухонной посуде и кухонной утвари. |
| Электропроводность | Алюминий имеет достаточно высокую электропроводность и может использоваться в качестве электрических проводников. |
| Отражательная способность | От УФ до инфракрасного излучения алюминий является отличным отражателем энергии излучения. Те же самые характеристики отражения делают алюминий теплоизоляционным материалом, который предотвращает солнечный свет летом и предотвращает потери тепла зимой. |
Химические свойства относятся к тому, что вещество вступает в реакцию с другими веществами или изменяется от одного вещества к другому. В общем, химические свойства можно наблюдать только во время химической реакции. Реакция вещества может быть вызвана изменениями, вызванными горением, ржавчиной, нагревом, взрывом, обесцвечиванием и т.п. Ниже приведены химические свойства алюминия:
В общем, химические свойства можно наблюдать только во время химической реакции. Реакция вещества может быть вызвана изменениями, вызванными горением, ржавчиной, нагревом, взрывом, обесцвечиванием и т.п. Ниже приведены химические свойства алюминия:
| Свойства | Описание |
| Окисление | Как правило, алюминиевые металлы не реагируют на эрозию воздуха, поскольку воздух покрывает их металл тонким слоем оксидов. Однако, если оксидный слой поврежден и оголен металлический алюминий, он снова вступит в реакцию с образованием амфотерного оксида. |
| Реакция с кислотой | Алюминий легко реагирует с неорганической кислотой с образованием раствора, содержащего гидратированные ионы алюминия, при этом выделяется водород. В случае реакции с азотной кислотой он пассивно реагирует, образуя защитный оксидный слой на поверхности оксида алюминия |
| Реакция со щелочью | Алюминий реагирует с основанием с образованием алюмината с выделением водорода. |
| Реакция с водой | Реакция с горячей водой. |
| Соединение | Смеси алюминия, кислорода и других элементов производят алюминиевые рудники, алюминиевый рудник является основным источником алюминия. |
| Сплав | В сочетании с такими элементами, как медь, кремний или магний, образует сплавы с высокой прочностью. |
Благодаря физическим и химическим свойствам алюминия его можно смешивать с другими металлами в алюминиевых сплавах, которые используются в различных алюминиевых сплавах. Алюминиевый сплав имеет характеристики, отличные от характеристик одного металла, и алюминиевый сплав классифицируется в соответствии с другими содержащимися элементами. Ниже приводится серия алюминиевого сплава и его основное использование:
| Серия | Элемент из сплава | Применение | |
| 18 09xxx | 18 09xxx | Отделка, химическое оборудование, теплоотражатель | |
| 2xxx | Медь | Панель грузовика , детали самолетов | |
| 3xxx | Марганец | Посуда, дорожный знак, холодильник | |
| 4xxx | Кремний | Корабль, мостик | |
| 5xxx | Магний | Топливный бак самолета | |
| 6xxx | Магний + кремний | -9002 Разъем для оружия низкого давления-9002 033||
| 7xxx | Цинк | Конструкция самолета | |
| 8xxx | Другие элементы представляют собой элементы из основных сплавов | Алюминиевая фольга, радиатор |
Алюминий не потеряет своих характеристик после сильной деформации. Благодаря этому из алюминия можно изготавливать различные формы алюминиевых изделий путем прокатки, экструзии, волочения, механической обработки и других механических процессов, таких как алюминиевые трубы, алюминиевые пластины, алюминиевые пластины, алюминиевая фольга и т.п. Легирование, холодная обработка и термическая обработка могут использоваться для настройки характеристик алюминия. Посмотреть Технологии обработки алюминиевых сплавов
Благодаря этому из алюминия можно изготавливать различные формы алюминиевых изделий путем прокатки, экструзии, волочения, механической обработки и других механических процессов, таких как алюминиевые трубы, алюминиевые пластины, алюминиевые пластины, алюминиевая фольга и т.п. Легирование, холодная обработка и термическая обработка могут использоваться для настройки характеристик алюминия. Посмотреть Технологии обработки алюминиевых сплавов
CHAL Aluminium Corporation специализируется на производстве и исследованиях композитных материалов из алюминия и алюминиевых сплавов, высокоточных алюминиевых труб, полос, фольги и пайки алюминиевых сплавов. Мы искренне приветствуем вас связаться с нами для любого делового сотрудничества! Мы более чем рады тесно сотрудничать с друзьями дома и за рубежом, чтобы создать лучшее будущее.
Похожие статьиАлюминий | Использование, свойства и соединения
алюминий
Посмотреть все СМИ
- Ключевые люди:
- Ганс Кристиан Эрстед Эмиль Ратенау Фридрих Вёлер Чарльз Мартин Холл
- Похожие темы:
- химический элемент обработка алюминия элемент группы бора
Просмотреть весь связанный контент →
алюминий (Al) , также пишется как алюминий , химический элемент, легкий серебристо-белый металл основной группы 13 (IIIa, или группа бора) периодической таблицы.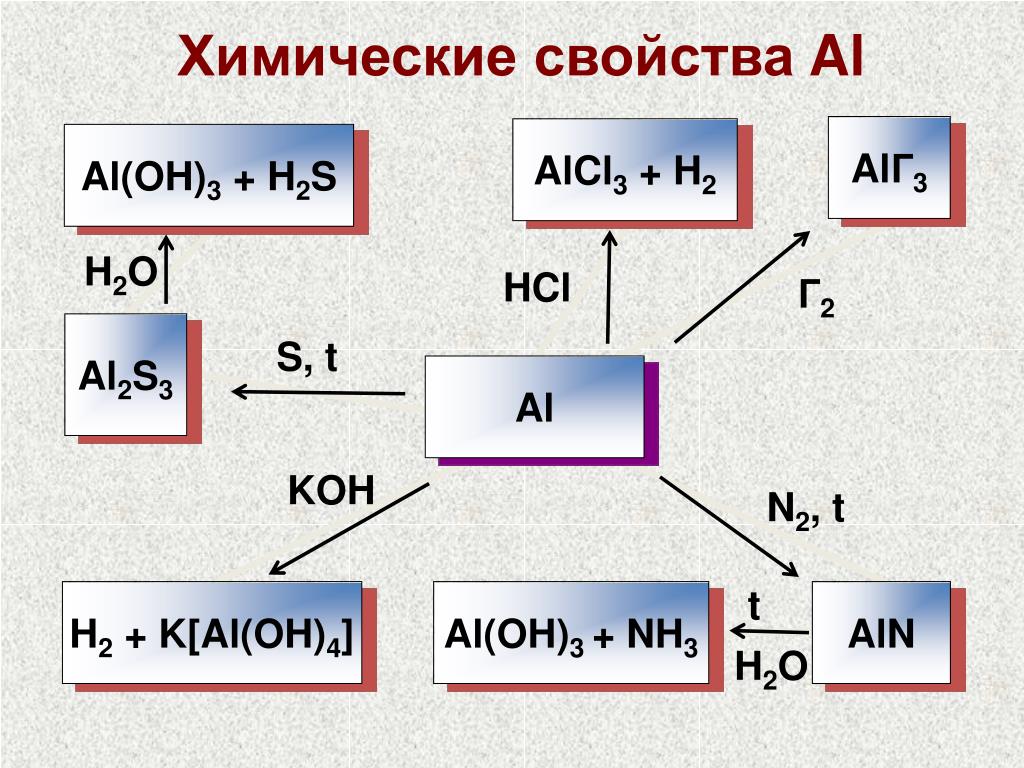 Алюминий является самым распространенным металлическим элементом в земной коре и наиболее широко используемым цветным металлом. В силу своей химической активности А. никогда не встречается в природе в металлическом виде, но его соединения в большей или меньшей степени присутствуют почти во всех горных породах, растительности и животных. Алюминий сосредоточен во внешних 16 км (10 милях) земной коры, из которых он составляет около 8 процентов по весу; его превосходят по количеству только кислород и кремний. Название алюминия происходит от латинского слова 9.0012 квасцы , используется для описания калиевых квасцов или сульфата алюминия-калия, KAl(SO 4 ) 2 ∙12H 2 O. 5
Алюминий является самым распространенным металлическим элементом в земной коре и наиболее широко используемым цветным металлом. В силу своей химической активности А. никогда не встречается в природе в металлическом виде, но его соединения в большей или меньшей степени присутствуют почти во всех горных породах, растительности и животных. Алюминий сосредоточен во внешних 16 км (10 милях) земной коры, из которых он составляет около 8 процентов по весу; его превосходят по количеству только кислород и кремний. Название алюминия происходит от латинского слова 9.0012 квасцы , используется для описания калиевых квасцов или сульфата алюминия-калия, KAl(SO 4 ) 2 ∙12H 2 O. 5
7 2 () 028
Возникновение и история
Алюминий встречается в виде алюмосиликатов в изверженных породах фельдшпатоиды и слюды; в полученной из них почве в виде глины; и при дальнейшем выветривании в виде бокситов и богатых железом латеритов. Бокситы, смесь гидратированных оксидов алюминия, являются основной алюминиевой рудой. Кристаллический оксид алюминия (наждак, корунд), встречающийся в некоторых магматических породах, добывается как природный абразив или в виде его более тонких разновидностей, таких как рубины и сапфиры. Алюминий присутствует в других драгоценных камнях, таких как топаз, гранат и хризоберилл. Из многих других алюминиевых минералов алунит и криолит имеют некоторое коммерческое значение.
Бокситы, смесь гидратированных оксидов алюминия, являются основной алюминиевой рудой. Кристаллический оксид алюминия (наждак, корунд), встречающийся в некоторых магматических породах, добывается как природный абразив или в виде его более тонких разновидностей, таких как рубины и сапфиры. Алюминий присутствует в других драгоценных камнях, таких как топаз, гранат и хризоберилл. Из многих других алюминиевых минералов алунит и криолит имеют некоторое коммерческое значение.
Викторина “Британника”
Викторина “118 названий и символов периодической таблицы”
До 5000 г. до н.э. люди в Месопотамии делали прекрасную керамику из глины, которая состояла в основном из соединения алюминия, а почти 4000 лет назад египтяне и вавилоняне использовали соединения алюминия в различных химических веществах и лекарствах. Плиний ссылается на квасцы, теперь известные как квасцы, соединение алюминия, широко используемое в древнем и средневековом мире для закрепления красителей в текстиле. Во второй половине 18 века такие химики, как Антуан Лавуазье, признали глинозем потенциальным источником металла.
Во второй половине 18 века такие химики, как Антуан Лавуазье, признали глинозем потенциальным источником металла.
Сырой алюминий был выделен (1825 г.) датским физиком Гансом Христианом Эрстедом путем восстановления хлорида алюминия амальгамой калия. Британский химик сэр Хамфри Дэви приготовил (1809 г.) железо-алюминиевый сплав путем электролиза плавленого оксида алюминия (оксида алюминия) и уже назвал этот элемент алюминием; слово позже было изменено на алюминий в Англии и некоторых других европейских странах. Немецкий химик Фридрих Велер, используя металлический калий в качестве восстановителя, получил алюминиевый порошок (1827 г.) и небольшие глобулы металла (1845 г.), по которым он смог определить некоторые его свойства.
Новый металл был представлен публике (1855 г.) на Парижской выставке примерно в то же время, когда он стал доступен (в небольших количествах за большие деньги) путем восстановления натрием расплавленного хлорида алюминия в процессе Девиля. Когда электроэнергия стала относительно обильной и дешевой, почти одновременно Шарль Мартин Холл в Соединенных Штатах и Поль-Луи-Туссен Эру во Франции открыли (1886 г. ) современный метод промышленного производства алюминия: электролиз очищенного оксида алюминия (Al 9).0281 2 O 3 ), растворенных в расплавленном криолите (Na 3 AlF 6 ). В 1960-е годы алюминий вышел на первое место, опередив медь, в мировом производстве цветных металлов. Для получения более подробной информации о добыче, переработке и производстве алюминия, см. обработка алюминия.
) современный метод промышленного производства алюминия: электролиз очищенного оксида алюминия (Al 9).0281 2 O 3 ), растворенных в расплавленном криолите (Na 3 AlF 6 ). В 1960-е годы алюминий вышел на первое место, опередив медь, в мировом производстве цветных металлов. Для получения более подробной информации о добыче, переработке и производстве алюминия, см. обработка алюминия.
Применение и свойства
Алюминий добавляют в небольших количествах к некоторым металлам для улучшения их свойств для конкретных целей, например, в алюминиевых бронзах и большинстве сплавов на основе магния; или, для сплавов на основе алюминия, к алюминию добавляются умеренные количества других металлов и кремния. Металл и его сплавы широко используются в авиастроении, строительных материалах, потребительских товарах длительного пользования (холодильники, кондиционеры, кухонная утварь), электрических проводниках, химическом и пищевом оборудовании.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Чистый алюминий (99,996%) довольно мягкий и непрочный; технический алюминий (чистота от 99 до 99,6%) с небольшими количествами кремния и железа отличается твердостью и прочностью. Ковкий и очень податливый алюминий можно вытягивать в проволоку или сворачивать в тонкую фольгу. Плотность металла составляет всего около одной трети плотности железа или меди. Несмотря на свою химическую активность, алюминий обладает высокой коррозионной стойкостью, так как на воздухе на его поверхности образуется прочная оксидная пленка.
Алюминий является отличным проводником тепла и электричества. Его теплопроводность примерно вдвое меньше, чем у меди; его электропроводность, около двух третей. Он кристаллизуется в гранецентрированной кубической структуре. Весь природный алюминий представляет собой стабильный изотоп алюминия-27. Металлический алюминий, его оксид и гидроксид нетоксичны.
Алюминий медленно подвергается воздействию большинства разбавленных кислот и быстро растворяется в концентрированной соляной кислоте. Однако концентрированную азотную кислоту можно перевозить в алюминиевых цистернах, поскольку она делает металл пассивным. Даже очень чистый алюминий подвергается энергичному воздействию щелочей, таких как гидроксид натрия и калия, с образованием водорода и иона алюмината. Из-за большого сродства к кислороду мелкодисперсный алюминий при возгорании сгорает в монооксиде или диоксиде углерода с образованием оксида и карбида алюминия, но при температурах до красного каления алюминий инертен к сере.
Алюминий может быть обнаружен в концентрациях до одной части на миллион с помощью эмиссионной спектроскопии. Алюминий может быть количественно проанализирован как оксид (формула Al 2 O 3 ) или как производное азоторганического соединения 8-гидроксихинолина. Производное имеет молекулярную формулу Al(C 9 H 6 ON) 3 .
Соединения
Обычно алюминий является трехвалентным. Однако при повышенных температурах было получено несколько газообразных одновалентных и двухвалентных соединений (AlCl, Al 2 O, AlO). В алюминии конфигурация трех внешних электронов такова, что в некоторых соединениях (например, в кристаллическом фториде алюминия [AlF 3 ] и хлориде алюминия [AlCl 3 ]) голый ион Al 3+ образован потеря этих электронов, как известно, происходит. Однако энергия, необходимая для образования иона Al 3+ , очень велика, и в большинстве случаев атому алюминия энергетически выгоднее образовывать ковалентные соединения путем sp 2 гибридизация, как это делает бор. Ион Al 3+ может быть стабилизирован гидратацией, а октаэдрический ион [Al(H 2 O) 6 ] 3+ встречается как в водном растворе, так и в некоторых солях.
Ряд соединений алюминия имеет важное промышленное применение. Глинозем, встречающийся в природе в виде корунда, также производится в промышленных масштабах в больших количествах для использования в производстве металлического алюминия, а также в производстве изоляторов, свечей зажигания и различных других изделий. При нагревании оксид алюминия образует пористую структуру, которая позволяет ему поглощать водяной пар. Эта форма оксида алюминия, известная как активированный оксид алюминия, используется для сушки газов и некоторых жидкостей. Он также служит носителем для катализаторов различных химических реакций.
Глинозем, встречающийся в природе в виде корунда, также производится в промышленных масштабах в больших количествах для использования в производстве металлического алюминия, а также в производстве изоляторов, свечей зажигания и различных других изделий. При нагревании оксид алюминия образует пористую структуру, которая позволяет ему поглощать водяной пар. Эта форма оксида алюминия, известная как активированный оксид алюминия, используется для сушки газов и некоторых жидкостей. Он также служит носителем для катализаторов различных химических реакций.
Анодный оксид алюминия (ААО), обычно получаемый путем электрохимического окисления алюминия, представляет собой наноструктурированный материал на основе алюминия с очень уникальной структурой. AAO содержит цилиндрические поры, которые можно использовать для различных целей. Это термически и механически стабильное соединение, а также оптически прозрачное и электрическое изолятор. Размер пор и толщину AAO можно легко адаптировать для определенных приложений, в том числе в качестве шаблона для синтеза материалов в нанотрубки и наностержни.
Другим важным соединением является сульфат алюминия, бесцветная соль, полученная действием серной кислоты на гидратированный оксид алюминия. Коммерческая форма представляет собой гидратированное кристаллическое твердое вещество с химической формулой Al 2 (SO 4 ) 3 . Он широко используется в производстве бумаги в качестве связующего для красителей и в качестве поверхностного наполнителя. Сульфат алюминия соединяется с сульфатами одновалентных металлов с образованием гидратированных двойных сульфатов, называемых квасцами. Квасцы, двойные соли формулы MAl(SO 4 ) 2 · 12H 2 O (где M представляет собой однозарядный катион, такой как K + ), также содержат ион Al 3+ ; М может быть катионом натрия, калия, рубидия, цезия, аммония или таллия, а алюминий может быть заменен множеством других ионов М 3+ , например галлия, индия, титана, ванадия, хрома, марганца. , железо или кобальт. Наиболее важной из таких солей является сульфат алюминия-калия, также известный как квасцы калия или квасцы калия. Эти квасцы имеют множество применений, особенно в производстве лекарств, текстиля и красок.
Наиболее важной из таких солей является сульфат алюминия-калия, также известный как квасцы калия или квасцы калия. Эти квасцы имеют множество применений, особенно в производстве лекарств, текстиля и красок.
Реакция газообразного хлора с расплавленным металлическим алюминием дает хлорид алюминия; последний является наиболее часто используемым катализатором в реакциях Фриделя-Крафтса, т. Е. Синтетических органических реакциях, связанных с получением самых разных соединений, включая ароматические кетоны, антрохинон и его производные. Гидратированный хлорид алюминия, широко известный как хлоргидрат алюминия, AlCl 3 ∙H 2 O, используется в качестве местного антиперспиранта или дезодоранта для тела, который сужает поры. Это одна из нескольких солей алюминия, используемых в косметической промышленности.
Гидроксид алюминия, Al(OH) 3 , используется для водонепроницаемости тканей и для производства ряда других соединений алюминия, включая соли, называемые алюминатами, которые содержат группу AlO − 2 .


 Подвергается закалке и старению, часто плакируется алюминием. Является конструкционным материалом для авиационного и транспортного машиностроения.
Подвергается закалке и старению, часто плакируется алюминием. Является конструкционным материалом для авиационного и транспортного машиностроения.