Химические свойства алюминий: Химические свойства алюминия, его применение
alexxlab | 17.02.1986 | 0 | Разное
Алюминий, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Алюминий | Химические свойства
Алюминий
Химически алюминий – довольно активный металл. На воздухе его поверхность мгновенно покрывается плотной пленкой оксида Al2О3, которая препятствует дальнейшему доступу кислорода к металлу и приводит к прекращению реакции, что обусловливает высокие антикоррозионные свойства алюминия. Защитная поверхностная пленка на алюминии образуется также, если его поместить в концентрированную азотную кислоту.
Характерная степень окисления алюминия +3, но благодаря наличию незаполненных 3р- и 3d-орбиталей атомы алюминия могут образовывать дополнительные донорно-акцепторные связи. Поэтому ион Al3+ с небольшим радиусом весьма склонен к комплексообразованию, образуя разнообразные катионные и анионные комплексы: AlCl4–, AlF63-, [Al(H2O)6]3+, Al(OH)4–, Al(OH)63-, AlH4– и многие другие. Известны комплексы и с органическими соединениями.
Известны комплексы и с органическими соединениями.
Химическая активность алюминия весьма высока; в ряду электродных потенциалов он стоит сразу за магнием. На первый взгляд такое утверждение может показаться странным: ведь алюминиевая кастрюля или ложка вполне устойчивы на воздухе, не разрушаются и в кипящей воде. Алюминий, в отличие от железа, не ржавеет. Оказывается, на воздухе металл покрывается бесцветной тонкой, но прочной из оксида, которая защищает металл от окисления. Так, если внести в пламя горелки толстую алюминиевую проволоку или пластинку толщиной 0,5-1 мм, то металл плавится, но алюминий не течет, так как остается в мешочке из его оксида. Если лишить алюминий защитной пленки или сделать ее рыхлой (например, погружением в раствор ртутных солей), алюминий тут же проявит свою истинную сущность: уже при комнатной температуре начнет энергично реагировать с водой с выделением водорода: 2Al + 6H2O -> 2Al(OH)3 + 3H2. На воздухе лишенный защитной пленки алюминий прямо на глазах превращается в рыхлый порошок оксида: 2Al + 3O2 -> 2Al2O3. Особенно активен алюминий в мелкораздробленном состоянии; алюминиевая пыль при вдувании в пламя моментально сгорает. Если смешать на керамической пластинке алюминиевую пыль с пероксидом натрия и капнуть на смесь водой, алюминий также вспыхивает и сгорает белым пламенем.
Особенно активен алюминий в мелкораздробленном состоянии; алюминиевая пыль при вдувании в пламя моментально сгорает. Если смешать на керамической пластинке алюминиевую пыль с пероксидом натрия и капнуть на смесь водой, алюминий также вспыхивает и сгорает белым пламенем.
Очень высокое сродство алюминия к кислороду позволяет ему отнимать кислород от оксидов ряда других металлов, восстанавливая их (метод алюминотермии). Самый известный пример – термитная смесь, при горении которой выделяется так много тепла, что полученное железо расплавляется: 8Al + 3Fe3O4 -> 4Al2O3 + 9Fe. Эта реакция была открыта в 1856 Н.Н.Бекетовым. Таким способом можно восстановить до металлов Fe2O3, CoO, NiO, MoO3, V2O5, SnO2, CuO, ряд других оксидов. При восстановлении же алюминием Cr2O3, Nb2O5, Ta2O5, SiO2, TiO2, ZrO2, B2O3 теплоты реакции недостаточно для нагрева продуктов реакции выше их температуры плавления.
Алюминий легко растворяется в разбавленных минеральных кислотах с образованием солей. Концентрированная азотная кислота, окисляя поверхность алюминия, способствует утолщению и упрочнению оксидной пленки (так называемая пассивация металла). Обработанный таким образом алюминий не реагирует даже с соляной кислотой. С помощью электрохимического анодного окисления (анодирования) на поверхности алюминия можно создать толстую пленку, которую нетрудно окрасить в разные цвета.
Вытеснение алюминием из растворов солей менее активных металлов часто затруднено защитной пленкой на поверхности алюминия. Эта пленка быстро разрушается хлоридом меди, поэтому легко идет реакция 3CuCl2 + 2Al -> 2AlCl3 + 3Cu, которая сопровождается сильным разогревом. В крепких растворах щелочей алюминий легко растворяется с выделением водорода: 2Al + 6NaOH + 6Н2О -> 2Na3[Al(OH)6] + 3H2 (образуются и другие анионные гидроксо-комплексы). Амфотерный характер соединений алюминия проявляется также в легком растворении в щелочах его свежеосажденного оксида и гидроксида. Кристаллический оксид (корунд) весьма устойчив к действию кислот и щелочей. При сплавлении со щелочами образуются безводные алюминаты: Al2O3 + 2NaOH -> 2NaAlO2 + H2O. Алюминат магния Mg(AlO2)2 – полудрагоценный камень шпинель, обычно окрашенный примесями в самые разнообразные цвета.
Кристаллический оксид (корунд) весьма устойчив к действию кислот и щелочей. При сплавлении со щелочами образуются безводные алюминаты: Al2O3 + 2NaOH -> 2NaAlO2 + H2O. Алюминат магния Mg(AlO2)2 – полудрагоценный камень шпинель, обычно окрашенный примесями в самые разнообразные цвета.
Бурно протекает реакция алюминия с галогенами. Если в пробирку с 1 мл брома внести тонкую алюминиевую проволоку, то через короткое время алюминий загорается и горит ярким пламенем. Реакция смеси порошков алюминия и иода инициируется каплей воды (вода с иодом образует кислоту, которая разрушает оксидную пленку), после чего появляется яркое пламя с клубами фиолетовых паров иода. Галогениды алюминия в водных растворах имеют кислую реакцию из-за гидролиза: AlCl3 + H2O -> Al(OH)Cl2 + HCl.
Реакция алюминия с азотом идет только выше 800° С с образованием нитрида AlN, с серой – при 200° С (образуется сульфид Al2S3), с фосфором – при 500° С (образуется фосфид AlP). При внесении в расплавленный алюминий бора образуются бориды состава AlB2 и AlB12 – тугоплавкие соединения, устойчивые к действию кислот. Гидрид (AlH)х (х = 1,2) образуется только в вакууме при низких температурах в реакции атомарного водорода с парами алюминия. Устойчивый в отсутствие влаги при комнатной температуре гидрид Alh4 получают в растворе безводного эфира: AlCl3 + LiH -> AlH3 + 3LiCl. При избытке LiH образуется солеобразный алюмогидрид лития LiAlH4 – очень сильный восстановитель, применяющийся в органических синтезах. Водой он мгновенно разлагается: LiAlH4 + 4H2O -> LiOH + Al(OH)3 + 4H2.
При внесении в расплавленный алюминий бора образуются бориды состава AlB2 и AlB12 – тугоплавкие соединения, устойчивые к действию кислот. Гидрид (AlH)х (х = 1,2) образуется только в вакууме при низких температурах в реакции атомарного водорода с парами алюминия. Устойчивый в отсутствие влаги при комнатной температуре гидрид Alh4 получают в растворе безводного эфира: AlCl3 + LiH -> AlH3 + 3LiCl. При избытке LiH образуется солеобразный алюмогидрид лития LiAlH4 – очень сильный восстановитель, применяющийся в органических синтезах. Водой он мгновенно разлагается: LiAlH4 + 4H2O -> LiOH + Al(OH)3 + 4H2.
Реакции алюминия
Химические свойства алюминия
Химические свойства алюминия определяются его положением в периодической системе химических элементов.
Ниже представлены основные химические реакции алюминия с другими химическими элементами. Эти реакции определяют основные химические свойства алюминия.
С чем реагирует алюминий
Простые вещества:
- галогены (фтор, хлор, бром и иодин)
- сера
- фосфор
- азот
- углерод
- кислород (горение)
Сложные вещества:
- вода
- минеральные кислоты (соляная, фосфорная)
- серная кислота
- азотная кислота
- щелочи
- окислители
- оксиды менее активных металлов (алюмотермия)
С чем не реагирует алюминий
Алюминий не реагирует:
- с водородом
- в обычных условиях – с концентрированной серной кислотой (из-за пассивации – образования плотной оксидной пленки)
- в обычных условиях – с концентрированной азотной кислотой (также из-за пассивации)
См. подробнее по химии алюминия
Алюминий и воздух
Обычно поверхность алюминия всегда покрыта тонким слоем оксида алюминия, который защищает ее от воздействия воздуха, точнее, кислорода. Поэтому считается, что алюминий не вступает в реакцию с воздухом. Если же этот оксидный слой повреждается или удаляется, то свежая поверхность алюминия реагирует с кислородом воздуха. Алюминий может гореть в кислороде ослепительно белым пламенем с образованием оксида алюминия Al2O3.
Если же этот оксидный слой повреждается или удаляется, то свежая поверхность алюминия реагирует с кислородом воздуха. Алюминий может гореть в кислороде ослепительно белым пламенем с образованием оксида алюминия Al2O3.
Реакция алюминия с кислородом:
- 4Al + 3O2 —> 2Al2O3
Алюминий и вода
Алюминий реагирует с водой по следующим реакциям [2]:
- 2Al + 6H2O = 2Al(OH)3 + 3H2 (1)
- 2Al + 4H2O = 2AlO(OH) + 3H2 (2)
- 2Al + 3H2O = Al2O3 + 3H2 (3)
В результате этих реакций образуются, соответственно, следующие соединения алюминия:
- модификация гидроксида алюминия байерит и водород (1)
- модификация гидроксида алюминия богемит и водород (2)
- оксид алюминия и водород (3)
Эти реакции, кстати, представляют большой интерес при разработке компактных установок для получения водорода для транспортных средств, которые работают на водороде [2].
Все эти реакции являются термодинамически возможными при температуре от комнатной до температуры плавления алюминия 660 ºС. Все они являются также экзотермическими, то есть происходят с выделением тепла [2]:
- При температуре от комнатной до 280 ºС наиболее устойчивым продуктом реакции является Al(OH)3.
- При температуре от 280 до 480 ºС наиболее устойчивым продуктом реакции является AlO(OH).
- При температуре выше 480 ºС наиболее устойчивым продуктом реакции является Al2O3.
Таким образом, оксид алюминия Al2O3 становится термодинамически более устойчивым, чем Al(OH)3 при повышенной температуре. Продуктом реакции алюминия с водой при комнатной температуре будет гидроксид алюминия Al(OH)3.
Реакция (1) показывает, что алюминий должен самопроизвольно реагировать с водой при комнатной температуре. Однако на практике кусок алюминия, опущенный в воду, не реагирует с водой в условиях комнатной температуры и даже в кипящей воде. Дело в том, что алюминий имеет на поверхности тонкий когерентный слой оксида алюминия Al2O3. Эта оксидная пленка прочно удерживается на поверхности алюминия и предотвращает его реакцию с водой. Поэтому, чтобы начать и поддерживать реакцию алюминия с водой при комнатной температуре необходимо постоянно удалять или разрушать этот оксидный слой [2].
Дело в том, что алюминий имеет на поверхности тонкий когерентный слой оксида алюминия Al2O3. Эта оксидная пленка прочно удерживается на поверхности алюминия и предотвращает его реакцию с водой. Поэтому, чтобы начать и поддерживать реакцию алюминия с водой при комнатной температуре необходимо постоянно удалять или разрушать этот оксидный слой [2].
Алюминий и галогены
Алюминий бурно реагирует со всем галогенами – это:
- фтор F
- хлор Cl
- бром Br и
- иодин (йод) I,
с образованием соответственно:
- фторида AlF3
- хлорида AlCl3
- бромида Al2Br6 и
- иодида Al2Br6.
Реакции водорода со фтором, хлором, бромом и иодином:
- 2Al + 3F2 → 2AlF3
- 2Al + 3Cl2 → 2AlCl3
- 2Al + 3Br2 → Al2Br6
- 2Al + 3l2 → Al2I6
Алюминий и кислоты
Алюминий активно вступает в реакцию с разбавленными кислотами: серной, соляной и азотной, с образованием соответствующих солей: сернокислого алюминия Al2SO4, хлорида алюминия AlCl3 и нитрата алюминия Al(NО3)3.
Реакции алюминия с разбавленными кислотами:
- 2Al + 3H2SO4 —> Al2(SO4)3 + 3H2
- 2Al + 6HCl —> 2AlCl3 + 3H2
- 2Al + 6HNO3 —> 2Al(NO3)3 + 3H2
С концентрированными серной и соляной кислотами при комнатной температуре не взаимодействует, при нагревании реагирует с образованием соли, окислов и воды.
Алюминий и щелочи
Алюминий в водном растворе щелочи – гидроксида натрия – реагирует с образованием алюмината натрия.
Реакция алюминия с гидроксидом натрия имеет вид:
- 2Al + 2NaOH + 10H2O —> 2Na[Al(H2O)2(OH)4] + 3H2
Все важнейшие реакции с алюминием
Для полноты информации приводим перечень основных реакций с участием алюминия из фундаментальной книги про алюминий [3]:
Важнейшие реакции с участием алюминия [3]
Источники:
1. Chemical Elements. The first 118 elements, ordered alphabetically / ed. Wikipedians – 2018
Chemical Elements. The first 118 elements, ordered alphabetically / ed. Wikipedians – 2018
2. Reaction of Aluminum with Water to Produce Hydrogen /John Petrovic and George Thomas, U.S. Department of Energy, 2008
3. Тринадцатый элемент: Энциклопедия / А. Дроздов – Библиотека РУСАЛа, 2007.
Алюминий, подготовка к ЕГЭ по химии
Алюминий является самым распространенным металлом в земной коре. Свойства алюминия позволяют активно применять в составе металлоконструкций: он легкий, мягкий, поддается штамповке, обладает высокой антикоррозийной устойчивостью.
Для алюминия характерна высокая химическая активность, отличается также высокой электро- и теплопроводностью.
При переходе атома алюминия в возбужденное состояние 2 электрона s-подуровня распариваются, и один электрон переходит на p-подуровень.
Алюминий получают путем электролиза расплава Al2O3 в криолите (Na3[AlF6]). Галлий, индий и
таллий получают схожим образом – методом электролиза их оксидов и солей.
Галлий, индий и
таллий получают схожим образом – методом электролиза их оксидов и солей.
При комнатной температуре реагирует с галогенами (кроме фтора) и кислородом, покрываясь при этом оксидной пленкой.
Al + O2 → Al2O3 (снаружи Al покрыт оксидной пленкой – Al2O3)
Al + Br2 → AlBr3 (бромид алюминия)
При нагревании алюминий вступает в реакции с фтором, серой, азотом и углеродом.
Al + F2 → (t) AlF3 (фторид алюминия)
Al + S → (t) Al2S3 (сульфид алюминия)
Al + N2 → (t) AlN (нитрид алюминия)
Al + C → (t) Al4C3 (карбид алюминия)
Алюминий проявляет амфотерные свойства (греч. ἀμφότεροι – двойственный), вступает в реакции как с кислотами, так и с основаниями.
ἀμφότεροι – двойственный), вступает в реакции как с кислотами, так и с основаниями.
Al + HCl → AlCl3 + H2
Al + H2SO4(разб.) → Al2(SO4)3 + H2↑
Al + H2SO4(конц.) → (t) Al2(SO4)3 + SO2↑ + H2O
Al + HNO3(разб.) → (t) Al(NO3)3 + N2O + H2O
Al + NaOH + H2O → Na[Al(OH)4] + H2↑ (тетрагидроксоалюминат натрия; поскольку алюминий дан в чистом виде – выделяется водород)
При прокаливании комплексные соли не образуются, так вода испаряется – вместо них образуются (в рамках ЕГЭ) средние соли – алюминаты (академически – сложные окиселы):
Na[Al(OH)4] → (t) NaAlO2 + H2O
При комнатной температуре не идет из-за образования оксидной пленки – Al2O3 – на воздухе. Если разрушить оксидную пленку
нагреванием раствора щелочи или амальгамированием (покрытием металла слоем ртути) – реакция идет.
Если разрушить оксидную пленку
нагреванием раствора щелочи или амальгамированием (покрытием металла слоем ртути) – реакция идет.
Al + H2O → (t) Al(OH)3 + H2↑
Алюминотермия (лат. Aluminium + греч. therme – тепло) – способ получения металлов и неметаллов, заключающийся в восстановлении их оксидов алюминием. Температуры при этом процессе могут достигать 2400°C.
С помощью алюминотермии получают Fe, Cr, Mn, Ca, Ti, V, W.
Fe2O3 + Al → (t) Al2O3 + Fe
Cr2O3 + Al → (t) Al2O3 + Cr
MnO2 + Al → (t) Al2O3 + Mn
Оксид алюминия
Оксид алюминия получают в ходе взаимодействия с кислородом – на воздухе алюминий покрывается оксидной пленкой. При нагревании гидроксид
алюминия, как нерастворимое основание, легко разлагается на оксид и воду.
При нагревании гидроксид
алюминия, как нерастворимое основание, легко разлагается на оксид и воду.
Al + O2 → Al2O3
Al(OH)3 → (t) Al2O3 + H2O↑
Проявляет амфотерные свойства: реагирует и с кислотами, и с основаниями.
Al2O3 + H2SO4 → Al2(SO4)3 + H2O
Al2O3 + NaOH + H2O → Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Al2O3 + NaOH → (t) NaAlO2 + H2O (алюминат натрия)
Al2O3 + Na2O → (t) NaAlO2
Гидроксид алюминия
Гидроксид алюминия получают в ходе реакций обмена между растворимыми солями алюминия и щелочами. В результате гидролиза солей алюминия
часто выпадает белый осадок – гидроксид алюминия.
В результате гидролиза солей алюминия
часто выпадает белый осадок – гидроксид алюминия.
AlBr3 + LiOH → Al(OH)3↓ + LiBr
Al(NO3)3 + K2CO3 → KNO3 + Al(OH)3↓ + CO2 (двойной гидролиз: Al(NO3)3 гидролизуется по катиону, K2CO3 – по аниону)
Al2S3 + H2O → Al(OH)3↓ + H2S↑
Проявляет амфотерные свойства. Реагирует и с кислотами, и с основаниями. Вследствие нерастворимости гидроксид алюминия не реагирует с солями.
Al(OH)3 + H2SO4 → Al2(SO4)3 + H2O
Al(OH)3 + LiOH → Li[Al(OH)4] (при избытке щелочи будет верным написание – Li3[Al(OH)6] – гексагидроксоалюминат лития)
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Алюминий: физические и химические свойства
Тема: «Алюминий: физические и химические свойства»
Учитель химии: Леоненко Н.В.
Урок изучения нового материала с мультимедийным сопровождением.
Цели:
• сформировать знания о физико-механических и химических свойствах алюминия на основе его положения в периодической системе, строения атома и кристалла;
• установить причинно-следственную связь между строением и свойствами при сравнении металлов I, II, III групп главных подгрупп;
• продолжить развитие умений наблюдать, делать выводы, объяснять ход эксперимента;
• формировать навыки составления уравнений химических реакций с участием простых веществ;
•
показать
практическое значение химических знаний.
Оборудование: схема-кластер; видеоматериалы с демонстрационными опытами; презентация, компьютер, экран, проектор, наборы реактивов на столах (алюминиевая проволока, фольга, растворы соляной кислоты, гидроксида натрия).
Ход урока
Учитель: Из глины я обыкновенной,
Но я на редкость современный,
Я не боюсь электротока,
Бесстрашно в воздухе лечу;
Служу на кухне я без срока-
Мне все задачи по плечу.
Горжусь своим я именем:
Зовусь я…………..(алюминием).
Сообщение темы и целей урока (запись темы в тетради)
Учитель: «Однажды
к древнеримскому императору Тиберию пришел ремесленник и принес чашу невиданной
красоты, изготовленную из серебристого и на удивление легкого металла. На
вопрос императора о названии чудесного металла ремесленник ответил, что металл
получен им из … глины и пока не имеет названия. Император, испугавшись, что
новый металл, который можно получать из обыкновенной глины, обесценит серебро и
подорвет могущество Рима, повелел чашу уничтожить, ремесленника обезглавить,
его мастерскую сравнять с землей!». Теперь, по прошествии тысячелетий, мы не
можем сказать, сколько правды лежит в основе этой легенды, рассказанной римским
историком Плинием Старшим в своей «Естественной истории», но значительная доля
правды в ней кроется. Действительно, алюминий-серебристо-белый, но в отличие от
серебра, на удивление легкий металл, который в принципе можно получить даже из
глины. Не случайно у нас в России в XIX столетии алюминий называли «глиний».
На
вопрос императора о названии чудесного металла ремесленник ответил, что металл
получен им из … глины и пока не имеет названия. Император, испугавшись, что
новый металл, который можно получать из обыкновенной глины, обесценит серебро и
подорвет могущество Рима, повелел чашу уничтожить, ремесленника обезглавить,
его мастерскую сравнять с землей!». Теперь, по прошествии тысячелетий, мы не
можем сказать, сколько правды лежит в основе этой легенды, рассказанной римским
историком Плинием Старшим в своей «Естественной истории», но значительная доля
правды в ней кроется. Действительно, алюминий-серебристо-белый, но в отличие от
серебра, на удивление легкий металл, который в принципе можно получить даже из
глины. Не случайно у нас в России в XIX столетии алюминий называли «глиний».
Сегодня нам предстоит знакомство с алюминием как химическим элементом, так и простым веществом.
Обратите внимание: на ваших столах находятся схемы-кластеры. Именно по ним мы
будем поэтапно изучать самый распространенный металл на земле.
Каждому ряду предлагается самостоятельная работа.
Самостоятельная работа.
1 ряд.
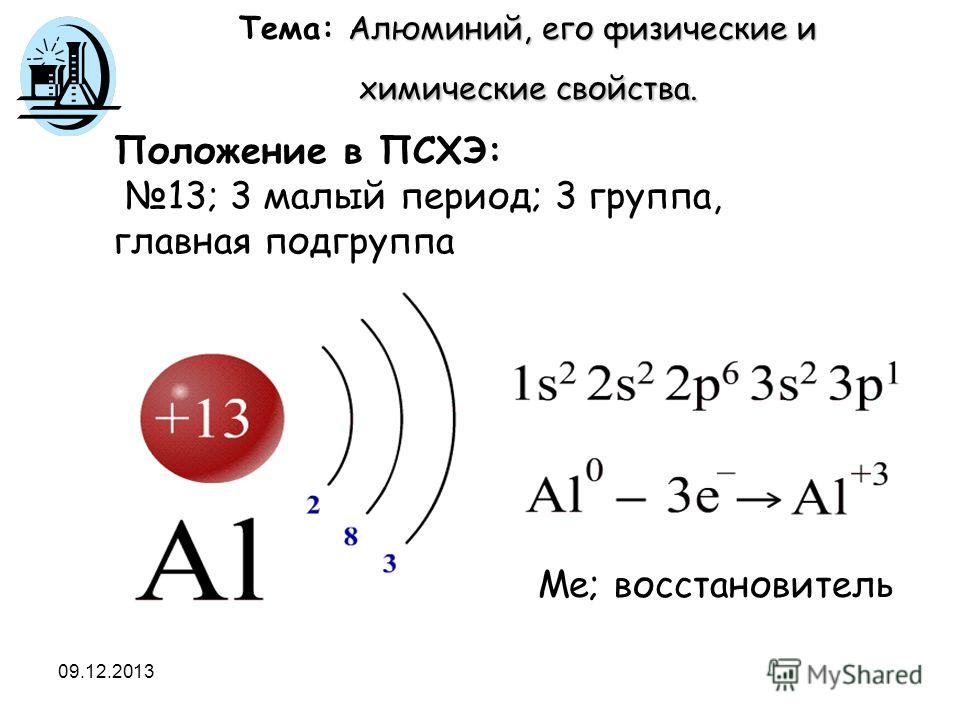
Дать характеристику элементу №13 по положению в периодической таблице.
2 ряд.
Указать состав ядра алюминия и строение электронной оболочки.
3 ряд.
Сопоставить строение атомов натрия, магния, алюминия и сделать вывод о химической активности этих металлов.
Ответы учащихся:
• Алюминий-металл, находится в 3 группе главной подгруппе, третьем малом периоде; порядковый номер-13, Аr(Аl)=27.
• Строение атома: Z(Аl)=13, е(Аl)=13, N(Аl)= Аr-Z= 27-13=14
Аl 1s2,2s2,2р6,3s2,3р1
Аl 1s2,2s2,2р6,3s1,3р2
Выводы: Степень окисления: +3, следовательно, алюминий в реакциях будет восстановитель.
Тип химической связи: металлическая.
Тип кристаллической решетки: металлическая.
•
Металлические
свойства ярче выражены у кальция и еще сильнее у натрия по сравнению с
алюминием, так как в ряду Na—Са—Аl число электронов на внешнем энергетическом
уровне увеличивается, сила притяжения между ядром и электронами внешнего
энергетического уровня увеличивается, атомный радиус уменьшается, энергия
ионизации увеличивается, электроотрицательность увеличивается. Следовательно,
химическая активность в ряду уменьшается.
Следовательно,
химическая активность в ряду уменьшается.
Учитель: Но в электрохимическом ряду напряжения металлов алюминий расположен сразу после щелочноземельных металлов. Следовательно, можно предположить о его достаточной химической активности. Поэтому в природе алюминий в свободном виде не встречается. В природе алюминий встречается в виде:
– бокситов,
– каолина,
– нефелина и т. д. (Слайд- )
Месторождения алюминиевого сырья имеются на Урале, в Казахстане, Башкирии.
Учитель: Рассмотрев особенности химического элемента алюминия, перейдем к изучению простого вещества.
Лабораторная работа по теме:
«Физические свойства алюминия»
Инструктивная карта.
1. Рассмотрите алюминиевую проволоку и фольгу.
2. Определите агрегатное состояние вещества алюминия.
3. Какого цвета образцы металла?
4. Определите, имеет ли блеск металл?
5. Опустите кусочек проволоки в воду. Наблюдается ли растворение алюминия в воде?
Опустите кусочек проволоки в воду. Наблюдается ли растворение алюминия в воде?
6. Кратко запишите свои наблюдения согласно плану:
– агрегатное состояние,
– цвет,
– блеск,
– пластичность,
– растворимость в воде.
Дополнение учителя:
– легкий металл; плотность=2,7г/см3
– легкоплавкий металл: tпл.=660оС
– электропроводен (3-е место по электропроводности),
– алюминий в воде не растворяется, т.к. на его поверхности образуется оксидная пленка.
(Слайд-физические свойства алюминия).
Учитель: Мы с вами выяснили, что в химических реакциях алюминий будет проявлять восстановительные свойства. С какими же веществами он должен взаимодействовать?
Учащиеся: Как с простыми, так и со сложными веществами.
Учитель: Записываем: Химические свойства алюминия.
I. Алюминий взаимодействует с простыми веществами- неметаллами.
Опыт: Сгорание
порошка алюминия.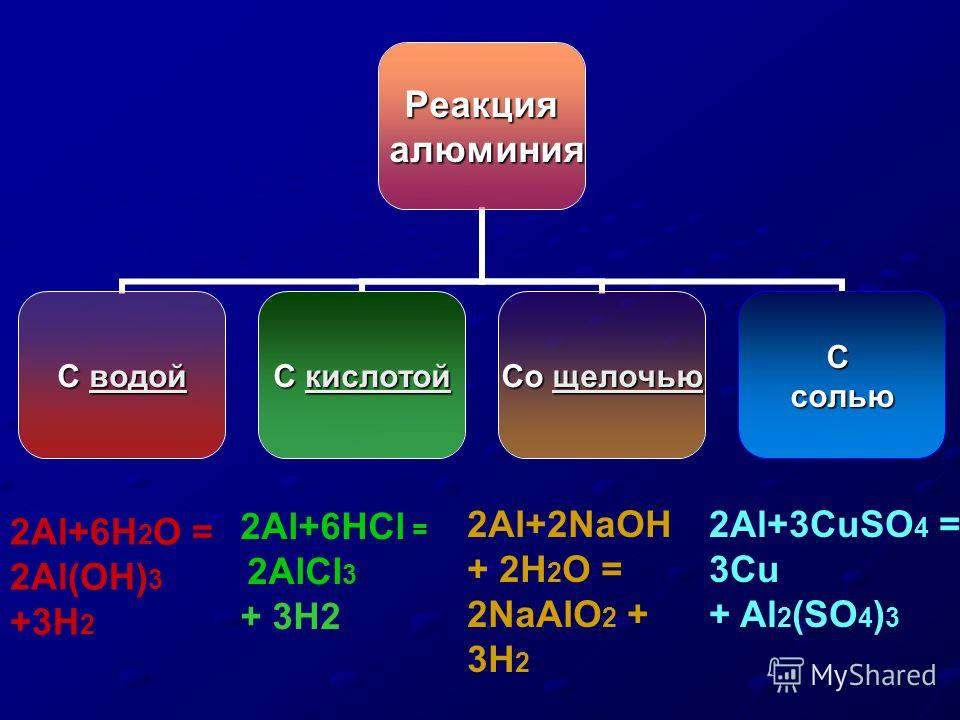
Горение бенгальской свечи.
Учитель: Пока горит бенгальская свеча, записываем уравнение химической реакции и разбираем его, как ОВР. 4Аl+3О2=2Аl2О3
Опыт: Взаимодействие алюминия с йодом: смешиваем порошок алюминия с йодом в соотношении 1:15, в середину смеси капаем две капли воды. Врезультате реакции образуется иодит алюминия и фиолетовые пары йода.
Учитель: Записываем уравнение реакции и разбираем его как ОВР.
2Аl+3I2=2АlI3
Видео: – взаимодействие алюминия с бромом;
– взаимодействие алюминия с серой.
Учитель: Записываем уравнения реакций и разбираем как ОВР.
2Аl+3Вr2=2АlВr3
2Аl+3S=Аl2S3
Учитель: Уравнения реакций взаимодействия алюминия с азотом, углеродом и фосфором записываем в молекулярном виде, а дома разбираем как ОВР.
2Аl+N2=2АlN(t800оС)
4Аl+3С=Аl4С3(t2000оС)
Аl+Р=АlР(t500оС)
II. Алюминий
взаимодействует со сложными веществами.
Алюминий
взаимодействует со сложными веществами.
Лабораторная работа по теме:
«Взаимодействие алюминия с кислотами и щелочами».
Инструктивная карта.
1. Возьмите две пробирки. В каждую положите по кусочку алюминия. Прилейте в одну из них 1-2 мл. раствора соляной кислоты, а в другую столько же раствора щелочи (NаОН). Что наблюдаете? Пробирки слегка нагрейте.
2. Запишите уравнения соответствующих реакций.
3. Сделайте выводы.
Учащиеся записывают уравнения реакций на доске и разбирают их в свете ОВР.
2Аl+6HCl=2AlCl3+3h3
2Al+2NaOH+2h3O=2NaAlO2+3h3
Вывод: Алюминий проявляет амфотерные свойства, так как взаимодействует как с растворами кислот, так и с растворами щелочей.
Учитель: Для алюминия характерными являются реакции взаимодействия с солями, в состав которых входит менее активный металл: (Cлайд )
2АL+3СиSO4=Al2(SO4)3+3Cu,
а также алюминотермия- взаимодействие более активного металла с оксидом менее активного металла: 8Аl+ 3Fe3O4=9Fe+4Al2O3
Учитель: Алюминий взаимодействует с водой (без оксидной пленки):
2 Аl+6h3O=2Al(OH)3+3h3
Записанные
уравнения реакций дома разобрать как окислительно-восстановительные.
Алюминий не реагирует с коцентрированными азотной и серной кислотами на холоде.
Учитель: Получение алюминия:
Из минералов в промышленности алюминий может быть получен в основном электролизом расплава:
2Аl2О3—–4Аl+3О2
При получении алюминия используют также металлический натрий:
АlCl3+3Na=Al+3NaCl (метод датского ученого Г.Эрстеда, впервые получившего алюминий).
Опираясь на физические и химические свойства, а также получение, рассмотрим применение алюминия.
Учащий ся.
Применение алюминия и его сплавов во всех видах транспорта, а в особенности воздушного, привело к уменьшению собственной массы транспортных средств и к резкому увеличению эффективности их использования.
Авиаконструкции, моторы, блоки, головки цилиндров, картеры, коробки передач, насосы и многие другие детали также изготавливают из алюминия и его сплавов.
Алюминий и его сплавы применяют также при отделки железнодорожных вагонов,
изготовлении корпусов и дымовых труб, спасательных лодок, радарных матч,
трапов. Активно используют алюминий и его сплавы в электротехнической
промышленности для изготовления кабелей, шинопроводов, конденсаторов,
выпрямителей переменного тока. В приборостроении алюминий и его сплавы
используют в производстве кино- и фотоаппаратуры, радиотелефонной аппаратуры.
Алюминий применяется в строительстве и ядерной энергетике. Нет ни одной отрасли
народного хозяйства, где бы не находил применение алюминий.
Активно используют алюминий и его сплавы в электротехнической
промышленности для изготовления кабелей, шинопроводов, конденсаторов,
выпрямителей переменного тока. В приборостроении алюминий и его сплавы
используют в производстве кино- и фотоаппаратуры, радиотелефонной аппаратуры.
Алюминий применяется в строительстве и ядерной энергетике. Нет ни одной отрасли
народного хозяйства, где бы не находил применение алюминий.
Закрепление.
Тест.
1
ряд.
1.Какова
электронная конфигурация атома алюминия?
А) 1s22s22p1 Б)1s22s22p3
B) 1s22s22p63s23p1 Г) 1s22s22p63s23p63d14s2
2. С
какими из указанных веществ реагирует алюминий?
А) СаО Б) HCl
B) Cl2 Г) NaOH
2
ряд.
1.
Какие из указанных металлов являются более активными, чем алюминий?
А) Na Б) Cu
B) Ca Г) Fe
2. Наиболее характерная степень окисления алюминия:
Наиболее характерная степень окисления алюминия:
А) +1 Б) +2
В) +3 Г) +4
3 ряд.
1. Алюминий в химических реакциях проявляет свойства:
А) окислителя Б) инертного соединения
В) восстановителя Г) окислителя и восстановителя
2. В промышленности алюминий получают:
А) используя в качестве восстановителя металлический натрий
Б) электролизом расплава оксида алюминия
В) используя в качестве восстановителя оксид углерода (П)
Г) электролизом раствора солей алюминия
• Правильные ответы:
1 ряд. | 1 ряд | 2 ряд | 2 ряд | 3 ряд | 3 ряд |
1 | 2 | 1 | 2 | 1 | 2 |
Выводы:
1. Алюминий- самый распространенный химический элемент- метал в земной коре.
Алюминий- самый распространенный химический элемент- метал в земной коре.
2. В химических реакциях алюминий является восстановителем, его степень окисления равна +3.
3. Алюминий- активный металл, взаимодействует как с простыми, так и со сложными веществами.
4. Алюминий- амфотерный металл, так как реагирует и с кислотами и со щелочами.
5. В промышленности алюминий получают электролизом расплава оксида алюминия.
Это интересно!!!
Металлический алюминий первым выделил в 1825 году датский химик Ханс Кристиан Эрстед. Пропустив газообразный хлор через слой раскаленного оксида алюминия, смешанного с углем, Эрстед выделил хлорид алюминия без малейших следов влаги. Чтобы восстановить металлический алюминий, Эрстеду понадобилось обработать хлорид алюминия амальгамой калия. Через 2 года Фридрих Велер усовершенствовал метод, заменив амальгаму калия чистым калием.
Домашнее задание: параграф 13, упр.2-5.
Типы химических
реакций.
Фрагмент урока: Проведение лабораторной работы по теме «Типы химических реакций».
Цели:
• сформировать знания об основных типах химических реакций, выполнив лабораторную работу и, закрепив имеющиеся знания на примере демонстрационного эксперимента;
• установить причинно-следственную связь между строением и свойствами веществ при определении типов химических реакций и составлении уравнений реакций;
• продолжить развитие умений наблюдать, делать выводы, объяснять ход эксперимента;
• формировать навыки составления уравнений химических реакций с участием простых и сложных веществ;
• показать практическое значение химических знаний.
Оборудование: схема-кластер;
видеоматериалы с демонстрационными опытами; презентация, компьютер, экран,
проектор, наборы реактивов на столах (пероксид водорода, оксид марганца (IV),
лучинка, спички, цинк, раствор соляной кислоты, магниевая лента).
Методы: обучения– 1. эвристический,
• диалогический,
• программированный;
преподавания- 1. побуждающий,
• стимулирующий,
• инструктивный,
• объяснительный;
учения- 1. частично-поисковый,
• практический,
• репродуктивный.
Ход урока.
Актуализация знаний.
Дать определения реакциям соединения, замещения, разложения.
Предполагаемый ответ. Реакции соединения– это реакции, в результате которых из нескольких простых или сложных веществ
образуется одно более сложное вещество.
Реакции разложения– это реакции, в результате которых из одного сложного вещества образуется несколько простых или сложных веществ.
Реакции
замещения–
это реакции между простым и сложным веществами, в результате которых атомы
простого вещества замещают атомы в сложном веществе.
Лабораторная работа по теме “Типы химических реакций”.
Задание 1.
В химический стакан налить пероксид водорода, далее добавить оксид марганца (IV) и внести в верхнюю часть стакана тлеющую лучинку. Что наблюдаете? Какой газ выделился? Написать уравнение реакции разложения пероксида водорода. Слить воду из стакана в пустую емкость, добавив к твердому остатку перосид водорода и внести тлеющую лучинку. Что наблюдаете? Сделайте вывод.
Задание 2.
В пробирку поместите таблетки цинка и прилейте раствор соляной или хлороводородной кислоты. Что наблюдаете? Запишите уравнение реакции. Сделайте вывод.
Задание 3.
Сожгите магниевую ленту. Что наблюдаете? Напишите уравнение реакции. Сделайте вывод.
Проверь свои знания по теме “Типы химических реакций”.
Опыт
1.
В один цилиндр помещаем раствор аммиака, а в другой цилиндр немного
концентрированной соляной кислоты. Соединяем отверстия цилиндров и наблюдаем
появление “дыма”- хлорида аммония. Написать уравнение реакции. Вывод?
Соединяем отверстия цилиндров и наблюдаем
появление “дыма”- хлорида аммония. Написать уравнение реакции. Вывод?
Опыт 2. Взаимодействие натрия с водой. Что наблюдаете? Написать уравнение реакции. Вывод?
Опыт 3. Разложение перманганата калия. Что наблюдаете? Напишите уравнение реакции. Вывод?
Написать уравнения реакций.
Задания на экране.
Распределить предложенные уравнения реакций по типам:
соединения;
замещения;
разложения.
Выводы:
1. Химическая реакция- это процесс превращения исходных веществ в продукты реакции.
2. Уравнение реакции- это условная запись химической реакции.
3. Реакции классифицируются по исходным веществам и продуктам реакции на р. соединения, р. замещения и р. разложения; по тепловому эффекту: на экзотермические и эндотермические.
4. Все химические реакции находят большое применение в народном хозяйстве.
Домашнее задание: Параграф 29,30,31.
Алюминий — химические и физические свойства, сферы применения
Алюминий — химические и физические свойства, сферы применения
Алюминий (Al) от латинского Aluminium — лёгкий парамагнитный металл, серебристо-белого цвета, плотностью 2712 кг/м³, легко поддающийся формовке, литью и механической обработке. Металл с повышенной тепло- и электропроводностью, и стойкостью к коррозии, за счёт образования оксидной защищающей плёнки Al2O3. Температура плавления технического алюминия 658°C, с повышенной чистотой 660°C. Сопротивление литого алюминия 10-12 кг/мм², деформируемого 18-25 кг/мм², сплавов 38-42 кг/мм². Пластичность технического алюминия 35%, чистого 50%. Прокат с повышенной электропроводностью 37·106 cм/м, теплопроводностью 203,5 Вт/(м·К), и повышенной светоотражаемостью.
Металл с повышенной тепло- и электропроводностью, и стойкостью к коррозии, за счёт образования оксидной защищающей плёнки Al2O3. Температура плавления технического алюминия 658°C, с повышенной чистотой 660°C. Сопротивление литого алюминия 10-12 кг/мм², деформируемого 18-25 кг/мм², сплавов 38-42 кг/мм². Пластичность технического алюминия 35%, чистого 50%. Прокат с повышенной электропроводностью 37·106 cм/м, теплопроводностью 203,5 Вт/(м·К), и повышенной светоотражаемостью.
Масса доли элементов в сплавах алюминия
- Дуралюмин — дюраль, дюралюминий, от названия немецкого города, где было начато промышленное производство сплава. Сплав алюминия (основа) с медью (Cu: 2,2-5,2%), магнием (Mg: 0,2-2,7%) марганцем (Mn: 0,2-1%). Подвергается закалке и старению, часто плакируется алюминием. Является конструкционным материалом для авиационного и транспортного машиностроения.
- Силумин — легкие литейные сплавы алюминия (основа) с кремнием (Si: 4-13%), иногда до 23% и некоторыми другими элементами: Cu, Mn, Mg, Zn, Ti, Be).
 Изготавливают детали сложной конфигурации, главным образом в авто- и авиастроении.
Изготавливают детали сложной конфигурации, главным образом в авто- и авиастроении. - Магналии — сплавы алюминия (основа) с магнием (Mg: 1-13%) и другими элементами, обладающие высокой коррозийной стойкостью, хорошей свариваемостью, высокой пластичностью. Изготавливают фасонные отливки (литейные магналии), листы, проволоку, заклепки и т.д. (деформируемые магналии).
Основные достоинства всех сплавов алюминия состоят в их малой плотности (2,5-2,8 г/см3), высокая прочность (в расчете на единицу веса), удовлетворительная стойкость против атмосферной коррозии, сравнительная дешевизна и простота получения и обработка.
Модули упругости алюминия и коэффициент Пуассона
| Наименование материала | Модуль Юнга, кГ/мм2 | Модуль сдвига, кГ/мм2 | Коэффициент Пуассона |
|---|---|---|---|
| Алюминиевая бронза, литье | 10500 | 4200 | — |
| Алюминиевая проволока тянутая | 7000 | — | — |
| Алюминий катаный | 6900 | 2600-2700 | 0,32-0,36 |
Физические свойства алюминия
Алюминий характеризуется высокой электропроводностью, теплопроводностью, стойкостью к коррозии и морозу, пластичностью. Он хорошо поддаётся штамповке, ковке, волочению, прокатке. Металл хорошо сваривается различными видами сварки. Важным свойством является малая плотность около 2,7 г/см³. Температура плавления составляет около 660°С. Механические, физико-химические и технологические свойства алюминия зависят от наличия и количества примесей, которые ухудшают свойства чистого металла. Основные естественные примеси – это кремний, железо, цинк, титан и медь.
Он хорошо поддаётся штамповке, ковке, волочению, прокатке. Металл хорошо сваривается различными видами сварки. Важным свойством является малая плотность около 2,7 г/см³. Температура плавления составляет около 660°С. Механические, физико-химические и технологические свойства алюминия зависят от наличия и количества примесей, которые ухудшают свойства чистого металла. Основные естественные примеси – это кремний, железо, цинк, титан и медь.
По степени очистки различают алюминий высокой и технической чистоты. Практическое различие заключается в отличии коррозионной устойчивости к некоторым средам. Чем чище металл, тем он дороже. Технический алюминий используется для изготовления сплавов, проката и кабельно-проводниковой продукции. Металл высокой чистоты применяют в специальных целях.
По показателю электропроводности алюминий уступает только золоту, серебру и меди. А сочетание малой плотности и высокой электропроводности позволяет конкурировать в сфере кабельно-проводниковой продукции с медью. Длительный отжиг улучшает электропроводность, а нагартовка ухудшает.
Длительный отжиг улучшает электропроводность, а нагартовка ухудшает.
Теплопроводность алюминия повышается с увеличением чистоты металла. Примеси марганца, магния и меди снижают это свойство. Алюминий обладает высокой удельной теплоёмкостью и теплотой плавления. Эти показатели значительно больше, чем у большинства металлов.
Чем выше степень чистоты алюминия, тем больше он способен отражать свет от поверхности. Металл хорошо полируется и анодируется.
Алюминий имеет большое сродство к кислороду и покрывается на воздухе тонкой прочной плёнкой оксида алюминия. Эта плёнка защищает металл от последующего окисления и обеспечивает его хорошие антикоррозионные свойства.
Металл обладает стойкостью к атмосферной коррозии, морской и пресной воде, практически не вступает во взаимодействия с органическими кислотами, концентрированной или разбавленной азотной кислотой.
На нашем сайте, в каталоге алюминиевого проката, вы можете ознакомится и приобрести следующие виды продукции из алюминия:
Области применения алюминия
Широко применяется как конструкционный профиль, при изготовлении кухонной посуды, фольги в пищевой промышленности. Также в авиационной и авиакосмической промышленности. Недостаток алюминия как конструкционного материала — малая прочность, поэтому для упрочнения алюминий сплавляют с медью и магнием, получая дюралюминий.
Алюминий применяется в электротехнике для изготовления проводов, экранирования и даже в микроэлектронике при напылении проводников на поверхности кристаллов микросхем. Благодаря комплексу свойств алюминиевые трубы широко распространены в тепловом оборудова6нии. Профильные трубы используются в строительстве и производственных сборках конструкций, при изготовлении мебели. Сплавы алюминия не приобретают хрупкость при сверхнизких температурах, используется в криогенной технике. Повышенный коэффициент отражения в сочетании с дешевизной и лёгкостью вакуумного напыления делает алюминий оптимальным материалом для изготовления зеркал.
Для декора входных и лестничных конструкций используется рифленые листы. При изготовлении облицовочных, противоскользящих и декоративных покрытий. В автомобилестроении для производства порогов и ступеней. Листовой прокат применяются в конструкциях, топливной, пищевой и химической промышленностях, также в строительстве и машиностроении. Производиться при помощи горячего, а затем холодного деформирования. Лист производят из сплава алюминия, и покрывают тонким слоем чистого алюминия. Материал обретает особую пластичность, прочность и устойчивость к негативным внешним факторам. Благодаря своим эксплуатационным характеристикам листы используются в строительстве чаще всего применяют как изоляционный или отделочный материал.
Лист производят из сплава алюминия, и покрывают тонким слоем чистого алюминия. Материал обретает особую пластичность, прочность и устойчивость к негативным внешним факторам. Благодаря своим эксплуатационным характеристикам листы используются в строительстве чаще всего применяют как изоляционный или отделочный материал.
В авиастроении алюминий используется как базовый материал, из-за своей легкости. Из прутков изготавливают детали силового каркаса самолетов и других узлов. Также прутки востребованы в автомобильной промышленности.
Проволока применяется главным образом в сварочных работах и электротехники. Также используется в строительстве, машиностроении, пищевой и мебельной промышленности. Как универсальный крепеж, применяется при изготовлении сеток, мебельной фурнитуры, пружин, заклёпок, различных декоративных элементов.
Для изготовления легких и прочных конструкций не заменим уголок. Он используется для элементов морских, речных и воздушных судов, комплектующих для автомобилей. Уголок применяют для ограждающих сооружений, декоративных и умеренно нагруженных несущих конструкций. Как заготовка для изготовления деталей посредством последующей обработки. Прочность увеличивается за счет термической обработки, для увеличения срока службы подвергают анодному оксидированию.
Уголок применяют для ограждающих сооружений, декоративных и умеренно нагруженных несущих конструкций. Как заготовка для изготовления деталей посредством последующей обработки. Прочность увеличивается за счет термической обработки, для увеличения срока службы подвергают анодному оксидированию.
Швеллера выполняют функцию стыковочного, базового элемента, встречаются в различных перемычках, карнизах, дверных и оконных профилях. Конструкции, изготовленные с их применением, отличают высокая жесткость, прочность и легкость. Благодаря пластичности, из него можно создавать инженерные, дизайнерские системы разных форм. Анодированный швеллер обладает высокими электроизоляционными свойствами и не подвержен накапливанию статического заряда, что важно при возведении высотных зданий. Благодаря швеллерам возможно изготавливать конструкции без применения сварки. Получая разборные сооружения, которые можно перенести частично или полностью на другое место. Данная технология, к примеру, используется при создании сезонных или временных складов, построек.
Полосы используются для закрывания соединительных швов между плитами. Как материал для изготовления декоративных элементов в производстве автомобилей, из них штампуют элементы отделки салона. Также используют в авиастроении, промышленности и других областях. Полосы обладают водо- и паронепроницаемостью. Не токсичны, можно использовать в сложных климатических условиях. В электротехнике из полос делают экранирующие и токопроводящие изделия.
Без использования алюминия невозможно было бы создать современных сооружений, мощных и легких машин, сверхбыстрых ракет и самолетов, а также предметов быта.
Назад в блог статей
хлорид алюминия | AMERICAN ELEMENTS®
РАЗДЕЛ 1. ИДЕНТИФИКАЦИЯ
Наименование продукта: Алюминий хлорид
Номер продукта: Все применимые коды продуктов American Elements, например. АЛ-КЛ-02 , АЛ-КЛ-03 , АЛ-КЛ-04 , AL-CL-05
Номер CAS: 7446-70-0
Соответствующие установленные области применения вещества: Научные исследования и разработки
Информация о поставщике:
American Elements
10884 Weyburn Ave.
Los Angeles, CA
Тел.: +1 310-208-0551
Факс: +1 310-208-0351
Телефон службы экстренной помощи:
Внутренний, Северная Америка: +1 800-44 -9300
Международный: +1 703-527-3887
РАЗДЕЛ 2. ИДЕНТИФИКАЦИЯ ОПАСНОСТИ
Классификация вещества или смеси в соответствии с 29 CFR 1910 (OSHA HCS)
GHS05 Коррозия
Skin Corr. 1B h414 Вызывает серьезные ожоги кожи и повреждения глаз.
Опасности, не классифицированные иначе Нет данных
Элементы маркировки СГС, включая меры предосторожности
Пиктограммы опасности
GHS05
Сигнальное слово Опасно
Краткая характеристика опасности
h414 Вызывает серьезные ожоги кожи и повреждение глаз.
Меры предосторожности
P260 Не вдыхать пыль/дым/газ/туман/пары/аэрозоль.
P303+P361+P353 При попадании на кожу (или волосы): Немедленно снять всю загрязненную одежду. Промойте кожу водой/душем.
P305+P351+P338 ПРИ ПОПАДАНИИ В ГЛАЗА: Осторожно промывать глаза водой в течение нескольких минут. Снимите контактные линзы, если они есть и это легко сделать. Продолжайте полоскать.
Снимите контактные линзы, если они есть и это легко сделать. Продолжайте полоскать.
P301+P330+P331 ПРИ ПРОГЛАТЫВАНИИ: прополоскать рот. Не вызывает рвоту.
P405 Магазин заперт.
P501 Утилизируйте содержимое/контейнер в соответствии с местными/региональными/национальными/международными нормами.
Классификация WHMIS
D2B — Токсичный материал, вызывающий другие токсические эффекты
E — Коррозионный материал
Система классификации
Рейтинги HMIS (шкала 0–4)
(Система идентификации опасных материалов) (острые эффекты) = 3
Воспламеняемость = 0
Физическая опасность = 1
Другие опасности
Результаты оценки PBT и vPvB
PBT: N/A
vPvB: N/A
Наименование вещества:
7446-70-0 Алюминий хлорид безводный
Идентификационный номер(а):
Номер ЕС: 231-208-1
Индексный номер: 013-003-00-7
РАЗДЕЛ 4. МЕРЫ ПЕРВОЙ ПОМОЩИ
Описание мер первой помощи
Общая информация Немедленно снимите одежду, испачканную продуктом.
При вдыхании:
Обеспечить пациента свежим воздухом. Если не дышит, сделайте искусственное дыхание. Держите пациента в тепле.
Немедленно обратитесь к врачу.
При попадании на кожу:
Немедленно промыть водой с мылом; тщательно промыть.
Немедленно обратитесь к врачу.
При попадании в глаза:
Промыть открытые глаза в течение нескольких минут под проточной водой. Проконсультируйтесь с врачом.
При проглатывании:
Обратитесь за медицинской помощью.
Информация для врача
Наиболее важные симптомы и эффекты, как острые, так и замедленные
Вызывает сильные ожоги кожи.
Вызывает серьезное повреждение глаз.
Указание на необходимость немедленной медицинской помощи и специального лечения:
Данные отсутствуют
РАЗДЕЛ 5. ПРОТИВОПОЖАРНЫЕ МЕРЫ
Средства пожаротушения
Подходящие средства пожаротушения CO2, песок, огнетушащий порошок. Не используйте воду.
Неподходящие средства пожаротушения из соображений безопасности Вода
Особые опасности, исходящие от вещества или смеси
Если этот продукт вовлечен в пожар, могут быть выделены следующие вещества:
Пары оксида металла
Хлористый водород (HCl)
Рекомендации для пожарных
Защитное оборудование:
Надеть автономный респиратор.
Носите полностью защитный непроницаемый костюм.
РАЗДЕЛ 6. МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
Меры предосторожности для персонала, защитное снаряжение и порядок действий в чрезвычайных ситуациях
Использовать средства индивидуальной защиты. Держите незащищенных людей подальше.
Обеспечить достаточную вентиляцию.
Меры предосторожности по охране окружающей среды: Не допускать попадания материала в окружающую среду без официального разрешения.
Методы и материалы для локализации и очистки:
Использовать нейтрализующий агент.
Утилизируйте загрязненный материал как отходы в соответствии с разделом 13.
Обеспечьте достаточную вентиляцию.
Предотвращение вторичных опасностей: Никаких специальных мер не требуется.
Ссылка на другие разделы
См. Раздел 7 для информации о безопасном обращении
См. Раздел 8 для информации о средствах индивидуальной защиты.
Информацию об утилизации см. в Разделе 13.
РАЗДЕЛ 7.
 ОБРАЩЕНИЕ И ХРАНЕНИЕ
ОБРАЩЕНИЕ И ХРАНЕНИЕ Обращение
Меры предосторожности для безопасного обращения
Работать под сухим защитным газом.
Держите контейнер плотно закрытым.
Хранить в прохладном, сухом месте в плотно закрытой таре.
Обеспечьте хорошую вентиляцию на рабочем месте.
Информация о защите от взрывов и пожаров: Продукт негорючий
Условия для безопасного хранения с учетом любых несовместимостей
Требования, предъявляемые к складским помещениям и емкостям: Особых требований нет.
Информация о хранении в одном общем хранилище:
Хранить вдали от окислителей.
Хранить вдали от прочных оснований.
Хранить в темноте.
Хранить вдали от воды/влаги.
Дополнительная информация об условиях хранения:
Хранить в сухом инертном газе.
Этот продукт чувствителен к влаге.
Держите контейнер плотно закрытым.
Хранить в прохладном сухом месте в хорошо закрытых контейнерах.
Беречь от влаги и воды.
Беречь от воздействия света.
Конкретное конечное использование Сведения не доступны
РАЗДЕЛ 8. КОНТРОЛЬ ВОЗДЕЙСТВИЯ ВОЗДЕЙСТВИЯ/СРЕДСТВА ИНДИВИДУАЛЬНОЙ ЗАЩИТЫ
Дополнительная информация о конструкции технических систем:
Правильно работающий химический вытяжной шкаф, предназначенный для опасных химических веществ и имеющий среднюю скорость потока не менее 100 футов в минуту.
Параметры управления
Компоненты с предельными значениями, требующими контроля на рабочем месте:
7446-70-0 Алюминий хлорид безводный (100,0%)
REL (США) Долговременное значение: 2 мг/м 3
как Al
ПДК (США) Долговременное значение: 1* мг/м 3
в виде Al;*в виде вдыхаемой фракции
EL (Канада) Долговременное значение: 2 мг/м 3
в виде Al
Дополнительная информация: нет данных для работы с химикатами.
Хранить вдали от пищевых продуктов, напитков и кормов.
Немедленно снимите всю испачканную и загрязненную одежду.
Мыть руки перед перерывами и по окончании работы.
Избегать попадания в глаза и на кожу.
Поддерживайте эргономически подходящую рабочую среду.
Дыхательное оборудование: Используйте подходящий респиратор при наличии высоких концентраций.
Используйте респиратор с картриджами типа P100 (США) или P3 (EN 143) в качестве резерва средств технического контроля. Необходимо провести оценку риска, чтобы определить, подходят ли респираторы
для очистки воздуха. Используйте только оборудование, проверенное и одобренное в соответствии с соответствующими государственными стандартами.
Защита рук:
Непроницаемые перчатки
Осмотрите перчатки перед использованием. №
Выбор подходящих перчаток зависит не только от материала, но и от качества. Качество будет варьироваться от производителя к производителю.
Материал перчаток Нитрилкаучук, NBR
Время проникновения материала перчаток (в минутах) 480
Толщина перчаток 0,11 мм
Защита глаз:
Плотно прилегающие защитные очки
Полная защита лица
Защита тела: Защитная рабочая одежда.
РАЗДЕЛ 9. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Информация об основных физических и химических свойствах
Внешний вид:
Форма: Порошок или гранулы
Цвет: от желтого до серого
Запах: Острый
Порог восприятия запаха: Данные отсутствуют.
pH (100 г/л) при 20 °C (68 °F): 2,4 / start: Данные отсутствуют
Воспламеняемость (твердое тело, газ) Данные отсутствуют.
Температура воспламенения: Данные отсутствуют.
Температура разложения: Данные отсутствуют.
Самовоспламенение: Данные отсутствуют.
Опасность взрыва: Данные отсутствуют.
Пределы взрываемости:
Нижний: Данные отсутствуют
Верхний: Данные отсутствуют
Давление пара при 20 °C (68 °F): 0,00003 гПа
Плотность при 20 °C (68 °F): 2,44 г/см 3 (20,362 фунта/гал)
Относительная плотность Данные отсутствуют.
Плотность паров Н/Д
Скорость испарения Н/Д
Растворимость в / Смешиваемость с
Вода: Реагирует с водой с образованием соляной кислоты (HCl).
Коэффициент распределения (н-октанол/вода): Данные отсутствуют.
Вязкость:
Динамическая: Н/Д
Кинематика: Н/Д
Другая информация Данные отсутствуют
РАЗДЕЛ 10. СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
Реакционная способность Данные отсутствуют
Химическая стабильность Стабилен при соблюдении рекомендуемых условий хранения.
Термическое разложение / условия, которых следует избегать: Разложение не происходит, если используется и хранится в соответствии со спецификациями.
Возможность опасных реакций Реагирует с водой с образованием соляной кислоты (HCl)
Условия, которых следует избегать Нет данных
Несовместимые материалы:
Основания
Вода/влага
Свет
Опасные продукты разложения:
Дым оксида металла
Хлористый водород (HCl)
РАЗДЕЛ 11. ТОКСИКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Информация о токсикологическом воздействии
Острая токсичность:
Проглатывание вызывает сильное разъедающее действие на рот и горло и опасность перфорации пищевода и желудка.
Реестр токсического воздействия химических веществ (RTECS) содержит данные об острой токсичности компонентов этого продукта.
Значения LD/LC50, соответствующие классификации:
Пероральная LD50 1130 мг/кг (мышь)
3450 мг/кг (крыса)
Кожная LD50 >2 г/кг (кролик)
Раздражение или коррозия кожи: Вызывает сильные ожоги кожи .
Раздражение или коррозия глаз: Вызывает серьезное повреждение глаз.
Сенсибилизация: Сенсибилизирующие эффекты неизвестны.
Мутагенность зародышевых клеток: Реестр токсических эффектов химических веществ (RTECS) содержит данные о мутациях для этого вещества.
Канцерогенность: Данные классификации канцерогенных свойств этого материала от EPA, IARC, NTP, OSHA или ACGIH отсутствуют.
Репродуктивная токсичность: Реестр токсического воздействия химических веществ (RTECS) содержит репродуктивные данные для этого вещества.
Специфическая токсичность для системы органов-мишеней – многократное воздействие: Эффекты неизвестны.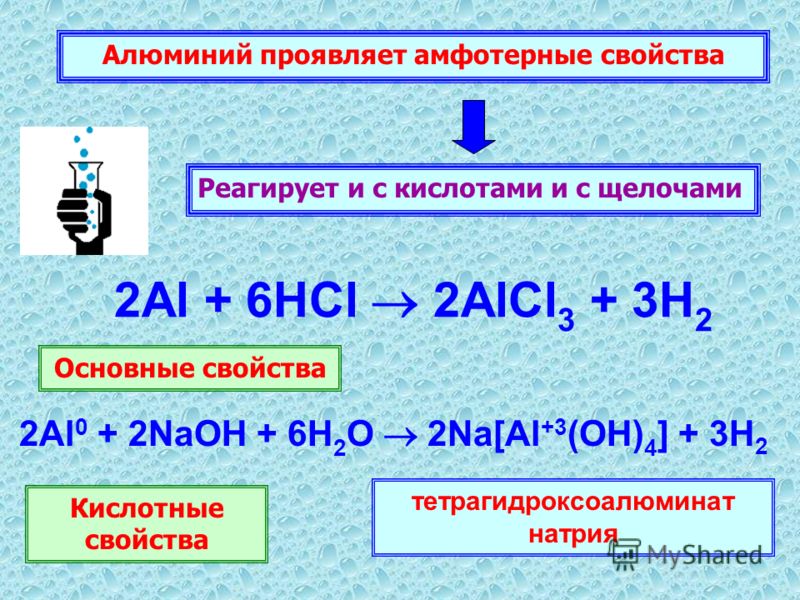
Специфическая системная токсичность на орган-мишень – однократное воздействие: Эффекты неизвестны.
Опасность при вдыхании: Эффекты неизвестны.
От подострой до хронической токсичности: Эффекты неизвестны.
Дополнительная токсикологическая информация: Насколько нам известно, острая и хроническая токсичность этого вещества полностью не известна.
РАЗДЕЛ 12. ЭКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Токсичность
Водная токсичность: данные отсутствуют
Стойкость и способность к разложению данные отсутствуют
Потенциал биоаккумуляции данные отсутствуют
Мобильность в почве данные отсутствуют выпущены в окружающую среду без официальных разрешений.
Не допускать попадания неразбавленного продукта или больших количеств в грунтовые воды, водотоки или канализационные системы.
Избегайте попадания в окружающую среду.
Результаты оценки PBT и vPvB
PBT: н/д
vPvB: н/д
Другие неблагоприятные воздействия Данные отсутствуют
РАЗДЕЛ 13.
 РЕКОМЕНДАЦИИ ПО УТИЛИЗАЦИИ
РЕКОМЕНДАЦИИ ПО УТИЛИЗАЦИИ Методы обработки отходов
Рекомендация Для обеспечения надлежащей утилизации см. официальные правила.
Неочищенная упаковка:
Рекомендация: Утилизация должна производиться в соответствии с официальными правилами.
РАЗДЕЛ 14. ИНФОРМАЦИЯ О ТРАНСПОРТИРОВКЕ
DOT, IMDG, IATA UN1726
Надлежащее отгрузочное наименование ООН
DOT Алюминий хлорид, безводный
IMDG, IATA АЛЮМИНИЙ ХЛОРИД, БЕЗВОДНЫЙ
Класс(ы) опасности при транспортировке 4 80024 Коррозионные вещества.
Маркировка 8
Класс 8 (C2) Коррозионные вещества
Маркировка 8
IMDG, IATA
Класс 8 Коррозионные вещества.
Этикетка 8
Группа упаковки
DOT, IMDG, IATA II
Опасность для окружающей среды: N/A
Особые меры предосторожности для пользователя Предупреждение: Коррозионные вещества
Номер EMS: F-A,S-B
Группы разделения Кислоты
Транспортировка наливом в соответствии с Приложением II MARPOL73/78 и Кодексом IBC N/A
Транспортировка/Дополнительная информация:
DOT
Загрязнитель морской среды (DOT): №
UN “Model Регламент”: UN1726, Алюминий хлорид безводный, 8, II
РАЗДЕЛ 15.
 НОРМАТИВНАЯ ИНФОРМАЦИЯ
НОРМАТИВНАЯ ИНФОРМАЦИЯ Правила/законы по безопасности, охране здоровья и окружающей среды, относящиеся к веществу или смеси
Элементы маркировки СГС, включая меры предосторожности
Пиктограммы, обозначающие опасности
GHS05
Сигнальное слово Опасно
Краткая характеристика опасности
h414 Вызывает серьезные ожоги кожи и повреждения глаз.
Меры предосторожности
P260 Не вдыхать пыль/дым/газ/туман/пары/аэрозоль.
P303+P361+P353 При попадании на кожу (или волосы): Немедленно снять всю загрязненную одежду. Промойте кожу водой/душем.
P305+P351+P338 ПРИ ПОПАДАНИИ В ГЛАЗА: Осторожно промывать глаза водой в течение нескольких минут. Снимите контактные линзы, если они есть и это легко сделать. Продолжайте полоскать.
P301+P330+P331 ПРИ ПРОГЛАТЫВАНИИ: прополоскать рот. Не вызывает рвоту.
P405 Магазин заперт.
P501 Утилизируйте содержимое/контейнер в соответствии с местными/региональными/национальными/международными нормами.
Национальные правила
Все компоненты этого продукта перечислены в Реестре химических веществ Агентства по охране окружающей среды США.
Все компоненты этого продукта перечислены в Канадском перечне веществ для внутреннего потребления (DSL).
Раздел 313 SARA (списки конкретных токсичных химических веществ) Вещество не указано в списке.
Предложение Калифорнии 65
Prop 65 – Химические вещества, вызывающие рак Вещество не указано.
Prop 65 – Токсичность для развития Вещество не указано.
Prop 65 – Токсичность для развития, женский пол Вещество не указано.
Prop 65 – Токсичность для развития, мужчины Вещество не указано.
Информация об ограничении использования: Только для использования технически квалифицированными лицами.
Другие правила, ограничения и запретительные положения
Вещество, вызывающее особую озабоченность (SVHC) в соответствии с Регламентом REACH (ЕС) № 1907/2006. Вещество не указано.
Необходимо соблюдать условия ограничений согласно Статье 67 и Приложению XVII Регламента (ЕС) № 1907/2006 (REACH) для производства, размещения на рынке и использования
.
Вещество не указано.
Приложение XIV Регламента REACH (требуется разрешение на использование) Вещество не указано.
Оценка химической безопасности: Оценка химической безопасности не проводилась.
РАЗДЕЛ 16. ПРОЧАЯ ИНФОРМАЦИЯ
Паспорт безопасности в соответствии с Регламентом (ЕС) № 1907/2006 (REACH). Приведенная выше информация считается верной, но не претендует на полноту и должна использоваться только в качестве руководства. Информация в этом документе основана на современном уровне наших знаний и применима к продукту с учетом соответствующих мер предосторожности. Это не является гарантией свойств продукта. American Elements не несет ответственности за любой ущерб, возникший в результате обращения или контакта с вышеуказанным продуктом. Дополнительные условия продажи см. на обратной стороне счета-фактуры или упаковочного листа. АВТОРСКОЕ ПРАВО 1997-2022 АМЕРИКАНСКИЕ ЭЛЕМЕНТЫ. ПРЕДОСТАВЛЯЕТСЯ ЛИЦЕНЗИЯ НА ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННОГО БУМАЖНОГО КОПИЯ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.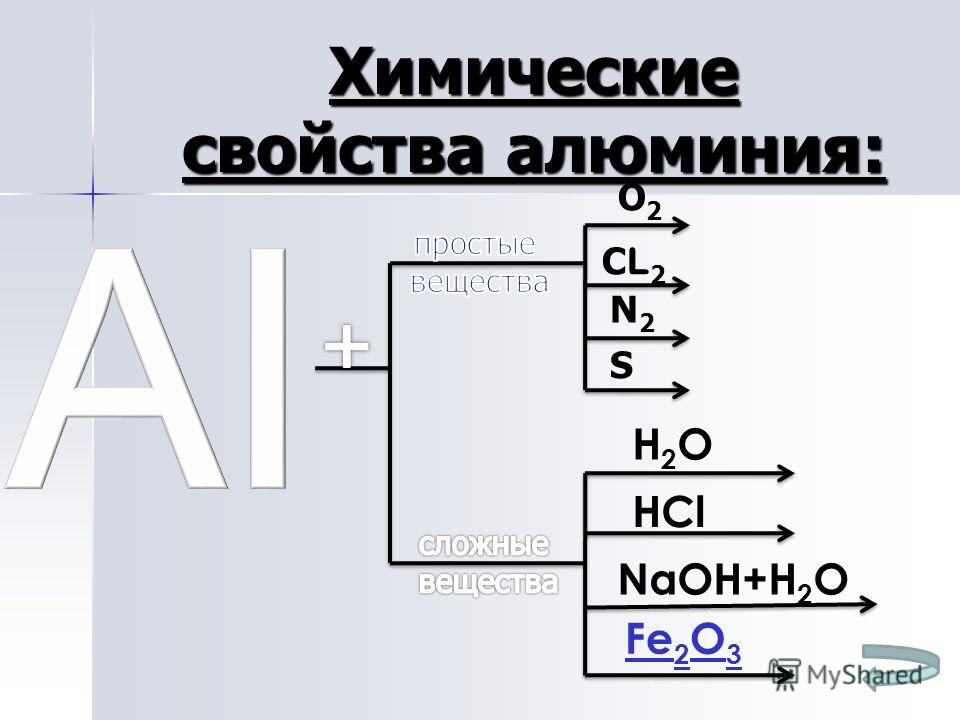
Что такое алюминий
Легкий, прочный и функциональный: эти качества делают алюминий одним из ключевых инженерных материалов нашего времени. Мы можем найти алюминий в домах, в которых живем, в автомобилях, на которых ездим, в поездах и самолетах, которые доставляют нас на большие расстояния, в мобильных телефонах и компьютерах, которыми мы пользуемся ежедневно, на полках в наших холодильниках и в современных интерьера, но всего 200 лет назад об этом металле было известно очень мало.
Такие драгоценные камни, как рубин, сапфир, аквамарин и изумруд, также являются минералами алюминия. Первые два представляют собой корунд, то есть оксид алюминия (Al 2 O 3 ) в кристаллической форме. Он по своей природе прозрачен и по прочности уступает только бриллиантам. Сапфир используется в пуленепробиваемых стеклах, окнах самолетов, устойчивых к царапинам экранах смартфонов. Тем временем один из менее ценных минералов корунда, наждак, используется в качестве абразива, например, в наждачной бумаге.
Сегодня нам известно почти 300 различных соединений алюминия и минералов, содержащих алюминий, от полевого шпата, ключевого исходного минерала на Земле, до рубина, сапфира и изумруда, которые встречаются гораздо реже.
Хамфри Дэви. Британский физик и химик сэр Хамфри Дэви первым получил новый химический элемент с помощью электролиза: ему удалось получить бор из борной кислоты. Он продолжал использовать электролиз, чтобы изолировать еще шесть ранее неизвестных металлов: калий, натрий, барий, кальций, магний и стронций. Именно Дэви доказал существование алюминия, металла, содержащегося в глиноземе, и дал ему название.
Но каким бы распространенным ни был алюминий, он мог бы навсегда остаться скрытым, если бы не электричество. Открытие алюминия стало возможным, когда ученые смогли использовать электричество для расщепления химических соединений на их элементы. В 19 веке датский физик Кристиан Эрстед использовал электролиз для получения алюминия. Электролиз или электролитическое восстановление — это процесс, который и сегодня используется для производства алюминия.
Электролиз или электролитическое восстановление — это процесс, который и сегодня используется для производства алюминия.
Другой довольно распространенный минерал, боксит, используется сегодня в качестве основного сырья для производства алюминия. Боксит представляет собой глинистый минерал, состоящий из различных модификаций гидроксида алюминия в смеси с оксидами железа, кремния, титана, серы, галлия, хрома, ванадия, а также сернистыми карбонатами кальция, железа и магния. Другими словами, ваш типичный боксит содержит почти половину таблицы Менделеева. Кстати, из-за текстуры боксита лет сто назад алюминий часто довольно поэтично называли серебром, полученным из глины. В среднем для производства 1 тонны алюминия требуется 4-5 тонн бокситов.
Бокситы были открыты в 1821 году геологом Пьером Бертье на юге Франции. Новые минералы были названы в честь района, в котором они были обнаружены: Les Baux. Около 90% мировых поставок бокситов приходится на тропические и субтропические районы, такие как Гвинея, Австралия, Вьетнам, Бразилия, Индия и Ямайка.
На первой стадии производства алюминия бокситы перерабатываются в глинозем или оксид алюминия Al 2 O 3 . Глинозем выглядит как белый порошок и затем перерабатывается в алюминий на алюминиевых заводах с помощью электролитического восстановления.
Производство алюминия требует огромного количества электроэнергии, около 15 МВтч на тонну продукции. Это примерно столько, сколько 100-квартирный дом потребляет в месяц. Поэтому лучшее место для алюминиевого завода находится рядом с мощным, желательно возобновляемым источником энергии. Гидроэлектростанции являются лучшим вариантом, поскольку они являются наиболее мощными «зелеными» источниками энергии, доступными сегодня.
Свойства алюминия
Алюминий предлагает редкое сочетание ценных свойств. Это один из самых легких металлов в мире: он почти в три раза легче железа, но при этом очень прочен, чрезвычайно гибок и устойчив к коррозии, поскольку его поверхность всегда покрыта чрезвычайно тонким, но очень прочным слоем оксидной пленки. Он не намагничивается, является отличным проводником электричества и образует сплавы практически со всеми другими металлами.
Он не намагничивается, является отличным проводником электричества и образует сплавы практически со всеми другими металлами.
Три раза легче, чем железо
почти столько же, сколько сталь
Легко при обработке
из -за тонкой поверхности
из -за тонкой поверхности Leachin of Alum
из -за тонкой поверхности из Alum
. давление как в жару, так и в холод. Его можно сворачивать, тянуть и штамповать. Алюминий не горит, не требует специальной покраски и в отличие от пластика не токсичен. Он также очень податлив, поэтому из него можно делать листы толщиной всего 4 микрона, а также очень тонкую проволоку. Сверхтонкая фольга, которую можно изготовить из алюминия, в три раза тоньше человеческого волоса. Кроме того, алюминий более экономичен, чем другие металлы и материалы.
Поскольку алюминий легко образует соединения с другими химическими элементами, было разработано огромное разнообразие алюминиевых сплавов. Даже очень небольшое количество примесей может резко изменить свойства металла, что позволит использовать его в новых областях. Например, в обычной жизни алюминий в смеси с кремнием и магнием можно встретить буквально на дороге, т.е. в алюминиевых колесах, в двигателях, шасси и других деталях современных автомобилей. Что касается алюминиево-цинкового сплава, скорее всего, вы держите его в руках прямо сейчас, поскольку именно этот сплав широко используется в производстве мобильных телефонов и планшетных ПК. Тем временем ученые продолжают разрабатывать новые алюминиевые сплавы.
Даже очень небольшое количество примесей может резко изменить свойства металла, что позволит использовать его в новых областях. Например, в обычной жизни алюминий в смеси с кремнием и магнием можно встретить буквально на дороге, т.е. в алюминиевых колесах, в двигателях, шасси и других деталях современных автомобилей. Что касается алюминиево-цинкового сплава, скорее всего, вы держите его в руках прямо сейчас, поскольку именно этот сплав широко используется в производстве мобильных телефонов и планшетных ПК. Тем временем ученые продолжают разрабатывать новые алюминиевые сплавы.
Современное строительство, автомобилестроение, авиация, энергетика, пищевая и другие отрасли промышленности были бы невозможны без алюминия. Кроме того, алюминий стал символом прогресса: все современные устройства и транспортные средства сделаны из алюминия. (ссылка на раздел «Использование»)
Если бы в автомобиле все медные провода были заменены алюминиево-циркониевыми, вес автомобиля был бы на 12 кг меньше
По оценкам Международного института алюминия (IAI), в настоящее время их 400 млн. тонн алюминия используется в инфраструктуре, на транспорте и в быту
тонн алюминия используется в инфраструктуре, на транспорте и в быту
Казалось бы, сочетания перечисленных выше качеств уже достаточно, чтобы сделать алюминий лучшим выбором в промышленности, однако есть еще одно не менее важное свойство: алюминий можно использовать повторно снова и снова. И алюминий, и его сплавы можно переплавлять и использовать повторно без ущерба для механических свойств. Ученые подсчитали, что 1 кг переработанных алюминиевых банок может сэкономить до 8 кг бокситов, 4 кг различных фторидов и до 15 кВт/ч электроэнергии.
Около 75% алюминия, произведенного за время существования алюминиевой промышленности, все еще используется сегодня.
Фото: © Shutterstock и © Русал.
Al Информация об элементе алюминия: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
Кристаллическая структура алюминия
Твердотельная структура алюминия Гранецентрированная кубическая .
Кристаллическая структура может быть описана с точки зрения ее элементарной ячейки. Единичные Клетки повторяются в трехмерном пространстве, образуя структуру.
Параметры элементарной ячейки
Элементарная ячейка представлена параметрами решетки, которые являются длинами ребер ячейки Постоянные решетки (a, b и c)
| a | b | c |
|---|---|---|
| 404,95 пм | 404,95 пм | 404,95 пм |
и углы между ними Углы решетки (альфа, бета и гамма).
| альфа | бета | Гамма |
|---|---|---|
| π/2 | π/2 | π/2 |
. y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможные симметричные расположения частиц в трехмерном пространстве описываются 230 пространственными группами (219различные типы или 230, если хиральные копии считаются различными.
| Space Group Name | Fm_ 3m | |
| Oxidation States | Space Group Number | 225 |
| Crystal Structure | Face Centered Cubic |
Aluminium Atomic and Orbital Properties
Атомы алюминия имеют 13 электронов и структуру электронной оболочки [2, 8, 3] с символом атомного термина (квантовые числа) 2 P 1/2 .
| Atomic Number | 13 |
| Number of Electrons (with no charge) | 13 |
| Number of Protons | 13 |
| Mass Number | 27 |
| Number нейтронов | 14 |
| Структура оболочки (электронов на энергетический уровень) | 2, 8, 3 |
| Электронная конфигурация | [Ne] 3s2 3p1 |
| Valence Electrons | 3s2 3p1 |
| Valence (Valency) | 3 |
| Main Oxidation States | 3 |
| Oxidation States | -2, – 1, 1, 2, 3 |
| Символ атомного термина (квантовые числа) | 2 P 1/2 |
5 Модель электрона0461
Электронная конфигурация основного состояния алюминия – нейтральный атом алюминия
Сокращенная электронная конфигурация алюминия
Сокращенная электронная конфигурация основного состояния нейтрального атома алюминия [Ne] 3s2 3p1. Часть конфигурации алюминия, эквивалентная благородному газу предыдущего периода, обозначается аббревиатурой [Ne]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 3s2 3p1, электроны в самой внешней оболочке, определяют химические свойства элемента.
Часть конфигурации алюминия, эквивалентная благородному газу предыдущего периода, обозначается аббревиатурой [Ne]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 3s2 3p1, электроны в самой внешней оболочке, определяют химические свойства элемента.
Полная электронная конфигурация нейтрального алюминия
Полная электронная конфигурация атома алюминия в основном состоянии, Полная электронная конфигурация
1s2 2s2 2p6 3s2 3p1 Принцип и правило Хунда.

Атомная структура алюминия
Атомный радиус алюминия составляет 118 пм, а его ковалентный радиус равен 118 пм.
| Вычисленный атомный радиус | 118 пм (1,18 Å) |
| Atomic Radius Empirical | 125 pm (1.25 Å) |
| Atomic Volume | 9.99 cm3/mol |
| Covalent Radius | 118 pm (1.18 Å) |
| Van der Waals Radius | 184 pm |
| Neutron Cross Section | 0.233 |
| Neutron Mass Absorption | 0.03 |
Atomic Spectrum of Aluminium
Алюминий Химические свойства: Энергия ионизации алюминия и сродство к электрону
Сродство к электрону алюминия составляет 42,5 кДж/моль.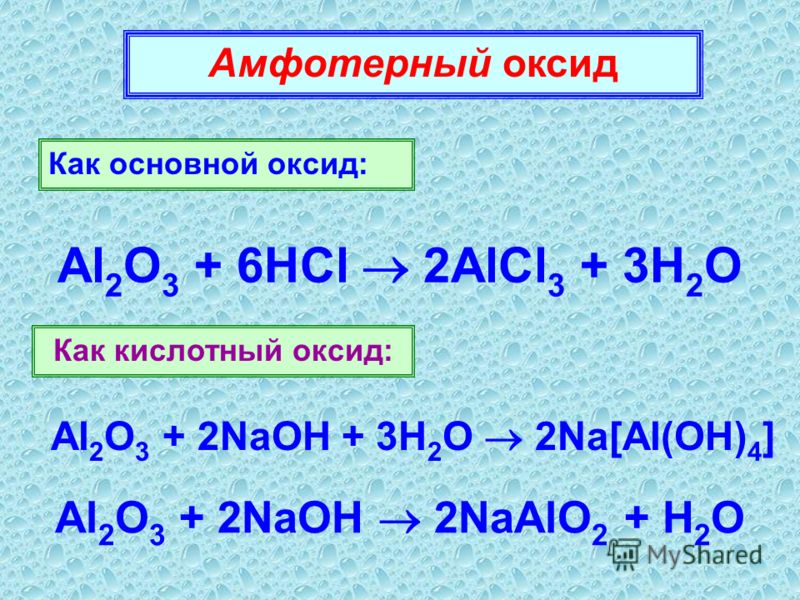
| Valence | 3 |
| Electronegativity | 1.61 |
| ElectronAffinity | 42.5 kJ/mol |
Ionization Energy of Aluminium
Refer to table below for Ionization energies of Aluminium
| Ionization energy number | Enthalpy – kJ/mol |
|---|---|
| 1st | 577.5 |
| 2nd | 1816.7 |
| 3rd | 2744.8 |
| 4th | 11577 |
| 5th | 14842 |
| 6th | 18379 |
| 7th | 23326 |
| 8th | 27465 |
| 9th | 31853 |
| 10th | 38473 |
| 11th | 42647 |
| 12th | 201266 |
| 13th | 222316 |
Aluminium Physical Properties
Refer к приведенной ниже таблице для физических свойств алюминия
| Плотность | 2,7 г/см3 (когда жидкость при т. пл. плотностью $2,375 г/см3) пл. плотностью $2,375 г/см3) |
| Molar Volume | 9.99 cm3/mol |
Elastic Properties
| Young Modulus | 70 |
| Shear Modulus | 26 GPa |
| Bulk Modulus | 76 GPa |
| Коэффициент Пуассона | 0,35 |
Твердость алюминия – испытания для измерения твердости элемента
| Твердость по шкале Мооса | 2,75 МПа |
| ВИКЕРСА. Электрические свойства алюминия см. в таблице ниже.0482 Superconducting Point | 1.175 |
Aluminium Heat and Conduction Properties
| Thermal Conductivity | 235 W/(m K) |
| Thermal Expansion | 0.0000231 /K |
Aluminium Magnetic Свойства
| Магнитный тип | Парамагнитный |
| Точка Кюри | – |
| Массовая магнитная восприимчивость | 7. 8e-9 m3/kg 8e-9 m3/kg |
| Molar Magnetic Susceptibility | 2.1e-10 m3/mol |
| Volume Magnetic Susceptibility | 0.0000211 |
Optical Properties of Aluminium
| Refractive Индекс | – |
Акустические свойства алюминия
| Скорость звука | 5100 м/с |
| Melting Point | 933.47 K (660.32°C, 1220.576 °F) |
| Boiling Point | 2792 K (2518.85°C, 4565.929999999999 °F) |
| Критическая температура | – |
| .0482 10.7 kJ/mol | |
| Heat of Vaporization | 293 kJ/mol |
| Heat of Combustion | – |
Aluminium Isotopes – Nuclear Properties of Aluminium
Aluminium has 22 isotopes, with between 21 и 42 нуклона. Алюминий имеет 1 стабильный природный изотоп.
Алюминий имеет 1 стабильный природный изотоп.
Изотопы алюминия – Природные стабильные изотопы: 27Al.
| Изотоп | Z | N | Isotope Mass | % Abundance | T half | Decay Mode | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 21Al | 13 | 8 | 21 | Synthetic | ||||||||
| 22Al | 13 | 9 | 22 | Synthetic | ||||||||
| 23Al | 13 | 10 | 23 | Synthetic | ||||||||
| 24Al | 13 | 11 | 24 | Synthetic | ||||||||
| 25Al | 13 | 12 | 25 | Synthetic | ||||||||
| 26Al | 13 | 13 | 26 | Синтетический | ||||||||
| 27AL | 13 | 14 | 27 | 100% | STABLE | 100% | STABL0482 13 | 15 | 28 | Synthetic | ||
| 29Al | 13 | 16 | 29 | Synthetic | ||||||||
| 30Al | 13 | 17 | 30 | Synthetic | ||||||||
| 31Al | 13 | 18 | 31 | Synthetic | ||||||||
| 32Al | 13 | 19 | 32 | Synthetic | ||||||||
| 33Al | 13 | 20 | 33 | Synthetic | ||||||||
| 34Al | 13 | 21 | 34 | Synthetic | ||||||||
| 35Al | 13 | 22 | 35 | Synthetic | ||||||||
| 36Al | 13 | 23 | 36 | Synthetic | ||||||||
| 37Al | 13 | 24 | 37 | Synthetic | ||||||||
| 38Al | 13 | 25 | 38 | Synthetic | ||||||||
| 39Al | 13 | 26 | 39 | Synthetic | ||||||||
| 40Al | 13 | 27 | 40 | Synthetic | ||||||||
| 41Al | 13 | 28 | 41 | Synthetic | ||||||||
| 42Al | 13 | 29 | 42 | Synthetic |
Aluminium Oxide Formula – Structure, Properties, Uses, Sample Questions
Оксид алюминия представляет собой химическое вещество, состоящее из атомов алюминия и кислорода. Алюминий теряет в химическом процессе три электрона, тогда как кислород приобретает два. Его часто называют глиноземом. Альфа-глинозем, глинозем, алунд или алкоксид – другие его названия. Оксид алюминия представляет собой белое аморфное вещество без запаха. Благодаря своим многочисленным полезным свойствам это химическое вещество вносит значительный вклад в широкий спектр приложений для продления жизни и социального обеспечения. Его также можно найти в бокситах.
Алюминий теряет в химическом процессе три электрона, тогда как кислород приобретает два. Его часто называют глиноземом. Альфа-глинозем, глинозем, алунд или алкоксид – другие его названия. Оксид алюминия представляет собой белое аморфное вещество без запаха. Благодаря своим многочисленным полезным свойствам это химическое вещество вносит значительный вклад в широкий спектр приложений для продления жизни и социального обеспечения. Его также можно найти в бокситах.
Формула оксида алюминия
Оксид алюминия встречается в природе в виде корунда, рубинов, сапфиров и изумрудов. Это щелочноземельное соединение, которое взаимодействует как с кислотами, так и с основаниями. Он выглядит белым и существует в виде твердого тела.
Не имеет запаха и не растворяется в воде. Эта молекула чаще всего встречается в кристаллической форме, известной как -оксид алюминия или корунд. Из-за своей твердости он обычно используется в качестве абразива и в режущих инструментах.
Химическая формула оксида алюминия: Al 2 O 3 неорганический химический реагент .
Структура оксида алюминия
Два атома алюминия связываются с двумя атомами кислорода каждый, образуя структуру оксида алюминия, что означает, что он имеет три атома кислорода.
Физические свойства оксида алюминия
- Оксид алюминия представляет собой беловатое твердое вещество.
- Нерастворим в воде, а также во всех других растворителях.
- Хотя оксид алюминия является электрическим изолятором, он проявляет теплопроводность в керамическом материале.
- Оксид алюминия имеет относительно высокие температуры плавления (2345К) и кипения (3250К).
- Оксид алюминия имеет плотность 3,987 г/см 3 .
Химические свойства оксида алюминия
- Алюминат натрия и вода образуются при взаимодействии оксида алюминия с гидроксидом натрия. Эта реакция протекает при температуре от 900 до 1100°С. Эта реакция, в которой оксид алюминия служит кислотой, дает соль и воду.

Al 2 O 3 + 2NaOH → 2NaAlO 2 + H 2 O
- Металлические оксиды обычно являются основными по своей природе, хотя оксиды алюминия являются ампероксидами. Как следствие, он действует как кислота и как основание. В этом случае он действует не как кислота, а как основание.
Алюминий 2 О 3 + Н 2 SO 4 → Al 2 (SO4) 3 + H 2 O
Это известно как реакция нейтрализации.
- Оксид алюминия содержит оксид-ионы, поэтому взаимодействует с кислотами аналогично оксидам натрия или магния. Раствор хлорида алюминия образуется при взаимодействии оксида алюминия с горячей разбавленной соляной кислотой.
Al 2 O 3 + 6HCl → 2AlCl 3 + 3H 2 O
Использование оксида алюминия
- Оксид алюминия в основном используется в качестве абразива из-за его твердости и прочности.
 Оксид алюминия используется в качестве заменителя технического алмаза при производстве наждачной бумаги, режущих инструментов и других изделий.
Оксид алюминия используется в качестве заменителя технического алмаза при производстве наждачной бумаги, режущих инструментов и других изделий. - Чаще всего используется в качестве керамического материала.
- Используется как пластиковый наполнитель.
- Его часто используют в качестве ингредиента солнцезащитного крема, губной помады, румян и краски для ногтей.
- Используется в производстве стекла. а алюмосиликатное стекло представляет собой обычное стекло, содержащее оксид алюминия. Алюмосиликатное стекло содержит 5–10 % оксида алюминия.
- Используется в качестве катализатора в различных промышленных процессах. Например, оксид алюминия используется в качестве катализатора в процессе Клауса, который превращает сероводородные отходы в элементарную серу.
- Оксид алюминия можно использовать для удаления воды из газовых потоков.
- Хлопья оксида алюминия используются в красках для придания отражающего или декоративного вида.
- Оксид алюминия используется в качестве электрического изолятора в интегральных схемах.

- Прозрачный оксид алюминия используется в натриевых лампах и компактных люминесцентных лампах.
Примеры вопросов
Вопрос 1. Вреден ли оксид алюминия для человека?
Ответ:
По сравнению с другими химическими веществами оксид алюминия менее опасен. Однако при увеличении концентрации увеличивается токсичность.
Вопрос 2: Каково назначение оксида алюминия?
Ответ:
Оксид алюминия представляет собой высококачественный керамический оксид, используемый в различных целях в производстве адсорбентов и катализаторов. Он также используется в аэрокосмической промышленности и в производстве различных экономически важных химических веществ.
Вопрос 3: Что такое оксид алюминия кислотный или основной?
Ответ:
Оксид алюминия (III) является амфотерным оксидом металла, что означает, что он обладает как кислотными, так и основными свойствами.
Кислотный или основной характер Al 2 O 3 определяется природой другого реагента в химическом процессе.
Вопрос 4: Какие жидкости реагируют с алюминием?
Ответ:
Хлорид алюминия и газообразный водород образуются при соединении алюминия с разбавленной соляной кислотой. При комнатной температуре хлор и жидкий бром реагируют с алюминием.
Вопрос 5: Почему алюминий не может реагировать с водой?
Ответ:
Металлический алюминий быстро образует тонкое покрытие из оксида алюминия толщиной в несколько миллиметров, что препятствует его реакции с водой. Когда этот слой подвергается коррозии, происходит реакция, в результате которой выделяется чрезвычайно горючий газообразный водород.
Вопрос 6: Является ли оксид алюминия газом?
Ответ:
Al 2 O обычно встречается в виде газа, поскольку твердое состояние неустойчиво при комнатной температуре и стабильно только при температуре от 1050 до 1600°C.
Оксид алюминия(I) получают кипячением Al и Al 2 O 3 в вакууме в присутствии SiO 2 и C с последующей конденсацией продуктов.
Разница между оловом и алюминием
Основное отличие — олово и алюминий
Олово и алюминий — это химические элементы, которые можно найти в p-блоке периодической таблицы. Обычно они рассматриваются как металлические элементы. Они имеют различное применение в зависимости от их химических и физических свойств. Олово можно найти в двух типах: альфа-олово и бета-олово. Бета-олово представляет собой металлическую форму олова, тогда как альфа-олово представляет собой неметаллическую форму. Алюминий считается металлоидом. Хотя между этими двумя элементами существует много различий, основное различие между оловом и алюминием заключается в том, что олово имеет серебристо-белый вид, тогда как алюминий имеет серебристо-серый вид.
Ключевые области применения
1. Что такое олово
Что такое олово
– Определение, химические свойства, применение
2. Что такое алюминий
– Определение, химические свойства, применение
3. В чем разница между оловом и алюминием
– Сравнение основных различий
, Олово, Металл, Металлоид, Неметалл, Олово
Что такое олово
Олово — это химический элемент, имеющий символ « Sn ». Символ Sn используется для латинского названия «Stannum». Атомный номер олова 50. Молярная масса около 118,71 г/моль. Это элемент p-блока. Электронная конфигурация олова [Kr] 4d 10 5s 2 5p 2 . Он находится в 14 группе периодической таблицы элементов.
Олово — мягкий серебристо-белый металл. Он используется для покрытия стальных банок, поскольку может действовать как защитный оксидный слой. Бронза – это металлический сплав, полученный из олова и меди. Металл олова податлив и пластичен. Температура плавления этого металла составляет 231,93°С, а температура кипения составляет около 2602°С.
Металл олова податлив и пластичен. Температура плавления этого металла составляет 231,93°С, а температура кипения составляет около 2602°С.
Рисунок 1: Альфа- и бета-олова
Существует два типа олова: альфа- и бета-олова. Альфа-олово представляет собой неметаллическую форму олова и известен как серое олово. Он стабилен при более низких температурах. Кристаллическая структура альфа-олова представляет собой кубическую кристаллическую структуру алмаза. Бета-олово представляет собой металлическую форму олова и известен как белое олово. Он стабилен при температурах выше комнатной. Поскольку альфа-олово представляет собой неметаллическую форму, оно не имеет другого применения, кроме использования в качестве полупроводникового материала.
Олово имеет две основные степени окисления: +2 и +4. Поэтому наиболее распространенными оксидами олова являются SnO и SnO 2 . Он очень устойчив к коррозии, так как может образовывать защитный слой на своей поверхности путем окисления до оксида олова.
Что такое алюминий
Алюминий — это химический элемент, имеющий символ «Al». Это мягкий металл серебристо-серого цвета. Имеет блестящий вид. Алюминий имеет небольшой вес по сравнению с другими металлами. Он податлив, т. е. может деформироваться под давлением. Эти свойства алюминия позволили использовать его в авиастроении.
Рисунок 2: Кусок алюминия
Кроме того, он является хорошим проводником тепла и электричества. Степень пластичности у алюминия высокая; это означает, что алюминий можно легко расплавить и превратить в проволочные структуры. Алюминиевая фольга непроницаема, даже если она очень тонкая.
При рассмотрении его химических свойств атомный вес алюминия составляет 26,98 ед. Молярная масса алюминия составляет около 26,98 г/моль. Атомный номер алюминия 13. Электронная конфигурация [Ne] 3s 2 3 шт. 1 . Температура плавления алюминия составляет около 660,32 °С, а температура кипения — около 2470 °С.
Алюминий находится в 13 группе периодической таблицы. Он принадлежит p-блоку и является металлоидом. Это означает, что он имеет умеренные свойства по сравнению с металлами и неметаллами. Алюминий очень пластичен. Это означает, что он может быть вытянут в тонкую проволоку.
Алюминий имеет множество применений. Примеры включают производство деталей для автомобилей, самолетов, в качестве упаковочного материала, контейнеров, строительных целей, производство предметов домашнего обихода, производство металлических сплавов и т. д.
Разница между оловом и алюминием
Определение
Олово: Олово — это химический элемент, имеющий символ «Sn».
Алюминий: Алюминий — это химический элемент, имеющий символ «Al».
Атомный номер
Олово: Атомное количество олова составляет 50.
Алюминий: Атомное число алюминия составляет 13.
Молярная масса
Олово: Молярная масса олова составляет около 118,71. г/моль.
г/моль.
Алюминий: Молярная масса алюминия составляет около 26,98 г/моль.
Температуры плавления и кипения
Олово: Температура плавления олова составляет 231,93 °С, а температура кипения составляет около 2602 °С.
Алюминий: Температура плавления алюминия составляет 660,32 °C, а температура кипения составляет около 2470 °C.
Внешний вид
Олово: Олово выглядит как серебристо-белый металл.
Алюминий: Алюминий выглядит как серебристо-серый металл.
Электронная конфигурация
Олово: Электронная конфигурация олова [Kr] 4d 10 5s 2 5p 2 .
Алюминий: Электронная конфигурация алюминия [Ne] 3s 2 3p 1 .
Общие степени окисления
Олово: Наиболее распространенные и стабильные степени окисления олова +2 и +4.
Алюминий: Наиболее распространенная и стабильная степень окисления алюминия +3.
Заключение
Олово и алюминий — важные химические элементы, имеющие широкий спектр применения. Есть много различий между оловом и алюминием. Основное различие между оловом и алюминием заключается в том, что олово имеет серебристо-белый цвет, тогда как алюминий имеет серебристо-серый цвет.
Изображение предоставлено:
1. «Алюминий». Википедия, Фонд Викимедиа, 22 ноября 2017 г., доступно здесь.
2. «Олово (Sn)». Encyclopædia Britannica, Encyclopædia Britannica, Inc., 25 августа 2014 г., доступно здесь.
3. «Жесть». Википедия, Фонд Викимедиа, 20 ноября 2017 г., доступно здесь.
Изображение предоставлено:
1. «Sn-Alpha-Beta» Alchemist-hp (разговор) (www.pse-mendelejew.de) — собственная работа (CC BY-SA 3.0 de) через Commons Wikimedia
2. « Алюминий-4» Неизвестно — (CC BY 3.0) через Commons Wikimedia
Молярная масса алюминия и свойства вещества
- Молярная масса алюминия — что это за химический элемент?
- Как найти молярную массу алюминия?
- Пример использования молярной массы алюминия в задании
- Физические свойства алюминия
- Химические свойства алюминия
- Изотопы алюминия
- Как люди получают алюминий?
- Где используется алюминий?
Алюминий нашел широкое применение в различных областях. Свойства алюминиевых сплавов делают их пригодными для использования практически во всех существующих отраслях промышленности. С этим веществом учащиеся сталкиваются при выполнении домашних заданий по химии или лабораторных работ. Поэтому мы создали полезную инструкцию по определению молярной массы Al, так как это самая распространенная задача.
Свойства алюминиевых сплавов делают их пригодными для использования практически во всех существующих отраслях промышленности. С этим веществом учащиеся сталкиваются при выполнении домашних заданий по химии или лабораторных работ. Поэтому мы создали полезную инструкцию по определению молярной массы Al, так как это самая распространенная задача.
Молярная масса алюминия. Что это за химический элемент?
Название: Алюминий (Al).
Атомный вес: 26,98.
Молекулярная масса: 26,981539 а.е.м.
Количество атомов: Алюминий содержит только один атом, который состоит из положительно заряженного ядра с 13 протонами, 14 нейтронами внутри и трех электронных оболочек с 13 электронами.
Температура плавления: 660 °C.
Точка кипения: 2518,82 °С.
Молярный объем: 10,0 см³/моль.
Алюминий — легкий и ковкий металл белого цвета, серебристо-матового цвета, благодаря тонкой оксидной пленке, которая моментально покрывает его на воздухе. Он принадлежит к III группе периодической системы, обозначается символом Al, имеет атомный номер 13 и атомную массу 26,98154.
Он принадлежит к III группе периодической системы, обозначается символом Al, имеет атомный номер 13 и атомную массу 26,98154.
В 16 веке знаменитый Парацельс сделал первый шаг к добыче алюминия. Из квасцов он выделил квасцовую землю, которая содержала оксид неизвестного тогда металла. В 18 веке к этому эксперименту вернулся немецкий химик Андреас Маргграф. Он назвал оксид алюминия «окись алюминия», что в переводе с латыни означает «вяжущий». В то время металл не был популярен, так как люди не находили его в чистом виде. Лишь в 1855 году в Париже на Всемирной выставке металлический алюминий произвел фурор.
Как найти молярную массу алюминия?
Чтобы найти молярную массу алюминия, нужно следовать алгоритму:
- Подготовьте таблицу Менделеева, чтобы узнать валентность данного элемента и атомные единицы массы.
- Теперь вам нужно написать химическое уравнение. Элемент всего один – Al, поэтому формула соответственно будет содержать только атом алюминия в нашей задаче.
 Если бы у вас было соединение оксида алюминия, уравнение было бы Al2O3. Вы можете составить такую формулу, изучив валентности элементов периодической таблицы.
Если бы у вас было соединение оксида алюминия, уравнение было бы Al2O3. Вы можете составить такую формулу, изучив валентности элементов периодической таблицы. - Вернитесь к периодической таблице и запишите валентность алюминия. Алюминий в своих соединениях проявляет валентность, равную III. Эти данные понадобятся вам в дальнейших расчетах.
- Зная валентность, можно найти количество молей в алюминии. В нашей задаче атом всего один, и это Al, так что формула будет выглядеть так:
M = Ar, Ar(Al) = Al · 1 моль = 26,98 г/моль.
Если вашим веществом, например, будет сульфат алюминия, то его химическая формула будет выглядеть так: Al2 SO4)3. Как видите, сульфат алюминия содержит три элемента. Следовательно, нужно сложить массы этих элементов и найти моль вещества.
- Вы на пути к финалу – остался всего один шаг. Вам нужно рассчитать массу одного моля алюминия. Можно воспользоваться такой формулой:
м(Ал) = Рр(Ал)/ЧА=27/6,02·1023=4,3·1023г.
Как видите, мы округли число 26,98 до 27 для удобства расчетов.

Если вы не до конца понимаете алгоритм или затрудняетесь выучить все эти формулы, вы всегда можете воспользоваться помощью нашей службы написания рефератов.
Пример использования молярной массы алюминия в задаче
Знать и находить молярную массу алюминия необходимо при решении различных задач. В качестве помощи при выполнении домашних заданий мы рассмотрим один из них.
Задание: Растворение оксида алюминия.
Решение: С одной стороны, масса оксида алюминия равна:
В этой формуле:
- V – объем растворенного оксида алюминия;
- ρ – его плотность;
- h – толщина барьерного слоя;
- S – площадь оксидной пленки.
С другой стороны, масса алюминия в растворе равна:
В этой формуле:
- vAl3 + количество алюминия;
- cAl3+ – концентрация ионных соединений алюминия;
- mAl – молярная масса алюминия;
- Vp – объем раствора;
- mAl3+ – масса алюминия в растворе.

Так как в оксиде алюминия на два атома алюминия приходится три атома кислорода, массу оксида можно выразить через массу металла:
Таким образом, получаем следующие данные:
Из Предлагаемый список, фосфорная и соляная кислоты могут быть использованы для растворения оксида алюминия:
Это кислая соль, которая образуется, так как кислота взята в большом избытке. В противном случае растворению мешал бы нерастворимый фосфат алюминия AlPO4.
Кремниевая кислота не может быть использована для растворения оксида алюминия, так как она сама нерастворима в воде.
Физические свойства алюминия
Металлический алюминий характеризуется высокой электропроводностью, теплопроводностью, устойчивостью к коррозии и морозу, пластичностью. Хорошо поддается штамповке, ковке, волочению, прокатке. Алюминий хорошо сваривается различными видами сварки.
Алюминий имеет высокое сродство к кислороду и на воздухе покрыт тонкой прочной пленкой оксида алюминия. Эта пленка защищает металл от последующего окисления и обеспечивает хорошие антикоррозионные свойства. Алюминий устойчив к морской, а пресная вода практически не взаимодействует с органическими кислотами, концентрированной или разбавленной азотной кислотой.
Эта пленка защищает металл от последующего окисления и обеспечивает хорошие антикоррозионные свойства. Алюминий устойчив к морской, а пресная вода практически не взаимодействует с органическими кислотами, концентрированной или разбавленной азотной кислотой.
Химические свойства алюминия
Алюминий является довольно активным амфотерным металлом. В нормальных условиях прочная оксидная пленка определяет его сопротивление. Если оксидная пленка разрушена, алюминий действует как динамичный восстанавливающий металл. При высоких температурах металл взаимодействует с кислородом. При нагревании идут реакции с серой, фосфором, азотом, углеродом, йодом. В обычных условиях металл образует отличное химическое соединение с хлором, бромом, магнием, калием. С водородом реакции нет.
При условии очистки от оксидной пленки происходит интенсивное взаимодействие с водой. Реакции с разбавленными кислотами протекают быстро. Реакции с концентрированными азотной и серной кислотами происходят при нагревании. Алюминий легко реагирует со щелочами. Практическое применение в металлургии нашла способность восстанавливать металлы из оксидов и солей — реакция алюминотермии. Также в результате реакции алюминия (Al), воды (h3O) и хлорида натрия (NaCl), образуется хлорид алюминия (AlCl3), водород (h3), гидроксид натрия (NaOH).
Алюминий легко реагирует со щелочами. Практическое применение в металлургии нашла способность восстанавливать металлы из оксидов и солей — реакция алюминотермии. Также в результате реакции алюминия (Al), воды (h3O) и хлорида натрия (NaCl), образуется хлорид алюминия (AlCl3), водород (h3), гидроксид натрия (NaOH).
Изотопы алюминия
Известно, что в природе алюминий может находиться в виде одного стабильного изотопа 27Al. Массовое число равно 27. Ядро изотопа алюминия 27Al содержит тринадцать протонов и четырнадцать нейтронов. Существуют радиоактивные изотопы алюминия с массовыми числами от 21 до 42, среди которых наиболее долгоживущий изотоп 26Al, имеющий период полураспада 720 тысяч лет.
Как люди получают алюминий?
Алюминий входит в число металлов и занимает третье место среди всех элементов по распространенности в земной коре. Этот реагент составляет примерно 8% земной коры, а алюминий встречается в тканях животных, растений как микроэлемент. В природе встречается в связанном виде в виде горных пород, минералов.


 Изготавливают детали сложной конфигурации, главным образом в авто- и авиастроении.
Изготавливают детали сложной конфигурации, главным образом в авто- и авиастроении.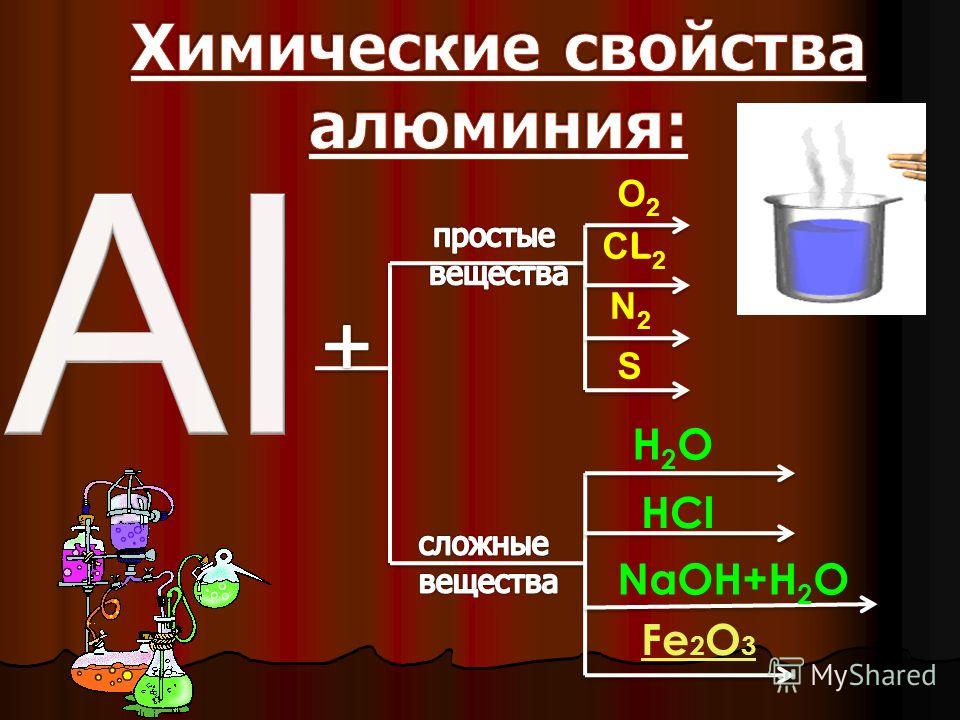

 Оксид алюминия используется в качестве заменителя технического алмаза при производстве наждачной бумаги, режущих инструментов и других изделий.
Оксид алюминия используется в качестве заменителя технического алмаза при производстве наждачной бумаги, режущих инструментов и других изделий.
 Кислотный или основной характер Al 2 O 3 определяется природой другого реагента в химическом процессе.
Кислотный или основной характер Al 2 O 3 определяется природой другого реагента в химическом процессе. Оксид алюминия(I) получают кипячением Al и Al 2 O 3 в вакууме в присутствии SiO 2 и C с последующей конденсацией продуктов.
Оксид алюминия(I) получают кипячением Al и Al 2 O 3 в вакууме в присутствии SiO 2 и C с последующей конденсацией продуктов.