Химический элемент аргон: Аргон – Wikiwand
alexxlab | 25.02.2023 | 0 | Разное
Характеристика элемента аргона – Telegraph
Характеристика элемента аргона
====================================
>> Перейти к скачиванию
====================================
Проверено, вирусов нет!
====================================
Прочие характеристики. Теплопроводность. (300 K) 0,0164 Вт/(м·К). Номер CAS · 7440-37-1. 18. Аргон. Ar. 39,948. 3s23p6. О советском/российском предприятии см. НИИ «Аргон». Арго́н элемент 18-й группы периодической таблицы химических элементов (по.
Аргон. Аргон (лат. Argon), Ar, химический элемент VIII группы периодической системы Менделеева, относится к инертным газам; атомный номер 18.
АРГОН (лат. Argon), Ar, химический элемент VIII группы периодической системы, атомный номер 18, атомная масса 39,948, относится к инертным, или.
АРГОН, Ar (лат. Argon * а. argon; н. Argon; ф. argon; и. argon), химический элемент главной подгруппы VIII группы периодической системы Менделеева.
Такое определение газ аргон получил благодаря своим инертным. На рисунке название химического элемента и его свойства.
Аргон, Вступление. Символ, Ar. Латинское название, Argon. Тип вещества, простой химический элемент. Первооткрыватель, У. Рамзай, Дж. Рэлей.
Основные характеристики аргона (Ar): атомная и молекулярная масса. а относительная атомная масса элемента (Ar) во сколько раз средняя масса.
АРГОН (от греч. argos – недеятельный; лат Argon) Ar, хим. элемент VIII гр. периодич. системы, относится к благородным газам, ат. н. 18, ат. м. 39,948.
Характеристика элемента. У кислорода по сравнению с атомом азота падает величина энергии ионизации, что вызвано спариванием электронов.
Аргон. Арго́н химический элемент с атомным номером 18. Третий по. и определенные молекулярные характеристики обеспечивают его особые.
Какие характеристики атома меняются в Периодической системе. Неметаллические свойства хлора больше чем у серы, но меньше, чем у аргона.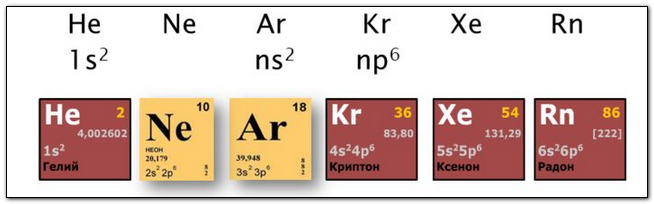
Сообщаем о переезде склада ООО Аргон-КР. Адрес. незначительными элементами высокотехнологичного. Сводный файл тех. характеристик.
Адрес трех электронов этого элемента таков: 1s2 2s1. Действительно, химическое поведение аргона настолько выделяется своей пассивностью.
Периодическая таблица элементов является графическим выражением. ( Be), магнием (Mg) и кальцием (Ca), а не с неоном (Ne) и аргоном (Ar). такая важная характеристика элемента, как его относительная атомная масса.
Рассмотрены результаты определения оптических характеристик и эле- ментного. элементов кислорода, аргона и материала катода на уровне.
Валентность – способность атомов химических элементов. Аргон / Argon. Эта характеристика химических элементов не является.
Жидкий и газообразный аргон в баллонах ГОСТ 10157-79 можно купить в компании «Газпродукт». Добывается аргон из воздуха (этот элемент – третий по распространенности в атмосфере. Технические характеристики.
аэропрочностного проектирования самолета «Аргон» по специальности. и диссипативных характеристик элементов конструкции ракеты-носителя.
и диссипативных характеристик элементов конструкции ракеты-носителя.
элемента аргона, существование которого явно противо- речило 3. надежные измерения характеристик газов, жидкостей и твердых тел.
Определите относительную плотность хлора по аргону и аргона по хлору. Для количественной характеристики состава вещества, смеси или раствора. Массовая доля элемента в соединении – отношение массы данного.
ХиМиК.ru – Аргон – Большая Советская Энциклопедия
Аргон (лат. Argon), Ar, химический элемент VIII гр. периодической системы Менделеева, относится к инертным газам; атомный номер 18, атомная масса 39,948. При обычных условиях аргон — газ без цвета, запаха и вкуса. К открытию аргона привело обнаруженное в 1892 Дж. Рэлеем превышение на 0,0016 г/л (при 0°С и 101 325 н/м2) плотности азота из воздуха по сравнению с плотностью азота, полученного из его соединений. В 1894 Рэлей и У. Рамзай выделили из азота воздуха газ, обладающий химической инертностью (греч. argys — бездеятельный). После открытия других инертных газов они были объединены в отдельную нулевую группу периодической системы; теперь общепринято рассматривать их как главную подгруппу VIII гр.
argys — бездеятельный). После открытия других инертных газов они были объединены в отдельную нулевую группу периодической системы; теперь общепринято рассматривать их как главную подгруппу VIII гр.
В природе аргон присутствует только в свободном виде. Атмосфера содержит 16-1012 т аргона, земная кора 0,165·1012 т, вода 0,752·1012 т. Объёмная концентрация аргона в воздухе 0,93%. Атмосферный аргон состоит из трёх стабильных изотопов: 36Ar (0,337% ), 38Ar (0,063% ) и 40Ar (99,600% ). Преобладание тяжёлого изотопа связано с его образованием при радиоактивном распаде природного калия 40K (в результате общее количество аргона в атмосфере непрерывно возрастает). Вследствие высокого содержания 40Ar атомная масса Ar больше, чем у следующего за ним в таблице Менделеева К. Из искусственно полученных радиоактивных изотопов аргона для радиоактивной метки наиболее пригоден 37Ar с периодом полураспада 35,0 дней. Плотность аргона (при 0°С и 101 325 н/м2) 1,7839 кг/м3, tпл —189,3°C, tkип —185,9°C. В 1 л воды при нормальных условиях растворяется 51,9 см3аргона. В металлах аргон практически не растворим. Молекула аргона одноатомна. Энергия первичной ионизации аргона велика (15,755 эв или 2,5241·10-18 адж), сродством к электрону аргон не обладает. Все попытки получить валентные соединения аргона оканчивались неудачей. Аргон способен образовывать соединения включения (клатраты) с веществами, имеющими в своих кристаллических решётках полости с размерами, приблизительно соответствующими диаметру атома аргона (H2O, D2O, фенол, гидрохинон). Наиболее полно изучен Ar·6H2O, впервые синтезированный в 1896 П. Вийаром при кристаллизации воды в атмосфере аргона (давление аргон 15,5 Мн/м2). температура разложения Ar·6H2O при 101 325 н/м2 42,0°C. Аргон с фенолом даёт соединение Ar·3С6Н5ОН.
Плотность аргона (при 0°С и 101 325 н/м2) 1,7839 кг/м3, tпл —189,3°C, tkип —185,9°C. В 1 л воды при нормальных условиях растворяется 51,9 см3аргона. В металлах аргон практически не растворим. Молекула аргона одноатомна. Энергия первичной ионизации аргона велика (15,755 эв или 2,5241·10-18 адж), сродством к электрону аргон не обладает. Все попытки получить валентные соединения аргона оканчивались неудачей. Аргон способен образовывать соединения включения (клатраты) с веществами, имеющими в своих кристаллических решётках полости с размерами, приблизительно соответствующими диаметру атома аргона (H2O, D2O, фенол, гидрохинон). Наиболее полно изучен Ar·6H2O, впервые синтезированный в 1896 П. Вийаром при кристаллизации воды в атмосфере аргона (давление аргон 15,5 Мн/м2). температура разложения Ar·6H2O при 101 325 н/м2 42,0°C. Аргон с фенолом даёт соединение Ar·3С6Н5ОН. В соединениях включения, например в SO2·6H2O, можно SO2 изоморфно заместить Ar (работы Б. А. Никитина и др.), что даёт возможность синтезировать Ar·6H2O при нормальном давлении.
В соединениях включения, например в SO2·6H2O, можно SO2 изоморфно заместить Ar (работы Б. А. Никитина и др.), что даёт возможность синтезировать Ar·6H2O при нормальном давлении.
В промышленности аргон получают в процессе разделения воздуха при глубоком охлаждении. Возможно получение аргона из продувочных газов колонн синтеза аммиака. Отделять аргон от других инертных газов лучше всего газохроматографическими методами. Аргон широко используется при термической обработке легко окисляющихся металлов. В защитной атмосфере из аргона проводят, например, сварку и резку различных редких и цветных металлов, плавку Ti, W, Zr и т.д. В атмосфере аргона выращивают кристаллы полупроводниковых материалов. Аргоном заполняют электрические лампочки (аргон снижает скорость испарения вольфрама и позволяет увеличить светоотдачу). Аргоновые трубки применяют для рекламы (сине-голубое свечение). На определении отношения 40Ar : 40K.![]() основан один из методов определения возраста минералов (см. Геохронология). Радиоактивный аргон иногда применяют для контроля вентиляционных систем.
основан один из методов определения возраста минералов (см. Геохронология). Радиоактивный аргон иногда применяют для контроля вентиляционных систем.
Лит: Фастовский В. Г., Ровинский А. Е., Петровский Ю. В., Инертные газы, М., 1964; Головко Г. А., Аппараты и установки для производства аргона, М.—Л., 1965; Финкельштейн Д. Н., Инертные газы, М., 1961; Бердоносов С. С., Инертные газы вчера и сегодня, М., 1966.
С. С. Бердоносов.
Аргон (Ar) – применение, химические и физические свойства
Аргон – благородный газ. Благородные газы – это 7 элементов в группе 18 (VIII A) периодической таблицы (Периодическая таблица представляет собой диаграмму, показывающую, как химические элементы связаны друг с другом). Инертные газы также называют инертными газами, потому что элементы группы 18 (VIII A) реагируют с очень небольшим количеством других элементов. На самом деле ни одно соединение аргона никогда не производилось.
Английский химик по имени Джон Уильям Струтт, более известный как лорд Рэлей (1842-1819 гг.).19), химик Уильям Рамсей (1852-1916) открыл аргон в 1894 году. Это был первый выделенный вид благородных газов.
Рэлей и Рамзи нашли аргон фракционной перегонкой жидкого воздуха. Фракционная перегонка — это метод медленного нагревания жидкого воздуха. Когда воздух нагревается, различные элементы снова превращаются из жидкости в газ. Часть воздуха, которая снова превращается в газ при температуре -185,86°C (-302,55°F), представляет собой аргон.
Обозначение: Ar
Атомный номер: 18
Атомная масса: 39,948
Семейство: Группа 18 (VIII A) Благородный газ
Произношение: AR-gon
Аргон используется для производства инертного слоя для некоторых промышленных операций. Инертная газовая оболочка предотвращает взаимодействие любых химических веществ в процессе работы с кислородом и другими веществами, присутствующими в воздухе. Аргон также используется при создании «неоновых» ламп и в лазерах.
Аргон также используется при создании «неоновых» ламп и в лазерах.
Открытие и наименование Аргона:
Аргон был открыт в 189 году4. Однако английский ученый Генри Кавендиш (1731-1810) предсказал существование аргона за 200 лет до открытия аргона. Когда Кавендиш попытался удалить кислород и азот из воздуха, он обнаружил, что осталось очень небольшое количество газа. Он правильно догадался, что в воздухе находится еще один элемент, но не смог определить, что это было.
Когда Рамзи повторил эксперименты Кавендиша в 1890-х годах, он тоже обнаружил в воздухе крошечное количество неизвестного газа. Но у Рамзи было преимущество перед Кавендишем: он мог использовать спектроскопию, которой во времена Кавендиша не существовало. Спектроскопия — это процесс, при котором испускаемый свет анализируется путем нагревания элемента.
Спектр (множественное число: спектры) элемента, который состоит из ряда цветных линий и отличается для каждого элемента.
Рамзи изучил спектр неизвестного газа. Он получил ряд линий, не принадлежащих ни одному другому элементу. Он был убежден, что открыл новый элемент. Тем временем Рэлей проделывал ту же работу почти в то же время. Он сделал свое открытие примерно в то же время, что и Рамзи. Оба ученых решили сделать свое заявление вместе. Название аргон происходит от греческого слова Аргос, «ленивый». Название основано на неспособности аргона реагировать с чем-либо.
Открытие аргона поставило перед химиками проблему. Аргон был первым благородным газом, открытым ученым. Куда должен идти этот элемент в таблице Менделеева? В то время периодическая таблица заканчивалась группой 17 (VIIА) справа. Рамзи предположил, что периодическую таблицу, возможно, придется расширить. Рамзи предложил добавить в таблицу целую новую группу. Эта группа будет помещена справа от группы 17 (VIIА) в периодической таблице.
Предложение Рамзи было принято, но оно создало еще одну интересную новую проблему для химиков. Если в периодической таблице существовала совсем новая группа, то где были другие элементы, принадлежавшие этой группе? К счастью, у химиков было хорошее представление о том, как могут выглядеть эти неизвестные элементы. Все элементы в одной группе очень похожи друг на друга. Химики начали искать более неактивные газы. В течение следующих пяти лет они нашли оставшихся членов группы и добавили к ним: гелий, криптон, неон, радон и ксенон.
Если в периодической таблице существовала совсем новая группа, то где были другие элементы, принадлежавшие этой группе? К счастью, у химиков было хорошее представление о том, как могут выглядеть эти неизвестные элементы. Все элементы в одной группе очень похожи друг на друга. Химики начали искать более неактивные газы. В течение следующих пяти лет они нашли оставшихся членов группы и добавили к ним: гелий, криптон, неон, радон и ксенон.
Физические свойства:
Аргон — бесцветный благородный газ без вкуса и запаха. Благородный газ аргон имеет плотность 1,784 грамма на литр. Когда мы сравниваем плотность аргона с плотностью воздуха, она составляет около 1,29 грамма на литр. Аргон меняет свое состояние с газообразного на жидкое при температуре -185,86°C (-302,55°F). Затем он меняет свое состояние с жидкого на твердое при температуре -189,3 °C (-308,7 °F). В редких случаях и в экстремальных условиях он образует слабые, сложные структуры.
Встречается в природе:
Содержание аргона в атмосфере составляет около 0,93 процента. Аргон также содержится в земной коре в количестве около 4 частей на миллион.
Извлечение:
Благородный газ Аргон можно получить из жидкого воздуха путем фракционной перегонки. Аргон также можно получить путем нагревания газообразного азота из атмосферы с горячим магнием или кальцием. Магний или кальций смешиваются с азотом, образуя нитрид:
Небольшое количество аргона всегда встречается в виде примеси с газообразным азотом. Он остается позади, потому что не вступает в реакцию с магнием или кальцием.
Аргон также может встречаться в скважинах с природным газом. При очистке природного газа некоторое количество аргона может быть извлечено в качестве побочного продукта реакции.
Изотопы:
Три изотопа аргона существуют в природе.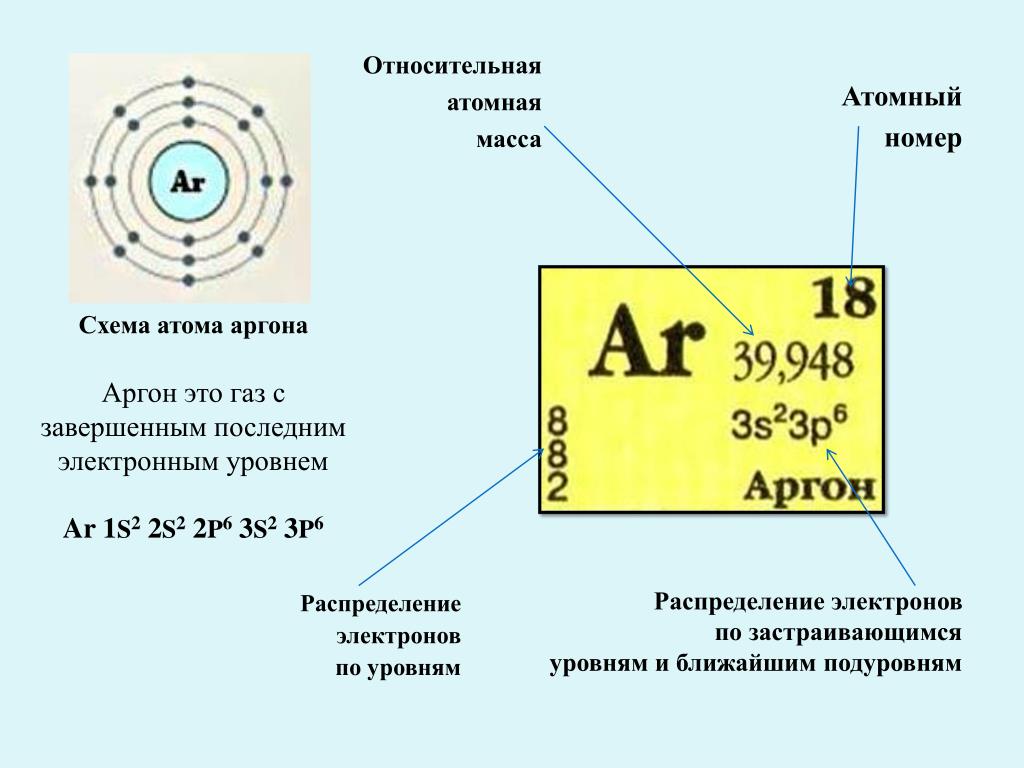 Это изотопы аргон-36, аргон-38 и аргон-40. Изотопы образуют два или более из элемента. Изотопы отличаются друг от друга в зависимости от их массового числа. Массовое число пишется справа от названия элемента и является массовым числом. Массовое число представлено количеством протонов плюс нейтронов в ядре атома элемента. Количество протонов определяет элемент, но количество нейтронов в атоме любого элемента может варьироваться. Каждое изменение представляет собой изотоп элемента.
Это изотопы аргон-36, аргон-38 и аргон-40. Изотопы образуют два или более из элемента. Изотопы отличаются друг от друга в зависимости от их массового числа. Массовое число пишется справа от названия элемента и является массовым числом. Массовое число представлено количеством протонов плюс нейтронов в ядре атома элемента. Количество протонов определяет элемент, но количество нейтронов в атоме любого элемента может варьироваться. Каждое изменение представляет собой изотоп элемента.
Радиоактивный изотоп — это тот, который распадается на части и испускает ту или иную форму радиации. Радиоактивные изотопы образуются, когда маленькие частицы обстреливают атомы. Эти частицы впиваются в атомы и делают их радиоактивными элементами.
Никакие радиоактивные изотопы аргона не имеют практического применения. Однако для определения возраста очень старых пород можно использовать один нерадиоактивный изотоп. Этот метод датирования и определения возраста горных пород описан в статье о калии.
Применение:
Благородный газ Аргон используется в ситуациях, когда необходимо защитить материалы от кислорода или других газов. Хорошим примером является лампа накаливания, состоящая из металлического провода внутри колбы из прозрачного стекла. Через провод должен проходить электрический ток, который заставляет его сильно нагреваться и излучать свет.
Кислород очень легко соединяется с горячим металлом; эта реакция образует соединение металла и кислорода. Это соединение не очень хорошо проводит электрический ток, поэтому лампочка может перестать излучать свет.
Аргон, тем не менее, используется для предотвращения этого. Поскольку аргон инертен, он не вступает в реакцию с горячей проволокой, оставляя металл горячим в течение длительного периода времени. Лампочка перестанет светить только тогда, когда металл сломается.
 Тогда это больше не может проводить электрический ток.
Тогда это больше не может проводить электрический ток.Аргон также можно использовать при сварке. Сварка – это процесс, при котором два металла соединяются друг с другом. В большинстве этих случаев два металла нагреваются до очень высоких температур. По мере того, как они становятся все горячее и горячее, они сливаются воедино.
Однако, когда металл нагревается, они начинают реагировать с кислородом. В этой реакции образуется составной компонент металла и кислорода. Становится трудно объединить эти два металла, если они образовали соединения, но введение аргона в сварочную среду улучшает их соединение.
Аргон также может использоваться в аргоновых лазерах и аргоновых лазерах на красителях. Лазер — это устройство, излучающее очень яркий свет одного цвета (частоты). Аргоновый лазер используется для лечения кожных заболеваний.
 Лазер излучает сине-зеленый свет на пораженный участок кожи тела. Энергия лазера поглощается гемоглобином (кровью) и преобразуется в тепло. (Гемоглобин — это белковый пигмент эритроцитов в нашем организме). Кровеносные сосуды повреждаются, но затем закупориваются, что приводит к их разложению и реабсорбции в организме человека. Нежелательные наросты сглаживаются, а темные пятна осветляются с небольшим риском образования рубцов.
Лазер излучает сине-зеленый свет на пораженный участок кожи тела. Энергия лазера поглощается гемоглобином (кровью) и преобразуется в тепло. (Гемоглобин — это белковый пигмент эритроцитов в нашем организме). Кровеносные сосуды повреждаются, но затем закупориваются, что приводит к их разложению и реабсорбции в организме человека. Нежелательные наросты сглаживаются, а темные пятна осветляются с небольшим риском образования рубцов.Аргоновый лазер на красителе действительно используется в глазной хирургии. Цвет света, излучаемого лазером, можно откалибровать с высокой точностью. Его можно заставить излучать свет в диапазоне от зеленого до синего. Каждый тон зеленого или синего имеет немного другую частоту. Он может проникнуть более или менее глубоко в глаз. Лазер можно модифицировать для лечения очень специфической части глаза. Аргоновый краситель используется для лечения опухолей, поврежденных кровеносных сосудов, состояний, включая сетчатку, и других проблем со зрением.

Соединения:
Соединение благородного газа аргона никогда не производилось.
Воздействие на здоровье:
Аргон не оказывает положительного или отрицательного воздействия на здоровье растений, животных и людей.
Аргон новости и последние обновления
Науки о Земле
07 сент. 2022 г.
Улавливание высоких давлений в алмазных капсулах
Сохранение высокобарических состояний материалов в условиях окружающей среды является долгожданной целью фундаментальных исследований и практических приложений.
Общая физика
17 августа 2022 г.
Общая физика
26 апр. 2022 г.
Аргон обнаружен в воздухе древней атмосферы
На массивных ледяных покровах, простирающихся через Гренландию и Антарктиду, температура настолько низка, что даже летнее солнце не может растопить осевший на них снег. По мере того, как снег накапливается, не тая и оседая…
Науки о Земле
30 марта 2022 г.
Нанофизика
05 июля 2021 г.
Общая физика
05 марта 2021 г.
Убедительные доказательства нейтринного процесса открывают возможности физики
Эксперимент по физике элементарных частиц COHERENT в Окриджской национальной лаборатории Министерства энергетики твердо установил существование нового типа нейтринного взаимодействия. Потому что нейтрино электрически нейтральны и…
Общая физика
26 января 2021 г.
На новом объекте тестируются будущие системы обнаружения нейтрино с «прекрасными» результатами
Международный эксперимент Deep Underground Neutrino Experiment, или DUNE, организованный Fermilab, будет масштабным. Фактически, с более чем 1000 сотрудников из более чем 30 стран и пяти континентов, это крупнейшая международная научная . ..
..
Общая физика
21 сент. 2020 г.
Изображение: Плазменный двигатель для малых спутников
Испытательный запуск европейского плазменного двигателя Helicon, разработанного совместно с ЕКА компанией SENER и группой плазменных и космических двигателей Университета Карлоса III (EP2-UC3M) в Испании. Эта компактная, безэлектродная и низковольтная конструкция идеально …
Исследование космоса
07 сент. 2020 г.
(намного) более ранняя дата рождения тектонических плит
Геофизики из Йельского университета сообщили, что постоянно меняющаяся подземная сеть тектонических плит Земли прочно сформировалась более 4 миллиардов лет назад — по крайней мере, на миллиард лет раньше, чем обычно думали ученые.![]()


 Тогда это больше не может проводить электрический ток.
Тогда это больше не может проводить электрический ток. Лазер излучает сине-зеленый свет на пораженный участок кожи тела. Энергия лазера поглощается гемоглобином (кровью) и преобразуется в тепло. (Гемоглобин — это белковый пигмент эритроцитов в нашем организме). Кровеносные сосуды повреждаются, но затем закупориваются, что приводит к их разложению и реабсорбции в организме человека. Нежелательные наросты сглаживаются, а темные пятна осветляются с небольшим риском образования рубцов.
Лазер излучает сине-зеленый свет на пораженный участок кожи тела. Энергия лазера поглощается гемоглобином (кровью) и преобразуется в тепло. (Гемоглобин — это белковый пигмент эритроцитов в нашем организме). Кровеносные сосуды повреждаются, но затем закупориваются, что приводит к их разложению и реабсорбции в организме человека. Нежелательные наросты сглаживаются, а темные пятна осветляются с небольшим риском образования рубцов.