Химический символ меди: Химические элементы. Символы химических элементов — урок. Химия, 8 класс.
alexxlab | 21.04.1988 | 0 | Разное
названия, символы и произношение символов
В таблице содержатся русские и латинские названия химических элементов, символы химических элементов и произношение символов. Для правильного произношения названий и символов в русских названиях и произношениях проставлены ударения.
| Русское название элемента | Латинское название элемента | Символ элемента | Произношение символа |
|---|---|---|---|
| Азо́т | Nitrogenium | N | эн |
| Акти́ний | Actinium | Ac | акти́ний |
| Алюми́ний | Aluminium | Al | алюми́ний |
| Амери́ций | Americium | Am | амери́ций |
| Арго́н | Argon | Ar | арго́н |
| Аста́т | Astatum | At | аста́т |
| Ба́рий | Barium | Ba | ба́рий |
| Бери́ллий | Beryllium | Be | бери́ллий |
| Бе́рклий | Berkelium | Bk | бе́рклий |
| Бор | Borum | B | бор |
| Бо́рий | Bohrium | Bh | бо́рий |
| Бром | Bromium | Br | бром |
| Вана́дий | Vanadium | V | вана́дий |
| Ви́смут | Bismuthum | Bi | ви́смут |
| Водоро́д | Hydrogenium | H | аш |
| Вольфра́м | Wolframium | W | вольфра́м |
| Гадоли́ний | Gadolinium | Gd | гадоли́ний |
| Га́ллий | Gallium | Ga | га́ллий |
| Га́фний | Hafnium | Hf | га́фний |
| Ге́лий | Helium | He | ге́лий |
| Герма́ний | Germanium | Ge | герма́ний |
| Го́льмий | Holmium | Ho | го́льмий |
| Дармшта́дтий | Darmstadtium | Ds | дармшта́дтий |
| Диспро́зий | Dysprosium | Dy | диспро́зий |
| Ду́бний | Dubnium | Db | ду́бний |
| Евро́пий | Europium | Eu | евро́пий |
| Желе́зо | Ferrum | Fe | фе́ррум |
| Зо́лото | Aurum | Au | а́урум |
| И́ндий | Indium | In | и́ндий |
| Йод | Iodium | I | йод |
| Ири́дий | Iridium | Ir | ири́дий |
| Итте́рбий | Ytterbium | Yb | итте́рбий |
| И́ттрий | Yttrium | Y | и́ттрий |
| Ка́дмий | Cadmium | Cd | ка́дмий |
| Ка́лий | Kalium | K | ка́лий |
| Калифо́рний | Californium | Cf | калифо́рний |
| Ка́льций | Calcium | Ca | ка́льций |
| Кислоро́д | Oxygenium | O | о |
| Ко́бальт | Cobaltum | Co | ко́бальт |
| Коперни́ций | Copernicium | Cn | коперни́ций |
| Кре́мний | Silicium | Si | сили́циум |
| Крипто́н | Krypton | Kr | крипто́н |
| Ксено́н | Xenon | Xe | ксено́н |
| Кю́рий | Curium | Cm | кю́рий |
| Ланта́н | Lanthanum | La | ланта́н |
| Ливермо́рий | Livermorium | Lv | ливермо́рий |
| Ли́тий | Lithium | Li | ли́тий |
| Лоуре́нсий | Lawrencium | Lr | лоуре́нсий |
| Люте́ций | Lutetium | Lu | люте́ций |
| Ма́гний | Magnesium | Mg | ма́гний |
| Ма́рганец | Manganum | Mn | ма́рганец |
| Медь | Cuprum | Cu | ку́прум |
| Мейтне́рий | Meitnerium | Mt | мейтне́рий |
| Менделе́вий | Mendelevium | Md | менделе́вий |
| Молибде́н | Molybdaenum | Mo | молибде́н |
| Моско́вий | Moscovium | Mc | моско́вий |
| Мышья́к | Arsenicum | As | арсе́никум |
| На́трий | Natrium | Na | на́трий |
| Неоди́м | Neodymium | Nd | неоди́м |
| Нео́н | Neon | Ne | нео́н |
| Непту́ний | Neptunium | Np | непту́ний |
| Ни́кель | Niccolum | Ni | ни́кель |
| Нио́бий | Niobium | Nb | нио́бий |
| Нихо́ний | Nihonium | Nh | нихо́ний |
| Нобе́лий | Nobelium | No | нобе́лий |
| Оганесо́н | Oganesson | Og | оганесо́н |
| О́лово | Stannum | Sn | ста́ннум |
| О́смий | Osmium | Os | о́смий |
| Палла́дий | Palladium | Pd | палла́дий |
| Пла́тина | Platinum | Pt | пла́тина |
| Плуто́ний | Plutonium | Pu | плуто́ний |
| Поло́ний | Polonium | Po | поло́ний |
| Празеоди́м | Praseodymium | Pr | празеоди́м |
| Проме́тий | Promethium | Pm | проме́тий |
| Протакти́ний | Protactinium | Pa | протакти́ний |
| Ра́дий | Radium | Ra | ра́дий |
| Радо́н | Radon | Rn | радо́н |
| Резерфо́рдий | Rutherfordium | Rf | резерфо́рдий |
| Ре́ний | Rhenium | Re | ре́ний |
| Рентге́ний | Roentgenium | Rg | рентге́ний |
| Ро́дий | Rhodium | Rh | ро́дий |
| Ртуть | Hydrargyrum | Hg | гидра́ргирум |
| Руби́дий | Rubidium | Rb | руби́дий |
| Руте́ний | Ruthenium | Ru | руте́ний |
| Сама́рий | Samarium | Sm | сама́рий |
| Свине́ц | Plumbum | Pb | плю́мбум |
| Селе́н | Selenium | Se | селе́н |
| Се́ра | Sulfur | S | эс |
| Серебро́ | Argentum | Ag | арге́нтум |
| Сибо́ргий | Seaborgium | Sg | сибо́ргий |
| Ска́ндий | Scandium | Sc | ска́ндий |
| Стро́нций | Strontium | Sr | стро́нций |
| Сурьма́ | Stibium | Sb | сти́биум |
| Та́ллий | Thallium | Tl | та́ллий |
| Танта́л | Tantalum | Ta | танта́л |
| Теллу́р | Tellurium | Te | теллу́р |
| Теннесси́н | Tennessium | Ts | теннесси́н |
| Те́рбий | Terbium | Tb | те́рбий |
| Техне́ций | Technetium | Tc | техне́ций |
| Тита́н | Titanium | Ti | тита́н |
| То́рий | Thorium | Th | то́рий |
| Ту́лий | Thulium | Tm | ту́лий |
| Углеро́д | Carboneum | C | цэ |
| Ура́н | Uranium | U | ура́н |
| Фе́рмий | Fermium | Fm | фе́рмий |
| Флеро́вий | Flerovium | Fl | флеро́вий |
| Фо́сфор | Phosphorus | P | пэ |
| Фра́нций | Francium | Fr | фра́нций |
| Фтор | Fluorum | F | фтор |
| Ха́ссий | Hassium | Hs | га́ссий |
| Хлор | Chlorum | Cl | хлор |
| Хром | Chromium | Cr | хром |
| Це́зий | Caesium | Cs | це́зий |
| Це́рий | Cerium | Ce | це́рий |
| Цинк | Zincum | Zn | цинк |
| Цирко́ний | Zirconium | Zr | цирко́ний |
| Эйнште́йний | Einsteinium | Es | эйнште́йний |
| Э́рбий | Erbium | Er | э́рбий |
10 фактов о меди — атомный номер 29 символ Cu
Перейти к содержанию
Search for:
Главная » Факты
 Просмотров 6 Опубликовано
Просмотров 6 Опубликовано
Медь — красивый и полезный металлический элемент, который можно найти в вашем доме как в чистом виде, так и в виде химических соединений. Медь — это элемент № 29 в периодической таблице Менделеева, с символом элемента Cu, от латинского слова cuprum . Название означает «с острова Кипр», который был известен своими медными рудниками.
10 фактов о меди
- Медь имеет красновато-металлический оттенок, который уникален среди всех элементов. Единственный другой не серебристый металл в таблице Менделеева — это золото, которое имеет желтоватый цвет. Добавление меди к золоту — это то, как получают красное золото или розовое золото.
- Медь была первым металлом, который обработал человек, наряду с золотом и метеоритным железом. Это связано с тем, что эти металлы были одними из немногих, которые существуют в своем естественном состоянии, а это означает, что относительно чистый металл можно найти в природе.
 Использование меди насчитывает более 10 000 лет. Ледяной Человек Эци (3300 г. до н.э.) был найден с топором, голова которого была сделана из почти чистой меди. Волосы ледяного человека содержали высокий уровень токсина мышьяка, что может указывать на то, что человек подвергся воздействию этого элемента во время плавки меди.
Использование меди насчитывает более 10 000 лет. Ледяной Человек Эци (3300 г. до н.э.) был найден с топором, голова которого была сделана из почти чистой меди. Волосы ледяного человека содержали высокий уровень токсина мышьяка, что может указывать на то, что человек подвергся воздействию этого элемента во время плавки меди. - Медь — важный элемент питания человека. Минерал имеет решающее значение для образования клеток крови и содержится во многих продуктах питания и большинстве источников воды. Продукты с высоким содержанием меди включают листовую зелень, зерно, картофель и бобы. Хотя для этого требуется много меди, ее можно получить и слишком много. Избыток меди может вызвать желтуху, анемию и диарею (которая может быть синей!).
- Медь легко образует сплавы с другими металлами. Двумя наиболее известными сплавами являются латунь (медь и цинк) и бронза (медь и олово), хотя существуют сотни сплавов.
- Медь — природный антибактериальный агент. В общественных зданиях обычно используют латунные дверные ручки (латунь — это медный сплав), потому что они помогают предотвратить передачу болезней.
 Металл также токсичен для беспозвоночных, поэтому его используют на корпусах кораблей, чтобы предотвратить прикрепление мидий и ракушек. Он также используется для борьбы с водорослями.
Металл также токсичен для беспозвоночных, поэтому его используют на корпусах кораблей, чтобы предотвратить прикрепление мидий и ракушек. Он также используется для борьбы с водорослями. - Медь обладает многими желательными свойствами, характерными для переходных металлов. Он мягкий, податливый, пластичный и отлично проводит тепло и электричество, а также устойчив к коррозии. Медь в конечном итоге окисляется с образованием оксида меди или зеленого цвета. Это окисление является причиной того, что Статуя Свободы имеет зеленый цвет, а не красновато-оранжевый. Это также причина того, что недорогие украшения, содержащие медь, часто обесцвечивают кожу.
- С точки зрения промышленного использования медь занимает третье место после железа и алюминия. Медь используется в проводке (60 процентов всей меди), сантехнике, электронике, строительстве, посуде, монетах и множестве других товаров. Медь в воде, а не хлор, является причиной зеленого цвета волос в плавательных бассейнах.

- Есть два распространенных состояния окисления меди, каждое из которых имеет свой набор свойств.. Один из способов отличить их друг от друга — это цвет спектра излучения, когда ион нагревается в пламени. Медь (I) превращается в пламя синего цвета, а медь (II) дает зеленое пламя.
- Почти 80 процентов меди, которая была добыта на сегодняшний день, все еще используется. Медь — это металл, пригодный для вторичной переработки на 100%. Это металл в большом количестве в земной коре, концентрация которого составляет 50 частей на миллион. Его содержание в морской воде составляет 2,5 х 10-4 мг/л. Медь на Земле образовалась в результате взрыва белых карликов и массивных звезд до образования Солнечной системы.
- Медь легко образует простые бинарные соединения, которые представляют собой химические соединения, состоящие всего из двух элементов. Примеры таких соединений включают оксид меди, сульфид меди и хлорид меди. Медь также образует комплексы, металлоорганические соединения и другие соединения, содержащие несколько атомов.

Источники
- Хаммонд, CR (2004). «Элементы» в Справочнике по химии и физике (81-е изд.). CRC Press. ISBN 0-8493-0485-7.
- Kim, B.E. (2008). «Механизмы приобретения, распределения и регулирования меди». Nat Chem Biol . Национальный центр биотехнологической информации, Bethesda MD.
- Массаро, Эдвард Дж., Изд. (2002). Справочник по фармакологии и токсикологии меди . Humana Press. ISBN 0-89603-943-9.
- Смит, Уильям Ф. и Хашеми, Джавад (2003). Основы материаловедения и инженерии . McGraw-Hill Professional. п. 223. ISBN 0-07-292194-3.
- Уист, Роберт (1984). CRC, Справочник по химии и физике . Бока-Ратон, Флорида: Издательство Chemical Rubber Company. стр. E110. ISBN 0-8493-0464-4.
от Дальтона до эндоэдральных фуллеренов
И. А. Леенсон
А. Леенсон
«Химия и жизнь» №5, 2013
Со времен Лавуазье химики не раз пытались унифицировать обозначения элементов и их соединений, сделать их более удобными и понятными для всех. В 1787 году Антуан Лавуазье, Луи де Морво, Антуан де Фуркруа и Клод Бертолле обсуждали давно назревшую реформу химической номенклатуры. Патриархи поручили подготовить соображения по новой системе записи молодым коллегам — Жану Ассенфрацу (1755–1827) и Пьеру Аде (1763–1832), а те предложили обозначать простые вещества простыми символами, а сложные — сочетанием этих символов. Например, кислород — горизонтальной линией —, азот наклонной , водород и углерод — соответственно и , серу и фосфор — значками и . Металлы обозначали буквами, взятыми из их латинских названий, — так, как сейчас обозначают все элементы. Но по традиции буквы помещали в кружок. Символ меди (cuprum) был похож на современный значок для авторского права: , символ свинца (plumbum) — на дорожный знак (или символ растворителя для сухой химчистки): . Символы кислот помещали в квадраты: для соляной кислоты (acidum muriaticum), для уксусной (acidum acetum) и т. д. Щелочи и «земли» обозначали буквами в треугольниках — вершинами вверх (поташ Р) или вниз (сода S, известь С, барит В, магнезия М). Комитет по номенклатуре при Академии наук одобрил эти обозначения, но химикам они не понравились: записывать неудобно, а печатать — тем более.
Символы кислот помещали в квадраты: для соляной кислоты (acidum muriaticum), для уксусной (acidum acetum) и т. д. Щелочи и «земли» обозначали буквами в треугольниках — вершинами вверх (поташ Р) или вниз (сода S, известь С, барит В, магнезия М). Комитет по номенклатуре при Академии наук одобрил эти обозначения, но химикам они не понравились: записывать неудобно, а печатать — тем более.
Следующий шаг предпринял основатель современной атомистической теории Джон Дальтон (1766–1844). До начала XIX века теория, согласно которой все вещества состоят из атомов, была чисто умозрительной и мало отличалась от воззрений древних. Даже ее сторонники не связывали ее с практическими задачами химии. Дальтон впервые начал рассматривать атомистическую теорию как реальность. Каждому известному элементу у него соответствовал свой сорт атомов, со своими массой и свойствами.
Как и некоторые его предшественники, Дальтон изображал символы элементов кружочками с буквами или другими значками внутри. Вот некоторые из символов Дальтона: водород , углерод , азот , кислород , фосфор , сера , натрий (и сода) , калий (и поташ) , магний , кальций (и известь) , железо , медь , цинк , серебро , платина , золото , свинец , ртуть , барий . Формула воды по Дальтону , аммиака , углекислого газа , серной кислоты . Эти формулы отражали не только качественный, но и количественный состав веществ — так, как они были известны в начале XIX века.
Вот некоторые из символов Дальтона: водород , углерод , азот , кислород , фосфор , сера , натрий (и сода) , калий (и поташ) , магний , кальций (и известь) , железо , медь , цинк , серебро , платина , золото , свинец , ртуть , барий . Формула воды по Дальтону , аммиака , углекислого газа , серной кислоты . Эти формулы отражали не только качественный, но и количественный состав веществ — так, как они были известны в начале XIX века.
Дальтон, чтобы его теория была понятной и наглядной, демонстрировал на лекциях разноцветные кубики, которые символизировали атомы разных элементов. Из этих кубиков он составлял химические соединения. Не все слушатели Дальтона хорошо понимали его. Когда одного студента спросили, что такое атомы, тот ответил: «Атомы — это кубики, которые мистер Дальтон показывает на лекциях».
Символы Дальтона постигла та же судьба, что и значки французских химиков: они были неудобны как для запоминания, так и для записи. Революционное, хотя и очень простое предложение внес выдающийся шведский химик Йёнс Якоб Берцелиус.![]() Он просто выкинул кружки и прочие геометрические фигуры, оставив только первую букву названия элемента на латыни. Если же эта буква у разных названий совпадает, можно вместо одной буквы взять две. Например, латинские названия известных химикам того времени элементов углерода (carboneum), кальция (calcium) и меди (cuprum) начинаются с одной буквы, поэтому символы для них С, Ca и Cu. Число же атомов в молекуле Берцелиус предложил записывать, как показатель степени в математике: SO2 для сернистого газа, SO3 для серного ангидрида и так далее. И хотя в 1835 году не менее знаменитый немецкий химик Юстус Либих предложил записывать число атомов в виде подстрочных индексов, запись по Берцелиусу химики использовали еще очень долго; ее можно видеть, например, в статьях и учебниках Д. И. Менделеева.
Он просто выкинул кружки и прочие геометрические фигуры, оставив только первую букву названия элемента на латыни. Если же эта буква у разных названий совпадает, можно вместо одной буквы взять две. Например, латинские названия известных химикам того времени элементов углерода (carboneum), кальция (calcium) и меди (cuprum) начинаются с одной буквы, поэтому символы для них С, Ca и Cu. Число же атомов в молекуле Берцелиус предложил записывать, как показатель степени в математике: SO2 для сернистого газа, SO3 для серного ангидрида и так далее. И хотя в 1835 году не менее знаменитый немецкий химик Юстус Либих предложил записывать число атомов в виде подстрочных индексов, запись по Берцелиусу химики использовали еще очень долго; ее можно видеть, например, в статьях и учебниках Д. И. Менделеева.
Впервые предложение Берцелиуса было опубликовано в январе 1814 года в журнале «Анналы философии», который издавал английский химик Томас Томсон. Статья была озаглавлена «О химических знаках и способе их применения для выражения химических пропорций». Как и у Дальтона, каждый знак в формулах Берцелиуса символизировал химический элемент и каждому элементу была поставлена в соответствие его относительная атомная масса. Зная относительные атомные массы, можно было по формуле рассчитать количественный состав вещества, конечно, если формула и атомные массы были правильные. Со статьей Берцелиуса быстро ознакомились все ведущие химики, и, как он и надеялся, ярлыки с новыми формулами появились на склянках с реактивами.
Как и у Дальтона, каждый знак в формулах Берцелиуса символизировал химический элемент и каждому элементу была поставлена в соответствие его относительная атомная масса. Зная относительные атомные массы, можно было по формуле рассчитать количественный состав вещества, конечно, если формула и атомные массы были правильные. Со статьей Берцелиуса быстро ознакомились все ведущие химики, и, как он и надеялся, ярлыки с новыми формулами появились на склянках с реактивами.
Сам Берцелиус отошел от этого принципа и начал «для краткости» обозначать, например, атомы кислорода точками, атомы серы и селена — вертикальными и горизонтальными черточками, атомы теллура — крестиками; чтобы показать удвоенные атомы, он перечеркивал соответствующий символ.
Так, вместо PbO у него , вместо MoSe2 символ , вместо СаTe символ , вместо Al2O3 перечеркнутый горизонтально символ Al с тремя точками наверху , а формула воды — это просто перечеркнутая горизонтально буква Н с точкой наверху . Однако эта новация не прижилась — повезло наборщикам и верстальщикам.
Однако эта новация не прижилась — повезло наборщикам и верстальщикам.
Вот уже два столетия химики пользуются символами Берцелиуса. Изменений, если не считать вновь открытые элементы, немного: F вместо Fl для фтора, Be вместо Gl («глициний») для бериллия, U вместо Ur для урана — вот, пожалуй, и все. Однако существенно изменились атомные массы элементов и соответственно формулы многих веществ.
В заключение — о последнем иероглифе, сравнительно недавно попавшем в химические формулы, но известном давно. Это так называемый «commercial at» @ (сокращение от at the rate of — по цене), попросту говоря, «почтовая собака». Он используется в формулах фуллеренов, если внутри их полости находятся какие-либо атомы или молекулы. Такие соединения называются эндоэдральными. Например, формула Mm@Cn означает, что внутри фуллерена с формулой Cn находятся, как в погремушке, m инкапсулированных атомов вещества М, например Sc3@C82. Такое обозначение позволяет отличать эндоэдральный фуллерен от обычного, к поверхности которого привиты различные атомы или группы атомов.
Такое обозначение позволяет отличать эндоэдральный фуллерен от обычного, к поверхности которого привиты различные атомы или группы атомов.
Химия знаки химических элементов. Химические элементы. Символы химических элементов. Общий принцип наименования элементов
Язык химии. Знаки химических элементов. Относительная атомная масса. Тема урока: Цели: Знать: знаки химических элементов, их названия и произношение, понятие «относительная атомная масса». Уметь: определять принадлежность химических элементов к металлам и неметаллам, записывать знаки химических элементов и значения их относительных атомных масс.
Другого ничего в природе нет Ни здесь, ни там, в космических глубинах: Все – от песчинок малых до планет – Из элементов состоит единых. Степан Щипачев «Читая Менделеева» Как формула, как график трудовой строй Менделеевской системы строгой. Вокруг тебя творится мир живой, входи в него, вдыхай, руками трогай.
Проверка домашнего задания 1. Какие вещества называют простыми? Приведите примеры.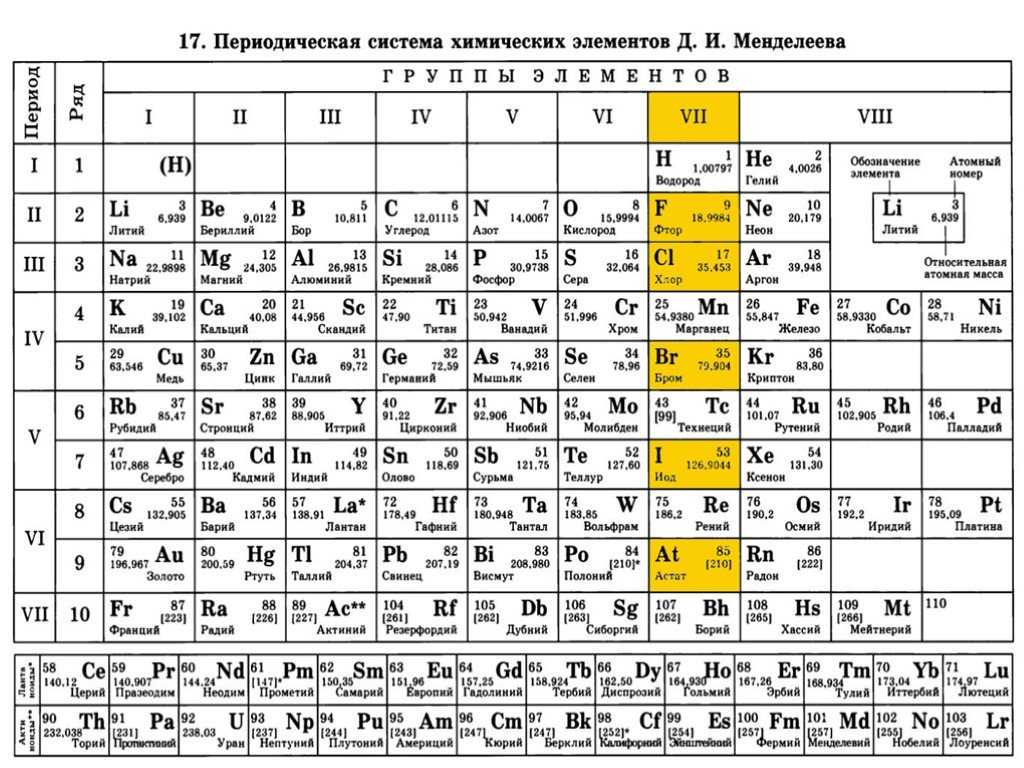 2. Какие вещества называют сложными? Приведите примеры. 3. Что такое химический элемент? Сколько известно химических элементов? 4. Говорится о кислороде как о простом веществе 1) кислород поддерживает горение 2) кислород входит в состав углекислого газа 3) кислород расположен в периодической таблице рядом с азотом 4) атом кислорода 5. Говорится о меди как о простом веществе 1) атомы меди входят в состав медного купороса 2) медь хорошо проводит электрический ток 3) атом меди тяжелее, чем атом железа 4) медь расположена в периодической таблице рядом с цинком
2. Какие вещества называют сложными? Приведите примеры. 3. Что такое химический элемент? Сколько известно химических элементов? 4. Говорится о кислороде как о простом веществе 1) кислород поддерживает горение 2) кислород входит в состав углекислого газа 3) кислород расположен в периодической таблице рядом с азотом 4) атом кислорода 5. Говорится о меди как о простом веществе 1) атомы меди входят в состав медного купороса 2) медь хорошо проводит электрический ток 3) атом меди тяжелее, чем атом железа 4) медь расположена в периодической таблице рядом с цинком
Проверка домашнего задания 5. Говорится о водороде как об элементе 1) водород горит 2) водород входит в состав воды 3) водород – самый легкий газ 4) водород мало растворим в воде 6. Говорится о сере как о простом веществе 1) атом серы 2) сера – один из элементов 3) порошок серы желтого цвета 4) сера входит в состав сульфида железа
Первую символику по обозначению химического элемента в 1814 году предложил шведский ученый Йенс-Якоб Берцелиус. Он предложил в качестве символов элементов использовать первую букву их латинских названий, а в случае совпадения первых букв – использовать и вторую букву.
Он предложил в качестве символов элементов использовать первую букву их латинских названий, а в случае совпадения первых букв – использовать и вторую букву.
Водород (по-латыни «гидрогениум», Hydrogenium) – Н кислород (по-латыни «оксигениум», Oxygenium) – О углерод (по-латыни «карбонеум», Carboneum) – C фтор (по-латыни «флюорум», Fluorum) – F железо (по-латыни «феррум», Ferrum) – Fe золото (по-латыни «аурум», Aurum) – Au
Относительная атомная масса масса атома Н равна 1,67 × г атома С 1,995 × г атома О 2,66 × г Введена атомная единица массы (а.е.м.) m (а.е.м.) = 1/12 m(12 C) = 1, г. A r (H) = m(атома) / m (а.е.м.) = = 1, г/1, г = 1,0079 а.е.м. A r – показывает, во сколько раз данный атом тяжелее 1/12 части атома 12 С, это безразмерная величина. Относительная атомная масса – это 1/12 массы атома углерода, масса которого равна 12 а.е.м.
Самый тяжелый из природных элементов – уран U. Фтор F – самый яростный в царстве неметаллов, ничто не может устоять под его «натиском». Имя самого редкого элемента на Земле – астат At. В толще земной коры его содержится всего 69 мг. Считается, что самое неудачное название элемента имеет азот N. По-гречески «а-зоос» означает «безжизненный». Но этот газ, входящий в состав воздуха, вовсе не ядовит, он просто непригоден для дыхания.
Имя самого редкого элемента на Земле – астат At. В толще земной коры его содержится всего 69 мг. Считается, что самое неудачное название элемента имеет азот N. По-гречески «а-зоос» означает «безжизненный». Но этот газ, входящий в состав воздуха, вовсе не ядовит, он просто непригоден для дыхания.
В честь ученых названы элементы: Md (101) – менделевий – Д.И. Менделеев No (102) – нобелий – А. Нобель Cm (96) – кюрий – Пьер и Мария Кюри Es (99) – эйнштейний – А.Эйнштейн Fm (100) – фермий – Э.Ферми Lr (103) – лоуренсий – Э.Лоуренс Rf (104) – резерфордий – Э.Резерфорд Bh (107) – барий – Н.Бор Mt (109) – мейтнерий – Л.Мейтнер
Есть названия элементов, обязанные собой цвету простых веществ и соединений (от индийского «сира» – светло-желтый цвет) сера S (от индийского «сира» – светло-желтый цвет) (от греческого «хлороз» – зеленый) хлор Cl (от греческого «хлороз» – зеленый) (от греческого «тодес» – фиолетовый) иод I (от греческого «тодес» – фиолетовый) образовано от греческого «хрома» – окрашенный, из-за разнообразной окраски соединений этого элемента. хром Cr образовано от греческого «хрома» – окрашенный, из-за разнообразной окраски соединений этого элемента. Названия происходят от греческих слов «бромом» и «осме», означающих «зловоние», «запах»; понятно, что именно было самым сильным впечатлением химиков, открывших эти элементы Названия бром Br и осмий Os происходят от греческих слов «бромом» и «осме», означающих «зловоние», «запах»; понятно, что именно было самым сильным впечатлением химиков, открывших эти элементы.
хром Cr образовано от греческого «хрома» – окрашенный, из-за разнообразной окраски соединений этого элемента. Названия происходят от греческих слов «бромом» и «осме», означающих «зловоние», «запах»; понятно, что именно было самым сильным впечатлением химиков, открывших эти элементы Названия бром Br и осмий Os происходят от греческих слов «бромом» и «осме», означающих «зловоние», «запах»; понятно, что именно было самым сильным впечатлением химиков, открывших эти элементы.
Разгадайте новое слово, которое можно получить, если от начала или конца названия химического элемента убрать число букв, соответствующее числу точек. Например, Cr, убираем из названия «хром» одну начальную букву и получаем «ром». а).. Na. б) Mg … в). F г) Ba..
ЛОГОРИФ Из названия, какого химического элемента, выбросив первые две буквы, можно получить название одной из распространенных игр? (Золото – лото) Из названия, какого химического элемента, выбросив последнюю букву, можно получить слово – клич, с которым солдаты идут в атаку, а мирные люди – на парад? (Уран – ура) К названию, какого химического элемента можно добавить в конце две буквы и получить название корабля, который затонул, столкнувшись с айсбергом? (Титан – Титаник) К названию, какого химического элемента можно добавить в конце три буквы, чтобы получить имя героя древнегреческого мифа, отправившегося в Колхиду за золотым руно? (Аргон – Аргонавт)
МЕТОГРАММА Из названия, какого химического элемента, заменяя первую букву на другую, можно получить слово, обозначающее название: пролива между Европой и Азией. (Фосфор – Босфор) местность, где в почве много воды. (Золото – болото) название инструмента. (Золото – долото) Из названия, какого химического элемента, заменяя последнюю букву на другую, можно получить слово, обозначающее название горной системы, являющейся границей между Европой и Азией? (Уран – Урал)
(Фосфор – Босфор) местность, где в почве много воды. (Золото – болото) название инструмента. (Золото – долото) Из названия, какого химического элемента, заменяя последнюю букву на другую, можно получить слово, обозначающее название горной системы, являющейся границей между Европой и Азией? (Уран – Урал)
АНАГРАММА Из названия, какого химического элемента, заменяя последнюю букву и читая с конца, можно получить слово, обозначающее название животного, которое может быть и домашним и диким? (Азот – коза) Из названия, какого химического элемента, переставляя первую букву в конец, можно получить название: полезного ископаемого. (Фтор – торф) одного из видов четырехугольника (Бром – ромб)
Муниципальное казенное общеобразовательное учреждение
«Попово-Лежачанская средняя общеобразовательная школа»
Районный семинар учителей химии
Глушковского района Курской области
Открытый урок по химии в 8 классе на тему: «Знаки химических элементов»
Подготовила:
Кондратенко Ольга Васильевна,
учитель химии и биологии
МКОУ “Попово-Лежачанская» СОШ
Глушковского района Курской области
с. Попово-Лежачи
Попово-Лежачи
Химия, 8 класс
Дата: 29.09.2015
Урок №12
Тема: Знаки химических элементов
Цель: закрепить знания и умения у обучающихся по темам «Методы познания в химии», «Чистые вещества и смеси», «Химические элементы», «Относительная атомная масса химических элементов».
Задачи урока:
Образовательн ые :
- проверить знания и умения у обучающихся по темам «Методы познания в химии», «Чистые вещества и смеси», «Химические элементы», «Относительная атомная масса химических элементов» пользуясь интерактивными средствами обучения;
- обобщить знания учащихся по изученным темам;
- выявить пробелы в усвоении учебного материала.
Развивающие:
- развивать химический язык, логическое мышление, внимание, память, интерес к современной химической науке, любознательность учащихся, умение делать выводы и обобщения;
- формировать навык работы с различными источниками информации с целью поиска и отбора необходимого материала.

Воспитательные:
- формировать положительную мотивацию учебной деятельности, научное мировозрение;
- развивать культуру умственного труда; навыки делового сотрудничества в процессе решения проблемы, работы в группах;
- воспитывать умение работать в коллективе, вежливость, дисциплинированность, аккуратность, трудолюбие;
- развивать умения формулировать и аргументировать собственное мнение, самостоятельность.
Планируемые результаты:
личностные: готовность и способность учащихся к саморазвитию, самоопределению; ответственное отношение к учению; способность ставить цели и строить жизненные планы; формирование коммуникативной культуры, ценности здорового и безопасного образа жизни;
метапредметные: уметь ставить цель и планировать пути её достижения, выбирая более рациональные способы решения данной проблемы; учиться корректировать свои действия в связи с изменением создавшейся ситуации; уметь создавать, применять и преобразовывать знаки и символы, модели и схемы для решения учебных и познавательных задач; уметь осознанно использовать речевые средства в соответствии с задачей коммуникации для выражения своих мыслей и потребностей; уметь организовывать совместную работу со сверстниками в группе; уметь находить информацию в различных источниках; владеть навыками самоконтроля, самооценки;
предметные:
знать : основные химические понятия «химический элемент», «простое вещество», «сложное вещество», знаки основных химических элементов; состав простых и сложных веществ; роль химии в жизни человека и в решении экологических проблем;
уметь: по формуле отличать простое вещество от сложного; химический элемент отличать от простого вещества; анализировать и объективно оценивать навыки безопасного обращения с веществами; устанавливать связи между реально наблюдаемыми химическими явлениями и процессами, происходящими в микромире; использовать различные методы изучения веществ.
Тип урока: контроль знаний.
Формы работы : групповая, работа в парах, игровая.
Методы обучения: проблемное изложение, частично-поисковый.
Приемы обучения : постановка проблемных вопросов.
Средства обучения: компьютер, проектор, презентация Power Point
Оборудование для учителя и учащихся: компьютер, проектор, таблица «Периодическая таблица химических элементов», лабораторный штатив, кольцо, фарфоровая чашка, спиртовка, фильтровальная бумага, ножницы, химические стаканы, стеклянная палочка, загрязненная смесь соли, вода.
Литература:
Для учителя:
- Горковенко М. Ю. Поурочные разработки по химии 8 класс к учебникам О. С. Габриеляна, Л. С. Гузея, Г. Е. Рудзитиса. – М: «ВАКО», 2004;
- Радецкий А. М., Горшкова В. П. Дидактический материал: химия 8-9 классы — М: Просвещение, 1997.
Для ученика:
Химия: неорганическая химия: учебник для 8 класса общеобразовательных учреждений/ Г. Е. Рудзитис, Ф. Г. Фельдман. – М: «Просвещение», 2014 г.
Е. Рудзитис, Ф. Г. Фельдман. – М: «Просвещение», 2014 г.
Ход урока:
I. Организационный момент (1 мин)
Учитель: Добрый день! Прошу всех садиться. Я поздравляю вас еще с одним чудесным днем. И мы с вами продолжаем творить волшебство на уроках химии.
II. Мотивация учебной деятельности (1 мин)
Учитель: Сегодня у нас необычный урок. Он будет проходить в форме игры. Оценка вашей работы в конце урока будет тем выше, чем больше баллов вы наберете. Количество заданий и их тип подобраны таким образом, что за выполнение работы вы сможете заработать более 40 баллов. Оценку вы получите согласно схемам пересчета, находящимся у вас на партах.
БЛАНК ОТВЕТОВ | |
ЗАДАНИЯ | Количество набранных баллов |
1. «Внимание, вопрос!» (7 баллов) | |
2. | |
3. «Крестики-нолики». (3 балла) | |
4. «Юные химики и химички». (15 баллов) | |
5. «Раздели меня». (4 балла) | |
6. «Ассоциации». (9 баллов) | |
7. «Я на выдумки мастак». (7 баллов) | |
8. «Парад химических элементов». (3 балла) | |
9. «Логические круги». (6 баллов) | |
10. «Пирамида». (3 балла) | |
11. Конкурс «Термины». (12 мин) | |
12. Конкурс «Последний шанс» (10 мин) | |
III. Контроль и коррекция знаний
1. Внимание, вопрос! (10 мин)
Учитель: Расскажите об этимологии названий химических элементов.
Ученик: Названия элементов имеют различную этимологию. Они происходят из:
названий стран и континентов – например, название рутений произошло от латинского названия России, а названия европий и америций – от названий континентов: Европа и Америка;
фамилий выдающихся химиков – например: менделевий, нобелий, резерфордий;
названий планет – например: уран, нептуний, плутоний;
названий рек – например, рений.
Все известные элементы имеют символы. Символьное обозначение элементов было предложено в 1814 году Й. Я. Берцелиусом. Раньше тоже использовались различные сокращенные обозначения элементов и соединений. Одним из таких видов обозначений были графические символы.
Учитель: Что мы знаем из истории развития языка химии?
Ученик: Еще в Средневековье, во времена алхимии использовались различные знаки для обозначения веществ, в основном металлов. Ведь основной целью алхимиков было получение из различных металлов золота. Поэтому каждый из них использовал свою систему обозначений. В 19 в. появилась необходимость использования понятной для всех ученых символики. И одним из первых такую символику предложил Джон Дальтон. Но его обозначениями было неудобно пользоваться.
В 19 в. появилась необходимость использования понятной для всех ученых символики. И одним из первых такую символику предложил Джон Дальтон. Но его обозначениями было неудобно пользоваться.
Учитель: Расскажите об системе обозначения химических элементов Й.Я. Берцелиуса
Ученик: Современную систему химических знаков предложил в начале XIX в. шведский химик Йёнс Якоб Берцелиус. Ученый предложил обозначать химические элементы первой буквой их латинского названия. В те времена все научные статьи печатала на латинском языке, он был общепринятым и понятным для всех ученых. Например, химический элемент кислород (по-латински Oxygenium) получил обозначение О. А химический элемент водород (Hydrogenium) – Н. Если названия нескольких элементов начинались на одну и ту же букву, то в символе элемента указывали вторую или одну из последующих букв названия. Например, ртуть (Hydrargyrum) обозначается Hg. Обратите внимание, что первая буква знака химического элемента всегда заглавная, если есть вторая буква – то она строчная.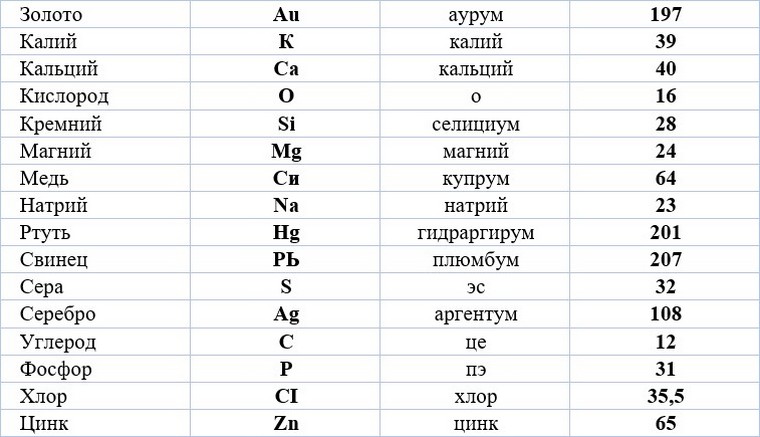 Необходимо запоминать не только названия элементов и их символы, но и произношение, т.е. как эти символы читаются. Определенных правил произношения знаков химических элементов нет. Их надо учить наизусть. Знаки некоторых химических элементов произносятся так же, как и соответствующая буква: кислород – «о», сера – «эс», фосфор – «пэ», азот – «эн», углерод – «цэ». Знаки других элементов произносятся так же, как и называются сами элементы: «натрий», «калий», «хлор», «фтор». Произношение некоторых знаков соответствует их латинскому названию: кремний – «силициум», ртуть – «гидраргирум», медь – «купрум», железо – «феррум».
Необходимо запоминать не только названия элементов и их символы, но и произношение, т.е. как эти символы читаются. Определенных правил произношения знаков химических элементов нет. Их надо учить наизусть. Знаки некоторых химических элементов произносятся так же, как и соответствующая буква: кислород – «о», сера – «эс», фосфор – «пэ», азот – «эн», углерод – «цэ». Знаки других элементов произносятся так же, как и называются сами элементы: «натрий», «калий», «хлор», «фтор». Произношение некоторых знаков соответствует их латинскому названию: кремний – «силициум», ртуть – «гидраргирум», медь – «купрум», железо – «феррум».
Учитель: Какое значение знаков химических элементов?
Ученик: Знак химического элемента имеет несколько значений. Во-первых, им обозначают все атомы данного элемента. Во-вторых, знаком химического элемента можно обозначить один или несколько атомов данного элемента. Например, запись O может означать: «химический элемент кислород» или «один атом кислорода».
Чтобы обозначить несколько атомов данного химического элемента, нужно перед его знаком поставить число, соответствующее количеству атомов. Например, запись 3N означает «три атома азота». Цифра, стоящая перед знаком химического элемента, называется коэффициентом.
Ученик: Попытки упорядочить старинные химические знаки продолжались до конца XVIII века. В начале XIX века английский химик Дж. Дальтон предложил обозначать атомы химических элементов кружками, внутри которых помещались точки, чёрточки, начальные буквы английских названий металлов и др. Химические знаки Дальтона получили некоторое распространение в Великобритании и в Западной Европе, но вскоре были вытеснены чисто буквенными знаками, которые шведский химик Й. Я. Берцелиус предложил в 1814. Высказанные им принципы составления химических знаков сохранили свою силу до настоящего времени. В России первое печатное сообщение о химических знаках Берцелиуса сделал в 1824 московский врач И. Я. Зацепин.
Учитель: Каковы принципы обозначения?
Ученик: Современные символы химических элементов состоят из первой буквы или из первой и одной из следующих букв латинского названия элементов. При этом только первая буква — заглавная. Например, H — водород (лат. Hydrogenium), N — азот (лат. Nitrogenium), Ca — кальций (лат. Calcium), Pt — платина (лат. Platinum) и т. п. Для новооткрытых трансурановых элементов, которые пока не получили утверждённого ИЮПАК названия, используют трехбуквенные обозначения, означающие числительное — порядковый номер. Например, Uut — унунтрий (лат. Ununtrium, 113), Uuh — унунгексий (лат. Ununhexium, 116). Изотопы водорода имеют особые символы и названия: H — протий 1H, D — дейтерий 2H, T — тритий 3H. Для обозначения изобаров и изотопов перед символом химического элемента вверху ставится массовое число (напр., 14N), а слева внизу — порядковый номер элемента (атомный номер) (напр., 64Gd). В том случае, когда в химических формулах и химических уравнениях не указаны массовое число и порядковый номер, каждый химический знак выражает среднюю относительную атомную массу его изотопов в земной коре. Для обозначения заряженного атома вверху справа указывается заряд иона (напр.
При этом только первая буква — заглавная. Например, H — водород (лат. Hydrogenium), N — азот (лат. Nitrogenium), Ca — кальций (лат. Calcium), Pt — платина (лат. Platinum) и т. п. Для новооткрытых трансурановых элементов, которые пока не получили утверждённого ИЮПАК названия, используют трехбуквенные обозначения, означающие числительное — порядковый номер. Например, Uut — унунтрий (лат. Ununtrium, 113), Uuh — унунгексий (лат. Ununhexium, 116). Изотопы водорода имеют особые символы и названия: H — протий 1H, D — дейтерий 2H, T — тритий 3H. Для обозначения изобаров и изотопов перед символом химического элемента вверху ставится массовое число (напр., 14N), а слева внизу — порядковый номер элемента (атомный номер) (напр., 64Gd). В том случае, когда в химических формулах и химических уравнениях не указаны массовое число и порядковый номер, каждый химический знак выражает среднюю относительную атомную массу его изотопов в земной коре. Для обозначения заряженного атома вверху справа указывается заряд иона (напр.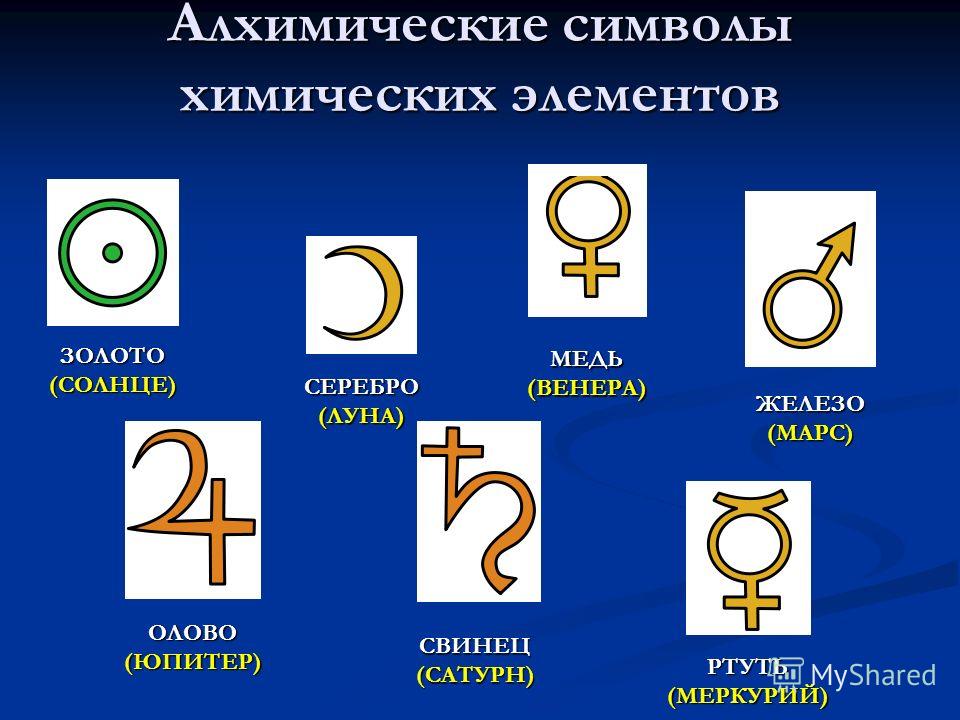 , Ca2+). Внизу справа указывают число атомов данного элемента в реальной или условной молекуле (напр., N2 или Fe2O3). Свободные радикалы обозначаются точкой справа (напр., Cl·).
, Ca2+). Внизу справа указывают число атомов данного элемента в реальной или условной молекуле (напр., N2 или Fe2O3). Свободные радикалы обозначаются точкой справа (напр., Cl·).
Ученик: Химики древнего мира и средних веков применяли для обозначения веществ, химических операций и приборов символические изображения, буквенные сокращения, а также сочетания тех и других. Семь металлов древности изображали астрономическими знаками семи небесных светил: Солнца (, золото), Луны (☽ , серебро), Юпитера (♃ , олово),Венеры (♀, медь), Сатурна (♄ , свинец), Меркурия (☿ , ртуть),Марса (♁ , железо). Металлы, открытые в XV—XVIII веках, — висмут, цинк, кобальт — обозначали первыми буквами их названий. Знак винного спирта (лат. spiritus vini) составлен из букв S и V. Знаки крепкой водки (лат. aqua fortis, азотная кислота) и золотой водки (лат. aqua regis, царская водка, смесь соляной и азотной кислот) составлены из знака воды Ñ и прописных букв F и R соответственно. Знак стекла (лат. vitrum) образован из двух букв V —прямой и перевёрнутой.
Учитель: Расскажите про международные и национальные символы.
Ученик: Приведённые в Периодической таблице элементов символы являются международными, но наряду с ними в некоторых странах употребительны обозначения, произведённые от национальных названий элементов. Например, во Франции вместо символов азота N, бериллия Be и вольфрама W могут использоваться Az (Azote), Gl (Glucinium) и Tu (Tungstène). В США вместо знака ниобия Nb нередко применяют Cb (Columbium). В Китае используется свой вариант химических знаков, основанный на китайских символах. Большинство символов были изобретены в XIX — XX веках. Символы для металлов (кроме ртути) используют радикал или («золото», металл вообще), для твёрдых при нормальных условиях неметаллов — радикал («камень»), для жидкостей — («вода»), для газов — («пар»). Например, символ молибдена состоит из радикала и фонетика, задающего произношение mu4.
Физкультминутка (1 мин)
2. Игра «Цветик-семицветик» (7 баллов) (2 мин. )
)
Вписать в каждый лепесток цветика-семицветика физические тела или вещества (по вариантам), которые нужно выбрать из определенного перечня.
Гвоздь, цинк, ваза, молоток, железо, поваренная соль, ложка, магний, золото, вода, льдина, яблоко, карандаш, стекло.
Физические тела Вещества
Ответы:
Тела: гвоздь, ваза, молоток, ложка, льдина, яблоко, карандаш.
Вещества: цинк, железо, поваренная соль, магний, золото, вода, стекло.
3. Игра «Крестики-нолики» (3 балла) (1 мин)
Найдите выигрышный путь в таблицах:
I вариант — однородные смеси;
II вариант — неоднородные смеси.
Ответ:
Верхняя строчка — однородные смеси;
Нижняя строчка — неоднородные смеси.
4. Конкурс «Юные химики» (15 баллов, по 1 баллу за каждое правильный ответ) (2мин)
Какая из команд больше назовет правил техники безопасности в кабинете химии.
5. Конкурс «Раздели меня» (4 балла), по 1 баллу за правильный ответ) (3 мин)
Установите соответствие между смесью и методом, которым ее можно разделить на чистые вещества.
Ответ:
I вариант
II вариант
6. Конкурс «Ассоциации». (9 баллов) (2 мин)
Участникам необходимо назвать лабораторное оборудование, которое по функции, внешнему виду или названию ассоциируется с изображенным на рисунке объектом;
7. Конкурс «Я на выдумки мастак» (7 баллов, по 1 баллу за элемент). (1 мин)
Назовите как можно больше химических элементов, используя буквы термина «Вольфрам».
Ответ: ванадий, осмий, литий, франций, родий, алюминий, магний.
8. Конкурс «Парад химических элементов» (3 балла). (1 мин)
Заполни таблицу.
Ответ:
10 . Конкурс «Пирамида» (3 балла) (2 мин)
Составьте пирамиду химических элементов по их атомным массам.
Ответ:
11. Конкурс «Термины». (12 баллов, по 1 баллу за правильный ответ) (2 мин)
Учитель диктует названия химических элементов, учащиеся записывают их символами на доске.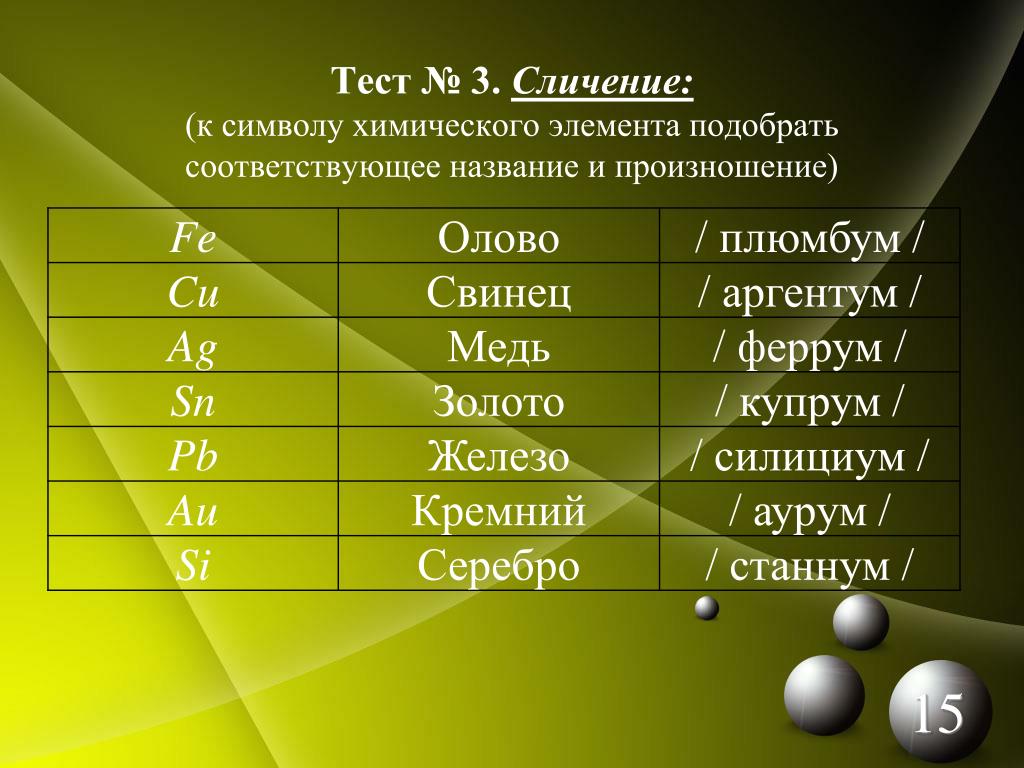
Ответ:
N, Na, Ba, Ca, H, O, C, Al, Mg, K, Cl, F.
12. Конкурс «Последний шанс» (10 баллов, по 1 баллу правильный ответ) (2 мин)
Команды по очереди, не повторяясь, отвечают на вопросы. Выигрывает та из них, которая последней даст ответ. Переведите с химического языка на общепринятый следующие выражения:
Не все то аурум, что блестит. (Не все то золото, что блестит).
Белый, как карбонат кальция. (Белый как мел).
Феррумный характер. (Железный характер).
Слово — аргентум, а молчание — аурум. (Слово — серебро, а молчание — золото) .
Много аш два о утекло. (Много воды утекло) .
Какой элемент всегда рад. (Радон).
Какой газ утверждает, что он не он? (Неон).
Какой элемент «вращается» вокруг Солнца? (Уран).
Какой элемент является настоящим «гигантом» (Титан).
Какой элемент назван в честь России? (Рутений).
IV. П одведение итогов. (1 мин.)
П одведение итогов. (1 мин.)
Учитель: Мы с вами все это время на протяжении двенадцати уроков старались открыть символическую дверь и войти в интересную страну, которая называется химией. Мы смогли ее немножечко приоткрыть и поглядеть, что за ней. Там интересно, там много неизвестного, которое влечет нас. Сейчас мы решим, готовы ли вы к серьезным испытаниям, которые ждут нас. Выясним, достаточно ли у вас для этого знаний, хорошо ли вы усвоили данные темы. Да не просто усвоили, а кто из вас сделал лучше.
(Объявление оценок по баллам)
V. Домашнее задание (1 мин)
§12, №1-4 с.44. Творческое задание: составить химический кроссворд.
VI. Рефлексия (1 мин)
Сегодня я узнал…
было трудно…
я понял, что…
я научился…
было интересно узнать, что…
меня удивило…
Занятие 4. Химические элементы. Знаки химических элементов. Относительная атомная масса.
Химический элемент
– совокупность атомов одного вида.
Почему одинаковые атомы были названы именно так? Слово «элемент» (лат. elementum) использовалось еще в античности (Цицероном, Овидием, Горацием) как часть чего-то (элемент речи, элемент образования и т. п.). В древности было распространено изречение «Как слова состоят из букв, так и тела — из элементов». Отсюда вероятное происхождение этого слова: по названию ряда согласных букв в латинском алфавите: l, m, n, t («el» — «em» — «en» — «tum»).
ХИМИЧЕСКИЙ ЯЗЫК
Человечество использует много разных языков.
Кроме естественных языков (японского, английского, русского – всего более 2,5
тысяч), существуют еще и искусственные языки, например, эсперанто. Среди
искусственных языков выделяются языки различных наук. Так, в химии используется
свой, химический язык. Химический язык – система условных обозначений и
понятий, предназначенная для краткой, ёмкой и наглядной записи и передачи
химической информации. Сообщение, написанное на большинстве естественных
языков, делится на предложения, предложения – на слова, а слова – на
буквы.
Мы с вами будем говорить особым, химическим языком. В нем, как и в нашем родном, русском, мы выучим вначале буквы — химические символы, затем научимся писать на их основе слова — формулы и далее, с помощью последних, — предложения — уравнения химических реакций:
Болгарские просветители Кирилл и Мефодий являются авторами славянской письменности-алфавита. А вот отцом химической письменности является шведский ученый Й. Я. Берцелиус, который предложил в качестве букв — символов химических элементов использовать начальные буквы их латинских названий, или, если с этой буквы начинаются названия нескольких элементов, то — добавлять к начальной букве еще одну из последующих букв названия.
Химические знаки (символы химические) – буквенные обозначения химических элементов. Состоят из первой или из первой и одной из следующих букв латинского названия элемента,напр., углерод – С (Carboeum), кальций – Ca (Calcium), кадмий – Cd…
Символ химического элемента
– это условное
обозначение химического элемента.
Историческая справка: Химики древнего мира и средних веков применяли для обозначения веществ, химических операций и приборов символические изображения, буквенные сокращения, а также сочетания тех и других. Семь металлов древности изображали астрономическими знаками семи небесных светил: Солнца ( ☉ , золото), Луны (☽ , серебро), Юпитера (♃ , олово),Венеры (♀, медь), Сатурна (♄ , свинец), Меркурия (☿ , ртуть),Марса (♁ , железо).
Металлы, открытые в XV—XVIII веках, — висмут, цинк,кобальт — обозначали первыми буквами их названий. Знак винного спирта (лат. spiritus vini) составлен из букв S и V. Знаки крепкой водки (лат. aqua fortis, азотная кислота) и золотой водки (лат. aqua regis, царская водка, смесь соляной и азотной кислот) составлены из знака водыÑ и прописных букв F и R соответственно. Знак стекла (лат. vitrum) образован из двух букв V —прямой и перевёрнутой.
Попытки упорядочить старинные химические знаки продолжались до конца
XVIIIвека. В начале XIX века английский химик Дж. Дальтон предложил обозначать
атомы химических элементов кружками, внутри которых помещались точки, чёрточки,
начальные буквы английских названий металлов и др.
В начале XIX века английский химик Дж. Дальтон предложил обозначать
атомы химических элементов кружками, внутри которых помещались точки, чёрточки,
начальные буквы английских названий металлов и др.
Химические знаки
Дальтона получили некоторое распространение в Великобритании и в Западной
Европе, но вскоре были вытеснены чисто буквенными знаками, которые шведский
химик Й. Я. Берцелиус предложил в 1814. Высказанные им принципы составления
химических знаков сохранили свою силу до настоящего времени. В России первое
печатное сообщение о химических знаках Берцелиуса сделал в 1824московский врач
И. Я. Зацепин.
ОТНОСИТЕЛЬНАЯ АТОМНАЯ МАССА
Историческая справка: Английский ученый Джон Дальтон (1766–1844) на своих лекциях демонстрировал студентам выточенные из дерева модели атомов, показывая, как они могут соединяться, образуя различные вещества. Когда одного из студентов спросили, что такое атомы, он ответил: «Атомы – это раскрашенные в разные цвета деревянные кубики, которые изобрел мистер Дальтон».
Конечно, Дальтон прославился не своими «кубиками» и даже не тем, что в двенадцатилетнем возрасте стал школьным учителем. С именем Дальтона связано возникновение современной атомистической теории. Впервые в истории науки он задумался о возможности измерения масс атомов и предложил для этого конкретные способы. Понятно, что непосредственно взвесить атомы невозможно. Дальтон рассуждал только о «соотношении весов мельчайших частиц газообразных и других тел», то есть об относительных их массах. И поныне, хотя масса любого атома в точности известна, ее никогда не выражают в граммах, так как это исключительно неудобно. Например, масса атома урана – самого тяжелого из существующих на Земле элементов – составляет всего 3,952·10
–22 г. Поэтому массу атомов выражают в относительных единицах, показывающих, во сколько раз масса атомов данного элемента больше массы атомов другого элемента, принятого в качестве стандарта. Фактически это и есть «соотношение весов» по Дальтону, т.е. относительная атомная масса. Массы атомов очень малы.
Массы атомов очень малы.
Абсолютные массы некоторых атомов:
m(C) =1,99268 ∙ 10 -23 г
m(H) =1,67375 ∙ 10 -24 г
m(O) =2,656812 ∙ 10 -23 г
В настоящее время в физике и химии принята единая система измерения. Введена атомная единица массы (а.е.м.)
m(а.е.м.) = 1/12 m(12C) = 1,66057 ∙ 10 -24 г.
Ar(H) = m(атома)/ m (а.е.м.) = 1,67375 ∙ 10 -24 г/1,66057 ∙ 10 -24 г = 1,0079 а.е.м.
Ar – показывает, во сколько раз данный атом тяжелее 1/12 части атома 12С, это безразмерная величина.
Относительная атомная масса – это 1/12 массы атома углерода, масса которого равна 12 а.е.м.
Относительная атомная масса безразмерная величина!!!
Например , относительная атомная масса атома кислорода равна 15,994. Считать самим значения относительной атомной массы не всегда обязательно. Можно воспользоваться значениями, приведенными в периодической системы химических элементов Д. И. Менделеева. Записать это следует так:
И. Менделеева. Записать это следует так:
Ar(O) = 16 .
Всегда используем округлённое значение.
Исключение представляет относительная атомная масса атома хлора: Ar(Cl) = 35,5.
Связь между абсолютной и относительной массами атома представлена формулой:
Распространённость элементов в природе. Основную массу космического вещества составляют Н и Не (99,9%).
Из 107 химических элементов только 89 обнаружены в природе, остальные, а именно технеций (атомный номер 43), прометий (атомный номер 61), астат (атомный номер 85), франций (атомный номер 87) и трансурановые элементы, получены искусственно посредством ядерных реакций (ничтожные количества Te, Pm, Np, Fr образуются при спонтанном делении урана и присутствуют в урановых рудах). В доступной части Земли наиболее распространены 10 элементов с атомными номерами в интервале от 8 до 26. В земной коре они содержатся в следующих относительных количествах:
Перечисленные 10 элементов составляют 99,92% массы земной коры.
Элемент | Атомный номер | |
47,00 | ||
29,50 | ||
8,05 | ||
4,65 | ||
Ртути соответствовала планета Меркурий, которая быстрее всех передвигается по небосводу. Да на “защите экологии” кормится большое количество народу! Ртуть – химический элемент, переходный метал. Вы, разумеется, догадались, что речь идет о ртути. Сколько ртути в люминесцентных лампах? Что делать? Опасность ртути чрезвычайно преувеличена!
«Химический элемент алюминий» – Какими физическими свойствами обладает алюминий. Незнакомец. Алюминий. На каких свойствах алюминия основано его применение. Цепочки превращений. Применение. Алюминиевая посуда. Состав. Химические свойства. Темные пятна. Физические свойства. Посуда из алюминия.
Физические свойства. Посуда из алюминия.
«Знаки элементов» – Мифы древних греков. Астрономические начала. Знаки химических элементов. Понятие о знаках химических элементов. Период. Имена великих ученых. Металлы. Свойства элементов. Географические начала. Координаты. Фтор. Литий. Малые периоды. Водород. Йёнс Якоб Берцелиус. Химический элемент. Подгруппы. Cера.
«Никель» – Блестящий серебристо-белый металл. Элемент земных глубин. Сплавы никеля. Шведский минералог А. Кронштедт. Немецкий химик Иеремия Рихтер. Применяется во многих отраслях народного хозяйства. Горит никель только в виде порошка. Является основным компонентом метеоритов. Похожий на серебро метал. Нержавеющие стали.
«Медь, серебро, золото» – Комплексные соединения. Особенности химии меди. Простые вещества. Получение меди. Серебро. Получение и разрушение. Почернение серебряных предметов. Кислородные соединения. Простые вещества. Элементы IБ-группы. Выплавка меди. Окислительно-восстановительные свойства. Минералы. Степени окисления. Химия элементов.
Степени окисления. Химия элементов.
«Химический элемент водород» – Слово хранителям знаний. Дилетанты. Лучший спортсмен. Обыватели. Фронтальная беседа. Свойства водорода. Ведущий. Скоростная дорожка. Водород. Номера практически возможных реакций. Материалы проекта или урока. Главное применение водорода. Проведем проверку знаний. Уравнения реакций. Действующие лица.
Всего в теме 46 презентаций
Как и в любой науке, в химии существует своя система условных обозначений, свой язык. Урок посвящен знакомству с языком химической науки, изучению символов химических элементов. Вы узнаете, когда и кем были придуманы современные символы химических элементов.
Тема: Первоначальные химические представления
Урок: Символы химических элементов
Еще в Средневековье, во времена алхимии использовались различные знаки для обозначения веществ, в основном металлов. Ведь основной целью алхимиков было получение из различных металлов золота. Поэтому каждый из них использовал свою систему обозначений.
В 19 в. появилась необходимость использования понятной для всех ученых символики. И одним из первых такую символику предложил Джон Дальтон. Но его обозначениями было неудобно пользоваться.
Рис. 1. Джон Дальтон и его система обозначения химических элементов
Современную систему химических знаков предложил в начале XIX в. шведский химик Йёнс Якоб Берцелиус. Ученый предложил обозначать химические элементы первой буквой их латинского названия. В те времена все научные статьи печатала на латинском языке, он был общепринятым и понятным для всех ученых.
Например, химический элемент кислород (по-латински Oxygenium) получил обозначение О.
А химический элемент водород (Hydrogenium) – Н. Если названия нескольких элементов начинались на одну и ту же букву, то в символе элемента указывали вторую или одну из последующих букв названия. Например, ртуть (Hydrargyrum) обозначается Hg.
Обратите внимание, что первая буква знака химического элемента всегда заглавная, если есть вторая буква – то она строчная.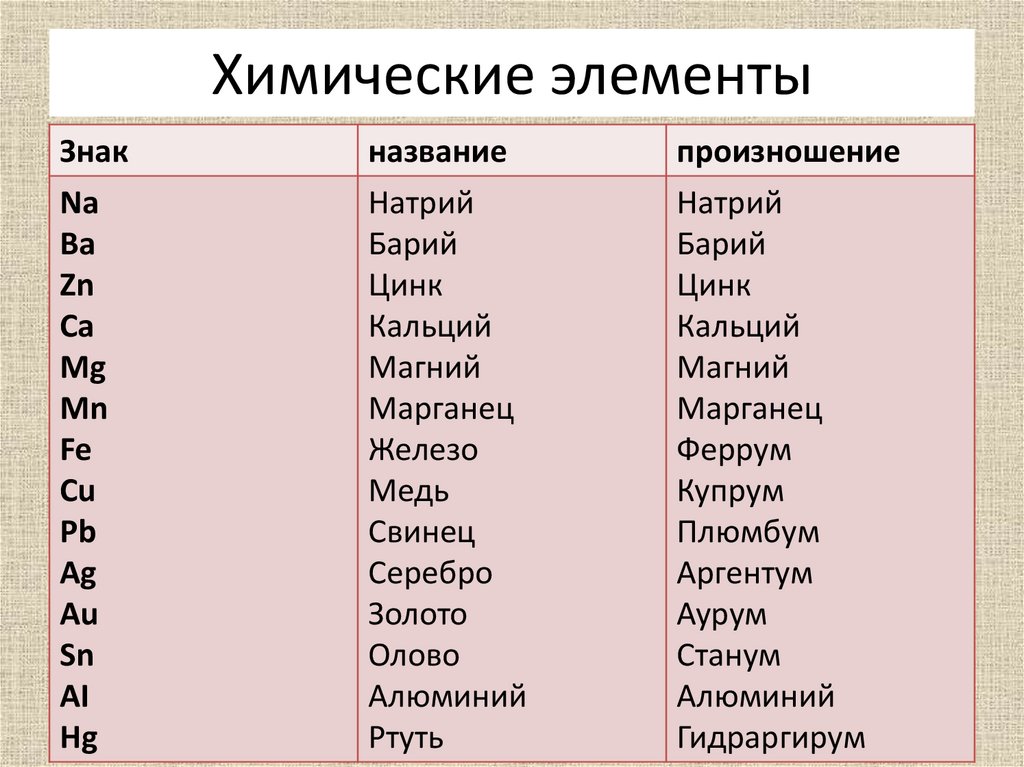 Необходимо запоминать не только названия элементов и их символы, но и произношение, т.е. как эти символы читаются.
Необходимо запоминать не только названия элементов и их символы, но и произношение, т.е. как эти символы читаются.
Определенных правил произношения знаков химических элементов нет. Их надо учить наизусть. Знаки некоторых химических элементов произносятся так же, как и соответствующая буква: кислород – «о», сера – «эс», фосфор – «пэ», азот – «эн», углерод – «цэ».
Знаки других элементов произносятся так же, как и называются сами элементы: «натрий», «калий», «хлор», «фтор».
Произношение некоторых знаков соответствует их латинскому названию: кремний – «силициум», ртуть – «гидраргирум», медь – «купрум», железо – «феррум».
Рис. 2. Символы и названия некоторых химических элементов
Знак химического элемента имеет несколько значений. Во-первых, им обозначают все атомы данного элемента. Во-вторых, знаком химического элемента можно обозначить один или несколько атомов данного элемента. Например, запись O может означать: «химический элемент кислород» или «один атом кислорода».
Чтобы обозначить несколько атомов данного химического элемента, нужно перед его знаком поставить число, соответствующее количеству атомов. Например, запись 3N означает «три атома азота».
Цифра, стоящая перед знаком химического элемента, называется коэффициентом.
1. Сборник задач и упражнений по химии: 8-й класс: к учебнику П.А. Оржековского и др. «Химия, 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. – М.: АСТ: Астрель, 2006.
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского – М.: АСТ: Астрель: Профиздат, 2006. (с.19-21)
3. Химия: 8-й класс: учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005.(§8)
4. Химия: неорг. химия: учеб. для 8 кл. общеобр. учреждений / Г.Е. Рудзитис, ФюГю Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§6)
5. Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Единая коллекция цифровых образовательных ресурсов ().
2. Электронная версия журнала «Химия и жизнь» ().
Домашнее задание
с.19-21 №№ 1-5 из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского – М.: АСТ: Астрель: Профиздат, 2006.
Самостоятельная работа по химии Знаки химических элементов 8 класс
Самостоятельная работа по химии Знаки химических элементов Периодическая система химических элементов Д.И. Менделеева с ответами для учащихся 8 класса. Самостоятельная работа состоит из 4 вариантов в каждом по 3 задания.
1 вариант
1. Заполните таблицу
| Название химического элемента | Химический символ | Произношение химического символа |
| Медь | ||
| Водород | ||
| Калий | ||
| Углерод | ||
| Серебро |
2. У становите соответствие между названием химического элемента, положением в Периодической системе и его символом:
У становите соответствие между названием химического элемента, положением в Периодической системе и его символом:
Химический элемент
1) магний
2) азот
3) железо
4) гелий
Положение в Периодической системе
А) 1-й период; VIII группа, главная подгруппа
Б) 4-й период; VIII группа, побочная подгруппа
В) 3-й период; II группа, главная подгруппа
Г) 2-й период; V группа, главная подгруппа
Химический символ
а) Fe
б) Mg
в) He
г) N
3. Предложите не менее трех классификаций, в основе которых лежат различные признаки, связанные с положением элементов: Ве, Se, V, N, As, Cr, Mg в Периодической системе.
2 вариант
1. Заполните таблицу
| Название химического элемента | Химический символ | Произношение химического символа |
| Кислород | ||
| Кремний | ||
| Алюминий | ||
| Сера | ||
| Цинк |
2. У становите соответствие между названием химического элемента, положением в Периодической системе и его символом:
У становите соответствие между названием химического элемента, положением в Периодической системе и его символом:
Химический элемент
1) фтор
2) хром
3) бор
4) натрий
Положение в Периодической системе
А) 4-й период; VI группа, побочная подгруппа
Б) 2-й период; VII группа, главная подгруппа
В) 3-й период; I группа, главная подгруппа
Г) 2-й период; III группа, главная подгруппа
Химический символ
а) F
б) Na
в) Cr
г) B
3. Предложите не менее трех классификаций, в основе которых лежат различные признаки, связанные с положением элементов: Br, S, О, Cl, Si, Cr, Mn в Периодической системе.
3 вариант
1. Заполните таблицу
| Название химического элемента | Химический символ | Произношение химического символа |
| Кальций | ||
| Железо | ||
| Азот | ||
| Серебро | ||
| Фосфор |
2. У становите соответствие между названием химического элемента, положением в Периодической системе и его символом:
У становите соответствие между названием химического элемента, положением в Периодической системе и его символом:
Химический элемент
1) серебро
2) кремний
3) кислород
4) аргон
Положение в Периодической системе
А) 3-й период; IV группа, главная подгруппа
Б) 5-й период; I группа, побочная подгруппа
В) 3-й период; VIII группа, главная подгруппа
Г) 2-й период; VI группа, главная подгруппа
Химический символ
а) O
б) Ag
в) Ar
г) Si
3. Предложите не менее трех классификаций, в основе которых лежат различные признаки, связанные с положением элементов: Са, С, Al, Sc, Ti, Ве, Mg в Периодической системе.
4 вариант
1. Заполните таблицу
| Название химического элемента | Химический символ | Произношение химического символа |
| Магний | ||
| Натрий | ||
| Марганец | ||
| Хлор | ||
| Кремний |
2. У становите соответствие между названием химического элемента, положением в Периодической системе и его символом:
У становите соответствие между названием химического элемента, положением в Периодической системе и его символом:
Химический элемент
1) литий
2) сера
3) бериллий
4) медь
Положение в Периодической системе
А) 2-й период; II группа, главная подгруппа
Б) 2-й период; I группа, главная подгруппа
В) 4-й период; 1 группа, побочная подгруппа
Г) 3-й период; VI группа, главная подгруппа
Химический символ
а) Cu
б) S
в) Be
г) Li
3. Предложите не менее трех классификаций, в основе которых лежат различные признаки, связанные с положением элементов: Р, Si, V, Sc, Na, Ge, Си в Периодической системе.
Ответы на самостоятельную работу по химии Знаки химических элементов
Вариант 1.
1. Cu — купрум, Н — аш, К — калий, С — це, Ag — аргентум.
2.
1) В — б,
2) Г — г,
3) Б — а,
4) А — в.
3. Возможные классификации:
а) элементы главных (Ве, Se, N, As, Mg) и побочных подгрупп (V, Cr),
б) элементы малых (Ве, N, Mg) и больших (Se, V, As, Cr) периодов,
в) элементы одного периода (2 — Ве, N; 3 — Mg; 4 — Se, V, As, Cr),
г) элементы одной группы (II — Ве, Mg, V — N, As, V, VI — Se, Cr).
Вариант 2.
1. О — о, Si — силициум, Al — алюминий, S — эс, Zn — цинк.
2.
1) Б — а,
2) А — в,
3) Г — г,
4) В — б.
3. Возможные классификации:
а) элементы главных (Br, S, О, Cl, Si) и побочных подгрупп (Mn, Cr),
б) элементы малых (S, О, Cl, Si) и больших (Br, Mn, Cr) периодов,
в) элементы одного периода (2 -0; 3 — Si, S, Cl; 4 — Br, Mn, Cr),
г) элементы одной группы (IV — Si, VI — О, S, Cr, VII — Br, Cl, Mn).
Вариант 3.
1. Са — кальций, Fe — феррум, N — эн, Ag — аргентум, Р — пэ.
2.
1) Б — б,
2) А — г,
3) Г — а,
4) В — в.
3. Возможные классификации:
а) элементы главных (Са, С, Al, Ве, Mg) и побочных подгрупп (Sc, Ti),
б) элементы малых (С, Al, Ве, Mg) и больших (Са, Sc, Ti) периодов,
в) элементы одного периода (2 — С, Ве; 3 — Al, Mg; 4 — Са, Sc, Ti),
г) элементы одной группы (II — Ве, Са, Mg, III — Al, Sc, IV — С, Ti).
Вариант 4.
1. Mg — магний, Na — натрий, Mn — марганец, Cl — хлор, Si — силициум.
Mg — магний, Na — натрий, Mn — марганец, Cl — хлор, Si — силициум.
2.
1) Б — г,
2) Г — б,
3) А — в,
4) В — а.
3. Возможные классификации:
а) элементы главнь1х (Р, Si, Na, Ge) и побочных подгрупп (V, Sc, Cu),
б) элементы малых (Р, Si, Na) и больших (V, Sc, Ge, Cu) периодов,
в) элементы одного периода (3 — Р, Si, Na; 4 — Cu, Ge, Sc, V),
г) элементы одной группы (I — Na, Cu, III — Sc, IV — Si, Ge, V — Р, V).
PDF-версия
Самостоятельная работа Знаки химических элементов(105 Кб, pdf)
Символы химических элементов – РЕАХИМПРИБОР
Принципы и История
Символы это условное обозначение химических элементов.
Вместе с химическими формулами, схемами и уравнениями химических реакций образуют формальный язык химии — систему условных обозначений и понятий, предназначенную для краткой, ёмкой и наглядной записи и передачи химической информации.
В зависимости от контекста символ химического элемента может обозначать:
Название химического элемента;
Один атом элемента;
Один моль атомов этого элемента.
Принципы обозначения
Современные символы химических элементов состоят из первой буквы или из первой и одной из следующих букв латинского названия элементов. Знакомо наверно из таблицы Менделеева.
При этом только первая буква — заглавная.
Например, H — водород (лат. Hydrogenium), N — азот (лат. Nitrogenium), Ca — кальций (лат. Calcium), Pt — платина (лат. Platinum) и т. п.
Для неоткрытых и новооткрытых трансурановых элементов, которые пока не получили утверждённого ИЮПАК названия, используют трехбуквенные обозначения, означающие числительное — порядковый номер.
Например, Uue — унуненний (лат. Ununennium, 119), Ubh — унбигексий (лат. Unbihexium, 126).
Изотопы водорода имеют особые символы и названия: H — протий 1H, D — дейтерий 2H, T — тритий 3H.
Для обозначения изобаров и изотопов перед символом химического элемента вверху ставится массовое число (напр., 14N),
а слева внизу — порядковый номер элемента (атомный номер) (напр., 64Gd).
В том случае, когда в химических формулах и химических уравнениях не указаны массовое число и порядковый номер, каждый химический знак выражает среднюю относительную атомную массу его изотопов в земной коре.
Для обозначения заряженного атома вверху справа указывается заряд иона (напр., Ca2+).
Внизу справа указывают число атомов данного элемента в реальной или условной молекуле (напр., N2 или Fe2O3).
Свободные радикалы обозначаются точкой справа (напр., Cl·).
История символов химических элементов
Символы химических элементов на почтовой марке СССР,
посвящённой 20 конгрессу ИЮПАК,
проводившемуся в 1965 году в Москве
Учёные древнего мира и средних веков так называемые Алхимики, применяли для обозначения веществ, химических операций и приборов символические изображения, буквенные сокращения, а также сочетания тех и других.
Таблицу Менделеева тогда ещё не знали.
Систематическое применение алхимиками особых химических знаков начинается с XIII в.
Одними из первых начинают прививаться следующие обозначения четырёх элементов-стихий Аристотеля:
Огонь Земля Воздух Вода
В то же время формируется символика металлов.
Так, у Раймунда Луллия семь металлов, известных с древности, имеют обозначения, тождественные с астрологическими знаками семи небесных светил: Солнца (☉, золото), Луны (☽, серебро), Юпитера (♃, олово), Венеры (♀, медь), Сатурна (♄, свинец), Меркурия (☿, ртуть), Марса (♁, железо).
Происхождение и смысл этих символов достоверно неизвестны.
Возможно, что знак свинца должен изображать косу Сатурна, знак железа — щит и копьё Марса, знак меди — ручное зеркало Венеры и т. п.: тогда их можно рассматривать, как знаки мифологических божеств, под названиями которых были известны металлы; но одинаково вероятно, что эти знаки являются и сокращениями имён тех же божеств. У алхимиков XIV—XVI вв. встречаются и такие объяснения, что замкнутый круг есть знак совершенства металла, полукруг (полумесяц) — знак приближения его к совершенству.
У алхимиков XIV—XVI вв. встречаются и такие объяснения, что замкнутый круг есть знак совершенства металла, полукруг (полумесяц) — знак приближения его к совершенству.
Металлы, открытые в XV—XVIII веках, — висмут, цинк, кобальт — стали обозначаться первыми буквами их названий.
Тогда же появились символы сложных веществ, связанные с их названиями.
Например, знак винного спирта составлен из букв S и V (лат. spiritus vini).
Знаки крепкой водки (лат. aqua fortis) — азотной кислоты, и царской водки (лат. aqua regis), смеси соляной и азотной кислот, составлены из знака воды Alchemy water и прописных букв F и R соответственно.
Знак стекла (лат. vitrum) образован из двух букв V — прямой и перевёрнутой.
Лавуазье А.Л. работая над новой классификацией и номенклатурой,
Предложил весьма громоздкую систему химической символики для элементов и соединений.
Попытки упорядочить старинные химические знаки продолжались до конца XVIII века.
Более целесообразная знаковая система была предложена в 1787 г.
Ж.-А. Гассенфратцем и П.-О. Аде; их химические знаки приспособлены уже к антифлогистической теории Лавуазье и имеют некоторые особенности, сохранившиеся впоследствии.
Они предложили ввести в качестве общих для каждого класса веществ символы в виде простых геометрических фигур и буквенных обозначений, а также прямые линии, проведённые в различных направлениях, для обозначения «истинных элементов» — света и теплорода, а также элементарных газов — кислорода, азота и водорода.
Так, все металлы должны были обозначаться кружками с начальной буквой (иногда две буквы, причём вторая строчная) французского названия металла посередине; все щёлочи и щёлочные земли (отнесённые Лавуазье тоже к числу элементов) — различным образом расположенными треугольниками с латинскими буквами посреди и т. д.
В начале XIX века английский химик Дж. Дальтон предложил обозначать атомы химических элементов кружками, внутри которых помещались точки, чёрточки, начальные буквы английских названий металлов и др.
Символы химических элементов Дальтона получили некоторое распространение в химической литературе, но вскоре были вытеснены новой буквенной символикой, предложенной шведским химиком Й. Я. Берцелиусом.
В 1814 г. Берцелиус подробно изложил систему химической символики, основанную на обозначении элементов одной или двумя буквами латинского названия элемента; число атомов элемента предлагалось указывать надстрочными цифровыми индексами (принятое в настоящее время указание числа атомов подстрочными цифрами предложил в 1834 г. Юстус Либих). Система Берцелиуса получила всеобщее признание и сохранилась до настоящего времени.
В России первое печатное сообщение о химических знаках Берцелиуса сделал в 1824 Московский врач.
Перечень символов химических элементов и их атомных весов Дж. Дальтона (1808)
Химическая формула меди: символ, свойства, формулы, примеры
- Автор Ankita Sahay
- Последнее изменение 19-07-2022
- Автор Анкита Сахай
- Последнее изменение 19-07-2022
Химическая формула меди: Медь — это металл, имеющий символ «\({\rm{Cu}}\). » Медь является третьим наиболее широко используемым металлом в мире. Это элемент d-блока в периодической таблице с атомным номером \(29\). Он кажется красноватым и является чрезвычайно пластичным металлом. Медь также известна как «чеканочный металл», потому что она использовалась для изготовления монет в древние времена. Это один из хорошо известных металлов, который используется во многих областях по всему миру.
» Медь является третьим наиболее широко используемым металлом в мире. Это элемент d-блока в периодической таблице с атомным номером \(29\). Он кажется красноватым и является чрезвычайно пластичным металлом. Медь также известна как «чеканочный металл», потому что она использовалась для изготовления монет в древние времена. Это один из хорошо известных металлов, который используется во многих областях по всему миру.
Медь является чрезвычайно хорошим проводником тепла и электричества, и это свойство меди объясняет ее широкое использование в производстве посуды и электрических проводов. Медь также является необходимым микроэлементом, необходимым человеческому организму. Медь обычно извлекается из руд Халькопирит, также известный как медный колчедан и подобные сульфидные руды. Медь в основном встречается в Чили и Перу, расположенных в Южной Америке. В Индии основными производителями меди являются Джаркханд, Раджастхан и Мадхья-Прадеш. После того, как медные руды извлечены, они обрабатываются в несколько этапов для извлечения из них чистой и рафинированной металлической меди.
Химическая формула меди
Узнайте, как написать химическую формулу
Название происходит от латинского слова cuprum , обозначающего Кипр, остров, где римляне впервые получили медь. Поскольку медь является элементом, вместо химической формулы у нее есть символ. Символ меди: \({\rm{‘Cu’}}\). Символ \({\rm{‘Cu’}}\) происходит от самого купрума . Этот элемент известен с доисторических времен.
Медь — это металл, который используется в различных сферах жизни и занимает важную часть цивилизации. Медь находится в группе \(11\) и периоде \(4\) современной периодической таблицы. Его атомный номер \(29{\text {th}}\) элемент современной периодической таблицы, также известный как переходный элемент, поскольку он является элементом d-блока. Некоторые из важных физических свойств меди приведены ниже:
- Медь имеет характерный красновато-коричневый цвет.
- Медь — чрезвычайно мягкий, пластичный и ковкий металл. Таким образом, ему можно придать нужную форму или согнуть в соответствии с нашими потребностями.

- Является хорошим проводником тепла и электричества. По этой причине из него изготавливают электрические провода и посуду. 9{65} \mathrm{Cu}\)
Химические свойства меди
1. Как и другие металлы, медь реагирует с влажной атмосферой, что приводит к коррозии. Медь тускнеет до сине-зеленого цвета, образуя гидроксид меди и карбонат меди. Но процесс коррозии в меди протекает крайне медленно, так как под воздействием влаги и воздуха на поверхности металлической меди образуется защитный оксидный слой и основные соли.
2. Медь растворяется в азотной кислоте.
3. Медь реагирует с кислородом воздуха с образованием оксида меди (II).
\({\rm{2Cu}}\left( {\rm{s}} \right){\rm{+}}{{\rm{O}}_{\rm{2}}}\left( {\rm{g}} \right) \to {\rm{2CuO}}\left({\rm{s}} \right)\)
4. Медь реагирует с галогенами с образованием галогенидов меди различных цветов, таких как хлорид меди (желто-коричневое твердое вещество в безводном и сине-зеленое твердое вещество в дигидрате), фторид меди (белый цвет) и бромид меди (черный цвет).
5. В ряду реакционной способности металлов медь занимает нижнее положение. Таким образом, он менее реактивен. Медь вытесняется железом, когда железный гвоздь опускают в раствор медного купороса. Это приводит к образованию сульфата железа и меди.
\(\ mathrm{CuSO}_{4}(\mathrm{aq})+\mathrm{Fe}(\mathrm{s}) \rightarrow \mathrm{FeSO}_{4}(\mathrm{aq}) +\mathrm{Cu}(\mathrm{s})\)
Использование меди
1. Они используются в электроприборах – Поскольку медь является отличным проводником электричества и имеет низкое удельное сопротивление. Серебро — еще один металл, который является отличным проводником электричества, даже лучше, чем медь. Его доступная цена делает его широко используемым во всем мире в производстве электроэнергии, передаче электроэнергии, телекоммуникациях, электронных схемах, производстве электрических проводов, кабелей и т. д.
2. Используется для изготовления посуды – Благодаря высокой теплопроводности, высокой температуре плавления и кипения, а также высокой пластичности медь широко используется для изготовления посуды различных форм и размеров. Как и другие металлы, медные сосуды легко проводят тепло к хранящейся в них пище и быстро готовят ее.
Как и другие металлы, медные сосуды легко проводят тепло к хранящейся в них пище и быстро готовят ее.
3. Медь также используется в теплообменниках кондиционеров, радиаторах компьютеров, автомобильных радиаторах, термосварочных машинах и телевизорах, поскольку этот металл является хорошим проводником тепла.
4. Медь очень полезна в водопроводных трубопроводах и соединительных шинах, которые являются жизненно важными элементами систем распределения электроэнергии, поскольку ее можно легко соединить пайкой, болтами или клеями.
5. Медь является одним из основных питательных веществ для человеческого организма. Он обеспечивает образование эритроцитов в организме вместе с железом. Достаточное количество меди в рационе очень важно, поскольку она помогает поддерживать здоровье костей, кровеносных сосудов, нервов и иммунной системы. Медь помогает предотвратить сердечно-сосудистые заболевания и остеопороз. Медью богаты моллюски, орехи и семечки, крупы с пшеничными отрубями, цельнозерновые продукты, шоколад, мясо и т. д.
д.
6. Медь также используется при изготовлении скульптур и статуй из-за легкости соединения. Он также используется ювелирами и другими ремесленниками.
7. Медь широко используется в автомобилях в качестве высокочистого медного провода, по которому проходит ток от автомобильного аккумулятора по всему автомобилю к такому оборудованию, как фары, центральный замок, цифровой экран и системы спутниковой навигации. Он также используется в электромобилях.
8. Медь также используется в трубопроводах. Он используется для транспорт вода для бытовых нужд; он также используется для подачи природного газа в дома и другие места, где это необходимо.
9. Изготавливаются различные сплавы меди, такие как бронза (медь и олово), латунь (медь и цинк), никель-серебро (медь, цинк и никель). Эти сплавы прочнее и устойчивы к коррозии, чем металлическая медь.
Резюме
В двух словах, медь — это металл, представленный как ‘\({\rm{Cu}}\)’. Это переходный металл, поскольку он присутствует в \ ({\ rm {d}} \) -блоке периодической таблицы. Атомный номер \({\rm{Cu}}\) равен \(29\). Он имеет характерный красновато-коричневый цвет и добывается из руды «Куприт», которая в основном добывается в Южной Америке. Медные рудники также есть в некоторых частях Индии, таких как Джаркханд, Раджастхан и т. д. С древних времен медь была необходима для различных видов жизнедеятельности.
Это переходный металл, поскольку он присутствует в \ ({\ rm {d}} \) -блоке периодической таблицы. Атомный номер \({\rm{Cu}}\) равен \(29\). Он имеет характерный красновато-коричневый цвет и добывается из руды «Куприт», которая в основном добывается в Южной Америке. Медные рудники также есть в некоторых частях Индии, таких как Джаркханд, Раджастхан и т. д. С древних времен медь была необходима для различных видов жизнедеятельности.
Это хороший проводник электричества, поэтому в основном используется для изготовления электрических проводов, кроме меди. Серебро — еще один металл, который является отличным проводником электричества, но медь дешевле серебра, поэтому ее используют для изготовления электрических проводов. Медь поставляет электричество и чистую воду в наши дома и города и играет важную роль в достижении устойчивого развития. Более того, это необходимо для самой жизни, поскольку нашему телу нужны следы меди в качестве минералов, чтобы выжить. 9{1}\)
Q. 2. Откуда произошло химическое название меди?
2. Откуда произошло химическое название меди?
Ответ: Химически медь обозначается как ‘\({\rm{Cu}}\)’. Его символ происходит от латинского слова cuprum , обозначающего Кипр, остров, где римляне впервые получили медь. Таким образом, символ \({\rm{‘Cu’}}\) происходит от первых двух букв самого купрума .
Q.3. Что такое медь?
Ответ: Медь — это металл, присутствующий в d-блоке периодической таблицы. Атомный номер \({\rm{Cu}}\) равен \(29\). Он имеет характерный красновато-коричневый цвет и добывается из руды «Куприт». Медь — очень ковкий и пластичный металл. Кроме того, это отличный проводник электричества и тепла. Благодаря этим уникальным свойствам медь широко используется в производстве электрических проводов и посуды. Он используется в различных сферах жизни и имеет древнюю историю. Медь также известна как «металл для монет», потому что в древние времена люди использовали медные монеты.
Q. 4. Каковы два химических свойства меди?
4. Каковы два химических свойства меди?
Ответ: Два химических свойства меди: (i) Медь реагирует с кислородом воздуха с образованием оксида меди (II). (ii) Медь тускнеет до сине-зеленого цвета с образованием гидроксида меди и карбоната меди.
Q.5. Из чего делают медь?
Ответ: Медь является элементом. Это природный ресурс, обнаруженный в виде руды, известной как куприт, найденной глубоко в земле. После добычи медь проходит несколько этапов очистки и рафинирования, чтобы обойти \(99,9%\) чистого металла.
«Мы надеемся, что эта статья «Химическая формула меди» помогла вам. Если у вас есть какие-либо вопросы, оставьте комментарий ниже, и мы свяжемся с вами».
Практические вопросы по меди с советами и решениями
11 Объяснение запутанных химических символов – сложные проценты
Нажмите, чтобы увеличить Большинство химических символов для элементов в периодической таблице вполне понятны; однако есть небольшой выбор, который, похоже, не имеет никакого отношения к названию своего элемента. После публикации периодической таблицы названий отклоненных элементов несколько дней назад возникли вопросы об этих элементах, поэтому давайте взглянем на их сбивающие с толку символы, а также на причины, стоящие за ними.
После публикации периодической таблицы названий отклоненных элементов несколько дней назад возникли вопросы об этих элементах, поэтому давайте взглянем на их сбивающие с толку символы, а также на причины, стоящие за ними.
Натрий – Natrium (Na)
Латинское название натрия, «natrium», происходит от греческого «nítron» (название карбоната натрия). Его первоисточником, вероятно, является арабское произведение «натрун». Ряд современных языков до сих пор называют элемент натрием, а не натрием, и именно от этого имени происходит его химический символ Na.
Калий – калий (K)
«Kalium» – это латинское название калия, происходящее от арабского «al qalīy», что означает «кальцинированная зола» (зола, оставшаяся после сжигания растительного материала). Как и в случае с натрием, в ряде современных языков калий по-прежнему называется калием, и это название дает элементу его химический символ К.
Железо – Феррум (Fe)
Латинское название железа «ferrum» дает ему символ Fe; оно просто означает «железо» или «меч» и, возможно, имеет семитское происхождение. Этот элемент известен под множеством различных названий на разных языках, причем некоторые источники предполагают, что для него существует более 200 различных названий. Вот список из 213 из них.
Этот элемент известен под множеством различных названий на разных языках, причем некоторые источники предполагают, что для него существует более 200 различных названий. Вот список из 213 из них.
Медь – купрум (Cu)
Нет недостатка в элементах, названных в честь мест, но название меди более тонкое, чем у большинства. Латинское название меди было «cyprium», что само по себе происходит от «kypros», греческого названия Кипра. Остров Кипр много веков назад славился своими запасами меди. Со временем название было упрощено до «купрум», а затем оно превратилось в английскую версию «медь».
Серебро – Argentum (Ag)
Считается, что латинское название серебра «argentum» происходит от индоевропейского языка, что, вероятно, связано с блеском металла. Страна Аргентина названа в честь серебра (хотя и косвенно как ссылка на Рио-де-ла-Плата) и является единственной страной, названной в честь химического элемента, а не наоборот.
Олово – Stannum (Sn)
Латинское название олова, «stannum», возможно, происходит от индоевропейского слова «stag» (капающий), потому что олово плавится при низкой температуре. Есть также предположение, что оно могло быть получено из корнуоллского слова «stean» из-за знаменитых оловянных рудников Корнуолла, хотя другие утверждают, что это слово просто происходит от латыни.
Есть также предположение, что оно могло быть получено из корнуоллского слова «stean» из-за знаменитых оловянных рудников Корнуолла, хотя другие утверждают, что это слово просто происходит от латыни.
Сурьма — Stibium (Sb)
Латинское слово «stibium» происходит от греческого слова «stíbi», что означает краска для глаз, что относится к использованию соединений сурьмы в качестве древнего косметического средства для глаз. Это слово, в свою очередь, вероятно, происходит от арабского или египетского. Сегодня немногие страны называют сурьму сурьмой, несмотря на ее символ.
Вольфрам – Вольфрам (W)
Вольфрам был назван в честь минерала, в котором он был обнаружен, вольфрамита. Это происходит от немецкого «wolf rahm» или «волчья пена», что означает количество олова, «съеденного» металлом во время его добычи. Wolfram до сих пор используется на нескольких языках. Слово «вольфрам» происходит от шведского и означает «тяжелый камень», что несколько уместно, так как это седьмой по плотности элемент в периодической таблице.
Золото – Aurum (Au)
Латинское название золота было «aurum», что означает «желтый», происходящее от слова «aurora» («рассвет»). Название «золото», используемое в германских языках, означает «желтый блестящий металл»; многие другие европейские языки используют производные от aurum.
Меркурий – Hydrargyrum (Hg)
Первоначальное латинское название Меркурия на самом деле было «argentum vivum» (живое серебро), но позднее латинское название было заимствовано из греческого «hydrargyros» (жидкое серебро) для обозначения «Hydrargyrum». Первоначальное английское название элемента было «ртуть». Алхимики считали его близким к золоту, и из-за этого они назвали его Меркурием в честь ближайшей к Солнцу планеты. Некоторым другим металлам, известным с древних времен, также были даны имена, соответствующие планетам, но Меркурий — единственный, который застрял.
Свинец – Plumbum
Латинское название свинца, «свинец», вероятно, происходит от языка, предшествующего древнегреческому. Это латинское название также является источником английских слов «сантехника» и «водопроводчик» из-за исторического использования свинца в водопроводных трубах.
Это латинское название также является источником английских слов «сантехника» и «водопроводчик» из-за исторического использования свинца в водопроводных трубах.
Понравился этот пост и рисунок? Рассмотрите возможность поддержки Compound Interest на Patreon и получайте превью предстоящих публикаций и многое другое!
Изображение в этой статье находится под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Ознакомьтесь с рекомендациями по использованию контента сайта.
Ссылки и дополнительная литература
- Список этимологий названий элементов – Википедия
- Elementymology & elements multidict – P van der Krogt
, например, нагрузка …
Химический символ для меди – Bilder und Stockfotos
2,177Bilder
- Bilder
- Fotos
- Grafiken
- VEKTORTOS
- 0277027.
 SERESSINELSINALE 9000
SERESSINELSINALE 90000277027.SERESSINELSINALE 9000
0277027027.SERESSINELSINELSIENTIALE
- .SIALESTIALDIALE
Durchstöbern Sie 2.177
химический символ меди Stock-Photografie und Bilder. Oder starten Sie eine neuesuche, um noch mehr Stock-Photografie und Bilder zu entdecken. kupfer Periodensystem elementsymbol auf Weißem Hintergrund Vektor – химический символ для меди Stock-grafiken, -clipart, -cartoons und -symbole 3D-рендеринг – химический символ для меди, фото и изображенияHervorhebung des chemischen Elements Kupfer im Periodensystem…
Набор символов химических элементов kreis serie 2-farbe – химический символ для меди Stock-grafiken, -clipart, -cartoons und -symboleНабор символов химических элементов Kreis Serie 2-Farbe
Periodensystem der elemente – химический символ для меди. Stock-grafiken, -clipart, -cartoons und -symbolePeriodensystem der Elemente
fokus auf chemisches element kupfer beleuchtet im Periodensystem der elemente. 3D-рендеринг – химический символ для меди, фото и изображения
3D-рендеринг – химический символ для меди, фото и изображенияFokus auf chemisches Element Kupfer beleuchtet im Periodensystem…
антикварные иллюстрации, физические принципы и эксперименты, электричество и магнетизм: kupfer rotierender würfel – химический символ для меди. Prinzipien und Experimente,… jumper – химический символ для меди, фото и изображенияJumper
verschiedene chiptypen, kontaktchip, rfid-combination – химический символ для меди, стоковые фото и изображенияVerschieden Chiptypen, Kontaktchip, RFID-Combination
купфер-символ. химический элемент периоденсистемы. вектор-фонд-иллюстрация – химический символ для меди сток-график, -клипарт, -мультфильмы и -символKupfer-Symbol. Химический элемент периодической системы. Vektor-Stoc
Антикварные иллюстрации, физические принципы и эксперименты, электричество и магнетизм: voltaischer haufen – химический символ для меди, графика, -клипарт, -мультфильмы и -символ Античные иллюстрации, физические принципы и эксперименты,. ..
..
Радиочастотная идентификация RFID-символ – Синяя 3D-иллюстрация
Periodensystem der elemente – химический символ для медных стоковых изображений, -клипартов, -мультфильмов и -символовPeriodensystem der Elemente
kugelhahn mit eingebautem messsensor und fernbedienung mit kontrollraum. – химический символ для фото и фото медиKugelhahn mit eingebautem Messsensor und Fernbedienung mit…
cpu-prozessor-chip – химический символ для фото и фото медиCPU-Prozessor-Chip
nahtloses muster mit verhütungskritzeleien. – химический символ для меди, графика, -клипарт, -мультфильмы и -символNahtloses Muster mit Verhütungskritzeleien.
Industrieanlagen aus kupfertanks zur дистилляция спирта. brennerei, пивоваренный символ. вектор-иллюстрация – химический символ для меди сток-график, -клипарт, -мультфильмы и -символ Industrieanlagen aus Kupfertanks zur Destillation von Alkohol. …
…
Stab der Asclepius-Apotheke Ikone isoliert auf weiß
cpu-prozessor-chip – химический символ для меди фото и изображенияCPU-Prozessor-Chip
arzt mit blutschlauch für Vitamine & Mineralstoffe test im Labor — химический символ для меди на фото и фотографиях -clipart, -cartoons und -symboleSchale mit Hygeia-Symbol isoliert auf weißem Hintergrund….
cpu-prozessorchip isoliert auf weißem hintergrund – chemical symbol for copper stock-fotos und bilderCPU-Prozessorchip isoliert auf weißem Hintergrund
ikone der intrauterinen spulenkontrazeption zur geburtenkontrolle, behandlung von гинекологический erkrankungen. vektor-flachbildschirm-illustration – химический символ для меди stock-grafiken, -clipart, -cartoons und -symboleIkone der intrauterinen Spulenkontrazeption zur Geburtenkontrolle,
arzt, der t-formiges intrauterines verhütungsgerät auf hellblauemhintergrund hält, nahaufnahme. platz für text — химический символ для меди, фото и фото
platz für text — химический символ для меди, фото и фотоArzt, der T-formiges intrauterines Verhütungsgerät auf…
elektronische platine und blauer akku — химический символ для меди, фото и фотоElektronische Platine und blauer Akku
rotrost auf der alten metalloberfläche, korrosiv durch chemische — химический символ для меди, фото и изображенияRotrost auf der alten Metalloberfläche, korrosiv durch chemische
минеральный символ векторсац. 3d-пилен тропфен капсельн. золотой абстрактный тафель. комплекс витаминов для здоровья. medizin gesundheit symbole eps10 – химический символ для меди фондовая графика, -клипарт, -мультфильмы и -символMineralien Symbol Vektorsatz. 3D-Pillen tropfen Капсельн. Goldene…
Match halbes Spiel, Cartoon Mikronährstoffe Zauberer – химический символ для меди Stock-grafiken, -clipart, -cartoons und -symboleMatch halbes Spiel, Cartoon Mikronährstoffe Zauberer
blauer akku isoliert auf weißemhintergrund — химический символ для меди. -fotos und bilder
-fotos und bilderKupfer (Cu) Symbol chemisches Element des Periodensystems, 3D-Anim
chemische struktur des edta4-, ethendiamintetraacetat-ions – химический символ для меди stock-grafiken, -clipart, -cartoons und -symboleChemische Struktur EDTA4-, Ethylendiamintetraacetat-Ions
kupfer-symbol. химический элемент периоденсистемы. векториллюстрация. – химический символ для меди, графика, -клипарт, -мультфильмы и -символKupfer-Symbol. Chemisches Element des Periodensystems….
Periodensystem der Elemente – химический символ для меди.0014 Türkis Mendelejews vorhersagen für das element – химический символ для меди, графика, -clipart, -cartoons und -symbole Cartoons und -symboleStruktur der Dobereiner-Triaden
бензотриазол, BTA, ингибитор коррозии, химический формуляр и структура – химический символ для меди Stock-grafiken, -clipart, -cartoons und -symboleBenzotriazol, BTA, Corrosionsinhibitor, chemische Formel und..
cpu-prozessorchip isoliert auf weißemhintergrund — химический символ для меди на фото и изображениях Haarspülung, kohlensaurepulver, harnstoff, kupfer(ii)-сульфат, шампунь Flussigkeit и перманганат калия. – химический символ для меди фото и фото
– химический символ для меди фото и фотоChemischer Inhaltsstoff в гексагональной молекулярной форме Behälter
Mineralstoffe. набор макроминералов и микроминералов, sammlung. ca, na, mg, fe, cl, k, zn, se, i, mn, cu, p. иллюстрация. диабетический элемент. Mineralien fürs leben. вектор – химический символ для меди сток-график, -клипарт, -мультфильмы и -символМинералстоффе. Набор макроминералов и микроминералов, Sammlung.
Витамины и минералы для здоровья человека. multivitamin- und nährstoffvektor-symbolsymbole in form von runden fliegenden bällen – химический символ для меди stock-grafiken, -clipart, -cartoons und -symboleVitamine und Mineralstoffe für eine gesunde Ernährung….
regelmäßige tabelle der elemente – химический символ для медный рисунок, клипарт, мультфильмы и символыRegelmäßige Tabelle der Elemente
blaue flüssigkeit in einem kleinen glas auf weißem hintergrund. Блауэр Фарбстофф им Бехерглас. ein beispiel für azurblaues краска. – химический символ для меди фото и изображения Blaue Flussigkeit in einem kleinen Glas auf weißem Hintergrund. …
…
Verhütungsmethode. Vektor flacher weiblicher Arm mit…
geöffnetes alchemiebuch voller symbole – химический символ для меди на фото и фотографияхGeöffnetes Alchemiebuch voller Symbole
купфер-символ. химический элемент периоденсистемы. векториллюстрация. – химический символ для меди, графика, -клипарт, -мультфильмы и -символKupfer-Symbol. Chemisches Element des Periodensystems….
junge pflanze, die im boden vor sonnigem hintergrund mit 16 digitalen nährstoffen wächst, die im pflanzenleben notwendig sind, pflanzennährstoffe, makronährstoffe, mikronährstoffe. аграрконцепт – химический символ меди, фото и изображенияJunge Pflanze, Die im Boden vor Sonnigem Hintergrund mit 16…
Mineralische nahrungsergänzungsmittel kapseln bezogen editierbare strich umriss symbol isoliert auf weißem hintergrund flache vektor-illustration. пиксель идеальный. 64 x 64 – химический символ для меди, графика, клипарт, мультфильмы и символы
пиксель идеальный. 64 x 64 – химический символ для меди, графика, клипарт, мультфильмы и символыMineralische Nahrungsergänzungsmittel Kapseln bezogen…
3d-darstellung der elemente des periodensystems, натрий, кальций, цинк, магний, Эйзен и купфер. bildungs-, wissenschafts-, technologie- und ingenieurshintergrund. – химический символ меди на стоковых фото и фотографиях3D-Darstellung der Elemente des Periodensystems, Natrium, Kalzium,
Periodensystem der Elemente Elemente (25) auf farbe knöpfe eps10 transparenz — химический символ для меди. ) auf Farbe Knöpfe EPS10… Periodensystem poster feind chemiker und studenten – Chemical Symbol for Copper Stock-grafiken, -clipart, -cartoons und -symbole данн ауф 0 аб. – химический символ для меди, графика, -клипарт, -мультфильмы и -символDie Wertigkeit steigt zuerst von 1 auf 4 und nimmt dann auf 0 ab.
купфер-символ. химический элемент периоденсистемы. векториллюстрация. – химический символ для меди, графика, -клипарт, -мультфильмы и -символ Kupfer-Symbol. Chemisches Element des Periodensystems….
Chemisches Element des Periodensystems….
Schaltkreis Nahaufnahme up
подробно eines caipirinha-bausatzes mit sechs schnapsgläsern, holzschnittbrett und Chemical tampern is stockufert-weiß фотографии и изображенияDetail eines Caipirinha-Bausatzes mit sechs Schnapsgläsern,…
das blau gefärbte salz ist Hydratisiertes kupfersulfat, cuso4. 5h3o, das beim erhitzen weiß wird, da es seine cristallisationsmoleküle verliert — химический символ для меди. Химический символ для меди Фото и фотоVerschiedene Metallwürfel auf Cremehintergrund
Periodisches System der Elemente – классический синий – химический символ для меди, графика, -клипарт, -мультфильмы и -символPeriodisches System der Elemente – Classic Blue
3d werbebanner für vape shop – реалистичный vaping-geräte und plastikflasche zum dumpfen. векториллюстрация. – химический символ для меди, графика, -клипарт, -мультфильмы и -символ 3D Werbebanner für Vape Shop – реалистичный Vaping-Geräte und. ..
..
Медь | Химия | Хранитель
Элемент этой недели – медь, чей символ, Cu, происходит от латинского cuprum для острова Кипр, потому что он был крупным экспортером меди. Атомный номер меди — 29. Медь — мягкий металл с высокой тепло- и электропроводностью. Если вы были внимательны, вы также заметите, что этот блестящий оранжево-красный металл — первый металл, который я представил вам, который не имеет блестящего бледно-серого цвета в своем естественном состоянии. На самом деле есть только три металла, которые в чистом самородном состоянии имеют цвет, отличный от серого, и медь — первый из них.
Медь всегда была важна для людей, даже в древние времена: ледяной человек Эци, убитый где-то около 3200 г. до н.э. и обнаруженный в Альпах, владел топором, сделанным почти из чистой меди. Но использование меди началось гораздо раньше: например, в северном Ираке был найден медный кулон, который датируется 8700 годом до нашей эры.
Медь наиболее знакома нам, потому что она использовалась в монетах. Сегодня медь все еще используется в монетах, но в основном она используется в промышленности, в электрических проводах, кровельных и водопроводных материалах, а также в промышленном оборудовании. Медь встречается редко, потому что она на 100% пригодна для вторичной переработки без потери своего качества — особенность, которая делает строительные площадки и вышки сотовой связи популярной целью воров в эти трудные экономические времена. Подсчитано, что 80% меди, которая когда-либо была добыта, все еще используется сегодня, что иногда заставляет меня задуматься об истории отдельных атомов меди, из которых состоят монеты в моем кармане.
Сегодня медь все еще используется в монетах, но в основном она используется в промышленности, в электрических проводах, кровельных и водопроводных материалах, а также в промышленном оборудовании. Медь встречается редко, потому что она на 100% пригодна для вторичной переработки без потери своего качества — особенность, которая делает строительные площадки и вышки сотовой связи популярной целью воров в эти трудные экономические времена. Подсчитано, что 80% меди, которая когда-либо была добыта, все еще используется сегодня, что иногда заставляет меня задуматься об истории отдельных атомов меди, из которых состоят монеты в моем кармане.
Вот новое видео о меди, включающее прекрасную демонстрацию и несколько историй от Профессора.
Как упомянул профессор, медь важна и для живых существ. Я до сих пор помню тот день, когда я был аспирантом, наблюдая (а затем проводя) операции на мотыльках и замечая, что у них прекраснейшая бледно-голубая кровь. Как я узнал, вместо гемоглобина их кровь ( гемолимфа ) использует белок, гемоцианин, который опирается на ионы меди вместо ионов железа, чтобы обратимо связывать кислород и доставлять его к тканям. Именно медь придает их крови красивый бледно-голубой цвет (то есть до того, как она окислится до черного цвета). Фактически, большинство беспозвоночных, включая моллюсков и некоторых членистоногих, используют гемоцианин в качестве переносчика кислорода.
Именно медь придает их крови красивый бледно-голубой цвет (то есть до того, как она окислится до черного цвета). Фактически, большинство беспозвоночных, включая моллюсков и некоторых членистоногих, используют гемоцианин в качестве переносчика кислорода.
Несмотря на токсичность при высоких концентрациях, медь является важным микроэлементом для растений и животных, но не всегда для других форм жизни. В низких концентрациях ионы меди (II) подавляют рост некоторых микробов и грибков, что делает его одним из центральных ингредиентов консервантов для древесины и фунгицидов.
Видеожурналист Брейди Харан — человек с камерой, а Ноттингемский университет — место с учеными. Вы можете следить за Брэди в твиттере @periodicvideos и за Ноттингемским университетом в твиттере @UniNottingham
You’ve already met these elements:
Nickel: Ni , atomic number 28
Cobalt: Co , atomic number 27
Iron: Fe , atomic number 26
Марганец: млн. , атомный номер 25
, атомный номер 25
Хром: CR , атомный номер 24
Vanadium: V , Atomic Number 23
TITANIUM: TI , , , , , , , , , , , , , , , , , , , .0016
Scandium: SC , Atomic Number 21
Кальций: CA , Атомный номер 20
Калий: K , ATOMIC NUMPLAY 19
СЕРФУР: S , Атомный номер 16
Phosphors: P , Atomic Number 15
1116: , , , , , , , , , , , , , , , , , , , , , , , , , , , , , .
 0015 14
0015 14 Aluminium: Al , atomic number 13
Magnesium: Mg , atomic number 12
Sodium: Na , atomic number 11
Neon: Ne , atomic number 10
Fluorine: F , atomic number 9
Oxygen: O , atomic number 8
Nitrogen: N , atomic number 7
Carbon: C , atomic number 6
Boron: B , atomic number 5
Beryllium: Be , atomic number 4
Lithium: Li , atomic number 3
Helium: He , atomic number 2
Водород: H , атомный номер 1
Вот замечательная интерактивная Периодическая таблица элементов, с которой действительно весело играть!
. . .. .. .. .. .. .. .. .. .. .. ..
. .. .. .. .. .. .. .. .. .. .. ..
Twitter: @GrrlScientist
Facebook: grrlscientist
Электронная почта: [email protected]
Что такое медь?
, что означает, что в структуре атома 29 протонов и 29 электронов. Химический символ для меди равен Cu .Медь — мягкий, ковкий и пластичный металл с очень высокой тепло- и электропроводностью. Свежая открытая поверхность чистой меди имеет красновато-оранжевый цвет. Медь используется как проводник тепла и электричества, как строительный материал и как составная часть различных металлических сплавов, таких как стерлинговое серебро, используемое в ювелирных изделиях, мельхиор, используемый для изготовления морского оборудования и монет, и константан, используемый в тензодатчиках и термопарах. для измерения температуры.
Copper – Properties
| Element | Copper |
|---|---|
| Atomic Number | 29 |
| Symbol | Cu |
| Element Category | Transition Metal |
| Phase при STP | Твердое вещество |
Атомная масса [а. е.м.] е.м.] | 63,546 |
| Плотность при STP [г/см3] | 8,92 |
| Электронная конфигурация | . 1.9 |
| 1st Ionization Energy [eV] | 7.7264 |
| Year of Discovery | unknown |
| Discoverer | unknown |
| Thermal properties | |
| Melting Point [Celsius scale] | 1084.62 |
| Boiling Point [Celsius scale] | 2927 |
| Thermal Conductivity [W/m K] | 401 |
| Specific Heat [J/g K] | 0.38 |
| Heat of Fusion [kJ/mol] | 13.05 |
| Heat of Vaporization [kJ/mol] | 300.3 |
См. также: Свойства меди
Атомная масса меди
Атомная масса меди 63,546 ед.
Обратите внимание, что каждый элемент может содержать больше изотопов, поэтому результирующая атомная масса рассчитывается на основе встречающихся в природе изотопов и их распространенности.
Единицей измерения массы является атомная единица массы (а.е.м.) . Одна атомная единица массы равна 1,66 х 10 -24 грамма. Одна единая атомная единица массы равна примерно масса одного нуклона (либо отдельного протона, либо нейтрона) и численно эквивалентна 1 г/моль.
Для 12 C атомная масса точно равна 12u, поскольку из нее определяется единица атомной массы. Изотопная масса обычно отличается для других изотопов и обычно находится в пределах 0,1 ед от массового числа. Например, 63 Cu (29 протонов и 34 нейтрона) имеет массовое число 63, а изотопная масса в его основном ядерном состоянии составляет 62, ед.
Существуют две причины различия между массовым числом и изотопной массой, известной как дефект массы:
- Нейтрон немного тяжелее , чем протон . Это увеличивает массу ядер с большим количеством нейтронов, чем протонов, относительно шкалы единиц атомной массы, основанной на 12 C с равным количеством протонов и нейтронов.

- Энергия связи между ядрами различается. Ядро с большей энергией связи имеет меньшую полную энергию, поэтому меньшая масса согласно соотношению эквивалентности массы и энергии Эйнштейна E = mc 2 . Для 63 Cu, атомная масса меньше 63, так что это должно быть доминирующим фактором.
См. также: Массовое число
Плотность меди
Плотность меди 8,92 г/см 3 .
Типичные плотности различных веществ при атмосферном давлении.
Плотность определяется как масса на единицу объема . Это интенсивное свойство , которое математически определяется как масса, деленная на объем:
ρ = m/V
вещества, деленное на общий объем (V), занимаемый этим веществом. Стандартная единица СИ равна килограммов на кубический метр ( кг/м 3 ). Стандартная английская единица измерения равна массе фунтов на кубический фут 9.0016 ( фунтов/фут 3 ).
Стандартная английская единица измерения равна массе фунтов на кубический фут 9.0016 ( фунтов/фут 3 ).
См. также: Что такое плотность?
Электроотрицательность меди 1,9 .
Сродство к электрону
В химии и атомной физике сродство к электрону атома или молекулы определяется как:
изменение энергии (в кДж/моль) нейтрального атома или молекулы (в газовой фазе) при присоединении к атому электрона с образованием отрицательного иона .
X + e – → X – + энергия Сродство = – ∆H
Другими словами, это можно выразить как вероятность нейтрального атома получить электрон . Обратите внимание, что энергия ионизации измеряет тенденцию нейтрального атома сопротивляться потере электронов. Сродство к электрону измерить труднее, чем энергию ионизации.
Атом меди в газовой фазе, например, выделяет энергию, когда он получает электрон для образования иона меди.
Cu + e – → Cu – – ∆H = сродство = 118,4 кДж/моль
Чтобы правильно использовать сродство к электрону, важно следить за знаками. При присоединении электрона к нейтральному атому выделяется энергия. Это сродство известно как сродство к первому электрону, и эти энергии отрицательны. По соглашению отрицательный знак показывает высвобождение энергии. Однако для присоединения электрона к отрицательному иону требуется больше энергии, что подавляет любое высвобождение энергии в процессе присоединения электрона. Это сродство известно как сродство ко второму электрону, и эти энергии положительны.
Сродство неметаллов и сродство металлов
- Металлы: Металлы любят терять валентные электроны, чтобы сформировать катионы, имеющие полностью стабильную оболочку. Электронное сродство металлов ниже, чем у неметаллов. Меркурий слабее всего притягивает лишний электрон.
- Неметаллы: Как правило, неметаллы имеют более положительное сродство к электрону, чем металлы.
 Неметаллы любят приобретать электроны для образования анионов, чтобы иметь полностью стабильную электронную оболочку. Хлор наиболее сильно притягивает лишние электроны. Сродство благородных газов к электрону окончательно не измерено, поэтому оно может иметь или не иметь слегка отрицательные значения.
Неметаллы любят приобретать электроны для образования анионов, чтобы иметь полностью стабильную электронную оболочку. Хлор наиболее сильно притягивает лишние электроны. Сродство благородных газов к электрону окончательно не измерено, поэтому оно может иметь или не иметь слегка отрицательные значения.
Электроотрицательность
Электроотрицательность , символ χ, является химическим свойством, которое описывает тенденцию атома притягивать электроны к этому атому. Для этой цели чаще всего используется безразмерная величина , шкала Полинга , символ χ.
Электроотрицательность меди:
χ = 1,9
В общем случае на электроотрицательность атома влияет как его атомный номер, так и расстояние, на котором находятся его валентные электроны от заряженного ядра. Чем выше связанное число электроотрицательности, тем больше элемент или соединение притягивает к себе электроны.
Наиболее электроотрицательному атому, фтору, присвоено значение 4,0, а значения варьируются до цезия и франция, которые являются наименее электроотрицательными при 0,7.
Первая энергия ионизации меди
Первая энергия ионизации меди 7,7264 эВ .
Энергия ионизации , также называемая потенциалом ионизации , представляет собой энергию, необходимую для удаления электрона из нейтрального атома.
X + энергия → X + + e −
где X — любой атом или молекула, способная к ионизации, X + — атом или молекула с удаленным электроном (положительный ион), а e — — удаленный электрон.
Атому меди, например, требуется следующая энергия ионизации для удаления самого внешнего электрона.
Cu + IE → Cu + + e − IE = 7,7264 эВ
Чаще всего используется энергия ионизации, связанная с удалением первого электрона. n Энергия ионизации относится к количеству энергии, необходимой для удаления электрона из частиц с зарядом ( n -1).
1st ionization energy
X → X + + e −
2nd ionization energy
X + → X 2+ + e −
3rd ionization energy
X 2 + → X 3+ + e −
Энергия ионизации для различных элементов
На каждый последующий удаленный электрон приходится энергия ионизации. Электроны, вращающиеся вокруг ядра, движутся по довольно четко определенным орбитам. Некоторые из этих электронов более прочно связаны в атоме, чем другие. Например, для удаления самого внешнего электрона из атома свинца требуется всего 7,38 эВ, а для удаления самого внутреннего электрона требуется 88 000 эВ. Помогает понять реакционную способность элементов (особенно металлов, которые теряют электроны).
Как правило, энергия ионизации увеличивается при движении вверх по группе и при перемещении слева направо по периоду. Более того:
- Энергия ионизации самая низкая для щелочных металлов, которые имеют один электрон вне замкнутой оболочки.

- Энергия ионизации возрастает по ряду на периодическом максимуме для благородных газов, имеющих замкнутые оболочки.
Например, для ионизации натрия требуется всего 496 кДж/моль или 5,14 эВ/атом. С другой стороны, неон, благородный газ, непосредственно предшествующий ему в таблице Менделеева, требует 2081 кДж/моль или 21,56 эВ/атом.
Медь – температура плавления и температура кипения
Температура плавления меди 1084,62°C .
Температура кипения меди: 2927°C .
Обратите внимание, что эти точки связаны со стандартным атмосферным давлением.
Температура кипения – насыщение
В термодинамике насыщение определяет состояние, при котором смесь пара и жидкости может существовать вместе при заданных температуре и давлении. Температура, при которой испарение (кипение) начинается при заданном давлении, называется температурой насыщения или температурой кипения . Давление, при котором начинается испарение (кипение) при данной температуре, называется давлением насыщения. Когда ее рассматривают как температуру обратного перехода от пара к жидкости, ее называют точкой конденсации.
Давление, при котором начинается испарение (кипение) при данной температуре, называется давлением насыщения. Когда ее рассматривают как температуру обратного перехода от пара к жидкости, ее называют точкой конденсации.
Точка плавления – насыщение
В термодинамике точка плавления определяет состояние, при котором твердое тело и жидкость могут существовать в равновесии. Добавление тепла превратит твердое вещество в жидкость без изменения температуры. Температура плавления вещества зависит от давления и обычно указывается при стандартном давлении. Когда ее рассматривают как температуру обратного перехода из жидкого состояния в твердое, ее называют точкой замерзания или точкой кристаллизации.
Медь – удельная теплоемкость, скрытая теплота плавления, скрытая теплота парообразования
Удельная теплоемкость меди 0,38 Дж/г K .
Скрытая теплота плавления меди 13,05 кДж/моль .
Скрытая теплота испарения меди составляет 300,3 кДж/моль .
Удельная теплоемкость
Удельная теплоемкость или удельная теплоемкость, – это свойство, связанное с внутренней энергией , которое очень важно в термодинамике. интенсивных свойств C V и C P определены для чистых, простых сжимаемых веществ в качестве частичных производных Entallpy U (T, V) и Entallpy H (T, V) и H (T, v) и H (T, V) и H (T, V) и H (T, V) и H (T, V) и H (T, V) и H (T, V) и H (T, V) ) , соответственно:
, где индексы v и p обозначают переменные, удерживаемые фиксированными во время дифференцирования. Свойства c v и c p обозначаются как удельная теплоемкость (или теплоемкость ), потому что при определенных особых условиях они связывают изменение температуры системы с количеством энергии, добавленной в результате теплопередачи. Их единицы СИ составляют Дж/кг K или Дж/моль K .
Свойства c v и c p обозначаются как удельная теплоемкость (или теплоемкость ), потому что при определенных особых условиях они связывают изменение температуры системы с количеством энергии, добавленной в результате теплопередачи. Их единицы СИ составляют Дж/кг K или Дж/моль K .
Различные вещества подвергаются воздействию различных величин за счет добавления тепла . При подводе к разным веществам определенного количества теплоты их температуры увеличиваются на разную величину.
Теплоемкость – экстенсивное свойство материи, означающее, что она пропорциональна размеру системы. Теплоемкость C имеет единицу энергии на градус или энергию на кельвин. При выражении того же явления в виде интенсивного свойства теплоемкость делится на количество вещества, массу или объем. Таким образом, количество не зависит от размера или степени выборки.
Таким образом, количество не зависит от размера или степени выборки.
Скрытая теплота парообразования
В общем, когда материал изменяет фазу из твердой в жидкую или из жидкой в газообразную, на это изменение фазы затрачивается определенное количество энергии. В случае фазового перехода из жидкости в газ это количество энергии известно как энтальпия испарения (символ ∆H vap ; единица измерения: Дж), также известная как (скрытая) теплота парообразования или теплота испарения. В качестве примера см. рисунок, на котором описаны фазовые переходы воды.
Скрытая теплота – это количество теплоты, добавляемое к веществу или отводимое от него для изменения фазы. Эта энергия разрушает межмолекулярные силы притяжения и должна обеспечить энергию, необходимую для расширения газа ( pΔV работа ). При добавлении скрытой теплоты изменения температуры не происходит. Энтальпия парообразования зависит от давления, при котором происходит это превращение.
Энтальпия парообразования зависит от давления, при котором происходит это превращение.
Скрытая теплота плавления
В случае перехода твердой фазы в жидкую изменение энтальпии, необходимое для изменения ее состояния, известно как энтальпия плавления (символ ∆H фьюз ; единица измерения: Дж), также известная как (скрытая) теплота плавления . Скрытая теплота — это количество теплоты, добавляемое к веществу или отводимое от него для осуществления фазового перехода. Эта энергия разрушает межмолекулярные силы притяжения, а также должна обеспечивать энергию, необходимую для расширения системы ( pΔV работает ).
Жидкая фаза имеет более высокую внутреннюю энергию, чем твердая фаза. Это означает, что к твердому телу должна быть подведена энергия, чтобы расплавить его, а энергия высвобождается из жидкости при ее замерзании, потому что молекулы в жидкости испытывают более слабые межмолекулярные силы и, следовательно, имеют более высокую потенциальную энергию (своего рода энергия диссоциации связи для межмолекулярные силы).
Температура, при которой происходит фазовый переход, является точкой плавления .
При добавлении скрытой теплоты изменение температуры не происходит. Энтальпия плавления является функцией давления, при котором происходит это превращение. По соглашению давление принимается равным 1 атм (101,325 кПа), если не указано иное.
Медь в периодической таблице
| Водород1H | Гелий2Не | ||||||||||||||||||
| Lithium3Li | Beryllium4Be | Boron5B | Carbon6C | Nitrogen7N | Oxygen8O | Fluorine9F | Neon10Ne | ||||||||||||
| Sodium11Na | Magnesium12Mg | Aluminium13Al | Silicon14Si | Phosphorus15P | Sulfur16S | Chlorine17Cl | Аргон18Ar | ||||||||||||
| Калий19K | Кальций20Ca | Scandium21Sc | Titanium22Ti | Vanadium23V | Chromium24Cr | Manganese25Mn | Iron26Fe | Cobalt27Co | Nickel28Ni | Copper29Cu | Zinc30Zn | Gallium31Ga | Germanium32Ge | Arsenic33As | Selenium34Se | Bromine35Br | Krypton36Kr | ||
| Рубидий37Rb | Стронций38Sr | Иттрий39Y | Zirconium40Zr | Niobium41Nb | Molybdenum42Mo | Technetium43Tc | Ruthenium44Ru | Rhodium45Rh | Palladium46Pd | Silver47Ag | Cadmium48Cd | Indium49In | Tin50Sn | Antimony51Sb | Tellurium52Te | Iodine53I | Xenon54Xe | ||
| Caesium55Cs | Барий56Ba | Лантан57La | Hafnium72Hf | Tantalum73Ta | Tungsten74W | Rhenium75Re | Osmium76Os | Iridium77Ir | Platinum78Pt | Gold79Au | Mercury80Hg | Thallium81Tl | Lead82Pb | Bismuth83Bi | Polonium84Po | Astatine85At | Radon86Rn | ||
| Francium87Fr | Радий88Ra | Актиний89Ac | Резерфордий104Rf | Dubnium105Db | Seaborgium106Sg | Bohrium107Bh | Hassium108Hs | Meitnerium109Mt | Darmstadtium110Ds | Roentgenium111Rg | Copernicium112Cn | Nihonium113Nh | Flerovium114Fl | Moscovium115Mc | Livermorium116Lv | Tennessine117Ts | Oganesson118Og | ||
| Церий58Ce | Praseodymium59Pr | Neodymium60Nd | Promethium61Pm | Samarium62Sm | Europium63Eu | Gadolinium64Gd | Terbium65Tb | Dysprosium66Dy | Holmium67Ho | Erbium68Er | Thulium69Tm | Ytterbium70Yb | Lutetium71Lu | ||||||
| Торий90Th | Протактиний91Pa | Уран92U | Neptunium93Np | Plutonium94Pu | Americium95Am | Curium96Cm | Berkelium97Bk | Californium98Cf | Einsteinium99Es | Fermium100Fm | Mendelevium101Md | Nobelium102No | Lawrencium103Lr | ||||||
–
–
–
Медь — Энциклопедия Нового Света
Медь (символ Cu , атомный номер 29) — один из старейших известных металлов в истории человечества. Красновато-оранжевый цвет, он пластичен, податлив и является отличным проводником тепла и электричества. В своей ионной форме медь является эссенциальным элементом для высших растений и животных, а также для человеческого организма.
Красновато-оранжевый цвет, он пластичен, податлив и является отличным проводником тепла и электричества. В своей ионной форме медь является эссенциальным элементом для высших растений и животных, а также для человеческого организма.
Содержание
- 1 Этимология и алхимический символ
- 2 История
- 3 источника
- 4 Примечательные характеристики
- 4.1 Изотопы
- 4.2 Сплавы
- 5 приложений
- 6 Биологическая роль
- 6.1 Токсичность
- 6.2 Прочие опасности
- 7 Соединения
- 8 Тесты на медь 2+ ионы
- 9 Примечания
- 10 Каталожные номера
- 11 кредитов
Медь и ее сплавы широко используются в электропроводке и машинах, электронных компонентах, конструкционных материалах, кухонной утвари и столовых приборах, чеканке монет, музыкальных инструментах и скульптурах. Кроме того, поскольку медь является биостатическим материалом, медные поверхности и дверные ручки используются в больницах для предотвращения переноса микробов, а сульфат меди (II) используется в качестве фунгицида.
Этимология и алхимический символ
Алхимический символ меди
Медь была важным ресурсом для древних греков и римлян. Греки назвали металл халкос (χαλκός). В римские времена он стал известен как aes Cyprium — aes , являющийся общим латинским термином для медных сплавов, таких как бронза (медь в сплаве с оловом), и Cyprium , указывающий, что большая часть меди добывалась на Кипре. Отсюда латинское слово стало cuprum , который в конечном итоге был переведен на английский язык до меди .
В мифологии и алхимии медь ассоциировалась с богиней Афродитой/Венерой из-за ее блестящей красоты, ее древнего использования для изготовления зеркал и связи с Кипром, который был посвящен богине. В алхимии символ меди был также символом планеты Венера.
История
Древний медный слиток из Закроса, Крит, имеет форму шкуры животного, характерную для той эпохи
Медь была известна некоторым из древнейших цивилизаций, и ее история использования насчитывает не менее десяти тысяч лет. Медный кулон был найден на территории современного северного Ирака и датируется 8700 91 563 гг. до н. э. К 5000 г. г. до н.э. № , имеются следы плавки меди, аффинажа меди из простых минералов, таких как малахит или азурит. Медь была первым металлом, выплавленным из руд.[1] Напротив, самые ранние признаки использования золота появляются около 4000 91 563 гг. до н. э.
Медный кулон был найден на территории современного северного Ирака и датируется 8700 91 563 гг. до н. э. К 5000 г. г. до н.э. № , имеются следы плавки меди, аффинажа меди из простых минералов, таких как малахит или азурит. Медь была первым металлом, выплавленным из руд.[1] Напротив, самые ранние признаки использования золота появляются около 4000 91 563 гг. до н. э.
Самый древний известный литой медный предмет — это наконечник булавы, обнаруженный в Кан Хасане в южной Анатолии и датированный примерно 5000 годом 91 563 года до н. э. Имеются артефакты из меди и бронзы (медь в сплаве с оловом, а иногда и с другими элементами) из шумерских городов, которые датируются 3000 г. г. до н.э. 91 564, и древнеегипетские артефакты из меди и бронзы почти такого же возраста. В одной пирамиде была обнаружена пятитысячелетняя медная водопроводная система.
Египтяне обнаружили, что добавление небольшого количества олова облегчает литье металла, поэтому бронзовые сплавы были найдены в Египте почти сразу же, как и медь. Использование меди в Древнем Китае датируется как минимум 2000 годом 9.1563 г. до н. э. К 1200 г. г. до н.э. , в Китае делали отличные бронзы. Обратите внимание, что на эти даты повлияли войны и завоевания, так как медь легко переплавляется и используется повторно.
Использование меди в Древнем Китае датируется как минимум 2000 годом 9.1563 г. до н. э. К 1200 г. г. до н.э. , в Китае делали отличные бронзы. Обратите внимание, что на эти даты повлияли войны и завоевания, так как медь легко переплавляется и используется повторно.
В Европе Эци Ледяной Человек, хорошо сохранившийся мужчина, датируемый 3200 г. до н.э. , был найден вместе с топором с медным наконечником, металл которого имел чистоту 99,7%. Высокий уровень мышьяка в его волосах предполагает, что он занимался выплавкой меди. Латунь, сплав цинка и меди, была известна грекам, но впервые широко использовалась римлянами.
Различные цивилизации мира прошли через «Бронзовый век» в разные, но пересекающиеся периоды времени. Например, считается, что ближневосточный бронзовый век длился с 3500 по 1200 год г. до н.э. ; британский бронзовый век датируется с 2100 по 700 год г. до н.э. ; а центральноевропейский бронзовый век длился с 1800 по 700 год г. до н.э. Переходный период в некоторых регионах между предшествующим периодом неолита (новый каменный век) и бронзовым веком называется энеолитом, когда некоторые инструменты из меди высокой чистоты использовались наряду с каменными орудиями.
до н.э. Переходный период в некоторых регионах между предшествующим периодом неолита (новый каменный век) и бронзовым веком называется энеолитом, когда некоторые инструменты из меди высокой чистоты использовались наряду с каменными орудиями.
West Mine at Alderley Edge
В эпоху бронзы медь добывалась на Британских островах в основном в следующих местах: South West County Cork, West Wales (например, шахта Cwmystwyth), North Wales (например, Great Orme) , Англси (гора Пэрис), Чешир (Олдерли-Эдж), Стаффордширские вересковые пустоши (например, шахта Эктон) и остров Мэн (между Англией и Северной Ирландией).
В Америке добыча меди началась с маргинальных разработок коренных американцев и некоторых разработок первых испанцев. Европейцы добывали медь в Коннектикуте еще в 1709 году.. Движение на запад также привело к расширению добычи меди с разработкой значительных месторождений в Мичигане и Аризоне в 1850-х годах и в Монтане в 1860-х годах.
Медь активно добывалась на полуострове Кевинау в Мичигане, а центром добычи был продуктивный рудник Куинси. В Аризоне было много известных месторождений, в том числе «Медная королева» в Бисби и «Юнайтед Верде» в Джероме. К 1886 году Анаконда в Бьютте, штат Монтана, стала главным поставщиком меди в стране. Медь также добывалась в Юте, Неваде и Теннесси, среди других мест.
Источники
Открытый медный рудник Эль-Чино в Нью-Мексико
Среднее содержание меди в породах земной коры составляет примерно 68 частей на миллион (млн) по массе. Источниками меди являются следующие минералы:
- сульфиды: халькопирит (CuFeS 2 ), борнит (Cu 5 FeS 4 ), ковеллит (CuS), халькоцит (Cu 2 S)
- карбонаты: азурит (Cu 3 (CO 3 ) 2 (OH) 2 ) и малахит (Cu 2 CO 3 (OH) 2 )
- оксид: куприт (Cu 2 O).

Самородная медь также образуется в нерентабельных россыпных месторождениях.
Медные руды в основном находятся в Чили, США, Индонезии, Австралии, Перу, России, Канаде, Китае, Польше, Казахстане и Мексике. [1]
Большая часть медной руды добывается или извлекается в виде сульфидов меди на крупных карьерах в медно-порфировых месторождениях (медные рудные тела в порфировых породах), содержащих 0,4–1,0% меди. Примеры открытых медных рудников включают Chuquicamata в Чили и шахту El Chino в Нью-Мексико.
Межправительственный совет стран-экспортеров меди (CIPEC), прекративший свое существование в 1992 году, когда-то пытался играть ту же роль в отношении меди, что и ОПЕК в отношении нефти. Однако такого же влияния она не добилась — не в последнюю очередь потому, что второй по величине производитель, Соединенные Штаты, никогда не был ее членом. Образована в 1967 году, ее основными членами были Чили, Перу, Заир и Замбия.
Примечательные характеристики
Медь существует в виде металлически связанного вещества, что позволяет ей иметь широкий спектр металлических свойств
В периодической таблице медь является переходным металлом в периоде 4, между никелем и цинком. Кроме того, он находится в группе 11 (бывшая группа 1В) вместе с серебром и золотом и имеет с ними ряд общих характеристик. Подобно серебру и золоту, медь обладает высокой тепло- и электропроводностью (среди чистых металлов при комнатной температуре только серебро имеет более высокую электропроводность). Все три являются пластичными и ковкими металлами, то есть их можно легко вытянуть в проволоку или раскатать в листы.
Кроме того, он находится в группе 11 (бывшая группа 1В) вместе с серебром и золотом и имеет с ними ряд общих характеристик. Подобно серебру и золоту, медь обладает высокой тепло- и электропроводностью (среди чистых металлов при комнатной температуре только серебро имеет более высокую электропроводность). Все три являются пластичными и ковкими металлами, то есть их можно легко вытянуть в проволоку или раскатать в листы.
Золото и медь являются единственными цветными металлическими элементами, помимо цезия, щелочного металла периода 6. Медь имеет свой характерный красновато-оранжевый цвет, поскольку отражает красный и оранжевый свет и поглощает другие частоты в видимом спектре. Под воздействием атмосферы поверхность металла превращается в карбонат меди (CuCO 3 ), вещество зеленого цвета, называемое патиной .
Чистота меди выражается как 4N для чистоты 99,9999% или 7N для 9Чистота 9,9999999%. Цифра показывает количество девяток после запятой.
Изотопы
Существует два стабильных изотопа меди: 63 Cu и 65 Cu. Кроме того, есть пара десятков радиоизотопов. Подавляющее большинство радиоизотопов имеют период полураспада порядка минут или меньше; самый долгоживущий, 64 Cu, имеет период полураспада 12,7 часов с двумя режимами распада, которые приводят к двум отдельным продуктам.
Кроме того, есть пара десятков радиоизотопов. Подавляющее большинство радиоизотопов имеют период полураспада порядка минут или меньше; самый долгоживущий, 64 Cu, имеет период полураспада 12,7 часов с двумя режимами распада, которые приводят к двум отдельным продуктам.
Сплавы
Существует множество сплавов меди: металлическое зеркало представляет собой сплав меди/олова, латунь представляет собой сплав меди/цинка, а бронза представляет собой сплав меди/олова (иногда с некоторыми другими элементами). Металлический монель представляет собой сплав меди и никеля, также называемый мельхиором. Хотя термин «бронза» обычно относится к сплавам меди и олова, он также является общим термином для любого сплава меди, такого как алюминиевая бронза, кремниевая бронза и марганцевая бронза.
Области применения
Медь широко используется в самых разных продуктах, как указано ниже.
- Электрические и электронные товары:
- Электропроводка.

- Электромагниты.
- Электрические машины, особенно электромагнитные двигатели и генераторы.
- Электрические реле, шины и переключатели.
- Вакуумные трубки, электронно-лучевые трубки и магнетроны в микроволновых печах.
- Волноводы для микроволнового излучения.
- В интегральных схемах медь все чаще заменяет алюминий из-за его превосходной проводимости.
- В качестве материала для изготовления компьютерных радиаторов из-за его превосходной способности рассеивать тепло по сравнению с алюминием.
- Электропроводка.
- Конструкционный материал:
- Строительство статуи: Статуя Свободы, например, содержит 179 200 фунтов (81,3 тонны) меди.
- Легированный никелем, используется для коррозионно-стойких материалов в судостроении.
- Кровля, водосточные желоба и водосточные желоба на зданиях.
- Товары для дома:
- Медная сантехника.
- Дверные ручки и прочая арматура в домах.

- В кухонной утвари, такой как сковороды.
- Большинство столовых приборов (ножи, вилки, ложки) содержат некоторое количество меди (нейзильбер). Серебро
- пробы, если оно используется в столовой посуде, должно содержать несколько процентов меди.
- Тираж:
- Медные сплавы используются в чеканке монет. Например, пенни США состоят из 2,5% меди и 97,5% цинка по весу; никель состоит из 75,0% меди и 25,0% никеля; Даймы и четверти состоят из 91,67% меди и 8,33% никеля.
- Медицинское применение:
- Бактерии не размножаются на поверхности меди, поскольку она является биостатической. Медные дверные ручки и медные поверхности используются в больницах для уменьшения передачи болезнетворных микробов.
- Болезнь легионеров подавляется медными трубками в системах кондиционирования воздуха.
- Сульфат меди(II) используется в качестве фунгицида и средства для борьбы с водорослями в домашних озерах и прудах.
 Он используется в садовых порошках и спреях для уничтожения плесени.
Он используется в садовых порошках и спреях для уничтожения плесени.
- Разное:
- В качестве компонента керамических глазурей и для окрашивания стекла.
- Сплав цинка с образованием латуни используется в музыкальных инструментах и декоративных предметах.
- Различные бронзы, состоящие из меди, олова и других элементов (таких как алюминий, марганец или кремний), используются для изготовления колоколов, тарелок, скульптур и промышленных компонентов.
- Соединения меди (например, раствор Фелинга) находят применение в химии.
- В качестве облицовки частей судов для защиты от скопления ракушек и мидий. Первоначально он использовался в чистом виде, но позже был заменен формой латуни, называемой металлом Мунца.
- Паровой двигатель Джеймса Уатта.
- Инуиты иногда использовали медь для изготовления режущего лезвия для ножей улу.
Биологическая роль
Медь необходима всем высшим растениям и животным. Медь в основном переносится кровью с помощью белка плазмы, называемого церулоплазмином. Когда медь впервые всасывается в кишечнике, она транспортируется в печень в связанном виде с альбумином. Медь содержится в различных ферментах, включая медные центры цитохром-с-оксидазы и фермента супероксиддисмутазы (содержащего медь и цинк). В дополнение к своим ферментативным функциям медь используется для биологического переноса электронов. Белки синей меди, которые участвуют в переносе электронов, включают азурин и пластоцианин. Название «голубая медь» происходит от их интенсивного синего цвета, возникающего из-за полосы поглощения переноса заряда лиганда на металл (LMCT) около 600 нанометров.
Медь в основном переносится кровью с помощью белка плазмы, называемого церулоплазмином. Когда медь впервые всасывается в кишечнике, она транспортируется в печень в связанном виде с альбумином. Медь содержится в различных ферментах, включая медные центры цитохром-с-оксидазы и фермента супероксиддисмутазы (содержащего медь и цинк). В дополнение к своим ферментативным функциям медь используется для биологического переноса электронов. Белки синей меди, которые участвуют в переносе электронов, включают азурин и пластоцианин. Название «голубая медь» происходит от их интенсивного синего цвета, возникающего из-за полосы поглощения переноса заряда лиганда на металл (LMCT) около 600 нанометров.
Большинство моллюсков и некоторые членистоногие, такие как мечехвост, используют для транспорта кислорода медьсодержащий пигмент гемоцианин, а не железосодержащий гемоглобин, поэтому их кровь при насыщении кислородом становится синей, а не красной.
Как отмечалось выше, медь является биостатическим материалом, и медные поверхности не позволяют размножаться бактериям.
Считается, что цинк и медь конкурируют за всасывание в пищеварительном тракте, поэтому диета с избытком одного из этих минералов может привести к дефициту другого. Рекомендуемая диетическая норма (RDA) меди для здоровых взрослых составляет 0,9.миллиграмм (мг)/день.
Токсичность
Со всеми соединениями меди, если не известно иное, следует обращаться так, как если бы они были токсичными. Для человека 30 граммов сульфата меди потенциально смертельны. Предлагаемый безопасный уровень меди в питьевой воде для человека варьируется в зависимости от источника, но, как правило, составляет от 1,5 до 2 мг/л. Верхний допустимый уровень потребления диетической меди (DRI) для взрослых из диетической меди из всех источников составляет 10 мг/день. При токсичности медь может ингибировать фермент дигидрофилгидратазу, фермент, участвующий в кроветворении.
Значительная часть токсичности меди связана с ее способностью принимать и отдавать отдельные электроны при изменении степени окисления. Это катализирует образование очень реакционноспособных «свободных радикалов», таких как гидроксильный (ОН) радикал, аналогично химии фентона. Эта каталитическая активность меди используется ферментами, с которыми она связана, и поэтому токсична только в том случае, если она не изолирована и не опосредована. Увеличение количества неопосредованных реактивных радикалов обычно называют «окислительным стрессом» и является активной областью исследований при различных заболеваниях, где медь может играть важную, но более тонкую роль, чем при острой токсичности.
Это катализирует образование очень реакционноспособных «свободных радикалов», таких как гидроксильный (ОН) радикал, аналогично химии фентона. Эта каталитическая активность меди используется ферментами, с которыми она связана, и поэтому токсична только в том случае, если она не изолирована и не опосредована. Увеличение количества неопосредованных реактивных радикалов обычно называют «окислительным стрессом» и является активной областью исследований при различных заболеваниях, где медь может играть важную, но более тонкую роль, чем при острой токсичности.
Наследственное заболевание, называемое болезнью Вильсона, заставляет организм удерживать медь, поскольку она не выводится печенью с желчью. Это заболевание, если его не лечить, может привести к поражению головного мозга и печени. Кроме того, исследования показали, что люди с психическими заболеваниями, такими как шизофрения, имеют повышенный уровень меди в организме. Однако на данном этапе неизвестно, способствует ли медь психическому заболеванию, пытается ли организм накапливать больше меди в ответ на болезнь, или высокий уровень меди является результатом психического заболевания.
Слишком много меди в воде наносит ущерб морской жизни. Наблюдаемый эффект этих более высоких концентраций на рыб и других существ заключается в повреждении жабр, печени, почек и нервной системы.
Прочие опасности
В порошкообразном виде металл является пожароопасным. Кроме того, при концентрациях выше 1 мг/л медь может оставлять пятна на одежде и других предметах, выстиранных в воде.
Соединения
Самородная медь
Обычные степени окисления меди включают менее стабильное состояние меди (I), Cu 1+ и более стабильное состояние меди (II) Cu 2+ . Последний образует голубые или сине-зеленые соли и растворы. В необычных условиях можно получить состояние 3+ и крайне редкое состояние 4+. Медь (I) и медь (II) также называются их общими названиями, медь и медь, соответственно.
Карбонат меди(II) зеленого цвета. Этот состав придает уникальный вид покрытым медью крышам и куполам некоторых зданий. Сульфат меди (II) образует синий кристаллический пентагидрат, одно из наиболее известных соединений меди в лаборатории. В качестве фунгицида используется бордоская смесь.
Сульфат меди (II) образует синий кристаллический пентагидрат, одно из наиболее известных соединений меди в лаборатории. В качестве фунгицида используется бордоская смесь.
Существует два стабильных оксида меди: оксид меди(II) (CuO) и оксид меди(I) (Cu 2 O). Эти оксиды используются для получения оксида иттрия-бария-меди (YBa 2 Cu 3 O 7-δ ) или YBCO, который составляет основу многих нетрадиционных сверхпроводников.
- Соединения меди (I) : хлорид меди (I), оксид меди (I).
- Соединения меди (II) : карбонат меди (II), хлорид меди (II), гидроксид меди (II), нитрат меди (II), оксид меди (II), сульфат меди (II), медь ( II) сульфид.
- Медные (III) Соединения (редко): калий гексафторуплат (K 3 CUF 6 )
- Mapper (IV). CuF 6 )
Тесты на медь
2+ ионы Добавьте водный раствор гидроксида натрия в тестируемый раствор. Если раствор содержит ионы меди 2+ , то замещением ионов меди ионами натрия будет образовываться голубой осадок гидроксида меди(II). Ионное уравнение:
Если раствор содержит ионы меди 2+ , то замещением ионов меди ионами натрия будет образовываться голубой осадок гидроксида меди(II). Ионное уравнение:
- Cu 2+ (водн.) + 2OH − (водн.) → Cu(OH) 2 (тв.)
Альтернативно, добавьте к испытуемому водному раствору аммиака. Если раствор содержит ионы меди 2+ , будет образовываться осадок, но он растворится при добавлении избытка аммиака, образуя темно-синий аммиачный комплекс, тетрааминомедь(II). Ионное уравнение:
- Cu 2+ (водн.) + 4NH 3 (водн.) → Cu(NH 3 ) 4 2+ (водный)
Примечания
- ↑ Коалиция по образованию в области минералов меди. Проверено 20 июня 2013 г.
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- «Металлы, токсичность и окислительный стресс».
 Current Medicinal Chemistry 12(10) (май 2005 г.): 1161-1208.
Current Medicinal Chemistry 12(10) (май 2005 г.): 1161-1208. - Управление по оценке технологий. Глава 6: «Технология производства меди». В Медь: технология и конкурентоспособность (резюме). 2005.
- «Роль химии Фентона в индуцированной тиолами токсичности и апоптозе». Рез. 145(5) (май 1996 г.): 542-53.
Кредиты
Энциклопедия Нового Света автора и редактора переписали и дополнили статью Википедии в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Кредит должен соответствовать условиям этой лицензии, которая может ссылаться как на – 91 544 участника Энциклопедии Нового Света и самоотверженные добровольные участники Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования.


 Использование меди насчитывает более 10 000 лет. Ледяной Человек Эци (3300 г. до н.э.) был найден с топором, голова которого была сделана из почти чистой меди. Волосы ледяного человека содержали высокий уровень токсина мышьяка, что может указывать на то, что человек подвергся воздействию этого элемента во время плавки меди.
Использование меди насчитывает более 10 000 лет. Ледяной Человек Эци (3300 г. до н.э.) был найден с топором, голова которого была сделана из почти чистой меди. Волосы ледяного человека содержали высокий уровень токсина мышьяка, что может указывать на то, что человек подвергся воздействию этого элемента во время плавки меди. Металл также токсичен для беспозвоночных, поэтому его используют на корпусах кораблей, чтобы предотвратить прикрепление мидий и ракушек. Он также используется для борьбы с водорослями.
Металл также токсичен для беспозвоночных, поэтому его используют на корпусах кораблей, чтобы предотвратить прикрепление мидий и ракушек. Он также используется для борьбы с водорослями.


 «Цветик-семицветик». (7 баллов)
«Цветик-семицветик». (7 баллов)