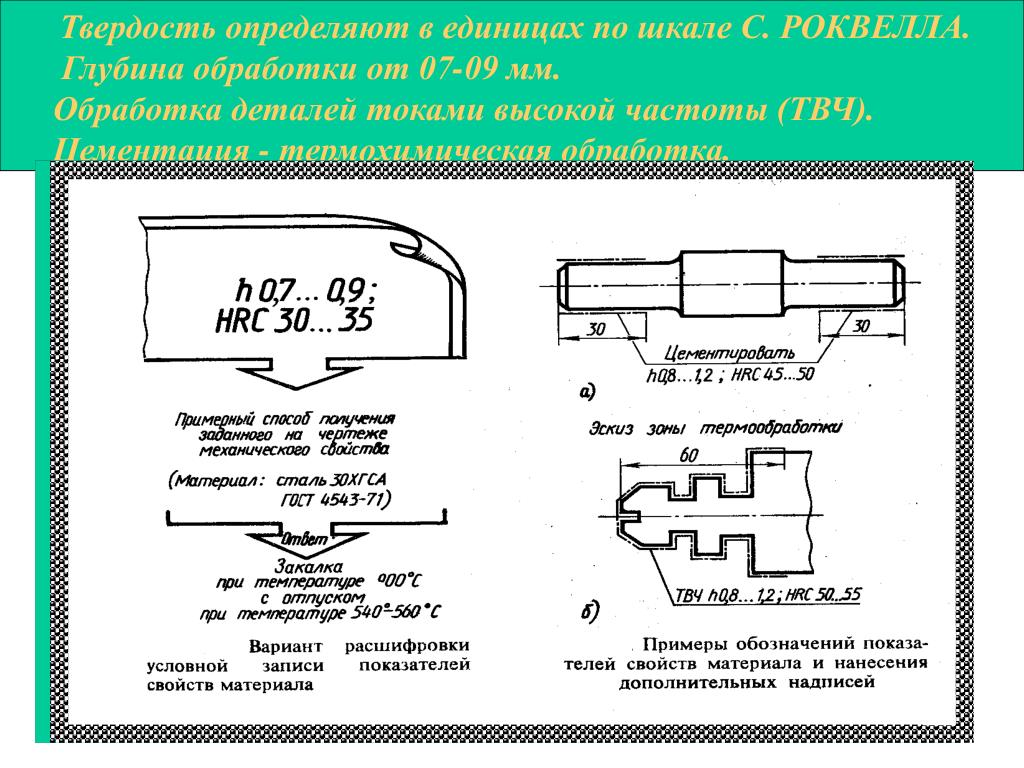
Химическое оксидирование стали пример записи в чертежах: Коды обозначений типа покрытий согласно ГОСТ 9.306-85 на чертежах
alexxlab | 28.05.2023 | 0 | Разное
Оксидирование – антикоррозийная защита металлов
Коррозия сопровождает металлы на всех этапах их служения человеку. Существует немало различных способов, чтобы спасти металлические изделия от коррозионного разрушения. Один из способов защиты металл сам подсказал человеку. На поверхности «голого» металла со временем образуется тонкая оксидная пленка – прочное покрытие, которое предохраняет его от агрессивного воздействия внешней среды.
Однако помимо такого естественного окисления на воздухе оксидные пленки на поверхности стали, желез, алюминия, чугуна можно получать и другими более быстрыми способами. Самый простой – это поместить образец в печь (термическое оксидирование). Также существует химический и электрохимический способ.
Химическое оксидирование
Химический способ позволяет сформировать на поверхности изделий из углеродистой и среднелегированной стали покрытие с высокими защитными и декоративными свойствами. Обработка стальных деталей осуществляется в растворе едкой щелочи и окислителей (хроматов, нитратов и др.). В результате химической реакции происходит формирование окисной пленки преимущественно черного цвета. Небольшая толщина такого покрытия никак не отражается на габаритах резьбы и самого изделия.
Обработка стальных деталей осуществляется в растворе едкой щелочи и окислителей (хроматов, нитратов и др.). В результате химической реакции происходит формирование окисной пленки преимущественно черного цвета. Небольшая толщина такого покрытия никак не отражается на габаритах резьбы и самого изделия.
Анодное оксидирование
Анодирование осуществляется в проводящей среде жидкого электролита. Сущность электрохимического оксидирования заключается в том, что катод, которым является сам защищаемый металл, насыщается электронами от внешнего источника тока. Роль анода в данном случае может выполнять любой б/у металл. В результате такой реакции на поверхности детали появляется защитно-декоративная оксидная пленка. Образованное покрытие отличается более высокими защитными свойствами, чем полученное при химическом оксидировании.
Оксидирование крепежных изделий (шурупов, саморезов, болтов, шпилек, гаек) улучшает их антикоррозионные, жаростойкие и другие свойства, а также придает метизам декоративный вид и повышает их антифрикционные качества, то есть увеличивает устойчивость металла к износу.
Оксидирование – один из самых простых и менее затратных способов защиты металлических крепежных элементов от ржавления. Оксидированные метизы допускается использовать в слабоагрессивных условиях внешней среды. Для повышения защитной способности оксидной пленки, крепеж дополнительно пропитывают маслами, смазками или дегидрирующими жидкостями. После процедуры промасливания металл сможет служить в средних и жестких условиях.
Для крепежа, применяемого в особо ответственных конструкциях, оксидного покрытия недостаточно. Здесь нужен более надежный метод защиты от коррозии – металлический. Он заключается в покрытии стали слоем другого металла, устойчивого к агрессивной среде (никелирование, хромирование, оцинковывание). Но об этом в следующей статье.
Статьи о продукции Обновлено: 02.12.2020 16:28:48
Поставить оценку
Успешно отправлено, Спасибо за оценку!
Нажмите, чтобы поставить оценку
Оксидирование – что это, виды, особенности
В процессе обработки металла большое значение имеет правильная защита материала от коррозии. Именно коррозийное разрушение приводит к тому, что металлические изделия постепенно начинают терять свою прочность и надежность, значительно уменьшается их устойчивость к внешним нагрузкам.
Именно коррозийное разрушение приводит к тому, что металлические изделия постепенно начинают терять свою прочность и надежность, значительно уменьшается их устойчивость к внешним нагрузкам.
В промышленности создано большое количество методов, которые могли бы существенно нарастить качество защиты от коррозии. И одним из таких распространенных средств является оксидирование.
Этот материал мы посвятим рассмотрению вопроса о том, что такое оксидирование, как оно проводится и работает. Это помогает лучше понять особенности процесса, провести его в полном соответствии со всеми установленными техническими требованиями.
Что такое оксидирование
Химический состав металла отличается возможностью появления на нем специальных оксидных пленок, если оказываются созданы соответствующие условия. Это необходимо для того, чтобы исключить контакт материала с источниками окисления, затормозить постепенный процесс разрушения металла.
Кроме непосредственной задачи по защите материала, оксидирование также может использоваться и в целях изменения внешнего вида материала. Это помогает придать ему особые внешние качества, сделать значительно более красивым и эстетичным.
Это помогает придать ему особые внешние качества, сделать значительно более красивым и эстетичным.
Сам процесс оксидирования может проводиться различными способами. В промышленности встречается электрохимическое, химическое, микродуговое и термическое оксидирование. В этом материале мы расскажем о том, чем различные средства отличаются друг от друга.
Химическое оксидирование
Существует множество средств, при помощи которых потенциально может проводиться оксидирование. И химический способ относится к категории одних из наиболее часто используемых.
Применение такого средства предполагает, что будет проводиться обработка изделия в растворе с четко продуманной рецептурой. Это могут быть как расплавы, так и окислители. В составе такого раствора часто встречаются нитраты, хроматы и другие компоненты, способные оказывать на материал аналогичное окислительное воздействие.
В процессе проводится пассивация поверхности. Это значит, что в результате химической реакции начинает формироваться декоративный или защитный слой, блокируется воздействие агрессивных внешних сред, потенциальных катализаторов коррозии.
Химическим методом можно оксидировать как черные, так и цветные металлы. В случае с черными металлами, температура раствора должна составляет 30-100 °С. Лучше всего показывают себя при проведении обработки составы с большим содержанием щелочей или кислот.
Если оксидирование планируется проводить с использованием кислот, раствор выбирается с учетом текущего состава и других особенностей металла. Чаще всего смешивается сразу несколько кислот, которые могли бы сформировать на поверхности материала специальную оксидную пленку. Больше всего распространены соляная и азотная кислоты, к которым могут добавляться различные присадки.
Не менее распространено и щелочное оксидирование. Диапазон температур при его проведении составляет 30-180 °С и чтобы добиться корректного проведения процедуры, его стоит строго соблюдать. При этом раствор создается на основании различных типов окислителей. После того, как обработка будет завершена, с поверхности удаляются все следы рабочего состава, деталь проходит просушивание.
Химическое оксидирование хорошо показывает себя на практике. При этом стоит учитывать, что формируемый на поверхности материала слой менее стойкий и долговечный, чем пленка, которая вырабатывается при использовании другого распространенного метода – анодирования.
Термическое оксидирование
Как можно понять по названию, такой процесс напрямую связан с использованием при обработке металла высоких температур. Но просто нагреть металл недостаточно. Требуется также поместить изделие в среду, которая сформирована с нужным уровнем содержания кислорода.
Чтобы прогреть материал до установленного уровня, требуется использовать специальную печь. Если планируется оксидировать сталь низколегированной группы, либо сделать это с железом, температура не должна превышать отметку в 350 градусов.
Когда проводится обработка легированной стали, максимальная температура увеличивается до 700 °С. Длительность обработки при этом составляет около часа.
Длительность обработки при этом составляет около часа.
Этот метод формирования оксидной пленки наиболее распространен при работе с кремнием. Чтобы материал получил высокий уровень защитных свойств, требуется создавать температуру, которая будет находиться в диапазоне от 800 до 1200 °С.
Анодирование
Анодированием называют оксидирование анодным либо электрохимическим методом. Потому, если вы встречаете такие обозначения процесса, можно сразу понять, что речь идет об одной и той же процедуре.
Чтобы сформировать стойкую оксидную пленку, применяется электролит. Он может быть как твердым, так и жидким. Когда проводится анодирование, используется положительный потенциал поверхности металла.
Активно используется анодирование, если нужно изменить внешние свойства материала, сделать его более эстетичным. При этом удается комбинировать как декоративные, так и защитные свойства для достижения одной цели.
Метод отличается универсальностью. Его можно применять для разных вариантов металлов и сплавов, но с учетом их первоначального состава. Как показывает практика, более всего распространен такой метод в том случае, если требуется провести обработку алюминия.
Как показывает практика, более всего распространен такой метод в том случае, если требуется провести обработку алюминия.
Плазменное оксидирование
При рассмотрении особенностей такого процесса нельзя забывать про использование плазменного метода обработки. Его особенность заключается в том, что в отличие от термического оксидирования, формируется не высокая, а низкая температура. Само изделие при этом находится внутри специально созданной с учетом особенностей материала плазменной среды.
При формировании плазмы используется ток. Таким образом удается обрабатывать кремний, а также полупроводники из различных материалов. Кроме своих непосредственных задач по защите, метод востребован, потому что помогает повысить степень светочувствительности некоторых типов изделий, которые нуждаются в этом больше всего.
Микродуговое оксидирование
Еще один метод, который активно применяется в ходе работ по созданию оксидных пленок – это микродуговое оксидирование. Название этого процесса также можно встретить под кратким обозначением «МДО».
Оксидные слои, которые формируются в результате такого воздействия на материал, оказываются многофункциональными. Эта методика во многом схожа по своим особенностям с анодной обработкой. Защитные свойства, которые формируются в результате, оказываются очень высокими.
Материал отлично защищается от термического воздействия, изолируется от агрессивных сред, которые провоцируют формирование коррозии. Нельзя также забывать и про декоративные особенности. Со стороны может показаться, что изделие после микродугового оксидирования становится керамическим. Но это только внешнее впечатление, потому что все остальные центральные особенности сохраняются.
Как отмечают специалисты, если рассматривать все методы оксидирования, то именно микродуговое привлекает к себе заметный интерес. Оно помогает формировать очень стойкое и прочное покрытие, что решает распространенную проблему – стирание оксидной пленки, потенциально приводящее к развитию коррозии и другим вариантам повреждения материала.
Чтобы провести микродуговое оксидирование применяется электролит с малым уровнем концентрации щелочи. При этом в него подается переменный или импульсный ток строго заданной частоты. Специального изменения свойств и какой-либо дополнительной подготовки при этом не требуется – материал просто нужно очистить.
Во время создания оксидных пленок применяется большое количество микроразрядов. Они передвигаются по хаотичным траекториям. При этом, удается сформировать как термическое, так и плазмохимическое воздействие.
Одно из преимуществ такого метода заключается в том, что само покрытие оказывается очень глубоко проникающим. Ему удается проникнуть вглубь материала на 70%. При этом еще 30% покрытия оказывается с наружной стороны, что позволяет формировать комплексную защиту с максимальной степенью защищенности.
Стоит также обратить внимание и на толщину покрытия. Она варьируется в диапазоне от 200 до 250 кг, что позволяет говорить о по-настоящему высоких показателях. При выборе определенной температуры электролита также уделяется большое внимание тому, с каким исходным материалом предстоит работать. Температура отличается от 15 до 400 °С.
Температура отличается от 15 до 400 °С.
Большое значение также имеет и то, какой именно электролит применяется в процессе. Вне зависимости от того, какой состав используется, какого-либо особого влияния на окружающую среду не оказывается.
В пользу выбора такого метода говорит доступность оборудования, его компактность и тот факт, что сами электролиты отличаются повышенным уровнем рассеивающих свойств. Это помогает работать с различными деталями, в том числе теми, у которых сложная форма, есть большое количество выемок и других особенностей рельефа поверхности.
Особенности использования оксидирования в процессе работы с алюминиевыми сплавами
При рассмотрении особенностей процесса оксидирования, особенно пристальное внимание стоит уделить вопросу создания оксидных слоев непосредственно на поверхности материала. Причина заключается в том, что в этом случае допустить ошибку становится значительно проще, чем с в случае с черными металлами. Тогда вся работа пойдет насмарку.
В процессе работы с алюминием используется несколько описанных ранее методов. Это химический, микродуговой и электрохимический. Рассмотрим их подробнее далее.
Анодное оксидирование алюминия и его сплавов
Во время работы с алюминием часто применяется его анодирование. Этот метод помогает значительно повысить степень защищенности от атмосферной коррозии, как для самого материала, так и для сплавов, которые формируются на его основе. Создание стойкой оксидной пленки таким методом также помогает подготовить поверхность для последующего успешного выполнения окрашивания выбранным типом состава.
Во время подобного метода обработки, с внешней стороны материала удается получить стойкое покрытие, которое будет отличаться повышенным уровнем защиты как от контакта с водой, так и кислот. Если рассматривать состав пленки, то больше всего в ней будет именно оксида алюминия. При этом стоит также обратить внимание на то, что основные характеристики твердости будут меняться в зависимости от того, какой состав у исходного материала:
- Технический алюминий – от 5000 до 6000 Мпа.

- Алюминиевые сплавы – от 2000 до 5000 Мпа.
Еще один важный показатель слоя, который формируется при использовании анодного оксидирования составляет 1014 – 1015 Ом·м.
Важная особенность анодного оксидирования заключается в том, что оно позволяет гибко формировать особенности каждого конкретного слоя. Он может иметь разную твердость, степень пористости, эластичность и другие ключевые показатели, которые стоит учитывать. Все что нужно при выполнении обработки для изменения характеристик конкретного слоя – отрегулировать состав электролита или сменить характеристики проводимого в конкретном случае электролиза.
Если электролит, который применяется в конкретном случае, создает кислую или нейтральную среду, на поверхности защитный слой создается очень быстро. При этом происходит стремительное твердение до заданных ранее показателей.
Электрохимическое оксидирование алюминия
Если в рамках выполняемой обработки выполняется электрохимическое оксидирование, то первичная пленка оказывается очень тонкой. Чтобы сделать ее значительно более толстой, требуется применять кислород.
Чтобы сделать ее значительно более толстой, требуется применять кислород.
На практике доказано, что рост пленки прекращается в том случае, если она достигает толщины 0,1 мкм. Чтобы спровоцировать дальнейшее разрастание защитного слоя, нужно использовать повышение напряжения строго в первоначально заданном диапазоне.
Стоит также обратить внимание на способность электролита к постепенному растворению формирующегося оксида алюминия и пленки, которую он способен создавать на поверхности материала. Потому нужно контролировать параметры проведения процедуры для того, чтобы пленка не растворялась, а наращивалась до уровня толщины до 2 мкм. Покрытие в таком случае будет отличаться как хорошими защитными показателями, так и низким уровнем пористости.
Если во время процедуры используется электролит, он может быстро растворить оксидный слой, либо сделать пленку значительно более толстой. Это зависит от состава, температуры и других условий.
В ряде случаев наблюдается ситуация, при которой скорость окисления значительно превышает скорость процесса, с которым на материале формируются окислы. В таком случае нужно контролировать ее стандартными методами.
В таком случае нужно контролировать ее стандартными методами.
Также стоит обратить внимание на степень толщины оксидной пленки. На этот параметр напрямую влияет то, насколько хорошо электролит может растворять конкретные варианты оксидов, как ведет себя материал, который оказывается погружен в него.
Еще один параметр, на который стоит обратить внимание – это непосредственно сама толщина оксидного покрытия. Во многом на нее влияет состав алюминия и сплавов, которые создаются на его основе. Считается, что обработка чистого алюминия значительно проще, чем работа с его сплавами – при анодировании слой удается сформировать значительно быстрее.
Если в сплаве есть большое количество различных добавок, пленка будет образовываться медленнее, значительно сложнее будет сформировать пленку, которая по своим характеристикам полностью подходит под ваши требования. Особенно сильное негативное влияние на качество оксидирования оказывает наличие в составе сплава таких компонентов, как медь, железо, марганец и магний. Если они есть, велика вероятность того, что защитная прослойка станет менее качественной и ровной. Такой дефект провоцируется тем, что при формировании пленки происходит формирование соединений, которые затем растворяются, создают пленки и пустоты.
Если они есть, велика вероятность того, что защитная прослойка станет менее качественной и ровной. Такой дефект провоцируется тем, что при формировании пленки происходит формирование соединений, которые затем растворяются, создают пленки и пустоты.
Применение оксидирования помогает получить пленку, которая состоит сразу из двух слоев. Один располагается непосредственно на границе с металлом. Именно он отвечает за формирование стабильной барьерной среды. Второй слой более толстый, в нем больше пор, выше мягкость. Он эффективно проникает в сам материал и делает его значительно более защищенным от большинства потенциальных внешних угроз.
Химическое оксидирование алюминия
Рассматривая процесс формирования на алюминии и его сплавах специальной оксидной пленки, стоит обратить внимание и на методы химического оксидирования. Эта технология востребована в промышленности, потому что отличается доступной стоимостью, сравнительной простой в реализации подготовкой изделия и рядом других преимуществ.
Важная особенность такого процесса заключается в том, что он не использует во время работы электрического тока. Изделие из алюминия или одного из сплавов помещается непосредственно в раствор хроматов. Это стимулирует постепенное появление оксидных пленок, помогает значительно ускорить процесс работы с крупными партиями – доступна одновременная параллельная обработка деталей.
Стоит отметить высокий уровень качества пленок, который, тем не менее, уступает анодированию и электрохимическим пленкам. Толщина подобного покрытия будет составлять до 3 мкм. Подобного оксидного слоя на практике вполне хватает для того, чтобы устранить большинство потенциальных угроз и оградить заготовку от негативного воздействия внешних агрессивных сред.
Именно при проведении химического оксидирования на первый план выходит контроль температуры. Большое значение имеет также и сам состав электролита, который активно будет использоваться в процессе.
Если в растворе, который применяется при подобной обработке детали, слишком мало щелочи, пленка будет слишком тонкой. Когда наблюдается перегрев есть вероятность получения рыхлой прослойки, которая не сможет выдержать значительного механического давления, сотрется и откроет путь для формирования коррозии.
Когда наблюдается перегрев есть вероятность получения рыхлой прослойки, которая не сможет выдержать значительного механического давления, сотрется и откроет путь для формирования коррозии.
Финишная обработка оксидных пленок
Наконец, стоит обратить внимание на проведение качественной финишной обработки оксидного слоя, который успел сформироваться на поверхности материала.
Существует два основных метода, которые могут использоваться в процессе:
- Проведение уплотнения. Средство направлено на то, чтобы слой оксидов стал заметно более стойким к коррозии, воздействию света. Это также помогает существенно нарастить его диэлектрические свойства – такая особенность проверена на практике. При проведении уплотнения хорошо показывает себя прогретая до температуры кипения вода. В нее могут добавляться соли, поверхностно-активные вещества. Все это помогает заметно увеличить скорость проведения такого процесса.
- Окрашивание. Пленки также могут окрашиваться – это позволяет сделать изделие более привлекательным внешне, а также сформировать дополнительный защитный слой, который ограничит потенциальный контакт с агрессивными средами.
 Чтобы краска легла ровно и без дефектов, пленка качественно промывается, с нее удаляются все посторонние загрязнения. Потом начинается непосредственное окрашивание. При этом стоит обратить внимание на то, что показатели пористости созданного ранее активного слоя напрямую влияют на то, какой цвет получит покрытие и насколько стойким оно в итоге окажется.
Чтобы краска легла ровно и без дефектов, пленка качественно промывается, с нее удаляются все посторонние загрязнения. Потом начинается непосредственное окрашивание. При этом стоит обратить внимание на то, что показатели пористости созданного ранее активного слоя напрямую влияют на то, какой цвет получит покрытие и насколько стойким оно в итоге окажется.
Оцинковка как средство защиты от коррозии
Еще один метод, который помогает надежно защитить материал от контакта с внешними агрессивными средами – проведение цинкования. Наша компания предоставляет клиентам профессиональное горячее цинкование с применением передового современного оборудования.
Есть сразу несколько причин обратиться к нам:
- Большие производственные мощности. У нас есть три крупных цеха для выполнения горячего цинкования. Мощность предприятия составляет до 120 тысяч тонн продукции в год.
- Высокий уровень качества. Мы строго следим за требованиями ГОСТ 9.307-89. Также на предприятии используется лучшее оборудование немецко-австрийской фирмы KVK KOERNER и чешской фирмы EKOMOR.
 Это позволяет нам быть уверенными в высоком уровне работы и предоставлять официальные гарантии.
Это позволяет нам быть уверенными в высоком уровне работы и предоставлять официальные гарантии. - Большой опыт. Мы успешно работаем на рынке с 2007 года. За это время было реализовано множество проектов.
Чтобы связаться с нами, получить дополнительные консультации по всем вопросам, касающимся сроков выполнения вашего заказа и других задач, достаточно просто оставить заявку на сайте или позвонить по указанным телефонам.
Вернуться к статьям
Поделиться статьей
Степени окисления переходных металлов
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 650
Степень окисления элемента связана с количеством электронов, которые атом теряет, приобретает или, по-видимому, использует при соединении с другим атомом в соединениях. Он также определяет способность атома окислять (терять электроны) или восстанавливать (приобретать электроны) другие атомы или частицы. Почти все переходные металлы имеют несколько экспериментально наблюдаемых степеней окисления.
Он также определяет способность атома окислять (терять электроны) или восстанавливать (приобретать электроны) другие атомы или частицы. Почти все переходные металлы имеют несколько экспериментально наблюдаемых степеней окисления.
Введение
Для заполнения атомных орбиталей требуется определенное количество электронов. S-блок состоит из элементов I и II групп, щелочных и щелочноземельных металлов (к этому блоку относятся натрий и кальций). Группы с XIII по XVIII включают p-блок, который содержит неметаллы, галогены и инертные газы (обычными членами являются углерод, азот, кислород, фтор и хлор). Переходные металлы находятся в d-блоке между группами III и XII. Если следующая таблица покажется вам странной или ориентация неясна, просмотрите раздел, посвященный атомным орбиталям.
| с Орбитальный | p Орбиты | d Орбиты |
|---|---|---|
| 1 орбиталь, 2 электрона | 3 орбитали: p x , p y , p z ; 6 электронов | 5 орбиталей: d x 2 -y 2 , d z 2 , d xy , d |
| Орбиталь с наивысшей энергией для данного квантового числа n | Вырожденный с s-орбиталью квантового числа n+1 |
Главное, что нужно помнить об электронной конфигурации, это то, что наиболее стабильная конфигурация благородного газа идеальна для любого атома. Формирование связей — это способ приблизиться к этой конфигурации. В частности, переходные металлы образуют более мягкие связи с анионами, катионами и нейтральными комплексами по сравнению с другими элементами. Это связано с тем, что d-орбиталь довольно размыта (в большей степени f-орбиталь серий лантанидов и актинидов).
Формирование связей — это способ приблизиться к этой конфигурации. В частности, переходные металлы образуют более мягкие связи с анионами, катионами и нейтральными комплексами по сравнению с другими элементами. Это связано с тем, что d-орбиталь довольно размыта (в большей степени f-орбиталь серий лантанидов и актинидов).
Электронные конфигурации нейтрального атома
Счет в периодической таблице — это простой способ определить, какие электроны находятся на каких орбиталях. Как упоминалось ранее, подсчитав протоны (атомный номер), вы можете определить количество электронов в нейтральном атоме. Организация по блокам ускоряет этот процесс. Например, если бы нас интересовало определение электронной организации ванадия (атомный номер 23), мы бы начали с водорода и продвигались вниз по периодической таблице).
1s (H, He), 2s (Li, Be), 2p (B, C, N, O, F, Ne), 3s (Na, Mg), 3p (Al, Si, P, S, Cl, Ar), 4s (K, Ca), 3d (Sc, Ti, V).
Если вы не уверены в этой системе счета и в том, как заполняются электронные орбитали, см. раздел о конфигурации электронов.
раздел о конфигурации электронов.
Ссылка на приведенную ниже периодическую таблицу подтверждает эту организацию. У нас есть три элемента на 3d-орбитали. Поэтому пишем в порядке заполнения орбиталей. 9или
[Ar] 4s 2 3d 3 .
Конфигурации нейтральных атомов переходных металлов четвертого периода приведены в таблице \(\PageIndex{2}\).
| Sc | Ти | В | Кр | Мн | Фе | Со | Никель | Медь | Цинк |
|---|---|---|---|---|---|---|---|---|---|
| [Ar] 4s 2 3d 1 | [Ar] 4s 2 3d 2 | [Ar] 4s 2 3d 3 | [Ar] 4s 2 3d 4 | [Ar] 4s 2 3d 5 | [Ar] 4s 2 3d 6 | [Ar] 4s 2 3d 7 | [Ar] 4s 2 3d 8 | [Ar] 4s 2 3d 9 | [Ar] 4s 2 3d 10 |
| [Ar] 4s 1 3d 5 | [Ar] 4s 1 3d 10 |
Хром и медь выглядят аномально. Взгляните на место элемента Chromium (атомный номер 24) в периодической таблице (рисунок \(\PageIndex{1}\)). Электронная конфигурация хрома не [Ar] 4s 2 3d 4 , а [Ar] 4s 1 3д 5 . Это связано с тем, что наполовину заполненное 3d-многообразие (с одним 4s-электроном) более стабильно, чем частично заполненное d-многообразие (и заполненное 4s-многообразие). Из таблицы \(\PageIndex{2}\) вы заметите, что медь демонстрирует аналогичное явление, хотя с полностью заполненным d-коллектором.
Взгляните на место элемента Chromium (атомный номер 24) в периодической таблице (рисунок \(\PageIndex{1}\)). Электронная конфигурация хрома не [Ar] 4s 2 3d 4 , а [Ar] 4s 1 3д 5 . Это связано с тем, что наполовину заполненное 3d-многообразие (с одним 4s-электроном) более стабильно, чем частично заполненное d-многообразие (и заполненное 4s-многообразие). Из таблицы \(\PageIndex{2}\) вы заметите, что медь демонстрирует аналогичное явление, хотя с полностью заполненным d-коллектором.
Степени окисления ионов переходных металлов
При рассмотрении ионов мы добавляем или вычитаем отрицательные заряды из атома. Учет атомных орбиталей при присвоении степеней окисления помогает понять, что переходные металлы представляют собой особый случай, но не исключение из этого удобного метода. Атому, который принимает электрон для достижения более стабильной конфигурации, присваивается степень окисления -1. Пожертвование электрона тогда +1. Когда переходный металл теряет электроны, он имеет тенденцию терять свои s-орбитальные электроны раньше любого из своих d-орбитальных электронов. Для более подробного обсуждения формы этих соединений см. Образование координационных комплексов.
Когда переходный металл теряет электроны, он имеет тенденцию терять свои s-орбитальные электроны раньше любого из своих d-орбитальных электронов. Для более подробного обсуждения формы этих соединений см. Образование координационных комплексов.
Пример \(\PageIndex{1}\)
Запишите электронные конфигурации:
- нейтральное железо,
- ион железа (II) и
- ион железа(III).
- Ответить
Атомный номер железа равен 26, поэтому в этом веществе 26 протонов.
- Fe: [Ar] 4s 2 3d 6
- Fe 2 + : [Ar] 3d 6
- Fe 3 + : [Ar] 3d 5
Обратите внимание, что сначала теряются s-орбитальные электроны , затем d-орбитальные электроны.
Пример \(\PageIndex{2}\)
Определите более стабильную конфигурацию между следующей парой:
- [Kr] 5s 2 4d 6 по сравнению с [Kr] 5s 1 4
- Ag 1 + против Ag 2 +
- Ответить
- Здесь описывается рутений.
 Имеется только один 5s электрон.
Имеется только один 5s электрон. - Однократно окисленное серебро ([Kr] 4d 10 ) более стабильно, чем дважды- ([Kr] 4d 9 ).
- Здесь описывается рутений.
Несколько степеней окисления
Большинство переходных металлов имеют несколько степеней окисления, поскольку переходные металлы относительно легко теряют электроны по сравнению с щелочными металлами и щелочноземельными металлами. Щелочные металлы имеют один электрон на валентной s-орбитали, а их ионы почти всегда имеют степень окисления +1 (из-за потери одного электрона). Точно так же щелочноземельные металлы имеют два электрона на своих валентных s-орбиталях, что приводит к образованию ионов со степенью окисления +2 (из-за потери обоих). Однако переходные металлы более сложны и демонстрируют ряд наблюдаемых степеней окисления, в первую очередь из-за удаления d-орбитальных электронов. В следующей таблице описаны наиболее распространенные степени окисления элементов периода 3.
Скандий — один из двух элементов первого периода переходного металла, который имеет только одну степень окисления (другой — цинк со степенью окисления +2). Все остальные элементы имеют как минимум две различные степени окисления. Марганец, находящийся в середине периода, имеет наибольшее количество степеней окисления и, действительно, самую высокую степень окисления за весь период, поскольку у него пять неспаренных электронов (см. таблицу ниже).
Все остальные элементы имеют как минимум две различные степени окисления. Марганец, находящийся в середине периода, имеет наибольшее количество степеней окисления и, действительно, самую высокую степень окисления за весь период, поскольку у него пять неспаренных электронов (см. таблицу ниже).
Чтобы помочь запомнить стабильность более высоких степеней окисления для переходных металлов, важно знать тенденцию: стабильность более высоких степеней окисления постепенно увеличивается вниз по группе. Например, в группе 6 (хром) Cr наиболее стабилен при степени окисления +3, а это означает, что вы не найдете много стабильных форм Cr в степени окисления +4 и +5. Напротив, существует много стабильных форм молибдена (Mo) и вольфрама (W) в степенях окисления +4 и +5.
Пример \(\PageIndex{3}\)
Что делает цинк стабильным в виде Zn 2 + ? Что делает скандий стабильным в виде Sc 3 + ?
- Ответить
Цинк имеет нейтральную конфигурацию [Ar]4s 2 3d 10 .
 Потеря 2 электронов не меняет полную d-орбиталь. Нейтральный скандий записывается как [Ar]4s 2 3d 1 . Потеря 3 электронов приводит конфигурацию в благородное состояние с валентностью 3p 6 .
Потеря 2 электронов не меняет полную d-орбиталь. Нейтральный скандий записывается как [Ar]4s 2 3d 1 . Потеря 3 электронов приводит конфигурацию в благородное состояние с валентностью 3p 6 .
Пример \(\PageIndex{4}\)
Почему железо почти всегда Fe 2 + или Fe 3 + ?
- Ответить
Железо записывается как [Ar]4s 2 3d 6 . Потеря 2 электронов с s-орбитали (3d 6 ) или 2 s- и 1 d-орбитали (3d 5 ) электрона являются довольно стабильными состояниями окисления.
Пример \(\PageIndex{5}\)
Запишите оксиды марганца в нескольких различных степенях окисления. Какие из них возможны и/или разумны?
- Ответить
Хотя Mn +2 является наиболее стабильным ионом марганца, d-орбиталь может удалять от 0 до 7 электронов.
 Таким образом, соединения марганца варьируются от Mn(0) в виде Mn (s) , Mn(II) в виде MnO, Mn(II, III) в виде Mn 3 O 4 , Mn(IV) в виде MnO 2 , или диоксид марганца, Mn(VII) в перманганат-ионе MnO 4 – и так далее.
Таким образом, соединения марганца варьируются от Mn(0) в виде Mn (s) , Mn(II) в виде MnO, Mn(II, III) в виде Mn 3 O 4 , Mn(IV) в виде MnO 2 , или диоксид марганца, Mn(VII) в перманганат-ионе MnO 4 – и так далее.
Степень окисления переходных металлов в соединениях
При наличии ионного соединения, такого как \(\ce{AgCl}\), можно легко определить степень окисления переходного металла. В этом случае вас попросят определить степень окисления серебра (Ag). Поскольку мы знаем, что хлор (Cl) находится в группе галогенов периодической таблицы, мы знаем, что он имеет заряд -1, или просто Cl – . Кроме того, видя, что для \(\ce{AgCl}\) нет общего заряда (что определяется, глядя на верхний правый угол соединения, т.е. AgCl # , где # представляет собой общий заряд соединения), мы можем заключить, что серебро (\(\ce{Ag}\)) имеет степень окисления +1. Это дает нам Ag + и Cl – , в которых положительный и отрицательный заряд компенсируют друг друга, в результате чего получается общий нейтральный заряд; поэтому +1 подтверждается как степень окисления серебра (Ag).
Пример \(\PageIndex{6}\)
Определите степень окисления кобальта в \(\ce{CoBr2}\).
- 9{-}}\)). Так как есть два брома, каждый с зарядом -1. Кроме того, мы знаем, что \(\ce{CoBr2}\) имеет общий нейтральный заряд, поэтому мы можем сделать вывод, что катион (кобальт), \(\ce{Co}\) должен иметь степень окисления от +2 до нейтрализовать заряд -2 от двух анионов брома.
Пример \(\PageIndex{7}\)
Какова степень окисления цинка в \(\ce{ZnCO3}\). (Примечание: анион \(\ce{CO3}\) имеет зарядовое состояние -2)
- Ответ 9{-}}\).
Этот пример также показывает, что атомы марганца могут иметь степень окисления +7, которая является максимально возможной степенью окисления для переходных металлов четвертого периода.
Марганец: тематическое исследование
Марганец широко изучается, поскольку он является важным восстановителем в химическом анализе, а также изучается в биохимии для катализа и в металлургии для обогащения сплавов.
Рисунок \(\PageIndex{2}\): (слева) Грубый фрагмент блестящего серебристого металла (CC BY-SA 3.0; Tomihahndorf через Википедию) (справа) В некоторых наскальных рисунках Ласко используются пигменты на основе марганца. (Общественное достояние; Prof saxx через Википедию) В растениях марганец требуется в следовых количествах; более сильные дозы начинают вступать в реакцию с ферментами и подавляют некоторые клеточные функции. Из-за гибкости марганца в принятии многих степеней окисления он становится хорошим примером для описания общих тенденций и концепций, лежащих в основе электронных конфигураций.
В растениях марганец требуется в следовых количествах; более сильные дозы начинают вступать в реакцию с ферментами и подавляют некоторые клеточные функции. Из-за гибкости марганца в принятии многих степеней окисления он становится хорошим примером для описания общих тенденций и концепций, лежащих в основе электронных конфигураций.Электронные конфигурации неспаренных электронов называются парамагнитными и реагируют на близость магнитов. Полностью спаренные электроны диамагнитны и не чувствуют этого влияния. Марганец, в частности, имеет парамагнитную и диамагнитную ориентацию в зависимости от его степени окисления. 9{0}\nonumber\]
Поскольку все 3p-орбитали спарены, этот комплекс является диамагнитным.

Резюме
Степени окисления переходных металлов подчиняются общим правилам для большинства других ионов, за исключением того факта, что d-орбиталь вырождается с s-орбиталью с более высоким квантовым числом. Переходные металлы достигают стабильности за счет соответствующего расположения своих электронов и окисляются или теряют электроны на другие атомы и ионы. Эти образующиеся катионы участвуют в образовании координационных комплексов или синтезе других соединений.
Вопросы
Определите степени окисления переходных металлов, обнаруженных в этих нейтральных соединениях. Примечание. В следующих соединениях переходный металл подчеркнут.
(A) Медь(I) Хлорид: Cu Cl (B) Медь(II) Нитрат: Cu (NO 3 ) 2 (C) Золото(V) Фтор: Au F 5 (D) Железо(II) Оксид: Fe O (E) Железо(III) Оксид: Fe 2 O 3 (F) Свинец(II) Хлор: Pb Cl 2 (G) Свинец(II) Нитрат: Pb (NO 3 ) 2 (H) Марганец(II) Хлорид: Mn Cl 2 (I) Молибден триоксид: Mo O 3 (J) Никель(II) Гидроксид: Ni (OH) 2 (K) Платина(IV) Хлорид: Pt Cl 4 (L) Серебро Сульфид: Ag 2 S (M) Вольфрам(VI) Фтор: W F 6 (N) Ванадий(III) Нитрид: V N (O) Цирконий Гидроксид: Zr (OH) 4 - Определите степень окисления переходного металла для общего ненейтрального соединения: Манганат ( Mn O 4 2 – 0 )
- Почему переходные металлы имеют большее число степеней окисления, чем металлы основной группы (т.
 е. щелочные металлы и щелочноземельные металлы)?
е. щелочные металлы и щелочноземельные металлы)? - Какой переходный металл имеет наибольшее количество степеней окисления?
- Почему число степеней окисления переходных металлов увеличивается в середине группы?
- Какие два переходных металла имеют только одну степень окисления?
Ссылки
- Окстоби Д., Гиллис Х.П., Кэмпион, А. Принципы современной химии, 6 -е, -е изд. Томсон Брукс/Коул, Белмонт. 2008 г.; 313-318.
- Audi A, Шервуд, стр. Рентгено-фотоэлектронные спектроскопические исследования валентной зоны марганца и его оксидов, интерпретированные расчетами кластерной и зонной структуры ; Серф. Интерфейс Анал.; 2002 г.; 33; 274-282.
- Reaney S, Kwik-Uribe C, Smith D. Состояние окисления марганца и его последствия для токсичности. Хим. Рез. Токсикол.; 2002 г.; 15; 1119-1126.
- CRC Handbook, 88 th ed. св. 1, пр. 1 Электронная конфигурация и энергия ионизации нейтральных атомов в основном состоянии ; 13-14.

- CRC Handbook, 88 th ed. св. 4, пр. 1 Температуры плавления, кипения, тройной и критической температуры элементов ; 133-134.
Авторы и ссылки
- Марго Крейтман (UCD), Джослин Вуд, Лиза Чу (UCD)
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги
- атомные орбитали
- конфигурация
- делокализованный
- диамагнетик
- электронная конфигурация
- электронная конфигурация
- энергетические диаграммы
- ионов
- Конфигурация благородного газа
- степени окисления
- степень окисления
- степени окисления
- парамагнитный
- физические свойства
- переходный металл
- Ион переходного металла
- Ионы переходных металлов
Что такое точечная коррозия? Как обнаружить и лечить питтинговую коррозию?
Питтинговая коррозия поражает металлы и сплавы, такие как сталь, железо, алюминий и другие.
 Обычно он ограничивается определенными областями. Он быстро проникает и атакует, и его трудно обнаружить. Чаще всего это происходит, когда слой пассивного покрытия физически поврежден или подвергся химическому воздействию. Это создает слабое место, где вода или коррозионные растворы воздействуют на подложку.
Обычно он ограничивается определенными областями. Он быстро проникает и атакует, и его трудно обнаружить. Чаще всего это происходит, когда слой пассивного покрытия физически поврежден или подвергся химическому воздействию. Это создает слабое место, где вода или коррозионные растворы воздействуют на подложку.Соседние материалы часто остаются незатронутыми. Если ее не остановить, точечная коррозия может быть разрушительной для кровельных систем или любой металлической конструкции. Она возникает быстро и ее легко не заметить, поэтому многие считают ее самой опасной формой коррозии.
Точечная коррозия Объяснение
Питтинговая коррозия представляет собой полость, отверстие или ямку, которые образуются на небольшой площади или в точке. Ямки или отверстия закрыты небольшим количеством продуктов коррозии (ржавчины) на поверхности. Когда катодная реакция на большой площади (покрытие) поддерживает анодную реакцию на небольшой площади (открытый металл), образуется ямка, полость или маленькое отверстие.
 Окисление происходит в металле даже при отсутствии подачи кислорода.
Окисление происходит в металле даже при отсутствии подачи кислорода.Большое потребление электронов большим катодом переносится на маленький анод, в результате чего возникает интенсивная точечная коррозия. Это будет незаметно и произойдет быстро с очень вредными последствиями. На поверхности видно только небольшое пятно ржавчины, в то время как повреждение происходит глубоко в металлической конструкции внизу.
Диаграмма точечной коррозии, показывающая, как ржавчина образуется в небольшой анодной области из-за высокого потребления электронов большой катодной площадью, образующей ямку внизу.
Что вызывает точечную коррозию?
Точечная коррозия возникает, когда катод (поврежденное покрытие) большой, а анод (открытый металл) маленький. Обычно поверхностный защитный слой или пленка становится катодом, когда он повреждается и трескается. Затем обнажается небольшой участок металла, который становится анодом.
Питтинг проявляется сильно, если раствор на поверхности металла содержит ионы хлорида, гипохлорита или бромида.
 Другими вредными растворами являются те, которые содержат фториды и йодиды. Также известно, что сульфиды и вода усиливают процесс питтинговой коррозии.
Другими вредными растворами являются те, которые содержат фториды и йодиды. Также известно, что сульфиды и вода усиливают процесс питтинговой коррозии.Наиболее распространенными причинами точечной коррозии являются;
- Трещины в защитном покрытии
- Царапины, потертости и мелкие сколы
- Неравномерное напряжение
- Дефект металлической подложки
- Турбулентный поток жидкости
- Неоднородное защитное покрытие
- Химическое воздействие на защитное покрытие
Склонность к металлам к точечной коррозии относятся;
- Нержавеющая сталь
- Хром
- Пассивное железо
- Ртуть
- Кобальт
- Алюминий
- Медь
- Ассоциированные сплавы
Другой пример точечной коррозии возникает, когда металл плохо обслуживается и подвергается воздействию капель воды и частиц пыли. Область под каплей недостаточно насыщена кислородом, в то время как окружающие области хорошо насыщены кислородом.
 Это приводит к дифференциальной аэрационной коррозии, когда окружающие области являются катодными, а небольшая область под каплями и частицами пыли становится анодной. Электроны проходят через металл и встречают воду и кислород. Ионы образуются и распадаются вместе, образуя ржавчину. По мере образования ржавчины в металле появляются ямки, трещины и щели.
Это приводит к дифференциальной аэрационной коррозии, когда окружающие области являются катодными, а небольшая область под каплями и частицами пыли становится анодной. Электроны проходят через металл и встречают воду и кислород. Ионы образуются и распадаются вместе, образуя ржавчину. По мере образования ржавчины в металле появляются ямки, трещины и щели.Типы точечной коррозии
Точечная коррозия может проявляться в различных формах. Форма ямки во многом зависит от затронутого материала и направления зерна в этом материале. Чаще всего страдают пассивные металлы и сплавы, в том числе нержавеющая сталь и алюминий. Однако почти любой металл или материал, подверженный коррозии, может быть затронут.
Желобковая точечная коррозия
Желобовые углубления имеют тенденцию быть полусферическими, чашеобразными или неправильной формы. Точечная коррозия возникает, когда пассивная пленка (защитный слой) разрушается, а металлическая стенка разрушается, образуя узкие и глубокие бороздки.
 Их плоские стенки обнажают кристаллическую структуру металла. Они могут быстро перфорировать толщину материала, например, кровельного листа, фермы или элемента водосточного желоба.
Их плоские стенки обнажают кристаллическую структуру металла. Они могут быстро перфорировать толщину материала, например, кровельного листа, фермы или элемента водосточного желоба.Диаграмма поперечного сечения точечной коррозии с вертикальной коррозией зерна.
Диаграмма поперечного сечения точечной коррозии с узкими и глубокими желобами.
Диаграмма поперечного сечения точечной коррозии в виде эллиптической желоба.
Неглубокая, широкая желобчатая точечная коррозия. Диаграмма поперечного сечения.
Боковая питтинговая коррозия
Боковые ямки покрыты полупроницаемой пленкой продуктов коррозии (ржавчины) и проявляются в виде горизонтальных зерен, подрезов и подповерхностных форм. Боковая точечная коррозия может очень быстро проникнуть в металл. Это очень трудно обнаружить, потому что поверхность металла выглядит нетронутой и свободной от коррозии. При наличии лишь нескольких небольших пятен ржавчины может показаться, что повреждение очень незначительное.

Схема поперечного сечения точечной коррозии при горизонтальном воздействии зерен сбоку.
Диаграмма поперечного сечения подповерхностной боковой точечной коррозии.
Подрезка поперечного сечения точечной коррозии сбоку.
Как проверить на питтинговую коррозию?
Визуальный осмотр корродированной металлической поверхности является первым и основным используемым методом. Подсчитайте количество ямок через окуляр микроскопа на определенной площади поверхности, например, 20 см 2 , чтобы определить приблизительный размер и распределение ямок. Количество ям не обязательно является самым важным фактором для рассмотрения. Глубина ямы, безусловно, самая большая опасность. Одна узкая глубокая яма может быть более опасной, чем множество мелких ям. Металлографический поперечный разрез для измерения глубины ямок покажет интенсивность атаки.
Акустические испытания — это когда ультразвуковые импульсы звуковой энергии передаются через контактную жидкость на масляной или водной основе на поверхность металла.
 Волны генерируются и отражают эхо, которые преобразуются в электрические сигналы. Эти сигналы можно интерпретировать, чтобы показать расположение ямок, щелей и дефектов в металле. Этот тест обладает хорошей чувствительностью и дает мгновенную информацию о глубине, ширине и расположении ямок и дефектов.
Волны генерируются и отражают эхо, которые преобразуются в электрические сигналы. Эти сигналы можно интерпретировать, чтобы показать расположение ямок, щелей и дефектов в металле. Этот тест обладает хорошей чувствительностью и дает мгновенную информацию о глубине, ширине и расположении ямок и дефектов.Электромагнитные испытания используется для обнаружения дефектов или неровностей в структуре электропроводящих материалов, таких как сталь и железо. Материалы с дефектами будут создавать магнитное поле, отличное от поля эталонного материала без дефектов.
Электрохимические испытания для измерения точечной коррозии в любом металле, такие как циклическая поляризация и потенциостатические испытания, также возможны. Это краткосрочные электрохимические тесты, дающие мгновенные результаты.
Испытание погружением или метод похудения — еще один вариант. Эти тесты требуют больше времени для выполнения. Они включают удаление образца металла и погружение в раствор.
 Через несколько дней его можно снять, чтобы рассчитать скорость коррозии. Вы можете наблюдать за ямками и их глубиной под микроскопом и производить необходимые расчеты.
Через несколько дней его можно снять, чтобы рассчитать скорость коррозии. Вы можете наблюдать за ямками и их глубиной под микроскопом и производить необходимые расчеты.Существует несколько стандартов, которые содержат рекомендации по электрохимическим испытаниям на точечную коррозию нержавеющих сталей, и наиболее популярными из них являются:
- ASTM G61 Испытание на циклическую поляризацию
- ASTM G150 Электрохимическое испытание на температуру точечной коррозии
Как лечить точечную коррозию?
Рекомендуется использовать рекомендуемые процедуры очистки, чтобы полностью обнажить ямки и удалить продукты коррозии. Избегайте использования растворов, которые чрезмерно воздействуют на основной металл. Желательно во время чистки периодически прощупывать ямки остроконечным инструментом. Это позволит вам определить степень любого подреза или подповерхностной коррозии. Энергичная очистка ямы проволочной щеткой значительно расширит отверстия. Удаление продуктов коррозии и подрезов металла поможет вам оценить степень повреждения.

Когда металлический материал будет чистым и свободным от мусора, проведите окончательную проверку повреждений. Если вы довольны тем, что коррозия была обнаружена вовремя, вы можете приступить к нанесению базового грунтовочного покрытия, а затем еще одного или двух верхних слоев. Если повреждение серьезное, а компонент слишком слабый, его необходимо заменить.
Цинк-фосфатное грунтовочное покрытие является одним из наиболее популярных методов покрытия для защиты от точечной коррозии. Специально разработанные грунтовки, такие как фосфат цинка, улучшают коррозионную стойкость.
Металлизация цинковым напылением — это метод, который очень эффективен против коррозии. Он имеет гладкую поверхность, которая эстетически привлекательна и популярна. Он не обеспечивает такую же защиту, как горячее цинкование, но поскольку это холодный процесс, нет риска деформации металла. Металлизация распылением цинка идеально подходит для использования на декоративных металлических предметах, таких как художественные выставки, металлические перила и заборы.

Химическое покрытие использует электростатический или сжатый воздух для нанесения порошка специального состава на стальную поверхность. Затем он плавится, образуя гладкую защитную пленку. Обработанная таким образом сталь не только защищена от коррозии и УФ-повреждений, но и обладает высокой устойчивостью к отслаиванию, царапанью и растрескиванию.
Горячее погружение — это метод покрытия цинком, который можно использовать для стали всех форм и размеров. Он включает погружение стали в ванну с расплавленным цинком при температуре до 450°C. Сталь, оцинкованная таким образом, является особенно популярным подходом для применения в трубах, поскольку она хорошо защищена от коррозии, а также от экстремальных погодных условий.
Как предотвратить и защитить от точечной коррозии?
Факторы окружающей среды, вызывающие точечную коррозию, должны быть по возможности сведены к минимуму. Влажность, температура, содержание хлоридов и кислот pH, а также уровень солей должны контролироваться и сводиться к минимуму.




 Чтобы краска легла ровно и без дефектов, пленка качественно промывается, с нее удаляются все посторонние загрязнения. Потом начинается непосредственное окрашивание. При этом стоит обратить внимание на то, что показатели пористости созданного ранее активного слоя напрямую влияют на то, какой цвет получит покрытие и насколько стойким оно в итоге окажется.
Чтобы краска легла ровно и без дефектов, пленка качественно промывается, с нее удаляются все посторонние загрязнения. Потом начинается непосредственное окрашивание. При этом стоит обратить внимание на то, что показатели пористости созданного ранее активного слоя напрямую влияют на то, какой цвет получит покрытие и насколько стойким оно в итоге окажется. Это позволяет нам быть уверенными в высоком уровне работы и предоставлять официальные гарантии.
Это позволяет нам быть уверенными в высоком уровне работы и предоставлять официальные гарантии. Имеется только один 5s электрон.
Имеется только один 5s электрон. Потеря 2 электронов не меняет полную d-орбиталь. Нейтральный скандий записывается как [Ar]4s 2 3d 1 . Потеря 3 электронов приводит конфигурацию в благородное состояние с валентностью 3p 6 .
Потеря 2 электронов не меняет полную d-орбиталь. Нейтральный скандий записывается как [Ar]4s 2 3d 1 . Потеря 3 электронов приводит конфигурацию в благородное состояние с валентностью 3p 6 . Таким образом, соединения марганца варьируются от Mn(0) в виде Mn (s) , Mn(II) в виде MnO, Mn(II, III) в виде Mn 3 O 4 , Mn(IV) в виде MnO 2 , или диоксид марганца, Mn(VII) в перманганат-ионе MnO 4 – и так далее.
Таким образом, соединения марганца варьируются от Mn(0) в виде Mn (s) , Mn(II) в виде MnO, Mn(II, III) в виде Mn 3 O 4 , Mn(IV) в виде MnO 2 , или диоксид марганца, Mn(VII) в перманганат-ионе MnO 4 – и так далее. В растениях марганец требуется в следовых количествах; более сильные дозы начинают вступать в реакцию с ферментами и подавляют некоторые клеточные функции. Из-за гибкости марганца в принятии многих степеней окисления он становится хорошим примером для описания общих тенденций и концепций, лежащих в основе электронных конфигураций.
В растениях марганец требуется в следовых количествах; более сильные дозы начинают вступать в реакцию с ферментами и подавляют некоторые клеточные функции. Из-за гибкости марганца в принятии многих степеней окисления он становится хорошим примером для описания общих тенденций и концепций, лежащих в основе электронных конфигураций.
 е. щелочные металлы и щелочноземельные металлы)?
е. щелочные металлы и щелочноземельные металлы)?
 Обычно он ограничивается определенными областями. Он быстро проникает и атакует, и его трудно обнаружить. Чаще всего это происходит, когда слой пассивного покрытия физически поврежден или подвергся химическому воздействию. Это создает слабое место, где вода или коррозионные растворы воздействуют на подложку.
Обычно он ограничивается определенными областями. Он быстро проникает и атакует, и его трудно обнаружить. Чаще всего это происходит, когда слой пассивного покрытия физически поврежден или подвергся химическому воздействию. Это создает слабое место, где вода или коррозионные растворы воздействуют на подложку. Окисление происходит в металле даже при отсутствии подачи кислорода.
Окисление происходит в металле даже при отсутствии подачи кислорода. Другими вредными растворами являются те, которые содержат фториды и йодиды. Также известно, что сульфиды и вода усиливают процесс питтинговой коррозии.
Другими вредными растворами являются те, которые содержат фториды и йодиды. Также известно, что сульфиды и вода усиливают процесс питтинговой коррозии. Это приводит к дифференциальной аэрационной коррозии, когда окружающие области являются катодными, а небольшая область под каплями и частицами пыли становится анодной. Электроны проходят через металл и встречают воду и кислород. Ионы образуются и распадаются вместе, образуя ржавчину. По мере образования ржавчины в металле появляются ямки, трещины и щели.
Это приводит к дифференциальной аэрационной коррозии, когда окружающие области являются катодными, а небольшая область под каплями и частицами пыли становится анодной. Электроны проходят через металл и встречают воду и кислород. Ионы образуются и распадаются вместе, образуя ржавчину. По мере образования ржавчины в металле появляются ямки, трещины и щели. Их плоские стенки обнажают кристаллическую структуру металла. Они могут быстро перфорировать толщину материала, например, кровельного листа, фермы или элемента водосточного желоба.
Их плоские стенки обнажают кристаллическую структуру металла. Они могут быстро перфорировать толщину материала, например, кровельного листа, фермы или элемента водосточного желоба.
 Волны генерируются и отражают эхо, которые преобразуются в электрические сигналы. Эти сигналы можно интерпретировать, чтобы показать расположение ямок, щелей и дефектов в металле. Этот тест обладает хорошей чувствительностью и дает мгновенную информацию о глубине, ширине и расположении ямок и дефектов.
Волны генерируются и отражают эхо, которые преобразуются в электрические сигналы. Эти сигналы можно интерпретировать, чтобы показать расположение ямок, щелей и дефектов в металле. Этот тест обладает хорошей чувствительностью и дает мгновенную информацию о глубине, ширине и расположении ямок и дефектов. Через несколько дней его можно снять, чтобы рассчитать скорость коррозии. Вы можете наблюдать за ямками и их глубиной под микроскопом и производить необходимые расчеты.
Через несколько дней его можно снять, чтобы рассчитать скорость коррозии. Вы можете наблюдать за ямками и их глубиной под микроскопом и производить необходимые расчеты.

