Химия 8 класс таблица свойства меди и серы: Сравните физические свойства меди и серы
alexxlab | 23.02.2023 | 0 | Разное
ГДЗ (ответы) Химия 8 класc Рудзитис Г.Е., Фельдман Ф.Г., 2019, §1 Предмет химии. Вещества и их свойства » Крутые решение для вас от GDZ.cool
ГДЗ (ответы) Химия 8 класc Рудзитис Г.Е., Фельдман Ф.Г., 2019, §1 Предмет химии. Вещества и их свойства
Другие задания смотри здесь…
Красным цветом приводится решение, а фиолетовым ― объяснение. |
Задание 1 Что изучает химия?
Химия – наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти превращения.
Каковы её важнейшие задачи?
Изучение веществ, их свойств и прогнозирование использования веществ в промышленности, сельском хозяйстве, медицине, быту, а также получение различных веществ.
Составьте схему, иллюстрирующую значение химии, и обсудите её с соседом по парте.
| ↗ | обеспечивает переработку
полезных ископаемых в ценные продукты: металлы, их сплавы, топливо. |
| ХИМИЯ → | обеспечивает сельское хозяйство минеральными удобрениями
и средствами зашиты растений от вредителей. |
| ↘ | обеспечивает производство строительных материалов, синтетических тканей, пластмасс, красок, моющих средств, медикаментов. |
Задание 2 Чем различаются понятия “вещество” и “тело”?
Тело имеет форму, занимает определённый объём и состоит из вещества.
Приведите примеры.
Медная проволока – медь;
карандаш– графит;
гвоздь – железо;
стакан – стекло;
ручка – пластмасса.
Задание 3 Из следующего перечня выпишите отдельно названия веществ и предметов (физических тел): железо, термометр, медь, капрон, ртуть, напильник, нож, сахар.
Вещества: железо, медь, капрон, ртуть, сахар.
Физические тела: термометр, напильник, нож.
Задание 4 Какими сходными и отличительными свойствами обладают следующие вещества:
а) поваренная соль и сахар;
Сходные свойства: белого цвета, не имеют запаха и растворимые в воде.
Отличительные свойства: вкус (соль ― солёная, сахар ― сладкий).
б) уксус и вода?
Сходные свойства: жидкости прозрачного цвета.
Отличительные свойства: вкус (уксус ― кислый, вода ― без вкуса), запах (уксус – резкий, вода – без запаха).
Задание 5 На основе жизненного опыта и используя дополнительную литературу, сравните физические свойства меди и серы. Ответ оформите в виде таблицы.
| Свойство | Медь | Сера |
| Агрегатное состояние | твердое | твердое |
| Цвет | золотисто-красный | желтый |
| Запах | без запаха | без запаха |
| Плотность | 8.96 г/см³ | 2.07 г/см³ |
| Растворимость в воде | нерастворима | нерастворима |
| Проводит тепло | хорошо | плохо |
| Проводит ток | проводит | не проводит |
| Температура плавления | 1083°C | 113°C |
| Температура кипения | 2567°C | 445°C |
ТЕСТ 1
В каком ряду находятся названия только веществ?
1) медь, медная проволока, стекло, колба;
2) железо, сахар, соль, уксус;
3) вилка, ножницы, фарфоровая ваза, стакан.
Ответ: 2)
ТЕСТ 2
В каком ряду находятся названия только тел?
1) крахмал, белок, соль, песок;
2) подсолнечное масло, железо, очки, ложка;
3) колба, стакан, фужер, стеклянная банка.
Ответ: 3)
Другие задания смотри здесь…
Строение атома серы и схема электронной оболочки
4.6Средняя оценка: 4.6
Всего получено оценок: 255.
4.6
Средняя оценка: 4.6
Всего получено оценок: 255.
Сера (S) – неметалл, относящийся к группе халькогенов. Строение атома серы легко определить, обратившись к периодической таблице Менделеева.
Строение
Сера в периодической таблице находится под 16 номером в третьем периоде, VI группе. Относительная атомная масса элемента – 32.
Рис. 1. Положение в периодической таблице.Природная сера имеет несколько изотопов:
- 32S;
- 33S;
- 34S;
- 36S.
Кроме этого, искусственно получено 20 радиоактивных изотопов.
Сера – элемент р-семейства. Атом серы включает ядро с положительным зарядом +16 (16 протонов, 16 нейронов) и 16 электронов, расположенных на трёх электронных оболочках. На внешнем энергетическом уровне находится 6 электронов, которые определяют валентность элемента. До завершения внешнего р-уровня не хватает двух электронов, что определяет степень окисления серы как -2.
Отрицательную степень окисления сера проявляет в составе солей – Al2S3, SiS2, Na2S. Четвёртая степень окисления проявляется в реакциях с галогенами (SCl4, SBr4, SF4) и при взаимодействии с кислородом (SO2). Наивысшая степень окисления (+6) проявляется с наиболее электроотрицательными элементами – H2SO4, SF6, SO3.
Электронное строение атома серы – 1s2
2s22p63s23p4 или +16 S)2)8)6.Физические свойства
Сера – кристаллическое соединение, которое при нагревании приобретает пластичную форму. Цвет неметалла варьирует от ярко-жёлтого до коричневого. Модификации серы зависят от количества атомов серы в молекуле.
Рис. 3. Сера.Сера – слабый проводник тепла и электрического тока. Не взаимодействует с водой, но хорошо растворяется в органических растворителях – феноле, бензоле, аммиаке, сероуглероде.
В природе сера встречается в виде самородков и в составе руд, минералов, горных пород. Сера находится в сульфидах, сульфатах, каменном угле, нефти, газе. Серу накапливают бактерии, перерабатывающие сероводород.
Химические свойства
Сера – активный элемент, реагирующий при нагревании практически со всеми элементами, кроме инертных газов и N2, I2, Au, Pt.
Взаимодействие | Продукты реакции | Пример |
С металлами | Сульфиды | Cu + S → CuS |
С кислородом при 280°С | Оксид серы | – S + O2 → SO2; – 2S + 3O2 → 2SO3 |
С водородом при нагревании | Сероводород | H2 + S → H2S |
С фосфором при нагревании в отсутствии воздуха | Сульфид фосфора | 2P + 3S → P2S3 |
С фтором | Фторид серы | S + 3F 2 → SF6 |
С углеродом | Сероуглерод | 2S + C → CS2 |
С кислотами | Кислота | S + 2HNO3 → 2NO + H2SO4 |
Со щёлочью | Сульфиды и сульфиты | 3S + 6KOH → K2SO3 + 2K2S + 3H2O |
Сера входит в состав белков. Большое количество серы накапливается в волосах.
Большое количество серы накапливается в волосах.
Что мы узнали?
Сера – кристаллический неметалл жёлтого цвета. Схема строения атома – +16 S)2)8)6. Проявляет три степени окисления: -2, +4, +6. Известно 24 изотопа серы. Это активный элемент, вступающий в реакцию с металлами и неметаллами. Образует соли – сульфиты и сульфиды, а также серную кислоту. Сера нерастворима в воде и соляной кислоте. Входит в состав живых организмов. В природе находится в свободном и связанном виде.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
Александр Котков
5/5
Александр Котков
5/5
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 255.
А какая ваша оценка?
Формула сульфида алюминия – структура, свойства, использование, примеры вопросов
Алюминий имеет символ Al. Его атомный номер 13. Его электронная конфигурация 1s 2 2s 2 2p 6 3s 2 3p 1 . Это легкий серебристо-белый металл, принадлежащий к 13 группе периодической таблицы. Он используется в различных продуктах, включая линии электропередач, бытовую электронику, корабли, компоненты космических кораблей, фольгу, банки, кухонную утварь, пивные кеги и детали самолетов. Основное преимущество алюминия заключается в том, что он является отличным проводником тепла и электричества и по отношению к своему весу почти в два раза лучше, чем медь. Сера с символом S, ее атомный номер 16 и ее электронная конфигурация 1s 2 2s 2 2p 6 3s 2 3p 4 . Это неметаллический химический элемент. Он относится к кислородной группе. Это твердое вещество светло-желтого цвета без запаха и вкуса. Сера необходима всем живым существам. Он используется в батареях, фунгицидах, моющих средствах, удобрениях, порохе, фейерверках и спичках.
Его атомный номер 13. Его электронная конфигурация 1s 2 2s 2 2p 6 3s 2 3p 1 . Это легкий серебристо-белый металл, принадлежащий к 13 группе периодической таблицы. Он используется в различных продуктах, включая линии электропередач, бытовую электронику, корабли, компоненты космических кораблей, фольгу, банки, кухонную утварь, пивные кеги и детали самолетов. Основное преимущество алюминия заключается в том, что он является отличным проводником тепла и электричества и по отношению к своему весу почти в два раза лучше, чем медь. Сера с символом S, ее атомный номер 16 и ее электронная конфигурация 1s 2 2s 2 2p 6 3s 2 3p 4 . Это неметаллический химический элемент. Он относится к кислородной группе. Это твердое вещество светло-желтого цвета без запаха и вкуса. Сера необходима всем живым существам. Он используется в батареях, фунгицидах, моющих средствах, удобрениях, порохе, фейерверках и спичках. Антуан Лавуазье открыл его в 1777 году.
Антуан Лавуазье открыл его в 1777 году.
Формула сульфида алюминия
Сульфид алюминия — это химическое соединение с формулой 9.0029 Ал 2 S 3 . Его также называют трисульфидом диалюминия. Это ионное соединение алюминия и серы. Это серое химическое соединение. Сульфид алюминия представляет собой неорганическое соединение, широко используемое в качестве сырья при производстве газообразного сероводорода.
Структура сульфида алюминия
Получение сульфида алюминия металл
2AL +3 S ⇢ AL 2 S 3
Физические свойства сульфида алюминия
- Алюминиевый моляр.
- Температура кипения 1500°C
- Температура плавления 1100°C
Химические свойства сульфида алюминия0031 AL 2 S 3 + 6H 2 O ⇢ 2AL (OH) 3 + 3 H 2 S Использование Aluminum Sulpid0061 Сульфид алюминия используется при получении сероводорода. Вопрос 1: Почему сульфид алюминия является ионным? Ответ: Алюминий — это металл, а сера — это неметалл, поэтому при их соединении образуется ионное соединение путем переноса электронов от металла к неметаллу. Следовательно, связь ионная. Вопрос 2: Каково использование алюминия? Ответ: Алюминий используется в различных продуктах, включая упаковку, банки, оконные рамы, компьютеры, мобильные телефоны, пленку и детали самолетов. Вопрос 3: Реагирует ли алюминий с азотом? Ответ: Алюминий реагирует с азотом с образованием нитрида алюминия. Алюминий имеет более высокое сродство к кислороду, чем азот, поэтому в присутствии кислорода и азота образуется Al 2 O 3 по отношению к нитриду алюминия. Вопрос 4: Сульфид алюминия является кислотой или основанием? Ответ: Сульфид алюминия кислый. Когда сульфат алюминия вступает в реакцию с водой, образуется гидроксид алюминия и разбавленный раствор серной кислоты, который изменяет кислотность почвы. Вопрос 5: Каковы пищевые источники алюминия? Ответ: Наиболее часто употребляемыми продуктами, содержащими значительное количество алюминийсодержащих пищевых добавок, являются порошки для выпечки, смеси для тортов, плавленые сыры и маринованные овощи. Вопрос 6: Что делает алюминий с вашим телом? Ответ: Небольшое воздействие алюминия обычно не вредно, но воздействие очень высоких концентраций может повлиять на здоровье. Он атакует вашу центральную нервную систему и связан с дегенеративными заболеваниями головного мозга. Вдыхание алюминиевой пыли в больших количествах может привести к легочным заболеваниям. Вопрос 7: Что особенного в Sulphur? Ответ: Сера имеет множество применений. Он используется для производства автомобильных аккумуляторов, очистки нефти и удобрений, а также добычи полезных ископаемых. Чистая сера представляет собой безвкусное, без запаха, хрупкое твердое вещество бледно-желтого цвета, плохо проводит электричество и не растворяется в воде. Сера реагирует со всеми металлами, кроме золота и платины, образуя сульфиды. Сера является многовалентным неметаллом, широко распространена и не имеет запаха. Символ элемента серы S. Сера (S) является критическим элементом, который никогда не следует упускать из виду. Сера (S), также называемая серой, является неметаллическим химическим элементом кислородной группы (группа 16 [VIa] периодической таблицы) и одним из самых реакционноспособных. Это неметалл и получается как побочный продукт добычи природного газа. Образует сульфиды со всеми металлами, кроме золота и платины, а также образует соединения с некоторыми неметаллическими элементами. Ежегодно производятся миллионы тонн серы, прежде всего для производства серной кислоты, которая широко используется в промышленности. Содержание Сера имеет долгую историю, восходящую к древним временам. Он был обнаружен китайцами около 2000 г. до н.э. Сера использовалась в Древней Греции, Египте, Китае и Индии с доисторических времен. В древности сера была известна как Тора, а в Библии она также упоминалась как «сера», что означает «горящая сера». В Египте и Греции сера была известна своей бактерицидной активностью и использовалась для окуривания, а также в лекарствах и мазях. Сера была известна в Китае как Шилин Хуан еще в 6 веке до нашей эры и добывалась из пирита. Доримские цивилизации использовали обожженную серу в качестве лекарства и использовали «кирпичи» серы в качестве фумигантов, отбеливающих средств и благовоний в религиозных обрядах. Китайцы в основном использовали его в черном порохе. В 1777 году Антуан Лавуазье предположил, что сера является отдельным элементом, но элементарная сера была открыта в 1867 году, а ее элементарная природа была установлена французскими химиками Жозефом Гей-Люссаком и Луи Тенаром. Сера широко распространена как на Земле, так и во всей Вселенной. Он занимает десятое место по распространенности среди всех элементов во Вселенной. Сера образуется в массивных звездах и содержится в различных типах метеоритов. Его образование происходит в основном в ходе реакции слияния ядер гелия и ядер кремния. Сера является пятым по распространенности элементом в земной коре по массе. Это распространено в вулканических регионах и жарких и засушливых районах по всему миру. Тихоокеанское огненное кольцо особенно известно своими богатыми запасами серы. Сера также встречается в своем естественном состоянии на Земле, где она образуется в результате метаболической активности анаэробных бактерий, разлагающих сульфатные минералы. Наиболее распространены гипс, пирит, барит и другие минералы серы. Сера в минералах Galena (сульфид свинца, PBS) Сера в настоящее время производится из природного газа, нефти и ископаемых ресурсов. Китай и Канада являются двумя крупнейшими производителями серы. Сера является необходимым компонентом всех живых клеток, а также содержится в белках, ДНК и широком спектре ферментов, обнаруженных в растениях, животных и микробах. Человеческое тело состоит из различных форм и соединений серы, и это восьмой по распространенности элемент по весу. Серная имеет четыре стабильные изотопы: 32 S (95,02%), 33 S (0,75%), 34 S (4,21%), и 363 363, , , , , , , , , , , , , , , , , , , , , 4. Сера имеет много аллотропов, среди которых наиболее важны следующие Моноклинная сера (α-сера) и желтая ромбическая сера (β-сера). Наиболее интригующей особенностью является их термическая стабильность; аллотропы серы взаимопревращаются, т.е. ромбическая сера при нагревании выше 369K дает моноклинную серу. Сера необходима всем живым существам. Он особенно важен для человека, поскольку является компонентом незаменимой аминокислоты метионина в нашем рационе. Сера также содержится в аминокислоте цистеине. В среднем человек потребляет около 900 мг серы в день, в основном в виде белка. Хотя элементарная сера не токсична, многие простые производные серы, такие как диоксид серы (SO2) и сероводород, являются токсичными. Сера обычно встречается в природе в виде сульфидов. Несколько процессов добавляют серные связи в окружающую среду, которые вредны как для животных, так и для людей. Эти вредные связи серы также образуются в природе в ходе различных реакций, особенно когда уже присутствуют вещества, не присутствующие в природе. Серосодержащие вещества в окружающей среде могут иметь следующие последствия для здоровья человека: Toxicity classification by WHMIS 1988 Обзор аварийных ситуаций: Содержит газ под давлением, который при нагревании может взорваться, но не загорится. ТОКСИЧЕН НА ВСЕХ УРОВНЯХ. При вдыхании смертельно. При вдыхании ОЧЕНЬ ТОКСИЧЕН, может привести к смерти. Попадание на кожу: КОРРОЗИОННОЕ . Газ вызывает раздражение кожи или ожоги. Рубцевание может быть постоянным. Прямой контакт со сжиженным газом может вызвать охлаждение или замерзание кожи (обморожение). Онемение, покалывание и покалывание — все это симптомы легкого обморожения. Кожа может приобрести восковидный белый или желтый оттенок. В тяжелых случаях могут возникнуть волдыри, отмирание тканей и инфекция. ЕДКИЙ контакт с глазами : Газ вызывает раздражение или ожоги глаз. Долгосрочные эффекты (хронические) Воздействие: Может вызывать респираторные заболевания. Он может вызвать раздражение и воспаление дыхательных путей. Для получения более подробной информации, касающейся информации о безопасности серы, https://www.teck.com/media/Sulphur.pdf Для немедленной помощи: Центры по контролю и профилактике заболеваний Горячая линия общественного реагирования (1 -888-246-2675) Агентство регистрации токсичных веществ и заболеваний (1-888-422-8737) Региональный токсикологический центр (1-800-222-1222) Примечание.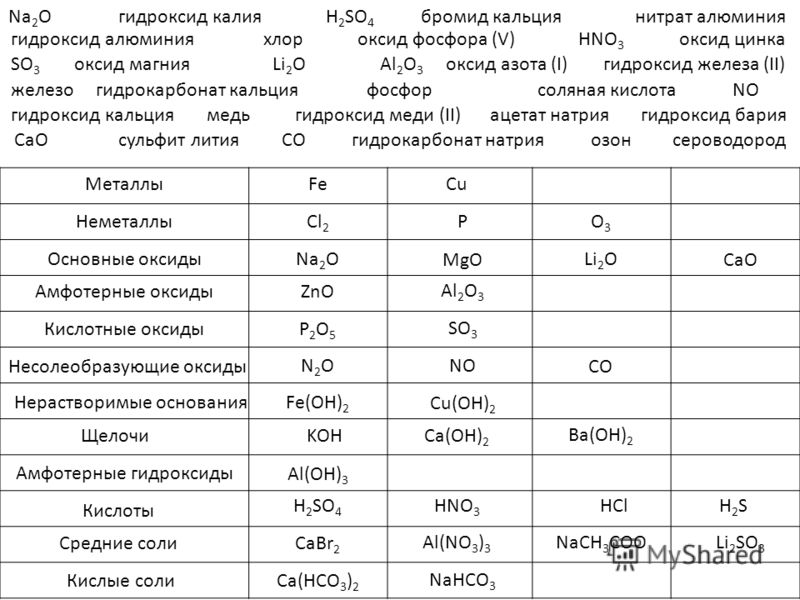
Примеры вопросов
 Алюминий также является отличным проводником электричества и намного дешевле, чем его аналог, медь. Поэтому он используется в электрических проводах и других подобных линиях электропередач.
Алюминий также является отличным проводником электричества и намного дешевле, чем его аналог, медь. Поэтому он используется в электрических проводах и других подобных линиях электропередач.
Элемент серы – история, свойства, использование, реакции, безопасность
 Чистая сера представляет собой безвкусное, без запаха, хрупкое бледно-желтое твердое вещество, плохо проводящее электричество и нерастворимое в воде. Его можно найти в природе в виде чистого элемента или в виде сульфидных и сульфатных минералов. Хотя сера печально известна своим запахом, который сравнивают с запахом тухлых яиц, этот запах характерен для сероводорода (H 2 S).
Чистая сера представляет собой безвкусное, без запаха, хрупкое бледно-желтое твердое вещество, плохо проводящее электричество и нерастворимое в воде. Его можно найти в природе в виде чистого элемента или в виде сульфидных и сульфатных минералов. Хотя сера печально известна своим запахом, который сравнивают с запахом тухлых яиц, этот запах характерен для сероводорода (H 2 S).

Blende (Zinc Sulfide, ZNS)
Pyrite (железо диульфид, FES 2 )
46. 34646.34646.34646.346.3464646.34646.34646.3464646.3464646.3464646.3464646.3464646.34646.34646.346.346.3464646. 2 )
34646.34646.34646.346.3464646.34646.34646.3464646.3464646.3464646.3464646.3464646.34646.34646.346.346.3464646. 2 )
гипс (дигидрат сульфата кальция, CaSO 4 ∙2H 2 O)
барит (сульфат бария, BaSO 4 ). (0,02%).
(0,02%).
Физические свойства SURLFUR Electronic Configuration [Ne] 3s²3p 4 Atomic Number 16 Atomic Weight 32.067 Group, Period, и Блок 16, 3, p-блок Атомный радиус 180 пм (Ван-дер-Ваальс) Ковалентный радиус 105 вечера ЭЛЕКТРОНЕГАТИВНОСТЬ 2,58 (Шкала Полингинга)
Химические свойства серы  Одним из наиболее распространенных типов молекул, связанных с серой, является октасера.
Одним из наиболее распространенных типов молекул, связанных с серой, является октасера.
Reactions of Sulfur 
Chemical Reactions Description S (s) + H 2 SO 4 (л) → 3 SO 2 (г) + 2 H 2 O (л) Сера не реагирует с разбавленными неокисляющими кислотами при нормальных условиях. 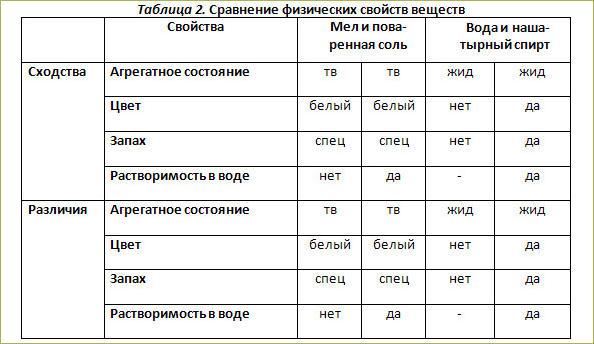
Сера реагирует с горячей концентрированной серной кислотой с образованием SO 2 .
S 2 2− (aq) + 2 H + (aq) → H 2 S (g) + S (s) Disulfide ions react with acid- образуя сероводород и свободную серу 9033 12 KOH (водн.) 4 K 2 S (водн.) + 2 K 2 S 2 O 3 (водн.) + 6 H 2 O (л) гидроксид, КОН, образующий сульфид и тиосульфат калия C (т) + 2S (т) → CS 2 (г) Углерод реагирует с серой при высоких температурах в отсутствие кислорода с образованием сероуглерода 2 S (г) Сера реагирует с водородом с образованием сероводорода Cd (г) + S 8 (г) → CdS (г)
Cd (т) + S 9003 s) → CdS(s) [желтый] В газообразной форме, Cd и S 8 реагирует с образованием CdS.  При 130-180 °C твердые Cd и S 8 реагируют со взрывом, также образуя CdS
При 130-180 °C твердые Cd и S 8 реагируют со взрывом, также образуя CdS S (т) + 3 F 2 (г) → SF 6 (т) 44
4 с избытком фтора образуя фторид серы(VI)
Использование и применение серы
Воздействие серы на здоровье 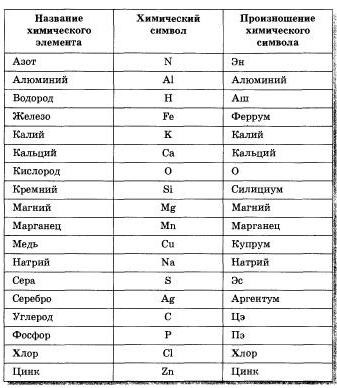 Часто используется в сочетании с салициловой кислотой. Тем не менее, существует ограниченное количество доказательств в поддержку такого использования.
Часто используется в сочетании с салициловой кислотой. Тем не менее, существует ограниченное количество доказательств в поддержку такого использования. Серная пыль (порошковая сера) является распространенным пестицидом в органическом сельском хозяйстве.
Серная пыль (порошковая сера) является распространенным пестицидом в органическом сельском хозяйстве.
Воздействие серы на окружающую среду
Toxicity, Safety, and Precautions related to Sulfur 
 Это может вызвать сильное раздражение носа и горла. В высоких концентрациях он может вызвать потенциально смертельное накопление жидкости в легких ( отек легких ). Кашель, одышка, затрудненное дыхание и стеснение в груди — вот некоторые из симптомов. Однократное воздействие высокой концентрации может привести к длительному состоянию, такому как астма. Многие вещи, такие как другие химические вещества или низкие температуры, могут легко вызвать раздражение дыхательных путей, если это произойдет.
Это может вызвать сильное раздражение носа и горла. В высоких концентрациях он может вызвать потенциально смертельное накопление жидкости в легких ( отек легких ). Кашель, одышка, затрудненное дыхание и стеснение в груди — вот некоторые из симптомов. Однократное воздействие высокой концентрации может привести к длительному состоянию, такому как астма. Многие вещи, такие как другие химические вещества или низкие температуры, могут легко вызвать раздражение дыхательных путей, если это произойдет. Возможны необратимые повреждения, включая слепоту. Прямой контакт со сжиженным газом может вызвать замерзание глаза. Это может привести к слепоте или необратимому повреждению глаз.
Возможны необратимые повреждения, включая слепоту. Прямой контакт со сжиженным газом может вызвать замерзание глаза. Это может привести к слепоте или необратимому повреждению глаз.
Меры предосторожности  Снимите одежду и украшения, которые могут мешать кровообращению. Снимите оставшуюся часть одежды после того, как осторожно обрежете одежду, которая прилипает к коже. Неплотно накройте пораженный участок стерильной повязкой. НЕ РАЗРЕШАЙТЕ ПОСТРАДАВШЕМУ ПИТЬ ИЛИ КУРИТЬ . Немедленно позвоните в токсикологический центр или врачу.
Снимите одежду и украшения, которые могут мешать кровообращению. Снимите оставшуюся часть одежды после того, как осторожно обрежете одежду, которая прилипает к коже. Неплотно накройте пораженный участок стерильной повязкой. НЕ РАЗРЕШАЙТЕ ПОСТРАДАВШЕМУ ПИТЬ ИЛИ КУРИТЬ . Немедленно позвоните в токсикологический центр или врачу. Держите цилиндр в вертикальном положении. Оберегайте баллоны от повреждений. Для перемещения баллонов используйте подходящую ручную тележку; не перетаскивайте, не катите, не скользите и не роняйте. Когда контейнеры не используются или пусты, держите контейнеры плотно закрытыми. Используйте инструменты и оборудование, устойчивые к коррозии.
Держите цилиндр в вертикальном положении. Оберегайте баллоны от повреждений. Для перемещения баллонов используйте подходящую ручную тележку; не перетаскивайте, не катите, не скользите и не роняйте. Когда контейнеры не используются или пусты, держите контейнеры плотно закрытыми. Используйте инструменты и оборудование, устойчивые к коррозии.

