Химия цвет меди: Химия. Цвета некоторых неорганических соединений.
alexxlab | 07.11.1987 | 0 | Разное
Медь. Химия меди и ее соединений — КиберПедия
Медь. Химия меди и ее соединений
Медь
1. Положение меди в периодической системе химических элементов
2. Электронное строение меди
3. Физические свойства
4. Нахождение в природе
5. Способы получения
6. Качественные реакции
7. Химические свойства
Оксид меди (II)
· Способы получения
· Химические свойства
Оксид меди (I)
· Химические свойства
Гидроксид меди (II)
· Химические свойства
Соли меди
Медь
Положение в периодической системе химических элементов
Медь расположена в 1В группе (или в побочной подгруппе I группы в короткопериодной ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение меди
Электронная конфигурация меди в основном состоянии
+29Cu 1s22s22p63s23p63d104s1 1s 2s 2p
3s 3p 4s 3d
У атома меди уже в основном энергетическом состоянии происходит провал (проскок) электрона с 4s-подуровня на 3d-подуровень.
Физические свойства
Медь – твердый металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Медь относительно легко поддается механической обработке. В природе встречается в том числе в чистом виде и широко применяется в различных отраслях науки, техники и производства.
Температура плавления 1083,4оС, температура кипения 2567оС, плотность меди 8,92 г/см3.
Нахождение в природе
Медь
встречается в земной коре (0,0047-0,0055 масс.%), в речной и морской воде. В природе медь встречается как в соединениях, так и в самородном виде. В промышленности используют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Также распространены и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2(OH)2CO3. Иногда медь встречается в самородном виде, масса которых может достигать 400 тонн.
Иногда медь встречается в самородном виде, масса которых может достигать 400 тонн.
Способы получения меди
Медь получают из медных руд и минералов. Основные методы получения меди — электролиз, пирометаллургический и гидрометаллургический.
· Гидрометаллургический метод: растворение медных минералов в разбавленных растворах серной кислоты, с последующим вытеснением металлическим железом.
Например, вытеснение меди из сульфата железом:
CuSO4 + Fe = Cu + FeSO4
· Пирометаллургический метод: получение меди из сульфидных руд. Это сложный процесс, который включает большое количество реакций. Основные стадии процесса:
1) Обжиг сульфидов:
2CuS + 3O2 = 2CuO + 2SO2
2) восстановление меди из оксида, например, водородом:
CuO + H2 = Cu + H2O
· Электролиз растворов солей меди:
2CuSO4 + 2H2O → 2Cu + O2 + 2H2SO4
Качественные реакции на ионы меди (II)
Качественная реакция на ионы меди +2 – взаимодействие солей меди (II) с щелочами. При этом образуется голубой осадок гидроксида меди(II).
При этом образуется голубой осадок гидроксида меди(II).
Например, сульфат меди (II) взаимодействует с гидроксидом натрия:
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
Соли меди (II) окрашивают пламя в зеленый цвет.
Химические свойства меди
В соединениях медь может проявлять степени окисления +1 и +2.
1. Медь — химически малоактивный металл. При нагревании медь может реагировать с некоторыми неметаллами: кислородом, серой, галогенами.
1.1. При нагревании медь реагирует с достаточно сильными окислителями, например, с кислородом, образуя CuО, Cu2О в зависимости от условий:
4Cu + О2 → 2Cu2О
2Cu + О2 → 2CuО
1. 2. Медь реагирует с серой с образованием сульфида меди (II):
2. Медь реагирует с серой с образованием сульфида меди (II):
Cu + S → CuS
1.3. Медь взаимодействует с галогенами. При этом образуются галогениды меди (II):
Cu + Cl2 = CuCl2
С u + Br2 = CuBr2
1.4. С азотом, углеродом и кремнием медь
не реагирует:Cu + N2 ≠
Cu + C ≠
Cu + Si ≠
1.5. Медь не взаимодействует с водородом.
Cu + H2 ≠
1.6. Медь взаимодействует с кислородом с образованием оксида:
2Cu + O2 → 2CuO
2. Медь взаимодействует и со сложными веществами:
Медь взаимодействует и со сложными веществами:
2.1. Медь в сухом воздухе и при комнатной температуре не окисляется, но во влажном воздухе, в присутствии оксида углерода (IV) покрывается зеленым налетом карбоната гидроксомеди (II):
2Cu + H2O + CO2
2.2. В ряду напряжений медь находится правее водорода и поэтому не может вытеснить водород из растворов минеральных кислот (разбавленной серной кислоты и др.).
Например, медь не реагирует с разбавленной серной кислотой:
Cu + H2SO4 (разб.) ≠
2.3. При этом медь реагирует при нагревании с концентрированной серной кислотой. При нагревании реакция идет, образуются оксид серы (IV), сульфат меди (II) и вода:
При нагревании реакция идет, образуются оксид серы (IV), сульфат меди (II) и вода:
Cu + 2H2SO4(конц.)
→ CuSO4 + SO2 + 2H2O
2.4. Медь реагирует даже при обычных условиях с азотной кислотой.
С концентрированной азотной кислотой:
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
С разбавленной азотной кислотой:
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 4H2O
Реакция меди с азотной кислотой
2. 5. Растворы щелочей на медь практически не действуют.
5. Растворы щелочей на медь практически не действуют.
2.6. Медь вытесняет металлы, стоящие правее в ряду напряжений, из растворов их солей.
Например, медь реагирует с нитратом ртути (II) с образованием нитрата меди (II) и ртути:
Hg(NO3)2 + Cu = Cu(NO3)2 + Hg
2.7. Медь окисляется оксидом азота (IV) и солями железа (III)
2Cu + NO2 = Cu2O + NO
2FeCl3 + Cu = 2FeCl2 + CuCl2
Оксид меди (II)
Оксид меди (II) CuO – твердое кристаллическое вещество черного цвета.
Оксид меди (I)
Оксид меди (I) Cu2O – твердое кристаллическое вещество коричнево-красного цвета.
Гидроксид меди (II)
Химические свойства
Гидроксид меди (II) Сu(OН)2 проявляет слабо выраженные амфотерные свойства (с преобладанием основных).
1. Взаимодействует с кислотами.
Например, взаимодействует с бромоводородной кислотой с образованием бромида меди (II) и воды:
Сu(OН)2 + 2HBr = CuBr2 + 2H2O
Cu(OН)2 + 2HCl = CuCl2 + 2H2O
2. Гидроксид меди (II) легко взаимодействует с раствором аммиака, образуя сине-фиолетовое комплексное соединение:
С u(OH)2 + 4(NH3 · H2O) = [Cu(NH3)4](OH)2 + 4H2O
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
3. При взаимодействии гидроксида меди (II) с концентрированными (более 40%) растворами щелочей образуется комплексное соединение:
При взаимодействии гидроксида меди (II) с концентрированными (более 40%) растворами щелочей образуется комплексное соединение:
Cu(OH)2 + 2NaOH(конц.) = Na2[Cu(OH)4]
4. При нагревании гидроксид меди (II) разлагается:
Сu(OH)2 → CuO + H2O
Соли меди
Соли меди (I)
В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность. Как восстановители они реагируют с окислителями.
Например, хлорид меди (I) окисляется концентрированной азотной кислотой:
CuCl + 3HNO3(конц.) = Cu(NO3)2 + HCl + NO2 + H2O
Также хлорид меди (I) реагирует с хлором:
2CuCl + Cl2 = 2CuCl2
Хлорид меди (I) окисляется кислородом в присутствии соляной кислоты:
4CuCl + O2 + 4HCl = 4CuCl2 + 2H2O
Прочие галогениды меди (I) также легко окисляются другими сильными окислителями:
2CuI + 4H2SO4 + 2MnO2 = 2CuSO4 + 2MnSO4 + I2 + 4H2O
Иодид меди (I) реагирует с концентрированной серной кислотой:
4CuI + 5H2SO4(конц. гор.) = 4CuSO4 + I2 + H2S + 4H2O
гор.) = 4CuSO4 + I2 + H2S + 4H2O
Сульфид меди (I) реагирует с азотной кислотой. При этом образуются различные продукты окисления серы на холоде и при нагревании:
Cu2S + 8HNO3(конц.хол.) = 2Cu(NO3)2 + S + 4NO2 + 4H2O
Cu2S + 12HNO3(конц.гор.) = Cu(NO3)2 + CuSO4 + 10NO2 + 6H2O
Для соединений меди (I) возможна реакция диспропорционирования:
2CuCl = Cu + CuCl2
Комплексные соединения типа [Cu(NH3)2]+ получают растворением в концентрированном растворе аммиака:
CuCl + 3NH3 + H2O → [Cu(NH3)2]OH + NH4Cl
Соли меди (II)
В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства.
Например, соли меди (II) окисляют иодиды и сульфиты:
2CuCl2 + 4KI = 2CuI + I2 + 4HCl
2CuCl2 + Na2SO3 + 2NaOH = 2CuCl + Na2SO4 + 2NaCl + H2O
Бромиды и иодиды меди (II) можно окислить перманганатом калия:
5CuBr2 + 2KMnO4 + 8H2SO4 = 5CuSO4 + K2SO4 + 2MnSO4 + 5Br2 + 8H2O
Соли меди (II) также окисляют сульфиты:
2CuSO4 + Na2SO3 + 2H2O = Cu2O + Na2SO4 + 2H2SO4
Более активные металлы вытесняют медь из солей.
Например, сульфат меди (II) реагирует с железом:
CuSO4 + Fe = FeSO4 + Cu
Cu(NO3)2 + Fe = Fe(NO3)2 + Cu
Сульфид меди (II) можно окислить концентрированной азотной кислотой. При нагревании возможно образование сульфата меди (II):
CuS + 8HNO3(конц.гор.) = CuSO4 + 8NO2 + 4H2O
Еще одна форма этой реакции:
CuS + 10HNO3(конц.) = Cu(NO3)2 + H2SO4 + 8NO2↑ + 4H2O
При горении сульфида меди (II) образуется оксид меди (II) и диоксид серы:
2CuS + 3O2 2CuO + 2SO2↑
Соли меди (II) вступают в обменные реакции, как и все соли.
Например, растворимые соли меди (II) реагируют с сульфидами:
CuBr2 + Na2S = CuS↓ + 2NaBr
При взаимодействии солей меди (II) с щелочами образуется голубой осадок гидроксида меди (II):
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Электролиз раствора нитрата меди (II):
2Cu(NO3)2 + 2Н2О → 2Cu + O2 + 4HNO3
Некоторые соли меди при нагревании разлагаются, например, нитрат меди (II):
2Cu(NO3)2 → 2CuO + 4NO2 + O2
Основный карбонат меди разлагается на оксид меди (II), углекислый газ и воду:
(CuOH)2CO3 → 2CuO + CO2 + H2O
При взаимодействии солей меди (II) с избытком аммиака образуются аммиачные комплексы:
CuCl2 + 4NH3 = [Cu(NH3)4]Cl2
При смешивании растворов солей меди (II) и карбонатов происходит гидролиз и по катиону слабого основания, и по аниону слабой кислоты:
2CuSO4 + 2Na2CO3 + H2O = (CuOH)2CO3↓ + 2Na2SO4 + CO2
Медь. Химия меди и ее соединений
Химия меди и ее соединений
Медь
1. Положение меди в периодической системе химических элементов
2. Электронное строение меди
3. Физические свойства
4. Нахождение в природе
5. Способы получения
6. Качественные реакции
7. Химические свойства
Оксид меди (II)
· Способы получения
· Химические свойства
Оксид меди (I)
· Химические свойства
Гидроксид меди (II)
· Химические свойства
Соли меди
Медь
МЕДЬ И ЕЕ ТАЙНА (ИССЛЕДОВАНИЕ ВЗАИМОДЕЙСТВИЯ СЕРНОЙ КИСЛОТЫ С МЕДЬЮ)
- Авторы
- Руководители
- Файлы работы
- Наградные документы
Мосейчук Е.В. 1Безруких А.И. 1
1МАОУ Гимназия № 4
Неверова Е.А. 1
1МАОУ Гимназия № 4
Диплом школьникаСвидетельство руководителя
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке “Файлы работы” в формате PDF
Cu + 2 H2SO4 = CuSO4 + 2H2O + SO2
Но после прекращения нагревания в пробирке отчетливо наблюдается образование осадка черного цвета, хотя ни один из продуктов, представленных в уравнении, не имеет черную окраску. После оседания частичек твердой фазы раствор остался бесцветным, не приобрел голубую окраску, характерную для гидратированных ионов меди Cu 2+.
В результате сопоставления видимых результатов химической реакции не согласующихся с уравнением, представленными в учебнике, возникло противоречие
Цель: доказать опытным путем качественный состав продуктов реакции концентрированной серной кислоты с медью и разрешить возникшее противоречие.
|
Продукт |
Качественные реакции, подтверждающие его состав |
|
SO2 |
5SO2 + 2KMnO4 + 3H2SO4 = 5SO3 + K2SO4 + 2MnSO4 + 3 H2O 3SO2 + 2 KMnO4 + H2O = 3SO3 + 2MnO2 + 2KOH SO2 + 2KMnO4 + 2KOH = SO3 + 2K2MnO4 + H2O Вывод: Выделяется оксид серы (IV) |
|
CuSO4 |
CuSO4 = Cu2+ + SO4 2- CuSO4 + BaCl2 = BaSO4 + CuCl2 Вывод: При добавлении воды появляется голубая окраска, характерная для гидратированных ионов меди(II), с солями бария выпадает осадок белого цвета |
|
Если: Осадок CuO или Cu2O Осадок CuS |
CuO + H2SO4 = CuSO4 + H2O
Вывод: Осадок должен был раствориться в кислоте, с образованием соли и воды, но он не растворился в 1 опыте. CuS + 8HNO3 (конц.) = CuSO4 + 8 NO2 + 4H2O Вывод: Осадок растворился с выделением бурого газа, раствор стал голубым |
Таким образом, мы доказали, что протекают по меньшей мере две реакции: основная (1) и побочные (2,3), в ходе которых образуется сульфид меди (II) или (I) , сведения о параллельных реакциях практически отсутствуют в учебниках и большинстве пособий.
Cu + 2H2SO4 = CuSO4 + 2H2O + SO2 (1)
4 Cu + 4 H2SO4 = 3 CuSO4 + 4 H2O + CuS (2)
5 Cu + 4 H2SO4 = 3 CuSO4 + 4 H2O + Cu2S(3)
Список литературы:
1. Лидин Р.А., Молочко В.А., Андреева Л.Л. Химические свойства неорганических веществ.- М.: Химия, 2000.-С.286
Лидин Р.А., Молочко В.А., Андреева Л.Л. Химические свойства неорганических веществ.- М.: Химия, 2000.-С.286
2. О.С.Габриелян. Химия: учебник для 9 класса общеобразовательных учреждений- Москва: Дрофа, 2010.- С. 138
3. Реми Г. Курс неорганической химии. Т.2. –М,: Мир, 1966. – С.400
ВВЕДЕНИЕ
Ни одна наука
не нуждается в эксперименте
в такой степени, как химия.
Майкл Фарадей
Каждую секунду в окружающем нас мире происходит неисчислимое множество химических реакции, одни из которых с предсказуемым результатом, другие нет.
При изучении темы «Серная кислота и ее свойства» мы наблюдали демонстрационный опыт взаимодействия концентрированной серной кислоты с пассивными металлами – медью. В процессе нагревания реакционной смеси происходило выделение газообразного продукта и растворение металла меди. Данный процесс [1], [2], [3] отражает химическое уравнение:
В процессе нагревания реакционной смеси происходило выделение газообразного продукта и растворение металла меди. Данный процесс [1], [2], [3] отражает химическое уравнение:
Cu + 2 H2SO4 = CuSO4 + 2H2O + SO2
Но после прекращения нагревания в пробирке отчетливо наблюдается образование осадка черного цвета, хотя ни один из продуктов, представленных в уравнении, не имеет черную окраску. После оседания частичек твердой фазы раствор остался бесцветным; не приобрел голубую окраску, характерную для гидратированных ионов меди Cu 2+.
В результате сопоставления видимых результатов химической реакции не согласующихся с уравнением, представленным в учебнике, возникли противоречия:
1. Почему полученная соль сульфат меди (II) не имеет голубой окраски?
2. Какой осадок выделяется при данной реакции?
Какой осадок выделяется при данной реакции?
Мы обратились к интернет ресурсам [1] и учебным пособиям [2], [3], [4], [5], [6], в которых рассматриваются свойства концентрированной серной кислоты; в большинстве случаев продуктами взаимодействия являются соль, газ и вода, согласно уравнению, представленному выше, но в пособии [4] рассматривается три различных варианта взаимодействия меди с серной кислотой, с учетом температуры кислоты:
Cu + H2SO4 ( конц., хол.) = CuO + SO2 + H2O
Cu + 2H2SO4 (конц., гор.) = СuSO4 + SO2 +2H2O
2Cu + 2H2SO4 (безводн.) = Cu2SO4 + 2H2O + SO2 ( 200 0 C)
А в [5] обращается внимание на возможность многостадийности взаимодействия меди с горячей концентрированной серной кислотой и образование оксида меди (II) на первом этапе:
Cu + H2SO4 = CuO + SO2 + H2O
CuO + H2SO4 = CuSO4 + H2O
В пособии по неорганической химии [2] , рассматривается данный процесс, с возможностью образования в продуктах реакции анилита Cu7S4
ОСНОВНАЯ ЧАСТЬ
Цель: доказать опытным путем качественный состав продуктов реакции концентрированной серной кислоты с медью и разрешить возникшее противоречие между видимыми результатами опыта и описанным уравнением данной реакции.
Задачи:
-
Проанализировать и подобрать методику по определению качественного состава основных продуктов химической реакции
-
Составить алгоритм проведения качественных реакций, подтверждающий состав продуктов реакции
-
Провести химический анализ
-
Сделать выводы, подтверждающие или опровергающие предположения.
Методы:
-
исследовательский метод, позволяющий прогнозировать результат, составлять алгоритм научного исследования и сформировать опыт выполнения исследования.
-
метод химического эксперимента, в ходе которого совершенствуется техника проведения эксперимента, поиск различных способов выполнения эксперимента, сравнение и сопоставление результатов.

Помещаем в пробирку медную проволоку, с которой удалена изоляция, затем приливаем концентрированную серную кислоту. Замечаем, что без нагревания никаких изменений не наблюдается. При нагревании отчетливо видно, как начинается выделяться газ и образуется осадок черного цвета. Выделяющийся газ имеет резкий запах. Попытка поджечь его у отверстия газоотводной трубки не приводит к успеху. Происходящий процесс описывается уравнением:
Cu + 2H2SO4 = CuSO4 + 2H2O + SO2
Гипотеза: выделяется оксид серы (IV) (сернистый газ) – негорючий бесцветный газ с резким запахом. Для доказательства используем реакцию с сильным окислителем – перманганатом калия.
Газоотводную трубку опускаем в стаканчик с раствором перманганата калия (подкисленный), наблюдаем, что окраска раствора исчезла, раствор стал бесцветным. Продолжим пропускание выделяющегося газа через раствор KMnO4 (нейтральный и щелочной раствор), наблюдаем, что в стаканчике с нейтральной средой раствор окрасился в бурый цвет, т.к. выпал осадок MnO2 а в стаканчике с щелочной средой раствор окрасился в зеленый цвет, т.к. образовались манганат – ионы MnO4 2- . К отверстию газоотводной трубки поднесем влажную синюю лакмусовую бумажку, она окрасилась в розовый цвет.
5SO2 + 2KMnO4 + 3H2SO4 = 5SO3 + K2SO4 + 2MnSO4 + 3 H2O
3SO2 + 2 KMnO4 + H2O = 3SO3 + 2MnO2 + 2KOH
SO2 + 2KMnO4 + 2KOH = SO3 + 2K2MnO4 + H2O
Вывод: химические свойства исследуемого вещества свидетельствуют о том, что выделяется сернистый газ.
Гипотеза: В процессе реакции выделяется сульфат меди (II), но его водный раствор должен быть голубого цвета; возможно воду поглощает концентрированная серная кислота.
Для проверки выдвинутого предположения помещаем в пробирку тонко измельченный медный купорос CuSO4*5H2O голубого цвета, приливаем концентрированную серную кислоту и осторожно перемешиваем стеклянной палочкой. Через некоторое время раствор становится бесцветным, голубая окраска осадка исчезает.
Вывод: Воду прочно связывает концентрированная серная кислота.
Гипотеза: Осадок черного цвета может быть оксидом меди (II).
Это вещество нам известно, мы его получали разложением малахита в 8 и 9 классе, растворяя в разбавленной серной кислоте, получали кристаллы медного купороса.
Для проверки выдвинутого предположения в пробирку наливаем 1-2 мл концентрированной серной кислоты и добавляем очень небольшими порциями тонкий порошок оксида меди (II) черного цвета так, чтобы частички твердой фазы находились во взвешенном состоянии. При нагревании заметно, как CuO растворяется, черный цвет исчезает. Постепенно из раствора выделяются кристаллики светло-серого цвета. Берем пробирку, в которой шло взаимодействие серной кислоты с оксидом меди (II), чтобы отделить осадок от раствора. Для этого сливаем избыток серной кислоты, как можно полнее. К осадку прибавляем несколько капель воды и наблюдаем появление голубой окраски.
Вывод: полученный в ходе реакции осадок должен был раствориться при нагревании в избытке концентрированной кислоты. Значит, данный осадок не является оксидом меди (II), а другое вещество.
Гипотеза: Вещество черного цвета содержит медь и, возможно, серу, как вариант сульфид меди (II) CuS.
Осадок, полученный в опыте 1, фильтруем, тщательно промываем водой до полного отсутствия сульфат – ионов. Пробуем растворить его в соляной и азотной кислотах. Наблюдаем, что осадок растворяется только при нагревании в концентрированной азотной кислоте, при этом раствор приобретает синюю окраску, характерную для гидратированных ионов меди. При разбавлении синяя окраска переходит в голубую. В процессе реакций выделяется бурый газ – оксид азота (IV), следовательно, в состав исследуемых веществ входит восстановитель, в роли которого могут выступать ионы S 2- и Cu 2+
CuS + 8HNO3 (конц.) = CuSO4 + 8 NO2 + 4H2O Вывод: Чтобы окончательно подтвердить гипотезу о том, что при взаимодействии меди с концентрированной серной кислотой образуется сульфид меди (II), мы исследовали продукт окисления осадка. Если осадок представляет собой сульфид меди (II), то при его окислении азотной кислотой в полученном растворе должен обнаружиться сульфат – ион. При добавлении в исследуемую смесь раствора хлорида бария наблюдается выпадение осадка белого цвета, который не растворяется при подкислении.
Если осадок представляет собой сульфид меди (II), то при его окислении азотной кислотой в полученном растворе должен обнаружиться сульфат – ион. При добавлении в исследуемую смесь раствора хлорида бария наблюдается выпадение осадка белого цвета, который не растворяется при подкислении.
CuSO4 + BaCl2 = BaSO4 + CuCl2
ЗАКЛЮЧЕНИЕ
Таким образом, мы доказали, что при взаимодействии концентрированной серной кислоты с медью протекают по меньшей мере две реакции: основная (1), в результате которой образуются как в большинстве реакций, связанных с концентрированными кислотами – соль, сульфат меди (II), газ – оксид серы (IV) и вода; и побочная (2), входе которой образуется сульфид меди (II), соль и вода. Сведения о параллельной реакции практически отсутствуют в учебниках и большинстве пособий.
Cu + 2H2SO4 = CuSO4 + 2H2O + SO2 (1)
4 Cu + 4 H2SO4 = 3 CuSO4 + 4 H2O + CuS (2)
5 Cu + 4 H2SO4 = 3 CuSO4 + 4 H2O + Cu2S (3)
Полученное вещество, сульфид меди, можно использовать на уроках химии для реакций, проводимых при изучении темы: «Сульфиды»
СПИСОК ЛИТЕРАТУРЫ
1. http://www.schoolchemistry.ru/katalog/sernayakislota.htm
http://www.schoolchemistry.ru/katalog/sernayakislota.htm
2. . Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии. Современный курс для поступающих в вузы. –М.: издательство Экзамен; 2010.-С.374
3 Лидин Р.А., Молочко В.А., Андреева Л.Л. Химические свойства неорганических веществ.- М.: Химия, 2000.-С.286
4. О.С.Габриелян. Химия: учебник для 9 класса общеобразовательных учреждений- Москва: Дрофа, 2010
5.- С. 138Реми Г. Курс неорганической химии. Т.2. –М,: Мир, 1966. – С.
6. 400Химия . Пособие-репетитор для поступающих в вузы. Под ред. Егорова А.С. 5-е изд. – Ростов н/Д.: 2003. – 768с.
Просмотров работы: 6064
Как отличить медь от латуни, бронзы, алюминия
Главная » Металлы и сплавы » Медь
Просмотров 1.1к. Опубликовано Обновлено
Содержание
- 1 Основные свойства и параметры меди
- 2 Отличия меди от латуни
- 3 Отличия меди от бронзы
- 4 Отличия меди от алюминия
Медь, как металл обладает выраженной пластичностью. Цвет меди имеет золотисто розовый оттенок с присутствием характерного металлического блеска. В качестве элемента периодической системы он имеет обозначение Cu. Название происходит от латинского Cuprum, что связано с именем острова Кипр. Имеются научные доказательства того, что в древние времена именно там находились рудники, где добывали, а затем выплавляли этот металл.
Древняя культура связана с изготовлением из нее украшений, посуды, иных предметов обихода. Но главным достижением древней металлургии было обстоятельство, при котором получили бронзу – сплав на ее основе.
Содержание
- Основные свойства и параметры меди
- Отличия меди от латуни
- Отличия меди от бронзы
- Отличия меди от алюминия
Основные свойства и параметры меди
Характерны следующие моменты:
- В контакте с кислородом воздуха способна образовывать оксидную пленку, что обусловлено появлением желтовато-красного оттенка.
 Этим можно ответить на вопрос, какого цвета медь. Если на свет посмотреть тонкую пластинку, то она будет зеленовато-голубого оттенка.
Этим можно ответить на вопрос, какого цвета медь. Если на свет посмотреть тонкую пластинку, то она будет зеленовато-голубого оттенка. - В чистом виде обладает достаточно выраженной мягкостью и пластичностью. Ее легко прокатать и вытянуть. С добавлением примесей твердость повышается.
- Широта применения обусловлено ее способностью отличной электропроводности.
- Обладает хорошими показателями теплопроводности. По этой характеристике ее опережает лишь серебро.
- Для нее характерна высокая плотность, температура плавления и кипения.
- С добавлением примесей свойства теплопроводности и электропроводности падают.
- Стойкость по отношению к процессам, связанным с коррозией. В воде, например, железо будет окисляться значительно быстрее.
- Материал легко протянуть в довольно тонкую проволоку.
- Металл обладает диамагнетическими свойствами.
В химическом плане активность незначительная по своей величине. Если воздух сухой, то окисления не произойдет. Процесс проходит только на воздухе с достаточным содержанием влаги. Не поддается действию кислот без окислительных свойств. С химических позиций отличается выраженной амфотерностью. В зависимости от условий ее характеристики отличаются и принимают характер кислоты или основания.
Процесс проходит только на воздухе с достаточным содержанием влаги. Не поддается действию кислот без окислительных свойств. С химических позиций отличается выраженной амфотерностью. В зависимости от условий ее характеристики отличаются и принимают характер кислоты или основания.
Отличия меди от латуни
Нередко возникает вопрос о том, как отличить медь от латуни. Латунь представляет собой сплав, где в 30% содержится цинк. В половине случаев для производства латуни проводят использование технического цинка, где его присутствует только 50%. Остальная часть состоит из свинца и других примесей. Для того чтобы различить эти представители, надо знать их характеристики. В связи с этим уместен вопрос, как определить медь?
Для отличия латуни от меди требуется выполнение ряда действий, с помощью которых можно распознать медь в домашних условиях:
- Чистят предмет, который необходимо проверить.
 Для удаления загрязнений используют водный раствор уксуса. Таким способом происходит удаление и окислов.
Для удаления загрязнений используют водный раствор уксуса. Таким способом происходит удаление и окислов. - Лучше определение проводить при белом свете. Медные изделия характеризуются красно-коричневым цветом. Латунная поверхность переливается несколькими цветами. Это связано с присутствием в ее составе нескольких представителей.
- Медные предметы мягкие и удар о твердую поверхность сопровождает приглушенность звука. У латуни этого нет. Звук более звонкий по своим характеристикам.
- Предметы способны содержать пометки в виде литеры «М» или «Л». По этому признаку эти два вида также могут отличаться.
- Узнать, что перед вами конкретно, можно и по области применения изделия. Медные изделия встретишь довольно редко, зато она повсеместно используется для производства проводов.
Перечисленными способами и проводят определение меди прямо дома.
Отличия меди от бронзы
Эти два вида имеют сходство по цвету. Поэтому иногда бывает необходимость провести разграничения. Это сделать не так сложно, если знать особенности бронзового состава. Узнать, что конкретно перед вами, можно по следующим характеристикам.
Это сделать не так сложно, если знать особенности бронзового состава. Узнать, что конкретно перед вами, можно по следующим характеристикам.
- Вещи из более пластичного материала характеризуются присутствием красновато-коричневого цвета. А вот для бронзы характерен желто-розовый оттенок. Даже по этому признаку можно отличить медь от бронзы.
- Отличить изделия можно и по характеру их взаимодействия с солевым раствором. Если им пролить медный предмет, то будет наблюдаться изменение цвета. Цвет у бронзы останется неизменным. Это также является характерным отличием.
- Оба вида отличаются свойствами эластичности. Если медная проволока легко сгибается одной рукой, то согнуть бронзовое изделие весьма проблематично.
- Медные вещи подвержены процессу естественного патинирования. При длительном взаимодействии с воздухом они покрываются зеленоватым налетом. У бронзовых изделий такой особенности не наблюдается.
Отличия меди от алюминия
Нередко актуальным становится вопрос, как отличать медь от алюминия.
По свойствам электропроводности она в 1,5 раза превышает этот показатель у алюминия. Такие предметы по прочности превосходят алюминиевые предметы. Если несколько раз согнуть алюминиевую проволоку, она сломается, а рыжая катанка останется невредимой. Можно даже отличить эти виды по весу. Изделия из алюминия гораздо легче. Температура плавления у алюминия гораздо меньше. Если при температуре 660 градусов он начинает плавиться, то такой температуры явно недостаточно для расплавления меди.
Рыжий провод легко спаять и контакт при этом будет весьма надежным. А вот обычным способом спаять алюминиевый провод весьма проблематично.
Он является представителем более молодым в плане его получения. В чистом виде он в природе не встречается, а, взаимодействуя с кислородом воздуха, способен образовывать стойкое соединение. Получать его стали лишь в 1825 году, в то время, как медь выплавляли уже в древние времена. Поскольку он гораздо легче, его активно используют при производстве самолетов. Поэтому он и получил название «крылатого металла». Добавляя в алюминий медь, получают сплав, имеющий название дюралюминий, для которого присущи более высокие характеристики прочности.
Поэтому он и получил название «крылатого металла». Добавляя в алюминий медь, получают сплав, имеющий название дюралюминий, для которого присущи более высокие характеристики прочности.
описание химического элемента, свойства и сферы применения
Металлическая медь издавна используется человечеством в самых разных областях жизни. Двадцать девятый элемент из периодической таблицы Д. И. Менделеева , находящийся между никелем и цинком, обладает интересными характеристиками и свойствами. Этот элемент обозначается символом Cu. Это один из немногих металлов с характерной окраской, отличной от серебристого и серого цветов.
- История появления меди
- Способы добычи
- Немного о названии
- Физические свойства металла
- Химические свойства элемента
- Области и особенности применения
- Сплавы меди
- Отрасли промышленности
- Роль в организме человека
История появления меди
О том, какое великое значение имел этот химический элемент в истории человечества и планеты, можно догадаться уже по названиям исторических эпох. После каменного века наступил медный, а за ним — бронзовый, также имеющий прямое отношение к этому элементу.
После каменного века наступил медный, а за ним — бронзовый, также имеющий прямое отношение к этому элементу.
Медь является одним из семи металлов, которые стали известны человечеству еще в древности. Если верить историческим данным, знакомство древних людей с этим металлом произошло примерно девять тысяч лет назад.
Древнейшие изделия из этого материала были обнаружены на территории современной Турции. Археологические раскопки, проведенные на месте крупного поселения времен неолита под названием Чаталхеюк, позволили отыскать небольшие медные шарики-бусины, а также медные пластины, которыми древние люди украшали свой наряд.
Найденные вещицы были датированы стыком восьмого и седьмого тысячелетий до нашей эры. Помимо самих изделий, на месте раскопок был обнаружен шлак, что говорит о производившихся выплавках металла из руды.
Получение меди из руды было относительно доступно. Поэтому несмотря на свою высокую температуру плавления, этот металл в числе первых был быстро и широко освоен человечеством.
Способы добычи
В природных условиях этот химический элемент существует в двух формах:
- соединения;
- самородки.
Любопытным фактом является следующее: медные самородки в природе попадаются гораздо более часто, чем золотые, серебряные и железные.
Природные соединения меди — это:
- оксиды;
- углекислые и сернистые комплексы;
- гидрокарбонаты;
- сульфидные руды.
Рудами, имеющими наибольшее распространение, являются медный блеск и медный колчедан. Меди в этих рудах содержится всего один-два процента. Первичная медь добывается двумя основными способами:
- гидрометаллургическим;
- пирометаллургическим.
Доля первого способа составляет десять процентов. Оставшиеся девяносто относятся ко второму методу.
Пирометаллический способ включает в себя комплекс процессов. Сначала медные руды обогащаются и обжигаются. Затем сырье плавится на штейн, после чего продувается в конвертере. Таким образом получается черновая медь. Превращение ее в чистую осуществляется путем рафинирования — сначала огневого, затем электролитического. Это последняя стадия. По ее окончании чистота полученного металла составляет практически сто процентов.
Сначала медные руды обогащаются и обжигаются. Затем сырье плавится на штейн, после чего продувается в конвертере. Таким образом получается черновая медь. Превращение ее в чистую осуществляется путем рафинирования — сначала огневого, затем электролитического. Это последняя стадия. По ее окончании чистота полученного металла составляет практически сто процентов.
Процесс получения меди гидрометаллургическим способом делится на два этапа.
- Вначале сырье выщелачивается при помощи слабого раствора серной кислоты.
- На заключительном этапе металл выделяется непосредственно из упомянутого в первом пункте раствора.
Данный метод используется при переработке только бедных руд, так как, в отличие от предыдущего способа, при его проведении невозможно попутно извлечь драгоценные металлы. Именно поэтому приходящийся на этот способ процент так невелик по сравнению с другим методом.
Немного о названии
Химический элемент Cuprum, обозначаемый символом Cu, получил свое название в честь небезызвестного острова Кипр. Именно там в далеком третьем веке до нашей эры были обнаружены крупные месторождения медной руды. Местными мастерами, трудившимися на этих рудниках, производилась выплавка данного металла.
Именно там в далеком третьем веке до нашей эры были обнаружены крупные месторождения медной руды. Местными мастерами, трудившимися на этих рудниках, производилась выплавка данного металла.
Физические свойства металла
Пожалуй, невозможно понять, что такое металлическая медь, не разобравшись в ее свойствах, основных характеристиках и особенностях.
При контакте с воздухом этот металл становится желтовато-розового цвета. Этот неповторимый золотисто-розовый оттенок обусловливается возникновением на поверхности металла оксидной пленки. Если эту пленку удалить, медь приобретет выразительный розовый цвет с характерным ярким металлическим блеском.
Удивительный факт: тончайшие медные пластинки на просвет имеют вовсе не розовый, а зеленовато-голубой или, иначе говоря, морской цвет.
В форме простого вещества медь обладает следующими характеристиками:
- удивительной пластичностью;
- достаточной мягкостью;
- тягучестью.

Чистая медь без наличия каких-либо примесей превосходно поддается обработке — ее с легкостью можно прокатить в пруток или лист либо вытянуть в проволоку, толщина которой будет доведена до тысячных долей миллиметра. Добавление примесей в этот металл повышает его твердость.
Помимо упомянутых физических характеристик, этот химический элемент обладает высокой электропроводностью. Эта особенность главным образом определила применение металлической меди.
Среди основных свойств этого металла стоит отметить его высокую теплопроводность. По показателям электропроводности и теплопроводности медь является одним из лидеров среди металлов. Более высокими показателями по этим параметрам обладает только один металл — серебро.
Нельзя не принимать во внимание тот факт, что показатели электро- и теплопроводности меди относятся к разряду базовых свойств. Они сохраняются на высоком уровне лишь пока металл находится в чистом виде. Уменьшить эти показатели возможно добавлением примесей:
Они сохраняются на высоком уровне лишь пока металл находится в чистом виде. Уменьшить эти показатели возможно добавлением примесей:
- мышьяка;
- железа;
- олова;
- фосфора;
- сурьмы.
Каждая из этих примесей в сочетании с медью оказывает на нее определенное влияние, в результате которого значения тепло- и электропроводности заметно понижаются.
Помимо всего прочего, металлическая медь характеризуется невероятной прочностью, высокой температурой плавления, а также высокой температурой кипения. Данные действительно впечатляют. Температура плавления меди превышает одну тысячу градусов Цельсия! А температура кипения составляет 2570 градусов Цельсия.
Этот металл относится к группе металлов-диамагнетиков. Это значит, что его намагничивание, как и у ряда других металлов, происходит не по направлению внешнего магнитного поля, а против него.
Еще одной немаловажной характеристикой можно назвать отличную устойчивость этого металла к коррозии. В условиях высокой влажности окисление железа, например, происходит в несколько раз быстрее, чем окисление меди.
В условиях высокой влажности окисление железа, например, происходит в несколько раз быстрее, чем окисление меди.
Химические свойства элемента
Данный элемент является малоактивным. При контакте с сухим воздухом в обычных условиях медь не начинает окисляться. Влажный воздух, напротив, запускает окислительный процесс, при котором образуется медный карбонат (II), являющийся верхним слоем патины. Практически моментально этот элемент реагирует с такими веществами, как:
- сера;
- селен;
- галогены.
Кислоты, не обладающие окислительными свойствами, не способны оказывать на медь влияние. Кроме того, она никак не реагирует при контакте с такими химическими элементами, как:
- азот;
- углерод;
- водород.
Кроме уже отмеченных химических свойств, для меди характерна амфотерность. Это значит, что в земной коре она способна образовать катионы и анионы. Соединения этого металла могут проявлять как кислотные свойства, так и основные — это напрямую зависит от конкретных условий.
Области и особенности применения
В древние времена металлическая медь использовалась для изготовления самых разных вещей. Умелое применение этого материала позволило древним людям обзавестись:
- дорогой посудой;
- украшениями;
- инструментами, имеющими тонкое лезвие.
Сплавы меди
Говоря о применении меди, нельзя не упомянуть о ее значении в получении различных сплавов, в основу которых ложится именно этот металл. К таким сплавам относятся:
- бронза;
- латунь.
Две эти разновидности явяются основными видами медных сплавов. Первый бронзовый сплав был создан на Востоке еще за три тысячелетия до нашей эры. Бронза по праву может считаться одним из величайших достижений металлургов древности. По сути, бронза — это соединение меди с прочими элементами. В большинстве случаев в роли второго компонента выступает олово. Но вне зависимости от того, какие элементы входят в сплав, основным компонентом всегда является медь. Формула латуни содержит главным образом медь и цинк, но возможны и дополнения к ним в виде других химических элементов.
Формула латуни содержит главным образом медь и цинк, но возможны и дополнения к ним в виде других химических элементов.
Помимо бронзы и латуни, этот химический элемент участвует в создании сплавов с другими металлами, среди которых алюминий, золото, никель, олово, серебро, титан, цинк. Медные сплавы с неметаллами, такими как кислород, сера и фосфор, используются гораздо реже.
Отрасли промышленности
Ценные свойства медных сплавов и чистого вещества способствовали их использованию в таких отраслях, как:
- электротехника;
- электромашиностроение;
- приборостроение;
- радиоэлектроника.
Но, разумеется, это еще не все области применения этого металла. Он является высокоэкологичным материалом. Именно поэтому он используется при строительстве домов. Например, кровельное покрытие, выполненное из металлической меди, благодаря своей высочайшей коррозийной устойчивости обладает сроком службы более сотни лет, не требуя при этом особого ухода и покраски.
Еще одна область использования этого металла — ювелирная отрасль. В основном он применяется в форме сплавов с золотом. Изделия из медно-золотого сплава характеризуются повышенной прочностью, высокой стойкостью. Такие изделия на протяжении долгого времени не деформируются и не истираются.
Соединения металлической меди выделяются высокой биологической активностью. В мире флоры этот металл имеет важное значение, так как он участвует в синтезе хлорофилла. Участие данного элемента в этом процессе позволяет обнаружить его в числе компонентов минеральных удобрений для растений.
Роль в организме человека
Нехватка этого элемента в человеческом организме может оказать негативное влияние на состав крови, а именно ухудшить его. Восполнить дефицит этого вещества можно при помощи специально подобранного питания. Медь содержится во многих продуктах питания, поэтому составить полезный рацион по душе не составит труда. Для примера, одним из продуктов, в составе которых имеется этот элемент, является обычное молоко.
Но составляя насыщенное этим элементом меню, не следует забывать о том, что переизбыток его соединений может привести к отравлению организма. Поэтому, насыщая организм этим полезным веществом, очень важно не переусердствовать. И касается это не только количества потребляемых продуктов.
К примеру, пищевое отравление может вызвать использование медной посуды. Приготовление пищи в такой посуде крайне не рекомендуется и даже воспрещается. Связано это с тем, что в процессе кипячения в пищу поступает значительное количество этого элемента, что может привести к отравлению.
В запрете на медную посуду есть одна оговорка. Использование такой посуды не представляет опасности в том случае, если ее внутренняя поверхность имеет оловянное покрытие. Только при выполнении этого условия использование медных кастрюлек не несет угрозы пищевого отравления.
Помимо всех перечисленных отраслей применения, распространение этого элемента не обошло стороной и медицину. В сфере лечения и поддержания здоровья он применяется в качестве вяжущего вещества и антисептика. Этот химический элемент входит в состав капель для глаз, которые используются при лечении такого заболевания, как конъюнктивит. Кроме того, медь является немаловажным компонентом различных растворов от ожогов.
Этот химический элемент входит в состав капель для глаз, которые используются при лечении такого заболевания, как конъюнктивит. Кроме того, медь является немаловажным компонентом различных растворов от ожогов.
Как чистить изделия из меди, латуни, бронзы
Как чистить изделия из меди, латуни, бронзы
Медные раковины, латунные вытяжки, бронзовые предметы интерьера, камины из меди и другие изделия, безусловно, приносят в Ваш дом красоту и уют. Но, как и все металлы, с течением времени медь, латунь и бронза тускнеют и меняют цвет. При взаимодействии с воздухом медь постепенно темнеет, а при постоянном контакте с водой медная поверхность становится голубовато-зеленой. Так как же ухаживать за изделиями из меди, латуни и бронзы?
На самом деле, это не так сложно, как может показаться. Есть много способов вновь сделать ваше медное изделие сияющим и заставить его выглядеть как новое. Кроме того, у каждого владельца изделия из цветных металлов есть еще один интересный выбор, но о нем мы поговорим чуть позже.
Кроме того, у каждого владельца изделия из цветных металлов есть еще один интересный выбор, но о нем мы поговорим чуть позже.
Итак, самые распространенные способы, с помощью которых можно почистить изделие из меди, латуни или бронзы:
Чистка медных и латунных изделий с помощью уксуса, муки и соли
Самым старым и известным средством для чистки меди, латуни и бронзы является уксус. Нужно смешать в равных пропорциях соль и муку и добавить столько уксуса, чтобы образовалась густая паста. Этой смесью при помощи мягкой ткани нужно протереть медное или латунное изделие (например, медную вытяжку) пока оно не засияет. После этого смыть пасту водой и хорошенько высушить предмет.
Уксус и соль для чистки меди, латуни и бронзы
Как очистить предметы из меди и латуни с помощью лимона
Еще один проверенный способ чистки медных, латунных и бронзовых предметов: протереть изделие (например, медную раковину, медную плиту или фартук для кухни из меди) половинкой лимона, сполоснуть водой и вытереть насухо. Также можно сделать смесь из лимонного сока и соды или соли, нанести эту кашицу на плиту, отполировать его мягкой тканью, смыть водой и высушить.
Также можно сделать смесь из лимонного сока и соды или соли, нанести эту кашицу на плиту, отполировать его мягкой тканью, смыть водой и высушить.
Эти способы работают, потому что кислота в уксусе и лимонном соке удаляет окисленную патину с медной и латунной поверхности, а соль и сода работают как мягкие абразивные средства.
Лимон заставит медь и латунь сиять
! Вместо лимона можно взять лайм
Кетчуп для чистки меди
Самый оригинальный, но также действенный способ – использовать кетчуп. Да, да, действительно, простой кетчуп. Кислота, содержащаяся в томатах, помогает почистить медную поверхность. Все так же просто, как и в других натуральных способах: нанести кетчуп на медный или латунный предмет, натереть, смыть водой и высушить. Мы, однако, считаем, что лучше не переводить этот продукт, а приправить им пасту, приготовленную на нашей плите из меди.
Кетчуп отлично подходит для чистки меди
Кипячение как способ почистить предметы из меди, латуни и бронзы
Если вышеописанные способы не работают, а изделие из меди, которое Вы хотите почистить, небольшое, то можно в большой кастрюле смешать 1 стакан уксуса, 1 столовую ложку соли, 3 или 4 стакана воды и довести жидкость до кипения. Помесить в кастрюлю нуждающееся в чистке медное или латунное изделие и кипятить его, пока налет не исчезнет. После этого Вам, скорее всего, понадобится еще немного его потереть, но, в любом случае, это потребует меньше времени и усилий.
Помесить в кастрюлю нуждающееся в чистке медное или латунное изделие и кипятить его, пока налет не исчезнет. После этого Вам, скорее всего, понадобится еще немного его потереть, но, в любом случае, это потребует меньше времени и усилий.
Кипящая вода поможет очистить небольшой предмет из меди, латуни и бронзы
Средства бытовой химии и специальные средства
В качестве альтернативы народным методам чистки изделий из меди, латуни, бронзы можно применять обычные бытовое чистящее средство, растворенное в воде. Однако этот способ не поможет вам избавиться от естественной патины, и подходит лишь для удаления жира, грязи и пыли.
Также сегодня в продаже есть специальные средства по уходу за медными и латунными предметами. Это концентраты кислоты, в инструкции к которым подробно описан способ применения.
Средста для чистки медных изделий можно купить в магазине бытовой химии
Предосторожности при чистке
! Будьте очень осторожны при использовании кислот. Надевайте перчатки;
Надевайте перчатки;
! Не применяйте жесткие и колючие щетки – они могут оставить царапины;
! Используя специальные чистящие средства, читайте инструкцию.
Особенности и рекомендации при уходе за изделиями из цветных металлов
Если предмет постоянно контактирует с водой (например, медная раковина), его следует протирать полотенцем после каждого использования. После чистки изделия Вы наверняка захотите сохранить его чистым и сияющим как можно дольше. На изделия из меди можно нанести слой защитного полимерного лака. Перед нанесением лака предмет нужно тщательно очистить, иначе пятна или следы рук могут проявиться позже. Также отметим, что не стоит покрывать лаком предметы, подвергающиеся постоянному механическому воздействию.
Медная раковина требует особого ухода
Натуральный внешний вид изделий из меди, латуни и бронзы
И самое оригинальное и творческое решение для тех, кому интересно наблюдать как «живет» металл, как он меняет цвета и оттенки. Если Вы специально стремитесь к естественности, чистка вашего медного изделия не будет вас сильно беспокоить. Природная патина, градации цвета, шероховатая, очень натуральная поверхность придают своеобразную прелесть естественному состоянию медного предмета или изделия из латуни и бронзы. Особенно хорошо это можно наблюдать на открытой медной проводке и медных светильниках.
Если Вы специально стремитесь к естественности, чистка вашего медного изделия не будет вас сильно беспокоить. Природная патина, градации цвета, шероховатая, очень натуральная поверхность придают своеобразную прелесть естественному состоянию медного предмета или изделия из латуни и бронзы. Особенно хорошо это можно наблюдать на открытой медной проводке и медных светильниках.
Если у вас есть вопрос об уходе за любыми медными или латунными изделиями, пишите нам!
Химия меди и её соединений
Производство -> Химическая промышленность | Автор: | Добавлено: 2015-05-28
Медь является представителем d-элементов, располагается в побочной подгруппе I группы периодической системы элементов Д. И. Менделеева.
Медь в ряду стандартных электродных потенциалов расположена после водорода, поэтому в природе встречается в виде сульфидов, солей и самородной меди.
Медь является особо практически значимым химическим элементом. Нас окружают в повседневной жизни огромное количество изделий, сделанных из сплавов меди. Вследствие высокой тепло- и электрической проводимости медь в больших количествах используется для изготовления электрических проводов, кабелей, котлов, перегонных кубов и т. д.
Химическая особенность меди связана с особенностью строения атома, как представителя d-элементов. Среди металлов d-семейства (хром, железо, медь) атом меди имеет наименьший радиус и наибольшее значение относительной электроотрицательности. Следовательно, металлические свойства меди выражены слабее, чем хрома и железа. Поэтому для меди еще более чем для хрома и железа, характерны соединения с преимущественно ковалентным типом химической связи.
Общая характеристика меди
Элемент медь расположен в IV периоде и 1В группе, химический знак Сu, атомный номер 29, относительная атомная масса Аr(Сu) – 63,546 (в химических расчетах округляется до 64).
Электронная конфигурация атома меди в основном состоянии 1s22s22p63s23p63d104s1, валентные электроны распределяются по 4s- и Зd-подуровням следующим образом (в атоме меди наблюдается «проскок» электрона с 4s-подуровня на Зd-подуровень):
(( (( (( (( (( (
3d 4s
Следовательно, в атоме меди третий энергетический уровень полностью заполнен электронами. Поскольку в степени окисления +2 медь имеет не полностью заполненный энергетический Зd-подуровень (конфигурация Зd9), она, подобно железу и хрому, также относится к семейству d-элементов.
В природе элемент медь представлен двумя стабильными изотопами (мольная доля 69,1%) и (мольная доля 30,9%). В земной коре массовая доля меди равна 0,01% (26-е место среди всех элементов и 17-е – среди металлов), мольная доля – 0,0028% (также 26-е место среди всех элементов и 16-е среди металлов). В природе элемент медь встречается как в виде соединений, так и в виде простого вещества (самородная медь). Важнейшие минералы меди: FеСuS2 – халькопирит, или медный колчедан, Сu2S – халькозин (медный блеск), СuS – ковеллин, (СuОН)2 ∙ CuСО3 – малахит.
В промышленности медь чаще всего получают из сульфидных руд, в которых содержание меди невелико (массовая доля ≈ 3%). С этой целью руду флотацией и обжигом вначале обогащают, а затем сплавляют окисленную медь с сульфидом меди (I):
+1 -2 +1 toC 0 +4
Cu2S + 2Cu2O ( 6Cu + SO2(.
Полученную таким образом черновую медь подвергают очистке (рафинированию) методом электролиза.
Кроме пирометаллургического метода, для получения меди используют и гидрометаллургический способ. В этом случае медные руды растворяют в разбавленных растворах аммиака, или h3SO4, например:
Cu2 + 2Fе(SO4)3 ( 4FеSО4 + 2CuSO4 + S(.
Из полученных растворов медь выделяют электролизом или вытесняют железом:
CuSO4 + Fе ( Cu( + FеSO4.
Некоторые атомные характеристики элемента и физико-химические свойства простого вещества меди.
Атомные а физико-химические свойства элемента и простого вещества меди
Орбитальный радиус, Первая энергия Относитель-ная Степень окисления tпл; Плотность, г/см3 Стандартный нм ионизации, кДж/моль электроотрицательнос tкип, оС (293К) электродный ть потенциал, В Сu2+ +
2e ( Cu0
0,119 745,4 1,75 +1, +2, +3 1084; 2567 8,96 0,337
Среди металлов d-семейства (хром, железо, медь) атом меди имеет наименьший радиус и наибольшее значение относительной электроотрицательности. Следовательно, металлические свойства меди выражены слабее, чем хрома и железа. Поэтому для меди еще более чем для хрома и железа, характерны соединения с преимущественно ковалентным типом химической связи.
Следовательно, металлические свойства меди выражены слабее, чем хрома и железа. Поэтому для меди еще более чем для хрома и железа, характерны соединения с преимущественно ковалентным типом химической связи.
Медь образует соединения со степенями окисления +1, +2 и +3, однако наиболее характерна для меди степень окисления + 2. Распределение электронов по 4s и 3d энергетическим подуровням для Cu (I), Cu (II) следующее:
Cu+1: (( (( (( (( (( 1s22s22p63s23d104s0 3d 4s Cu+2: ( (( (( (( (( 1s22s22p63s23d94s0 Простое вещество медь – металл красного цвета, ковкий (из меди можно прокатать листочки толщиной в несколько микрометров), обладает прекрасной тепло- и электрической проводимостью (в этом отношении уступает только серебру). Недостаток меди как конструкционного материала – малая твердость, что легко устраняется добавлением других металлов. Медь относится к группе тяжелых тугоплавких металлов. Кристаллическая медь имеет кубическую гранецентрированную решетку.
Химическая активность меди невелика, на что указывает, например, значение стандартного электродного потенциала. В РСЭП медь расположена за водородом, поэтому наиболее эффективно медь окисляется не водородом, а анионом кислот-окислителей (НNО3, Н2SO4(конц. )). Разбавленные растворы кислот-неокислителей, щелочей (в отсутствие окислителей) на медь не действуют.
В РСЭП медь расположена за водородом, поэтому наиболее эффективно медь окисляется не водородом, а анионом кислот-окислителей (НNО3, Н2SO4(конц. )). Разбавленные растворы кислот-неокислителей, щелочей (в отсутствие окислителей) на медь не действуют.
Вследствие окисления на воздухе в присутствии углекислого газа медные изделия со временем покрываются зеленным налетом карбоната гидроксомеди(П) (CuОН)2СО3.
Взаимодействие меди с простыми и сложными веществами
Взаимодействие с простыми веществами
При температуре красного каления медь реагирует с кислородом с образованием оксида меди (II), а при более высокой температуре- оксида меди (I):
2Cu + О2 ( 2CuО оксид меди (П), черный;
4Cu + О2 ( 2Cu2О оксид меди (I), красный.
С галогенами медь реагирует при нагревании; во всех случаях (кроме иода) образуются галогениды Cu (II):
Cu + Cl2 ( CuCl2
В случае иода образуется иодид меди (I)[1]:
2Cu + I2 ( 2СuI.
При нагревании медь реагирует с серой, состав продукта зависит от температуры; как и в случае с кислородом, стабилизации низшей степени окисления способствует более сильное нагревание:
Сu + S ( СuS, сульфид меди (II)
2Сu + S ( Сu2S.
сульфид меди (I)
При нагревании сульфиды Cu (I) и Cu (П) восстанавливаются водородом до металлической меди:
CuS + Н2 ( Cu + Н2S(.
С азотом, водородом и углеродом медь непосредственно не реагирует, ее соединения с этими элементами могут быть получены косвенным путем.
С фосфором и кремнием медь при нагревании образует соединения внедрения:
2Cu + Р ( Cu2P (а также Cu3P2, Cu3P),
2Cu + Si ( Cu2Si (а также соединения другого состава).
С серебром и никелем медь образует твердые растворы с неограниченной взаимной растворимостью, с некоторыми металлами – интерметаллиды (например, CuZn, CuZn3).
Взаимодействие со сложными веществами
С чистой (не содержащей кислород) водой медь не реагирует. Медь хорошо растворяется в азотной и серной концентрированной кислотах:
Cu + 4НNО3 (конц. ) ( Cu(NO3)2 + 2NО2( + 2h3O, w > 60%
Cu + 8НNО3 ( 3Cu(NO3)2 + 2NО( + 4h3O, w ≈ 40%
Cu + 2Н2SО4 (конц. ) ( CuSO4 + SО2( + 2h3O,
С разбавленными галоген овод сродными кислотами медь не взаимодействует, однако растворяется в их концентрированных растворах вследствие образования чрезвычайно устойчивых комплексных ионов, содержащих Cu+1:
0 +1 +1
2Cu + 4НС1(конц. ) ( 2Н[CuС12] + (.
) ( 2Н[CuС12] + (.
дихлорокупрат (I) водорода
При нагревании медь реагирует с сероводородом:
2Сu + Н2S ( Cu2S + h3(.
При обычной температуре медь окисляется оксидом азота (IV), а при нагревании – и оксидом азота (II):
2Cu + NO2 ( Cu2O + NO(,
4Cu + 2NO ( 2Cu2O + N2(.
Нагретая до красного каления, медь реагирует с аммиаком, образуя нитриды меди (I):
6Cu + 2NН3 ( 2Cu3N + ЗН2(.
Медь вытесняет менее активные металлы из водных растворов солей:
Cu(кр. ) + 2АgNО3(р-р) ( Cu(NO3)2(р-р) + 2Аg(кр. ).
В растворимое состояние медь можно перевести с помощью водного раствора FеСl3, поскольку ионы Fе3+ окисляют металлическую медь (на практике эта реакция используется для травления печатных плат):
Cu(кр. ) + 2FeCl3(р-р) ( CuCl2(р-р) + 2FeCl2(кр. ).
Для меди характерно образование комплексных соединений. Например, в присутствии кислорода медь растворяется в концентрированных водных растворах аммиака с образованием ярко-синего тетраамминового комплекса:
2Cu + 8NН3 ∙ h3O + O2 ( 2[Cu(NН3)4](ОН)2 + 6Н2O.
гидроксид тетрааммин меди (П)
Оксиды и гидроксиды меди
Оксид меди (I) Сu2О
Оксид меди (I) Сu2О – твердое вещество красного цвета, в природе встречается в виде минерала куприта. В лабораторных условиях Сu2О удобно получать, обрабатывая при слабом нагревании глюкозу свежеполученным гидроксидом меди (II):
2Cu(ОН)2 + Сh3OH(СНОН)4 – С (
H глюкоза
( Сh3OH(СНОН)4 – С + Cu2O( + 2h3O.
OH глюконовая кислота
Оксид меди (I) практически не растворим в воде, обладает слабовыраженными амфотерными свойствами (преобладают основные), растворяется в кислотах и концентрированных растворах щелочей при нагревании:
Cu2O + 4НС1 ( 2Н[CuСl2] + Н2O,
Cu2O + Н2SO4 ( CuSO4 + Н2O + Cu(,
Cu2O + 2NaOH (конц. ) + h3O ( 2Na[Cu(OH)2].
дигидроксокупрат (I) натрия
Оксид меди (I) хорошо растворяется в водных растворах аммиака с образованием комплексных соединений (аммиакатов), координационное число Сu(I) равно двум:
Cu2O + 4Nh4 + h3O ( 2[Cu(Nh4)2]OH.
гидроксид диаммин меди (I)
При нагревании с восстановителями Cu2О легко восстанавливается до металла:
Cu2O + h3 ( 2Cu + h3O(,
Cu2O + CO ( 2Cu + CO2(,
3Cu2O + 2Al ( 6Cu + Al2O3.
Сильное нагревание на воздухе превращает Cu2O в CuО:
2Cu2O +O2 ( 4CuO.
а при еще более сильном нагревании в инертной атмосфере оксид меди (I) разлагается на простые вещества:
2Cu2O ( 4Cu + O2(.
Гидроксид меди (I) CuОН
Гидроксид меди (I) CuОН – неустойчивое, плохо раcтворимое в воде вещество желтого цвета, в свободном состоянии CuОН не выделен, при кипячении своих взвесей легко разлагается:
2CuОН ( Cu2O( + Н2O.
Гидроксид меди (I) можно получить обработкой холодных водных растворов солей меди (I) щелочью:
CuС1+ КОН ( CuОН( + КС1.
На воздухе гидроксид меди (I) легко окисляется до Cu(OH)2:
4CuОН + О2 + 2Н2O ( 4Cu(ОН)2.
Гидроксид меди (I) обладает слабовыраженными амфотерными свойствами (преобладают основные), взаимодействует с кислотами и концентрированными растворами щелочей:
CuОН +НСl ( CuСl( + Н2О,
СuОН + NаОН(конц. ) ( Nа[Cu(ОН)2].
) ( Nа[Cu(ОН)2].
дигидроксокупрат (I) натрия
Подобно всем соединениям меди, CuОН легко растворяется в водных растворах аммиака:
CuОН + 2NН3(водн. ) ( [Cu(NН3)2]ОН.
бесцветный
Оксид меди (II) CuООксид меди (II) CuО – твердое вещество черного цвета, плохо растворяется в воде, встречается в природе в виде минерала мелаконита (тенорита). Способы получения CuО описываются уравнениями:
2Сu + О2 ( 2CuO,
Cu(OH)2 ( CuO + h3O,
2Cu(NO3)2 ( 2CuO + 4NO2( + O2(,
(CuOH)2CO3 ( 2CuO + h3O + CO2(.
Оксид меди (II) обладает слабовыраженными амфотерными свойствами (преобладают основные), хорошо растворяется в кислотах, а в щелочах – только при сплавлении:
CuO + h3SO4(разб. ) ( CuSO4 + h3O,
CuO + 2H+ ( Cu2+ + h3O,
CuO + 2KOH(кр. ) ( K2CuO2 + h3O(.
купрат меди (II) калия
Подобно оксиду меди (I), CuО хорошо растворяется в водном растворе аммиака с образованием ярко-синего комплексного соединения; координационное число Cu (II) равно четырем:
CuO + 4Nh4 + h3O ( [Cu(Nh4)4](OH)2.
гидроксид тетрааммин меди (II)
Оксид меди (II) легко восстанавливается водородом и другими восстановителями:
CuO + h3 ( CuO + h3O(,
CuO + CO ( Cu + CO2(,
CuO + C ( Cu + CO(.
Оксид меди CuО обладает окислительными свойствами. В лабораторной практике эта особенность используется для получения альдегидов или кетонов из первичных и вторичных спиртов соответственно:
Ch4Ch3OH +CuО ( Ch4 – С + Cu( + h3O,
Сh4 – CH – Ch4 + CuO ( Ch4 – C – Ch4 + Cu( + h3O.
При нагревании оксид меди (II) разлагается с образованием оксида меди(I):
4CuO ( 2CuO + h3O(.
Гидроксид меди (II) Сu(ОН)2
Гидроксид меди (II) Сu(ОН)2 – плохо растворимое в воде твердое вещество синего цвета, легко разлагается при нагревании:
Cu(ОН)2 ( CuО + h3O(.
Гидроксид меди (II) можно получить обменным взаимодействием холодных водных растворов соли меди (II) и щелочи:
Cu(NO3)2 + 2NаОН ( Cu(OH)2( + 2NаNO3,
Cu2+ + 2ОН- ( Cu(OH)2(.
С этой же целью можно использовать водный раствор аммиака, однако при его избытке Cu(ОН)2 легко растворяется с образованием тетрамминового комплекса:
Cu2+ + 2Nh4 ∙ h3O ( Cu(OH)2( ( [Cu(Nh4)4](OH)2.
голубой осадок ярко-синий
Гидроксид меди (II) обладает слабовыраженными амфотерными свойствами (слабое основание и еще более слабая кислота):
Cu(ОН)2 + 2НС1(конц. ) ( CuС12 + 2Н2O,
Cu(ОН)2 + 2Н+ ( Cu2+ + 2Н2O,
Cu(ОН)2 + 4НС1(конц. ) ( h3[CuСl4] + 2Н2О,
Cu(ОН)2 + 2КОН(конц. ) ( К2[Cu(ОН)4].
теграгидроксокупрат (II) калия
Подобно оксиду СuО, гидроксид меди (II) обладает слабовыраженными окислительными свойствами. Реакция со свежеосажденным Cu(ОН)2 является качественной на альдегидную группу:
R – С + 2Cu(OH)2 ( R – C +Cu2O ( + 2h3O.
H OH красный
Как и все соединения меди, Cu(ОН)2 хорошо растворяется в концентрированных водных растворах аммиака:
2Cu(OH)2 + 4Nh4 ∙ h3O ( [Cu(Nh4)4](OH)2 + 4h3O.
Ввиду крайне малой растворимости CuS аммиакаты меди разрушаются сероводородом:
[Cu(Nh4)4](OH)2 + h3S ( CuS( + 2h3O + 4Nh4(.
Соли меди
Медь образует два ряда солей – соли меди (I) и соли меди (II), которые ввиду амфотерности соединений меди могут быть как катионного, так и анионного типа.
Соли меди (I)
Соли меди (I) в большинстве имеют белый цвет и в водных растворах неустойчивы. Свойства солей Cu (I) рассмотрим на примере наиболее устойчивой и изученной соли – CuС1. Для получения хлорида меди (I) используют реакции обмена:
Cu2O + 2НС1 ( 2CuС1 + h3O,
Cu2O + 2Н+ ( 2Cu+ + h3O.
или окислительно-восстановительные реакции с участием соединений Cu(II):
+1 0 +2 +2
2СuСl2 + Zn ( 2CuCl + ZnCl2,
Cu+2 + e ( Cu+1 2
Zn0 – 2e ( Zn+2 1
+2 -1 +1 0
2СuСl2 ( 2CuCl + Cl2(,
Cu+2 + e ( Cu+1 2
2Cl-1 – 2e ( Cl20 1
Соли меди (I) обладают выраженными восстановительными свойствами:
+1 0 +2 -2
4СuСl + O2 + 4HCl ( 4CuCl2 + 2h3O,
Cu+1 – e ( Cu+2 4
O20 + 4e ( 2O-2 1 при нагревании диспропорционируют:
+1 t0 0 +2
2СuСl ( Cu + CuCl2,
+1 t0 0 +2
Сu2SO4 ( Cu + CuSO4, склонны к комплексообразованию:
CuС1 + НСl ( Н[CuСl2],
CuС1 + 2NН3 ( [Cu(NН3)2]Сl.
хлорид диаммин меди (I)
Аммиачные растворы CuС1 реагируют с алкинами, содержащими концевую тройную связь; полученные при этом соединения (общее название – ацетилениды) – вещества желтого цвета:
HC ( CH + 2CuCl ( 2HСl + Cu – C ( C – Cu(.
ацетилен ацетиленид меди (I)
C ( CH C ( C – Cu(
+ CuCl ( HCl + фенилацетиленид меди (I)
Соли меди (II)
Соли меди (II) в общем более устойчивы, чем соли меди (I), и поэтому наиболее распространены. Получают соли меди (II) различными способами: а) исходя из металлической меди:
Cu + Cl2 ( CuCl2,
Cu + S ( CuS,
Cu + 2h3SO4 (конц. ) ( CuSO4 + SO2( +2h3O,
Cu + 4HNO3 (конц. ) ( Cu(NO3)4 + 2NO2( +2h3O,
Cu (кр. ) + 2AgNO3 (p-p) ( Cu(NO3)3 (p-p) + 2Ag (кр. ).
б) по реакциям обмена с участием СuО, Cu(ОН), или солей меди (II):
CuO + 2HCl ( СuCl2 + h3O,
CuO + 2H+ ( Сu2+ + h3O,
Cu(OH)2 + h3SO4 ( СuSO4 + 2h3O,
Cu(OH)2 + 2H+ ( Сu2+ + 2h3O,
CuCl2 + 2AgNO3 ( Сu(NO3)2 + 2AgCl(,
Cl- + Ag+ ( AgCl(,
Cu(OH)2 + 2NaOH ( Na2[Сu(OH)4],
Cu(OH)2 + 2OH- ( [Сu(OH)42-],
Менее распространены реакции получения солей Cu(II) из соединений Cu(I):
2 CuС1+С12 ( 2CuС12.
Соли меди (II) не обладают ярковыраженными окислительными или восстановительными свойствами, хотя такие реакции с их участием возможны:
CuС12(р-р) + h3(г) ( Cu(кр. ) + 2НС1(ж),
Cu+2 + 2е ( Cu0 1
Н20 – 2e (2H+ 1
2CuС12 ( 2CuCl + С12(.
На способности ионов Cu2+ окислять иодид-ионы основан метод количественного определения иодидов по выделенному свободному иоду:
2 CuSO4 + 2KI ( I2( + 2К2SO4 + 2CuI.
Соли меди (II), подобно сопям меди (I), проявляют склонность к комплексообразованию:
CuС12 + 2NаС1(конц. ) ( Nа2[CuС14], тетрахлорид меди (II) натрия
CuС12 + 4NН3 ( [Cu(NН3)4]С12, хлорид тетрааммин-меди (II).
Рассмотрим более подробно свойства некоторых наиболее распространенных солей меди (II).
Сульфид меди (II) CuS
Сульфид меди (II) CuS – порошок черного цвета, в природе встречается в виде минерала ковеллина; плохо растворим в воде, щелочах и водном растворе аммиака. В растворимое состояние CuS можно перевести с помощью концентрированных азотной или серной кислот (в галогеноводородных кислотах сульфид меди (II) не растворяется):
В растворимое состояние CuS можно перевести с помощью концентрированных азотной или серной кислот (в галогеноводородных кислотах сульфид меди (II) не растворяется):
ЗCuS + 8НNО3(конц. ) ( 3CuSO4 + 8NO( + 4Н2O,
CuS + 2Н2SО4(конц. ) ( CuSO4 + SO2( + S( + 2Н2O.
В лабораторных условиях сульфид меди (II) удобно получать по обменным реакциям с участием солей Cu (II), причем с этой цепью можно использовать сероводород, так как CuS не растворим в разбавленных кислотах:
CuSO4 + h3S ( CuS( + h3SO4(разб. ),
Cu2+ + h3S ( CuS( + 2H+,
CuSO4 + Na2S ( CuS( + Na2SO4,
Cu2+ + S2- ( CuS(.
Во влажном воздухе CuS окисляется кислородом воздуха при нагревании с образованием сульфата меди (II):
CuS + 2О2 ( CuSO4.
В отсутствие влаги обжиг сульфида меди (II) приводит к образованию оксидов меди (II) и серы (IV):
2CuS + 3O2 ( 2CuO + 2SO2(.
При слабом нагревании без доступа воздуха сульфид меди (II) превращается в сульфид меди (I), а при более сильном прокаливании в инертной атмосфере разлагается на простые вещества:
2CuS ( Cu2S + S,
CuS ( Cu + S.
Как уже отмечалось, водород при нагревании восстанавливает сульфид меди (II) до металлической меди.
Нитрат меди (II) Сu(NO3)2
Нитрат меди (II) Сu(NO3)2 обычно образуется в виде синего кристаллогидрата Сu(NO3)2 ∙ ЗН2O при растворении меди или ее соединений в азотной кислоте:
ЗСu + 8НNО3 ( 3Cu(NО3)2 + 2NО( + 4Н2O,
CuО + 2НNО3 ( Cu(NО3)2 + Н2О,
Cu(ОН)2 + 2НNО3 ( Cu(NO3)2 + 2Н2О.
При осторожном нагревании кристаллогидрат вначале теряет воду:
Cu(NО3)2 ∙ 3Н2O ( Cu(NО3)2 + ЗН2O, синий зеленый а затем нитрат меди (II) разлагается:
2Cu(NО3)2 ( 2CuO + 4NО2( + O2(.
Для нитрата меди (II) характерны реакции, типичные для солей слабых оснований и сильных кислот: а) гидролиз в водных растворах:
Cu(NО3)2 +h3O CuOHNO3 + HNO3; б) взаимодействие со щелочами:
Cu(NО3)2 + 2КОН ( Сu(ОН)2( + 2KNO3; в) взаимодействие с солями:
Cu(NО3)2 + Na2S ( СuS( + 2NaNO3.
Более активные металлы вытесняют медь из водного раствора Cu(NО3)2:
Cu(NО3)2 + Zn( Сu( + Zn(NO3)2.
При электролизе водного раствора Cu(NО3)2 в анодном пространстве получают НNО3:
2Cu(NО3)2 + 2Н2O ( 2Cu( + О2( + 4НNO3.
Сульфат меди (II) CuSO4
Сульфат меди (II) CuSO4 – в безводном состоянии порошок белого цвета, который активно поглощает воду с образованием синего пентагидрата (медного купороса):
CuSO4 + 5h3O ( CuSO4 ∙ 5h3O.
белый синий
При нагревании до 250°С медный купорос теряет воду:
CuSO4 ∙ 5h3O ( CuSO4 + 5h3O(.
Водные растворы CuSO4 из-за гидролиза имеют кислую реакцию, реагируют с более активными металлами и подвергаются электролизу:
2CuSО4 + 2Н2O (CuOH)2SO4 + Н2SO4,
CuSО4 + Zn ( ZnSO4 + Сu(,
2CuSО4 + 2Н2O ( 2Cu( + О2( + 2Н2SO4, вступают в реакции обмена с другими солями и щелочами:
CuSО4 + K2S ( СuS( + K2SO4,
CuSО4 + 2NaOH ( Сu(OH)2( + Na2SO4,
При нагревании сульфат меди (II) разлагается:
CuSО4 ( СuO + SO3(,
2CuSО4 ( 2СuO + 2SO2( + O2(.
Карбонат гидроксомеди (II) (CuОН)2СО3 или Сu(ОН)2 ∙ CuСО3
Карбонат гидроксомеди (II) (CuОН)2СО3 или Сu(ОН)2 ∙ CuСО3 в природе встречается в виде минерала малахита. Соль представляет собой светло-зеленый порошок, плохо растворимый в воде. В лаборатории соль можно получить взаимодействием водных растворов соли меди (II) и карбоната щелочного металла:
2СuSO4 + 2Na2CO3 + h3O ( (CuOH)2CO3( + 2Na2SO4 + CO2(.
Следует обратить внимание на то, что в результате этой реакции не образуется карбонат меди. При нагревании малахит разлагается:
(CuOH)2CO3 ( 2CuО + СО2( + Н2O.
Применение меди и ее соединений
Вследствие высокой тепло- и электрической проводимости медь в больших количествах используется для изготовления электрических проводов, кабелей, котлов, перегонных кубов и т. д.
Самое разнообразное применение находят сплавы меди. Латунь (содержит до 45% цинка) используется для изготовления радиаторов, деталей часовых механизмов, в судостроении. Медно-никелевые сплавы применяют в энергетической промышленности, судостроении, для изготовления термопар, магазинов сопротивлений. Основное назначение бронзы (содержит олово или алюминий) – изготовление колоколов, статуй.
Медно-никелевые сплавы применяют в энергетической промышленности, судостроении, для изготовления термопар, магазинов сопротивлений. Основное назначение бронзы (содержит олово или алюминий) – изготовление колоколов, статуй.
Соединения меди нашли следующее применение:
Cu2O – а качестве выпрямителя переменного тока.
CuО – как окислитель в лабораторной технике, в производстве стекла и эмалей, как зеленый и синий краситель.
СuSO4 – как осушитель; СuSO4 • 5Н2О – медный купорос – для борьбы с вредителями сельского хозяйства, При пропитке древесины для предотвращения гниения.
(CuOH)2CO3 – для изготовления синих и зеленых красок, как поделочный камень (в виде малахита).
Это интересно знать
1. При сравнении свойств меди и щелочных металлов возникает закономерный вопрос: почему при однотипной электронной конфигурации внешнего энергетического уровня (например, 4s1 у атомов К и Cu) свойства меди и щелочных металлов столь различны? Дело в том, что орбитальный радиус атома меди (0,119 нм) значительно меньше, чем калия (0,216 нм), а заряд ядра – больше. Поэтому 4s1-электрон в атоме меди сильнее притягивается к ядру, чем в атоме калия; соответственно первая энергия ионизации атома меди (745,4 кДж/моль) существенно выше, чем атома калия (418,8 кДж/моль). Однако вторая и третья энергии ионизации для меди (1957,9 и 3554 кДж/моль соответственно) значительно меньше таковых для калия (3070,1 и 4,4*103 кДж/моль соответственно), т. е. в атоме меди 4s- и Зd-электроны близки по энергии. Это объясняется тем, что оторвать электрон(ы) от иона с электронной конфигурацией. Зs23p63d10 (Cu+) легче, чем от иона с электронной конфигурацией. Зs23p6 (K+). Поэтому в отличие от щелочных металлов медь в соединениях может проявлять степени окисления +2, +3 и даже + 4.
Поэтому 4s1-электрон в атоме меди сильнее притягивается к ядру, чем в атоме калия; соответственно первая энергия ионизации атома меди (745,4 кДж/моль) существенно выше, чем атома калия (418,8 кДж/моль). Однако вторая и третья энергии ионизации для меди (1957,9 и 3554 кДж/моль соответственно) значительно меньше таковых для калия (3070,1 и 4,4*103 кДж/моль соответственно), т. е. в атоме меди 4s- и Зd-электроны близки по энергии. Это объясняется тем, что оторвать электрон(ы) от иона с электронной конфигурацией. Зs23p63d10 (Cu+) легче, чем от иона с электронной конфигурацией. Зs23p6 (K+). Поэтому в отличие от щелочных металлов медь в соединениях может проявлять степени окисления +2, +3 и даже + 4.
2. Не менее интересен вопрос о причинах различия в химической активности меди и цинка – металлов, относящихся к одному семейству, соседей по периодической системе. Значения двукратной энергии ионизации атомов цинка (1733,3 кДж/моль) незначительно меньше, чем меди (1957,9 кДж/моль), однако энтальпия атомизации для цинка (130,5 кДж/моль) почти в три раза меньше, чем для простого вещества меди (339,0 кДж/моль). Иными словами, атомы цинка в его кристалле менее прочно связаны между собой, что и обусловливает большую химическую активность простого вещества (не атома!) цинка по сравнению с простым веществом медью.
Иными словами, атомы цинка в его кристалле менее прочно связаны между собой, что и обусловливает большую химическую активность простого вещества (не атома!) цинка по сравнению с простым веществом медью.
3. При очистке меди электролитическим способом катодом служит лист чистой меди, анодом – болванка неочищенной (черновой) меди, а электролитом – раствор СuSO4. В процессе электролиза анод растворяется:
Сu0 – 2е ( Cu2+ и медь оседает на катоде:
Сu2+ – 2е ( Cu0.
Таким способом получают медь высокой степени чистоты, содержащую до 99,8% меди по массе.
4. Для меди в степени окисления +3 известны соединения Cu2О3, (оксид кислотного характера), K3[CuF6], КCuО2, К[Cu(ОН)4] и др. Описано соединение, в котором степень окисления меди равна +4: Сs2[CuF6].
5. Поясним причину растворения меди в галогеноводородных кислотах. Дело в том, что электродный потенциал системы Сu+/Cu зависит от концентрации ионов Сu+ следующим образом: чем меньше концентрация ионов Сu+, тем сильнее значение электродного потенциала сдвигается в сторону отрицательных значений. Образование очень устойчивого комплекса Н[CuСl2] настолько понижает концентрацию ионов Сu+, что электродный потенциал системы Сu+/Сu сдвигается в сторону отрицательных значений и становится возможным окисление атомов меди ионами Н+.
Образование очень устойчивого комплекса Н[CuСl2] настолько понижает концентрацию ионов Сu+, что электродный потенциал системы Сu+/Сu сдвигается в сторону отрицательных значений и становится возможным окисление атомов меди ионами Н+.
6. Высокая склонность меди к образованию комплексных соединений объясняется наличием в ее атоме вакантных и близких по энергии 4р- и 4d-орбиталей. При образовании химической связи медь обычно служит акцептором электронов, а молекулы или ионы с неподеленными парами электронов (Н2O, Nh4) – донорами электронов. Однако, известны комплексные соединения, в которых медь за счет неподеленных пар электронов на Зd-орбиталях является донором электронов.
7. Сульфат меди (I) может быть получен при 200°С по реакции:
2Cu + 2Н2SO4 ( Cu2SO4 + SO2( + 2Н2O.
Эта соль устойчива на воздухе, но водой разлагается на Cu2SO4 и Cu (диспропорционирует).
Практическая часть
В условиях школьной лаборатории я решила провести наиболее интересные опыты с медью и ее соединениями.
Опыт №1. Металлические покрытия и «ледяные узоры» без тока
Растворим около 10 г кристаллического сульфата меди в 100 мл воды и погрузим в раствор стальную иглу или кусочек железной жести. (Рекомендуем предварительно до блеска зачистить железо тонкой наждачной шкуркой. ) Через короткое время железо покроется красноватым слоем выделившейся меди. Более активное железо вытесняет медь из раствора, причем железо растворяется в виде ионов, а медь выделяется в виде металла. Процесс продолжается до тех пор, пока раствор находится в контакте с железом. Как только медь покроет всю поверхность железа, он практически прекратится. В этом случае образуется довольно пористый слой меди, так что защитные покрытия без применения тока получать нельзя.
Fe + CuSO4 → FeSO4 + Cu
В следующих опытах опустим в раствор сульфата меди небольшие полоски цинковой и свинцовой жести. Через 15 минут вытащим их, промоем и исследуем под микроскопом. Мы различим красивые, похожие на ледяные, узоры, которые в отраженном свете имеют красную окраску и состоят из выделившейся меди. Здесь также более активные металлы перевели медь из ионного в металлическое состояние.
Здесь также более активные металлы перевели медь из ионного в металлическое состояние.
Zn + CuSO4 → ZnSO4 + Cu
Pb + CuSO4 → PbSO4 + Cu
В свою очередь, медь может вытеснять металлы, стоящие ниже в ряду напряжений, то есть менее активные. На тонкую полоску листовой меди или на расплющенную медную проволоку (предварительно зачистив поверхность до блеска) нанесем несколько капель раствора нитрата серебра. Невооруженным взглядом можно будет заметить образовавшийся черноватый налет, который под микроскопом в отраженном свете имеет вид тонких игл и растительных узоров (так называемых дендритов).
2AgNO3 + Cu → Cu(NO3)2 + 2Ag
Опыт №2. Реакции меди с кислотами
Медь реагирует с концентрированной серной кислотой
Cu + 2h3SO4 → CuSO4 + SO2↑ + 2h3O
С азотной кислотой медь реагирует как с разбавленной, так и с концентрированной
Cu + 4HNO3(конц. ) → Cu(NO3)2 + 2NO2↑ + 2h3O
3Cu + 8HNO3(разб. ) → 3Cu(NO3)2 + 2NO↑ + 4h3O
) → 3Cu(NO3)2 + 2NO↑ + 4h3O
Таким образом, медь и ее соединения являются практически значимыми веществами.
Нас окружают в повседневной жизни огромное количество изделий, сделанных из сплавов меди. Вследствие высокой тепло- и электрической проводимости медь в больших количествах используется для изготовления электрических проводов, кабелей, котлов, перегонных кубов и т. д.
Широко использование меди в аналитической химии. Медь также является очень необходимым элементом в биологических системах. Недостаток меди в крови человека вызывает особого рода анемию. Поэтому человек должен следить за балансом металлов в своем организме.
Как представитель d-элементов медь способна образовывать комплексные соединения.
Эта тема мне стала очень интересна. Работу я буду продолжать в старших классах. Я буду заниматься методами аналитической химии для исследования содержания меди в различных сплавах. Также я ставлю перед собой цель – более глубокое изучение соединений меди в составе комплексных соединений.
Происхождение цвета в комплексных ионах
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3707
- Джим Кларк
- Школа Труро в Корнуолле
На этой странице будет просто рассмотрено происхождение цвета сложных ионов, в частности, почему так много ионов переходных металлов окрашены.
Белый свет и цвета
Если пропустить белый свет через призму, он разделится на все цвета радуги. Видимый свет — это просто небольшая часть электромагнитного спектра, большую часть которого мы не видим: гамма-лучи, рентгеновские лучи, инфракрасное излучение, радиоволны и так далее. Каждый из них имеет определенную длину волны: от 10 -16 метров для гамма-лучей до нескольких сотен метров для радиоволн. Видимый свет имеет длину волны примерно от 400 до 750 нм. (1 нанометр = 10-9метров.)
Видимый свет имеет длину волны примерно от 400 до 750 нм. (1 нанометр = 10-9метров.)
Пример 1. Синий цвет сульфата меди (II) в растворе
Если белый свет (например, обычный солнечный свет) проходит через раствор сульфата меди (II), некоторые длины волн света поглощаются раствором. Ионы меди(II) в растворе поглощают свет в красной области спектра. Свет, который проходит через раствор и выходит с другой стороны, будет иметь в себе все цвета, кроме красного. Мы видим эту смесь длин волн как бледно-голубой (голубой). Диаграмма дает представление о том, что произойдет, если пропустить белый свет через раствор сульфата меди (II).
Определить, какой цвет вы увидите, непросто, если попытаться сделать это, воображая, что «перепутали» оставшиеся цвета. Вы бы никогда не подумали, что все остальные цвета, кроме красного, будут выглядеть, например, голубыми. Иногда то, что вы видите на самом деле, бывает совершенно неожиданным. Смешивание различных длин волн света не дает такого же результата, как смешивание красок или других пигментов. Однако иногда вы можете получить некоторую оценку цвета, который вы увидите, используя идею дополнительных цветов.
Смешивание различных длин волн света не дает такого же результата, как смешивание красок или других пигментов. Однако иногда вы можете получить некоторую оценку цвета, который вы увидите, используя идею дополнительных цветов.
Если расположить несколько цветов по кругу, получится «цветовой круг». На схеме показан один из возможных вариантов этого.
Цвета, расположенные напротив друг друга на цветовом круге, называются дополнительными цветами. Синий и желтый — дополнительные цвета; красный и голубой дополняют друг друга; а также зеленый и пурпурный. Смешивание двух дополнительных цветов света даст вам белый свет. Все это означает, что если определенный цвет поглощается из белого света, то, что ваш глаз обнаруживает, смешивая все другие длины волн света, является его дополнительным цветом. Раствор сульфата меди (II) имеет бледно-голубой (голубой) цвет, потому что он поглощает свет в красной области спектра. Голубой — дополнительный цвет красного.
Мы часто небрежно говорим о переходных металлах как о тех, которые находятся в середине Периодической таблицы, где заполнены d-орбитали, но на самом деле их следует называть d-блочными элементами, а не переходными элементами (или металлами). Эта сокращенная версия Периодической таблицы показывает первую строку блока d, где заполняются 3d-орбитали.
Эта сокращенная версия Периодической таблицы показывает первую строку блока d, где заполняются 3d-орбитали.
Обычно переходный металл определяется как металл, который образует один или несколько стабильных ионов с неполностью заполненными d-орбиталями. Цинк с электронной структурой [Ar] 3d 10 4s 2 не считается переходным металлом, какое бы определение вы ни использовали. В металле имеет полноценный 3д уровень. Когда он образует ион, 4s-электроны теряются — снова остается полностью полный 3d-уровень. На другом конце ряда скандий ([Ar] 3d 1 4s 2 ) также не считается переходным металлом. Хотя в металле есть частично заполненный d-уровень, когда он образует свой ион, он теряет все три внешних электрона. Технически Sc 3 + ион не считается ионом переходного металла, поскольку его уровень 3d пуст.
Пример 2: Ионы металлов Hexaaqua
На диаграммах показаны приблизительные цвета некоторых типичных ионов металлов Hexaaqua с формулой [ M(H 2 O) 6 ] n+ . Заряд этих ионов обычно равен 2+ или 3+.
Заряд этих ионов обычно равен 2+ или 3+.
Ионы непереходных металлов
Все эти ионы бесцветны.
Ионы переходных металлов
Соответствующие ионы переходных металлов окрашены. Некоторые из них, такие как ион гексааквамарганца (II) (не показан) и ион гексаакваэрона (II), довольно слабо окрашены, но они окрашены.
Итак, что заставляет ионы переходных металлов поглощать длины волн видимого света (вызывая цвет), тогда как ионы непереходных металлов этого не делают? И почему цвет так сильно варьируется от иона к иону?
Происхождение цвета в комплексных ионах, содержащих переходные металлы
Комплексные ионы, содержащие переходные металлы, обычно окрашены, в то время как аналогичные ионы непереходных металлов не окрашены. Это говорит о том, что частично заполненные d-орбитали должны каким-то образом участвовать в формировании цвета. Помните, что переходные металлы определяются как имеющие частично заполненные d-орбитали.
Октаэдрические комплексы
Для простоты мы рассмотрим октаэдрические комплексы, которые имеют шесть простых лигандов, расположенных вокруг центрального иона металла. Аргумент на самом деле ничем не отличается, если у вас есть мультидентатные лиганды. Когда лиганды связываются с ионом переходного металла, возникает отталкивание между электронами в лигандах и электронами на d-орбиталях иона металла. Это повышает энергию d-орбиталей. Однако из-за того, как d-орбитали расположены в пространстве, это не увеличивает все их энергии на одинаковую величину. Вместо этого он разделяет их на две группы. На диаграмме показано расположение d-электронов в Cu 2 + ион до и после связывания с ним шести молекул воды.
Всякий раз, когда 6 лигандов располагаются вокруг иона переходного металла, d-орбитали всегда разделяются таким образом на 2 группы – 2 с более высокой энергией, чем остальные 3. Размер энергетической щели между ними (показан синие стрелки на диаграмме) зависит от природы иона переходного металла, его степени окисления (например, 3+ или 2+) и природы лигандов. Когда белый свет проходит через раствор этого иона, часть энергии света используется для продвижения электрона с нижнего набора орбиталей в пространство верхнего набора.
Когда белый свет проходит через раствор этого иона, часть энергии света используется для продвижения электрона с нижнего набора орбиталей в пространство верхнего набора.
Каждой длине волны света соответствует определенная энергия. Красный свет имеет наименьшую энергию в видимой области. Фиолетовый свет обладает наибольшей энергией. Предположим, что энергетическая щель на d-орбиталях комплексного иона соответствует энергии желтого света.
Желтый свет будет поглощаться, потому что его энергия будет использоваться для продвижения электрона. Остаются другие цвета. Ваш глаз увидит проходящий свет как темно-синий, потому что синий является дополнительным цветом к желтому.
Тетраэдрические комплексы
Простые тетраэдрические комплексы имеют четыре лиганда, расположенных вокруг центрального иона металла. Опять же лиганды влияют на энергию d-электронов в ионе металла. На этот раз, конечно, лиганды расположены в пространстве по-другому относительно формы d-орбиталей. Чистый эффект заключается в том, что когда d-орбитали разделяются на две группы, три из них имеют большую энергию, а две другие – меньшую энергию (противоположное расположению в октаэдрическом комплексе). Помимо этого различия в деталях, объяснение происхождения цвета с точки зрения поглощения света определенной длины волны точно такое же, как и для октаэдрических комплексов.
Чистый эффект заключается в том, что когда d-орбитали разделяются на две группы, три из них имеют большую энергию, а две другие – меньшую энергию (противоположное расположению в октаэдрическом комплексе). Помимо этого различия в деталях, объяснение происхождения цвета с точки зрения поглощения света определенной длины волны точно такое же, как и для октаэдрических комплексов.
Как насчет комплексных ионов непереходных металлов?
Непереходные металлы не имеют частично заполненных d-орбиталей. Видимый свет поглощается только в том случае, если некоторая энергия света используется для продвижения электрона точно через правильную энергетическую щель. Непереходные металлы не имеют электронных переходов, которые могут поглощать длины волн видимого света. Например, хотя скандий является членом d-блока, у его иона (Sc 3 + ) не осталось d-электронов для движения. Это ничем не отличается от иона на основе Mg 2 + или Ал 3 + . Комплексы скандия (III) бесцветны, поскольку не поглощают видимый свет. В случае цинка 3d-уровень полностью заполнен — нет ни одной щели, куда мог бы продвинуться электрон. Комплексы цинка также бесцветны.
Комплексы скандия (III) бесцветны, поскольку не поглощают видимый свет. В случае цинка 3d-уровень полностью заполнен — нет ни одной щели, куда мог бы продвинуться электрон. Комплексы цинка также бесцветны.
Факторы, влияющие на цвет комплексов переходных металлов
В каждом случае мы собираемся выбрать конкретный ион металла для центра комплекса и изменить другие факторы. цвет меняется довольно случайным образом от металла к металлу в переходной серии.
Природа лиганда
Различные лиганды по-разному влияют на энергии d-орбиталей центрального иона. Некоторые лиганды обладают сильными электрическими полями, которые вызывают большую энергетическую щель, когда d-орбитали разделяются на две группы. Другие имеют гораздо более слабые поля, создающие гораздо меньшие промежутки. Помните, что размер зазора определяет, какая длина волны света будет поглощаться. В списке показаны некоторые распространенные лиганды. Те, что наверху, производят наименьшее расщепление; те внизу самое большое расщепление.
Чем больше расщепление, тем больше энергии необходимо для продвижения электрона с низшей группы орбиталей на высшие. Что касается цвета поглощаемого света, большая энергия соответствует более коротким длинам волн. Это означает, что по мере увеличения расщепления поглощенный свет будет иметь тенденцию смещаться от красного конца спектра к оранжевому, желтому и так далее.
В химии меди(II) есть довольно четкий случай. Если к ионам гексааквамеди(II) в растворе добавить избыток раствора аммиака, бледно-голубой (голубой) цвет сменится на темно-чернило-синий, поскольку некоторые молекулы воды в комплексном ионе заменяются аммиаком.
Первый комплекс должен поглощать красный свет, чтобы дать дополнительный голубой цвет. Второй должен поглощать в желтой области, чтобы дать дополнительный цвет темно-синий. Желтый свет имеет более высокую энергию, чем красный свет. Вам нужна эта более высокая энергия, потому что аммиак вызывает большее расщепление d-орбиталей, чем вода.
Однако увидеть это не всегда так просто! Попытка разобраться, что поглощается, когда у вас есть мутные цвета не на простом цветовом круге дальше по странице, гораздо большая проблема. На диаграммах приведены приблизительные цвета некоторых ионов на основе хрома (III).
Очевидно, что смена лиганда меняет цвет, но пытаться объяснить цвета с точки зрения нашей простой теории непросто.
Степень окисления металла
По мере увеличения степени окисления металла увеличивается и степень расщепления d-орбиталей. Следовательно, изменения степени окисления изменяют цвет поглощаемого света и, следовательно, цвет света, который вы видите. Возьмем другой пример из химии хрома, включающий только изменение степени окисления (от +2 до +3):
Ион 2+ почти такого же цвета, как ион гексааквамеди(II), а ион 3+ имеет трудно поддающийся описанию фиолетово-сине-серый цвет.
Координация иона
Расщепление больше, если ион октаэдрический, чем если он тетраэдрический, и поэтому цвет изменится при изменении координации. Проблема в том, что ион обычно меняет координацию только в том случае, если вы меняете лиганд, а изменение лиганда также меняет цвет. Следовательно, вы не можете изолировать эффект изменения координации. Например, часто цитируемый случай происходит из химии кобальта (II) с ионами [Co (H 2 O) 6 ] 2+ и [CoCl 4 ] 2-.
Проблема в том, что ион обычно меняет координацию только в том случае, если вы меняете лиганд, а изменение лиганда также меняет цвет. Следовательно, вы не можете изолировать эффект изменения координации. Например, часто цитируемый случай происходит из химии кобальта (II) с ионами [Co (H 2 O) 6 ] 2+ и [CoCl 4 ] 2-.
Разница в цветах будет комбинацией эффекта смены лиганда и изменения количества лигандов.
Авторы и авторство
Эта страница под названием «Происхождение цвета в сложных ионах» распространяется по незаявленной лицензии и была создана, изменена и/или курирована Джимом Кларком.
- Вернуться к началу
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Джим Кларк
- Показать страницу TOC
- № на стр.

- Теги
- Цвета
- комплексные ионы
- координация
- мультидентатные лиганды
- Октаэдрические комплексы
- степень окисления
- Тетраэдрические комплексы
- переходные металлы
ЦВЕТА СЛОЖНЫХ ИОНОВ МЕТАЛЛОВ На этой странице будет просто рассмотрено происхождение цвета сложных ионов, в частности, почему так много ионов переходных металлов окрашены. Имейте в виду, что это только введение в то, что может перерасти в чрезвычайно сложную тему. Почему некоторые соединения окрашены? Белый свет Вы, конечно, знаете, что если пропустить белый свет через призму, он распадется на все цвета радуги. Видимый свет — это просто небольшая часть электромагнитного спектра, большую часть которого мы не видим: гамма-лучи, рентгеновские лучи, инфракрасное излучение, радиоволны и так далее. Каждый из них имеет определенную длину волны: от 10 -16 метров для гамма-лучей до нескольких сотен метров для радиоволн. Видимый свет имеет длину волны примерно от 400 до 750 нм. (1 нанометр = 10 -9 метров.) На диаграмме показано приближение к спектру видимого света. | |||
Важно: Это не настоящий спектр — это вымышленный рисунок. Цвета являются лишь приблизительными значениями, как и приписанные им длины волн. Любой, кто решит использовать этот спектр в качестве чего-то большего, чем иллюстрация, должен знать, что он не претендует на точность! | |||
Почему раствор сульфата меди(II) синий? Если белый свет (например, обычный солнечный свет) проходит через раствор сульфата меди(II), некоторые длины волн света поглощаются раствором. Свет, который проходит через раствор и выходит с другой стороны, будет иметь в себе все цвета, кроме красного. Мы видим эту смесь длин волн как бледно-голубой (голубой). Диаграмма дает представление о том, что произойдет, если пропустить белый свет через раствор сульфата меди(II). Определить, какой цвет вы увидите, будет непросто, если вы попытаетесь сделать это, воображая, что “перепутываете” оставшиеся цвета. Вы бы никогда не подумали, что все остальные цвета, кроме красного, будут выглядеть, например, голубыми. Иногда то, что вы видите на самом деле, весьма неожиданно. Смешивание различных длин волн света не дает такого же результата, как смешивание красок или других пигментов. Однако иногда можно получить некоторую оценку цвета, который вы увидите, используя идею дополнительных цветов . Дополнительные цвета Если расположить несколько цветов по кругу, получится «цветовой круг». Цвета, расположенные прямо напротив друг друга на цветовом круге, называются дополнительными цветами. Синий и желтый — дополнительные цвета; красный и голубой дополняют друг друга; а также зеленый и пурпурный. Смешивание двух дополнительных цветов света даст вам белый свет. | |||
Осторожно: Это НЕ то же самое, что смешивание цветов краски. Если вы смешаете желтую и синюю краску, вы не получите белую краску. Это сбивает с толку? ДА! | |||
Все это означает, что если определенный цвет поглощается из белого света, то, что ваш глаз определяет, смешивая все другие длины волн света, является его дополнительным цветом. Раствор сульфата меди (II) имеет бледно-голубой (голубой) цвет, потому что он поглощает свет в красной области спектра. Голубой — дополнительный цвет красного. | |||
Примечание: Если вам интересно понять взаимосвязь между поглощаемым и видимым цветом (помимо самого основного описания выше), найдите путь к уроку 2 («Цвет и зрение») раздела «Световые волны и зрение» на Кабинет физики. Я не даю прямую ссылку на эти страницы, потому что этот сайт все еще развивается, и безопаснее давать ссылку на главную страницу сайта. Это самое понятное объяснение, которое я нашел в Интернете. | |||
Происхождение окраски комплексных ионов Переходный металл против комплексных ионов других металлов Что такое переходный металл? Мы часто небрежно говорим о переходных металлах как о тех, которые находятся в середине Периодической таблицы, где заполнены d-орбитали, но на самом деле их следует называть d-блочными элементами, а не переходными элементами (или металлами). | |||
Примечание: Если вы не понимаете заполнение орбиталей в Периодической таблице, то вы должны пройти по этой ссылке, прежде чем продолжить.  Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | |||
В этой укороченной версии Периодической таблицы показана первая строка блока d, где заполняются 3d-орбитали. Обычное определение переходный металл представляет собой металл, образующий один или несколько стабильных ионов, которые имеют не полностью заполненные d-орбитали . | |||
Примечание: Самое последнее определение ИЮПАК включает возможность того, что сам элемент также имеет неполные d-орбитали. Это вряд ли будет большой проблемой (на самом деле она возникает только со скандием), но вам будет полезно выучить ту версию, которую хочет ваша программа. Обе версии определения в настоящее время используются в различных учебных программах Великобритании. Если вы готовитесь к экзамену в Великобритании и у вас нет копии программы, перейдите по этой ссылке, чтобы узнать, как ее получить. | |||
Цинк с электронной структурой [Ar] 3d 10 4s 2 не считается переходным металлом, какое бы определение вы ни использовали. В металле имеет полноценный 3д уровень. Когда он образует ион, 4s-электроны теряются — снова остается полностью полный 3d-уровень. На другом конце ряда скандий ([Ar] 3d 1 4s 2 ) также не считается переходным металлом. Хотя в металле есть частично заполненный d-уровень, когда он образует свой ион, он теряет все три внешних электрона. Ион Sc 3+ не считается ионом переходного металла, потому что его уровень 3d пуст. Некоторые образцы цветов На диаграммах показаны приблизительные цвета некоторых типичных ионов металлов гексааква с формулой [ M(H 2 О) 6 ] n+ . | |||
Примечание: Если вам не нравятся названия комплексных ионов, вам может быть полезно перейти по этой ссылке. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | |||
Ионы непереходных металлов Все эти ионы бесцветны. (Извините, я не могу сделать действительно бесцветным!) Ионы переходных металлов Соответствующие ионы переходных металлов окрашены. Некоторые, такие как ион гексааквамарганца (II) (не показан) и ион гексаакваэрона (II), довольно слабо окрашены, но они имеют 90 333 – 90 334 цвета. Итак. . . что заставляет ионы переходных металлов поглощать длины волн видимого света (вызывая цвет), тогда как ионы непереходных металлов этого не делают? И почему цвет так сильно варьируется от иона к иону? Происхождение окраски комплексных ионов, содержащих переходные металлы Комплексные ионы, содержащие переходные металлы, обычно окрашены, в то время как аналогичные ионы непереходных металлов не окрашены. Октаэдрические комплексы Для простоты мы рассмотрим октаэдрические комплексы, которые имеют шесть простых лигандов, расположенных вокруг центрального иона металла. Аргумент на самом деле ничем не отличается, если у вас есть мультидентатные лиганды — это просто немного сложнее представить! | |||
Примечание: Если вы не уверены в форме сложных ионов, вам может быть полезно перейти по этой ссылке, прежде чем продолжить. Вам нужно только прочитать начало этой страницы. Если вы не знаете, что такое лиганд, срочно прочитайте введение в комплексные ионы! Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | |||
Когда лиганды связываются с ионом переходного металла, возникает отталкивание между электронами в лигандах и электронами на d-орбиталях иона металла. Однако из-за того, как d-орбитали расположены в пространстве, это не увеличивает все их энергии на одинаковую величину. Вместо этого он разделяет их на две группы. На схеме показано расположение d-электронов в ионе Cu 2+ до и после связывания с ним шести молекул воды. Всякий раз, когда 6 лигандов располагаются вокруг иона переходного металла, d-орбитали всегда таким образом разделяются на 2 группы — 2 с более высокой энергией, чем остальные 3. Величина энергетической щели между ними (показана синими стрелками на диаграмме) зависит от природы иона переходного металла, степени его окисления (например, 3+ или 2+) и природы лиганды. Когда белый свет проходит через раствор этого иона, часть энергии света используется для продвижения электрона с нижнего набора орбиталей в пространство верхнего набора. Каждой длине волны света соответствует определенная энергия. Предположим, что энергетическая щель на d-орбиталях комплексного иона соответствует энергии желтого света. Желтый свет будет поглощаться, потому что его энергия будет использована для продвижения электрона. Остаются другие цвета. Ваш глаз увидит проходящий свет как темно-синий, потому что синий является дополнительным цветом к желтому. | |||
Предупреждение: Это серьезное упрощение, но оно подходит для этого уровня (уровень UK A или эквивалентный). Например, он не учитывает поглощение, происходящее в широком диапазоне длин волн, а не в одном, или в случаях, когда поглощается более одного цвета из разных частей спектра. Если ваша учебная программа требует, чтобы вы знали о том, как формы d-орбиталей определяют разделение энергий, перейдите по этой ссылке для получения краткого объяснения. | |||
Как насчет комплексных ионов непереходных металлов? Непереходные металлы не имеют частично заполненных d-орбиталей. Видимый свет поглощается только в том случае, если некоторая энергия света используется для продвижения электрона точно через правильную энергетическую щель. Непереходные металлы не имеют электронных переходов, которые могут поглощать длины волн видимого света. Например, хотя скандий является членом d-блока, у его иона (Sc 3+ ) не осталось d-электронов для движения. Это ничем не отличается от иона на основе Mg 2+ или Al 3+ . Комплексы скандия (III) бесцветны, поскольку не поглощают видимый свет. В случае с цинком уровень 3d полностью заполнен – нет ни одной щели, куда мог бы продвинуться электрон. Комплексы цинка также бесцветны. Тетраэдрические комплексы Простые тетраэдрические комплексы имеют четыре лиганда, расположенных вокруг центрального иона металла. В результате, когда d-орбитали разделяются на две группы, три из них имеют большую энергию, а две другие — меньшую энергию (противоположное расположению в октаэдрическом комплексе). Если не считать этого различия в деталях, объяснение происхождения цвета с точки зрения поглощения определенных длин волн света точно такое же, как и для октаэдрических комплексов. Факторы, влияющие на цвет комплексного иона переходного металла В каждом случае мы будем выбирать конкретный ион металла в качестве центра комплекса и изменять другие факторы. Цвет меняется довольно случайным образом от металла к металлу в переходной серии. Природа лиганда Различные лиганды по-разному влияют на энергии d-орбиталей центрального иона. Некоторые лиганды обладают сильными электрическими полями, которые вызывают большую энергетическую щель, когда d-орбитали разделяются на две группы. Помните, что размер зазора определяет, какая длина волны света будет поглощаться. В списке показаны некоторые распространенные лиганды. Те, что наверху, производят наименьшее расщепление; те внизу самое большое расщепление. Чем больше расщепление, тем больше энергии необходимо для продвижения электрона с низшей группы орбиталей на высшие. Что касается цвета поглощаемого света, большая энергия соответствует более коротким длинам волн. Это означает, что по мере увеличения расщепления поглощенный свет будет смещаться от красного конца спектра к оранжевому, желтому и так далее. В химии меди(II) имеется довольно четкий случай. Если к ионам гексааквамеди(II) в растворе добавить избыток раствора аммиака, бледно-голубой (голубой) цвет сменится на темно-чернило-синий, поскольку некоторые молекулы воды в комплексном ионе заменяются аммиаком. Первый комплекс должен поглощать красный свет, чтобы дать дополнительный голубой цвет. Второй должен поглощать в желтой области, чтобы дать дополнительный цвет темно-синий. Желтый свет имеет более высокую энергию, чем красный свет. Вам нужна эта более высокая энергия, потому что аммиак вызывает большее расщепление d-орбиталей, чем вода. Однако увидеть это не всегда так просто! Попытка разобраться, что поглощается, когда у вас есть мутные цвета не на простом цветовом круге дальше по странице, гораздо большая проблема. На диаграммах приведены приблизительные цвета некоторых ионов на основе хрома(III). Очевидно, что смена лиганда меняет цвет, но пытаться объяснить цвета с точки зрения нашей простой теории непросто. | |||
Примечание: Честно говоря, я потратил пару недель, пытаясь найти простой способ сделать это на основе простого цветового круга, и в конце концов сдался.  Жизнь слишком коротка! Жизнь слишком коротка! | |||
Степень окисления металла По мере увеличения степени окисления металла увеличивается и степень расщепления d-орбиталей. Изменения степени окисления, таким образом, изменяют цвет поглощаемого света и, таким образом, цвет света, который вы видите. Возьмем другой пример из химии хрома, включающий только изменение степени окисления (от +2 до +3): Ион 2+ почти такого же цвета, как ион гексааквамеди(II), а ион 3+ имеет трудно поддающийся описанию фиолетово-сине-серый цвет. Координация иона Расщепление больше, если ион октаэдрический, чем если он тетраэдрический, и поэтому цвет будет меняться при изменении координации. К сожалению, я не могу придумать ни одного простого примера, чтобы проиллюстрировать это! Проблема в том, что ион обычно меняет координацию только при смене лиганда, а смена лиганда также меняет цвет. Например, часто упоминаемый случай происходит из химии кобальта (II) с ионами [Co(H 2 O) 6 ] 2+ и [CoCl 4 ] 2- . Разница в цветах будет комбинацией эффекта смены лиганда и изменения количества лигандов. | |||
Примечание: Существует интересный ряд соединений, описываемых как «термохромные». Они меняют цвет при нагревании. Пример: [(CH 3 CH 2 ) 2 NH 2 ] 2 CuCl 4 . Он содержит ион тетрахлоркупрата (II) в сочетании с положительным ионом, который по существу представляет собой ион аммония, в котором два атома водорода заменены этильными группами. Это твердое вещество ярко-зеленого цвета на холоде, которое становится ярко-желтым при 43°C. Ярко-зеленое твердое вещество имеет четыре атома хлора, расположенных вокруг центрального иона меди (II) в форме квадрата. Это ученая степень. Если вы хотите продолжить, вы можете выполнить поиск в Google (включая Google Книги) по запросу термохромный тетрахлорокупрат (II) . | |||
В меню комплексных ионов. . . В меню неорганической химии. . . В главное меню .
© Джим Кларк, 2003 г. (последнее изменение: ноябрь 2014 г.) | |||
Sizzling Science: Exploring the Chemistry of Fireworks
Share on Facebook
Share on Twitter
Share on Reddit
Share on LinkedIn
Share via Email
Печать
Ключевые понятия
Химикаты
Металлы
Огонь
Атомы
Энергия
Введение
Вы когда-нибудь смотрели фейерверк и задавались вопросом, как создаются все разные цвета — удивительные красные, желтые, красные, синие, пурпурные, зеленые и другие? Цвет или цвета фейерверка зависят от того, какие химические вещества, производящие цвет, в нем содержатся. Эти химические вещества представляют собой различные металлы, которые горят, когда взрывается фейерверк, и именно горящие металлы создают яркие цвета. Разные металлы дают разные, специфические цвета. В этом научном задании вам предстоит обжечь несколько металлов дома, чтобы выяснить, какие цвета они дают. Затем на следующем фейерверке вы сможете произвести впечатление на друзей и семью своими знаниями о том, что может быть причиной некоторых цветов, которые они видят!
Эти химические вещества представляют собой различные металлы, которые горят, когда взрывается фейерверк, и именно горящие металлы создают яркие цвета. Разные металлы дают разные, специфические цвета. В этом научном задании вам предстоит обжечь несколько металлов дома, чтобы выяснить, какие цвета они дают. Затем на следующем фейерверке вы сможете произвести впечатление на друзей и семью своими знаниями о том, что может быть причиной некоторых цветов, которые они видят!
Фон
Астрономы могут выяснить, из чего состоят далекие звезды (другими словами, их атомный состав), увидев, какой тип света испускает звезда. В этом упражнении вы будете делать что-то подобное, наблюдая за цветом пламени при горении различных химикатов. Как это работает? Это сводится к атомам и энергии.
Вся материя состоит из атомов. Атомы имеют ядро, окруженное электронами. Электроны, движущиеся вокруг ядра, обладают определенным количеством энергии, называемой энергетическими уровнями. Если электроны получают энергию, они перемещаются со своего энергетического уровня на более высокий через определенные ступени. Точно так же, если электроны теряют энергию, они переходят на более низкий энергетический уровень. Потерянная энергия может быть унесена в виде тепла или света (фотон). То, сколько именно энергии теряется, влияет на то, какой свет получается, что мы можем воспринимать как разницу в его цвете.
Если электроны получают энергию, они перемещаются со своего энергетического уровня на более высокий через определенные ступени. Точно так же, если электроны теряют энергию, они переходят на более низкий энергетический уровень. Потерянная энергия может быть унесена в виде тепла или света (фотон). То, сколько именно энергии теряется, влияет на то, какой свет получается, что мы можем воспринимать как разницу в его цвете.
Материалы
- Помощник для взрослых
- Поваренная соль (химическое название: хлорид натрия)
- Небольшой полиэтиленовый пакет
- Шесть бамбуковых шампуров
- Белый клей
- Сульфат меди (его можно приобрести в зоомагазинах или магазинах для аквариумов и использовать для борьбы с водорослями, или он продается в магазинах товаров для дома в качестве убийцы корней. Убедитесь, что продукт представляет собой чистый сульфат меди и что он находится в форме порошка или небольшого кристаллы.
 )
) - Спички или зажигалка
- Свеча (Выберите ту, которая может стоять самостоятельно или имеет прочную подставку.)
- Наружная поверхность (место, где вы можете безопасно зажечь свечу после того, как на улице стемнеет или стемнеет. Убедитесь, что оно находится на открытом месте, чтобы обеспечить хорошую циркуляцию воздуха.)
- Емкость для воды
- Одноразовые перчатки (Настоятельно рекомендуется для работы с сульфатом меди.)
- Защитные очки (рекомендуется)
- Фонарик (опционально)
Подготовка
- Насыпьте небольшое количество поваренной соли (примерно одну столовую ложку) в небольшой пластиковый пакет.
- Нанесите тонкий слой клея на верхушку шпажки толщиной один дюйм. Достаточно совсем немного клея.
- Окуните кончик шпажки с клеем в соль в пакете. Немного покрутите шпажку вперед и назад, чтобы кончик шампура покрылся солью.
 Отложите шампур в сторону, чтобы он подсох. Повторите это с еще двумя шампурами, чтобы у вас было три шампура с кончиками, покрытыми солью.
Отложите шампур в сторону, чтобы он подсох. Повторите это с еще двумя шампурами, чтобы у вас было три шампура с кончиками, покрытыми солью. - Далее надо взрослому обмазать еще три шпажки медным купоросом. Прочтите и соблюдайте все меры предосторожности, указанные на упаковке сульфата меди. Будьте осторожны, чтобы никто не вдыхал пыль сульфата меди и не попадал на кожу или лицо. При желании используйте одноразовые перчатки и защитные очки. Если вы не используете перчатки, не прикасайтесь к сульфату меди. Смажьте последний дюйм кончика шпажки тонким слоем клея и опустите смазанный клеем кончик в пакет с голубым медным купоросом, поворачивая его взад-вперед, чтобы покрыть кончик. Повторите это с еще двумя шампурами, чтобы у вас было три с покрытыми кончиками.
- Дайте высохнуть всем шести шампурам. Это может занять около получаса.
- Когда вы позже будете сжигать шампуры, обязательно делайте это на открытом воздухе и будьте осторожны, чтобы не вдыхать пары или дым от шампуров, покрытых медным купоросом.

- При использовании огня, сжигании шампуров и обращении с сульфатом меди требуется наблюдение взрослых.
Процедура
- В темное время суток (или сумерки) вынесите свечу, спички и подготовленные шпажки на открытое место снаружи, где можно безопасно зажечь свечу. Обеспечьте хороший поток воздуха и всегда стойте с наветренной стороны от пламени (чтобы ветерок уносил дым от вас). Также имейте при себе емкость с водой в качестве меры предосторожности.
- Попросите взрослого зажечь свечу.
- Когда свеча хорошо разгорится и вы окажетесь с наветренной стороны пламени, осторожно выньте одну из подготовленных шпажек и поднесите конец с химическим покрытием к пламени. Ни в коем случае не вдыхайте пары или дым от горящего шампура! Какого цвета горит химическое вещество? Как он соотносится с обычным цветом пламени свечи? Вы можете увидеть цвет пламени свечи или, удерживая шпажку от свечи (после того, как химические вещества загорятся) и глядя на пламя на кончике шпажки.

- Вертел также может загореться через несколько секунд. В этом случае снимите его с огня и потушите в емкости с водой.
- Повторите этот процесс для остальных пяти шампуров. (Чтобы вам было проще понять, какое химическое вещество вы сжигаете, помните, что шампуры, покрытые хлоридом натрия (поваренной солью), будут иметь белые кончики, а шампуры, покрытые сульфатом меди, — синие.) Какой цвет имеет хлорид натрия? гореть? Какого цвета горит медный купорос?
- Дополнительно: Вы можете попробовать выполнить это упражнение, используя другие металлы, которые, как известно, дают определенные цвета пламени при горении. Ознакомьтесь с разделом «Дополнительные сведения», чтобы узнать, как это сделать. Обязательно всегда изучайте и соблюдайте все надлежащие меры предосторожности при обращении с различными химическими веществами и их сжигании. Какие цвета получают другие металлы при сжигании?
Наблюдения и результаты
Наконечник, покрытый хлоридом натрия, горел чисто желто-оранжевым, а наконечник с сульфатом меди голубовато-зеленым?
Типичное пламя будет гореть желто-оранжевым с небольшим количеством синего у основания фитиля. Когда вы обжигали кончик шампура, покрытый хлоридом натрия, вы должны были видеть, что пламя было чисто желто-оранжевым (без синевы). Это потому, что когда металлический натрий сгорает, он излучает интенсивный желто-оранжевый свет. Когда вы обожгли кончик шампура, покрытый медным купоросом, вы должны были заметить, что пламя приобрело сине-зеленые следы. Это потому, что когда металлическая медь горит, она излучает голубовато-зеленый свет.
Когда вы обжигали кончик шампура, покрытый хлоридом натрия, вы должны были видеть, что пламя было чисто желто-оранжевым (без синевы). Это потому, что когда металлический натрий сгорает, он излучает интенсивный желто-оранжевый свет. Когда вы обожгли кончик шампура, покрытый медным купоросом, вы должны были заметить, что пламя приобрело сине-зеленые следы. Это потому, что когда металлическая медь горит, она излучает голубовато-зеленый свет.
Если электроны атома теряют энергию, они падают на более низкий энергетический уровень, и потерянная энергия может быть высвобождена в виде света. Различные типы атомов или элементов имеют разные промежутки между их энергетическими уровнями, что заставляет их светиться разными цветами, когда они сгорают и теряют эту энергию.
Очистка
Не забудьте потушить свечу и шампуры, когда закончите. Когда вы уверены, что они потушены (предварительно окунув их в емкость с водой), вы можете выбросить использованные шампуры в мусор.
Дополнительные сведения
Испытания пламени, Калифорнийский университет в Дэвисе, ChemWiki
Испытания пламени: окраска пламени по элементам, издание Mineral News
Веселье, научные мероприятия для вас и вашей семьи, издание Science Buddies
Радужное пламя, издание Science Buddies Buddies
Это задание было предложено вам в сотрудничестве с Science Buddies
ОБ АВТОРАХ
Медная патина | Как наносить патину на медь
Наука о том, как медь образует патину
Мебель для дома из меди придает элегантную красоту, потому что медь является «живым» металлом, то есть она меняет цвет со временем. Красота меди уникальна среди декоративных материалов, потому что изменения, которые она претерпевает, уникальны для каждого дома и места.
Естественные изменения, происходящие с медными предметами, делают их единственным в своем роде символом наследия, который трудно воспроизвести. Оттенки патины, образующиеся на поверхности медной мебели, могут хранить воспоминания о трапезах, разливах, новых домах и переменах в жизни на протяжении веков.
Медь — это больше, чем просто блестящий металл. Это металл, который можно украсить красивой резьбой, рассказывающей историю. Знание того, как образуется медная патина, позволит вам глубже оценить уникальную патину, которая появляется в истории вашей семьи. Эти знания также позволят вам влиять на то, какой цвет патины образуется и как быстро это произойдет.
Химическая реакция
Вы когда-нибудь спрашивали себя: «Почему медь зеленеет?» Образование патины на меди аналогично образованию ржавчины на железе. И то, и другое происходит, когда кислород воздуха взаимодействует с атомами металла в присутствии воды.
Медь реагирует с кислородом воздуха, в результате чего образуется диоксид меди (уравнение 1). Затем диоксид меди реагирует с большим количеством кислорода с образованием оксида меди (уравнение 2). Этот оксид меди из реакции 2 является основным виновником, который позже сформирует цвет патины. Если на поверхности меди присутствует сера, то они могут реагировать с образованием сульфида меди черного цвета (уравнение 3). Зеленоватые и голубоватые цвета патины меди возникают в результате следующего набора реакций.
Зеленоватые и голубоватые цвета патины меди возникают в результате следующего набора реакций.
Воздух содержит не только кислород, которым мы дышим. Он содержит углекислый газ, который мы выдыхаем вместе с водяным паром.
Первая реакция, придающая патине ее цвет, это когда одна молекула углекислого газа и одна молекула воды, находящиеся в воздухе, реагируют с двумя молекулами оксида меди на поверхности меди. В результате получается соединение под названием малахит (уравнение 4), цвет которого варьируется от оттенков темно-зеленого до оттенков синего.
Вторая реакция, которая добавляет цвет патине, это когда три молекулы оксида меди из уравнения 2 могут реагировать с двумя молекулами диоксида углерода и одной молекулой воды (уравнение 5). В результате получается азурит, представляющий собой соединение, цвет которого варьируется от оттенков синего до оттенков фиолетового.
Третья реакция, которая влияет на цвет патины, это когда четыре молекулы оксида меди из уравнения 2 реагируют с одной молекулой сульфата и тремя молекулами воды (уравнение 6). В результате получается соединение под названием брошантит, цвет которого варьируется от оттенков темно-зеленого до изумрудного.
В результате получается соединение под названием брошантит, цвет которого варьируется от оттенков темно-зеленого до изумрудного.
Химические реакции, описанные выше, могут быть записаны атомарными символами следующим образом:
- Уравнение 1: 4Cu + O2 → 2Cu2O [от красного до розового]
- Уравнение 2: 2Cu2O + O2 → 4CuO [черный]
- Уравнение 3: Cu + S → CuS [черный]
- Уравнение 4: 2CuO + CO2 + h3O → Cu2CO3(OH)2 [«малахит», от темно-зеленого до синего]
- Уравнение 5: 3CuO + 2CO2 + h3O → Cu3(CO3)2(OH)2 [«азурит», от синего до фиолетового]
- Уравнение 6: 4CuO + SO3 + 3h3O → Cu4SO4(OH)6 [«брохантит», от темно-зеленого до изумрудного]
Причины, по которым патина может быть зеленой и синей
Патина бывает разных цветов и узоров, которые зависят от уникального опыта, полученного каждым медным предметом. В следующем разделе объясняется физика и химия того, почему цвета патины могут так сильно различаться от места к месту и время от времени. В этом разделе в общих чертах описывается, почему присутствие определенных химических соединений может влиять на зеленые и синие оттенки, часто наблюдаемые в патине.
В следующем разделе объясняется физика и химия того, почему цвета патины могут так сильно различаться от места к месту и время от времени. В этом разделе в общих чертах описывается, почему присутствие определенных химических соединений может влиять на зеленые и синие оттенки, часто наблюдаемые в патине.
Продукты, полученные в результате уравнений 4-6 в предыдущем разделе, имеют свои собственные оттенки цвета:
- Малахит: от темно-зеленого до синего
- Азурит: от синего до фиолетового
- Брохантит: от темно-зеленого до изумрудного
В зависимости от того, какое сочетание этих трех элементов присутствует, цвет патины может варьироваться от оттенков зеленого до оттенков синего. Более темный зеленый цвет указывает на обилие малахита и брошантита, а синий указывает на обилие азурита. Каждое из этих трех соединений само по себе может образовывать красивые кристаллические структуры, подобные драгоценным камням. При смешивании в небольших количествах и удерживании на поверхности меди эти три соединения производят приятный блеск патины.
При смешивании в небольших количествах и удерживании на поверхности меди эти три соединения производят приятный блеск патины.
Интересно отметить, что человеческая кровь имеет красный цвет, потому что молекула железа, которая переносит кислород в нашей крови, — это железо, которое придает красный цвет. Моллюски, такие как крабы, имеют зеленовато-голубую кровь, потому что атом металла, который переносит кислород в их телах, — это медь.
Факторы, влияющие на образование патины
Почему со временем образуется медная патина? Как мы установили, патина на меди образуется в результате химических реакций. Чем быстрее идет химическая реакция, тем больше продуктов образуется. Несколько факторов в меди и окружающей среде могут повлиять на то, как быстро образуется патина и какие цвета она будет иметь.
Знание этих факторов не только поможет вам оценить патину на меди, но и позволит вам влиять на ее формирование. Эти знания, несомненно, впечатлят ваших друзей и родственников, поскольку они восхищаются элегантностью вашей меди и изысканностью, которую она привносит как в ваш дом, так и в ваши разговоры.
Температура
Химические реакции происходят, когда молекулы движутся и сталкиваются друг с другом. Молекулы слишком малы, чтобы увидеть их невооруженным глазом, но мы знаем, что химические реакции происходят благодаря множеству признаков, таких как изменение цвета. Тепло заставляет молекулы двигаться быстрее, независимо от того, подпрыгивают ли эти молекулы в воздухе или в жидкости. Более высокие температуры вызывают больше реакций на поверхности меди.
Чем выше температура, тем быстрее могут протекать химические реакции. Более быстрые молекулы движутся с большей энергией, поэтому их столкновения друг с другом с большей вероятностью разрушат связи внутри молекулы. Более того, высокоэнергетические столкновения помогают формировать связи между двумя молекулами. Это похоже на то, как легче растворить сахар в горячем чае, чем в чае со льдом. Вы никогда не задумывались, почему сахар всегда остается на дне вашего чая со льдом, даже если вы перемешивали его в течение пяти минут?
Географическое положение
Климат в разных регионах разный. Внутренние и пустынные районы могут быть очень жаркими, а прибрежные районы холодными. В высокогорных районах холоднее, чем в долинах. Часто место, где вы храните свои медные изделия, определяет температуру, которой подвергается ваша медь.
Внутренние и пустынные районы могут быть очень жаркими, а прибрежные районы холодными. В высокогорных районах холоднее, чем в долинах. Часто место, где вы храните свои медные изделия, определяет температуру, которой подвергается ваша медь.
Вентиляция помещений и близлежащие источники тепла
В помещениях без окон и вентиляции летом может быть очень жарко. Печи, камины, топки, обогреватели и холодильники производят тепло. Это тепло может нагреть всю комнату или близлежащие медные предметы.
Влажность и осадки
Химические реакции, приводящие к образованию патины, требуют присутствия воды. Вода существует в виде влаги в воздухе, тумана, дождя и снега. В некоторых местах высокая влажность, то есть в воздухе много влаги. В некоторых регионах наблюдаются как высокие температуры, так и высокая влажность, что способствует химическим реакциям, образующим патину. Некоторые регионы очень сухие, поэтому естественный водяной пар в воздухе минимален.
Количество осадков
В разных регионах выпадает разное количество дождя и снега. Медные предметы, подвергающиеся воздействию влажной погоды, часто промокают или становятся влажными. В некоторых регионах дожди идут большую часть года, в то время как в других дожди идут всего несколько недель в году.
Медные предметы, подвергающиеся воздействию влажной погоды, часто промокают или становятся влажными. В некоторых регионах дожди идут большую часть года, в то время как в других дожди идут всего несколько недель в году.
Ближайшие источники пара
Бытовые приборы могут производить пар, который увлажняет воздух. Чайники, водогрейные котлы и скороварки выделяют значительное количество пара, который может воздействовать на близлежащие медные предметы или предметы в той же комнате.
Примеси в меди
Медная руда, добытая из-под земли, содержит много примесей. В процессе электролиза получается чистая медь. Однако медь может содержать примеси в виде других металлов, таких как железо, никель, кобальт и молибден. Эти примеси также могут вступать в реакцию с кислородом и водяным паром, как и медь, с образованием цветных соединений.
Железо может образовывать оксиды железа красновато-коричневого цвета. Кобальт может образовывать оксиды кобальта, имеющие зеленовато-коричневый цвет. Количество примесей в меди может повлиять на цвет патины.
Количество примесей в меди может повлиять на цвет патины.
Загрязнение воздуха
В приведенном выше уравнении 6 оксид меди реагирует с оксидом серы и водой с образованием брошантита, который придает патине зеленоватый цвет. Сера существует в атмосфере в виде оксида серы. Одним из источников загрязнения воздуха оксидом серы является сжигание ископаемого топлива, такого как нефть и бензин. На самом деле, кислотный дождь, который повреждает здания и статуи, частично получает свою кислотность из-за оксидов серы, которые смешиваются с водяным паром, образуя серную кислоту. Городские районы с большим количеством автомобилей будут иметь большое количество оксидов серы в атмосфере. Другими источниками образования оксида серы в воздухе являются промышленные районы, которые выделяют дым, такие как электростанции и химические заводы.
Медная патина в действии
Теперь, когда мы ознакомились с научными данными о медной патине, приведем несколько примеров использования этого элемента дизайна в действии? Как только вы научитесь распознавать его отчетливый зеленый цвет, вы удивитесь, насколько он распространен. Медь была ключевым архитектурным материалом на протяжении всей истории.
Медь была ключевым архитектурным материалом на протяжении всей истории.
Статуя Свободы может быть самой известной медной патиной в мире. Трудно представить, что он был коричневым при первой сборке! Вот еще несколько зданий с медной патиной различных оттенков зеленого:
Берлинский собор
Берлинский собор — одно из самых узнаваемых зданий Берлина. Он был построен между 1894 и 1905 годами и имеет пять медных куполов и несколько медных статуй. Хотя он был поврежден во время Второй мировой войны, с тех пор он был восстановлен и сохранил свою культовую зеленую патину.
Посольства Северных стран, Берлин
Посольства Северных стран, также расположенные в Берлине, являются еще одним уникальным примером использования меди в архитектуре, на этот раз с отчетливо современным внешним видом. Он состоит из зданий, представляющих каждую из стран Северной Европы, окруженных зеленой медной стеной, которая огибает комплекс. По словам его архитектора, «медная полоса представляет собой последовательность из 3850 медных ламелей одного типа». Завершено в 1999, стена придает зданиям цельный вид, а ламели наклонены под разными углами, чтобы обеспечить прохождение света и воздуха.
Завершено в 1999, стена придает зданиям цельный вид, а ламели наклонены под разными углами, чтобы обеспечить прохождение света и воздуха.
Дворец Бельведер, Вена
Дворец Бельведер в Вене является примером использования меди в архитектуре барокко. Построенная в начале 1700-х годов, медная крыша все еще не повреждена 300 лет спустя и выглядит великолепно сегодня. Предположительно, дизайн был вдохновлен формой палаток османской армии, разбивших лагерь за пределами Вены.
Церковь Темппелиауко, Хельсинки
Церковь Темппелиауко в Хельсинки, Финляндия, — еще один потрясающий образец современной архитектуры. Завершенная в 1969 году, эта церковь была выкопана из твердой гранитной породы и имеет большой медный купол, окруженный 180 оконными стеклами, которые действуют как просвет.
Церковь известна своей великолепной акустикой и имеет орган с 3001 трубой! Медь дополняет прочный, похожий на пещеру интерьер, а его покрытая патиной внешность видна на вершине холма.
Юрский музей Астурии, Испания
Юрский музей Астурии, расположенный в северной части Испании на атлантическом побережье, выполнен в форме следа динозавра. Крыша сделана из фанерного каркаса, покрытого медной пластиной для защиты от морского воздуха. Поскольку здание было открыто только в 2004 году, вы можете видеть, что крыша по-прежнему в основном имеет свой первоначальный коричневато-медный цвет и постепенно покрывается зеленой патиной.
Мэрия Миннеаполиса
Мэрия Миннеаполиса была построена между 1888 и 1909 годами и первоначально имела терракотовую крышу. Но когда она начала протекать, ее заменили на медную крышу. На момент установки это была самая большая и тяжелая крыша в США, она весила более 180 000 фунтов!
Fairmont Le Chateau Frontenac, Монреаль
Chateau Frontenac — одно из самых знаковых зданий в Квебеке, Канада. Поскольку часть крыши была заменена в 2011-2012 годах, легко увидеть разницу между оригинальной крышей, на которой все еще есть зеленый налет, и обновленной крышей, которая теперь имеет блестящий коричневый цвет.
Библиотека Пекхэма, Лондон
Наконец, давайте взглянем на Библиотеку Пекхэма, удостоенное наград здание, открытое в Лондоне в 2000 году. Внешний вид здания построен из патинированной меди и имеет отчетливый ярко-зеленый цвет. внешний вид, дополненный стальной сеткой и окнами из цветного стекла. Часть здания приподнята над улицей, чтобы создать пешеходную зону и уменьшить шум от уличного движения.
Приобретенная и нанесенная патина
При проектировании с использованием меди важно иметь представление не только о том, как она будет выглядеть сегодня, но и о том, как она будет выглядеть в будущем. Не все медные здания будут образовывать патину с одинаковой скоростью, и окончательный вид патины зависит от окружающей среды.
Здания, расположенные в промышленных условиях, будут образовывать налет сульфида меди из-за кислотных дождей, а здания в сельской местности будут образовывать налет основного карбоната меди. Медь во влажной морской среде, такой как Музей Юрского периода, может ожидать более быстрого образования патины. Некоторые экстерьеры покрыты медными сплавами, а не чистой копией, которая выветривается с разной скоростью.
Некоторые экстерьеры покрыты медными сплавами, а не чистой копией, которая выветривается с разной скоростью.
Если вы не хотите ждать образования приобретенной патины, вы можете создать накладную патину с помощью химических процессов. Простая смесь уксуса и соли может создать патину на медном украшении или декоративном изделии. Мгновенная патина не подходит для использования в архитектуре, но может быть достаточно долговечной для художественного проекта или элемента дизайна интерьера.
Медь — не единственный материал, покрывающийся патиной. Котелки из углеродистой стали, терракотовые кастрюли и предметы деревянной мебели могут образовывать патину, хотя каждый из них имеет свой собственный внешний вид. Например, японские ножи традиционно изготавливаются с использованием процесса, называемого неконошобен, в котором используется кислый раствор для получения защитного голубоватого налета на лезвии из углеродистой стали.
Мастер по металлу может помочь вам определить наилучший способ ухода за медной патиной, чтобы обеспечить постоянный внешний вид или помочь ей изящно состариться с течением времени.
Типы патины, доступные в компании CopperSmith
В компании CopperSmith мы не без веской причины хвастаемся своим превосходным выбором красивой патины. У нас есть широкий выбор цветов патины, поэтому у вас не должно возникнуть проблем с поиском правильного оттенка, который соответствует вашему домашнему декору. Вам не нужно ждать годы или десятилетия, чтобы получить нужный оттенок патины. Мы предлагаем созревшую патину, которой вы можете наслаждаться немедленно.
Оттенки патины, доступные в компании CopperSmith, включают:
- Натуральная необработанная медь [красновато-розовый]
- Старая монета [красновато-коричневый]
- Антик [тускло-коричневый]
- Dark Antique [темно-коричневый]
- Бронза [темно-синий]
Мы не только понимаем нюансы различных оттенков медной патины, но и придаем медной мебели дополнительный слой красоты, которого не может достичь сама патина: текстуру. Физическая текстура меди придает глубину и придает характер патине.
Текстуры медной патины, доступные в CopperSmith, включают:
- Smooth
- Капот кованый
- Улей кованый
- Легкая чеканка
- Ручная чеканка
Красота медной патины имеет еще одно уникальное измерение глубины и элегантности. Точно так же, как чеканная текстура меди меняет то, как свет отражается от ее поверхности, трехмерная резьба захватывает воображение, предлагая скрытые истории за каждым изгибом. Изысканная резьба может придать медному изделию очаровательный характер. В качестве альтернативы, они могут добавить черту королевской гордости к обычному домашнему приспособлению.
Резьба по индивидуальному заказу в изделиях CopperSmith включает:
- Пейзажи
- Сады
- Королевские эмблемы
- Геометрические узоры
- Птицы
- Рыба
- Кирпичи
Типы медной мебели, доступные в компании CopperSmith
Компания CopperSmith предлагает медную мебель для каждой комнаты в доме: кухни, ванной комнаты, столовой, спальни и даже гаража. Просмотрите наш веб-сайт, чтобы увидеть все различные изделия из меди, которые мы предлагаем.
Просмотрите наш веб-сайт, чтобы увидеть все различные изделия из меди, которые мы предлагаем.
Медные вытяжки
Медные вытяжки над плитой могут легко стать центральным элементом кухни. Медная патина неизбежно привлечет внимание со всех уголков комнаты. Украсьте вытяжку ремешками и заклепками, которые сами по себе могут иметь фактурные узоры. Вытяжки не только выполняют важную функцию безопасности по удалению паров и твердых частиц из воздуха, но и могут радовать глаза.
Раковины
Помимо плиты, кухонная мойка является наиболее важным предметом кухонной мебели. У CopperSmith есть передние раковины и раковины в сарае, обращенные лицом к кухне, что привлекает внимание со всех концов комнаты. Раковины есть не только на кухне, но и в ванной. В гаражах могут быть раковины рядом со стиральной машиной или для повседневного использования, так что даже это помещение можно украсить медью. Некоторые люди предпочитают иметь медные раковины рядом с уличным грилем или во внутреннем дворике, что облегчает приготовление пищи и уборку. Проверьте это, если вам интересно узнать о различных стилях кухонных раковин.
Проверьте это, если вам интересно узнать о различных стилях кухонных раковин.
Ванны
Медные ванны создают неповторимое ощущение роскоши и характера. Они не только имеют элегантный дизайн, но и легко моются.
Столешницы
Медные столешницы — это универсальные предметы мебели, которые подходят для любой комнаты в доме, будь то обеденный стол, журнальный столик или тумбочка.
Примеры других изделий из меди в компании CopperSmith:
- Светильники
- Зеркала
- Ручки и ручки
- Вешалки и кольца для полотенец
- Фрески для фартука
- Вешалки для гобеленов
- И многое другое!
Как создать желаемую патину
Поскольку мы знаем химические реакции, вызывающие различные оттенки цвета в медной патине, мы можем повлиять на то, какой цвет приобретет патина и как быстро она образуется. Создание искусственной патины — обычное дело среди людей, которые делают медные украшения и посуду. Следующие советы научат вас, как патинировать медь.
Следующие советы научат вас, как патинировать медь.
Нанесение равномерного рисунка искусственной патины на крупную мебель, такую как ванны, столы и вытяжки, является более сложной задачей, чем на украшения. Для крупных предметов лучше всего выбрать кусок меди, патина которого создана профессионалами в промышленных масштабах.
Для каждого из следующих методов: чем дольше медь подвергается воздействию самодельной смеси химикатов, тем интенсивнее становится патина. Вы должны обязательно проверить силу своего лечения на мелких предметах, таких как монеты и пенни, прежде чем делать это на ваших ценных медных вещах.
Ведите записи о том, какое количество каждого химиката было смешано, что позволит вам отрегулировать силу или действие вашей самодельной смеси для патинирования в соответствии с желаемым эффектом. Протестируйте метод, чтобы увидеть, как быстро образуется патина, чтобы знать, когда остановить инкубационный период.
Обязательно соблюдайте правила техники безопасности при обращении с любым средством для уборки дома. Взрослый должен присматривать за детьми до 18 лет. Бытовые чистящие средства могут вызывать раздражение глаз, кожи, носовых ходов и легких. Они также могут быть опасны при попадании внутрь.
Взрослый должен присматривать за детьми до 18 лет. Бытовые чистящие средства могут вызывать раздражение глаз, кожи, носовых ходов и легких. Они также могут быть опасны при попадании внутрь.
Инкубация с измельченными горячими вареными яйцами
Метод горячего вареного яйца идеально подходит для создания коричневатой патины на меди. Яйца варят вкрутую, а затем разбивают на кусочки в повторно закрывающемся пластиковом пакете или контейнере, пока они еще горячие. Затем медь помещают в пакет и запечатывают от нескольких минут до нескольких часов, в зависимости от желаемого оттенка коричневой патины. Чем дольше время инкубации, тем темнее коричневый цвет. Этот метод идеально подходит для небольших изделий из меди, но с большими изделиями с его помощью трудно справиться.
Использование Miracle-Gro
Удобрение для растений Miracle-Gro является отличным окислителем меди. Для синей патины смешайте одну часть Miracle-Gro с тремя частями воды, чтобы получился раствор, которым можно распылить или протереть медь. Для получения зеленой патины смешайте одну часть Miracle-Gro с тремя частями красного винного уксуса. Патина образуется в течение 30 минут и становится постоянной в течение 24 часов.
Для получения зеленой патины смешайте одну часть Miracle-Gro с тремя частями красного винного уксуса. Патина образуется в течение 30 минут и становится постоянной в течение 24 часов.
Замачивание в белом уксусе и соли, опилках или картофельных чипсах
Замачивание меди в белом уксусе и соли создаст синий или зеленый налет. Другой способ сделать это — закопать медь в опилках или измельченных картофельных чипсах, смоченных в белом уксусе. Чем дольше закапывается медь, тем темнее становится патина.
Воздействие на медь соленой воды и паров аммиака
Опрыскайте медь раствором соленой воды, а затем поместите медь в контейнер, содержащий недетергентный аммиак. Медь не должна касаться аммиачной жидкости, а должна быть приподнята над ней.
Герметичный контейнер улавливает пары аммиака, которые затем контактируют с медью. Будьте осторожны при обращении с аммиаком: надевайте защитные перчатки, защитные очки и будьте рядом с водой на случай, если вам понадобится смыть с себя аммиак. Кроме того, не вдыхайте аммиак и не используйте его на открытом воздухе или убедитесь, что помещение хорошо проветривается.
Кроме того, не вдыхайте аммиак и не используйте его на открытом воздухе или убедитесь, что помещение хорошо проветривается.
Как естественным образом повлиять на цвет патины
Существуют способы естественного формирования патины без применения к ней химикатов. Воздействие на медь внешних условий способствует образованию патины. Наружные условия включают туман, дождь, снег и жару. Если оставить окна открытыми, изменится температура и содержание влаги в комнате, поэтому любые медные предметы в этой комнате также испытают изменения.
Вы можете намеренно оставить медную мебель рядом с источниками тепла и влаги, например, на кухне рядом с плитой или задней стенкой холодильника. Если оставить медь рядом с окном, чтобы на нее попадало много солнечного света, медь подвергается воздействию естественного тепла.
Запечатывание патины для сохранения желаемого цвета
Патину, образующуюся искусственными методами, можно легко удалить щеткой, поэтому ее необходимо запечатать, чтобы она оставалась постоянной. Герметиками могут быть воск, лак или запатентованная смесь химических веществ. В ювелирных и ремесленных магазинах продаются различные марки герметиков для защиты патины.
Герметиками могут быть воск, лак или запатентованная смесь химических веществ. В ювелирных и ремесленных магазинах продаются различные марки герметиков для защиты патины.
Поскольку патина образуется в результате химических реакций между медью и молекулами в воздухе, предотвращение попадания воздуха на медь предотвратит дальнейшее образование патины. Нанесение герметика также может быть способом сохранить патину, которая вам нравится, предотвращая ее дальнейшее изменение.
Получите совет по использованию медной мебели в вашем домашнем декоре
Эксперты компании CopperSmith ждут, чтобы дать экспертный совет о том, как спроектировать медную мебель, которая будет идеально соответствовать вашему дому и вашим потребностям. Мы поддерживаем нашу гарантию возврата денег, потому что мы верим в предоставление только лучших услуг и продуктов. Мы можем выслать вам образцы нашей медной патины, чтобы вы могли лично оценить внешний вид нашей меди.
Наши опытные дизайнеры проведут вас через процесс и варианты, избавив вас от догадок в процессе покупки и планирования. Наши знания и опыт помогут вам подобрать правильную мебель, которая подойдет для любого места и цели.
Наши знания и опыт помогут вам подобрать правильную мебель, которая подойдет для любого места и цели.
Зачем ждать дальше? Свяжитесь с нами, и мы добавим сияния в ваш день!
19 сентября 2016 г.
Комплексы меди – MEL Chemistry
Реактивы
- Сульфат меди(II)
- Дисульфит динатрия
- хлорид натрия
- Карбонат аммония
Безопасность
- Наденьте защитные перчатки и очки.

- Проведите эксперимент на пластиковом лотке и в хорошо проветриваемом помещении.
- Держите флаконы подальше от носа и рта.
- Избегайте вдыхания газообразного аммиака из флакона с карбонатом аммония.
Общие правила безопасности
- Не допускайте попадания химических веществ в глаза или рот.
- Держите маленьких детей, животных и тех, кто не носит защитные очки, подальше от экспериментальной зоны.
- Храните этот экспериментальный набор в недоступном для детей младше 12 лет месте.
- Очистите все оборудование после использования.
- Убедитесь, что все контейнеры полностью закрыты и правильно хранятся после использования.
- Убедитесь, что все пустые контейнеры утилизированы надлежащим образом.

- Не используйте оборудование, которое не входит в комплект поставки или не рекомендовано в инструкции по эксплуатации.
- Не заменяйте продукты питания в оригинальной упаковке. Утилизируйте немедленно.
Общая информация по оказанию первой помощи
- При попадании в глаза: Промыть глаза большим количеством воды, при необходимости держать глаза открытыми. Немедленно обратитесь за медицинской помощью.
- При проглатывании: прополоскать рот водой, выпить немного пресной воды. Не вызывает рвоту. Немедленно обратитесь за медицинской помощью.
- При вдыхании: Вынести пострадавшего на свежий воздух.
- При попадании на кожу и при ожогах: промыть пораженный участок большим количеством воды не менее 10 минут.

- В случае сомнений немедленно обратитесь к врачу. Возьмите с собой химикат и его контейнер.
- В случае травмы всегда обращайтесь за медицинской помощью.
Консультации для присматривающих за взрослыми
- Неправильное использование химикатов может привести к травмам и ущербу для здоровья. Проводите только те опыты, которые указаны в инструкции.
- Этот экспериментальный набор предназначен для использования только детьми старше 12 лет.
- Поскольку способности детей сильно различаются даже в пределах возрастных групп, наблюдающие взрослые должны проявлять осторожность в отношении того, какие эксперименты подходят и безопасны для них. Инструкции должны позволять наблюдателям оценивать любой эксперимент, чтобы установить его пригодность для конкретного ребенка.

- Перед началом экспериментов надзирающий взрослый должен обсудить предупреждения и информацию о безопасности с ребенком или детьми. Особое внимание следует уделять безопасному обращению с кислотами, щелочами и горючими жидкостями.
- Территория, окружающая эксперимент, должна быть свободна от каких-либо препятствий и вдали от места хранения продуктов питания. Она должна быть хорошо освещена и проветрена, а также находиться рядом с водопроводом. Должен быть обеспечен прочный стол с термостойкой столешницей.
- Вещества в одноразовой упаковке должны быть израсходованы (полностью) в течение одного эксперимента, т.е. после вскрытия упаковки.
Часто задаваемые вопросы и устранение неполадок
Мне кажется, я добавил слишком много определенного реагента. Что я должен делать?
Что я должен делать?
Не волнуйтесь! Продолжите эксперимент и посмотрите, что произойдет. Когда вы закончите, вы можете повторить эксперимент, используя правильные измерения, и сравнить свои результаты.
Когда я добавил сульфат меди(II) CuSO 4 к карбонату аммония (NH 4 ) 2 CO 3 , смесь запузырилась и зашипела. Это нормально?
Да, это так! Эта реакция высвобождает углекислый газ CO 2 , который создает пузырьки, которые вы видите. Кроме того, выделяется небольшое количество аммиака NH 3 , поэтому вы можете почувствовать легкий запах.
Все растворы во флаконах одного цвета.
Возможно, вы перепутали реагенты во время эксперимента. Повторите эксперимент, тщательно отслеживая, какой реагент вы используете.
Как избавиться от растворов?
Чтобы избавиться от растворов, слейте их в раковину и смойте большим количеством воды. Вы можете почувствовать легкий запах NH 3 и SO 2 . Если вы это сделаете, проветрите комнату после эксперимента.
Вы можете почувствовать легкий запах NH 3 и SO 2 . Если вы это сделаете, проветрите комнату после эксперимента.
Другие эксперименты
Медное дерево
Горящий магний
Кислородно-водородный
Светящееся вещество
Пошаговые инструкции
Налейте три бесцветных соединения в отдельные флаконы.
Добавьте сульфат меди CuSO 4 во флаконы.
Смешайте растворы.
Утилизация
Утилизируйте твердые отходы вместе с бытовым мусором. Вылейте растворы в раковину и промойте большим количеством воды.
Вылейте растворы в раковину и промойте большим количеством воды.
Научное описание
Раствор сульфата меди CuSO 4 имеет красивый синий цвет, но этот цвет меняется при смешивании с другими соединениями. Почему это? Как оказалось, цвет в основном возникает из-за взаимодействия частиц меди — ионов меди Cu 2+ с их окружением. Например, в растворе CuSO 4 они окружены молекулами H 2 O, и такое расположение приводит к яркому синему цвету. Кстати, кристаллы сульфата меди своим голубым цветом тоже обязаны воде, в чем вы можете убедиться в другом эксперименте из этой серии.
Карбонат аммония (NH 4 ) 2 CO 3 дает некоторое количество молекул аммиака NH 3 в растворе, которые легко заменяют молекулы воды вокруг Cu 2+ . Такое расположение, известное как медно-аммиачный комплекс, дает насыщенный темно-синий цвет.
Раствор хлорида натрия NaCl содержит ионы хлорида Cl \- . Когда Cu 2+ окружен ими, вы можете наблюдать действительно красивый зеленый цвет.
Что динатрия дисульфит Na 2 S 2 O 5 немного сложнее. С одной стороны, он реагирует с Cu 2+ , превращая их в Cu 1+ . С другой стороны, он легко дает SO 2 молекул. Последний может образовывать комплекс с Cu + , что придает раствору желто-оранжевый оттенок.
Наука оживилась: Химия/Решения
Водные растворы и осадки медь
В водных растворах медь существует в +1 и +2
степень окисления. Степень окисления +1 нестабильна как обычный аква-ион и
как такового не существует. Однако в сочетании со многими другими лигандами
Степень окисления +1 стабильна, но очень склонна к окислению в воздухе.
Степень окисления +2 стабильна во всем диапазоне рН как в виде акваиона, так и в виде
водный осадок или в виде комплекса. Медь (II) имеет очень богатый водный раствор.
химии и образует многочисленные комплексы, как в кислых, так и в щелочных
решения. Особенно щелочные комплексы часто имеют красивый королевский цвет.
синие цвета. Медь (II) слабо амфотерна. В сильных щелочных растворах или
при очень низких концентрациях медь образует темно-синий купратный ион.
Медь (II) имеет очень богатый водный раствор.
химии и образует многочисленные комплексы, как в кислых, так и в щелочных
решения. Особенно щелочные комплексы часто имеют красивый королевский цвет.
синие цвета. Медь (II) слабо амфотерна. В сильных щелочных растворах или
при очень низких концентрациях медь образует темно-синий купратный ион.
Степень окисления +1
Эта степень окисления, безусловно, не самая распространенная. степень окисления. Некоторые соединения меди в степени окисления +1 доступен в продаже, но можно получить только оксид Cu 2 O и хранят таким образом, чтобы он оставался чистым и не окислялся кислородом воздуха.
В водном растворе медь (I) существует только в форме
комплексные ионы с другими лигандами, кроме воды. С Cu + (водный)
почти мгновенно диспропорционирует Cu 2+ (водн.)
и Cu(s). Комплексы меди (I) могут образовываться как в кислой
и щелочные растворы.
Здесь раствор аммиачной меди (I) раствор показано. Этот раствор содержит ионы Cu(NH 3 ) 2 + (водн.), вместе с избытком аммиака. Растворы меди (I) обычно бесцветны.
На обеих картинках показана одна и та же пробирка, всего несколько секунд
отдельно во времени. На этих рисунках видно, как легко такой раствор окисляется
кислород из воздуха. На левой картинке показан бесцветный раствор, но
поверхность жидкости уже голубая и стекло пробирки над
жидкость тоже синего цвета. При легком встряхивании пробирки можно наблюдать
синие кудри, идущие вниз. Это происходит из-за окисления воздуха на поверхности
жидкость водного бесцветного Cu(NH 3 ) 2 + (водн.)
до темно-синего водного Cu(NH 3 ) 4 2+ (водн.).
По-видимому, последнее вызывает увеличение плотности жидкости, так что
синий раствор движется вниз в жидкости. Если жидкость осталась
контакт с воздухом в течение более длительного времени, затем он становится темно-синим.
Примечание: чтобы показать эту бесцветную медь (I) небольшое избыточное количество дитионита натрия было добавлено к темно-синий раствор сульфата меди (II) в избытке аммиака. Без добавлением этого сильного восстановителя просто невозможно показать бесцветный раствор соединения меди (I).
Также могут быть растворы меди (I) в кислой растворы, такие как комплекс CuCl 2 (водн.). Дано подробное описание этого иона и его свойств. здесь.
Хотя комплексы меди (I) могут образовываться в сильно
щелочные растворы, при действительно высоких значениях pH многие из этих комплексов нестабильны
больше. Если, например. добавляют концентрированный раствор гидроксида натрия.
бесцветный раствор аммиака, как показано выше, затем очень мелкодисперсный светлый
сразу выпадает желтый осадок. Этот осадок представляет собой водную медь (I).
оксид или что-то вроде гидроксида меди (I). Его точный состав не
однако совершенно ясно. Лучшее описание этого соединения, вероятно, Cu 2 О п Н 2 О. Это очень хорошее соединение красивого насыщенного темно-желтого цвета.
Тот факт, что такие желтые осадки могут образовываться из соединений меди, не
известен очень хорошо.
Это очень хорошее соединение красивого насыщенного темно-желтого цвета.
Тот факт, что такие желтые осадки могут образовываться из соединений меди, не
известен очень хорошо.
Другая форма оксида меди (I) известна гораздо лучше.
Это соединение кирпично-красного цвета, образованное медленным восстановлением щелочной
комплексный раствор меди (II). Примером этого является хорошо известная модель Фелинга.
реагент, содержащий комплекс тартрат/медь (II) в избытке раствора
гидроксид натрия. При добавлении мягкого восстановителя (например, глюкозы или глицерина)
такого раствора, то образуется осадок кирпично-красного цвета из очень мелкокристаллического
Cu 2 О. Образование этого осадка происходит в течение нескольких часов при комнатной
температура. Осадок, образующийся таким образом, очень плотный. Когда
пробирку встряхивают, затем через несколько секунд большая часть осадка уже
снова осела на дно, и только мельчайшие частицы остались в
жидкость.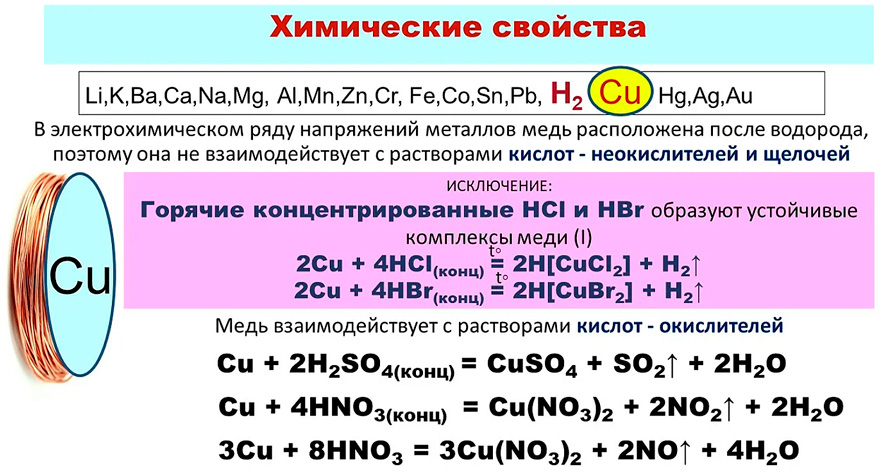 Здесь приведены изображения кирпично-красного оксида меди (I). Слева
изображение показывает оксид меди (I), встряхнутый в жидкость, правое изображение
выпадает компактный осадок, из которого декантируют жидкость и тест
трубка держится вверх дном.
Здесь приведены изображения кирпично-красного оксида меди (I). Слева
изображение показывает оксид меди (I), встряхнутый в жидкость, правое изображение
выпадает компактный осадок, из которого декантируют жидкость и тест
трубка держится вверх дном.
Примечание: Это мое личное наблюдение, что чем быстрее процесс образования оксида меди (I), тем легче цвет. Однако это наблюдение о цвете оксида меди (I) не удалось подтвердить текстами из признанных учебников.
Итак, при образовании оксида меди (I)
мгновенно из раствора, например, при добавлении гидроксида натрия к
аммиачный раствор меди (I), то образуется соединение ярко-желтого цвета. Когда
оксид образуется в течение нескольких часов, т.е. восстановлением глюкозой, затем
оксид кирпично-красный. Также можно получить промежуточные цвета. Например. при добавлении
раствора сульфата меди (II) в теплый щелочной раствор натрия
аскорбата образуется ярко-оранжевый осадок. Формирование этого апельсина
состав не мгновенный. Сначала образуется грязно-зеленый осадок,
проходит несколько секунд, прежде чем он станет ярко-оранжевым.
Сначала образуется грязно-зеленый осадок,
проходит несколько секунд, прежде чем он станет ярко-оранжевым.
Степень окисления +2
Это самая известная степень окисления меди. и он же самый стабильный. В воде медь образует аква-ионы небесно-голубого цвета. Cu(H 2 O) 6 2+ (водн.). Этот ион имеет тенденцию к некоторому гидролизу в воде, а когда раствор соли меди (II) выдерживается длительное время, затем жидкость становится немного кислой на дне осаждается небольшое количество основной соли меди.
Изображение раствора, содержащего простой водный раствор меди (II) ионы приведены здесь:
При добавлении раствора гидроксида натрия к такому
раствор соли меди (II), затем ярко-синий осадок меди (II)
образуется гидроксид. Это кристаллическое твердое вещество, которое довольно твердое. Когда
решения, например. сульфат меди и гидроксид натрия достаточно высокой
концентрации добавляются друг к другу, тогда осадок становится таким твердым,
что частицы едва ли могут быть разрушены сильным встряхиванием. Левая картинка
показывает осадок Cu(OH) 2 сразу после создания
На правом рисунке показана та же пробирка после довольно сильного встряхивания. Как
На правом рисунке показано, что бесцветный раствор гидроксида натрия все еще находится в
дно, не смешиваясь с остальной жидкостью. Это показывает, что осадок имеет
достаточно мощная структура.
Левая картинка
показывает осадок Cu(OH) 2 сразу после создания
На правом рисунке показана та же пробирка после довольно сильного встряхивания. Как
На правом рисунке показано, что бесцветный раствор гидроксида натрия все еще находится в
дно, не смешиваясь с остальной жидкостью. Это показывает, что осадок имеет
достаточно мощная структура.
Замечательным свойством гидроксида меди (II) является то, что он теряет воду при нагревании, даже если осадок погружен в воду! На следующих двух рисунках показана одна и та же пробирка с нагретым до примерно 90 С. Весь осадок чернеет снизу (источник нагревание), и при встряхивании пробирки осадок довольно легко разрушается. разойтись и все становится черным.
При добавлении раствора гидроксида натрия к горячему
раствор соли меди (II), то выпадает черный осадок
немедленно. Черный осадок (или лучше: очень темно-коричневый, если наблюдать очень
осторожно), представляет собой оксид меди (II), CuO.
При добавлении раствора соли меди (II) к очень концентрированный раствор гидроксида, затем образуется некоторое количество купрата. Это показывает что медь (II) слегка амфотерна. Ион купрата остается в растворе при очень высокой концентрации гидроксида, но он также может оставаться в растворе при более низкие концентрации гидроксида, но тогда концентрация меди должна также быть низким. На следующих двух рисунках показано образование раствора, содержащий темно-синий ион купрата, Cu(OH) 4 2 , иногда сформулирован как CuO 2 2 (водн.).
На левом рисунке показан умеренно концентрированный раствор.
гидроксида натрия и очень разбавленного раствора медного купороса (правая проба
пробирка с бледно-голубой жидкостью). На правом рисунке показан результат добавления
раствора медного купороса к раствору едкого натра, соединенному с
какая-то тряска. Жидкость прозрачная и имеет приятный голубой цвет. Когда больше меди
добавляли бы сульфат, тогда он становился бы мутным.
Когда больше меди
добавляли бы сульфат, тогда он становился бы мутным.
На следующем рисунке показан более концентрированный раствор. купрат-иона. Он был приготовлен путем добавления твердого сульфата меди в очень концентрированный раствор едкого натра и нагревание этого раствора, при этом встряхивания, в течение нескольких минут. Как показано на рисунке, цвет иона купрата приятный темно-синий. На дне находится твердый оксид меди (II). объяснение образования этого дано выше.
Щелочные комплексы меди в степени окисления +2
А
Очень типичным и хорошо известным свойством меди (II) является то, что она образует глубокие королевские
синие комплексы со многими соединениями в щелочных средах. Самый известный
Примером этого является тетрааминовый комплекс меди (II), образованный при добавлении
избыток аммиака к раствору соли меди (II). Другие подобные комплексы,
тем не менее, могут быть сформированы, например, добавлением меди (II) в щелочной раствор
глицерин, глюкоза или тартрат натрия.




 Этим можно ответить на вопрос, какого цвета медь. Если на свет посмотреть тонкую пластинку, то она будет зеленовато-голубого оттенка.
Этим можно ответить на вопрос, какого цвета медь. Если на свет посмотреть тонкую пластинку, то она будет зеленовато-голубого оттенка. Для удаления загрязнений используют водный раствор уксуса. Таким способом происходит удаление и окислов.
Для удаления загрязнений используют водный раствор уксуса. Таким способом происходит удаление и окислов.


 Ионы меди(II) в растворе поглощают свет в красной области спектра.
Ионы меди(II) в растворе поглощают свет в красной области спектра. На схеме показан один из возможных вариантов этого. Поиск в интернете выдаст много разных версий!
На схеме показан один из возможных вариантов этого. Поиск в интернете выдаст много разных версий!
 Используйте кнопку НАЗАД в браузере, чтобы быстро вернуться на эту страницу.
Используйте кнопку НАЗАД в браузере, чтобы быстро вернуться на эту страницу.  Заряд этих ионов обычно равен 2+ или 3+.
Заряд этих ионов обычно равен 2+ или 3+. Это говорит о том, что частично заполненные d-орбитали должны каким-то образом участвовать в формировании цвета. Помните, что переходные металлы определяются как имеющие частично заполненные d-орбитали.
Это говорит о том, что частично заполненные d-орбитали должны каким-то образом участвовать в формировании цвета. Помните, что переходные металлы определяются как имеющие частично заполненные d-орбитали. Это повышает энергию d-орбиталей.
Это повышает энергию d-орбиталей. Красный свет имеет наименьшую энергию в видимой области. Фиолетовый свет обладает наибольшей энергией.
Красный свет имеет наименьшую энергию в видимой области. Фиолетовый свет обладает наибольшей энергией.
 Опять же лиганды влияют на энергию d-электронов в ионе металла. На этот раз, конечно, лиганды расположены в пространстве по-другому относительно формы d-орбиталей.
Опять же лиганды влияют на энергию d-электронов в ионе металла. На этот раз, конечно, лиганды расположены в пространстве по-другому относительно формы d-орбиталей. Другие имеют гораздо более слабые поля, создающие гораздо меньшие промежутки.
Другие имеют гораздо более слабые поля, создающие гораздо меньшие промежутки.
 Вы не можете изолировать эффект изменения координации.
Вы не можете изолировать эффект изменения координации. У желтого они расположены в виде искаженного тетраэдра. Изменение цвета связано с изменением расположения лигандов.
У желтого они расположены в виде искаженного тетраэдра. Изменение цвета связано с изменением расположения лигандов. . .
. .  )
) Отложите шампур в сторону, чтобы он подсох. Повторите это с еще двумя шампурами, чтобы у вас было три шампура с кончиками, покрытыми солью.
Отложите шампур в сторону, чтобы он подсох. Повторите это с еще двумя шампурами, чтобы у вас было три шампура с кончиками, покрытыми солью.




