Химия углекислый газ: Anti-DDoS Flood Protection and Firewall
alexxlab | 25.08.1995 | 0 | Разное
Углекислый газ – формула, молярная масса, физические свойства (8 класс, химия)
4.3
Средняя оценка: 4.3
Всего получено оценок: 384.
4.3
Средняя оценка: 4.3
Всего получено оценок: 384.
Диоксид углерода, оксид углерода, углекислота – все эти названия одного вещества, известного нам, как углекислый газ. Так какими же свойствами обладает этот газ, и каковы области его применения?
Углекислый газ и его физические свойства
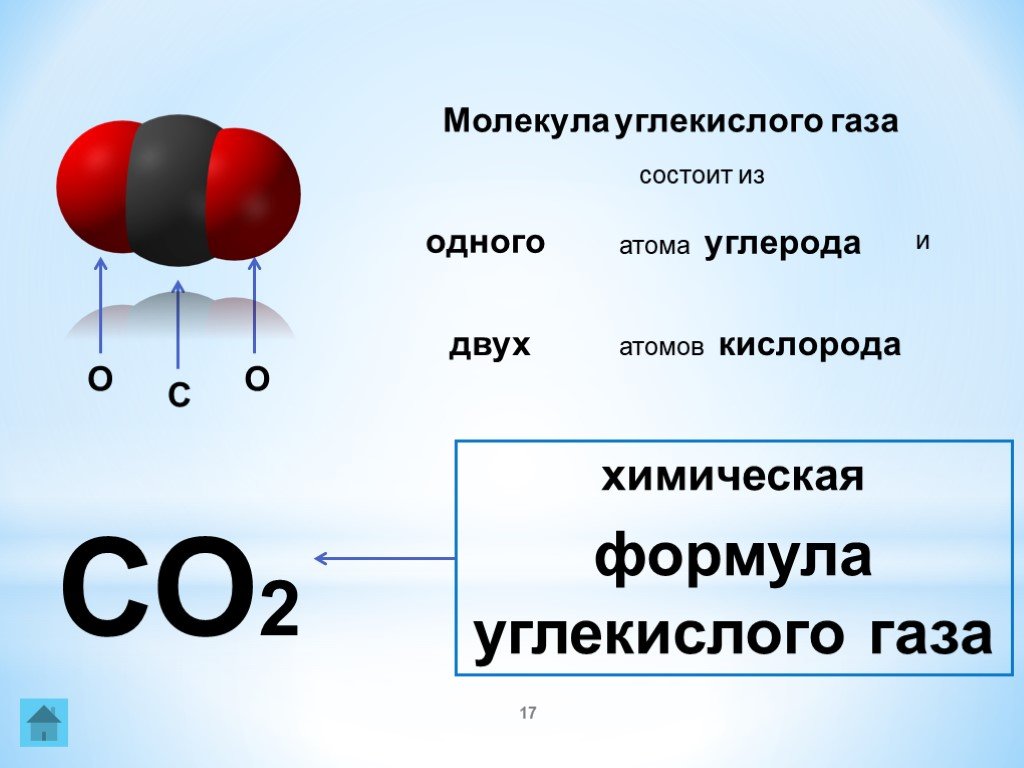
Углекислый газ состоит из углерода и кислорода. Формула углекислого газа выглядит так – CO₂. В природе он образуется при сжигании или гниении органических веществ. В воздухе и минеральных источниках содержание газа также достаточно велико. кроме того люди и животные также выделяют диоксид углерода при выдыхании.
Рис. 1. Молекула углекислого газа.Диоксид углерода является абсолютно бесцветным газом, его невозможно увидеть. Также он не имеет и запаха. Однако при его большой концентрации у человека может развиться гиперкапния, то есть удушье. Недостаток углекислого газа также может причинить проблемы со здоровьем. В результате недостатка это газа может развиться обратное состояние к удушью – гипокапния.
Недостаток углекислого газа также может причинить проблемы со здоровьем. В результате недостатка это газа может развиться обратное состояние к удушью – гипокапния.
Если поместить углекислый газ в условия низкой температуры, то при -72 градусах он кристаллизуется и становится похож на снег. Поэтому углекислый газ в твердом состоянии называют «сухой снег».
Рис. 2. Сухой снег – углекислый газ.Углекислый газ плотнее воздуха в 1,5 раза. Его плотность составляет 1,98 кг/м³ Химическая связь в молекуле углекислого газа ковалентная полярная. Полярной она является из-за того, что у кислорода больше значение электроотрицательности.
Важным понятием при изучении веществ является молекулярная и молярная масса. Молярная масса углекислого газа равна 44. Это число формируется из суммы относительных атомных масс атомов, входящих в состав молекулы. Значения относительных атомных масс берутся из таблицы Д.И. Менделеева и округляются до целых чисел. Соответственно, молярная масса CO₂ = 12+2*16.
w = n * Ar / Mr
n – число атомов или молекул.
Ar – относительная атомная масса химического элемента.
Mr – относительная молекулярная масса вещества.
Рассчитаем относительную молекулярную массу углекислого газа.
Mr(CO₂) = 14 + 16 * 2 = 44 w(C) = 1 * 12 / 44 = 0,27 или 27 % Так как в формулу углекислого газа входит два атома кислорода, то n = 2 w(O) = 2 * 16 / 44 = 0,73 или 73 %
Ответ: w(C) = 0,27 или 27 %; w(O) = 0,73 или 73 %
Химические и биологические свойства углекислого газа
Углекислый газ обладает кислотными свойствами, так как является кислотным оксидом, и при растворении в воде образует угольную кислоту:
CO₂+H₂O=H₂CO₃
Вступает в реакцию со щелочами, в результате чего образуются карбонаты и гидрокарбонаты. Этот газ не подвержен горению.
При нагревании углекислый газ распадается на угарный газ и кислород:
2CO₃=2CO+O₃.
Как и другие кислотные оксиды, данный газ легко вступает в реакцию с другими оксидами:
СaO+Co₃=CaCO₃.
Углекислый газ входит в состав всех органических веществ. Круговорот этого газа в природе осуществляется с помощью продуцентов, консументов и редуцентов. В процессе жизнедеятельности человек вырабатывает примерно 1 кг углекислого газа в сутки. При вдохе мы получаем кислород, однако в этот момент в альвеолах образуется углекислый газ. В этот момент происходит обмен: кислород попадает в кровь, а углекислый газ выходит наружу.
Получение углекислого газа происходит при производстве алкоголя. Также этот газ является побочным продуктом при получении азота, кислорода и аргона. Применение углекислого газа необходимо в пищевой промышленности, где углекислый газ выступает в качестве консерванта, а также углекислый газ в виде жидкости содержится в огнетушителях.
Что мы узнали?
Углекислый газ – вещество, которое в нормальных условиях не имеет цвета и запаха. помимо своего обычного названия – углекислый газ, его также называют оксидом углерода или диоксидом углерода.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
Яна Василькова
8/10
Карина Гаврилова
10/10
Елена Асадова
7/10
Лиана Бизина
10/10
Кристина Микляева
10/10
Оценка доклада
4.3
Средняя оценка: 4.3
А какая ваша оценка?
“МЯГКАЯ” ХИМИЯ | Наука и жизнь
В поисках путей утилизации углекислого газа – побочного продукта многих технологий, а также одного из главных виновников “парникового эффекта” – сегодня выдвигается множество проектов (см. “Наука и жизнь” № 2, 2001 г.). Среди них такие экзотические, как захоронение сжиженного CO2 на океанских глубинах или закачка этого газа в выработанные под морским дном газовые емкости. В предлагаемом материале рассказыв ается о вполне “земном” решении данной проблемы и дается информация о некоторых сферах промышленности, в которых СО2 уже с успехом работает. Исследователи нашли способ использовать углекислый газ в ранее необычных для него областях производства, где он станет основой новых технологий. В результате отрицательные нагрузки этого газа на природу ослабнут.
“Наука и жизнь” № 2, 2001 г.). Среди них такие экзотические, как захоронение сжиженного CO2 на океанских глубинах или закачка этого газа в выработанные под морским дном газовые емкости. В предлагаемом материале рассказыв ается о вполне “земном” решении данной проблемы и дается информация о некоторых сферах промышленности, в которых СО2 уже с успехом работает. Исследователи нашли способ использовать углекислый газ в ранее необычных для него областях производства, где он станет основой новых технологий. В результате отрицательные нагрузки этого газа на природу ослабнут.
В мире сегодня ежегодно используют 15 миллионов тонн органических растворителей и еще большее количество воды или водных смесей – таковы требования разных технологических процессов. Однако есть возможность такую “мокрую” химию заменить “сухой”, основанной на СО2. Об этом говорится в работе доктора Иозефа Де Симоне, обладателя премии Президента США, учрежденной за успехи в химии, не приносящей вреда природе. Сейчас ученый создает экологически безупречный растворитель для промышленности. На двух примерах Де Симоне показывает, как углекислый газ становится основой новой химии.
Сейчас ученый создает экологически безупречный растворитель для промышленности. На двух примерах Де Симоне показывает, как углекислый газ становится основой новой химии.
***
На фирме “Дюпон” (США) заканчивается сборка огромного агрегата для производства тефлона, известного многим как покрытие “непригорающих” сковородок. До настоящего времени слой тефлона изготавливался при участии соединений фтора – элемента, получившего название “убийца озонового слоя” нашей планеты. Разработчики фирмы предложили ввести в прцесс двуокись углерода: выигрывает экология, а тефлон, получаемый по более простой технологии, станет значительно дешевле.
***
Неожиданное применение СО2: он способен служить чистящим средством. Немецкая фирма “Мицелл” уже готова внедрить оборудование для сухой очистки посуды в многолюдных ресторанах “Макдоналдс”. Но это лишь одно из направлений работ. Наиболее серьезный проект – очистка с помощью СО2 металлов от жиров и масел, которые применяют при резании, точении и фрезеровании деталей. Здесь масштабы утилизации углекислого газа поистине грандиозны.
Здесь масштабы утилизации углекислого газа поистине грандиозны.
Текстиль – материал, совсем не похожий на металл, но оказалось, что и его можно отмывать с помощью СО2 в специальных машинах, заменяющих стиральные.
“Сухая” стирка происходит таким образом. Клиент кладет грязные вещи в мешок (в нем же он затем получит исполненный заказ). Процесс состоит из двух либо трех периодов по четверти часа, во время которых одежда находится в барабане, в принципе, такой же конструкции, что и в обычной стиральной машине, но только большего размера и, главное, герметически закрывающемся.
Барабан, в который заложены мешки с грязной одеждой, заполняют углекислым газом, находящимся под давлением, в результате чего он переходит в жидкое состояние. Стирка происходит, когда содержимое барабана нагревается до 31оС, а давление в нем достигает 72,9 атмосферы (именно потому, что обработка материалов идет при сравнительно низких параметрах, химию СО2 и называют “мягкой”). Жидкий углекислый газ энергично закипает, наступает состояние равновесия жидкости и газа, в котором они становятся неотличимыми друг от друга. Ученые называют такое фазовое состояние двуокиси углерода сверхкритичес ким (сокращенно – ск; и такая двуокись углерода обозначается как скСО
Жидкий углекислый газ энергично закипает, наступает состояние равновесия жидкости и газа, в котором они становятся неотличимыми друг от друга. Ученые называют такое фазовое состояние двуокиси углерода сверхкритичес ким (сокращенно – ск; и такая двуокись углерода обозначается как скСО
В этом-то сверхкритическом состоянии углекислота и становится превосходным моющим средством. После “стирки” в барабан добавляют детергент – вещество, похожее на обычный стиральный порошок, и ткань “прополаскивается” в этой смеси. Потом давление снижают, СО2 снова становится газом, который уходит из ткани, захватывая с собой частички грязи и детергента (они остаются на фильтрах). Чистую двуокись углерода после каждой “стирки” улавливают, сжимают, и она снова готова к обработке следующей партии одежды. За каждый цикл улетучивается лишь два процента СО2.
Через 40-45 минут клиент получает белье, очищенное от жира, пятен, грязи, прохладное, свежее, словно обдутое морозным ветром.
У нового способа чистки много достоинств . Низкая температура сохраняет ткань, ее волокна не рвутся; скСО 2, словно взрывная волна, проникает в поры и внутрь волокон и так же мгновенно при снижении давления в барабане удаляется из них. Это дает возможность “стирать” очень “деликатные” вещи, которые обычно не доверяют машине и химчистке. Ткани после стирки ничем не пахнут, тогда как запах обычных моющих и чистящих средств, например перхлорэтилена, стойко держится на вещах. А ведь он относится к вредным и для окружающей среды, и для нервной системы человека. К сожалению, у перхлорэтилена есть важное преимущество: он дешев. Да и машина для стирки с помощью двуокиси углерода стоит пока дорого – 150 000 долларов. Новый метод выдерживает конкуренцию лишь благодаря льготным налогам, поскольку во многих странах такого рода предприятия относятся к экологически чистым и поддерживаются правитель ствами.
***
Развитие новой, безопасной для природы химии идет по разным направлениям, правда, пока чаще в лабораторных и полупромышленных условиях.
В семидесятых годах Курт Цозель, сотрудник нобелевского лауреата Карла Циглера, занялся изучением свойств СО2 в сверхкритическом состоянии. Работы проводились в сотрудничестве с известной кофейной фирмой “Хааг”. Цозель выяснил, что углекислый газ в сверхкритическом состоянии может выборочно растворить одно из веществ, находящихся в смеси, а потом, при понижении давления, выделить его из смеси. Он использовал это свойство для извлечения кофеина из бобов кофе. Способ оказался весьма удачным, и теперь в Германии именно так обрабатывают 100 000 тонн зеленых зерен ежегодно.
На пивоваренных заводах скСО2 позволяет усиливать или ослаблять характерный для пива аромат. А в Австрии виноделы использовали это его свойство для сохранения букета вин. Потребность в природных ароматических добавках, получаемых из трав, пряностей, лекарственных растений, с каждым годом растет. Пока при их извлечении применяют высокое давление, но не далек тот день, когда скСО2 сможет решить многие задачи индустрии запахов без помощи повышенных давлений, значит – дешевле.
Потребность в природных ароматических добавках, получаемых из трав, пряностей, лекарственных растений, с каждым годом растет. Пока при их извлечении применяют высокое давление, но не далек тот день, когда скСО2 сможет решить многие задачи индустрии запахов без помощи повышенных давлений, значит – дешевле.
***
Сотрудники Института угля в Руре доктор А. Фюрстнер и профессор В. Лейтнер на базе все той же двуокиси углерода в ее сверхкритическом состоянии создают новую химию растворителей. Как известно, многие химические реакции идут только в присутствии катализатора, без него процесс либо очень замедляется, либо вовсе не начинается. Такие классические катализаторы, как платина, родий или никель, нерастворимы в скСО2. Поэтому химики считали его лишь средством, “вытягивающим” какое-либо вещество из смеси, но никак не растворителем. Сейчас ситуация изменилась. Ученые нашли простой способ заставить многие металлы-катализаторы растворяться в скСО2 и “плавать” в нем, как рыба в воде. Для этого к ним присоединяют своего рода “плавники” из полимерных фторсодержащих молекул. Теперь можно проводить каталитические процессы, не используя вредные органически е растворител и.
Для этого к ним присоединяют своего рода “плавники” из полимерных фторсодержащих молекул. Теперь можно проводить каталитические процессы, не используя вредные органически е растворител и.
***
Реакциями в среде скСО2 легко управлять. Это позволило получать многие органические вещества, представляющие собой относительно крупные циклические (кольцеобразные) молекулы, например антибиотики, намного проще, чем привычными способами. Циклы-кольца образуются из длинных молекул при смыкании их концевых участков. Но не все молекулярные цепочки смыкаются в кольца при химической реакции. Иногда концы соседних молекул сращиваются и образуют длинные молекулярные нити, так называемые линейные полимеры. При производстве антибиоти ков такая полимеризация крайне нежелательна.
В сверхкритической двуокиси углерода удается этот процесс прервать. В среде скСО2, так же как и при высоком давлении, реакционная смесь делается “плотнее”: молекулы заметно теряют подвижность, в результате чего они реже сталкиваются с соседними молекулами, а чаще замыкаются сами на себя, формируя кольца. Очень важно и то, что в среде двуокиси углерода кольца получаются правильной формы.
Очень важно и то, что в среде двуокиси углерода кольца получаются правильной формы.
***
Ближайшая задача – научиться получать на основе скСО2 различные виды пластмасс для производства мебели, упаковочных материалов, ковров, обоев и даже деталей автомобилей. Все эти изделия будут дешевле производимых сегодня и, что важно, без характерных запахов, присущих употребляемым ныне растворителям.
Вполне возможно, что мир стоит на пороге решительных перемен в производстве пластмасс. Эта отрасль, как известно, развивается наиболее быстрыми темпами, опережая металлургию чугуна и алюминия. Сегодня объем ее продукции в мире измеряется сотнями миллионов тонн.
Приходит экологически чистое и более дешевое химическое производство, основанное на использовании двуокиси углерода, которая до сих пор считалась отходом энергетики, виновником возникнове ния “парникового эффекта” и связанных с ним серьезных климатических катастроф.
Можно надеяться, что именно здесь человечество найдет один из надежных и недорогих “складов”, куда запрячет излишки СО2.
углекислый газ | Определение, формула, использование и факты
фотосинтез
Посмотреть все СМИ
- Ключевые люди:
- Джозеф Блэк Ян Баптиста ван Гельмонт Джерард Питер Койпер
- Похожие темы:
- парниковый газ углеродный след Кривая килинга углеродная компенсация углеродный налог
Просмотреть весь связанный контент →
диоксид углерода , (CO 2 ), бесцветный газ со слабым резким запахом и кислым вкусом. Это один из наиболее важных парниковых газов, связанных с глобальным потеплением, но он является второстепенным компонентом атмосферы Земли (около 3 объемов на 10 000), образующимся при сгорании углеродосодержащих материалов, ферментации и дыхании животных. растениями в фотосинтезе углеводов. Присутствие газа в атмосфере не позволяет части лучистой энергии, полученной Землей, возвращаться в космос, вызывая так называемый парниковый эффект. В промышленности его извлекают для самых разных целей из дымовых газов, в качестве побочного продукта при получении водорода для синтеза аммиака, из печей для обжига извести и из других источников.
Углекислый газ был признан газом, отличным от других, в начале 17 века бельгийским химиком Яном Баптиста ван Гельмонтом, который наблюдал его как продукт как брожения, так и сгорания. Он сжижается при сжатии до 75 кг на квадратный сантиметр (1071 фунт на квадратный дюйм) при 31 ° C (87,4 ° F) или до 16–24 кг на квадратный сантиметр (230–345 фунтов на квадратный дюйм) при температуре от -23 до – 12 ° C (от -10 до 10 ° F). К середине 20 века большая часть углекислого газа продавалась в жидком виде. Если дать жидкости расшириться до атмосферного давления, она охлаждается и частично замерзает до твердого вещества, похожего на снег, называемого сухим льдом, которое возгоняется (переходит непосредственно в пар, не плавясь) при температуре -78,5 °C (-109°C)..3 °F) при давлении нормальной атмосферы.
Викторина “Британника”
Атмосфера: правда или вымысел?
Земля единственная планета с атмосферой? От углекислого газа до космических путешествий: очистите воздух в этой викторине об атмосфере Земли.
При обычных температурах углекислый газ практически не реагирует; выше 1700 ° C (3100 ° F) он частично разлагается на окись углерода и кислород. Водород или углерод также превращают его в монооксид углерода при высоких температурах. Аммиак реагирует с углекислым газом под давлением с образованием карбамата аммония, а затем мочевины, важного компонента удобрений и пластмасс. Углекислый газ мало растворим в воде (1,79объемы на объем при 0 ° C и атмосферном давлении, большие количества при более высоких давлениях), образуя слабокислый раствор. Этот раствор содержит двухосновную кислоту, называемую угольной кислотой (H 2 CO 3 ).
Углекислый газ используется в качестве хладагента в огнетушителях, для надувания спасательных плотов и спасательных жилетов, взрывания угля, вспенивания резины и пластика, стимулирования роста растений в теплицах, обездвиживания животных перед забоем и в газированных напитках.
Воспламененный магний продолжает гореть в углекислом газе, но этот газ не поддерживает горение большинства материалов. Длительное воздействие на человека 5-процентной концентрации углекислого газа может привести к потере сознания и смерти.
Длительное воздействие на человека 5-процентной концентрации углекислого газа может привести к потере сознания и смерти.
Редакторы Британской энциклопедии Эта статья была недавно отредактирована и дополнена Джоном П. Рафферти.
7.6: Углекислый газ — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 212656
- Эндрю Р. Бэррон
- Университет Райса через CNX
Углекислый газ (CO 2 ) является наиболее устойчивым оксидом углерода и образуется при сжигании углерода или углеродсодержащих соединений на воздухе или в избытке кислорода (7.6. 1). Для промышленного применения его обычно получают разложением карбоната кальция (известняка) (7.6.2), а не отделением от продуктов сгорания.
1). Для промышленного применения его обычно получают разложением карбоната кальция (известняка) (7.6.2), а не отделением от продуктов сгорания.
\[ \text{C + O}_2 \rightarrow \text{CO}_2\]
\[ \text{CaCO}_3 \rightarrow \text{CaO + CO}_2\]
Фазовая химия диоксида углерода
Диоксид углерода не существует в виде жидкости при нормальном атмосферном давлении, но твердый CO 2 (также известный как сухой лед ) возгоняется при -78,5 °C (рис. \(\PageIndex{1) }\)). Сухой лед (рис. \(\PageIndex{2}\)) обычно используется в качестве хладагента для хранения пищевых продуктов или биологических образцов.
Рисунок \(\PageIndex{1}\): Фазовая диаграмма двуокиси углерода. Рисунок \(\PageIndex{2}\): Фотография сплошного блока из 9 элементов.0090 сухой лед .Примечание
При помещении сухого льда в воду (особенно нагретую) происходит ускорение сублимации и образование низкотонущего густого облака тумана (дымообразного). Это используется в генераторах дыма, в театрах, на концертах, в домах с привидениями и в ночных клубах для создания драматических эффектов (рис. \(\PageIndex{3}\)). Туман от сухого льда парит над землей, в отличие от других генераторов искусственного тумана (которые используют частичное сгорание масла), где туман поднимается, как дым.
Это используется в генераторах дыма, в театрах, на концертах, в домах с привидениями и в ночных клубах для создания драматических эффектов (рис. \(\PageIndex{3}\)). Туман от сухого льда парит над землей, в отличие от других генераторов искусственного тумана (которые используют частичное сгорание масла), где туман поднимается, как дым.
Сверхкритический диоксид углерода
Как отмечалось выше, диоксид углерода обычно ведет себя в воздухе как газ при стандартной температуре и давлении (стандартные условия = 25 °C и 1 атм) или как твердое вещество при замораживании. Однако, если температура и давление увеличиваются от STP до критической точки или выше (рисунок \(\PageIndex{1}\)), двуокись углерода приобретает промежуточные свойства между газом и жидкостью (T c = 31,1 °С и Р c = 72,9 атм).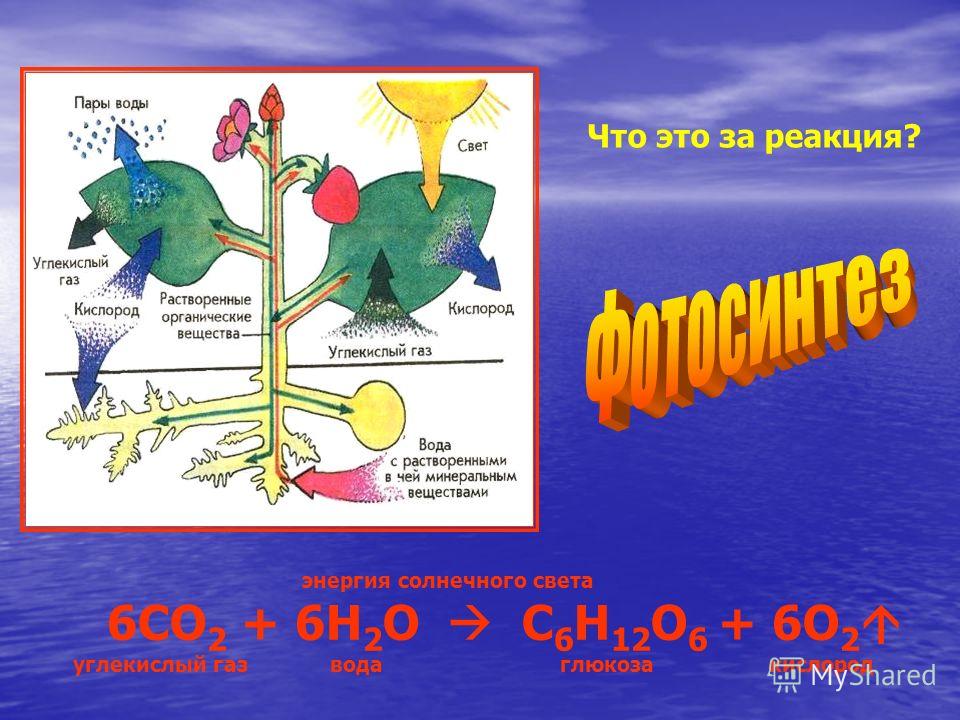
Сверхкритический CO 2 стал важным промышленным растворителем благодаря его роли в химической экстракции, а также низкой токсичности и воздействию на окружающую среду. В связи с этим он рассматривается как многообещающий зеленый растворитель. Одним из самых больших применений является удаление кофеина из кофе и чая без остатка и позволяющее отделить кофеин и использовать его в других напитках.
Структура и связь
Двуокись углерода представляет собой линейную молекулу из-за π-локализации. Склеивание в CO 2 включает 2 σ-связи и 2 набора из 3 центральных π-связей (рис. \(\PageIndex{4}\)). Длину связи C-O, равную 1,2 Å, следует сравнить со значением, наблюдаемым для органических карбонилов (например, кетонов, сложных эфиров, альдегидов) 1,2–1,3 Å.
Рисунок \(\PageIndex{4}\): Диаграмма молекулярных орбиталей углекислого газа.Растворение и реакция с водой
Хотя CO 2 не имеет дипольного момента, он очень полярен (диэлектрическая проницаемость = 1,60 при 0 °C, 50 атм) и, следовательно, растворяется в полярных растворителях, таких как вода, до концентрации 18%.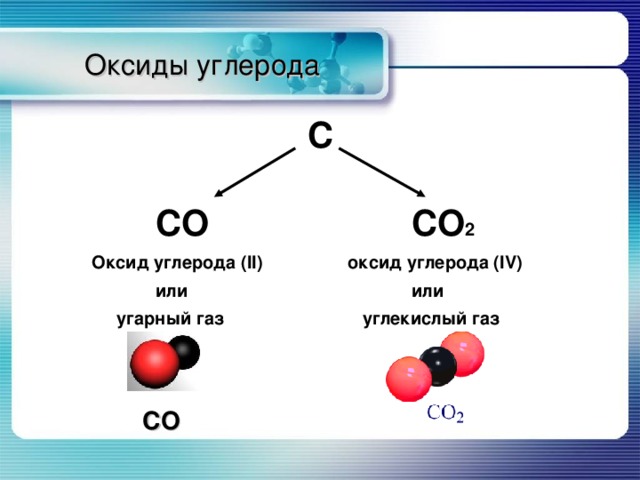 (0,04 М). Большинство из них (+99%) присутствует в виде сольватированного CO 2 (рис. \(\PageIndex{5}\)), и только ок. 0,2% вступает в реакцию с образованием угольной кислоты (7.6.1), с последующим достижением равновесия, приводящим к образованию бикарбоната (HCO 3 – ) и карбоната (CO 3 2-).
(0,04 М). Большинство из них (+99%) присутствует в виде сольватированного CO 2 (рис. \(\PageIndex{5}\)), и только ок. 0,2% вступает в реакцию с образованием угольной кислоты (7.6.1), с последующим достижением равновесия, приводящим к образованию бикарбоната (HCO 3 – ) и карбоната (CO 3 2-).
\[ \text{H}_2\text{O + CO}_2 \rightarrow \text{H}_2\text{CO}_3\]
Рисунок \(\PageIndex{5}\): Типичная водная сольватация углекислый газ.Общая реакция включает ряд равновесий. Первое равновесие – это образование угольной кислоты (7.6.4). Скорость реакции (7.6.5) составляет 1 секунду (т. е. медленная), и, как следствие, когда в организме переносится углекислый газ, присутствует фермент, ускоряющий реакцию.
\[ \text{CO}_{\text{2(solv)}} \text{ + H}_2\text{O} \xrightleftharpoons[\text{k}_{\text{H}_2\text {CO}_3}]{\text{k}_{\text{CO}_2}} \text{H}_2\text{CO}_3\]
\[ \text{K = } \dfrac{\ text {k} _ {\ text {H} _2 \ text {CO} _3}} {\ text {k} _ {\ text {CO} _2}} \ text { = } \ dfrac {25} {0,04} \ text{ = 600}\]
Равновесие 2 и является следствием первой ионизации угольной кислоты с образованием бикарбоната (HCO 3 – ), (7. 6.6). В отличие от первой реакции (7.6.4) эта реакция протекает очень быстро с K 9+ \]
6.6). В отличие от первой реакции (7.6.4) эта реакция протекает очень быстро с K 9+ \]
Образование угольной кислоты является причиной того, что даже при отсутствии загрязняющих веществ (таких как SO 2 ) естественная дождевая вода имеет слабокислую реакцию из-за растворенного CO 2 . Равновесие, связанное с угольной кислотой, также отвечает за буферизацию pH крови.
Химия реакций
Фотосинтез в растениях восстанавливает CO 2 до органического вещества, но подобные реакции еще предстоит разработать в неживых системах.
Гриньяры легко реагируют с диоксидом углерода с образованием карбоксилата, который при гидролизе дает ассоциированную карбоновую кислоту (7.6.8). Аналогичные реакции происходят и с другими металлоорганическими соединениями. Кроме того, СО 2 реагирует с солями щелочных металлов и фенолов (фенолятами) с образованием гидроксикарбоксилата.
\[ \text{RMgX + CO}_2 \rightarrow \text{RCO}_2\text{MgX} \xrightarrow{\text{H}_2\text{O}} \text{RCO}_2\text{H + HOMgX}\]
Известен ряд комплексов CO 2 с переходными металлами, в которых координация может происходить через центральный углерод (рис. \(\PageIndex{6}\)a) или C= O-связь (рис. \(\PageIndex{6}\)b). В качестве альтернативы, CO 2 может соединить два металлических центра.
\(\PageIndex{6}\)a) или C= O-связь (рис. \(\PageIndex{6}\)b). В качестве альтернативы, CO 2 может соединить два металлических центра.
Глобальное потепление и двуокись углерода
Глобальное потепление – процесс наблюдаемого повышения средней температуры приповерхностного воздуха Земли и океанов с середины -х годов -го века. Глобальная приземная температура увеличилась на 0,74 ° C (1,33 ° F) между началом и концом 20 века (рис. \(\PageIndex{7}\)). Принято считать, что большая часть этого повышения температуры произошла с середины 20 9 г. до н.э.0130-го века и было вызвано увеличением концентрации парниковых газов в результате сжигания ископаемого топлива (выработка дополнительного CO 2 ) и вырубки лесов (утрата механизма потребления CO 2 ), см. рисунок \( \PageIndex{7}\). Хотя считается, что природные явления (включая солнечную радиацию и извержение вулканов) вызвали большую часть потепления с доиндустриальных времен, масштабы изменений, вызванных глобальной индустриализацией, более значительны.
Атмосфера Земли выполняет две функции. Во-первых, озон (O 3 ) в верхних слоях атмосферы не пропускает вредное ультрафиолетовое излучение к поверхности Земли. Во-вторых, когда солнечная радиация проникает в атмосферу, часть тепла затем сохраняется вследствие наличия в атмосфере СО 2 . Именно этот процесс модулирует температуру поверхности и обеспечивает стабильную среду для жизни. Отказ или изменение любого из этих процессов может иметь драматические последствия для пригодности планеты для жизни.
Рассмотрим относительное положение Венеры, Земли и Марса по отношению к Солнцу (рисунок \(\PageIndex{8}\)). Чем ближе планета к Солнцу, тем сильнее УФ-излучение и тем больше нагревается планета; однако температура также сильно регулируется атмосферой. Венера имеет атмосферу, состоящую на 95% из CO 2 , и имеет температуру на поверхности около 450 °C. Напротив, хотя атмосфера Марса также на 95 % состоит из CO 2 , ее плотность всего на 1 % меньше, чем у Земли, и, таким образом, температура поверхности колеблется от 40 °C в течение дня (из-за радиационного нагрева) до –80 °C. °C ночью (из-за отсутствия остаточного тепла из-за разреженной атмосферы). Их следует сравнить с земной атмосферой, которая содержит 0,038% CO 9 .0023 2 , что позволяет сохранять нужное количество тепла для поддержания жизни. Ясно, что любое значительное изменение содержания CO 2 в атмосфере изменит глобальную температуру планеты.
Напротив, хотя атмосфера Марса также на 95 % состоит из CO 2 , ее плотность всего на 1 % меньше, чем у Земли, и, таким образом, температура поверхности колеблется от 40 °C в течение дня (из-за радиационного нагрева) до –80 °C. °C ночью (из-за отсутствия остаточного тепла из-за разреженной атмосферы). Их следует сравнить с земной атмосферой, которая содержит 0,038% CO 9 .0023 2 , что позволяет сохранять нужное количество тепла для поддержания жизни. Ясно, что любое значительное изменение содержания CO 2 в атмосфере изменит глобальную температуру планеты.
Библиография
- Н. Стерн, The Stern Review: The Economics of Climate Change , Министерство финансов Великобритании, Лондон.
- Р. Б. Гупта и Дж.-Дж. Shim, Растворимость в сверхкритическом диоксиде углерода , CRC Press (2006).

- Улавливание и хранение двуокиси углерода: специальный отчет Межправительственной группы экспертов по изменению климата , Cambridge University Press (2005).
Эта страница под названием 7.6: Углекислый газ распространяется под лицензией CC BY 3.0 и была создана, изменена и/или курирована Эндрю Р. Бэрроном (CNX) с помощью исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts. ; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- Эндрю Р.