Химия углекислый газ формула: Углекислый газ (диоксид углерода) – Что такое Углекислый газ (диоксид углерода)?
alexxlab | 19.02.2023 | 0 | Разное
Объявления о защитах диссертаций,Диссертационный совет
14.12.2022
Лесничева Алена Сергеевна Диссертация «Фазовые равновесия и протонный перенос в акцепторно-допированных скандатах лантана» на соискание ученой степени кандидата химических наук
.
Защита диссертации: 01.03.2023
13.10.2022
Козлова Анна Владимировна Диссертация «Синтез и исследование бинарных систем Li4Ti5O12 –Li2TiO3 и Li4Ti5O12 –TiO2 » на соискание ученой степени кандидата химических наук
.
Защита диссертации: 22.12.2022
26.09.2022
Видюк Томила Максимовна Диссертация «Особенности фазовых и структурных превращений в системе Ti-C-Cu при электроискровом спекании и холодном газодинамическом напылении» на соискание ученой степени кандидата химических наук
.
Защита диссертации: 08.12.2022
06.12.2021
Плеханов Максим Сергеевич Диссертация «Структура и физико-химические свойства твердых растворов и композитов на основе La1 – xSrxScO3 – δ и переходных металлов» на соискание ученой степени кандидата химических наук
.
Защита диссертации: 16.02.2022
08.09.2021
Косова Нина Васильевна Диссертация «Механохимически стимулированный синтез наноструктурированных катодных материалов для металл-ионных аккумуляторов » на соискание ученой степени доктора химических наук
Защита диссертации: 22.12.2021
26.07.2021
Шиндров Александр Александрович Диссертация «Смешанно-анионные железо-натрийсодержащие соединения как матрицы для обратимой интеркаляции ионов щелочных металлов» на соискание ученой степени кандидата химических наук.
Защита диссертации: 06.10.2021
21.09.2020
Масленников Даниэль Владимирович Диссертация «Исследование факторов, определяющих морфологию и микроструктуру продуктов реакции термического разложения (Ce1-xGdx)2 (C2O4)3•10H2O (x = 0, 0.1)» на соискание ученой степени кандидата химических наук
.
Защита диссертации: 02.12.2020
08.06.2020
Бычков Алексей Леонидович
Защита диссертации: 23.09.2020
08.06.2020
Мищенко Ксения Владимировна Диссертация «Синтез и термические превращения формиатов и оксокарбоната висмута с получением металлического висмута и его оксидов» на соискание ученой степени кандидата химических наук
.
Защита диссертации: 16.09.2020
04.10.2019
Ухина Арина Викторовна Диссертация «Структурно-морфологические особенности формирования металл-алмазных композиций» на соискание ученой степени кандидата химических наук
.
Защита диссертации: 18.12.2019
19.08.2019
Семыкина Дарья Олеговна Диссертация «Cтруктурно-морфологические и электрохимические свойства натрий/литий ванадий-содержащих электродных материалов для натрий/литий-ионных аккумуляторов» на соискание ученой степени кандидата химических наук
.
Защита диссертации: 27.11.2019
15.10.2018
Тяпкин Павел Юрьевич Диссертация «Нанокомпозиты на основе оксидов железа, синтезированных в порах мезопористого диоксида кремния» на соискание ученой степени кандидата химических наук
.
Защита диссертации: 21.12.2018
08.10.2018
Скрипкина Татьяна Сергеевна Диссертация «Механохимическая модификация структуры гуминовых кислот для получения комплексных сорбентов» на соискание ученой степени кандидата химических наук
.
Защита диссертации: 19.12.2018 в 10:00
08.10.2018
Подгорбунских Екатерина Михайловна Диссертация «Исследование механоферментативных превращений полимеров трудноперерабатываемого растительного сырья» на соискание ученой степени кандидата химических наук
.
Защита диссертации: 19.12.2018 в 12:00
03.10.2018
Шубникова Елена Викторовна Диссертация «Структура и кислородная проницаемость оксидов со смешанной проводимостью
Sr1-yBayCo0. 8-xFe0.2
8-xFe0.2
.
Защита диссертации: 05.12.2018
26.09.2018
Лозанов Виктор Васильевич Диссертация «Синтез и физико-химическое исследование тугоплавких соединений, образующихся в системах на основе гафния, тантала и иридия» на соискание ученой степени кандидата химических наук
.
Защита диссертации: 12.12.2018
03.05.2017
Прокип Владислав Эдвардович Диссертация «Физико-химическое исследование германатов гафния» на соискание ученой степени кандидата химических наук
.
Защита диссертации: 05.07.2017 в 10:00
01.02.2017
Пестерева Наталья Николаевна
.
Защита диссертации: 05.04.2017 в 10:00
27.12.2016
Попов Михаил Петрович Диссертация «Изучение влияния модификации вольфрамом на функциональные свойства перовскита состава Ba0.5Sr0.5Co0.8Fe0.2O3-δ» на соискание ученой степени кандидата химических наук
.
Защита диссертации: 01.03.2017 в 10:00
10.08.2016
Подгорнова Ольга Андреевна Диссертация «Синтез, структура и электрохимические свойства катодных материалов на основе LiCoPO 4» на соискание ученой степени кандидата химических наук
.
Защита диссертации: 12.10.2016 в 10:00
Новости
1 – 20 из 22
Начало | Пред. | 1 2
|
След. |
Конец
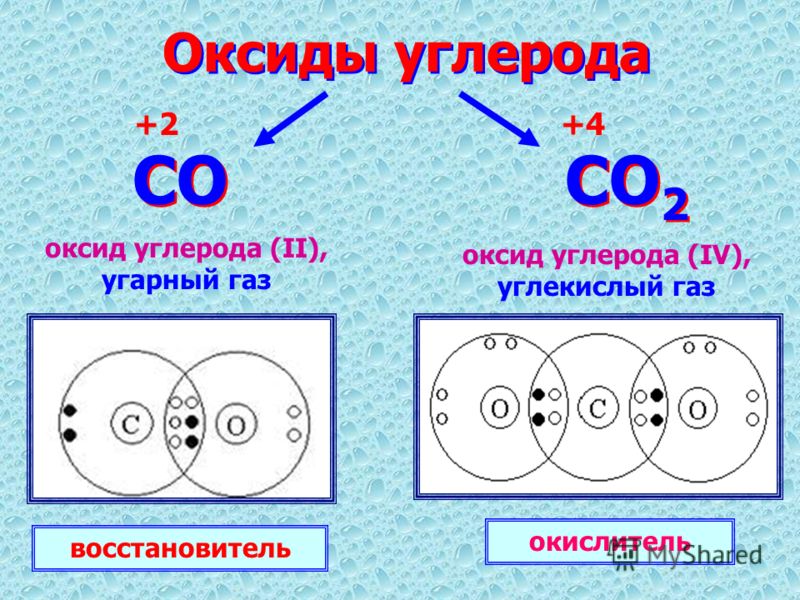
Углекислый газ CO2
2207 Просмотры 3 Понравилось Опубликовано: May 14th 2020
Углекислый газ «един» на Земле во множестве разных «обличий»: не боясь ошибиться, его можно именовать «диоксид углерода», «двуокись углерода», «оксид углерода», «угольный ангидрид» или даже «углекислота». При обычных условиях данный газ обладает плотностью, большей, нежели плотность воздуха, практически не обладает запахом (что касается больших концентраций, он демонстрирует слабый кисловатый аромат «соды») и способен перевоплощаться из твёрдого вещества в газ, а при условии повышенного давления превращается в жидкость. Данный газ является растворимым в водной среде, он негорюч, однако в нём может осуществляться горение активных металлов – таких как, например, магний или барий. Химической формулой углекислоты является СО2.
При обычных условиях данный газ обладает плотностью, большей, нежели плотность воздуха, практически не обладает запахом (что касается больших концентраций, он демонстрирует слабый кисловатый аромат «соды») и способен перевоплощаться из твёрдого вещества в газ, а при условии повышенного давления превращается в жидкость. Данный газ является растворимым в водной среде, он негорюч, однако в нём может осуществляться горение активных металлов – таких как, например, магний или барий. Химической формулой углекислоты является СО2.
Распространение углекислоты в природе и в человеческом организме
Ещё задолго до возникновения жизни на Земле углекислота была основой атмосферы. В настоящее время её нахождение в воздухе определяется средними отметками 0.04 %. Накопление СО2 в атмосфере приводит к образованию углекислотных облаков, что провоцирует похолодание.
Выделением углекислого газа сопровождаются гниение, а также горение органических веществ. Также он, как известно, производится при дыхании растительных культур и живых организмов: за сутки среднестатистический человек производит таким образом примерно один килограмм углекислого газа. Он транспортируется от тканей, в которых образуется как один из завершающих продуктов метаболизма, проходит по венам, а затем выдыхается через лёгкие. Следовательно, эпицентром скопления углекислого газа в организме является венозная система, чуть меньше его находится в лёгких и совсем в незначительных количествах он присутствует в артериальной крови.
Он транспортируется от тканей, в которых образуется как один из завершающих продуктов метаболизма, проходит по венам, а затем выдыхается через лёгкие. Следовательно, эпицентром скопления углекислого газа в организме является венозная система, чуть меньше его находится в лёгких и совсем в незначительных количествах он присутствует в артериальной крови.
В организме человека СО2 играет большую роль в ауторегуляции кровотока и регуляции рН крови. Кроме того, в определённых соотношениях он положительно влияет на миокард.
Распространённые сферы применения углекислого газа
Угольный ангидрид широко применяется в пищевом производстве – например, в качестве разрыхлителя и консервирующего вещества, что обозначается на упаковке продукта специальным кодом Е290. Кроме этого, углекислота получила распространение как средство для газирования лимонада, энергетиков и других популярных газированных напитков.
В медицине одной из важнейших сфер использования двуокиси углерода является криохирургия: здесь данный газ выступает в качестве главного инструмента криоабляции новообразований в человеческом организме.
Жидкий СО2 активно используется в системах пожаротушения. Углекислый газ формирует защитную среду в процессе сварки проволокой. Помещённая в баллоны, углекислота может служить источником питания двигателей в авиамоделировании. Твёрдый угольный ангидрид или так называемый «сухой лёд» находит применение в роли хладагента в лабораторной практике, а также в процессе ремонта оборудования.
Токсическое влияние СО2 на живые организмы
Увеличенное содержание углекислого газа в воздушной среде приводит к токсическому влиянию на живые организмы, так, что безобидная углекислота превращается в удушающий газ IV класса опасности. При слабом превышении СО2 (до 0.2-0.4 % или 2000−4000 ppm) у человека может отмечаться слабость, сонливость, снижение концентрации внимания. Содержание 7-10 % порождает головную боль, проблемы со слухом, провоцирует потерю сознания.
Для закрытых помещений уровень CO2 в норме должен составлять приблизительно 600 ppm, однако в учебных аудиториях, как правило, концентрация углекислоты находится на отметках 2000-2500 ppm, что значительно ухудшает результаты учебной деятельности и вызывает серьёзную обеспокоенность у исследователей.
Необходимость и основные методы регистрации углекислоты
Различные варианты исследований углекислого газа востребованы во многих отраслях деятельности человека. К примеру, в медицине и различных технологических процессах существует необходимость определения его парциального давления – для исследования дыхательных смесей, предназначенных для искусственной вентиляции лёгких, мониторинга концентрации газа в замкнутых пространствах для профилактики болезней и патологических состояний живых организмов и растений и т. д. Концентрация СО2 также является важным предметом исследования экологов – например, в ходе изучения парникового эффекта.
Регистрация углекислоты осуществляется посредством использования специализированных газоизмерительных систем – например, анализаторов газа, функционирующих по принципу инфракрасной спектроскопии. Медицинский газоанализатор качества СО2, регистрирующий содержание диоксида углерода в воздухе, выдыхаемом человеком, носит название капнограф.
Окисление океана | Изучайте науку в Scitable
Брюэр, П. Г. и Хестер, К. Подкисление океана и повышение прозрачности океана для низкочастотных звуков. Океанография 22 , 86–93 (2009).
Г. и Хестер, К. Подкисление океана и повышение прозрачности океана для низкочастотных звуков. Океанография 22 , 86–93 (2009).
Бриджес, М. А. и Маттис, М. Р. Более двух тысяч оценок рН репрезентативных пищевых продуктов. Американский журнал болезней пищеварения 9 , 440–449 (1939).
Эби, М. и др. . Продолжительность антропогенного изменения климата: тысячелетние временные масштабы потенциального CO 2 и возмущения температуры поверхности. Journal of Climate 22 , 2501–2511 (2009 г.).
Хоффман, Р. С. и др. . Сравнение титруемого кислотно-щелочного резерва и pH в потенциально едких бытовых продуктах. Клиническая токсикология 27 , 241–261 (1989). doi:10.3109/15563658908994421
Хёниш, Б. и Хемминг, Н. Г. Реакция pH поверхности океана на изменения pCO 2 в течение двух полных ледниковых циклов. Earth and Planetary Science Letters 236 , 305–314 (2005).
Хёниш, Б. и др. . Концентрация углекислого газа в атмосфере в переходный период среднего плейстоцена. Наука 324 , 1551–1554 (2009).
Хешги, Х. С. Улавливание углекислого газа в атмосфере за счет повышения щелочности океана. Energy 20 , 915–922 (1995).
Клейпас, Дж. А. и др. . Геохимические последствия повышенного содержания углекислого газа в атмосфере на коралловых рифах. Наука 284 , 118–120 (1999).
Люти, Д. и др. . Рекорд концентрации углекислого газа с высоким разрешением за 650 000–800 000 лет до настоящего времени. Природа 453 , 379–382 (2008).
Maier, C. и др. . Кальцификация холодноводного коралла Lophelia pertusa в условиях окружающей среды и пониженного pH. Биогеонауки 6 , 1671–1680 (2009).
Манцелло, Д. П. и др. . Плохо сцементированные коралловые рифы восточной тропической части Тихого океана: возможное понимание развития рифов в условиях высокого содержания CO 2 мир. Труды Национальной академии наук Соединенных Штатов Америки 105 , 10450–10455 (2008 г.).
Труды Национальной академии наук Соединенных Штатов Америки 105 , 10450–10455 (2008 г.).
Masson-Delmotte, V. и др. . EPICA Dome C запись интенсивности ледников и межледниковья. Quaternary Science Reviews 29 , 113–128 (2010). doi:10.1016/j.quascirev.2009.09.030
Monnin, C. et al . Геохимия бария в осадочных поровых водах и пластовых водах океанической коры на восточном склоне хребта Хуан де Фука (ODP Leg 168), Геохимия, геофизика, геосистемы 2 , У1–У15 (2001).
Орр, Дж. К. и др. . Антропогенное закисление океана в двадцать первом веке и его влияние на кальцифицирующие организмы. Природа 437 , 681–686 (2005).
Пандольфи, Дж. М. и др. . Прогнозирование будущего коралловых рифов в условиях глобального потепления и закисления океана. Наука 333 , 418–422 (2011).
Пети, Дж. Р. и др. . История климата и атмосферы за последние 420 000 лет из ледяного керна Восток, Антарктида. Природа 399 , 429–436 (1999).
Природа 399 , 429–436 (1999).
Рэйвен, Дж. и др. . Подкисление океана из-за увеличения концентрации углекислого газа в атмосфере . Лондон, Великобритания: Королевское общество, 2005. (ссылка)
Revelle, R. & Suess, H. Обмен углекислым газом между атмосферой и океаном и вопрос увеличения содержания CO 2 в атмосфере за последние десятилетия. Tellus 9 , 18–27 (1957).
Риджвелл, А. и Шмидт, Д. Н. Прошлые ограничения уязвимости морских кальцификаторов к массивному выбросу углекислого газа. Nature Geoscience 3 , 196–200 (2010).
Риджвелл А. и др. . От лабораторных манипуляций к моделям системы Земли: масштабирование последствий кальцификации подкислением океана. Биогеонауки 6 , 2611-2623 (2009).
Райс, Дж. Б. и др. . Морские кальцификаторы проявляют неоднозначную реакцию на CO 2 , вызванное подкислением океана. Геология 37 , 1131–1134 (2009).
Сабина, С. Л. и др. . Океанический поглотитель антропогенного CO 2 . Наука 305 , 367–371 (2004).
Siegenthaler, U. и др. . Стабильные отношения углеродного цикла и климата в позднем плейстоцене. Наука 310 , 1313–1317 (2005).
Терли, С. и др. . Социальная проблема закисления океана. Бюллетень о загрязнении морской среды 60 , 787–792 (2010 г.).
Определение, формула, структура, свойства, использование
Дом »химия
Дивья Каре | Обновлено: 4 августа 2022 г., 17:29 IST
0
Сохранить
Скачать публикацию в формате PDF Обнаруженный фламандским химиком Яном Баптистом Ван Гельмортом при сжигании древесного угля в закрытом сосуде, двуокись углерода представляет собой бесцветный газ без запаха, присутствующий в атмосфере. Углекислый газ используется растениями для фотосинтеза. Это также газ, выдыхаемый живыми существами при дыхании.
Продолжайте читать, чтобы узнать больше о двуокиси углерода, ее структуре, свойствах, воздействии на окружающую среду и важности углеводородов.
Двуокись углерода
Двуокись углерода — природный газ, содержащийся в атмосфере Земли. Это бесцветный газ без запаха, который можно получить путем сжигания углерода и соединений органической химии. Это газ при комнатной температуре и при затвердевании известен как сухой лед.
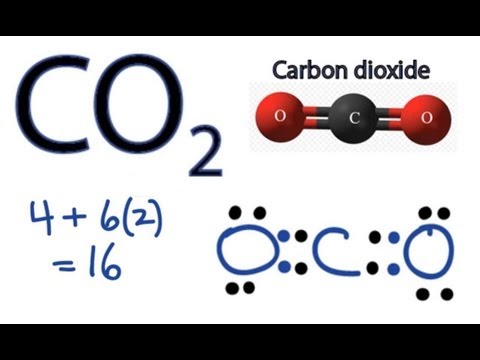
Двуокись углерода образуется, когда один атом углерода образует связь с двумя атомами кислорода. Записывается как \(\text{C}\text{O}_2 \). Связь между атомами углерода и кислорода является ковалентной связью.
Структура двуокиси углерода
Двуокись углерода имеет простую молекулярную структуру. Углерод ковалентно связан с каждым атомом кислорода, и результирующая молекулярная форма является линейной.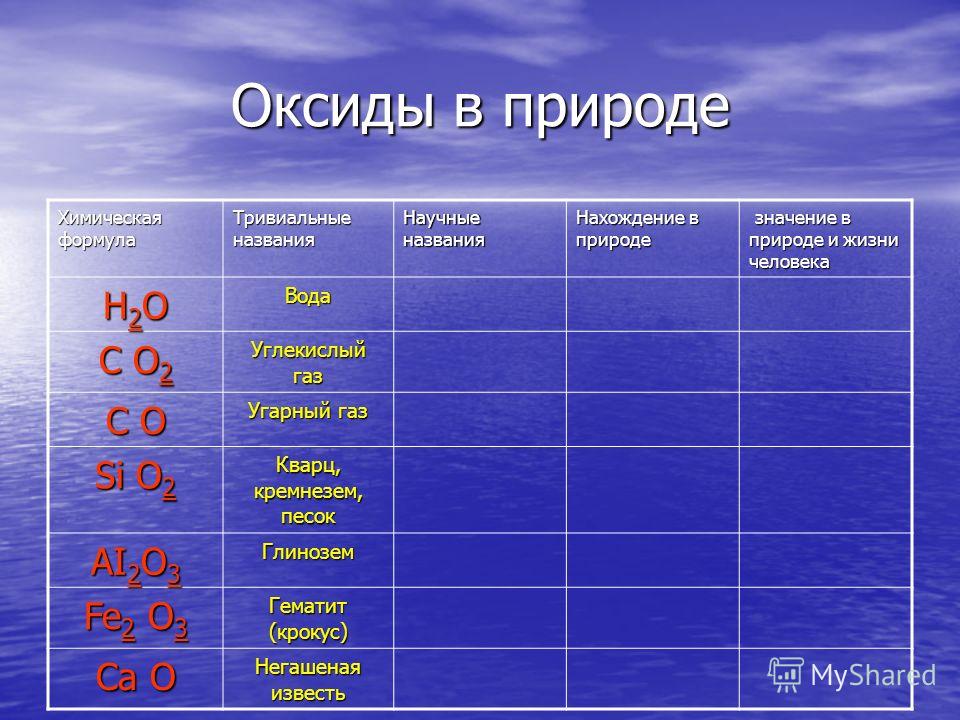 Каждая двойная связь состоит из одной сигма-связи и одной пи-связи.
Каждая двойная связь состоит из одной сигма-связи и одной пи-связи.
Свойства углекислого газа
Давайте изучим некоторые свойства углекислого газа-
Физические свойства
- Углекислый газ – бесцветный газ.
- Не имеет запаха, т.е. не имеет запаха.
- Молекулярная формула двуокиси углерода \( \text{C}\text{O}_2 \).
- Молекулярная масса \( \text{C}\text{O}_2 \) составляет 44,095 г/моль.
- Плотность 1,977 г/моль.
- Температура плавления -56,6℃.
- Температура кипения \( \text{C}\text{O}_2 \) составляет -78,5℃.
- Растворимость в воде составляет 0,9 об./об. при 20℃.
Химические свойства
- \( \text{C}\text{O}_2 \) слегка растворяется в воде с образованием слабой кислоты
\(\text{C}\text{O}_2\ +\ \text{H}_2\text{O}\ →\ \text{H}_2\text{C}\text{O}_3 \)
- Реагирует со щелочью с образованием карбонатов и бикарбонатов.

- Поглощается растениями в процессе фотосинтеза.
Углекислый газ в атмосфере
Поскольку мы изучили, что \(\text{C}\text{O}_2 \) является естественным газом, он уже присутствует в атмосфере Земли. Кроме того, углекислый газ является парниковым газом, то есть он задерживает солнечный свет в атмосфере Земли. Это приводит к увеличению тепла атмосферы Земли, это является ключевым фактором увеличения глобального потепления, которое наносит ущерб окружающей среде. Уровни \( \text{C}\text{O}_2 \) растут из-за различных видов деятельности человека, таких как вырубка лесов, сжигание ископаемого топлива, теплицы и т. д. Эти повышенные количества \(\text{C}\ text{O}_2 \) вредны для всех живых существ, поскольку они вызывают дисбаланс в экосистеме, что вызывает экологические проблемы.
Воздействие углекислого газа на окружающую среду
Давайте посмотрим на некоторые экологические последствия \( \text{C}\text{O}_2 \).
- Повышение уровня \( \text{C}\text{O}_2 \) загрязняет качество воздуха, которым мы дышим.

- Увеличение \( \text{C}\text{O} _2\) приводит к увеличению выбросов парниковых газов и, следовательно, к парниковому эффекту. Это приводит к таянию ледников и повышению уровня океана.
- Из-за парникового эффекта температура на Земле продолжает расти, и если это продолжится, произойдет больше стихийных бедствий, которые создадут много проблем для человечества.
Важность двуокиси углерода
Несмотря на то, что \( \text{C}\text{O}_2 \) имеет некоторые недостатки, он также очень важен для некоторых аспектов окружающей среды. Например,
- Он используется растениями для осуществления процесса фотосинтеза.
- Используется в холодильниках в качестве хладагента.
- Используется в холодных напитках и напитках для придания им шипучести.
- Способствует ускоренному росту растений в теплицах.
- Используется во многих кулинарных техниках.
- Выделяется живыми организмами при дыхании.
Вы также можете ознакомиться с другими темами по химии. Получите помощь от экспертов, чтобы подготовиться к экзаменам с избранными учебными материалами, пробными тестами и ценными советами, которые помогут вам получить более высокие оценки на экзамене. Загрузите бесплатное приложение Testbook, чтобы получить эксклюзивные предложения прямо сейчас.
Получите помощь от экспертов, чтобы подготовиться к экзаменам с избранными учебными материалами, пробными тестами и ценными советами, которые помогут вам получить более высокие оценки на экзамене. Загрузите бесплатное приложение Testbook, чтобы получить эксклюзивные предложения прямо сейчас.
Часто задаваемые вопросы об углекислом газе
Q.1 Как кислород и углекислый газ переносятся в организме человека?
Ans.1 Гемоглобин, обнаруженный в крови, помогает транспортировать эти газы в нашем организме.
Q.2 Является ли углекислый газ парниковым газом?
Ответ 2 Да, углекислый газ является парниковым газом.
Q.3 Каково количество углекислого газа в атмосфере?
Ответ 3 В настоящее время в атмосфере Земли содержится около 412 частей на миллион углекислого газа.
Q.4 Каково общее название твердой двуокиси углерода?
Ответ 4
Сухой лед — это общее название твердой двуокиси углерода.