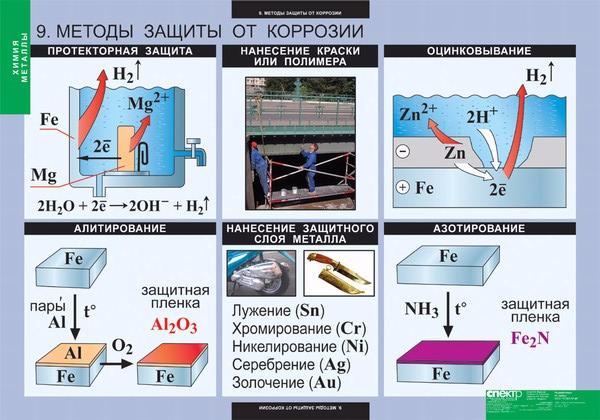
Химия защита металлов от коррозии: Коррозия металлов — урок. Химия, 9 класс.
alexxlab | 09.05.2023 | 0 | Разное
Основные способы защиты металлоизделий от коррозии
05 Мар
Dasha2023-02-07T13:27:58+03:00
Комментарии к записи Основные способы защиты металлоизделий от коррозии отключены
Коррозия представляет собой процесс разрушения металлопроката из-за воздействия химических или электрохимических воздействий. Простыми словами, это ржавчина, которая возникает в процессе эксплуатации изделий по причине частого контакта металла с влагой, почвой или другой агрессивной средой. Согласно последним подсчетам развитые страны несут около 5 % ущерба от национального дохода в связи с возникновением коррозии, поэтому борьбе с ней уделяется весомое значение.
Защита металлов от возникновения ржавчины базируется на ряде принципов:
- Изолирование поверхности от агрессивных факторов;
- Улучшение химсопротивления материала;
- Снижение агрессивности среды;
- Электрохимическая защита.
Некоторые методы используются еще на этапе производства, другие же — в процессе эксплуатации.
Какие из них наиболее эффективны?
Проявляться коррозия на металлических изделиях, в том числе и на двутавровой балке, может по-разному — поверхностное или глубинное проникновение, ржавый слой, окисление компонентов. Метод борьбы с этой проблемой подбирается в зависимости от особенностей условий эксплуатации конструкции. Очень важно определить природу процесса. Это может быть контакт с кислородом, химически активными веществами, влагой, почвой.
Самыми надежными и эффективными защитными мерами с проявлениями ржавчины считаются следующие методы:
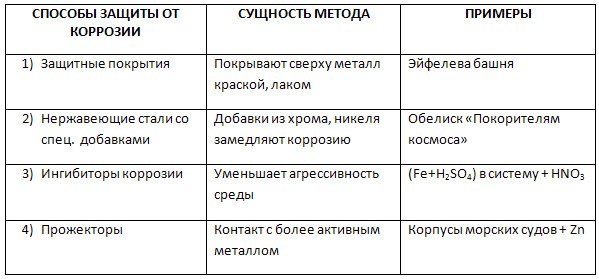
- Защитные покрытия;
- Легирование;
- Металлизация;
- Изменение состава материала.
Рассмотрим каждый из них подробнее.
Использование защитных покрытий
Поверхностная защита металлических балок может выполняться как нанесением специальных пленок, так и окрашиванием конструкций. В быту чаще всего для этих целей используется краска, содержащая в своем составе алюминий. Задача такого способа – перекрыть поступление кислорода к поверхности стали, тем самым защитить ее от разрушений. Вне зависимости от состава покрытий к ним предъявляется ряд требований: отличные адгезионные качества, возможность сохранять свои характеристики в агрессивной среде.
Вне зависимости от состава покрытий к ним предъявляется ряд требований: отличные адгезионные качества, возможность сохранять свои характеристики в агрессивной среде.
Главными достоинствами защитных покрытий является простота реализации и доступная цена. Но вот только долговечность их, к сожалению, невелика.
Химические покрытия металла
Основываются на покрытии металлических конструкций специальной пленкой, устойчивой к воздействию кислорода, влаги, перепаду температур. Речь идет о оксидировании, сульфидировании и т.п.
Процедура выполняться может в горячем и холодном состоянии и требует наличия специального оборудования. Есть у этого метода один недостаток — защитная пленка изменяет цвет изделия, что в некоторых ситуациях не совсем уместно.
Легирование
Выполняется на стадии производства изделий. При изготовлении детали, конструкции в металл вводятся специальные добавки. Чаще всего ими является марганец, хром, которые придают стали устойчивости к агрессивной среде.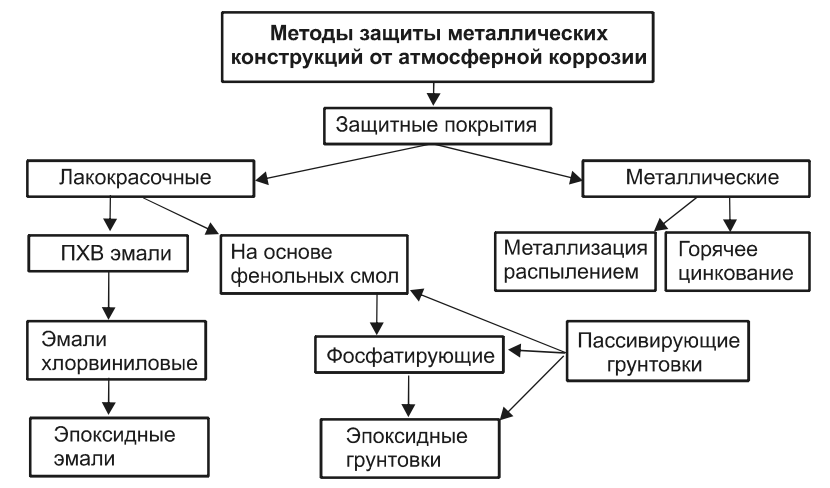
Например, для возведения высоток используется исключительно легированная сталь для максимальной надежности и защиты от экстремальных климатических условий.
Металлизация
Заключается в покрытии поверхностного слоя деталей присадком расплавленного металла. Процедура выполняется с помощью пульверизатора.
Изменение состава атмосферы
Это может быть вакуумирование или среда инертных газов. Достаточно эффективные способы, но довольно дорогостоящие, так как требуют использования дополнительного оборудования.
Вывод: производители много сил и ресурсов тратят на то, чтобы изделия были устойчивы к коррозии и прослужили долгую службу. В связи с этим можно быть уверенным, что металлоизделия будут надежно защищены от ржавчины, обеспечена максимальная устойчивость и надежность конструкции, но только при условии приобретения ее у надежных поставщиков.
Защита металлов от коррозии | Задачи 284
Задание 284.
Если пластинку из чистого цинка опустить в разбавленную кислоту, то начавшееся выделение водорода вскоре почти прекращается. Однако при прикосновении к цинку медной палочкой на последней начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнения протекающей химической реакции.
Решение:
При опускании пластинки из чистого цинка в раствор разбавленной кислоты, начавшееся выделение водорода вскоре почти прекратится, потому что на пластинке из цинка образуется оксидная плёнка, которая будет препятствовать дальнейшему взаимодействию цинка с разбавленной кислотой. Оксидная плёнка образуется при взаимодействии цинка с кислородом, растворённым в воде по схеме:
Zn + 1/2O2 = ZnO
Если прикоснуться к цинковой пластинке медной палочкой, то возникнет гальваническая пара цинк — медь, в которой цинк будет являться анодом, а медь – катодом. Это происходит, потому что стандартный электродный потенциал цинка (-0,763 В) значительно отрицательнее, чем потенциал меди (+0,34 В).
Анодный процесс: Zn0 – 2 = Zn2+
Катодный процесс в кислой среде: 2Н+ + 2 = H2↑
Образующиеся ионы Zn2+ будут с имеющимися анионами кислоты давать соль, а ионы водорода Н+
, деполяризуясь на медной палочке, Zn0 – 2 = Zn2+образуют водород, который в виде пузырьков газа выделяется из раствора. Ионно-молекулярное уравнение реакции будет иметь вид:Zn + 2H+ = Zn2+ + H2↑
Молекулярная форма уравнения реакции:
Zn + 2HCl = ZnCl2 + H2↑
Задание 285.
В чем сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите, содержащем растворенный кислород. Составьте электронные уравнения анодного и катодного процессов.
Решение:
Для предотвращения коррозии стальных конструкций применяется протекторная защита: создаётся электрический контакт защищаемой конструкции с протектором – более активным металлом (обычно Zn, Mg, Al или их сплавы). При таком контакте возникает гальваническая пара типа Zn — Fe и коррозии подвергается протектор, а не сама стальная конструкция (трубопровод, корпус корабля и т.п.). Например, корпус корабля защищают протектором – цинковые брусья, которые крепят в нескольких местах днища корабля. Под действием морской воды и кислорода цинк разрушается, а корпус корабля защищается, таким образом, от коррозии. При этом протекают следующие электрохимические процессы:
При таком контакте возникает гальваническая пара типа Zn — Fe и коррозии подвергается протектор, а не сама стальная конструкция (трубопровод, корпус корабля и т.п.). Например, корпус корабля защищают протектором – цинковые брусья, которые крепят в нескольких местах днища корабля. Под действием морской воды и кислорода цинк разрушается, а корпус корабля защищается, таким образом, от коррозии. При этом протекают следующие электрохимические процессы:
Анодный процесс: Zn0 – 2 = Zn2+;
Катодный процесс:
а) в нейтральной или щелочной среде: 1/2O2 + H2O + 2 = 2OH–;
б) в кислой среде: 1/2O2 + 2H+ + 2 = H2O
Таким образом, цинк разрушается, окисляясь до ионов Zn2+, которые с гидроксильными ионами образуют нерастворимый гидроксид Zn(OH)2 или в виде ионов Zn2+ уходит в раствор, если реакция среды кислая.
Задание 286.
Железное изделие покрыли никелем. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
Решение:
Железо имеет более электроотрицательный стандартный электродный потенциал (-0,44 В), чем никель (-0,24 В), поэтому железо является анодом, никель – катодом.
Анодный процесс – окисление металла: Fe0 – 2 = Fe2+
и катодный процесс – восстановление ионов водорода (водородная деполяризация) или молекул кислорода (кислородная деполяризация). Поэтому при коррозии пары Fe — Ni с водородной деполяризацией происходит следующие процессы:
Анодный процесс: Fe0 – 2 = Fe2+
Катодный процесс: в кислой среде: 2Н+ + 2 = Н2
Продуктом коррозии будет газообразный водород соединение железа с кислотным остатком (соль).
При коррозии пары Fe — Ni в атмосферных условиях на катоде происходит кислородная деполяризация, а на аноде – окисление железа:
Анодный процесс: Fe0 – 2 = Fe2+
Катодный процесс:
в нейтральной среде: 1/2O2 + H2O + 2 = 2OH–
Так как ионы Fe2+ с гидроксид-ионами ОН– образуют нерастворимый гидроксид, то продуктом коррозии будет Fe(OH)2. При контакте с кислородом воздуха Fe(OH) 2 быстро окисляется до метагидроксида железа FeO(OH), приобретая характерный для него бурый цвет:
4Fe(OH)2 + О2 = 4FeO(OH) + 2Н2О
Так как никель имеет более электроположительный стандартный электродный потенциал, чем железо, то данное покрытие является катодным. При повреждении катодного покрытия (или наличия пор) возникает коррозионный элемент, в котором основной материал в поре служит анодом и растворяется, а материал покрытия – катодом, на котором выделяется водород или поглощается кислород. Следовательно, данное катодное покрытие может защищать железо от коррозии лишь при отсутствии пор и повреждений покрытия.
Следовательно, данное катодное покрытие может защищать железо от коррозии лишь при отсутствии пор и повреждений покрытия.
17.5: Коррозия и ее предотвращение
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 44459
Цели обучения
- Понять процесс коррозии.
Коррозия — это гальванический процесс, при котором металлы разрушаются в результате окисления — обычно, но не всегда, до их оксидов. Например, на воздухе железо ржавеет, серебро тускнеет, а медь и латунь приобретают голубовато-зеленую поверхность, называемую патиной. Из различных металлов, подверженных коррозии, железо является наиболее важным с коммерческой точки зрения. По оценкам, только в Соединенных Штатах ежегодно тратится 100 миллиардов долларов на замену железосодержащих объектов, разрушенных коррозией. Следовательно, разработка методов защиты металлических поверхностей от коррозии представляет собой весьма активное направление промышленных исследований. В этом разделе мы опишем некоторые химические и электрохимические процессы, ответственные за коррозию. Мы также изучаем химическую основу некоторых распространенных методов предотвращения коррозии и обработки корродированных металлов.
По оценкам, только в Соединенных Штатах ежегодно тратится 100 миллиардов долларов на замену железосодержащих объектов, разрушенных коррозией. Следовательно, разработка методов защиты металлических поверхностей от коррозии представляет собой весьма активное направление промышленных исследований. В этом разделе мы опишем некоторые химические и электрохимические процессы, ответственные за коррозию. Мы также изучаем химическую основу некоторых распространенных методов предотвращения коррозии и обработки корродированных металлов.
Коррозия – это окислительно-восстановительный процесс.
В условиях окружающей среды окисление большинства металлов термодинамически самопроизвольно, за исключением золота и платины. Поэтому на самом деле несколько удивительно, что какие-либо металлы вообще полезны во влажной, богатой кислородом атмосфере Земли. Однако некоторые металлы устойчивы к коррозии по кинетическим причинам. Например, алюминий в банках для безалкогольных напитков и в самолетах защищен тонким слоем оксида металла, который образуется на поверхности металла и действует как непроницаемый барьер, предотвращающий дальнейшее разрушение.
В отличие от этих металлов, железо при коррозии образует красно-коричневый гидратированный оксид металла (\(\ce{Fe2O3 \cdot xh3O}\)), известный как ржавчина, который не образует плотной защитной пленки ( Рисунок \(\PageIndex{1}\)). Вместо этого ржавчина постоянно отслаивается, обнажая свежую металлическую поверхность, уязвимую для реакции с кислородом и водой. Поскольку для образования ржавчины необходимы и кислород, и вода, железный гвоздь, погруженный в деоксигенированную воду, не заржавеет даже в течение нескольких недель. Точно так же гвоздь, погруженный в органический растворитель, такой как керосин или минеральное масло, не заржавеет из-за отсутствия воды, даже если растворитель насыщен кислородом.
 Производители автомобилей тратят много времени и денег на разработку красок, которые плотно прилегают к металлической поверхности автомобиля, чтобы предотвратить контакт насыщенной кислородом воды, кислоты и соли с металлом под ним. К сожалению, даже самая лучшая краска подвержена царапинам или вмятинам, а электрохимическая природа процесса коррозии означает, что две царапины, относительно удаленные друг от друга, могут работать вместе как анод и катод, что приводит к внезапному механическому повреждению (рис. \(\PageIndex{ 2}\)). Рисунок \(\PageIndex{2}\): Небольшие царапины на защитном лакокрасочном покрытии могут привести к быстрой коррозии железа. Отверстия в защитном покрытии позволяют восстанавливать кислород на поверхности с большим воздействием воздуха (катод), в то время как металлическое железо окисляется до Fe 2 + (водн.) на менее открытом участке (анод). Ржавчина образуется, когда Fe 2 + (водн.) диффундирует в место, где он может реагировать с атмосферным кислородом, часто удаленным от анода.
Производители автомобилей тратят много времени и денег на разработку красок, которые плотно прилегают к металлической поверхности автомобиля, чтобы предотвратить контакт насыщенной кислородом воды, кислоты и соли с металлом под ним. К сожалению, даже самая лучшая краска подвержена царапинам или вмятинам, а электрохимическая природа процесса коррозии означает, что две царапины, относительно удаленные друг от друга, могут работать вместе как анод и катод, что приводит к внезапному механическому повреждению (рис. \(\PageIndex{ 2}\)). Рисунок \(\PageIndex{2}\): Небольшие царапины на защитном лакокрасочном покрытии могут привести к быстрой коррозии железа. Отверстия в защитном покрытии позволяют восстанавливать кислород на поверхности с большим воздействием воздуха (катод), в то время как металлическое железо окисляется до Fe 2 + (водн.) на менее открытом участке (анод). Ржавчина образуется, когда Fe 2 + (водн.) диффундирует в место, где он может реагировать с атмосферным кислородом, часто удаленным от анода. Электрохимическое взаимодействие между катодными и анодными участками может привести к образованию большой ямки под окрашенной поверхностью, что в конечном итоге приведет к внезапному отказу с небольшим видимым предупреждением о возникновении коррозии.
Электрохимическое взаимодействие между катодными и анодными участками может привести к образованию большой ямки под окрашенной поверхностью, что в конечном итоге приведет к внезапному отказу с небольшим видимым предупреждением о возникновении коррозии.Профилактическая защита
Одним из наиболее распространенных методов предотвращения коррозии железа является нанесение защитного покрытия из другого металла, который труднее окисляется. Например, смесители и некоторые внешние детали автомобилей часто покрывают тонким слоем хрома с помощью электролитического процесса. Однако с увеличением использования полимерных материалов в автомобилях использование хромированной стали в последние годы сократилось. Точно так же «жестяные банки», в которых хранятся супы и другие продукты, на самом деле состоят из стального контейнера, покрытого тонким слоем олова. Хотя ни хром, ни металлы олова по своей природе не устойчивы к коррозии, они оба образуют защитные оксидные покрытия, которые препятствуют доступу кислорода и воды к основной стали (железному сплаву).
 Менее легко окисляемая медь действует как катод, вызывая быстрое растворение железа вблизи соединения, что иногда приводит к катастрофическому отказу водопровода. 9{2+}_{(водн.)} + 2H_2O_{(l)} }_{\text{общий}}\label{Eq7} \]
Менее легко окисляемая медь действует как катод, вызывая быстрое растворение железа вблизи соединения, что иногда приводит к катастрофическому отказу водопровода. 9{2+}_{(водн.)} + 2H_2O_{(l)} }_{\text{общий}}\label{Eq7} \]Более активный металл реагирует с кислородом и в конечном итоге растворяется, «жертвуя» себя, чтобы защитить железный предмет. Катодная защита – это принцип, лежащий в основе оцинкованной стали, которая представляет собой сталь, защищенную тонким слоем цинка. Оцинкованная сталь используется в различных предметах, от гвоздей до мусорных баков.
Кристаллическая поверхность горячеоцинкованной стальной поверхности. Это служило как профилактической защите (защита нижележащей стали от кислорода воздуха), так и катодной защите (после воздействия цинк окисляется раньше, чем нижележащая сталь). В аналогичной стратегии расходуемые электроды с использованием магния, например, используются для защиты подземных резервуаров или труб (Рисунок \(\PageIndex{4}\)). Замена жертвенных электродов более рентабельна, чем замена железных предметов, которые они защищают.
Замена жертвенных электродов более рентабельна, чем замена железных предметов, которые они защищают.
 Аналогичная стратегия использует многие мили несколько менее реактивной цинковой проволоки для защиты нефтепровода на Аляске.
Аналогичная стратегия использует многие мили несколько менее реактивной цинковой проволоки для защиты нефтепровода на Аляске.Пример \(\PageIndex{1}\)
Предположим, старый деревянный парусник, скрепленный железными винтами, имеет бронзовый гребной винт (напомним, что бронза — это сплав меди, содержащий около 7–10 % олова). 9\circ_{\textrm{overall}} =\textrm{1,68 В}
\end{align*} \nonumber \]
Со временем железные винты растворятся, и лодка развалится.
- B Возможные способы предотвращения коррозии, в порядке снижения затрат и неудобств, следующие: разборка лодки и ее сборка с помощью бронзовых винтов; снятие лодки с воды и хранение ее в сухом месте; или прикрепление недорогого куска металлического цинка к гребному валу в качестве жертвенного электрода и замена его один или два раза в год. Поскольку цинк является более активным металлом, чем железо, он будет действовать как расходуемый анод в электрохимической ячейке и растворяться (уравнение \(\ref{Eq7}\)).

Упражнение \(\PageIndex{1}\)
Предположим, что водопроводные трубы, ведущие в ваш дом, сделаны из свинца, а остальная сантехника в вашем доме – из железа. Чтобы исключить возможность отравления свинцом, вы вызываете сантехника для замены свинцовых труб. Он назовет вам очень низкую цену, если он сможет использовать свой существующий запас медных труб для выполнения этой работы.
- Вы принимаете его предложение?
- Что еще нужно сделать сантехнику в вашем доме?
- Ответить на
Нет, если только вы не планируете продать дом в ближайшее время, потому что соединения труб \(\ce{Cu/Fe}\) приведут к быстрой коррозии.
- Ответ б
Любые существующие соединения \(\ce{Pb/Fe}\) должны быть тщательно проверены на наличие коррозии железных труб из-за соединения \(\ce{Pb–Fe}\); менее активный \(\ce{Pb}\) будет служить катодом для восстановления \(\ce{O2}\), способствуя окислению более активного \(\ce{Fe}\) поблизости.

Резюме
Коррозия — это гальванический процесс, который можно предотвратить с помощью катодной защиты. Ухудшение металлов в результате окисления представляет собой гальванический процесс, называемый коррозией. Защитные покрытия состоят из второго металла, который труднее окисляется, чем защищаемый металл. В качестве альтернативы на металлическую поверхность можно нанести более легко окисляющийся металл, что обеспечит катодную защиту поверхности. Тонкий слой цинка защищает оцинкованную сталь. Жертвенные электроды также могут быть прикреплены к объекту для его защиты.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
Коррозия – Химия
Электрохимия
OpenStaxCollege
[латексная страница]
Цели обучения
К концу этого раздела вы сможете:
- Дайте определение коррозии
- Перечислите некоторые методы, используемые для предотвращения или замедления коррозии
Коррозия обычно определяется как разрушение металлов в результате электрохимического процесса. Образование ржавчины на железе, потускнение серебра и сине-зеленая патина на меди — все это примеры коррозии. Общая стоимость коррозии в Соединенных Штатах значительна и оценивается более чем в полтриллиона долларов в год.
Статуя Свободы: Изменение цвета
Статуя Свободы — достопримечательность, которую признает каждый американец. Статую Свободы легко узнать по высоте, осанке и уникальному сине-зеленому цвету ([ссылка]). Когда эта статуя была впервые доставлена из Франции, ее внешний вид не был зеленым. Он был коричневым, цвета его медной «кожи». Так как же Статуя Свободы изменила цвет? Изменение внешнего вида было прямым результатом коррозии. Медь, которая является основным компонентом статуи, медленно окислялась на воздухе. Окислительно-восстановительные реакции металлической меди в окружающей среде протекают в несколько стадий. Металлическая медь окисляется до оксида меди (I) (Cu 2 O), который имеет красный цвет, а затем к оксиду меди(II), который имеет черный цвет
Статую Свободы легко узнать по высоте, осанке и уникальному сине-зеленому цвету ([ссылка]). Когда эта статуя была впервые доставлена из Франции, ее внешний вид не был зеленым. Он был коричневым, цвета его медной «кожи». Так как же Статуя Свободы изменила цвет? Изменение внешнего вида было прямым результатом коррозии. Медь, которая является основным компонентом статуи, медленно окислялась на воздухе. Окислительно-восстановительные реакции металлической меди в окружающей среде протекают в несколько стадий. Металлическая медь окисляется до оксида меди (I) (Cu 2 O), который имеет красный цвет, а затем к оксиду меди(II), который имеет черный цвет
\(\text{2Cu}\left(s\right)+\phantom{\rule{0.2em}{0ex }}\frac{1}{2}{\text{O}}_{2}\left(g\right)\phantom{\rule{0.2em}{0ex}}⟶\phantom{\rule{0.2em }{0ex}}{\text{Cu}}_{2}\text{O}\left(s\right)\phantom{\rule{5em}{0ex}}\left(\text{red}\right )\)
\({\text{Cu}}_{2}\text{O}\left(s\right)+\phantom{\rule{0.2em}{0ex}}\frac{1}{ 2}\phantom{\rule{0. 2em}{0ex}}{\text{O}}_{2}\left(g\right)\phantom{\rule{0.2em}{0ex}}⟶\phantom{ \rule{0.2em}{0ex}}\text{2CuO}\left(s\right)\phantom{\rule{5em}{0ex}}\left(\text{black}\right)\)
2em}{0ex}}{\text{O}}_{2}\left(g\right)\phantom{\rule{0.2em}{0ex}}⟶\phantom{ \rule{0.2em}{0ex}}\text{2CuO}\left(s\right)\phantom{\rule{5em}{0ex}}\left(\text{black}\right)\)
Уголь, часто содержащий большое количество серы, активно сжигался в начале прошлого века. В результате триоксид серы, диоксид углерода и вода прореагировали с CuO
\(\text{2CuO}\left(s\right)+{\text{CO}}_{2}\left(g\ справа) + {\ текст {H}} _ {2} \ текст {O} \ влево (l \ вправо) \ фантом {\ правило {0.2em} {0ex}} ⟶ \ фантом {\ правило {0.2em} { 0ex}}{\text{Cu}}_{2}{\text{CO}}_{3}{\text{(OH)}}_{2}\left(s\right)\phantom{\rule {5em}{0ex}}\text{(зеленый)}\)
\(\text{3CuO}\left(s\right)+{\text{2CO}}_{2}\left(g\right ) + {\ text {H}} _ {2} \ text {O} \ left (l \ right) \ phantom {\ rule {0.2em} {0ex}} ⟶ \ phantom {\ rule {0.2em} {0ex }}{\text{Cu}}_{2}{{\left(\text{CO}}_{3}\right)}_{2}{\text{(OH)}}_{2}\ влево (с \ вправо) \ фантом {\ правило {5em} {0ex}} \ текст {(синий)} \)
\(\text{4CuO}\left(s\right)+{\text{SO}}_{3}\left(g\right)+{\text{3H}}_{2}\text{ O}\left(l\right)\phantom{\rule{0.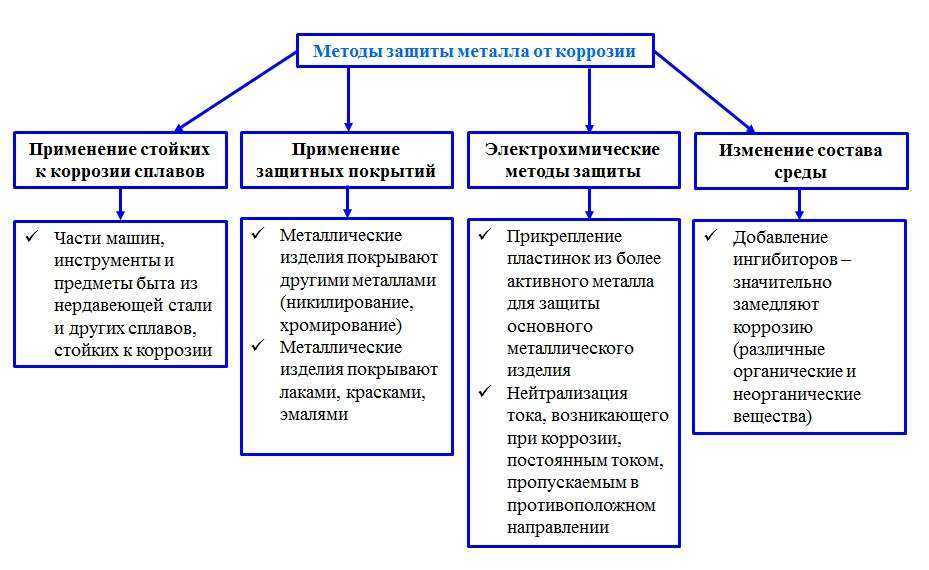 2em}{0ex}}⟶\phantom{\rule{0.2em}{0ex}}{\text{Cu}}_{4}{\text {SO}}_{4}{\text{(OH)}}_{6}\left(s\right)\phantom{\rule{5em}{0ex}}\text{(зеленый)}\)
2em}{0ex}}⟶\phantom{\rule{0.2em}{0ex}}{\text{Cu}}_{4}{\text {SO}}_{4}{\text{(OH)}}_{6}\left(s\right)\phantom{\rule{5em}{0ex}}\text{(зеленый)}\)
Эти три соединения ответственны за характерную сине-зеленую патину, наблюдаемую сегодня. К счастью, образование патины создало на поверхности защитный слой, предотвращающий дальнейшую коррозию медной оболочки. Формирование защитного слоя — это форма пассивации, которая обсуждается далее в следующей главе. 9{\ текст {+}} \ влево (вода \ вправо) \)
Количество молекул воды различно, поэтому оно представлено как x . В отличие от патины на меди, образование ржавчины не создает защитного слоя, поэтому коррозия железа продолжается, поскольку ржавчина отслаивается и подвергает свежее железо воздействию атмосферы.
Как только краска царапается на окрашенной железной поверхности, возникает коррозия и начинает образовываться ржавчина. Скорость спонтанной реакции увеличивается в присутствии электролитов, таких как хлорид натрия, используемый на дорогах для растапливания льда и снега или в соленой воде.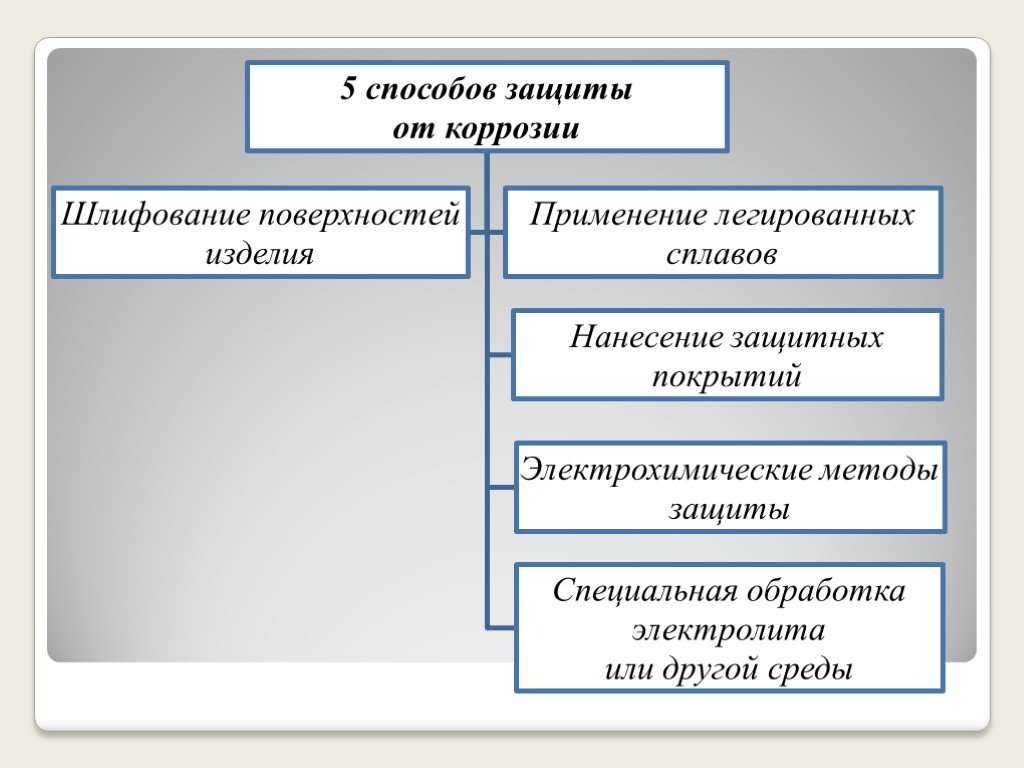
Один из способов уберечь железо от коррозии — красить его. Слой краски предотвращает контакт воды и кислорода, необходимых для образования ржавчины, с железом. Пока краска остается неповрежденной, железо защищено от коррозии.
Другие стратегии включают сплав железа с другими металлами. Например, нержавеющая сталь — это в основном железо с небольшим количеством хрома. Хром имеет тенденцию собираться вблизи поверхности, где он образует оксидный слой, защищающий железо.
Оцинкованное или оцинкованное железо использует другую стратегию. Цинк легче окисляется, чем железо, потому что у цинка более низкий восстановительный потенциал. Поскольку цинк имеет более низкий восстановительный потенциал, он является более активным металлом. Таким образом, даже если цинковое покрытие поцарапается, цинк все равно окислится раньше железа. Это говорит о том, что этот подход должен работать и с другими активными металлами.
Еще одним важным способом защиты металла является использование его в качестве катода в гальваническом элементе. Это катодная защита, которую можно использовать не только для железа, но и для других металлов. Например, ржавчину подземных резервуаров и труб для хранения железа можно предотвратить или значительно уменьшить, соединив их с более активным металлом, таким как цинк или магний ([ссылка]). Это также используется для защиты металлических частей водонагревателей. Более активные металлы (с более низким восстановительным потенциалом) называются жертвенными анодами, потому что по мере их износа они подвергаются коррозии (окислению) на аноде. Защищаемый металл служит катодом и поэтому не окисляется (корродирует). Когда аноды должным образом контролируются и периодически заменяются, полезный срок службы резервуара для хранения железа может быть значительно увеличен.
Это катодная защита, которую можно использовать не только для железа, но и для других металлов. Например, ржавчину подземных резервуаров и труб для хранения железа можно предотвратить или значительно уменьшить, соединив их с более активным металлом, таким как цинк или магний ([ссылка]). Это также используется для защиты металлических частей водонагревателей. Более активные металлы (с более низким восстановительным потенциалом) называются жертвенными анодами, потому что по мере их износа они подвергаются коррозии (окислению) на аноде. Защищаемый металл служит катодом и поэтому не окисляется (корродирует). Когда аноды должным образом контролируются и периодически заменяются, полезный срок службы резервуара для хранения железа может быть значительно увеличен.
Одним из способов защиты подземного резервуара для хранения железа является катодная защита. Использование активного металла, такого как цинк или магний, в качестве анода эффективно превращает резервуар для хранения в катод, предотвращая его коррозию (окисление).
Коррозия – это разрушение металла, вызванное электрохимическим процессом. Ежегодно тратятся большие суммы денег на устранение последствий коррозии или ее предотвращение. Некоторые металлы, такие как алюминий и медь, образуют защитный слой при коррозии на воздухе. Тонкий слой, образующийся на поверхности металла, предотвращает контакт кислорода с большим количеством атомов металла и, таким образом, «защищает» оставшийся металл от дальнейшей коррозии. Железо корродирует (образует ржавчину) при воздействии воды и кислорода. Ржавчина, образующаяся на железном металле, отслаивается, обнажая свежий металл, который также подвергается коррозии. Одним из способов предотвращения или замедления коррозии является нанесение покрытия на металл. Покрытие предотвращает контакт воды и кислорода с металлом. Краска или другие покрытия замедляют коррозию, но они неэффективны, если их поцарапать. Оцинкованное или гальванизированное железо использует тот факт, что цинк более склонен к окислению, чем железо. Пока покрытие остается, даже если оно поцарапано, цинк окислится раньше железа. Еще одним методом защиты металлов является катодная защита. В этом методе легко окисляемый и недорогой металл, часто цинк или магний (жертвенный анод), электрически соединяется с металлом, который необходимо защитить. Более активный металл является жертвенным анодом и является анодом в гальваническом элементе. «Защищенный» металл является катодом и остается неокисленным. Одним из преимуществ катодной защиты является то, что расходуемый анод можно контролировать и при необходимости заменять.
Пока покрытие остается, даже если оно поцарапано, цинк окислится раньше железа. Еще одним методом защиты металлов является катодная защита. В этом методе легко окисляемый и недорогой металл, часто цинк или магний (жертвенный анод), электрически соединяется с металлом, который необходимо защитить. Более активный металл является жертвенным анодом и является анодом в гальваническом элементе. «Защищенный» металл является катодом и остается неокисленным. Одним из преимуществ катодной защиты является то, что расходуемый анод можно контролировать и при необходимости заменять.
Какой член каждой пары металлов более подвержен коррозии (окислению)?
(a) Mg или Ca
(b) Au или Hg
(c) Fe или Zn
(d) Ag или Pt
Рассмотрим следующие металлы: Ag, Au, Mg, Ni и Zn. Какой из этих металлов можно использовать в качестве расходуемого анода при катодной защите подземного стального резервуара-хранилища? Сталь в основном состоит из железа, поэтому используйте -0,447 В в качестве стандартного восстановительного потенциала для стали.
Mg и Zn
{°}=\text{−0,477 В}\right),\) и тем не менее, когда оба подвергаются воздействию окружающей среды, необработанный алюминий имеет очень хорошую коррозионную стойкость, в то время как коррозионная стойкость необработанного железа плохая. Объясните это наблюдение.
Если образец железа и образец цинка вступают в контакт, цинк подвергается коррозии, а железо – нет. Если образец железа соприкасается с образцом меди, железо подвергается коррозии, а медь — нет. Объясните это явление.
Оба примера включают катодную защиту. (Жертвенный) анод — это металл, который подвергается коррозии (окисляется или вступает в реакцию). В случае железа (-0,447 В) и цинка (-0,7618 В) цинк имеет более отрицательный стандартный восстановительный потенциал и поэтому служит анодом. В случае железа и меди (0,34 В) железо имеет меньший стандартный восстановительный потенциал и поэтому подвергается коррозии (служит анодом). 9{°}=\text{−3,04 В},\), который, по-видимому, способен защитить все другие металлы, перечисленные в стандартной таблице потенциалов восстановления?
Хотя восстановительный потенциал лития делает его способным защищать другие металлы, этот высокий потенциал также свидетельствует о том, насколько реактивным является литий; у него будет спонтанная реакция с большинством веществ.