Ионы меди: Ионы меди в водопроводной воде оказались катализатором в синтезе нальдемедина
alexxlab | 24.01.1985 | 0 | Разное
Turabdzhanov | ХИМИЧЕСКАЯ БЕЗОПАСНОСТЬ
ХИМИЧЕСКАЯ БЕЗОПАСНОСТЬ, 2018, Том 2, № 2,
с. 173 — 182
Технологии ликвидации источников химической опасности
УДК 661.182.547.721 Скачать PDF
DOI: 10.25514/CHS.2018.2.14115
ИССЛЕДОВАНИЕ СОРБЦИИ ИОНОВ МЕДИ ИЗ СТОЧНЫХ ВОД ФОСФОРНОКИСЛЫМ КАТИОНИТОМ
С. М. Турабджанов, Т. В. Понамарева, Д. А. Юсупова, З. Ш. Назиров, Л. С. Рахимова*
Ташкентский государственный технический университет имени Ислама Каримова,
г. Ташкент, Узбекистан
Поступила в редакцию 11.10.2018 г.
Опубликовано 26.12.2018 г.
Аннотация — Одним из наиболее эффективных способов очистки промышленных сточных вод и водоемов, содержащих ионы тяжелых металлов, является их извлечение с помощью ионообменных сорбентов, что обеспечивает селективное выделение ионов металлов с их последующей утилизацией и возвращением очищенных стоков в оборотную систему водоснабжения. Разработан метод получения нового фосфорнокислого катионита поликонденсационного типа, обладающего избирательными свойствами к ионам меди. Катионит с функциональными фосфорнокислыми группами получают поликонденсацией дифенилоксида и фурфурола с последующим фосфорилированием продукта. Установлен механизм процесса фосфорилирования и проведены квантово-химические расчеты образования комплекса катионита с атомами меди. Определены регенерационная способность, расход промывной воды, а также сорбционные свойства к ионам меди в лаборатории в динамических условиях. Синтезированный катионит обладает избирательными свойствами к ионам меди и позволяет удалять их из растворов до предельно допустимой концентрации.
Разработан метод получения нового фосфорнокислого катионита поликонденсационного типа, обладающего избирательными свойствами к ионам меди. Катионит с функциональными фосфорнокислыми группами получают поликонденсацией дифенилоксида и фурфурола с последующим фосфорилированием продукта. Установлен механизм процесса фосфорилирования и проведены квантово-химические расчеты образования комплекса катионита с атомами меди. Определены регенерационная способность, расход промывной воды, а также сорбционные свойства к ионам меди в лаборатории в динамических условиях. Синтезированный катионит обладает избирательными свойствами к ионам меди и позволяет удалять их из растворов до предельно допустимой концентрации.
Ключевые слова: комплексообразование, селективность, избирательность, катионит, регенерация, экотоксикант, сточная вода, ионы меди.
SORPTION OF COPPER(II) IONS FROM WASTE WATER BY MEANS OF PHOSPHORYLATED CATION EXCHANGE POLYMER
S. M. Turabdzhanov, T. V. Ponamaryova, D. A. Yusupova, Z. Sh. Nazirov, and L. S. Rakhimova*
M. Turabdzhanov, T. V. Ponamaryova, D. A. Yusupova, Z. Sh. Nazirov, and L. S. Rakhimova*
Tashkent State Technical University named after Islam Karimov,
Tashkent, Republic of Uzbekistan
Received Oktober 11, 2018
Published December 26, 2018
Abstract – One of the most effective methods for purifying industrial wastewater and water bodies contaminated with heavy metal ions is an extraction procedure by means of ion-exchange sorbents, which provides selective removal of metal ions followed by their utilization and return of purified effluents into circulating water supply system. A procedure has been developed for synthesis of a novel polycondensation type phosphorylated cation-exchange polymer with relevant selectivity towards copper(II) ions. The cation-exchange polymer is functionalized with phosphoryl groups and can be obtained by polycondensation reaction of diphenyloxide and furfural, followed by product phosphorylation. Mechanism of the phosphorylation process has been established and quantum chemical calculations for formation of a complex of cation-exchanger with copper atoms have been carried out. The sorbent regeneration capacity, consumption of wash water, along with sorption characteristics for copper(II) ions were determined in laboratory under dynamic conditions. The synthesized cation-exchange resin is characterized by high selectivity for copper(II) ions thus enabling their removal from contaminated solutions up to the values of maximum permissible concentration.
Mechanism of the phosphorylation process has been established and quantum chemical calculations for formation of a complex of cation-exchanger with copper atoms have been carried out. The sorbent regeneration capacity, consumption of wash water, along with sorption characteristics for copper(II) ions were determined in laboratory under dynamic conditions. The synthesized cation-exchange resin is characterized by high selectivity for copper(II) ions thus enabling their removal from contaminated solutions up to the values of maximum permissible concentration.
Keywords: complexation, selectivity, distinguishability, cation-exchanger, regeneration, ecotoxicant, waste water, copper(II) ions.
Список литературы:
1. Шачнева Е.Ю. Воздействие тяжелых токсичных металлов на окружающую среду Научный потенциал регионов на службу модернизации. Астрахань: АИСИ, 2012. № 2 (3). 170 с.
2. Пимнева Л.А. // Современные проблемы науки и образования. 2015. № 2 (часть 2). http://www.science-education.ru/ru/article/view?id=21611 (дата обращения 11.10.2018).
http://www.science-education.ru/ru/article/view?id=21611 (дата обращения 11.10.2018).
3. Turobdjonov S.M., Rakhimova L.S. // Austrian Journal of Technical and Natural Sciences. 2016. No. 1–2. Р. 111.
4. Турабджанов С.М., Рахимова Л.С., Юсупова Д.А. Изучение сорбции ионов меди квантово-химическим методом. XXI Всероссийская конференция молодых ученых-химиков (с международным участием). Нижний Новгород. С. 353.
5. Аловитдинов А.Б. Синтез, исследование свойств и применение фосфорорганических ионообменников. Ташкент: «Фан», 1982. 80с.
6. Щуревич О.А., Люблинер И.П. // Весцi АН Беларусi. Сер. хiм. 1996. н. 2. С. 96.
7. Количественный химический анализ вод. Методика выполнения измерений массовой концентрации ионов меди в природных и очищенных сточных водах фотометрическим методом с диэтилдитиокарбаматом свинца (ДДК свинца) в четыреххлористом углероде ПНД Ф 14.1:2.48-96. М., 1996. 14 с.
References:
1. Shachneva E.Yu. Impact of heavy toxic metals on the environment. Scientific potential of regions on modernization service. Astrakhan’: AISI, 2012. No. 2 (3). 170 р. [in Russian].
Scientific potential of regions on modernization service. Astrakhan’: AISI, 2012. No. 2 (3). 170 р. [in Russian].
2. Pimneva L.A. // Modern problems of science and education. 2015. No. 2 (part 2). http://www.science-education.ru/ru/article/view?id=21611 (accessed 11.10.2018) [in Russian].
3. Turobdjonov S.M., Rakhimova L.S. // Austrian Journal of Technical and Natural Sciences. 2016. No. 1–2. P. 111.
4. Turabdzhanov S.M., Rakhimov L.S., Yusupova D.A. Studying the sorption of copper ions by the quantum-chemical method. XXI All-Russian Conference of Young Scientists-Chemists (with international participation). Nizhny Novgorod: Izd. Nizhegorod. Univ., 2018. Р. 353 [in Russian].
5. Alovitdinov A.B. Synthesis, studying properties and use of organophosphorus ion exchangers. Tashkent: Fan, 1982. 80 р. [in Russian].
6. Shchurevich O.A., Lyubliner I.P. // Vesci AN Belarusi. Ser. Khim. 1996. No. 2. P. 96 [in Belarusian].
7. Quantitative chemical analysis of water. Methods for measuring mass concentration of copper ions in natural and treated wastewater by photometric method with lead diethyldithiocarbamate in carbon tetrachloride. PND F 14.1: 2.48-96. M., 1996. 14 p. [in Russian].
PND F 14.1: 2.48-96. M., 1996. 14 p. [in Russian].
Бассейн без хлора на основе ионов меди и серебра (ионизация воды)
В последнее время всё чаще к нам стали обращаться клиенты с запросами на поставку оборудования для дезинфекции воды на основе ионов меди и серебра. Своё решение приобрести такую установку клиенты объясняют желанием сделать бассейн без хлора.
Одной из основных причин появления таких обращений является уверенность людей в том, что страшнее хлора ничего не бывает: хлор пахнет, от него появляется раздражение глаз и кожи. Давайте попробуем разобраться, возможна ли дезинфекция воды в бассейне без хлора с помощью устройств на основе ионов меди и серебра. И если это возможно, то насколько такой метод безопасен для человека.
Мы будем оперировать только фактами и нормативными документами, действующими на территории Российской Федерации, а легенды и мифы о персидском царе Кире, священных водах Ганга, египетских алхимиках и прочих магах оставим производителям данного оборудования.
Серебро — элемент 11 группы (по устаревшей классификации — побочной подгруппы первой группы), пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 47. Обозначается символом Ag (лат. Argentum)[1].
Следы серебра (порядка 0,02 мг/кг веса) содержатся в организмах всех млекопитающих. Но его биологическая роль недостаточно изучена. Ионы серебра обладают бактериостатическими свойствами*. Однако, для достижения бактериостатического эффекта концентрацию ионов серебра в воде необходимо повысить настолько, что она становится непригодной для питья[2]. Вода в бассейне, согласно действующему законодательству РФ, должна быть питьевого качества.
* Бактериостатические вещества (Б. в.)
(от Бактерии и греч. stasis — cтояние на месте) антибиотики, ионы металлов (Ag+, Au3+, Hg2+, Cu2+), химиотерапевтические средства (сульфаниламиды, препараты мышьяка) и другие вещества, задерживающие полностью размножение бактерий или других микроорганизмов, т.
Как и все тяжёлые металлы, серебро, при избыточном поступлении в организм – токсично.
По данным 2009 года — нижний предел бактериостатического действия серебра находится на уровне 50 – 300 мкг/л[4], что уже опасно для человека. По данным ВОЗ, выраженный бактерицидный эффект (т. е. способность гарантированно убивать определённые бактерии) наблюдается при концентрациях ионов серебра свыше 150 мкг/л. При концентрациях 50 – 100 мкг/л ионы серебра обладают бактериостатическим действием (т. е. способностью сдерживать рост и размножение бактерий). Отметим, что при длительном поступлении в организм избыточных доз серебра развивается аргирия, внешне выражающаяся серой окраской слизистых оболочек и кожи, причем преимущественно на освещённых участках тела, что обусловлено отложением частичек восстановленного серебра. Какие-либо расстройства самочувствия заболевших аргирией наблюдаются далеко не всегда.
Согласно действующим российским санитарным нормам серебро относится к высокоопасным веществам (2-й класс опасности по санитарно-токсикологическому признаку вредности), и предельно допустимая концентрация серебра в питьевой воде составляет 0,050 мг/л(50 мкг/л)[5]. (Для справки: класс опасности хлора – 3, т. е. он считается менее опасным веществом.) Например, в ЕС (Европейский Союз) ПДК по серебру составляет 0,01 мг/л (10 мкг/л), т. е. в 5 раз ниже, чем в России. При таких концентрациях применение ионов серебра для дезинфекции вообще бесполезно.
Существует еще одна опасность применения серебра – сложность постоянного контроля за его концентрацией в воде. Все измерения приходится делать вручную, а в идеале – отдавать воду на анализ в лабораторию. Это означает, что установка, вырабатывающая ионы, продолжит их вырабатывать даже при значительном превышении концентрации и узнаете вы об этом только после очередного теста воды.
Главный вывод из вышесказанного состоит в том, что в тех концентрациях, которые разрешены действующими нормативами (а их соблюдение – закон) – 50 мкг/л по российским СанПиН – серебро в воде обладает в лучшем случае бактериостатическим эффектом, т. е. способно притормозить рост бактерий. О обеззараживающем действии при такой концентрации говорить сложно. Из этого следует, что нарушается пункт 3.8.1. СанПиН на бассейны 2.1.2.1188-03, которые гласят: “Обеззараживание воды, поступающей в ванны плавательных бассейнов, должно быть обязательным для всех бассейнов рециркуляционного типа, а также для проточных бассейнов с морской водой”.
Медь — элемент 11-й группы 4-го периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Обозначается символом Cu (от лат. Cuprum).
Соединения меди (II) обладают слабыми окислительными свойствами [6].
Ионы меди в таких установках выполняют роль альгицида и коагулянта. ПДК меди в питьевой воде 1,0 мг/л. 3-й класс опасности [5].
3-й класс опасности [5].
Все измерения количества меди в воде также приходится делать вручную, а в идеале – отдавать воду на анализ в лабораторию.
Однако стоит отметить, что практическое применение комбинации ионов меди и серебра усиливает действие этих элементов и в определенной пропорции может поддерживать воду в хорошем состоянии за счет подавления репликации и жизнедеятельности бактерий.
Устройства для ионизации воды на основе комбинации меди и серебра производятся несколькими компаниями. Количество и процентное соотношение генерируемых ионов держится в секрете. Эффективность установки зависит от алгоритма работы устройства и от качества применяемых электродов.
В результате работы таких устройств производится дезинфицирующее средство, которое подлежит сертификации в установленном порядке. Кроме сертификата на само устройство необходим сертификат и на метод обеззараживания.
Если вы решите приобрести и установить устройство данного типа в свой бассейн, настоятельно рекомендуем затребовать у продавца сертификаты установленного порядка: сертификат соответствия техническому регламенту на установку и свидетельство о государственной регистрации в таможенном союзе на дезинфицирующее средство, производимое той или иной установкой [7].
По состоянию на 04.03.2014 свидетельство установленного образца о регистрации в таможенном союзе есть только у одного производителя таких устройств. Чтобы не превращать статью в рекламную, обращайтесь за подробностями к менеджерам нашей компании. При наличии необходимых сертификатов мы не видим препятствий для установки других систем.
Продавцы подобных установок могут предоставить сертификат на само устройство от известных институтов или лабораторий, но сертификат на устройство не гарантирует действенность метода. В таком случае применение данных устройств нарушает пункт 3.8.3. СанПиН на бассейны 2.1.2.1188-03: “3.8.3.: Использование других методов обеззараживания, не указанных в п.3.8.2, допускается в том случае, если надёжность и безопасность их обоснована специальными технологическими и гигиеническими исследованиями после получения положительного санитарно-эпидемиологического заключения
“.
Ссылки производителей данных установок на пункт 3. 8.2. СанПиН на бассейны 2.1.2.1188-03 “Учитывая опасность для здоровья побочных продуктов хлорирования
(галогеносодержащих соединений), следует отдавать предпочтение
альтернативным методам обеззараживания.” имеют смысл только при наличии свидетельства о регистрации средства обеззараживания производимого тем или иным устройством.
8.2. СанПиН на бассейны 2.1.2.1188-03 “Учитывая опасность для здоровья побочных продуктов хлорирования
(галогеносодержащих соединений), следует отдавать предпочтение
альтернативным методам обеззараживания.” имеют смысл только при наличии свидетельства о регистрации средства обеззараживания производимого тем или иным устройством.
Использованные источники информации:
[1] – Википедия http://ru.wikipedia.org/wiki/Серебро
[2] – Некрасов Б. В. Основы общей химии, 1973 г.
[3] – А. А. Имшенецкий. Большая советская энциклопедия. — М.: Советская энциклопедия. 1969—1978.
[4] – Khaydarov R.A, Khaydarov R.R., Estrin Y., Cho S., Scheper T, and Endres
C, «Silver nanoparticles: Environmental and human health impacts»,
Nanomaterials: Risk and Benefits, Series: NATO Science for Peace and
Security Series C: Environmental Security, 2009, Springer, Netherlands,
pp. 287—299 ISSN 1874-6519 URL
http://dx.doi.org/10.
[5] – СанПиН 2.1.4.1074-01. Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества
[6] – Википедия – http://ru.wikipedia.org/wiki/Медь
[7] – Перечень товаров, подлежащих государственной регистрации и продукция. подлежащая государственной регистрации в соответствии с Решением Комиссии таможенного союза от 28 мая 2010 г. N 299, пункт 9.
Также в открытом доступе есть информация ВОЗ – Всемирной Организации Здравоохранения (http://www.who.int/ru/index.html) и USEPA – Агентства по Охране Окружающей Среды США. (http://water.epa.gov/)
Описание меди (Cu) и ее негативное влияние на организм человека.
Фазлутдинов К.К.
12.12.2018 (обновленно 01.02.2021)
17462 просмотров
Содержание:
1. Общие сведения о меди
Общие сведения о меди
2. Физиологическая роль меди
3. Негативное влияние меди на организм человека
1. Общие сведения о меди.
Медь — поливалентный металл XI группы таблицы Менделеева. Самой устойчивой степенью окисления меди является 2+, затем 1+. Реже можно получить соединения меди со степенями окисления 3+, 4+ и 5+.
Считается, что своё латинское название (Cuprum) этот металл получил благодаря острову Кипр, на котором более 5000 лет назад находились медные рудники и местные жители освоили технологии переработки медной руды в различные изделия. Однако, археологам встречались медные изделия и гораздо более позднего периода. Так, в Ираке была найдена медная подвеска, датируемая 8700 г до н.э. Следовательно, человечество пользуется медью уже как минимум на протяжении 10000 лет.
Несмотря на это, медики заинтересовались ее влиянием на организм человека лишь в конце 18 века. В 1893 году ученый из Швейцарии К. Негель объявил об антисептических свойствах меди. После этого было сделано открытие о решающей роли меди в обмене веществ всех живых организмов на планете и она была отнесена к важным микроэлементам.
После этого было сделано открытие о решающей роли меди в обмене веществ всех живых организмов на планете и она была отнесена к важным микроэлементам.
Из 100-150 мг (по некоторым данным – 250 мг) меди, распределенной в организме человека, 10% приходится на клетки печени. Человеческий организм испытывает постоянную потребность в меди, т.к. не может использовать ее повторно. Поэтому ежедневно с пищей человек обязательно должен получать 2-3 мг меди.
В наибольшем количестве этот элемент содержат такие продукты как:
– орехи (500-1450 мкг),
– макаронные изделия (650-700 мкг),
– морепродукты (500-900 мкг),
– злаковые (470-530 мкг)
– печень крупнорогатого скота (3000-3800 мкг).
Однако, не рекомендуется употреблять блюда богатые медью и молочные продукты в один прием пищи, т.к. медь плохо усваивается в присутствии казеина. Именно по этой причине у детей в раннем возрасте особенно велик риск развития дефицита меди, так как основным продуктом их питания является молоко.
2. Физиологическая роль меди.
Как и большинство поливалентных металлов медь играет важную роль в метаболизме животных.
а. Процессы кроветворения.
Медь стимулирует созревание ретикулоцитов (молодых эритроцитов) превращая поступающее с пищей железо в органически связанную форму.
б. Гормоны гипофиза.
Медь стимулирует выработку гормонов гипофиза, тем самым нормализируя работу эндокринной системы организма.
в. Ферменты.
Медь входит в большинство окислительных ферментов, усиливающих энергию дыхания, влияющих на белковый и углеводный обмен. Одним из самых важных считается цитохромоксидаза — фермент катализирующий финальный этап тканевого дыхания, осуществляющий перенос электронов цитохрома на кислород. Этот металл является важнейшим компонентом белка церулоплазмин, который ускоряет окисление полиаминов в плазме крови человека. Так же медь это неотъемлемая часть ферментов управляющих процессами окисления и выработки таких белков как коллаген, который является основой соединительных тканей в организме: сухожилий, хрящей, дермы и эластин, который наряду с коллагеном образует объемную сеть волокон, придающих прочность соединительной ткани. Из эластина также строятся волокна соединительных тканей, образующих внутренний слой (каркас) сосудов. Поэтому медьсодержащие препараты часто используют при лечении переломов и разрывов связок.
Из эластина также строятся волокна соединительных тканей, образующих внутренний слой (каркас) сосудов. Поэтому медьсодержащие препараты часто используют при лечении переломов и разрывов связок.
г. Защита организма.
Воздействуя вместе с аскорбиновой кислотой медь мешает проникновению в организм воспалителей и микробов. Во время инфекционных заболеваний, а также при особых формах цирроза печени наблюдается резкое увеличение медьсодержащих соединений в сыворотке крови.
д. Психологическое состояние.
После продолжительных исследований организма человека ученые сделали вывод, что медь оказывает влияние не только на физиологическое, но и на психологическое состояние человека. У людей склонных к агрессии в волосах содержится гораздо больше этого металла, чем у спокойных, сдержанных.
3. Негативное влияние меди на человека.
Избыток меди в организме, как правило, возникает у людей работающих на вредных производствах. Например, во время шлифовки медного изделия в воздух рабочей зоны в виде пыли попадают частицы меди и её оксида. Концентрация их может достигать от 0,3 до 15 мг./м3. Примерно через час вдыхания такого воздуха рабочим начнет ощущаться сладковатый привкус во рту, затем возникнет кашель, а если не предпринять никаких действий и продолжить работу, то спустя ещё несколько часов появятся такие симптомы как тошнота, головная боль, повышенная температура.
Концентрация их может достигать от 0,3 до 15 мг./м3. Примерно через час вдыхания такого воздуха рабочим начнет ощущаться сладковатый привкус во рту, затем возникнет кашель, а если не предпринять никаких действий и продолжить работу, то спустя ещё несколько часов появятся такие симптомы как тошнота, головная боль, повышенная температура.
Интоксикация медью также может наступить при длительном проживании в экологически неблагоприятных районах, неправильном использовании лекарственных препаратов, чрезмерном употреблении в пищу некоторых продуктов.
Медь в продуктах питания может присутствовать как в естественных концентрациях, так и копиться искусственно. Например, рыба может жить в водоемах, загрязненных медью от сбросов сточных вод с превышением ПДК по меди. Оттуда же может пить скот. В конечном счете рыба, мясо и субпродукты попадут на стол к человеку, но качество их будет низким, а количество меди будет зашкаливать.
Каковы последствия интоксикации медью?
а. Угнетение нервной системы.
Угнетение нервной системы.
В высоких концентрациях медь оказывает крайне негативное влияние на работу ЦНС. вплоть до развития болезни Альцгеймера.
б. Инактивация ферментов.
При избытке меди в организме происходит снижение активности образования, либо полная инактивация некоторых ферментов.
в. Угнетение дыхания.
Замедляется поступление кислорода в клетки крови, появляется головная боль, затрудняется дыхание, учащается сердцебиение, возникает тревожность. Возможно развитие диареи, тошноты, болей в животе и сильного увеличения печени.
При хроническом отравлении медью может возникать такой парадокс – избыточные ионы меди начнут откладываться в различных тканях (почки; радужные оболочки глаз; печень) оказывая на них токсичное воздействие, хотя в нормальной цепи процесса обмена веществ организма возникает дефицит этого микроэлемента.
Конец статьи
Понравилась статья? Оцените статью. Всего 1 клик!
Нажмите на звезду
Средняя оценка:
4,07
Всего оценок: 14
Данная статья является интеллектуальной собственностью ООО “НПП Электрохимия”. Любое копирование информации возможно только с разрешения владельца сайта. Размещение активной индексируемой ссылки на https://zctc.ru обязательно.
Любое копирование информации возможно только с разрешения владельца сайта. Размещение активной индексируемой ссылки на https://zctc.ru обязательно.
Болезнетворные бактерии ослабляют иммунитет, поглощая ионы меди – Газета.Ru
Болезнетворные бактерии ослабляют иммунитет, поглощая ионы меди – Газета.Ru | НовостиТренер «Динамо» Йоканович заподозрил судей в неуважении к свой… 02:50
Власти США могут закрыть тюрьму Гуантанамо 02:43
Депутат Европарламента пришел на заседание в футболке «Торино» с фамилией… 02:33
Тайфун вызвал эвакуацию более 2 млн человек в Японии 02:23
В Госдуме выступили против иностранных менеджеров в российском футболе 02:18
В Венгрии заявление Путина назвали судьбоносным для Запада 02:16
Тренер «Реала» Анчелотти рассказал о реакции Винисиуса на сравнение… 02:01
В «ПСЖ» заявили о готовности продлить контракты с Месси и… 01:56
Партия Макрона сменила название на «Ренессанс» 01:52
Полузащитник Инсинье пропустит матчи сборной Италии из-за трагедии в семье 01:47
Наука
Болезнетворные штаммы обычной кишечной палочки, поражающие мочевой пузырь и другие части выделительной системы человека, крадут основное оружие иммунных клеток – ионы меди, что позволяет им защищаться от попыток организма уничтожить очаг заражения, сообщает РИА «Новости» со ссылкой на публикацию в журнале Nature Chemical Biology.
«И хотя многие пациенты избавляются от таких болезней без особых проблем, в других случаях инфекция продолжает существовать или неоднократно возвращается, несмотря на многократные курсы антибиотиков. В некоторых случаях, болезнь распространяется в почки или кровь и начинает угрожать здоровью пациента. Мы изучали, чем же отличаются наиболее опасные кишечные палочки от других патогенных штаммов этого микроба», – заявил руководитель группы биологов Джеффри Хендерсон из Медицинской школы университета штата Вашингтон в Сент-Луисе (США).
Хендерсон и его коллеги изучали продукты жизнедеятельности, которые выделяют различные штаммы кишечной палочки Escherichia coli, поражающие мочеполовые пути человека.
Как отмечают исследователи, в своей предыдущей работе они выяснили, что болезнетворность кишечной палочки зависит от того, насколько активно она выделяет молекулы иерсиниябактина. Это вещество позволяет бактерии «отнимать» ионы железа у пораженного организма и использовать их для собственных нужд – размножения и транспортировки энергии.
Несмотря на столь важную роль иерсиниябактина в жизни кишечной палочки, оставалось непонятным, как это вещество влияет на устойчивость бациллы к иммунной системе человека. Авторы статьи нашли ответ на этот вопрос при помощи простого опыта – они добавили иерсиниябактин в образцы мочи здоровых людей и проследили за тем, с ионами каких металлов соединяются молекулы этого вещества.
Оказалось, что молекулы иерсиниябактина присоединяют не только ионы железа, но и меди. Как объясняют ученые, ионы меди токсичны для кишечной палочки и других бактерий и их повышенная концентрация в среде обитания может привести к гибели микробов. В частности, некоторые иммунные клетки используют ионы меди в качестве оружия для борьбы с инфекцией мочевого пузыря.
Таким образом, иерсиниябактин выполняет сразу две функции – он нейтрализует свободные ионы меди и конкурирует за доступ к ним с иммунными клетками, лишая их возможности использовать медь для защиты организма. Это позволяет бактериям выживать внутри мочевого пузыря и переносить дополнительные нагрузки, такие как курсы антибиотиков.
Авторы статьи полагают, что результаты их работы могут быть приспособлены для диагностики инфекции на ранних этапах ее развития – чем больше в моче пациента соединений иерсиниябактина и меди, тем сложнее будет вылечить заражение. Это поможет подобрать адекватные методы борьбы с кишечной палочкой до того, как болезнь начнет угрожать жизни пациента, заключают ученые.
Подписывайтесь на «Газету.Ru» в Новостях, Дзен и Telegram.
Чтобы сообщить об ошибке, выделите текст и нажмите Ctrl+Enter
Новости
Дзен
Telegram
Картина дня
Диверсанты, взрывы, перестрелка. Что произошло в Херсоне
ТАСС: российские силовики ликвидировали вооруженную группу в Херсоне
«Урганта и Орбакайте выгнали из театра за неуважение к гимну». Объясняем, почему это фейк
Иван Ургант и Кристина Орбакайте опровергли слухи об отказе вставать под гимн России
У виллы Дмитрия Киселева в Крыму сожгли две машины. Это сделал человек в маске и бахилах
Неизвестный поджег автомобили на вилле телеведущего Дмитрия Киселева в Крыму
Администрация Херсонской области заявила о полном контроле российских сил над регионом
Лукашенко заявил о защищенности исконно национальных границ Белоруссии
Высокопоставленный чиновник НАТО оскорбил россиян с помощью носков
В НАТО признали планы расширить свои границы к пределам России несколько лет назад
Новости и материалы
Тренер «Динамо» Йоканович заподозрил судей в неуважении к свой команде
Власти США могут закрыть тюрьму Гуантанамо
Депутат Европарламента пришел на заседание в футболке «Торино» с фамилией Миранчука
Тайфун вызвал эвакуацию более 2 млн человек в Японии
В Госдуме выступили против иностранных менеджеров в российском футболе
В Венгрии заявление Путина назвали судьбоносным для Запада
Тренер «Реала» Анчелотти рассказал о реакции Винисиуса на сравнение его с обезьяной
В «ПСЖ» заявили о готовности продлить контракты с Месси и Рамосом
Партия Макрона сменила название на «Ренессанс»
Полузащитник Инсинье пропустит матчи сборной Италии из-за трагедии в семье
Посольство Украины отреагировало на слова экс-главы МИД Румынии об украинских границах
Полузащитник «Зенита» Мантуан назвал себя талисманом петербургской команды
Брата полузащитника «Ювентуса» Погба заключили под стражу
Пушилин поручил организовать в ДНР круглосуточную разгрузку и развоз топлива
Космонавты попросили привезти к месту приземления «Союза МС-21» капусту, репу и шашлыки
«Барселона» планирует бесплатно подписать полузащитника «Челси» Жоржиньо
В Молдавии организаторы протеста ожидают 50 тыс. участников митинга в Кишиневе
участников митинга в Кишиневе
Мбаппе обогнал Месси и Роналду в списке самых высокооплачиваемых футболистов
Все новости
Военная операция РФ на Украине. День 206-й
Онлайн-трансляция военной спецоперации РФ на Украине — 206-й день
«Сначала королева, теперь он». Умер режиссер Масленников — автор фильмов о Шерлоке Холмсе
Режиссер советских фильмов про Шерлока Холмса Игорь Масленников умер в возрасте 90 лет
Худший летний трансфер: новичок «Спартака» Бальде отстранен из-за проблем с допингом
Национальный антидопинговый суд Италии дисквалифицировал игрока «Спартака» Бальде до 5 декабря
«Это была чудовищная ошибка». Власти Шри-Ланки извинились за арест лайнера «Аэрофлота»
Власти Шри-Ланки назвали арест самолета «Аэрофлота» ошибкой и принесли извинения
Тест: угадайте артиста по его питомцу
Попробуйте угадать звезд по фотографиям их домашних животных
Зеленский напомнил Германии о «нацистском прошлом»
Зеленский заявил, что нацистское прошлое Германии мешает поставкам оружия на Украину
Лучшие фотографии недели
США намекают на поставки Украине штурмовиков и истребителей
Почему союзники до сих пор не предоставили Киеву военные самолеты
Юморист-иноагент. Минюст внес Галкина в черный список
Максим Галкин включен в список физлиц-иноагентов
«Ради мужа пошла на секс-тренинг, а теперь он считает меня проституткой»
Менеджер из Санкт-Петербурга — о неожиданной проблеме в сексуальной жизни
Тимати, Самойлова, Бородина: какими подарками балуют своих детей знаменитости
Истории пяти звезд о подарках, которые они делали своим детям
«Просят рак легких вместо импотенции». Как заставить россиян бросить курить и пить
Маркетологи объяснили, почему курильщиков не пугают страшные картинки на пачке
Как теперь зарабатывать на Ethereum. Советы аналитиков
Советы аналитиков
Чэнь Лиминь из ICB Fund рассказал, кто заработает на Ethereum после раскола
Дмитрий Воденников
Слезы Толстого
О том, что никто не придет назад
Дмитрий Самойлов
Почему дизлайкают ламантинов?
О темнокожей русалочке
Евгений Коган
Что почем
О том, какой курс рубля сегодня комфортен для российской экономики
Владимир Трегубов
Эволюция денег
О том, как человечество шло от ракушек и золота к современной валюте
Андрей Колесников
Партитура Либермана
Об уроке первого приступа реформаторства
–>
Читайте также
Найдена ошибка?
Закрыть
Спасибо за ваше сообщение, мы скоро все поправим.
Продолжить чтение
Комплексы меди – MEL Chemistry
Реагенты
- Сульфат меди(II)
- Пиросульфит натрия
- Хлорид натрия
- Карбонат аммония
Безопасность
- Перед началом опыта наденьте защитные перчатки и очки.

- Проводите эксперимент на подносе в хорошо проветриваемом помещении.
- Не вдыхайте пары́ аммиака из стаканчика с карбонатом аммония.
Общие правила безопасности
- Не допускайте попадания химических реагентов в глаза или рот.
- Не допускайте к месту проведения экспериментов людей без защитных очков, а также маленьких детей и животных.
- Храните экспериментальный набор в месте, недоступном для детей младше 10 лет.
- Помойте или очистите всё оборудование и оснастку после использования.
- Убедитесь, что все контейнеры с реагентами плотно закрыты и хранятся по правилам после использования.
- Убедитесь, что все одноразовые контейнеры правильно утилизированы.
- Используйте только оборудование и реактивы, поставляемые в наборе или рекомендуемые текущими инструкциями.

- Если вы использовали контейнер для еды или посуду для проведения экспериментов, немедленно выбросьте их. Они больше не пригодны для хранения пищи.
Информация о первой помощи
- В случае попадания реагентов в глаза тщательно промойте глаза водой, при необходимости держа глаз открытым. Немедленно обратитесь к врачу.
- В случае проглатывания реагентов промойте рот водой, выпейте немного чистой воды. Не вызывайте рвоту. Немедленно обратитесь к врачу.
- В случае вдыхания реагентов выведите пострадавшего на свежий воздух.
- В случае контакта с кожей или ожогов промывайте поврежденную зону большим количеством воды в течение 10 минут или дольше.
- В случае сомнений немедленно обратитесь к врачу.
 Возьмите с собой химический реагент и контейнер от него.
Возьмите с собой химический реагент и контейнер от него. - В случае травм всегда обращайтесь к врачу.
Рекомендации для родителей
- Неправильное использование химических реагентов может вызвать травму и нанести вред здоровью. Проводите только указанные в инструкции эксперименты.
- Данный набор опытов предназначен только для детей 10 лет и старше.
- Способности детей существенно различаются даже внутри возрастной группы. Поэтому родители, проводящие эксперименты вместе с детьми, должны по своему усмотрению решить, какие опыты подходят для их детей и будут безопасны для них.
- Родители должны обсудить правила безопасности с ребенком или детьми перед началом проведения экспериментов. Особое внимание следует уделить безопасному обращению с кислотами, щелочами и горючими жидкостями.

- Перед началом экспериментов очистите место проведения опытов от предметов, которые могут вам помешать. Следует избегать хранения пищевых продуктов рядом с местом проведения опытов. Место проведения опытов должно хорошо вентилироваться и находиться близко к водопроводному крану или другому источнику воды. Для проведения экспериментов потребуется устойчивый стол.
- Вещества в одноразовой упаковке должны быть использованы полностью или утилизированы после проведения одного эксперимента, т.е. после открытия упаковки.
Часто задаваемые вопросы
Мы добавили слишком много реагента. Что делать?
Не волнуйтесь! Продолжайте эксперимент и наблюдайте за происходящим. Когда закончите, повторите опыт с правильным количеством нужного вещества, а затем сравните результаты.
После добавления сульфата меди(II) CuSO4 к карбонату аммония (NH4)2CO3 смесь стала пузыриться и шипеть. Это нормально?
Это нормально?
Да! В ходе этой реакции выделяется углекислый газ CO2 — отсюда и пузыри. А еще в небольшом количестве выделяется аммиак NH3, поэтому вы можете почувствовать легкий запах.
Все растворы в стаканчиках одного цвета.
Возможно, вы случайно смешали реагенты. Повторите опыт, внимательно отслеживая, какое именно вещество вы используете.
Растворы такие красивые и яркие! Как их правильно утилизировать?
Рады, что вам нравится результат! Растворы можно вылить в раковину и обильно промыть ее водой.
Другие эксперименты
Дистилляция
Серная луна
Разноцветное молоко
Электролиз воды
Пошаговая инструкция
Налейте в три разных стаканчика бесцветные растворы, как показано ниже.
Добавьте в стаканчики сульфат меди CuSO4.
Теперь реагенты нужно перемешать.
Утилизация
Твердые отходы эксперимента утилизируйте вместе с бытовым мусором.
Что произошло
Раствор сульфата меди CuSO4 красивого синего цвета, но цвет меняется при смешивании с другими веществами. Почему это происходит? Цвет раствора зависит от взаимодействий ионов меди Cu2+ с окружающими их веществами. В растворе CuSO4 они окружены молекулами воды H2O, и именно благодаря такой структуре у раствора и появляется насыщенный синий цвет. Кстати, у кристаллов сульфата меди такой цвет тоже из-за воды, но об этом — в другом опыте этого набора!
Карбонат аммония (NH4)2CO3 выделяет в раствор молекулы аммиака NH3, которые легко заменяют воду, окружающую Cu2+ . Таким образом получается темно-синий комплекс меди с аммиаком .
Таким образом получается темно-синий комплекс меди с аммиаком .
В растворе хлорида натрия NaCl содержатся хлорид-ионы Cl\- . Когда они собираются вокруг ионов Cu2+ , раствор окрашивается в очень красивый зеленый цвет.
Происходящие с пиросульфитом натрия Na2S2O5 процессы уже не так просты. Он превращает Cu2+ в Cu1+ и выделяет молекулы двуокиси серы SO2 . И вот она уже и образует с Cu+ желтовато-оранжевый комплекс .
Гель для интимной гигиены ARGENTUM LACTA (коллоидное серебро+ионы меди), Shokonat Professional Cosmetics
Название:
Артикул:
Текст:
Выберите категорию:
Все НАТУРАЛЬНЫЙ УХОД ЗА ЛИЦОМ » Косметика для очищения кожи век, лица и шеи » Тоники » Гидролаты » Сыворотки » Кремы, сливки, гели, масла косметические для лица и шеи » Кремы, сливки, гели, масла косметические , патчи, сыворотки для век » Уход за ресницами и бровями » Уход за губами » Пилинги, Скрабы, Гоммажи для лица и шеи » Патчи и маски косметические для век, лица и шеи » Средства защиты от солнца и восстановления кожи лица и шеи после загара НАТУРАЛЬНЫЙ УХОД ЗА ТЕЛОМ » Средства ухода за руками » Кремы, гели, сливки, спреи, масла для тела » Средства ухода за стопами » Средства для массажа » Скрабы ,Пилинги, Гоммажи для тела » Маски, Обертывания для тела » Коррекция фигуры и Антицеллюлитные средства » Средства защиты от солнца и восстановления кожи тела » Средства для депиляции и бритья тела НАТУРАЛЬНЫЙ УХОД ЗА ВОЛОСАМИ » Шампуни без сульфатов » Бальзамы и Кондиционеры для волос » Маски и лечебные средства для волос » Несмываемые средства ухода за волосами ДЛЯ МУЖЧИН ДЛЯ ДЕТЕЙ И ПОДРОСТКОВ НАТУРАЛЬНЫЕ СРЕДСТВА ГИГИЕНЫ » Средства дезинфекции рук и помещений » Гели для душа » Бельди » Мыло » Средства для интимной гигиены » Уход за полостью рта » Дезодоранты НАТУРАЛЬНАЯ ДЕКОРАТИВНАЯ КОСМЕТИКА » Основы под макияж, Праймеры » Тональные и ВВ кремы » Пудры, Хайлайтеры , Консилеры » Румяна, Бронзеры » Тушь для ресниц » Тени, Подводки, Карандаши для век » Тени, Карандаши, Помады для бровей » Средства для губ » Аксессуары СПА И АРОМАТЕРАПИЯ » Эфирные масла и Аромамасла » Косметические масла » Аромабальзамы » Духи » Ароматизаторы, Аромасвечи, Аромапалочки » Соли, Концентраты для ванн, Фитованны » Гейзеры для ванн » Пены для ванн ЦЕЛЕБНЫЙ КРЫМ, АЛТАЙ, СИБИРЬ, КАВКАЗ » Грязь Сакского озера и средства на ее основе » Живица кедровая » Маклюра » Мумиё » Прополис » Средства с водорослями » Похудение, коррекция фигуры, улучшение обмена веществ » Защита от насекомых и средства помощи при укусах » Кожный покров » Опорно-двигательная система » Сердечно-сосудистая система » Пищеварительная система » Дыхательная система и ЛОР органы » Эндокринная система » Мочеполовая система » Нервная система » Зрительная система » Очищение организма » Иммунная система » Противопростудные средства » Полость рта БЫТОВАЯ НЕ ХИМИЯ » Для мытья посуды » Для уборки дома » Для стирки ЧАЙ » Фиточай » В составе черный , зеленый чай ПОДАРОЧНЫЕ НАБОРЫ С ЛЕГКИМ ПАРОМ » Натуральные косметические средства для бани и сауны » Фиточай для бани и сауны » Аксессуары для бани и сауны АКСЕССУАРЫ КАТАЛОГ ДЛЯ ОПТОВИКОВ » DOCTOR OIL (КРЫМ) »» Косметические масла DOCTOR OIL опт »» Аптека органическая DOCTOR OIL опт »» Косметические средства для волос DOCTOR OIL опт »» Косметические средства для век и ресниц DOCTOR OIL опт »» Косметические средства для лица DOCTOR OIL опт »» Косметические средства для тела DOCTOR OIL опт »» Серия косметики Florana DOCTOR OIL опт » ЦАРСТВО АРОМАТОВ (КРЫМ) »» Варенье ТМ “Конфитюр” опт »» Травяной чай и Фиточай “Будьте здоровы” ТМ “Конфитюр” опт »» Бальзамы косметические и средства для массажа опт »» Эфирные масла и Аэрозоли эфирных масел опт »» Масла косметические опт »» Кремы-масло и кремы-йогурты опт »» Сыворотки и масло “Живая косметика” опт »» Гидролаты , душистая вода, тоники натуральные опт »» Патчи и тканевые маски для лица опт »» Маски Живые , Фруктовые и маски Живая Крымская Косметика опт »» Освежители для полости рта с пребиотиками опт »» Помады гигиенические опт »» Гели и крем-гели косметические опт »» Сливки косметические натуральные с растительными экстрактами опт »» Пенки, мицеллярная вода и гидрофильные масла для очищения кожи лица опт »» Крем-скрабы для лица ENERGETIC опт »» Скрабы масляно-солевые, сахарные для лица, губ и тела опт »» Соли, концентраты и пены для ванны опт »» Мыло и мочалки джутовые с мылом опт »» Крем-Дезодоранты и Присыпки дезодорирующие опт »» Духи твердые опт »» Системные комплексные программы по уходу за кожей с сосудистой сеточкой опт »» Серии детской косметики “Амадина” и “Сашенька” опт »» Серия кремов Cream-Mousse опт »» Серия fitoлифтинг с маклюрой опт »» Серия с муцином улитки опт »» Серия косметики “Orange Vitamin Multicomplex” с облепихой для антивозрастного ухода опт »» Серия косметики “Гранат&Грейпфрут” для всех типов кожи опт »» Серия косметики “Огуречная” опт »» Серия косметики “Aloe Vera” для чувствительной и проблемной кожи опт »» Серия косметики “Blanc Bleu” на основе белой глины опт »» Серия косметики “X stream” для мужчин с натуральным комплексом биоактивных компонентов о »» Серия косметики “Choco Cream” на основе какао опт »» Серия косметики “4 Seasons Care”для сухой и чувствительной кожи с сосудистой сеточкой опт »» Серия косметики”Genesis” для лица, шеи и зоны декольте опт »» Серия косметики “Antiage” для ухода за зрелой кожей с полифенолами винограда опт »» Серия косметики “Vanilla” для волос и тела опт »» Серия косметики “Spa” для антицеллюлитного ухода опт »» Серия косметики “Восточная” опт »» Серия солнцезащитной косметики “Sunline” опт
Возраст:
Все0 +7+12 – 1818 – 2525 +35 +45 +55 +
Тип кожи:
ВсеНормальнаяСухаяЧувствительнаяКомбинированнаяПроблемнаяЖирная
Производитель:
ВсеАлтайский НектарАлтай ФлораБизорюкКрымская Живая КосметикаКавказский ЦелительКомпас ЗдоровьяКонфитю ,КрымКрымский ДесертКрымский СолепромыселКрымская Натуральная КоллекцияКрымская РозаКрымский ТравникКрымский ЧайМануфактура Дом Природы , КрымМастерская Олеси МустаевойМонастырская ПродукцияМоре ЛечитНародный ЦелительПантика, КрымПолиада, КрымСакские грязи (Формула Здоровья), КрымСашера-МедСпивакЪЦарство Ароматов, КрымЧистаунBotavikosCosmos Organic CosmeticsChikoroffChocoLatteDeonatDoctor OilDr. AquaEcoCraftFitparadFreshbubbleJurassic SpaInnatureKristall MineralsLaboratoriumLekkosLevranaMiKoOrganicZonePure WaterRozettaShokonatTambuSunTinto
AquaEcoCraftFitparadFreshbubbleJurassic SpaInnatureKristall MineralsLaboratoriumLekkosLevranaMiKoOrganicZonePure WaterRozettaShokonatTambuSunTinto
Новинка:
Вседанет
Спецпредложение:
Вседанет
Результатов на странице:
5203550658095
Понимание явления высвобождения ионов меди из мембран TFC, модифицированных медью: математическая и экспериментальная методология с использованием модели усадочного сердечника
1. Канг Г., Цао Ю. Разработка противообрастающих мембран обратного осмоса для очистки воды: обзор. Вода Res. 2012; 46: 584–600. doi: 10.1016/j.waters.2011.11.041. [PubMed] [CrossRef] [Google Scholar]
2. Буономенна М.Г. Мембраны обратного осмоса с улучшенными нанотехнологиями. Опреснение. 2013; 314:73–88. doi: 10.1016/j.desal.2013.01.006. [Перекрестная ссылка] [Академия Google]
3. Гош А.К., Биндал Р.К., Прабхакар С., Тевари П.К. Композитные полиамидные мембраны обратного осмоса (ОО) – последние разработки и будущие направления. Новости БАРК. 2011; 321:43–51. [Google Scholar]
Новости БАРК. 2011; 321:43–51. [Google Scholar]
4. Jiang S., Li Y., Ladewig B.P. Обзор методов борьбы с загрязнением мембраны обратного осмоса. науч. Общая окружающая среда. 2017; 595: 567–583. doi: 10.1016/j.scitotenv.2017.03.235. [PubMed] [CrossRef] [Google Scholar]
5. Matin A., Khan Z., Zaidi S.M.J., Boyce M.C. Биообрастание в мембранах обратного осмоса для опреснения морской воды: явления и предотвращение. Опреснение. 2011; 281:1–16. doi: 10.1016/j.desal.2011.06.063. [Перекрестная ссылка] [Академия Google]
6. Нгуен Т., Роддик Ф.А., Фан Л. Биообрастание мембран для очистки воды: обзор основных причин, методов мониторинга и мер контроля. Мембраны. 2012;2:804–840. doi: 10.3390/membranes2040804. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Касим М., Бадрелзаман М., Дарвиш Н.Н., Дарвиш Н.А., Хилал Н. Опреснение обратным осмосом: современный обзор. Опреснение. 2019; 459: 59–104. doi: 10.1016/j.desal.2019.02.008. [Перекрестная ссылка] [Академия Google]
8. Альварадо К., Фаррис К., Килдафф Дж. Новые мембранные технологии для устойчивой очистки воды. Эльзевир; Амстердам, Нидерланды: 2016 г. Мембранное загрязнение, моделирование и последние разработки для смягчения последствий; стр. 433–462. [Google Scholar]
Альварадо К., Фаррис К., Килдафф Дж. Новые мембранные технологии для устойчивой очистки воды. Эльзевир; Амстердам, Нидерланды: 2016 г. Мембранное загрязнение, моделирование и последние разработки для смягчения последствий; стр. 433–462. [Google Scholar]
9. Бейкер Дж.С., Дадли Л.Ю. Биообрастание в мембранных системах — обзор. Опреснение. 1998; 118:81–89. doi: 10.1016/S0011-9164(98)00091-5. [CrossRef] [Google Scholar]
10. Ву Дж., Контрерас А.Е., Ли К. Изучение влияния функциональных групп поверхности мембран обратного осмоса на альгинатное обрастание при опреснении морской воды. Дж. Член. науч. 2014; 458:120–127. doi: 10.1016/j.memsci.2014.01.056. [Перекрестная ссылка] [Академия Google]
11. Карханечи Х., Рази Ф., Савада И., Такаги Р., Омукай Ю., Мацуяма Х. Улучшение противообрастающих свойств обратноосмотической мембраны за счет высвобождения биоцидов и устойчивости к адгезии. Сентябрь Пуриф. Технол. 2013; 105:106–113. doi: 10.1016/j.seppur.2012.12.016. [CrossRef] [Google Scholar]
12. Гох П.С., Зулхайрун А.К., Исмаил А.Ф., Хилал Н. Современные противообрастающие модификации опреснительной мембраны обратного осмоса: обзор. Опреснение. 2019;468:114072. doi: 10.1016/j.desal.2019.114072. [CrossRef] [Google Scholar]
Гох П.С., Зулхайрун А.К., Исмаил А.Ф., Хилал Н. Современные противообрастающие модификации опреснительной мембраны обратного осмоса: обзор. Опреснение. 2019;468:114072. doi: 10.1016/j.desal.2019.114072. [CrossRef] [Google Scholar]
13. Риджуэй Х., Исида К., Родригес Г., Шафарик Дж., Ноэлл Т., Болд Р. Биообрастание мембран: подготовка мембран, характеристика и анализ бактериальной адгезии. Методы Энзимол. 1999; 310:441–460. doi: 10.1016/S0076-6879(99)10036-3. [PubMed] [CrossRef] [Google Scholar]
14. Инбакандан Д., Кумар С., Абрахам Л.С., Кирубагаран Р., Венкатесан Р., Хан С.А. Наночастицы серебра с эффектом против микрообрастания: исследование морских бактерий, образующих биопленку. Коллоидный прибой. Б Биоинтерфейсы. 2013; 111:636–643. doi: 10.1016/j.colsurfb.2013.06.048. [PubMed] [CrossRef] [Академия Google]
15. Рана Д., Ким Ю., Мацуура Т., Арафат Х.А. Разработка противообрастающих тонкопленочных композитных мембран для опреснения морской воды. Дж. Член. науч. 2011; 367:110–118. doi: 10.1016/j.memsci.2010.10.050. [CrossRef] [Google Scholar]
2011; 367:110–118. doi: 10.1016/j.memsci.2010.10.050. [CrossRef] [Google Scholar]
16. Раза М.А., Ислам А., Сабир А., Галл Н., Али И., Мехмуд Р., Бэй Дж., Хассан Г., Хан М.У. Сшитые мембраны PVA/TEOS, содержащие наночастицы оксида цинка и альгинат натрия, улучшают характеристики обратного осмоса для опреснения. Дж. Заявл. Полим. науч. 2019;136:47559. doi: 10.1002/app.47559. [CrossRef] [Google Scholar]. науч. Общая окружающая среда. 2009; 407:1461–1468. doi: 10.1016/j.scitotenv.2008.10.053. [PubMed] [CrossRef] [Google Scholar]
18. Квак С.-Ю., Ким С.-Х., Ким С.-С. Мембрана обратного осмоса, обладающая отличными противообрастающими свойствами, и способ ее изготовления. 6551536Б1. Патены США. 2003 22 апреля
19. Гарсия А., Кинтеро Ю., Висенсио Н., Родригес Б., Озтюрк Д., Москера Э., Корралес Т.П., Фолькманн У.Г. Влияние наноструктур TiO 2 на антиадгезионные и фотоиндуцированные бактерицидные свойства тонкопленочных композитных мембран. RSC Adv. 2016;6:82941–82948. doi: 10.1039/C6RA17999A. [CrossRef] [Google Scholar]
doi: 10.1039/C6RA17999A. [CrossRef] [Google Scholar]
20. Гарсия А., Родригес Б., Озтюрк Д., Росалес М., Паредес К., Куадра Ф., Монтсеррат С. Эффективность опреснения противообрастающих мембран обратного осмоса. Мод. Окружающая среда. науч. англ. 2016; 2: 481–489.. doi: 10.15341/mese(2333-2581)/07.02.2016/007. [CrossRef] [Google Scholar]
21. García A., Rodríguez B., Ozturk D., Rosales M., Diaz D.I., Mautner A. Включение наночастиц CuO в тонкопленочные композитные мембраны обратного осмоса (TFC-RO) на противообрастающие свойства. Полим. Бык. 2018;75:2053–2069. doi: 10.1007/s00289-017-2146-4. [CrossRef] [Google Scholar]
22. Родригес Б., Озтюрк Д., Росалес М., Флорес М., Гарсия А. Противообрастающие тонкопленочные композитные мембраны (TFC) путем образования Cu-(м-фенилендиамина) in situ. ) олигомерный комплекс. Дж. Матер. науч. 2018;53:6325–6338. doi: 10.1007/s10853-018-2039-4. [CrossRef] [Google Scholar]
23. Ben-Sasson M., Zodrow K.R., Genggeng Q., Kang Y. , Giannelis EP, Elimelech M. Функционализация поверхности тонкопленочных композитных мембран с наночастицами меди для придания антимикробных свойств поверхности. Окружающая среда. науч. Технол. 2014;48:384–393. doi: 10.1021/es404232s. [PubMed] [CrossRef] [Google Scholar]
, Giannelis EP, Elimelech M. Функционализация поверхности тонкопленочных композитных мембран с наночастицами меди для придания антимикробных свойств поверхности. Окружающая среда. науч. Технол. 2014;48:384–393. doi: 10.1021/es404232s. [PubMed] [CrossRef] [Google Scholar]
24. Gladis F., Eggert A., Karsten U., Schumann R. Предотвращение роста биопленки на искусственных поверхностях: оценка противоводорослевой активности двух биоцидов и фотокаталитических наночастиц. Биообрастание. 2010;26:89–101. doi: 10.1080/08927010
8184. [PubMed] [CrossRef] [Google Scholar]
25. Матранга В., Корси И. Токсическое воздействие искусственных наночастиц в морской среде: модельные организмы и молекулярные подходы. Мар Окружающая среда. Рез. 2012;76:32–40. doi: 10.1016/j.marenvres.2012.01.006. [PubMed] [CrossRef] [Google Scholar]
26. Чоффи Н., Торси Л., Дитаранто Н., Тантилло Г., Гибелли Л., Саббатини Л., Блеве-Закео Т., Д’Алессио М., Замбонин П.Г., Траверса Э. Композиты наночастиц меди/полимер с противогрибковыми и бактериостатическими свойствами. хим. Матер. 2005; 17: 5255–5262. doi: 10.1021/cm0505244. [Перекрестная ссылка] [Академия Google]
хим. Матер. 2005; 17: 5255–5262. doi: 10.1021/cm0505244. [Перекрестная ссылка] [Академия Google]
27. Мегана С., Кабра П., Чакраборти С., Падмавати Н. Понимание механизма антибактериальной активности наночастиц оксида меди. RSC Adv. 2015;5:12293–12299. doi: 10.1039/C4RA12163E. [CrossRef] [Google Scholar]
28. Онтиверос М.А., Кинтеро Ю., Лланкилеф А., Морел М. Антибиообрастающие и опресняющие свойства тонкопленочных композитных мембран обратного осмоса, модифицированных наночастицами меди и железа. Материалы. 2019;12:2081. doi: 10.3390/ma12132081. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Che X., Ding R., Li Y., Zhang Z., Gao H., Wang W. Механизм долгосрочной токсичности НЧ CuO для микроводорослей. Нанотоксикология. 2018;12:923–939. doi: 10.1080/17435390.2018.1498928. [PubMed] [CrossRef] [Google Scholar]
30. Чен К.Л., Ботун Г.Д. Встреча наночастиц с клеточными мембранами: исследование неспецифических взаимодействий с использованием модельных мембран. Окружающая среда. науч. Технол. 2014; 48: 873–880. doi: 10.1021/es403864v. [PubMed] [CrossRef] [Google Scholar]
Окружающая среда. науч. Технол. 2014; 48: 873–880. doi: 10.1021/es403864v. [PubMed] [CrossRef] [Google Scholar]
31. Beddoes C.M., Case C.P., Briscoe W.H. Понимание проникновения наночастиц в клетку: физико-химическая перспектива. Доп. Коллоидный интерфейс Sci. 2015; 218:48–68. doi: 10.1016/j.cis.2015.01.007. [PubMed] [CrossRef] [Академия Google]
32. Саркар А., Дас Дж., Манна П., Сил П.К. Нано-медь вызывает окислительный стресс и апоптоз в почках как внешними, так и внутренними путями. Токсикология. 2011; 290:208–217. doi: 10.1016/j.tox.2011.09.086. [PubMed] [CrossRef] [Google Scholar]
33. Чанг Ю.Н., Чжан М., Ся Л., Чжан Дж., Син Г. Токсические эффекты и механизмы наночастиц CuO и ZnO. Материалы. 2012;5:2850–2871. дои: 10.3390/ma5122850. [CrossRef] [Google Scholar]
34. Kaweeteerawat C., Chang C.H., Roy K.R., Liu R., Li R., Toso D., Fischer H., Ivask A., Ji Z., Zink J.I., et al. . Наночастицы Cu оказывают иное воздействие на Escherichia coli и Lactobacillus brevis, чем их микроразмерные и ионные аналоги. АКС Нано. 2015;9: 7215–7225. doi: 10.1021/acsnano.5b02021. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
АКС Нано. 2015;9: 7215–7225. doi: 10.1021/acsnano.5b02021. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
35. Beswick P.H., Hall G.H., Hook A.J., Little K., McBrien D.C.H., Lott K.A.K. Токсичность меди: данные о превращении двухвалентной меди в одновалентную медь in vivo в анаэробных условиях. хим. биол. Взаимодействовать. 1976; 14: 347–356. doi: 10.1016/0009-2797(76)
-7. [PubMed] [CrossRef] [Google Scholar]36. Ren G., Hu D., Cheng E.W.C., Vargas-Reus M.A., Reip P., Allaker R.P. Характеристика наночастиц оксида меди для антимикробных применений. Междунар. Дж. Антимикроб. Агенты. 2009 г.;33:587–590. doi: 10.1016/j.ijantimicag.2008.12.004. [PubMed] [CrossRef] [Google Scholar]
37. Хедберг Дж., Бломберг Э., Одневалл Валлиндер И. В поисках наноспецифических эффектов растворения металлических наночастиц в условиях, подобных пресноводным: критический обзор. Окружающая среда. науч. Технол. 2019;53:4030–4044. doi: 10.1021/acs.est.8b05012. [PubMed] [CrossRef] [Google Scholar]
38. Zhang W., Yao Y., Sullivan N., Chen Y. Моделирование влияния основного размера наночастиц серебра, покрытых цитратом, на их кинетику высвобождения ионов. Окружающая среда. науч. Технол. 2011;45:4422–4428. doi: 10.1021/es104205a. [PubMed] [CrossRef] [Академия Google]
Zhang W., Yao Y., Sullivan N., Chen Y. Моделирование влияния основного размера наночастиц серебра, покрытых цитратом, на их кинетику высвобождения ионов. Окружающая среда. науч. Технол. 2011;45:4422–4428. doi: 10.1021/es104205a. [PubMed] [CrossRef] [Академия Google]
39. Кент Р. Д., Виксланд П. Дж. Растворение и стойкость наноматериалов на основе меди в недонасыщенных растворах по отношению к медным твердым фазам. Окружающая среда. науч. Технол. 2016;50:6772–6781. doi: 10.1021/acs.est.5b04719. [PubMed] [CrossRef] [Google Scholar]
40. Левеншпиль О. Инженерия химических реакций. Том 38 Публикации ACS; Вашингтон, округ Колумбия, США: 1999. [Google Scholar]
41. Сафари В., Арзпейма Г., Ращи Ф., Мостоуфи Н. Сжимающаяся частица — модель сжимающегося ядра для выщелачивания цинковой руды, содержащей кремнезем. Междунар. Дж. Майнер. Процесс. 2009 г.;93:79–83. doi: 10.1016/j.minpro.2009.06.003. [CrossRef] [Google Scholar]
42. Гото М., Рой Б.К., Хиросе Т. Модель выщелачивания с усадкой керна для экстракции сверхкритической жидкости. Дж. Суперкрит. Жидкости. 1996; 9: 128–133. doi: 10.1016/S0896-8446(96)
Дж. Суперкрит. Жидкости. 1996; 9: 128–133. doi: 10.1016/S0896-8446(96)
43. Рахимпур А., Мадаени С.С., Тахери А.Х., Мансурпанах Ю. Связывание наночастиц TiO 2 с УФ-облучением для модификации полиэфирсульфоновых ультрафильтрационных мембран. Дж. Член. науч. 2008; 313: 158–169.. doi: 10.1016/j.memsci.2007.12.075. [CrossRef] [Google Scholar]
44. Каннинен П., Йоханс С., Мерта Дж., Конттури К. Влияние структуры лиганда на стабильность и окисление наночастиц меди. J. Коллоидный интерфейс Sci. 2008; 318:88–95. doi: 10.1016/j.jcis.2007.09.069. [PubMed] [CrossRef] [Google Scholar]
45. Ван З., Фон Дем Буше А., Кабади П.К., Кейн А.Б., Хёрт Р.Х. Биологические и экологические трансформации наноматериалов на основе меди. АКС Нано. 2013;7:8715–8727. doi: 10.1021/nn403080y. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
46. Шевалье М.Т., Гонсалес Дж., Альварес В. Биоразлагаемые полимерные микрочастицы как средства доставки лекарств. IFMBE Proc. 2015;49:187–190. doi: 10.1007/978-3-319-13117-7_49. [CrossRef] [Google Scholar]
IFMBE Proc. 2015;49:187–190. doi: 10.1007/978-3-319-13117-7_49. [CrossRef] [Google Scholar]
47. Фоглер Х.С. Основы инженерии химических реакций: Essenti Chemica Reactio Engi. Пирсон Образование; London, UK: 2010. [Google Scholar]
48. Madigan M.T., Martinko J.M., Parker J. Brock Biology of Microorganisms. Том 11 Прентис Холл; Река Аппер-Сэдл, Нью-Джерси, США: 1997. [Google Scholar]
49. Мидандер К., Кронхольм П., Карлссон Х.Л., Элин К., Меллер Л., Лейграф К., Валлиндер И.О. Характеристики поверхности, высвобождение меди и токсичность частиц меди и оксида меди (II) нано- и микрометрового размера: междисциплинарное исследование. Маленький. 2009; 5: 389–399. doi: 10.1002/smll.200801220. [PubMed] [CrossRef] [Google Scholar]
50. Chai L., Wang T., Zhang L., Wang H., Yang W., Dai S., Meng Y., Li X. A Cu-m- Индуцированный фенилендиаминовым комплексом путь изготовления гидрогеля поли(м-фенилендиамин)/восстановленный оксид графена и его адсорбционное применение. Carbon NY 2015; 81: 748–757. doi: 10.1016/j.carbon.2014.10.018. [Перекрестная ссылка] [Академия Google]
Carbon NY 2015; 81: 748–757. doi: 10.1016/j.carbon.2014.10.018. [Перекрестная ссылка] [Академия Google]
51. Ким Ю., Гостик Дж.Т. Измерение эффективной диффузии в пористой среде с радиальным расположением без прокладок. Междунар. J. Тепломассообмен. 2019;129:1023–1030. doi: 10.1016/j.ijheatmasstransfer.2018.10.054. [CrossRef] [Google Scholar]
52. Heitjans P., Kärger J. Диффузия в конденсированных средах: методы, материалы, модели. Springer Science & Business Media; Berlin/Heidelberg, Germany: 2006. [Google Scholar]
53. Siepmann J., Siepmann F. Математическое моделирование растворения лекарств. Междунар. Дж. Фарм. 2013; 453:12–24. doi: 10.1016/j.ijpharm.2013.04.044. [PubMed] [CrossRef] [Академия Google]
54. Смит Б.Т. Remington Education: физическая аптека. Фармацевтическая пресса; London, UK: 2015. [Google Scholar]
55. Бондаренко О., Иваск А., Кякинен А., Кару А. Субтоксическое действие наночастиц CuO на бактерии: кинетика, роль ионов Cu и возможные механизмы действия . Окружающая среда. Загрязн. 2012; 169:81–89. doi: 10.1016/j.envpol.2012.05.009. [PubMed] [CrossRef] [Google Scholar]
Окружающая среда. Загрязн. 2012; 169:81–89. doi: 10.1016/j.envpol.2012.05.009. [PubMed] [CrossRef] [Google Scholar]
56. Ши Дж., Абид А.Д., Кеннеди И.М., Христова К.Р., Силк В.К. Для ряски (Landoltia punctata) наночастицы оксида меди являются более ингибирующими, чем растворимая медь в нерасфасованном растворе. Окружающая среда. Загрязн. 2011;159: 1277–1282. doi: 10.1016/j.envpol.2011.01.028. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
57. Wang Z., Li N., Zhao J., White J.C., Qu P., Xing B. Взаимодействие наночастиц CuO с эпителиальными клетками человека: Cellular поглощение, местоположение, экспорт и генотоксичность. хим. Рез. Токсикол. 2012; 25:1512–1521. doi: 10.1021/tx3002093. [PubMed] [CrossRef] [Google Scholar]
МЕДЬ На этой странице рассматриваются некоторые аспекты химии меди, необходимые для сдачи экзаменов уровня A в Великобритании. Химия меди (II) в основном резюмируется из других мест на сайте со ссылками на более подробные объяснения. Реакции ионов меди(II) в растворе Простейший ион, который медь образует в растворе, представляет собой типичный синий ион гексааквамеди(II) – [Cu(H 2 O) 6 ] 2+ . | ||
Примечание: Если вас не устраивают сложные ионы (в том числе то, как они связаны и названы), вам стоит пройти по этой ссылке и изучить первые пару страниц в меню сложных ионов, прежде чем продолжить. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | ||
Реакция ионов гексааквамеди(II) с гидроксид-ионами Ионы гидроксида (например, из раствора гидроксида натрия) удаляют ионы водорода из водных лигандов, присоединенных к иону меди. После того, как ион водорода будет удален из двух молекул воды, останется комплекс без заряда – нейтральный комплекс. | ||
Примечание: Цветовая кодировка показывает, что этот не является реакцией обмена лиганда. Кислороды, которые первоначально были связаны с медью, все еще связаны в нейтральном комплексе. | ||
В пробирке изменение цвета: | ||
Примечание: Вы найдете подробное обсуждение реакций между ионами гексааква и ионами гидроксида, если перейдете по этой ссылке. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | ||
Реакции ионов гексааквамеди(II) с раствором аммиака Аммиак действует как основание и лиганд. При небольшом количестве аммиака ионы водорода отрываются от гексааква-иона точно так же, как и в случае с гидроксид-ионом, с образованием того же нейтрального комплекса. Этот осадок растворяется, если добавить избыток аммиака. Аммиак заменяет воду в качестве лиганда с образованием ионов тетраамминдиаквамеди(II). Обратите внимание, что заменены только 4 из 6 молекул воды. | ||
Примечание: Вы можете удивиться, почему это второе уравнение дается исходя из исходного гексаакваиона, а не нейтрального комплекса. Объяснить, почему осадок снова растворяется, довольно сложно. Полное объяснение вы найдете на странице о реакциях между ионами гексааква и раствором аммиака. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | ||
Изменения цвета: Реакция ионов гексааквамеди(II) с карбонат-ионами Вы просто получаете осадок того, что можно представить как карбонат меди(II). | ||
Примечание: Только одна из экзаменационных комиссий уровня A в Великобритании хочет этого, и это упрощение, которое они делают.  На самом деле осадок лучше описать как основной карбонат с формулой типа xCuCO 3 ,yCu(OH) 2 ,zH 2 O. На самом деле осадок лучше описать как основной карбонат с формулой типа xCuCO 3 ,yCu(OH) 2 ,zH 2 O.Вы найдете подробное обсуждение реакций между ионами гексааква и ионами карбоната, если перейдете по этой ссылке. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | ||
Реакция лигандного обмена с участием ионов хлорида Если добавить концентрированную соляную кислоту в раствор, содержащий ионы гексааквамеди(II), шесть молекул воды заменятся четырьмя ионами хлорида. Происходящая реакция обратима. Поскольку реакция обратима, вы получаете смесь цветов из-за обоих комплексных ионов. Цвет иона тетрахлоркупрата (II) может быть описан как оливково-зеленый или желтый. Если к зеленому раствору добавить воды, он снова станет синим. | ||
Примечание: Более подробно эта реакция описана на странице, посвященной реакциям обмена лигандами.  Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | ||
Реакция ионов гексааквамеди(II) с иодид-ионами Простая реакция Ионы меди(II) окисляют иодид-ионы до йода, и в процессе сами восстанавливаются до йодида меди(I). | ||
Примечание. Если вам нужно, вы можете узнать больше о степенях окисления, перейдя по этой ссылке. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | ||
Исходная грязно-коричневая смесь выпадает в не совсем белый осадок йодида меди(I) в растворе йода. | ||
Примечание. У меня было несколько попыток правильно подобрать этот цвет, но мое программное обеспечение продолжает немного изменять его, поскольку я адаптирую диаграмму для использования в Интернете.  Цвет раствора йода на самом деле довольно сильно варьируется в зависимости от его концентрации, поэтому меня это не слишком беспокоит! Цвет раствора йода на самом деле довольно сильно варьируется в зависимости от его концентрации, поэтому меня это не слишком беспокоит! | ||
Использование этой реакции для определения концентрации ионов меди(II) в растворе Если пипеткой отобрать известный объем раствора, содержащего ионы меди(II), в колбу, а затем добавить избыток раствора йодида калия, получится реакция, которую мы только что описали. Вы можете найти количество йода, выделившегося при титровании раствором тиосульфата натрия. При вливании раствора тиосульфата натрия из бюретки окраска йода тускнеет. Когда почти все кончится, добавьте немного раствора крахмала. Он обратимо реагирует с йодом, образуя темно-синий комплекс крахмал-йод, который гораздо легче увидеть. Вы медленно добавляете последние несколько капель раствора тиосульфата натрия, пока не исчезнет синяя окраска. Если вы проследите пропорции реакции с помощью двух уравнений, вы обнаружите, что на каждые 2 моля ионов меди (II), с которыми вы должны были начать, вам нужно 2 моля раствора тиосульфата натрия. Если известна концентрация раствора тиосульфата натрия, легко рассчитать концентрацию ионов меди(II). | ||
Примечание: Если вы не очень хорошо разбираетесь в расчетах титрования, вам может быть интересна моя книга расчетов по химии. Этот конкретный пример подробно рассматривается на страницах 66-67. | ||
Некоторые основные химические соединения меди(I) Диспропорционирование ионов меди(I) в растворе Химия меди(I) ограничена реакцией, которая протекает с участием простых ионов меди(I) в растворе. Это хороший пример диспропорционирования – реакции, в которой что-то окисляется и восстанавливается. Ионы меди(I) в растворе диспропорционируют с образованием ионов меди(II) и осадка меди. Реакция: Любая попытка получить простое соединение меди(I) в растворе приводит к этому. Например, при реакции оксида меди(I) с горячей разбавленной серной кислотой можно ожидать получения раствора сульфата меди(I) и воды. На самом деле вы получаете коричневый осадок меди и синий раствор сульфата меди (II) из-за реакции диспропорционирования. Стабилизация степени окисления меди(I) Нерастворимые соединения меди(I) Мы уже видели, что йодид меди(I) образуется в виде не совсем белого осадка, если добавить раствор йодида калия в раствор, содержащий ионы меди(II). Иодид меди(I) практически нерастворим в воде, поэтому реакции диспропорционирования не происходит. Аналогичным образом можно получить хлорид меди(I) в виде белого осадка (реакция описана ниже). Если его отделить от раствора и как можно быстрее высушить, он останется белым. Однако при контакте с водой он медленно становится синим по мере образования ионов меди (II). Реакция диспропорционирования происходит только с простыми ионами меди(I) в растворе. Комплексы меди(I) Образование комплексов меди(I) (кроме комплексов с водой в качестве лиганда) также стабилизирует степень окисления меди(I). Например, как [Cu(NH 3 ) 2 ] + , так и [CuCl 2 ] – представляют собой комплексы меди(I), которые не диспропорционируют. Хлорсодержащий комплекс образуется при растворении оксида меди(I) в концентрированной соляной кислоте. Можно представить, что это происходит в два этапа. Сначала образуется хлорид меди(I): Но в присутствии избытка ионов хлорида из HCl это реагирует с образованием стабильного растворимого комплекса меди(I). Вы можете получить белый осадок хлорида меди(I) (упомянутый выше), добавляя к этому раствору воду. Это обращает последнюю реакцию, удаляя лишний хлорид-ион.
В меню переходных металлов. . . В меню неорганической химии. . . В главное меню . . . © Джим Кларк, 2003 г. (изменено в июле 2015 г.) | ||
Польза для здоровья, рекомендуемое потребление, источники и риски
Медь является важным микроэлементом, необходимым для выживания. Он содержится во всех тканях организма и играет роль в производстве эритроцитов и поддержании нервных клеток и иммунной системы.
Он также помогает организму вырабатывать коллаген и усваивать железо, а также участвует в производстве энергии.
Большая часть меди в организме содержится в печени, мозге, сердце, почках и скелетных мышцах.
Как слишком много, так и слишком мало меди может повлиять на работу мозга. Нарушения связаны с болезнью Менкеса, Вильсона и Альцгеймера
Нарушения связаны с болезнью Менкеса, Вильсона и Альцгеймера
Дефицит встречается редко, но может привести к сердечно-сосудистым заболеваниям и другим проблемам.
В этой статье рассматривается польза меди для здоровья, источники и потенциальные риски для здоровья.
Краткие факты о меди:
- Медь необходима для ряда функций организма.
- Дефицит меди встречается редко, за исключением определенных состояний, таких как болезнь Менкеса.
- Медные добавки обычно не нужны и могут привести к дисбалансу.
- Дисбаланс меди связывают с болезнью Альцгеймера.
- Любой, кто подумывает о добавках меди, должен сначала поговорить с врачом.
Медь является важным питательным веществом для организма.
Вместе с железом он позволяет организму образовывать эритроциты.
Помогает поддерживать здоровье костей, кровеносных сосудов, нервов и иммунитета, а также способствует усвоению железа.
Достаточное количество меди в рационе может помочь предотвратить сердечно-сосудистые заболевания и остеопороз.
Здоровье сердечно-сосудистой системы
Низкий уровень меди связан с высоким уровнем холестерина и высоким кровяным давлением. Одна группа исследователей предположила, что некоторым пациентам с сердечной недостаточностью могут помочь добавки меди.
Исследования на животных связывают низкий уровень меди с сердечно-сосудистыми заболеваниями, но остается неясным, окажет ли ее дефицит такое же влияние на людей.
Нейронная сигнализация
В 2016 году профессор Крис Чанг, химик, участвующий в Программе академического обмена Саклера в Беркли, Калифорния, разработал и использовал флуоресцентный зонд для отслеживания движения меди в нервных клетках и из них.
Профессор Чанг говорит: «Медь похожа на тормоз или диммер, по одному на каждую нервную клетку».
Его команда обнаружила, что если в клетку попадает большое количество меди, это, по-видимому, снижает передачу сигналов нейронами. Когда уровень меди в этой клетке падает, передача сигналов возобновляется.
Когда уровень меди в этой клетке падает, передача сигналов возобновляется.
Иммунная функция
Недостаток меди может привести к нейтропении. Это дефицит лейкоцитов или нейтрофилов, которые борются с инфекцией.
У человека с низким уровнем нейтрофилов больше шансов заболеть инфекционным заболеванием.
Остеопороз
Тяжелый дефицит меди связан со снижением минеральной плотности костей и повышенным риском развития остеопороза.
Необходимы дополнительные исследования того, как предельный дефицит меди может повлиять на здоровье костей и как добавки с медью могут помочь предотвратить и лечить остеопороз.
Производство коллагена
Медь играет важную роль в поддержании уровня коллагена и эластина, основных структурных компонентов нашего тела. Ученые выдвинули гипотезу о том, что медь может обладать антиоксидантными свойствами и что ее здоровое потребление вместе с другими антиоксидантами может помочь предотвратить старение кожи.
Без достаточного количества меди организм не может заменить поврежденную соединительную ткань или коллаген, из которого состоит каркас кости.
Это может привести к целому ряду проблем, включая дисфункцию суставов, поскольку ткани организма начинают разрушаться.
Артрит
Исследования на животных показали, что медь может помочь предотвратить или отсрочить артрит, и для этой цели люди носят медные браслеты. Однако никакие исследования на людях не подтвердили это.
Антиоксидантное действие
Медь также может выполнять антиоксидантную функцию. Это может помочь уменьшить производство свободных радикалов.
Свободные радикалы могут повреждать клетки и ДНК, приводя к раку и другим заболеваниям.
Рекомендуемая суточная доза (RDA) составляет около 900 микрограмм (мкг) в день для подростков и взрослых.
Верхний предел для взрослых в возрасте 19 лет и старше составляет 10 000 мкг или 10 миллиграммов (мг) в день. Потребление выше этого уровня может быть токсичным.
Как дефицит меди, так и отравление медью редко встречаются в Соединенных Штатах (США).
Поделиться на PinterestВысокое потребление добавок с витамином С может вызвать дефицит меди.
Хотя дефицит меди встречается редко, некоторые состояния здоровья и другие факторы могут увеличить риск.
К ним относятся:
- генетические дефекты метаболизма меди
- проблемы всасывания
- слишком высокое потребление добавок цинка или витамина С
- некоторые состояния, такие как демиелинизация центральной нервной системы (ЦНС), полинейропатия, миелопатия и воспаление зрительного нерва
Поскольку медь накапливается в печени, дефицит меди со временем развивается медленно.
Цинк и витамин С
Высокое потребление цинка (150 мг в день или выше) и витамина С (более 1500 мг в день) может вызвать дефицит меди, конкурируя с медью за всасывание в кишечнике.
Причины дефицита меди у младенцев
Дефицит меди наблюдается у младенцев, которые употребляют коровье молоко вместо смеси. В коровьем молоке мало меди. В идеале дети до 1 года должны находиться на грудном вскармливании, а если нет, то на искусственных смесях. Коровье молоко не содержит необходимых питательных веществ для человеческого младенца.
В коровьем молоке мало меди. В идеале дети до 1 года должны находиться на грудном вскармливании, а если нет, то на искусственных смесях. Коровье молоко не содержит необходимых питательных веществ для человеческого младенца.
Низкий уровень меди может привести к:
- анемии
- низкой температуре тела
- переломам костей
- остеопорозу
- потеря пигментации кожи
- проблемы с щитовидной железой
Заболевания обмена веществ могут повлиять на то, как организм усваивает витамины и минералы.
Болезнь Менкеса
Болезнь Менкеса, сцепленное с Х-хромосомой рецессивное заболевание, неблагоприятно влияет на то, как мозг усваивает медь. Это может привести к задержке развития и задержке развития нервной системы у младенцев в возрасте от 6 до 8 недель. Ребенок с этим заболеванием может не дожить до 3-летнего возраста.
Подкожные инъекции меди могут помочь нормализовать уровень меди в крови, но помогут ли они нормализовать уровень меди в мозге, зависит от типа вовлеченной генетической мутации.
Одно клиническое исследование показало, что лечение младенцев до появления симптомов может помочь улучшить крупную моторику, мелкую моторику и адаптивные навыки, личные и социальные навыки, а также развитие языковой нервной системы у детей. Это также улучшило рост.
Другие последствия дефицита меди
Дефицит меди также связан с:
- повышенным риском инфицирования
- остеопорозом
- депигментацией волос и кожи
- анемией, так как медь способствует образованию эритроцитов
Слишком мало или слишком много меди может повредить ткани головного мозга.
У взрослых наблюдается нейродегенерация в результате дисбаланса меди. Это может быть связано с проблемой механизмов, участвующих в метаболизме меди для использования в головном мозге.
Высокий уровень меди может привести к окислительному повреждению головного мозга. Например, при болезни Вильсона высокие уровни меди накапливаются в печени, мозге и других жизненно важных органах.
Возможная связь с болезнью Альцгеймера
Чрезмерное накопление меди также связано с болезнью Альцгеймера.
Профессор Чанг и его коллеги выдвинули гипотезу, что когда медь накапливается необычным образом, это может вызвать образование амилоидных бляшек на нервной клетке.
Накопление амилоидных бляшек может привести к болезни Альцгеймера и другим нейродегенеративным заболеваниям.
Поделиться на Pinterest Орехи кешью содержат медь.
Медь содержится в самых разных продуктах.
Хорошие источники включают:
- oysters and other shellfish
- whole grains
- beans
- potatoes
- yeast
- dark leafy greens
- cocoa
- dried fruits
- black pepper
- organ meats, such as kidneys and liver
- nuts, например, кешью и миндаль
В большинстве фруктов и овощей мало меди, но она присутствует в цельнозерновых продуктах, ее добавляют в некоторые сухие завтраки и другие обогащенные продукты.
Медные добавки доступны, но лучше сначала попытаться получить необходимые витамины и минералы с пищей, чтобы снизить риск дисбаланса. Очень немногим людям необходимо принимать медные добавки.
Кроме того, питательные вещества в пище работают вместе, создавая более значительный эффект, чем тот, который достигается при приеме отдельных питательных веществ по отдельности.
Большинство поливитаминных добавок содержат 2 мг меди, что находится на полпути к безопасному и адекватному диапазону потребления, установленному Советом по пищевым продуктам и питанию (FNB).
Добавки меди могут взаимодействовать со следующими веществами:
- противозачаточные таблетки и гормональная терапия
- нестероидные противовоспалительные средства (НПВП), такие как аспирин и ибупрофен
- пеницилламин, используемые для снижения уровня меди при болезни Вильсона
- аллопуринол, средство от подагры
- циметидин или тагамет, применение при язве желудка и желудочном рефлюксе
- добавки цинка
Эти продукты могут снижать или повышать уровень меди в крови, что приводит к дисбалансу.
Токсичность меди
Не сообщалось о каких-либо побочных эффектах от нормального потребления меди с пищей, но симптомы могут появиться, если есть:
- чрезмерное потребление хранение в медных трубах
- воздействие химических веществ с высоким содержанием меди
- использование медных кастрюль
Признаки отравления медью включают:
- тошноту, рвоту, диарею и боль в животе
- headache
- dizziness
- weakness
- a metallic taste in the mouth
More serious effects are rare, but they include:
- cirrhosis and jaundice
- abnormalities in red blood cells and heart problems
Increased Уровни меди в сыворотке были связаны с более высоким риском сердечно-сосудистых заболеваний.
Вода, содержащая более 6 мг меди на литр, может вызвать проблемы с желудком. Если питьевая вода вызывает симптомы, человек должен проверить ее.
Дефицит меди может иметь негативные последствия для здоровья, но редко встречается у здоровых людей, соблюдающих сбалансированную диету.
Потребность в питательных веществах должна сначала удовлетворяться за счет пищевых продуктов, а затем в качестве резерва можно использовать добавки.
Любой, кто рассматривает возможность приема добавки, должен сначала проконсультироваться с поставщиком медицинских услуг. Добавки не контролируются Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) на предмет качества или чистоты.
Удаление ионов меди (II) из загрязненной воды путем инкапсуляции чайных листьев перечной мяты в альгинатные шарики
Дэвид, 10-й класс, Нью-Джерси — победитель YNA 2014
Введение
Озера и реки всегда были частью нашей жизни, но одержимость нашего общества шумной городской жизнью часто приводит к тому, что мы забываем и пренебрегаем сложной жизнью под воды. Под поверхностью тысячи различных организмов живут вместе в экологической гармонии. Эта экосистема, пожалуй, наименее нарушена человеческой жизнью в нашем городе. Тем не менее деятельность человека по-прежнему влияет на жизнь водных организмов, часто угрожая нарушить их гармоничное существование. Сброс отходов и неправильная утилизация опасных материалов приводят к накоплению вредных химических веществ, наносящих ущерб биологическому сообществу. Этот ущерб окружающей среде имеет опасные последствия и для людей, поскольку мы потребляем рыбу, которая обитает в этих реках и озерах. Под биологическим увеличением это означает, что токсичные химические вещества, которые накапливаются в рыбе, в конечном итоге потребляются людьми (Лю).
Сброс отходов и неправильная утилизация опасных материалов приводят к накоплению вредных химических веществ, наносящих ущерб биологическому сообществу. Этот ущерб окружающей среде имеет опасные последствия и для людей, поскольку мы потребляем рыбу, которая обитает в этих реках и озерах. Под биологическим увеличением это означает, что токсичные химические вещества, которые накапливаются в рыбе, в конечном итоге потребляются людьми (Лю).
Тяжелые металлы, известные своими высокотоксичными свойствами, представляют собой невидимую, но серьезную угрозу для этих водных экосистем. Деятельность человека вызывает большое загрязнение воды тяжелыми металлами. На самом деле, концентрация свинца в районах, затронутых деятельностью человека, в 20 раз выше, чем в незагрязненных регионах, на которые непосредственно не влияет деятельность человека (Атар). К счастью, существует несколько законов и постановлений, направленных на сокращение выбросов тяжелых металлов. Агентство по охране окружающей среды, федеральное учреждение, которому поручено отслеживать и контролировать выбросы загрязняющих веществ в окружающую среду, установило максимально допустимые выбросы для тяжелых металлов: свинец 15 частей на миллиард, медь 1,3 части на миллион, ртуть 2 части на миллиард, кадмий 5 частей на миллион и хром. 100 частей на миллиард (EPA). Медь является наиболее распространенным металлом, поскольку она используется в промышленном производстве, на металлообрабатывающих заводах и даже в производстве продуктов питания. Хотя небольшое количество меди необходимо для здоровья человека, избыточное количество может вызвать неблагоприятные последствия для здоровья, включая тошноту и желудочно-кишечные проблемы (WebMD). Несмотря на законы, созданные для ограничения загрязнения, избыток меди все еще присутствует во многих водоемах, поэтому крайне важно найти способы ее безопасного удаления.
100 частей на миллиард (EPA). Медь является наиболее распространенным металлом, поскольку она используется в промышленном производстве, на металлообрабатывающих заводах и даже в производстве продуктов питания. Хотя небольшое количество меди необходимо для здоровья человека, избыточное количество может вызвать неблагоприятные последствия для здоровья, включая тошноту и желудочно-кишечные проблемы (WebMD). Несмотря на законы, созданные для ограничения загрязнения, избыток меди все еще присутствует во многих водоемах, поэтому крайне важно найти способы ее безопасного удаления.
Медь всегда была объектом ремонта. Современные методы снижения содержания меди в наших озерах и реках включают активный ил, химическое осаждение, обратный осмос и ионный обмен, и все они могут быть эффективными для удаления меди из водных систем (Akpor; Volesky). К сожалению, эти весьма специфические методы не могут быть использованы на больших водоемах из-за высокой стоимости этих процессов и огромного количества задействованной воды (Лиу, Хойнака, Наварро). Более того, некоторые из этих процессов производят химические побочные продукты, которые могут угрожать организмам, населяющим эти экосистемы. На сегодняшний день наиболее перспективным методом является биоремедиация, при которой для удаления загрязняющих веществ используются биологические системы. По сравнению с другими методами он имеет более низкую стоимость и создает минимальное количество химических побочных продуктов.
Более того, некоторые из этих процессов производят химические побочные продукты, которые могут угрожать организмам, населяющим эти экосистемы. На сегодняшний день наиболее перспективным методом является биоремедиация, при которой для удаления загрязняющих веществ используются биологические системы. По сравнению с другими методами он имеет более низкую стоимость и создает минимальное количество химических побочных продуктов.
Мне посчастливилось проводить исследования в области биоремедиации в рамках стажировки у доктора Абеля Наварро, доцента кафедры химии муниципального колледжа Манхэттена. Под руководством доктора Наварро я активно проводил исследования по использованию недорогих биологических материалов, таких как листья чая, для адсорбции органических соединений из водных систем. Удивительно, но некоторые обычные ингредиенты, которые мы потребляем ежедневно, показали высокую адсорбцию органических соединений. Среди различных видов протестированных чайных листьев листья мяты перечной показали наилучшие показатели адсорбции. Вопрос заключался в том, может ли этот тип чайного листа также адсорбировать медь. В ходе проекта исследования с помощью инфракрасной спектроскопии с преобразованием Фурье (FTIR) выявили преобладание различных функциональных групп, включая карбоксильные и гидроксильные группы, на поверхности листьев. Эти функциональные группы вносят основной вклад в адсорбцию. Поскольку карбоксильные группы имеют отрицательный заряд, есть большая вероятность, что чайный лист будет природным биосорбентом меди. Тем не менее, использование чайных листьев мяты также имеет некоторые недостатки. Мало того, что трудно отделить листья от воды из-за их размера, на мяту перечную также легко воздействуют другие вещества, присутствующие в озерной и речной воде. Чтобы получить идеальный адсорбент меди, нам нужно было бы приготовить матрицу, которая могла бы иммобилизовать чайные листья мяты перечной, сохраняя при этом ее адсорбционные способности.
Вопрос заключался в том, может ли этот тип чайного листа также адсорбировать медь. В ходе проекта исследования с помощью инфракрасной спектроскопии с преобразованием Фурье (FTIR) выявили преобладание различных функциональных групп, включая карбоксильные и гидроксильные группы, на поверхности листьев. Эти функциональные группы вносят основной вклад в адсорбцию. Поскольку карбоксильные группы имеют отрицательный заряд, есть большая вероятность, что чайный лист будет природным биосорбентом меди. Тем не менее, использование чайных листьев мяты также имеет некоторые недостатки. Мало того, что трудно отделить листья от воды из-за их размера, на мяту перечную также легко воздействуют другие вещества, присутствующие в озерной и речной воде. Чтобы получить идеальный адсорбент меди, нам нужно было бы приготовить матрицу, которая могла бы иммобилизовать чайные листья мяты перечной, сохраняя при этом ее адсорбционные способности.
Альгинатные шарики (AB) представляют собой пористые материалы, которые самопроизвольно образуются при взаимодействии раствора альгината натрия с хлоридом кальция. Также известно, что АБ является отличным биосорбентом благодаря нескольким потенциальным местам адсорбции (таким как функциональные карбоксильные группы). Поскольку лаборатория, в которой я работал, была заинтересована в тех же проектах биоремедиации, что и я, мы смогли провести эксперименты по тестированию шариков альгината и их эффективности в адсорбции меди. Удивительно, но альгинатные шарики оказались способны адсорбировать даже больше, чем чайные листья мяты перечной, возможно, из-за их высокой пористости. Их структура и механизмы адсорбции означали, что альгинатные шарики практически не подвергались воздействию уплотняющих агентов, которые имитировали воду из окружающей среды (Наварро). Чайные листья перечной мяты оказались лучшими адсорбентами при адсорбции органических соединений, в то время как альгинатные шарики оказались как хорошо адсорбирующими, так и пригодными для использования в матрице чайных листьев перечной мяты.
Также известно, что АБ является отличным биосорбентом благодаря нескольким потенциальным местам адсорбции (таким как функциональные карбоксильные группы). Поскольку лаборатория, в которой я работал, была заинтересована в тех же проектах биоремедиации, что и я, мы смогли провести эксперименты по тестированию шариков альгината и их эффективности в адсорбции меди. Удивительно, но альгинатные шарики оказались способны адсорбировать даже больше, чем чайные листья мяты перечной, возможно, из-за их высокой пористости. Их структура и механизмы адсорбции означали, что альгинатные шарики практически не подвергались воздействию уплотняющих агентов, которые имитировали воду из окружающей среды (Наварро). Чайные листья перечной мяты оказались лучшими адсорбентами при адсорбции органических соединений, в то время как альгинатные шарики оказались как хорошо адсорбирующими, так и пригодными для использования в матрице чайных листьев перечной мяты.
Можно ли использовать чайный лист перечной мяты, иммобилизованный альгинатом, в качестве адсорбента ионов меди из сточных вод?
Гипотеза Иммобилизация чайного листа мяты перечной в альгинатных гранулах покажет гораздо более высокую адсорбцию меди в различных экспериментальных условиях.
Приготовление адсорбентов
Мятные пакетики были куплены на местном рынке. Чайные пакетики замачивали в кипящей дистиллированной воде для удаления остатков цвета, запаха и вкуса и помещали в печь при температуре не выше 50°С для сушки на ночь. Затем чайные пакетики разрезали и хранили в пластиковых контейнерах до тех пор, пока не пришло время использовать их в экспериментах по адсорбции.
Перечная мята в смеси с альгинатом натрия. Нажмите, чтобы увеличить
Альгинатные гранулы были приготовлены по хорошо известной методике. Вкратце, 4,5 г альгината натрия растворяли в 200 мл деионизированной воды при магнитном перемешивании. Дополнительно готовили раствор хлорида кальция путем смешивания 33 г соли с 1,5 л дистиллированной воды, также при магнитном перемешивании. Затем раствор альгината медленно по каплям добавляли в раствор кальция. Альгинатные шарики образуются сразу в растворе кальция. Наконец, шарики тщательно промывали дистиллированной и деионизированной водой для удаления остатков ионов кальция и хлорида. Альгинатные шарики суспендировали в деионизированной воде в стеклянной бутылке и хранили в холодильнике (Navarro).
Затем раствор альгината медленно по каплям добавляли в раствор кальция. Альгинатные шарики образуются сразу в растворе кальция. Наконец, шарики тщательно промывали дистиллированной и деионизированной водой для удаления остатков ионов кальция и хлорида. Альгинатные шарики суспендировали в деионизированной воде в стеклянной бутылке и хранили в холодильнике (Navarro).
Инкапсуляцию использованных листьев мяты перечной в альгинатные шарики (ABPM) проводили по тем же процедурам, что и приготовление альгинатных шариков. Для инкапсулирования различные массы чайных листьев мяты перечной, в пределах от 1 до 4 граммов, смешивали с раствором альгината. Оптимальное соотношение альгинат/чайный лист максимизировало количество частиц в шарике, не нарушая пористость шарика альгината. Оптимальное соотношение альгинат/чайный лист определяли визуально по однородному распределению частиц листьев в шарике.
Создание гибридов ABPM путем добавления альгината натрия и чайных листьев перечной мяты в хлорид кальция (слева). Листья мяты перечной, альгинатные шарики и СМАД, использованные в экспериментах (справа)
Листья мяты перечной, альгинатные шарики и СМАД, использованные в экспериментах (справа)
Преобразование массы влажное-сухое
Альгинатные шарики представляют собой гидрогели и, таким образом, содержат небольшое количество воды, что может привести к неправильной интерпретации массы фактических материалов внутри них. Это было исправлено путем построения калибровочной кривой, которая переводит влажную массу гранул (или гибридов) в сухую массу. Расчет адсорбции проводили на сухую массу; поэтому его определение имело решающее значение.
Регистрировали массу различных наборов влажных шариков, а затем шарики помещали в печь для сушки при 50°C. После сушки регистрировали сухую массу и строили калибровочную кривую.
Характеристика адсорбентов с помощью сканирующей электронной микроскопии (СЭМ)
Текстуру и морфологию адсорбентов (PM, AB и гибриды) исследовали под сканирующим электронным микроскопом. Это устройство делает снимки с высоким зумом и разрешением без золотого покрытия. Образцы помещали непосредственно в держатель образцов и делали микрофотографии для их сравнения.
Это устройство делает снимки с высоким зумом и разрешением без золотого покрытия. Образцы помещали непосредственно в держатель образцов и делали микрофотографии для их сравнения.
Эксперименты по адсорбции
Шейкер-инкубатор. Нажмите, чтобы увеличить
Периодические эксперименты проводились при комнатной температуре в двух повторностях путем смешивания различных масс трех адсорбентов с известными концентрациями растворов меди с отрегулированным рН в пластиковых пробирках объемом 50 мл. Суспензии помещали в шейкер с орбитальным перемешиванием. Эта процедура сопровождалась изменением различных параметров. Эти параметры включали: рН (от 2 до 7), массу адсорбента (в пределах от 20 до 300 мг адсорбента), наполнитель (от 2 до 10 % масс./масс. полиэтиленгликоля), соленость (хлорид натрия, нитрат натрия и кальций). нитратов), наличие другого тяжелого металла (от 20 до 100 мг/л свинца) и наличие органических загрязнителей (от 20 до 100 мг/л красителя). Эти параметры определили оптимальные условия, при которых адсорбция ионов меди максимальна. Эти параметры исследовались по одному, чтобы избежать неправильной интерпретации данных.
нитратов), наличие другого тяжелого металла (от 20 до 100 мг/л свинца) и наличие органических загрязнителей (от 20 до 100 мг/л красителя). Эти параметры определили оптимальные условия, при которых адсорбция ионов меди максимальна. Эти параметры исследовались по одному, чтобы избежать неправильной интерпретации данных.
Считыватель микропланшетов, используемый для считывания данных. Нажмите, чтобы увеличить
По достижении равновесия раствор отделяли от адсорбентов под действием силы тяжести, а оставшуюся концентрацию меди определяли спектрофотометрически.
Начальную и конечную концентрации меди определяли количественно с помощью УФ-видимой спектрофотометрии с использованием метода Zincon при длине волны 600 нм. В этой процедуре комплекс синего цвета получается путем смешивания растворов меди с таким же количеством молей цинкона (красителя). Измерения проводились с помощью автоматического считывателя микропланшетов.
Измерения проводились с помощью автоматического считывателя микропланшетов.
Чистая проба всегда готовилась в тех же условиях, что и реальная проба, но без адсорбента. Этот пустой образец использовали для первоначального определения концентрации меди и в качестве контроля любого внешнего фактора, который мог повлиять на адсорбцию.
Анализ данных
Количество адсорбированной меди выражали в процентах адсорбции. С начальной концентрацией меди (Ci) и конечной концентрацией меди (Cf) использовали следующее уравнение (Наварро): % ADS = (Ci – Cf) * 100/Ci, где % ADS – процент адсорбции.
Результаты
Как и ожидалось, гибриды ABPM продемонстрировали более высокую скорость адсорбции, чем PM или AB сами по себе.
Влияние pH
График процента адсорбции меди с помощью PM, AB и ABPM при различных уровнях pH.
Эксперименты с рН позволили мне определить оптимальный рН, при котором адсорбция меди максимальна. Чем ближе рН к диапазону 5-7, тем лучше адсорбент, поскольку большинство водоемов имеют рН в этом диапазоне. В эксперименте ABPM показал самую высокую адсорбцию при pH 6 по сравнению как с альгинатными шариками, так и с листьями мяты перечной.
Чем ближе рН к диапазону 5-7, тем лучше адсорбент, поскольку большинство водоемов имеют рН в этом диапазоне. В эксперименте ABPM показал самую высокую адсорбцию при pH 6 по сравнению как с альгинатными шариками, так и с листьями мяты перечной.
PH может легко влиять на адсорбцию, так как свободные ионы водорода могут прикрепляться к поверхности абсорбента, где предполагается связывание ионов Cu +2 . Таким образом, pH 6 позволяет адсорбентам поглощать как можно больше Cu +2 .
Влияние массы адсорбента
График процента адсорбции меди PM, AB и ABPM с различной массой.
Целью массового эксперимента было определение оптимального соотношения массы адсорбента и концентрации меди. Когда я добавляю больше адсорбентов, процент адсорбции увеличивается, но в определенный момент добавление большего количества адсорбентов не увеличивает адсорбцию. Эксперимент показал, что по сравнению с альгинатными шариками и особенно листьями мяты перечной гибриды СМАД очень быстро достигают оптимальной массы, при 50 мг.
Эксперимент показал, что по сравнению с альгинатными шариками и особенно листьями мяты перечной гибриды СМАД очень быстро достигают оптимальной массы, при 50 мг.
Эффект агента скученности
График процента адсорбции меди PM, AB и ABPM при различном процентном содержании полиэтиленгликоля.
В реальных водных системах вода не такая чистая, как дистиллированная. Существуют тысячи микроорганизмов, а также различные соединения, которые могут влиять на адсорбцию адсорбентов. Чтобы имитировать эти внешние факторы, полиэтиленгликоль использовали в качестве «агента скопления людей». Опять же, ABPM показал гораздо более высокую адсорбцию по сравнению с одними альгинатными шариками. Мята перечная из-за своей структуры, а также механизмов адсорбции сильно пострадала от полиэтиленгликоля и показала небольшую адсорбцию.
Влияние солености
График процента адсорбции меди PM, AB и ABPM в присутствии различных солей.
Еще одним отличием дистиллированной воды, используемой для экспериментов, от воды водных экосистем является разница в солености. Большинство озер и рек содержат соли. Хлорид натрия (NaCl) и нитрат натрия (NaNO 3 ) использовали в качестве солей. Нитрат кальция (Ca(No 3 ) 2 ) использовался, в частности, потому, что он диссоциирует на Ca +2 , положительно заряженный ион с зарядом +2, который такой же, как у Cu +2 . Первые две соли практически не влияли на адсорбцию меди, но нитрат кальция сильно снижал адсорбцию на СМАД. Ионы кальция присоединяются к поверхности адсорбентов вместо ионов меди, предотвращая адсорбцию за счет конкуренции.
Влияние тяжелых металлов
График процента адсорбции меди PM, AB и ABPM при различных концентрациях свинца.
Хотя вышеперечисленные адсорбенты доказали свою способность удалять медь, я хотел знать, что произойдет, если в водных растворах будут присутствовать другие тяжелые металлы, как это было бы в реальной жизни. Эксперименты проводились при различных концентрациях свинца в качестве вторичного металла. По мере увеличения концентрации свинца скорость адсорбции уменьшалась. Тем не менее, ABPM по-прежнему демонстрировал свое превосходство над другими адсорбентами. Это показывает, что он остается наиболее эффективным адсорбентом даже при наличии различных тяжелых металлов.
Влияние органических красителей
График процента адсорбции меди PM, AB и ABPM при различных концентрациях желтого красителя.
В водных системах, если в них присутствуют ионы меди, вполне вероятно, что там также присутствуют органические загрязнители, такие как красители. Мои предыдущие исследования в лаборатории показали, что органические красители адсорбируются на поверхности альгинатных шариков и мяты перечной, предполагая, что адсорбенты могут предпочитать органические соединения тяжелым металлам. Однако результаты, показанные на рисунке 12, показывают, что ABPM по-прежнему предпочитает медь желтому красителю, потому что медь имеет заряд +2, что означает, что она имеет более сильное сродство с карбоксильными группами на поверхности.
Мои предыдущие исследования в лаборатории показали, что органические красители адсорбируются на поверхности альгинатных шариков и мяты перечной, предполагая, что адсорбенты могут предпочитать органические соединения тяжелым металлам. Однако результаты, показанные на рисунке 12, показывают, что ABPM по-прежнему предпочитает медь желтому красителю, потому что медь имеет заряд +2, что означает, что она имеет более сильное сродство с карбоксильными группами на поверхности.
Фотографии со сканирующего электронного микроскопа
Сканирование электронных микроскопических фотографий СМАД.
Как показано выше, поверхность шарика альгината очень пористая. На снимке также видны чайные листья перечной мяты. Поскольку на этом изображении они находятся на поверхности, это означает, что они также были эффективны в процессе адсорбции.
Выводы
Мои результаты показали, что моя гипотеза подтвердилась. На протяжении всех экспериментов адсорбция меди следовала тренду ABPM > AB > PM. Поскольку оптимальный pH ABPM равен 6, его можно применять практически к любому природному водоему. Он также имеет относительно низкую оптимальную массу, что позволяет использовать эффективные и недорогие методы. Было показано, что даже в присутствии уплотняющих агентов, таких как полиэтиленгликоль, ABPM адсорбирует медь, не подвергаясь ее влиянию. Обычные соли, такие как NaCl, незначительно влияли на скорость адсорбции, в то время как эксперименты с учетом органических красителей и тяжелых металлов по-прежнему показали, что соединение ABPM предпочитает медь другим соединениям. Таким образом, ABPM является недорогим и эффективным адсорбентом для очистки сточных вод от меди. В будущем следует провести дальнейшие исследования того, как можно модифицировать ABPM для повышения его эффективности.
Библиография
Акпор, Б. «Очистка от тяжелых металлов в системах очистки питьевой воды и сточных вод: процессы и применение». Международный журнал физических наук 5.5 (2010): 1807-1817. Распечатать.
«Очистка от тяжелых металлов в системах очистки питьевой воды и сточных вод: процессы и применение». Международный журнал физических наук 5.5 (2010): 1807-1817. Распечатать.
Атар, Мохаммад и С.Б. Вогора. Тяжелые металлы и окружающая среда . Нью-Дели: New Age International Publishers, 1995. Печать.
«Основная информация о кадмии в питьевой воде». Агентство по охране окружающей среды США, 17 октября 2013 г. Интернет. 6 февраля 2014 г.
«Основная информация о хроме в питьевой воде». Агентство по охране окружающей среды США , 13 декабря 2013 г. Интернет. 6 февраля 2014 г.
«Основная информация о ртути (неорганической) в питьевой воде». Агентство по охране окружающей среды США , 5 февраля 2014 г. Интернет. 6 февраля 2014 г.
Хойнацка, Катажина. Биосорбция и биоаккумуляция на практике . Нью-Йорк: Издательство Nova Science, 2009. Печать.
«Побочные эффекты меди и безопасность». WebMD . WebMD, н.д. Веб. 13 февраля 2014 г.
WebMD, н.д. Веб. 13 февраля 2014 г.
Куизано, Н., Б. Льянос и А. Наварро. «Экологические применения адсорбции природными биополимерами. Часть I. Фенольные соединения». Rev. Soc. Ким . Перу , 75.4 (2009): 495-508. Распечатать.
Ким Т., Д. Ян, Дж. Ким, Х. Мусаев и А. Наварро. «Сравнительная адсорбция высокопористых и сырцовых адсорбентов для удаления ионов меди (II) из сточных вод . ” Тенденции в Хроматог рафи 8 (2013): 97-108. Распечатать.
«Правило свинца и меди». Агентство по охране окружающей среды США , 30 июня 2012 г. Интернет. 6 февраля 2014 г.
Лю, Ю. Основы и приложения изотерм биосорбции, кинетики и термодинамики . Нью-Йорк: Издательство Nova Science, 2009. Печать.
Волески, Богумил. Сорбция и биосорбция . Сент-Ламбер, Квебек: BV Sorbex, 2003. Печать.
Ионы меди текут подобно жидкости через кристалл
изображение: Художественное воплощение интригующей суперионной кристаллической структуры CuCrSe2, в которой ионы меди движутся подобно жидкости между твердыми слоями хрома и селена, обусловливая полезные электрические свойства. посмотреть больше
посмотреть больше
Авторы и права: Окриджская национальная лаборатория/Джилл Хемман
ДАРЕМ, Северная Каролина. Ученые-материаловеды обнаружили физическое явление, лежащее в основе многообещающих электрических свойств класса материалов, называемых суперионными кристаллами. Лучшее понимание таких материалов может привести к созданию более безопасных и эффективных перезаряжаемых батарей, чем литий-ионный нынешний флагман.
Ставшие популярной темой изучения только в течение последних пяти лет, суперионные кристаллы представляют собой нечто среднее между жидкостью и твердым телом. В то время как некоторые из их молекулярных компонентов сохраняют жесткую кристаллическую структуру, другие становятся жидкими при температуре выше определенной температуры и способны течь через твердый каркас.
В новом исследовании ученые из Университета Дьюка, Окриджской национальной лаборатории (ORNL) и Аргоннской национальной лаборатории (ANL) исследовали один такой суперионный кристалл, содержащий медь, хром и селен (CuCrSe 9). 0035 2 ) с помощью нейтронов и рентгеновских лучей, чтобы определить, как ионы меди в материале достигают свойств жидкости. Результаты появятся онлайн 8 октября в журнале Nature Physics .
0035 2 ) с помощью нейтронов и рентгеновских лучей, чтобы определить, как ионы меди в материале достигают свойств жидкости. Результаты появятся онлайн 8 октября в журнале Nature Physics .
«Когда CuCrSe 2 нагревается выше 190 градусов по Фаренгейту, его ионы меди летают внутри слоев хрома и селена примерно так же быстро, как движутся молекулы жидкой воды», — сказал Оливье Делэр, доцент кафедры машиностроения и материаловедения в Герцог и старший автор исследования. «И все же это твердое вещество, которое можно было бы держать в руке. Мы хотели понять молекулярную физику, лежащую в основе этого явления».
Чтобы исследовать поведение ионов меди, Делэр и его коллеги обратились к двум объектам мирового класса: Источнику нейтронов расщепления в Ок-Ридже и Усовершенствованному источнику фотонов в Аргонне. Каждая машина представляла собой уникальную часть головоломки.
Исследовав большой образец порошка CuCrSe 2 , изготовленного в Ок-Ридже, с помощью мощных нейтронов, исследователи получили широкомасштабное представление об атомной структуре и динамике материала, выявив колебания жесткого каркаса из атомов хрома и селена. а также случайные скачки ионов меди внутри.
а также случайные скачки ионов меди внутри.
Для более узкого, но более подробного изучения режимов вибрации исследователи облучили крошечное одиночное зерно кристалла CuCrSe 2 рентгеновским излучением высокого разрешения. Это позволило им изучить, как лучи рассеиваются на его атомах и как колебания каркаса позволяют распространяться поперечным волнам, что является отличительной чертой твердого тела.
Имея в руках оба набора информации, группа Делара провела квантовое моделирование поведения атомов материала в Национальном научно-вычислительном центре энергетических исследований, чтобы объяснить свои выводы. Ниже температуры фазового перехода 19При температуре 0 градусов по Фаренгейту атомы меди вибрируют вокруг изолированных участков, захваченных карманами каркасной структуры материала. Но выше этой температуры они могут случайным образом переключаться между несколькими доступными сайтами. Это позволяет ионам меди течь через твердый кристалл.
Хотя требуется дополнительная работа, чтобы понять, как атомы меди взаимодействуют друг с другом после того, как оба места будут заняты, результаты дают подсказки относительно того, как использовать аналогичные материалы в будущих электронных приложениях.
«В большинстве коммерческих литий-ионных аккумуляторов используется жидкий электролит для переноса ионов между положительным и отрицательным полюсами аккумулятора», — сказал Делэр. «Хотя эта жидкость эффективна, она может быть опасно воспламеняющейся, как, к сожалению, обнаружили многие владельцы ноутбуков и смартфонов».
«Существуют варианты суперионных кристаллов, которые содержат такие ионы, как литий или натрий, которые ведут себя как медь в CuCrSe 2 », — сказал Делэр. «Если мы сможем понять, как работают суперионные кристаллы с помощью этого исследования и будущих исследований, мы, возможно, сможем найти лучшее и надежное решение для транспортировки ионов в перезаряжаемых батареях».
###
Это исследование было поддержано Министерством энергетики (DE-SC0016166, DE-SC0001299, DE-AC02-06Ch21357, DE-AC02-05Ch21231, DEAC05-00OR22725).
ЦИТАТА: «Селективный пробой фононных квазичастиц при суперионном переходе в CuCrSe2». JL Niedziela, Dipanshu Bansal, Andrew F. May, Jingxuan Ding, Tyson Lanigan-Atkins, Georg Ehlers, Douglas L. Abernathy, Ayman Said и Olivier Delaire. Nature Physics , 2018. DOI: 10.1038/s41567-018-029
JL Niedziela, Dipanshu Bansal, Andrew F. May, Jingxuan Ding, Tyson Lanigan-Atkins, Georg Ehlers, Douglas L. Abernathy, Ayman Said и Olivier Delaire. Nature Physics , 2018. DOI: 10.1038/s41567-018-029
DOI
10.1038/s41567-018-0298-2
не несут ответственности за достоверность новостных сообщений, размещенных на EurekAlert! содействующими учреждениями или для использования любой информации через систему EurekAlert.
Оптимизация удаления ионов меди(II) из водного раствора на хитозане и гранулах сшитого хитозана :: Биоресурсы
Патруля, В., Негрулеску, А., Минча, М.М., Питуличе, Л.Д., Спиридон, О.Б., и Остафе, В. (2013). «Оптимизация удаления ионов меди (II) из водного раствора на хитозане и гранулах сшитого хитозана», BioRes. 8(1), 1147-1165.Abstract
В статье исследуется удаление и извлечение ионов меди из шахтных вод с использованием хитозана и сшитых хитозановых шариков в качестве нерастворимых сорбентов в кислых и щелочных растворах. Эксперименты по периодической адсорбции проводились в зависимости от pH, дозы адсорбента, времени контакта и начальной концентрации ионов Cu(II). Равновесные данные были подобраны с использованием моделей Ленгмюра, Фрейндлиха, Эловича и Темкина. Экспериментальные данные лучше всего представлены с использованием кинетической модели псевдовторого порядка и модели изотермы Ленгмюра. Извлечение ионов Cu(II) из сорбентов успешно осуществлялось обработкой сорбентов водным раствором ЭДТА. Потенциометрический метод был использован для обнаружения ионов Cu(II) в пробах синтетической воды после процесса адсорбции. Результаты показали, что ионы Cu(II) могут быть эффективно удалены из синтетических водных растворов, подобно шахтным водам, с использованием хитозана и гранул сшитого хитозана.
Эксперименты по периодической адсорбции проводились в зависимости от pH, дозы адсорбента, времени контакта и начальной концентрации ионов Cu(II). Равновесные данные были подобраны с использованием моделей Ленгмюра, Фрейндлиха, Эловича и Темкина. Экспериментальные данные лучше всего представлены с использованием кинетической модели псевдовторого порядка и модели изотермы Ленгмюра. Извлечение ионов Cu(II) из сорбентов успешно осуществлялось обработкой сорбентов водным раствором ЭДТА. Потенциометрический метод был использован для обнаружения ионов Cu(II) в пробах синтетической воды после процесса адсорбции. Результаты показали, что ионы Cu(II) могут быть эффективно удалены из синтетических водных растворов, подобно шахтным водам, с использованием хитозана и гранул сшитого хитозана.
Загрузить PDF
Полный текст статьи
Оптимизация удаления ионов меди(II) из водного раствора на хитозановых и сшитых хитозановых шариках
Виорика Патруля, a,b Анамария Негрулеску, a,b Мануэла М. Минча, a,b,§ Лаура Д. Питуличе, a,b,§ Отилия Бизереа Спиридон,6 a4,6 и Василе Остафе a,b, *
Минча, a,b,§ Лаура Д. Питуличе, a,b,§ Отилия Бизереа Спиридон,6 a4,6 и Василе Остафе a,b, *
В статье рассматривается удаление и извлечение ионов меди из шахтных вод с использованием хитозана и сшитых хитозановых шариков в качестве нерастворимых сорбентов в кислых и щелочных растворах. Эксперименты по периодической адсорбции проводились в зависимости от pH, дозы адсорбента, времени контакта и начальной концентрации ионов Cu(II). Равновесные данные были подобраны с использованием моделей Ленгмюра, Фрейндлиха, Эловича и Темкина. Экспериментальные данные лучше всего представлены с использованием кинетической модели псевдовторого порядка и модели изотермы Ленгмюра. Извлечение ионов Cu(II) из сорбентов успешно осуществлялось обработкой сорбентов водным раствором ЭДТА. Потенциометрический метод был использован для обнаружения ионов Cu(II) в пробах синтетической воды после процесса адсорбции. Результаты показали, что ионы Cu(II) могут быть эффективно удалены из синтетических водных растворов, подобно шахтным водам, с использованием хитозана и гранул сшитого хитозана.
Ключевые слова: Адсорбция; Медь; бусины из хитозана; Равновесие; кинетика; Изотермы
Контактная информация: а: Западный университет Тимишоары, химический факультет, Песталоцци 16, Тимишоара 300115, Румыния; b: Западный университет Тимишоары, Передовые лаборатории экологических исследований, Ойтуз 4, Тимишоара 300086, Румыния; Все авторы имеют равный вклад; § Мануэла М. Минча и Лаура Д. Питуличе временно связаны с Университетом «Александру Иоан Куза», РУМЫНИЯ.
* Автор, ответственный за переписку: [email protected]
ВВЕДЕНИЕ
Присутствию ионов тяжелых металлов в окружающей среде уделяется большое внимание из-за их повышенного выброса в реки и их токсичности (Ngah et al. 2002; Chowdhury et al. 2012). Потенциальными источниками меди являются сточные воды горнодобывающей промышленности, промышленные стоки, ванны для очистки металлов и гальванопокрытия (технологии очистки металлов), производство древесной массы и бумаги, а также краски против обрастания (Quek 9). 0965 и др. 1998; Гупта 1998; Findon и др. 1993). Медь является важным питательным веществом в следовых количествах, но в больших количествах она токсична для растений и водорослей (Ngah and Fatinathan 2008). У людей повышенные концентрации меди могут вызывать окислительный стресс и рак (Ho et al. 2002; Gupte and Mumper 2009). Избыток меди может быть токсичным для рыб при более низких значениях pH, даже при очень малых концентрациях в природных водах (Gupta 1998).
0965 и др. 1998; Гупта 1998; Findon и др. 1993). Медь является важным питательным веществом в следовых количествах, но в больших количествах она токсична для растений и водорослей (Ngah and Fatinathan 2008). У людей повышенные концентрации меди могут вызывать окислительный стресс и рак (Ho et al. 2002; Gupte and Mumper 2009). Избыток меди может быть токсичным для рыб при более низких значениях pH, даже при очень малых концентрациях в природных водах (Gupta 1998).
За прошедшие годы был разработан ряд технологий, таких как ионный обмен, фильтрация, химическое осаждение, комплексообразование, адсорбция, электроосаждение и обратный осмос. Эти методы кажутся многообещающими для обработки разбавленных растворов металлов (Камински и Модрейвска 19).97; Динс и Диоксин, 1992). Адсорбция представляет собой очень экономичный и эффективный метод удаления ионов тяжелых металлов из разбавленных растворов (Feng et al. 2012). Многие материалы, такие как активированный уголь (Bailey et al. 1999; Babel and Kurniawan 2003) или недорогие сорбенты биологического происхождения, такие как целлюлоза, альгинаты, каррагенан, лигнины, белки, хитин и производные хитина, были исследованы как адсорбенты для удаления тяжелых металлов из воды и промышленных стоков (Динс и Диоксин 1992; Ли и Бай, 2005 г.; Гуибал и др. 1998; Эванс и др. 2002; Нга и др. 2002). Биополимеры широко доступны, экологически безопасны и привлекательны в промышленном отношении благодаря их способности снижать концентрацию ионов тяжелых металлов до уровня частей на миллиард (Deans and Dioxin 1992). Хитозан представляет собой природный полимер, полученный из хитина, биоразлагаемого, нетоксичного и экологически чистого материала (Feng et al. 2012). Хитозан является эффективным биосорбентом с точки зрения адсорбционной способности благодаря наличию большого количества свободных амино- и гидроксильных групп, с которыми ионы металлов могут связываться либо путем химической, либо физической адсорбции (Deans and Dioxin 19).
1999; Babel and Kurniawan 2003) или недорогие сорбенты биологического происхождения, такие как целлюлоза, альгинаты, каррагенан, лигнины, белки, хитин и производные хитина, были исследованы как адсорбенты для удаления тяжелых металлов из воды и промышленных стоков (Динс и Диоксин 1992; Ли и Бай, 2005 г.; Гуибал и др. 1998; Эванс и др. 2002; Нга и др. 2002). Биополимеры широко доступны, экологически безопасны и привлекательны в промышленном отношении благодаря их способности снижать концентрацию ионов тяжелых металлов до уровня частей на миллиард (Deans and Dioxin 1992). Хитозан представляет собой природный полимер, полученный из хитина, биоразлагаемого, нетоксичного и экологически чистого материала (Feng et al. 2012). Хитозан является эффективным биосорбентом с точки зрения адсорбционной способности благодаря наличию большого количества свободных амино- и гидроксильных групп, с которыми ионы металлов могут связываться либо путем химической, либо физической адсорбции (Deans and Dioxin 19). 92; Лу, 2001). Аминогруппы и гидроксильные группы хитозана могут выступать в качестве центров хелатирования ионов металлов (Ngah et al . 2002).
92; Лу, 2001). Аминогруппы и гидроксильные группы хитозана могут выступать в качестве центров хелатирования ионов металлов (Ngah et al . 2002).
Рис. 1. Схематическое изображение реакции сшивания хитозана с глутаровым альдегидом
Хитозан растворим в разбавленных органических кислотах, таких как уксусная и муравьиная кислота. По этой причине был разработан ряд физических и химических модификаций для повышения химической стабильности хитозана в кислых средах (Ngah and Liang 19).99; Нга и др. 2002, 2005; Руис и др. 2000; Коэльо и др. 2007).
Одной из важных химических модификаций хитозана является использование сшивающего агента (Sun and Wang 2006). Этот метод использовался для повышения устойчивости хитозана к кислотному, щелочному и другому химическому разложению, хотя он снижает способность адсорбировать ионы металлов (Chen et al. 2008). Одним из наиболее часто используемых сшивающих агентов является глутаровый альдегид (Ngah и др. 2002). Реакция сшивки хитозана глутаровым альдегидом представлена на рис. 1.
2002). Реакция сшивки хитозана глутаровым альдегидом представлена на рис. 1.
Существует много методов количественного определения концентрации ионов меди в образцах, таких как атомно-абсорбционная спектроскопия, атомно-абсорбционная спектроскопия холодного пара, пламенная атомно-абсорбционная спектроскопия – электротермическая атомизация, анодная инверсионная вольтамперометрия, хроматография и гравиметрическое детектирование, которые наиболее часто используются. Хотя эти методы точны и точны, они трудоемки из-за пробоподготовки, и для их проведения требуются дорогие материалы и инструменты. Поэтому эти методы не подходят для обработки большого количества анализов. Потенциометрия, прямая или титрование, — простая процедура, не требующая трудоемкой пробоподготовки; он быстрый и поэтому подходит для серийных определений (Бизерия Спиридон, Бизерея, 2002; Бизерея Спиридон, 2010).
В настоящем исследовании исследуется адсорбция ионов Cu(II) на гранулах хитозана и гранулах хитозан-ГЛК (хит-ГЛК) с использованием потенциометрического метода обнаружения ионов Cu(II). Изучено влияние различных экспериментальных условий, таких как начальный рН раствора, скорость перемешивания, дозировка адсорбента и начальная концентрация поглощения ионов Cu(II). Модели изотерм Ленгмюра, Фрейндлиха, Эловича и Темпкина использовались для согласования данных равновесной адсорбции. Скорости адсорбции определяли количественно, а затем сравнивали с кинетическими выражениями псевдопервого и псевдовторого порядка. Результаты этого исследования могут быть использованы в других целях для очистки сточных вод.
Изучено влияние различных экспериментальных условий, таких как начальный рН раствора, скорость перемешивания, дозировка адсорбента и начальная концентрация поглощения ионов Cu(II). Модели изотерм Ленгмюра, Фрейндлиха, Эловича и Темпкина использовались для согласования данных равновесной адсорбции. Скорости адсорбции определяли количественно, а затем сравнивали с кинетическими выражениями псевдопервого и псевдовторого порядка. Результаты этого исследования могут быть использованы в других целях для очистки сточных вод.
На рис. 2 показано образование хелатов хитозана с ионами меди(II) (рис. 2, а) и с ГЛК (рис. 2, б). В цитируемой нами литературе указывается скорее на координационную связь между адсорбентом и адсорбатом, приводящую к монослойному покрытию. Тем не менее, есть и другие ссылки, показывающие возможную структуру комплексообразования Cu(II) на разных адсорбентах.
Рис. 2. Образование хелатов меди с: (а) хитозаном и (б) хит-ГЛК
Бенавенте (2008) предполагает структуру типа «подвеска» в виде незаряженного комплекса, идентифицированного при рентгенологическом исследовании. Более того, при рН выше 5,8 (оптимальное значение рН, использованное в настоящем исследовании, равно 6,0) Rhazi и соавт. (2002) считают незаряженным комплекс, что не предполагает дальнейшего отторжения свободных ионов Cu(II). Эрнандес и его коллеги упоминают о комплексообразовании ионов металлов через –ОН в сахарной единице хитозана и других биополимеров (Hernandez et al . 2007, 2008).
Более того, при рН выше 5,8 (оптимальное значение рН, использованное в настоящем исследовании, равно 6,0) Rhazi и соавт. (2002) считают незаряженным комплекс, что не предполагает дальнейшего отторжения свободных ионов Cu(II). Эрнандес и его коллеги упоминают о комплексообразовании ионов металлов через –ОН в сахарной единице хитозана и других биополимеров (Hernandez et al . 2007, 2008).
ЭКСПЕРИМЕНТАЛЬНЫЙ
Материалы
Хитозан со степенью деацетилирования примерно от 75 до 85% и средней молекулярной массой был получен от Sigma Aldrich Chemie GmbH (Германия). Соляная кислота (HCl), 65% азотная кислота (HNO 3 ), ледяная уксусная кислота, муравьиная кислота, гидроксид натрия (NaOH) и полу(пентагидрат) нитрата меди (II) были приобретены у Sigma Aldrich Chemie GmbH ( Германия). Используемый EDTA был от Chinoin (Будапешт), тогда как 50% глутаровый альдегид был от Fluka (Швейцария). Все реагенты, использованные в этом исследовании, были аналитической чистоты. Для приготовления всех растворов использовали деионизированную и дистиллированную воду.
Для приготовления всех растворов использовали деионизированную и дистиллированную воду.
Для экспериментов по адсорбции использовали термостатируемый шейкер (Vibramax 100 Heidolph). Встряхиватель устанавливали на постоянную скорость 300 об/мин и температуру 25±1ºC для экспериментов по адсорбции.
Содержание ионов меди в образцах, подвергнутых адсорбции хитозана и гранул хит-ГЛК, определяли потенциометрически с использованием электрода, чувствительного к меди, типа ELIT 8227 и электрода сравнения с двойным спаем, типа ELIT 003 N (NICO2000 Ltd., Великобритания). Измерения проводились с помощью системы виртуального прибора, состоящей из аппаратной части, платы NI – USB 9215 А и программный компонент, реализованный с помощью NI LabVIEW 2009 (National Instruments, Остин, США). Попытки оптимизировать метод были представлены в предыдущих исследованиях (Bizerea Spiridon et al. 2011a,b). Концентрации ионов меди в исследованиях десорбции определяли методом атомно-абсорбционной спектрофотометрии с использованием спектрофотометра VARIAN SpectrAA 110. Все значения рН были измерены с помощью рН-метра Multi 340i.
Все значения рН были измерены с помощью рН-метра Multi 340i.
Подготовка гранул хитозана
Раствор хитозана готовили путем растворения примерно 1,00 г порошка хитозана в 30 мл 2% раствора уксусной кислоты. Вязкий раствор оставляли на ночь перед добавлением по каплям в ванну для осаждения, содержащую 500 мл 0,5 М NaOH, которая нейтрализовала уксусную кислоту в геле хитозана; таким образом, гель хитозана превращался в однородные сферические шарики. Водный раствор NaOH умеренно встряхивали при слабом непрерывном перемешивании. Влажные гранулы хитозанового геля тщательно промывали дистиллированной водой и фильтровали для удаления остаточного NaOH. Перед экспериментами по адсорбции гранулы хитозана хранили при 4°C после добавления нескольких капель хлороформа для предотвращения бактериальной деградации.
Приготовление гранул хитозан-ГЛК
гранулы хитозан-ГЛК получали путем суспендирования влажных гранул хитозана (синтезированных, как описано выше) в 0,5% растворе глутарового альдегида в течение 24 ч при комнатной температуре. Через 24 ч гранулы сшитого хитозана отфильтровывали и интенсивно промывали дистиллированной водой для удаления непрореагировавшего глутарового альдегида. Затем шарики обрабатывали 2% раствором уксусной кислоты, чтобы убедиться, что материал больше не растворяется в слабых органических кислотах. Наконец, гранулы chit-GLA хранили при 4ºC после добавления нескольких капель хлороформа для предотвращения бактериальной деградации.
Через 24 ч гранулы сшитого хитозана отфильтровывали и интенсивно промывали дистиллированной водой для удаления непрореагировавшего глутарового альдегида. Затем шарики обрабатывали 2% раствором уксусной кислоты, чтобы убедиться, что материал больше не растворяется в слабых органических кислотах. Наконец, гранулы chit-GLA хранили при 4ºC после добавления нескольких капель хлороформа для предотвращения бактериальной деградации.
Тест на растворение и набухание хитозана и гранул Chit-GLA
Хитозан и гранулы хит-ГЛК были протестированы на их растворимость в 5% уксусной кислоте, 5% муравьиной кислоте, дистиллированной воде и 0,5 М растворе гидроксида натрия. К каждому раствору добавляли приблизительно 0,1 г гранул хитозана или хит-ГЛК и перемешивали в течение 24 часов.
Исследования набухания хитозана и гранул хит-ГЛК проводились в дистиллированной воде при комнатной температуре в течение 24 часов. Процент набухания этих шариков рассчитывали по следующему уравнению:
(1)
, где W s – вес набухших шариков (г), а W – вес сухих шариков (г).
Эксперименты по адсорбции
Растворы ионов Cu(II) между 10 -2 М и 10 -5 М были приготовлены путем растворения в деионизированной воде соответствующего количества Cu(NO 3 ) 2 •2,5H 2 O измеряется на аналитических весах с погрешностью ± 0,0001 мг. Сорбцию Cu(II) из приготовленных растворов проводили в периодических процессах при комнатной температуре (25±1°С). Эксперименты по периодической адсорбции проводили, помещая примерно 1,00 г гранул хитозана и хит-ГЛК, соответственно, в 250-мл химический стакан с 50 мл стандартных растворов металлов и перемешивая с использованием термошейкера.
В рамках данного исследования для изучения изотерм адсорбции использовались различные концентрации ионов Cu(II). Из-за высокой степени удаления, полученной в наших предварительных экспериментах, наиболее подходящая концентрация ионов Cu(II) для дальнейших испытаний оказалась равной 10 -4 M. Это значение было использовано для исследования влияния pH, времени контакта и для кинетических исследований. Все измерения проводились в двух повторностях.
Это значение было использовано для исследования влияния pH, времени контакта и для кинетических исследований. Все измерения проводились в двух повторностях.
Эффективность процесса, R (%) , Количество адсорбированного металла и адсорбционная способность, q e (мг/г), определяли по следующим уравнениям соответственно:
(2)
(3)
где C 0 начальная концентрация ионов Cu(II) (мг/л), C e конечная (равновесная) концентрация ионов Cu(II) (мг/л), V — объем раствора ионов Cu(II) (мл), а W — вес использованного хитозана или хитозан-ГЛК (г).
Влияние рН
Влияние рН раствора на адсорбцию ионов Cu(II) хитозаном и хит-ГЛК изучали путем добавления примерно 1,00 г каждого вида шариков в 50 мл 10 -4 М растворов нитрата меди (II), при различных значениях рН от 2 до 6. Абсорбцию хитозаном или хит-ГЛК проводили в течение 60 мин при комнатной температуре и при перемешивании. Регулировку рН проводили с использованием 0,1 М NaOH или 0,1 М HCl. Затем растворы фильтровали и измеряли концентрацию ионов Cu(II) в супернатанте с помощью медночувствительного электрода.
Регулировку рН проводили с использованием 0,1 М NaOH или 0,1 М HCl. Затем растворы фильтровали и измеряли концентрацию ионов Cu(II) в супернатанте с помощью медночувствительного электрода.
Влияние времени контакта
Время контакта представляет собой время, необходимое для достижения равновесия в процессе адсорбции. Для каждого образца исследовали адсорбционную способность в зависимости от времени. Время контакта варьировалось от 20 до 260 мин.
Влияние времени контакта изучали при комнатной температуре при перемешивании со скоростью 300 об/мин с использованием постоянной дозы адсорбента (примерно 0,50 г). Испытания проводились с использованием 50 мл 10 -4 М раствора Cu(II). Затем супернатант отделяли от сорбента фильтрованием и измеряли концентрацию ионов Cu(II) в супернатанте.
Влияние дозировки адсорбента
Также изучалось изменение массы адсорбента в пределах от 0,05 до 1,00 г при предварительно определенных рН и времени перемешивания. Образцы перемешивали в течение 90 минут с последующим фильтрованием и потенциометрическим определением ионов Cu(II).
Образцы перемешивали в течение 90 минут с последующим фильтрованием и потенциометрическим определением ионов Cu(II).
Изотермические исследования
Линейные формы изотерм чаще используются из практических соображений, поскольку они позволяют определять константы и другие параметры, описывающие кинетику адсорбции, из экспериментальных данных.
Математическая корреляция обычно изображается в виде графиков, выражающих количество, адсорбированное на твердой фазе, в зависимости от его остаточной концентрации в растворе (Малек и Фарук, 1996). Это разделение ионов металлов между водной и твердой (гелевой) фазами будет описано одной или несколькими изотермами адсорбции и приведет к эмпирическим выводам, связанным с механизмом адсорбции, таким как монослойная или многослойная модели (Findon et al. 1993). ).
Изотермы адсорбции Ленгмюра широко использовались для количественной оценки и дифференциации адсорбции различных биосорбентов (Ленгмюр 1916). Эта эмпирическая модель предполагает монослойную адсорбцию (толщина адсорбированного слоя составляет одну молекулу), при этом адсорбция может происходить только в конечном числе мест (Виджаярагхаван, и др., , 2006). Другими словами, после заполнения участка комплексообразованием с медью дальнейшая адсорбция не может происходить (Allen et al. 2004; Demirbas et al. 2008). В рамках модели изотермы Ленгмюра предполагаются однородная адсорбция, постоянные энтальпии и активные энергии сорбции (Кунду и Гупта, 2006).
Эта эмпирическая модель предполагает монослойную адсорбцию (толщина адсорбированного слоя составляет одну молекулу), при этом адсорбция может происходить только в конечном числе мест (Виджаярагхаван, и др., , 2006). Другими словами, после заполнения участка комплексообразованием с медью дальнейшая адсорбция не может происходить (Allen et al. 2004; Demirbas et al. 2008). В рамках модели изотермы Ленгмюра предполагаются однородная адсорбция, постоянные энтальпии и активные энергии сорбции (Кунду и Гупта, 2006).
Модель изотермы Ленгмюра, используемая для монослойной адсорбции, может быть представлена уравнением (4),
(4)
где C e – равновесная концентрация ионов металлов (мг/л), q e – количество ионов металлов, адсорбированных на единицу массы адсорбента (мг/г), Q m m — максимальная адсорбционная способность ионов металлов (мг/г), а b — константа адсорбционного равновесия Ленгмюра (мл/мг). Поэтому, используя линеаризованную форму уравнения Ленгмюра ( т.е. . уравнение (5)),
Поэтому, используя линеаризованную форму уравнения Ленгмюра ( т.е. . уравнение (5)),
(5)
построен график C e /q e против C e , дающий прямую линию с наклоном 1/9065 м и точкой пересечения 90 Q м б ). Существенная особенность изотермы Ленгмюра состоит в том, что она может быть выражена через фактор разделения или параметр равновесия, R L , (Вебер и Чакраворти, 1974), что определяется уравнением (6),
(6)
, где C 0 представляет начальную концентрацию Cu(II) (мг/л), а b является константой равновесия адсорбции Ленгмюра (мл/мг).
Эмпирические расчеты приводят к пониманию того, что для процессов адсорбции более низкое значение R L отражает более благоприятную адсорбцию. Значение 1 описывает линейную адсорбцию, тогда как значение 0 указывает на необратимую реакцию адсорбции, а не на процесс динамического равновесия. Значения R L больше 1 указывает на неблагоприятную адсорбцию.
Значения R L больше 1 указывает на неблагоприятную адсорбцию.
Модель изотермы Фрейндлиха (Freundlich 1906) — популярная модель многослойной адсорбции, используемая для неоднородных поверхностей (Adamson and Gast 1997). Эта модель описывает неидеальную и обратимую адсорбцию, которая не ограничивается образованием монослоя. Модель Фрейндлиха определяется уравнением (7):
(7)
где C e – равновесная концентрация ионов металлов (мг/л), q e – количество ионов металлов, адсорбированных на единицу массы адсорбента (мг/г), K F – максимальная адсорбционная способность ионов металлов (мг/г), а n – константа присутствует на нелинейной изотерме Фрейндлиха, что указывает на интенсивность адсорбции. Линеаризованная форма уравнения Фрейндлиха, заданная уравнением (8),
(8)
, где коэффициент 1/n обычно выражается как b F , что представляет собой наклон прямой линии, полученной путем построения графика ln( q e ) по сравнению с ln( C e ). Значение b F важно, так как это способ описания интенсивности адсорбции или неоднородности поверхности. Значение b F должно быть между 0 и 1, если процесс адсорбции описывается хемосорбцией. Чем ближе к 0 значение b F , тем более неоднородна поверхность твердой фазы (Haghseresht and Lu 1998).
Значение b F важно, так как это способ описания интенсивности адсорбции или неоднородности поверхности. Значение b F должно быть между 0 и 1, если процесс адсорбции описывается хемосорбцией. Чем ближе к 0 значение b F , тем более неоднородна поверхность твердой фазы (Haghseresht and Lu 1998).
Изотерма Эловича модель предполагает, что количество центров адсорбции увеличивается экспоненциально с адсорбцией, что указывает на многослойную адсорбцию. Уравнение Эловича (Елович и Ларинов, 1962) выражается уравнением (9),
(9)
, где K E — константа равновесия Эловича (л/мг), а Q m — максимальная адсорбционная способность Эловича (мг/г). Линеаризованная форма уравнения Эловича, использованная для построения графика ln( q e /C e ) по сравнению с q e дается уравнением (10).
(10)
Модель изотермы Темкина (Темкин, 1941) характеризуется линейным уменьшением теплоты адсорбции всех молекул в слое за счет взаимодействия между сорбентом и адсорбатом. Другой важной особенностью модели Темкина является то, что адсорбция в этом случае описывается однородным распределением энергий связи со всеми центрами адсорбции. Модель Темкина задается уравнением (11), а ее линеаризованная форма задается уравнением (12), которое можно использовать для построения графика q e против . пер( С и ),
(11)
(12)
где R – универсальная газовая постоянная (R = 8,314 Дж моль -1 К -1 ), T – температура, 25°C в данном исследовании, ∆Q – теплопередача (Дж моль -1 ), а K 0 является константой Темкина. Изотермические исследования проводились при изменении начальной концентрации ионов Cu(II) в пределах 7,5×10 -5 и 5×10 -3 M. Количество ионов Cu(II), адсорбированных в равновесном состоянии на единицу массы адсорбента, и адсорбционную емкость, соответственно, рассчитывали по уравнению (12) как функцию равновесной концентрации Cu(II) обнаружен потенциометрически.
Количество ионов Cu(II), адсорбированных в равновесном состоянии на единицу массы адсорбента, и адсорбционную емкость, соответственно, рассчитывали по уравнению (12) как функцию равновесной концентрации Cu(II) обнаружен потенциометрически.
Кинетические исследования
Механизм адсорбции исследован с помощью псевдопервой и псевдовторой кинетических моделей. Модель псевдопервого порядка, задаваемая уравнением (13), в большинстве случаев очень хорошо описывает начальную фазу процесса адсорбции, но не подходит для остальной части периода контакта (Хо и Маккей 19).99):
(13)
где q e количество ионов Cu(II), адсорбированных (мг/г) в состоянии равновесия, q t , количество ионов Cu(II), адсорбированных на единицу массы адсорбента (мг/г). ) в моменты времени t и k 1 – константа скорости адсорбции первого порядка (мин -1 ). Чтобы определить значение k 1 , log( q e -q t ) по сравнению с log( q e ).
Модель псевдовторого порядка, представленная уравнением (14), считается наиболее подходящей для описания всего процесса адсорбции (Chiou and Li 2003):
(14)
где q e количество ионов Cu(II), адсорбированных (мг/г) в состоянии равновесия, q t количество ионов Cu(II), адсорбированных на единицу массы адсорбента (мг/г). ) во время т и к 2 – константа скорости адсорбции второго порядка (г мг –1 мин –1 ). Для определения значения k 2 был использован график т/кв t по сравнению с t .
Кинетические исследования периодических процессов проводили с использованием постоянной массы гранул хитозана и хит-ГЛК (0,50 г) в 50 мл раствора 10 -4 М ионов Cu(II). Через 90 мин каждый раствор фильтровали и измеряли концентрацию ионов Cu(II) в фильтрате.
Исследования десорбции
Исследования десорбции очень полезны в реальных ситуациях загрязнения воды ионами Cu(II) из-за того, что хитозан и гранулы хит-ГЛК могут быть переработаны после удаления ионов Cu(II) из водного потока, что удорожает процесс -эффективный (Нгах и др. 2006 г.). В нашей работе для десорбционных исследований использовали ЭДТА.
2006 г.). В нашей работе для десорбционных исследований использовали ЭДТА.
Гранулы хитозана и хит-ГЛК, предварительно подвергнутые воздействию растворов Cu(II), перемешивали с 50 мл 10 -2 или 10 -3 М растворы ЭДТА на 60 минут. Потенциометрический метод экономичен и экономичен при измерении свободных ионов Cu(II) в растворах, но он не позволяет обнаружить Cu(II) в его хелатной форме с ЭДТА. В литературе упоминаются методы декомплексации ионов металлов из комплексов ЭДТА, которые должны дополнительно позволить потенциометрическое определение ионов металлов (Ngah et al. 2006; Tiwari et al. 2008; Rhoads and Davis 2004). Однако в данном исследовании мы выбрали прямое определение комплекса Cu(II) методом атомно-абсорбционной спектрометрии (ААС).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Тест на растворимость и набухание хитозана и гранул Chit-GLA
Экспериментальные результаты показали, что гранулы хитозана растворимы в 5% уксусной и 5% муравьиной кислоте, но не растворимы в дистиллированной воде и 0,5 М NaOH; Гранулы chit-GLA были нерастворимы во всех протестированных средах (таблица 1). Высокая растворимость гранул хитозана в разбавленных растворах уксусной и муравьиной кислот с образованием гидрогеля обусловлена первичными аминогруппами на основной цепи хитозана.
Высокая растворимость гранул хитозана в разбавленных растворах уксусной и муравьиной кислот с образованием гидрогеля обусловлена первичными аминогруппами на основной цепи хитозана.
Таблица 1 . Растворимость хитозана и гранул Chit-GLA в различных водных средах
После сшивания улучшилось набухание хитозана. Сшивающая обработка необходима для усиления химической стабильности гранул в разбавленном кислом растворе. Процент набухания хитозана и гранул хитозан-ГЛК указан в таблице 2.
Таблица 2. Набухание хитозана и гранул Chit-GLA
Влияние pH
На рис. 3 показано влияние pH на адсорбцию Cu(II) на гранулах хитозана. Адсорбция линейно возрастала с увеличением рН раствора Cu(II). В кислой среде (низкий рН) первичные аминогруппы протонировались с положительным зарядом, который электростатически отталкивает катионные ионы Cu(II) и ингибирует их адсорбцию гранулами хитозана или хит-ГЛК.
Рис. 3. Хитозан в кислой среде
При значениях pH выше 4,0 Hernandez и коллеги (2008) указывают, что процесс комплексообразования происходит в основном через аминогруппу из-за стереохимически благоприятного положения групп –OH.
Аналогичная адсорбционная способность наблюдалась у хитозановых шариков при значениях pH от 4,0 до 6,0. Гранулы хит-ГЛК проявляли наилучшую адсорбционную способность при рН 6,0. Кроме того, для остальных исследований адсорбции использовали pH 6,0, чтобы предотвратить образование Cu(OH) 2 осадок, происходящий одновременно с адсорбцией ионов Cu(II) при значениях рН выше 7,0. Образование осадка Cu(OH) 2 неблагоприятно влияет на адсорбцию гранул хитозана или хит-ГЛК и приводит к неправильной интерпретации данных адсорбции.
Рис. 4. Изменение адсорбционной способности ионов Cu(II) на гранулах хитозана и хит-ГЛК в зависимости от рН
Влияние времени контакта
Оптимальное время контакта для адсорбции ионов Cu(II) на хитозан и гранулы хит-ГЛК можно определить по величине адсорбционной емкости, достигаемой за определенное время. На рис. 5 показано изменение адсорбционной емкости в зависимости от времени контакта для исходной концентрации Cu(II) 10 9 .0146 -4 М, так как это оптимальный вариант, при котором достигается максимальная адсорбция.
На рис. 5 показано изменение адсорбционной емкости в зависимости от времени контакта для исходной концентрации Cu(II) 10 9 .0146 -4 М, так как это оптимальный вариант, при котором достигается максимальная адсорбция.
Адсорбция Cu(II) увеличивалась со временем контакта и в конце концов достигла равновесия при начальной концентрации Cu(II) 10 -4 M. Таким образом, можно утверждать, что оптимальное время контакта для адсорбции Cu( II) составляет 180 мин как для гранул хитозана, так и для гранул хит-ГЛК, в экспериментальных условиях, апробированных в работе.
Рис. 5. Изменение адсорбционной способности ионов Cu(II) на хитозане и гранулах хит-ГЛК в зависимости от времени контакта
Влияние дозы адсорбента
Исследования, представленные на рисунках 6 и 7, проводились в одинаковых экспериментальных условиях. На рисунке 6 показано изменение адсорбционной емкости в зависимости от массы адсорбента, гранул хит-ГЛК для исходной концентрации ионов Cu(II) 10 -4 М. Количество используемого адсорбента варьировалось от 0,05 г до 1,00 г, в то время как другие параметры поскольку рН, концентрацию, время контакта и скорость перемешивания поддерживали постоянными. Можно наблюдать значительно сниженную адсорбционную способность гранул хит-ГЛК. Результаты показали, что значение плато адсорбционной способности достигается после приема 0,2 г хит-ГЛК. На рис. 7 показано изменение адсорбционной емкости хитозановых шариков при изменении дозы адсорбента в течение 10 -4 M и 10 -3 M концентрации ионов Cu(II). Хотя адсорбционная емкость была выше для растворов Cu(II) 10 -3 М, процент удаления был намного ниже по сравнению с раствором Cu(II) 10 -4 М. Это говорит о том, что на первой стадии процесса было доступно большое количество свободных мест адсорбции, а затем, по прошествии времени, свободных оставшихся мест было меньше и их было трудно занять из-за сил отталкивания между частицами абсорбата. В результате связывающая способность адсорбента стремится к насыщению, что приводит к снижению общего процента удаления (Anbia and Ghaffari 2009).
Количество используемого адсорбента варьировалось от 0,05 г до 1,00 г, в то время как другие параметры поскольку рН, концентрацию, время контакта и скорость перемешивания поддерживали постоянными. Можно наблюдать значительно сниженную адсорбционную способность гранул хит-ГЛК. Результаты показали, что значение плато адсорбционной способности достигается после приема 0,2 г хит-ГЛК. На рис. 7 показано изменение адсорбционной емкости хитозановых шариков при изменении дозы адсорбента в течение 10 -4 M и 10 -3 M концентрации ионов Cu(II). Хотя адсорбционная емкость была выше для растворов Cu(II) 10 -3 М, процент удаления был намного ниже по сравнению с раствором Cu(II) 10 -4 М. Это говорит о том, что на первой стадии процесса было доступно большое количество свободных мест адсорбции, а затем, по прошествии времени, свободных оставшихся мест было меньше и их было трудно занять из-за сил отталкивания между частицами абсорбата. В результате связывающая способность адсорбента стремится к насыщению, что приводит к снижению общего процента удаления (Anbia and Ghaffari 2009). ; Камбл и др. . 2008).
; Камбл и др. . 2008).
Относительно адсорбционной способности, несмотря на то, что площадь, подвергшаяся адсорбции, увеличивается вместе с дозой адсорбента, в связи с тем, что адсорбированное количество не увеличивается пропорционально (линейно) с ростом количества адсорбента, соотношение (адсорбционная способность) между масса адсорбата (мг) и масса адсорбента (г) уменьшается. При контакте адсорбента и адсорбата из раствора адсорбция происходит быстро в больших количествах. В дальнейшем, по мере быстрого уменьшения концентрации адсорбата, оставшиеся в растворе частицы диффундируют медленнее вследствие увеличения длины диффузионного пути и, таким образом, адсорбция снижается.
| Рис. 6. Влияние массы адсорбента на адсорбционную способность и процент удаления ионов Cu(II) на гранулах хит-ГЛК для исходной концентрации ионов Cu(II) 10 -4 м | Рис. 7. Влияние массы адсорбента на адсорбционную емкость и процент удаления ионов Cu(II) на гранулах хитозана для начальной концентрации ионов Cu(II) 10 -4 М и 10 -3 М 7. Влияние массы адсорбента на адсорбционную емкость и процент удаления ионов Cu(II) на гранулах хитозана для начальной концентрации ионов Cu(II) 10 -4 М и 10 -3 М |
Изотермы адсорбции
Изотермы равновесия необходимы для описания механизма адсорбции любой системы адсорбент-адсорбат. Данные по равновесной адсорбции ионов Cu(II) были подвергнуты четырем различным моделям изотерм адсорбции: Ленгмюра, Фрейндлиха, Эловича и Темкина. В качестве примера приведена экспериментальная изотерма равновесия по модели Ленгмюра адсорбции ионов Cu(II) на хитозан и хит-ГЛК при исходной концентрации Cu(II) 10 -4 М приведен на рис. 8.
Рис. 8. График изотермы адсорбции ионов Cu(II) на хитозан и гранулы хит-ГЛК для исходной концентрации Cu(II) 10 -4 M
Графики на рис. 9 представляют линеаризованные формы моделей изотерм адсорбции Ленгмюра, Фрейндлиха, Эловича и Темкина для адсорбции ионов Cu(II) на хитозан и хит-ГЛК для исходной концентрации Cu(II) 10 -4 М.
Рис. 9. Изотермы адсорбции ионов Cu(II) на гранулах хитозана и хит-ГЛК, линеаризованные по моделям Ленгмюра (а), Фрейндлиха (б), Эловича (в) и Темкина (г) для исходной Cu(II) концентрация 10 -4 M
В таблице 3 представлены результаты расчетов. Можно заметить, что модель Ленгмюра была наилучшей моделью для описания адсорбции ионов Cu(II) на хитозане и гранулах сшитого хитозана для исследованного диапазона концентраций (коэффициент корреляции, R 2 > 0,99).
Согласно модели Ленгмюра для монослойной адсорбции, сшивающая обработка хитозана снижает его адсорбционную способность за счет уменьшения количества свободных аминогрупп для связывания ионов Cu(II), поскольку именно аминогруппы реагируют с хитозановым сшивающим агентом. , глутаровый альдегид.
Таблица 3. Экспериментальные константы изотерм и коэффициенты определения
Согласно модели изотермы Ленгмюра максимальная адсорбционная емкость ( Q m ) ионов Cu(II) на гранулах хит-ГЛК достигала значения несколько выше, чем на хитозане (8,672 мг/г на хит-ГЛК по сравнению с 7,003 мг/г при адсорбции на хитозане). Значения R L составляли 0,131 и 0,162 для адсорбции на хитозане и хит-ГЛК соответственно; эти значения находились в диапазоне от нуля до единицы, что указывало на благоприятную адсорбцию.
Значения R L составляли 0,131 и 0,162 для адсорбции на хитозане и хит-ГЛК соответственно; эти значения находились в диапазоне от нуля до единицы, что указывало на благоприятную адсорбцию.
Значения параметров адсорбции для изотерм Фрейндлиха также представлены в табл. 3. Коэффициенты детерминации превышали 0,9.4, что свидетельствует о хорошем согласии экспериментальных данных с моделью Фрейндлиха. Однако значения R 2 были ниже по сравнению с моделью изотермы Ленгмюра. Значения b F для адсорбции на хитозане и хит-ГЛК находились в диапазоне от 0 до 1, что указывало на то, что имела место хемосорбция. Тот факт, что значения b F не были очень близки к 0, указывает на то, что адсорбция на поверхности была более гомогенной, чем гетерогенной.
Моделирование Эловичем экспериментальных данных также показало, что имела место хемосорбция (McLintock 1967). При подгонке данных к этой модели наблюдались высокие коэффициенты корреляции, особенно в случае гранул хит-ГЛК. Тем не менее коэффициенты корреляции были ниже, чем у моделей Ленгмюра и Фрейндлиха. Однако коэффициент корреляции выше 0,94, аналогичный коэффициенту, полученному как для адсорбции хитозана, так и для адсорбции хит-ГЛК, позволяет предположить, что адсорбция ионов Cu(II) происходит путем хемосорбции. Это было ожидаемым результатом, учитывая, что ионы Cu(II) связаны координированными ковалентными связями со структурой хитозана, как показано на рис. 2.9.0003
Тем не менее коэффициенты корреляции были ниже, чем у моделей Ленгмюра и Фрейндлиха. Однако коэффициент корреляции выше 0,94, аналогичный коэффициенту, полученному как для адсорбции хитозана, так и для адсорбции хит-ГЛК, позволяет предположить, что адсорбция ионов Cu(II) происходит путем хемосорбции. Это было ожидаемым результатом, учитывая, что ионы Cu(II) связаны координированными ковалентными связями со структурой хитозана, как показано на рис. 2.9.0003
Модель Темкина имела самые низкие значения коэффициента корреляции, что свидетельствовало о том, что эта модель не является лучшим описанием адсорбции ионов Cu(II) на хитозан и сшитый хитозан. Однако модель указывала на то, что адсорбция Cu(II) является экзотермическим процессом, поскольку ΔQ > 0 для обоих адсорбентов.
Кинетические исследования
Графики каротажа ( q e -q t ) и т/кв t в зависимости от времени t приведены на рис. 10a и 10b, соответственно, для псевдопервой и псевдовторой кинетических моделей для адсорбции 10 -4 M ионов Cu(II) на гранулах хитозана и хит-ГЛК. И псевдопервая, и псевдовторая кинетические модели показали хорошую линейность ( R 2 > 0,97). Поскольку модель кинетики псевдовторого порядка имела более высокий коэффициент корреляции, она была выбрана как наиболее подходящая кинетическая модель для описания поведения адсорбции. Это наблюдение хорошо согласуется с другими литературными данными (Chiou and Li 2003). Значения кинетических параметров приведены в табл. 4. При этом видно, что теоретическое значение адсорбционной емкости ( q e theor 0,937) хорошо согласуется с экспериментальным значением ( q e exp 0,950).
10a и 10b, соответственно, для псевдопервой и псевдовторой кинетических моделей для адсорбции 10 -4 M ионов Cu(II) на гранулах хитозана и хит-ГЛК. И псевдопервая, и псевдовторая кинетические модели показали хорошую линейность ( R 2 > 0,97). Поскольку модель кинетики псевдовторого порядка имела более высокий коэффициент корреляции, она была выбрана как наиболее подходящая кинетическая модель для описания поведения адсорбции. Это наблюдение хорошо согласуется с другими литературными данными (Chiou and Li 2003). Значения кинетических параметров приведены в табл. 4. При этом видно, что теоретическое значение адсорбционной емкости ( q e theor 0,937) хорошо согласуется с экспериментальным значением ( q e exp 0,950).
Рис. 10. График псевдопервого порядка (а) и график псевдовторого порядка (б) для адсорбции 10 -4 М ионов Cu(II) на хитозан и гранулы хит-ГЛК
Таблица 4. Кинетические параметры ионов 10 -4 M Cu(II) на хитозан и гранулы Chit-GLA
Кинетические параметры ионов 10 -4 M Cu(II) на хитозан и гранулы Chit-GLA
Исследования десорбции
Исследования десорбции проводили в растворах 10 -2 М и 10 -3 М ЭДТА. Шарики хитозана были растворимы в >10 -2 М растворах ЭДТА; поэтому использовались более низкие концентрации ЭДТА, что обеспечивало хорошую десорбцию Cu(II) из шариков. Процесс сшивания повысил устойчивость гранул хит-ГЛК к растворению в растворах ЭДТА. Десорбция Cu(II) из хитозана и гранул сшитого хитозана с использованием 10 9Растворы 0146 -2 М и 10 -3 М ЭДТА представлены в таблице 5 и рассчитаны по уравнению (15),
.(15)
, где C d – концентрация меди, полученная после десорбции меди из раствора ЭДТА, установленная методом атомно-абсорбционной спектрометрии, а C 0 – исходная концентрация раствора меди, используемого для адсорбции на хитозане. и чет-GLA шарики.
и чет-GLA шарики.
Таблица 5. Процент десорбции Cu(II) из комплекса Cu(II)-хитозан и Cu(II)-сшитых шариков
ВЫВОДЫ
- Было проведено сравнительное исследование удаления ионов Cu(II) из растворов 10 -4 M и 10 -3 M Cu(II) путем адсорбции на гранулах хитозана, поперечно сшитых хитозаном и глутаральдегидом, соответственно. Адсорбционные тесты показали, что ионы Cu(II) могут быть эффективно удалены с помощью хитозановых и сшитых глутаральдегидом гранул хитозана. В отношении адсорбции Cu(II) из растворов с низкой концентрацией наши данные в целом согласуются с литературными данными. Наша работа ясно показала, что, хотя хитозановые гранулы обладают более высокой адсорбционной способностью, чем сшитые хитозановые гранулы, сшитые хитозановые гранулы можно использовать в средах с низким pH и демонстрируют низкую степень набухания.
- Некоторые первоначальные тесты показали, что адсорбция меди из растворов 10 -4 М происходит с лучшей адсорбционной способностью и степенью удаления, чем те, которые получены из растворов 10 -3 М.

- Механизм адсорбции лучше всего описывается моделью изотермы Ленгмюра.
- Механизм адсорбции определяется хемосорбцией, которая фактически представляет собой стадию контроля скорости. Высокие коэффициенты корреляции модели изотермы Эловича, значения от 0 до 1 из b F Константа Фрейндлиха и модель кинетики псевдовторого порядка, наиболее подходящие для адсорбции ионов Cu(II) на гранулах хитозана и хит-ГЛК, поддерживают механизм, основанный на хемосорбции.
- На основании экспериментальных результатов, полученных при применении изотермной модели Темкина, можно утверждать, что процесс адсорбции меди был экзотермической реакцией.
- Извлечение ионов Cu(II) было успешно достигнуто при обработке шариков водным раствором ЭДТА.
- Количественное определение ионов Cu(II) в образцах синтетической воды было точно измерено с помощью потенциометрии электрода, чувствительного к меди. Этот метод менее трудоемкий и более быстрый, чем другие методы количественной оценки, и больше подходит для обработки большого количества тестов.
 Потенциометрия является точной и эффективной альтернативой количественного определения ионов Cu(II) по сравнению с методами атомно-абсорбционной спектрометрии.
Потенциометрия является точной и эффективной альтернативой количественного определения ионов Cu(II) по сравнению с методами атомно-абсорбционной спектрометрии.
БЛАГОДАРНОСТИ
Авторы Мануэла М. Минча и Лаура Д. Питулис благодарят за финансовую поддержку стратегического гранта POSDRU/89/1.5/S/63663, Проект «Транснациональная сеть интегрированного управления постдокторскими исследованиями в области научной коммуникации/Институциональное строительство (постдокторская школа) и программа стипендий (CommScie)», финансируемая в рамках Отраслевой оперативной программы развития человеческих ресурсов (2007 г. -2013). Авторы Отилия Бизеря Спиридон и Василе Остафе признательны за поддержку проекта 464 RoS-NET, финансируемого средствами Инструмента ЕС для подготовки к вступлению (IPA) в рамках Программы трансграничного сотрудничества IPA между Румынией и Республикой Сербией.
ССЫЛКИ
Адамсон А.В. и Гаст А.П. (1997). Физическая химия поверхностей , Шестое издание, Wiley-Interscience, Нью-Йорк.
Аллен, С.Дж., Маккей, Г., и Портер, Дж.Ф. (2004). «Модели изотерм адсорбции основных красителей торфом в одно- и двухкомпонентных системах», J. Colloid Interf. науч. 280(2), 322-333.
Анбиа, М., и Гаффари, А. (2009). «Адсорбция фенольных соединений из водных растворов с использованием углеродного нанопористого адсорбента, покрытого полимером», Приложение. Серф. науч. 255(23), 9487-9492.
Бабель, С., и Курниаван, Т.А. (2003). «Обзор недорогих адсорбентов для поглощения тяжелых металлов из загрязненной воды», J. Hazard. Матер. 97(1-3), 219-243.
Бейли, С.Е., Олин, Т.Дж., Брика, Р.М., и Адриан, Д.Д. (1999). «Обзор потенциально недорогих сорбентов для тяжелых металлов», Water Res. 33(11), 2469-2479.
Бенавенте, М. (2008). Адсорбция ионов металлов на хитозан: исследование равновесия и кинетики, Лиценциатская диссертация, KTH Kemiteknik, Стокгольм.
Бизереа Спиридон О., Питулице Л., Даскалу Д. , Влад-Орос Б., Ионел Р., Остафе В. и Тодорович Л. (2011a). «Удаление меди из сточных вод путем адсорбции на биожеолите», Ann.W.U.T-Ser. хим. 20(4), 45-58.
, Влад-Орос Б., Ионел Р., Остафе В. и Тодорович Л. (2011a). «Удаление меди из сточных вод путем адсорбции на биожеолите», Ann.W.U.T-Ser. хим. 20(4), 45-58.
Бизеря Спиридон, О., Даскалу, Д., Питулице, Л., Влад-Орос, Б., Ионел, Р., Милошевич, Н., и Гардич, В. (2011b). «Влияние гидратации биомассы на адсорбцию меди из шахтных сточных вод на спирулине», Ann.WUT-сер. хим. 20(4), 67-80.
Бизерия Спиридон, О. (2010). «Cd (II)-селективный потенциометрический сенсор с многослойной твердой мембраной на основе селенида и его применение», J. Optoelectron. Доп. М. 12(11), 2226-2235.
Бизереа Спиридон, О., и Бизереа, М. (2002). «Микрозонд на основе Cd-ион-селективного мембранного электрода для обнаружения микроэлементов», J. Trace Microprobe T. 20(4), 473-479.
Чен А.-Х., Лю С.-К., Чен С.-Ю. и Чен С.-Ю. (2008). «Сравнительная адсорбция ионов Cu(II), Zn(II) и Pb(II) в водном растворе на сшитом хитозане с эпихлоргидрином», Дж. Азар. Матер. 154(1–3), 184–191.
Азар. Матер. 154(1–3), 184–191.
Чиу, М.С., и Ли, Х.Ю. (2003). «Адсорбционное поведение реактивного красителя в водном растворе на гранулах химически сшитого хитозана», Chemosphere 50(8), 1095-1105.
Чоудхури, З. З., Заин, С. М., Хан, Р. А., Рафик, Р. Ф., и Халид, К. (2012). «Исследования адсорбции катионов свинца (II) из водных растворов на гранулированный активированный уголь, полученный из оболочки Mangostana garcinia , в периодическом режиме и в неподвижном слое», BioResources 7(3), 2895-2915.
Коэльо, Т.С., Лаус, Р., Мангрич, А.С., де Фавере, В.Т., и Ларанджерира, М.К.М. (2007). «Влияние покрытия гепарином микросфер сшитого эпихлоргидрином хитозана на адсорбцию ионов меди (II)», React. Функц. Полим. 67(5), 468-475.
Динс, Дж. Р., и Диоксин, Б. Г. (1992). «Поглощение Pb 2+ и Cu 2+ новыми биополимерами», Water Res. 26(4), 469–472.
Демирбас, Э., Кобя, М. , Конукман, А.Е.С. (2008). «Анализ погрешностей исследований равновесия для адсорбции Cr (VI) активированным углем из миндальной скорлупы из водных растворов», Дж. Азар. Матер. 154(1–3), 787–794.
, Конукман, А.Е.С. (2008). «Анализ погрешностей исследований равновесия для адсорбции Cr (VI) активированным углем из миндальной скорлупы из водных растворов», Дж. Азар. Матер. 154(1–3), 787–794.
Елович С.Ю., Ларинов О.Г. (1962). “К теории адсорбции из растворов неэлектролитов на твердом (I) уравнении адсорбции из растворов и анализе его простейшей формы, (II) проверке уравнения изотермы адсорбции из растворов”, Изв. акад. наук. СССР, отд. хим. Наук 2(2), 209-216.
Эванс, Дж. Р., Дэвидс, В. Г., Макрей, Дж. Д., и Амирбахман А. (2002). «Кинетика поглощения кадмия крабовыми панцирями на основе хитозана», Вода Res. 36(13), 3219-3226.
Фэн, Х., Ли, Дж., и Ван, Л. (2012). «Удаление красителя Reactive Red 228 из водных растворов с помощью льняной костры, модифицированной хитозаном», BioResources 7(1), 624-639.
Финдон, А., Маккей, Г., и Блэр, Х.С. (1993). «Исследования транспорта для сорбции ионов меди хитозаном», J. Environ. науч. Лечить. А 28(1), 173-185.
Environ. науч. Лечить. А 28(1), 173-185.
Freundlich, HMF (1906). «По адсорбции в растворе», J. Phys. хим. 57А, 385-471.
Гибаль, Э., Майлот, К., и Тобин, Дж. М. (1998). «Сорбция анионов металлов хитозановыми гранулами: исследования равновесия и кинетики», Ind. Eng. хим. Рез. 37(4), 1454–1463.
Гупта, В.К. (1998). «Равновесное поглощение, динамика сорбции, разработка процесса и работа колонны для удаления меди и никеля из водного раствора и сточных вод с использованием активированного шлака, недорогого адсорбента», Ind. Eng. хим. Рез. 37(1), 192-202.
Гупте, А., и Мампер, Р. Дж. (2009). «Повышенный уровень меди и окислительный стресс в раковых клетках как мишень для лечения рака», Cancer Treat. Ред. 35, 32–46.
Хагсерешт, Ф., и Лу, Г. (1998). «Характеристики адсорбции фенольных соединений на адсорбентах, полученных из угольных отходов», Energ. Топливо. 12(6), 11:00–11:07.
Эрнандес, Р. Б., Йола, О. Р., и Мерсе, А. Л. Р. (2007). «Химическое равновесие в комплексообразовании двухвалентных катионов первого переходного ряда Cu 2+ , Mn 2+ и Zn 2+ с хитозаном», J. Braz. хим. соц. 18(7), 1388–1396.
Б., Йола, О. Р., и Мерсе, А. Л. Р. (2007). «Химическое равновесие в комплексообразовании двухвалентных катионов первого переходного ряда Cu 2+ , Mn 2+ и Zn 2+ с хитозаном», J. Braz. хим. соц. 18(7), 1388–1396.
Эрнандес, Р. Б., Франко, А. П., Йола, О. Р., Лопес-Дельгадо, А., Фелкман, Дж., Ресио, М. А. Л., и Мерсе, А. Л. Р. (2008). «Координационное исследование хитозана и Fe 3+ », J. Mol. Структура 877, 89-99.
Хо, Ю.С., Хуанг, К.Т., и Хуанг, Х.В. (2002). «Равновесная изотерма сорбции ионов металлов на древовидном папоротнике», Process Biochem. 37(12), 1421–1430.
Хо, Ю.С., и Маккей, Г. (1999). «Сорбция ионов свинца (II) на торфе», Water Res. 33(2), 578-584.
Камбле, С.П., Мангрулкар, П.А., Бансивал, А.К., Райалу, С.С. (2008). «Адсорбция фенола и о-хлорфенола на молекулярных ситах на основе зольной пыли с измененной поверхностью», Chem. англ. J. 138, 73–83.
Камински В. и Модреевска З. (1997). «Применение хитозановых мембран для разделения ионов тяжелых металлов», Отдел. науч. Технол. 32(16), 2659-2668.
Кунду, С., и Гупта, А.К. (2006). «Адсорбция мышьяка цементом с покрытием из оксида железа (IOCC): регрессионный анализ данных о равновесии с использованием нескольких моделей изотерм и их оптимизация», Chem. англ. J. 122(1-2), 93-106.
Ленгмюр, И. (1916). «Состав и основные свойства твердых и жидких тел», J. Am. хим. Соц . 38(11), 2221-2295.
Ли, Н., и Бай, Р. (2005). «Адсорбция меди на гранулах гидрогеля хитозан-целлюлоза: поведение и механизмы», Сентябрь Purif. Технол. 42(3), 237–247.
Лу, Г., Яо, X., Ву, X., и Чжан, Т. (2001). «Определение общего содержания ионов с помощью стеклоуглеродного электрода, модифицированного хитозаном», Microchem. J. 69(1), 81–87.
Малек А. и Фарук С. (1996). «Сравнение изотермных моделей адсорбции углеводородов на активированном угле», AIChE J. 42(11), 3191-3201.
42(11), 3191-3201.
Маклинток, И.С. (1967). «Уравнение Эловича в кинетике хемосорбции», Nature 216(5121), 1204-1205.
Ngah, WSW, and Liang, KH (1999). «Адсорбция ионов золота (III) на хитозан и N -карбоксиметилхитозан: исследования равновесия», Ind. Eng. хим. Рез. 38(4), 1411-1414.
Ngah, WSW, Endud, C.S., и Mayanar, R. (2002). «Удаление ионов меди (II) из водного раствора на хитозан и гранулы сшитого хитозана», React. Функц. Полим. 50(2), 181–190.
Нга, У. С. В., Гани, С. А., и Камари, А. (2005). «Адсорбционное поведение ионов Fe(II) и Fe(III) в водном растворе на хитозане и гранулах сшитого хитозана», Биоресурс. Технол. 96(4), 443-450.
Нга, У. С. В., Камари, А., Фатинатан, С., и Нг, П. В. (2006). «Адсорбция хрома из водного раствора с использованием гранул хитозана», Адсорбция , 12, 249-257.
Нгах, В.С. В. и Фатинатан С. (2008). «Адсорбция ионов Cu(II) в водном растворе с использованием гранул хитозана, гранул хитозан-ГЛК и гранул хитозан-альгинат», Chem. англ. Дж . 143, 62-72.
англ. Дж . 143, 62-72.
Quek, S.Y., Wase, D.A.J., and Forester, C.F. (1998). «Использование отходов саго для сорбции свинца и меди», Water SA 24(3), 251-256.
Рази, М., Десбриер, Дж., Толаймате, А., Ринаудо, М., Воттеро, П., и Алагуи, А. (2002). «Вклад в изучение комплексообразования меди хитозаном и олигомерами», Polymer 43, 1267-1276.
Роудс, К.Р., и Дэвис, А.П. (2004). «Извлечение металлов и повторное использование катализатора в фотокаталитическом окислении медь-этилендиаминтетрауксусной кислоты», Дж. Окружающая среда. англ. 104(4), 425-431.
Руис, М., Састре, А.М., и Гибаль Э. (2000). «Сорбция палладия на хитозане, сшитом глутаровым альдегидом», React . Функция. Полим. 45(3), 155-173.
Сун, С., и Ван, А. (2006). «Адсорбционные свойства карбоксиметилхитозановой и сшитой карбоксиметилхитозановой смолы с Cu(II) в качестве темплата», Sep. Purif. Технол. 49(3), 197-204.


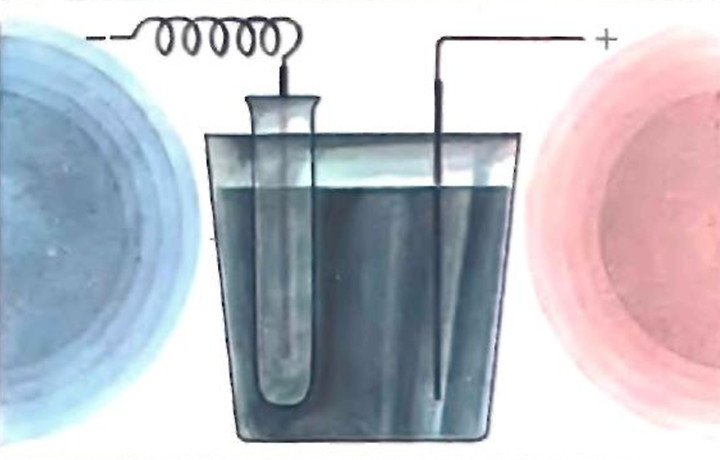
 Возьмите с собой химический реагент и контейнер от него.
Возьмите с собой химический реагент и контейнер от него.
 На странице также рассматриваются некоторые простые химические процессы на основе меди(I).
На странице также рассматриваются некоторые простые химические процессы на основе меди(I). Он нерастворим в воде, и образуется осадок.
Он нерастворим в воде, и образуется осадок.



 Вам нужно будет использовать КНОПКУ НАЗАД в браузере, чтобы вернуться сюда позже.
Вам нужно будет использовать КНОПКУ НАЗАД в браузере, чтобы вернуться сюда позже.