Испарение свинца при нагреве: Свойства свинца и его соединений » Все о металлургии
alexxlab | 22.03.2023 | 0 | Разное
Свойства свинца и его соединений » Все о металлургии
06.05.2015
Свинец — серовато-белый, блестящий в свежем изломе металл, расположенный в IV группе системы Менделеева, с порядковым номером 82, Кларк свинца 1*10в-4%. Молекулярный вес свинца 207,21 Параметр решетки а0=4,9389 А.
Свинец мягок, чертится ногтем, непрочен, хорошо прокатывается и куется, но плохо вытягивается в проволоку. При давлении 5 т/см2 твердый металл переходит в текучее состояние.
Удельный вес твердого свинца 11,35; в пределах от 328 до 750° его удельный вес изменяется от 10,654 до 10,188.
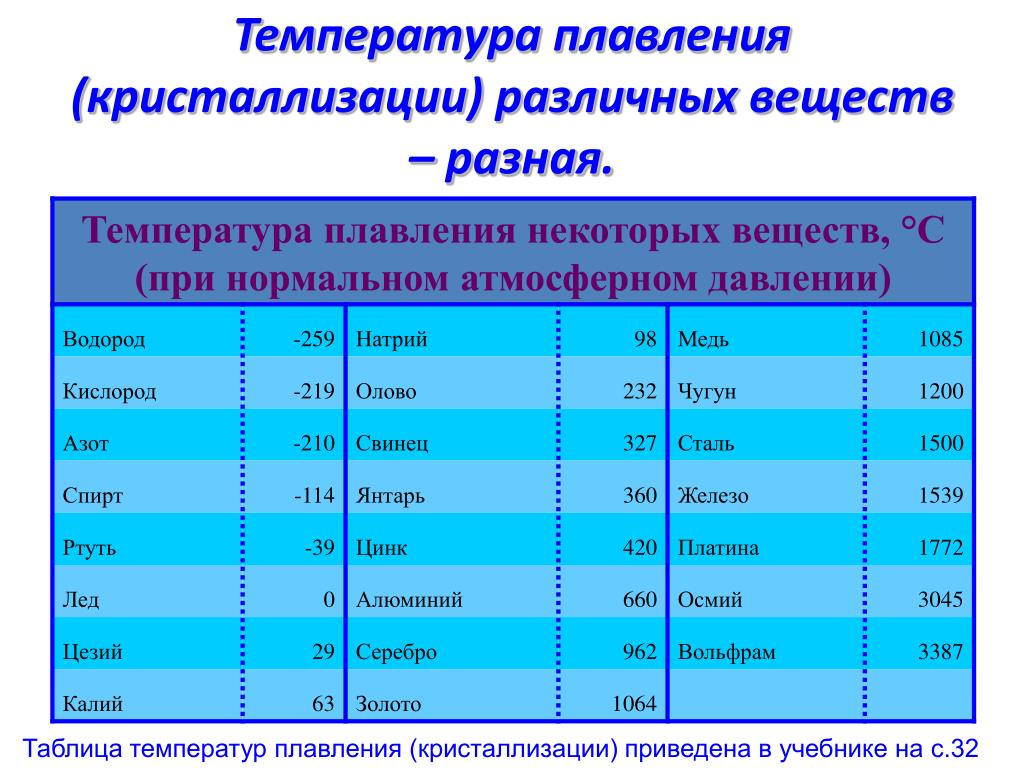
Температура плавления 327,4°, температура кипения 1750° (по другим данным 1525—1540°). Заметная летучесть появляется при температуре около 900°.
Удельная теплоемкость свинца при 18° равна 0,029 кал, а расплавленного — 0,034 кал. Скрытая теплота плавления 5,6 кал, скрытая теплота испарения 230 кал.
Теплопроводность свинца при 18° равна 0,083 кал/см*сек, или 7,5% от теплопроводности серебра.
Удельное электрическое сопротивление свинца равно 20,68 мом/см3 при 18°, или 7,77% от электропроводности серебра.
Под влиянием влажного воздуха поверхность свинца окисляется с образованием пленки Pb(OH)2. Под влиянием SO3 или CO2 гидрат окиси свинца превращается в практически нерастворимые в воде сернокислое или углекислое соединения.
Газы O2, SO2, h3, N2, CO, CO2 не растворяются в свинце.
Свинец хорошо растворяется в разбавленной азотной кислоте; в серной и соляной кислотах при комнатной температуре он не растворяется, так как образующиеся хлорид и сульфат свинца покрывают его плотной нерастворимой пленкой. В этих кислотах свинец растворяется лишь при нагревании до 200—250°. Так же устойчив чистый свинец и к щелочам, аммиаку, хлору и содержащим хлор растворам, органическим кислотам и маслам.
Присутствие примесей, как правило, снижает коррозионную устойчивость свинца.
Свинец легко сплавляется со многими металлами, однако с железом он не сплавляется, что позволяет вести обработку свинца в железной аппаратуре.

Ниже приведены составы наиболее распространенных сплавов на свинцовой основе, %:
Свинец входит также в состав легкоплавких сплавов (переходящих в жидкое состояние при температуре ниже 100°), содержащих олово, кадмий, висмут и ртуть.
Из химических соединений свинца наибольшее значение в технологии его получения имеют сульфид (PbS), окись (PbO), сульфат (PbSO4) и карбонат (PbCO3).
Сернистый свинец PbS (природный минерал галенит) плавится при 1135° и при 950° интенсивно испаряется. Упругость его паров при 1000° достигает 17 мм рт. ст., при этом упругость диссоциации его равна 1,26*10в-1 мм рт. ст.
Температура воспламенения частиц сульфида размером 0,25 мм в присутствии кислорода воздуха 360—380°. Окисление протекает с образованием окиси и сульфата свинца Сернистый свинец растворим в металлическом свинце (рис. 2). При 1040° однородный сплав расслаивается, и нижний слой его содержит 19,4% PbS. В твердом состоянии Pb и PbS взаимно нерастворимы.
Окись свинца PbO плавится при 883°, интенсивно улетучивается при 950—1000° (при которых упругость паров равна 1,8—3,7 мм рт. ст.), кипит при 1472° и при нагревании диссоциирует на свинец и кислород При 1100° упругость диссоциации достигает 1,3*10в-13 мм рт. ст. В свинце PbO нерастворима.
Существует две разновидности окиси свинца, желтая аморфная окись свинца в виде порошка и кристаллический глет.
Окись свинца является амфотерным окислом с более резко выраженными основными, чем кислотными свойствами Глет образует ряд легкоплавких соединений с кремнеземом (силикаты), а также с окислами кальция, магния, алюминия и железа.
С окислами щелочных металлов окись и перекись свинца образуют ряд соединений. Соединения типа Me PbO2 называются плюмбитами, соединения типа MePbO3 — ппюмбатами. В свою очередь различают Me РbО3 — метаплюмбаты и Me2PbO4 — ортоплюмбаты. Плюмбаты — соединения непрочные.
 При нагревании PbSO4 разлагается с образованием основного сульфата. 6РbО*5SO3, при прокаливании в атмосфере h3 или CO образует смесь из Pb и PbS с выделением SO2. При нагревании с углем до 700—800° можно получить PbS, Pb и PbO.
При нагревании PbSO4 разлагается с образованием основного сульфата. 6РbО*5SO3, при прокаливании в атмосфере h3 или CO образует смесь из Pb и PbS с выделением SO2. При нагревании с углем до 700—800° можно получить PbS, Pb и PbO.Установлено образование трех основных солей: 3РbО*PbSO4, 2РbО*PbSO4 и PbO*PbSO4. По данным Шенка и Росбаха и Егера и Гермса, изучивших диаграмму плавкости системы PbSO4—PbO, пере численные соли образуют ряд эвтектик, плавящихся при температуре около 950°.
Основной карбонат свинца, близкий по составу к 2РЬСO3*Pb(OH)2, применяется как краска.
- Свинцовые руды и концентраты
- Свинец
- Кооперирование цинкового производства с химической промышленностью
- Интенсификация производства цинка
- Переработка цинкосодержащих полупродуктов
- Электролиз цинка
- Очистка раствора сульфата цинка от примесей
- Выщелачивание цинка
- Транспортирование и подготовка огарка цинка
- Рафинирование цинка
Свинец
| Свинец | |
|---|---|
| Атомный номер | 82 |
| Внешний вид простого вещества | |
| Свойства атома | |
|
Атомная масса (молярная масса) |
207,2 а. е. м. (г/моль) е. м. (г/моль) |
| Радиус атома | 175 пм |
|
Энергия ионизации (первый электрон) |
715,2 (7,41) кДж/моль (эВ) |
| Электронная конфигурация | [Xe] 4f14 5d10 6s2 6p2 |
| Химические свойства | |
| Ковалентный радиус | 147 пм |
| Радиус иона | (+4e) 84 (+2e) 120 пм |
|
Электроотрицательность (по Полингу) |
1,8 |
| Электродный потенциал |
Pb←Pb2+ -0,126 В Pb←Pb4+ 0,80 В |
| Степени окисления | 4, 2 |
| Термодинамические свойства простого вещества | |
| Плотность | 11,3415 г/см³ |
| Молярная теплоёмкость | 26,65[1]Дж/(K·моль) |
| Теплопроводность | 35,3 Вт/(м·K) |
| Температура плавления | 600,65 K |
| Теплота плавления | 4,77 кДж/моль |
| Температура кипения | 2 013 K |
| Теплота испарения | 177,8 кДж/моль |
| Молярный объём | 18,3 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 4,950 Å |
| Отношение c/a | n/a |
| Температура Дебая | 88,00 K |
| Pb | 82 |
| 207,2 | |
| [Xe]4f145d106s26p2 | |
| Свинец | |
Свинец — элемент главной подгруппы четвёртой группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 82. Обозначается символом Pb (лат. Plumbum). Простое вещество свинец (CAS-номер: 7439-92-1) — ковкий, сравнительно легкоплавкий металл серого цвета.
И. Менделеева, с атомным номером 82. Обозначается символом Pb (лат. Plumbum). Простое вещество свинец (CAS-номер: 7439-92-1) — ковкий, сравнительно легкоплавкий металл серого цвета.
Происхождение слова «свинец» неясно. В большинстве славянских языков (болгарском, сербско-хорватском, чешском, польском) свинец называется оловом. Слово с тем же значением, но похожее по произношению на «свинец», встречается только в языках балтийской группы: švinas (литовский), svins (латышский).
Латинское же plumbum (тоже неясного происхождения) дало английское слово plumber — водопроводчик (когда-то трубы зачеканивали мягким свинцом), и название венецианской тюрьмы со свинцовой крышей — Пьомбе, из которой по некоторым данным ухитрился бежать Казанова. Известен с глубокой древности. Изделия из этого металла (монеты, медальоны) использовались в Древнем Египте, свинцовые водопроводные трубы — в Древнем Риме. Указание на свинец как на определённый металл имеется в Ветхом Завете. Выплавка свинца была первым из известных человеку металлургических процессов. До 1990 г. большое количество свинца использовалось (вместе с сурьмой и оловом) для отливки типографских шрифтов, а также в виде тетраэтилсвинца — для повышения октанового числа моторного топлива.
До 1990 г. большое количество свинца использовалось (вместе с сурьмой и оловом) для отливки типографских шрифтов, а также в виде тетраэтилсвинца — для повышения октанового числа моторного топлива.
Нахождение свинца в природе
Содержание в земной коре 1,6·10
Получение свинца
Страны — крупнейшие производители свинца (включая вторичный свинец) на 2004 год (по данным ILZSG), в тыс. тонн:
| ЕС | 2200 |
| США | 1498 |
| Китай | 1256 |
| Корея | 219 |
Физические свойства свинца
Свинец имеет довольно низкую теплопроводность, она составляет 35,1 Вт/(м·К) при температуре 0°C. Металл мягкий, легко режется ножом. На поверхности он обычно покрыт более или менее толстой плёнкой оксидов, при разрезании открывается блестящая поверхность, которая на воздухе со временем тускнеет.
Металл мягкий, легко режется ножом. На поверхности он обычно покрыт более или менее толстой плёнкой оксидов, при разрезании открывается блестящая поверхность, которая на воздухе со временем тускнеет.
Плотность — 11,3415 г/см³ (при 20 °C)
Температура плавления — 327,4 °C
Температура кипения — 1740 °C
Химические свойства свинца
Электронная формула: KLMN5s25p65d106s26p2, в соответствии с чем он имеет степени окисления +2 и +4. Свинец не очень активен химически. На металлическом разрезе свинца виден металлический блеск, постепенно исчезающий из-за образования тонкой плёнки РbО.
С кислородом образует ряд соединений Рb2О, РbО, РbО2, Рb2О3, Рb3О4. Без кислорода вода при комнатной температуре не реагирует со свинцом, но при большой температуре получают оксида свинца и водород при взаимодействии свинца и горячего водяного пара.
Оксидам РbО и РbО2 соответствуют амфотерные гидрооксиды Рb(ОН)2 и Рb(ОН)4.
При реакции Mg2Pb и разбавленной HCl получается небольшое количество РbН4. Pbh5 — газозообразное вещество без запаха, которое очень легко разлагается на свинец и и водород. При большой температуре галогены образовывают со свинцом соединения вида РbХ2 (X — соответствующий галоген). Все эти соединения мало растворяются в воде. Могут быть получены галогениды и типа РbХ4. Свинец с азотом прямо не реагирует. Азид свинца Pb(N3)2 получают косвенным путём: взаимодействием растворов солей Рb (II) и соли NaN3. Сульфиды свинца можно получить при нагревании серы со свинцом, образуется сульфид PbS. Сульфид получают также пропусканием сероводорода в растворы солей Pb (II). В ряду напряжений Pb стоит левее водорода, но свинец не вытесняет водород из разбавленных HCl и h3SO4, из-за перенапряжения Н2 на Pb, а также на поверхности металла образуются плёнки трудно-растворимых хлорида РbCl2 и сульфата PbSO4, защищающие металл от дальнейшего действия кислот. Концентрированные кислоты типа h3SO4 и НCl при нагревании действуют на Pb и образуют с ним растворимые комплексные соединения состава Pb(HSO4)2 и Н2[РbCl4]. Азотная, а также некоторые органических кислоты (например, лимонная) растворяют свинец с получением солей Рb(II). По растворимости в воде соли свинца делятся на нерастворимые (напрммер, сульфат, карбонат, хромат, фосфат, молибдат и сульфид), малорастворимые (вроде, хлорид и фторид) и растворимые (к примеру,ацетат, нитрат и хлорат свинца). Соли Pb (IV) могут быть получены электролизом сильно подкисленных серной кислотой растворов солей Рb (II). Соли Pb (IV) присоединяют отрицательные ионы с образованием комплексных анионов, например, плюмбатов (РbО3)2- и (РbО4)4-, хлороплюмбатов (РbCl6)2-, гидроксоплюмбатов [Рb(ОН)6]2- и других. Концентрированные растворы едких щелочей при нагревании реагируют с Pb с выделением водорода и гидроксоплюмбитов типа Х2[Рb(ОН)4]. Еион (Ме=>Ме++e)=7,42 эВ.
Азотная, а также некоторые органических кислоты (например, лимонная) растворяют свинец с получением солей Рb(II). По растворимости в воде соли свинца делятся на нерастворимые (напрммер, сульфат, карбонат, хромат, фосфат, молибдат и сульфид), малорастворимые (вроде, хлорид и фторид) и растворимые (к примеру,ацетат, нитрат и хлорат свинца). Соли Pb (IV) могут быть получены электролизом сильно подкисленных серной кислотой растворов солей Рb (II). Соли Pb (IV) присоединяют отрицательные ионы с образованием комплексных анионов, например, плюмбатов (РbО3)2- и (РbО4)4-, хлороплюмбатов (РbCl6)2-, гидроксоплюмбатов [Рb(ОН)6]2- и других. Концентрированные растворы едких щелочей при нагревании реагируют с Pb с выделением водорода и гидроксоплюмбитов типа Х2[Рb(ОН)4]. Еион (Ме=>Ме++e)=7,42 эВ.
Основные соединения свинца
Оксиды свинца
Оксиды свинца имеют преимущественно основный или амфотерный характер. Многие из них окрашены в красные, жёлтые, чёрные, коричневые цвета. На фотографии в начале статьи, на поверхности свинцовой отливки, в её центре видны цвета побежалости — это тонкая плёнка оксидов свинца, образовавшаяся из-за окисления горячего металла на воздухе.
На фотографии в начале статьи, на поверхности свинцовой отливки, в её центре видны цвета побежалости — это тонкая плёнка оксидов свинца, образовавшаяся из-за окисления горячего металла на воздухе.
Галогениды свинца
Халькогениды свинца
Халькогениды свинца — сульфид свинца, селенид свинца и теллурид свинца — представляют собой кристаллы чёрного цвета, которые являются узкозонными полупроводниками.
Соли свинца
Сульфат свинца
Нитрат свинца
Ацетат свинца — свинцовый сахар, относится к очень ядовитым веществам. Ацетат свинца, или свинцовый сахар, Pb(CH3COO)2·3H2O существует в виде бесцветных кристаллов или белого порошка, медленно выветривающегося с потерей гидратной воды. Соединение хорошо растворимо в воде. Оно обладает вяжущим действием, но так как содержит ионы ядовитого свинца, то применяется как наружное в ветеринарии. Ацетат применяют также в аналитической химии, крашении, ситценабивном деле, как наполнитель шёлка и для получения других соединений свинца. Основной ацетат свинца Pb(CH3COO)2·Pb(OH)2 — менее растворимый в воде белый порошок — используется для обесцвечивания органических растворов и очистки растворов сахара перед анализом.
Основной ацетат свинца Pb(CH3COO)2·Pb(OH)2 — менее растворимый в воде белый порошок — используется для обесцвечивания органических растворов и очистки растворов сахара перед анализом.
Применение свинца
Свинец в народном хозяйстве
Нитрат свинца применяется для производства мощных смесевых взрывчатых веществ. Азид свинца применяется как наиболее широкоупотребляемый детонатор (инициирующее взрывчатое вещество). Перхлорат свинца используется для приготовления тяжелой жидкости (плотность 2,6 г/см³), используемой во флотационном обогащении руд, он иногда применяется в мощных смесевых взрывчатых веществах как окислитель. Фторид свинца самостоятельно, а так же совместно с фторидом висмута, меди, серебра применяется в качестве катодного материала в химических источниках тока. Висмутат свинца, сульфид свинца PbS, иодид свинца применяются в качестве катодного материала в литиевых аккумуляторных батареях. Хлорид свинца PbCl2 в качестве катодного материала в резервных источниках тока. Теллурид свинца PbTe широко применяется в качестве термоэлектрического материала (термо-э.д.с 350 мкВ/К), самый широкоприменяемый материал в производстве термоэлектрогенераторов и термоэлектрических холодильников. Двуокись свинца PbO2 широко применяется не только в свинцовом аккумуляторе, но так же на её основе производятся многие резервные химические источники тока, например — свинцово-хлорный элемент, свинцово-плавиковый элемент и др.
Теллурид свинца PbTe широко применяется в качестве термоэлектрического материала (термо-э.д.с 350 мкВ/К), самый широкоприменяемый материал в производстве термоэлектрогенераторов и термоэлектрических холодильников. Двуокись свинца PbO2 широко применяется не только в свинцовом аккумуляторе, но так же на её основе производятся многие резервные химические источники тока, например — свинцово-хлорный элемент, свинцово-плавиковый элемент и др.
Свинцовые белила, основной карбонат Pb(OH)2•PbCO3, плотный белый порошок, — получается из свинца на воздухе под действием углекислого газа и уксусной кислоты. Использование свинцовых белил в качестве красящего пигмента теперь не так распространено, как ранее, из-за их разложения под действием сероводорода h3S. Свинцовые белила применяют также для производства шпатлевки, в технологии цемента и свинцовокарбонатной бумаги.
Арсенат и арсенит свинца применяют в технологии инсектицидов для уничтожения насекомых — вредителей сельского хозяйства (непарного шелкопряда и хлопкового долгоносика).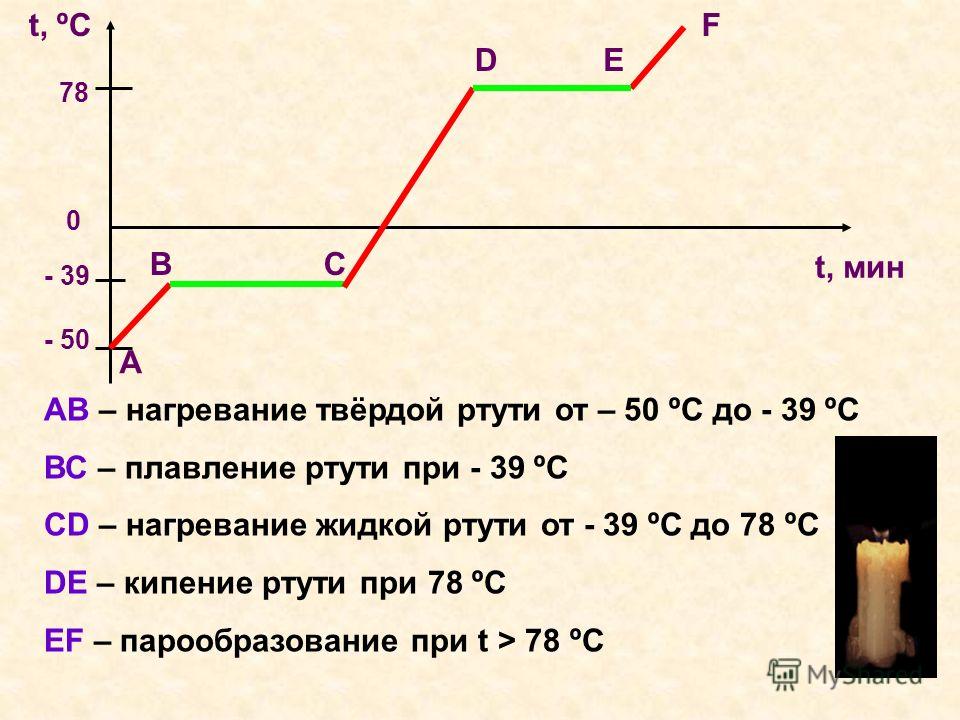 Борат свинца Pb(BO2)2·h3O, нерастворимый белый порошок, используют для сушки картин и лаков, а вместе с другими металлами — в качестве покрытий стекла и фарфора. Хлорид свинца PbCl2, белый кристаллический порошок, растворим в горячей воде, растворах других хлоридов и особенно хлорида аммония Nh5Cl. Его применяют для приготовления мазей при обработке опухолей.
Борат свинца Pb(BO2)2·h3O, нерастворимый белый порошок, используют для сушки картин и лаков, а вместе с другими металлами — в качестве покрытий стекла и фарфора. Хлорид свинца PbCl2, белый кристаллический порошок, растворим в горячей воде, растворах других хлоридов и особенно хлорида аммония Nh5Cl. Его применяют для приготовления мазей при обработке опухолей.
Хромат свинца PbCrO4 известен как хромовый желтый краситель, является важным пигментом для приготовления красок, для окраски фарфора и тканей. В промышленности хромат применяют в основном в производстве желтых пигментов. Нитрат свинца Pb(NO3)2 — белое кристаллическое вещество, хорошо растворимое в воде. Это вяжущее ограниченного применения. В промышленности его используют в спичечном производстве, крашении и набивке текстиля, окраске рогов и гравировке. Сульфат свинца Pb(SO4)2, нерастворимый в воде белый порошок, применяют как пигмент в аккумуляторах, литографии, в технологии набивных тканей.
Сульфид свинца PbS, чёрный нерастворимый в воде порошок, используют при обжиге глиняной посуды и для обнаружения ионов свинца.
Поскольку свинец хорошо поглощает γ-излучение, он используется для радиационной защиты в рентгеновских установках и в ядерных реакторах. Кроме того, свинец рассматривается в качестве теплоносителя в проектах перспективных ядерных реакторов на быстрых нейтронах.
Значительное применение находят сплавы свинца. Пьютер (сплав олова со свинцом), содержащий 85-90 % Sn и 15-10 % Pb, формуется, недорог и используется в производстве домашней утвари. Припой, содержащий 67 % Pb и 33 % Sn, применяют в электротехнике. Сплавы свинца с сурьмой используют в производстве пуль и типографского шрифта, а сплавы свинца, сурьмы и олова — для фигурного литья и подшипников. Сплавы свинца с сурьмой обычно применяют для оболочек кабелей и пластин электрических аккумуляторов. Соединения свинца используются в производстве красителей, красок, инсектицидов, стеклянных изделий и как добавки к бензину в виде тетраэтилсвинца (C2H5)4Pb (умеренно летучая жидкость, пары к-рой в малых концентрациях имеют сладковатый фруктовый запах, в больших-неприятный запах; Тпл = 130 °C, Ткип = 80°С/13 мм рт. ст.; плотн. 1,650 г/см³; nD2v = 1,5198; не раств. в воде, смешивается с орг. растворителями; высокотоксичен, легко проникает через кожу; ПДК = 0,005 мг/м³; ЛД50 = 12,7 мг/кг (крысы, перорально)) для повышения октанового числа.
ст.; плотн. 1,650 г/см³; nD2v = 1,5198; не раств. в воде, смешивается с орг. растворителями; высокотоксичен, легко проникает через кожу; ПДК = 0,005 мг/м³; ЛД50 = 12,7 мг/кг (крысы, перорально)) для повышения октанового числа.
Свинец в медицине
Экономические показатели
Цены на свинец в слитках (марка С1) в 2006 году составили в среднем 1,3—1,5 долл/кг.
Страны, крупнейшие потребители свинца в 2004 году, в тыс. тонн (по данным ILZSG):
| Китай | 1770 |
| ЕС | 1553 |
| США | 1273 |
| Корея | 286 |
Физиологическое действие
Свинец и его соединения токсичны. Попадая в организм, свинец накапливается в костях, вызывая их разрушение. ПДК в атмосферном воздухе соединений свинца 0,003 мг/м³, в воде 0,03 мг/л, почве 20,0 мг/кг. Выброс свинца в Мировой океан 430—650 тысяч т/год.
Выброс свинца в Мировой океан 430—650 тысяч т/год.
Свинец – Удельная теплоемкость, Скрытая теплота плавления, Скрытая теплота испарения
Автор
Свинец – Удельная теплоемкость, Скрытая теплота плавления, Скрытая теплота парообразования
Удельная теплоемкость свинца1 0,13 Дж/г К .
Скрытая теплота плавления свинца составляет 4,799 кДж/моль .
Скрытая теплота испарения свинца составляет 177,7 кДж/моль .
Удельная теплоемкость
Удельная теплоемкость или удельная теплоемкость – это свойство, связанное с внутренней энергией , которое очень важно в термодинамике. Интенсивные свойства C V и C P определены для чистых, простых сжимаемых веществ в качестве частичных производных внутренней энергии U (T, V) и Entry Entalp (Т, р) соответственно:
, где индексы v и p обозначают переменные, фиксированные во время дифференцирования. Свойства c v и c p называются удельной теплоемкостью (или теплоемкостью ), поскольку при определенных особых условиях они связывают изменение температуры системы с количеством добавленной энергии. по теплопередаче. Их единицы СИ составляют Дж/кг·К или Дж/моль·К .
Свойства c v и c p называются удельной теплоемкостью (или теплоемкостью ), поскольку при определенных особых условиях они связывают изменение температуры системы с количеством добавленной энергии. по теплопередаче. Их единицы СИ составляют Дж/кг·К или Дж/моль·К .
Различные вещества подвергаются воздействию различных величин за счет добавления тепла . При подводе к разным веществам определенного количества теплоты их температуры увеличиваются на разную величину.
Теплоемкость является экстенсивным свойством материи, то есть пропорциональна размеру системы. Теплоемкость C имеет единицу измерения энергии на градус или энергию на кельвин. При выражении того же явления в виде интенсивного свойства теплоемкость делится на количество вещества, массу или объем. Таким образом, количество не зависит от размера или степени выборки.
Таким образом, количество не зависит от размера или степени выборки.
Скрытая теплота парообразования
Обычно, когда материал изменяет фазу из твердой в жидкую или из жидкой в газообразную, на это фазовое изменение затрачивается определенное количество энергии. В случае фазового перехода жидкости в газ это количество энергии известно как энтальпия испарения (символ ∆H пар ; единица измерения: Дж), также известная как (скрытая) теплота парообразования или теплота испарения. В качестве примера см. рисунок, на котором описаны фазовые переходы воды.
Скрытая теплота – это количество теплоты, добавляемое к веществу или отводимое от него для осуществления фазового перехода. Эта энергия разрушает межмолекулярные силы притяжения и должна обеспечивать энергию, необходимую для расширения газа ( pΔV работа ). При добавлении скрытой теплоты изменения температуры не происходит. Энтальпия парообразования зависит от давления, при котором происходит это превращение.
Энтальпия парообразования зависит от давления, при котором происходит это превращение.
Скрытая теплота плавления
В случае перехода твердой фазы в жидкую изменение энтальпии, необходимое для изменения ее состояния, известно как энтальпия плавления (символ ∆H fus ; единица измерения: Дж), также известная как (скрытая) теплота плавления . Скрытая теплота — это количество теплоты, добавляемое к веществу или отводимое от него для осуществления фазового перехода. Эта энергия разрушает межмолекулярные силы притяжения и должна обеспечивать энергию, необходимую для расширения системы ( pΔV работа ).
Жидкая фаза имеет более высокую внутреннюю энергию, чем твердая фаза. Это означает, что энергия должна быть передана твердому телу, чтобы расплавить его. Энергия высвобождается из жидкости, когда она замерзает, потому что молекулы в жидкости испытывают более слабые межмолекулярные силы и имеют более высокую потенциальную энергию (своего рода энергия диссоциации связи для межмолекулярных сил).
Температура, при которой происходит фазовый переход, является точкой плавления .
При добавлении скрытой теплоты изменение температуры не происходит. Энтальпия плавления является функцией давления, при котором происходит это превращение. По соглашению давление принимается равным 1 атм (101,325 кПа), если не указано иное.
Lead – Properties
| Element | Lead | ||
|---|---|---|---|
| Atomic Number | 82 | ||
| Symbol | Pb | ||
| Element Category | Poor Metal | ||
| Phase при STP | Твердое тело | ||
| Атомная масса [а.е.м.] | 207,2 | ||
| Плотность при STP [г/см3] | 11,34 | Electron Configuration | [Hg] 6p2 |
| Possible Oxidation States | +2,4 | ||
| Electron Affinity [kJ/mol] | 35. 1 1 | ||
| Electronegativity [Pauling scale] | 2.33 | ||
| 1st Ionization Energy [eV] | 7.4167 | ||
| Year of Discovery | unknown | ||
| Discoverer | unknown | ||
| Thermal properties | |||
| Melting Point [Celsius scale] | 327.5 | ||
| Boiling Point [Celsius scale] | 1740 | ||
| Thermal Conductivity [W/m K] | 35 | ||
| Specific Heat [J /g K] | 0.13 | ||
| Heat of Fusion [kJ/mol] | 4.799 | ||
| Heat of Vaporization [kJ/mol] | 177.7 |
| Hydrogen1H | Helium2He | ||||||||||||||||||
| Lithium3Li | Beryllium4Be | Boron5B | Carbon6C | Nitrogen7N | Oxygen8O | Fluorine9F | Neon10Ne | ||||||||||||
| Sodium11Na | Magnesium12Mg | Aluminium13Al | Silicon14Si | Фосфор15P | Сера16S | Хлор17Cl | Аргон18Ar | ||||||||||||
| Potassium19K | Calcium20Ca | Scandium21Sc | Titanium22Ti | Vanadium23V | Chromium24Cr | Manganese25Mn | Iron26Fe | Cobalt27Co | Nickel28Ni | Copper29Cu | Zinc30Zn | Gallium31Ga | Germanium32Ge | Arsenic33As | Selenium34Se | Бром35Br | Криптон36Kr | ||
| Рубидий37Rb | Strontium38Sr | Yttrium39Y | Zirconium40Zr | Niobium41Nb | Molybdenum42Mo | Technetium43Tc | Ruthenium44Ru | Rhodium45Rh | Palladium46Pd | Silver47Ag | Cadmium48Cd | Indium49In | Tin50Sn | Antimony51Sb | Tellurium52Te | Iodine53I | Ксенон54Xe | ||
| Цезий55Cs | Барий56Ba | Lanthanum57La | Hafnium72Hf | Tantalum73Ta | Tungsten74W | Rhenium75Re | Osmium76Os | Iridium77Ir | Platinum78Pt | Gold79Au | Mercury80Hg | Thallium81Tl | Lead82Pb | Bismuth83Bi | Polonium84Po | Astatine85At | Radon86Rn | ||
| Франций87Fr | Радий88Ra | Актиний89Ac | Rutherfordium104Rf | Dubnium105Db | Seaborgium106Sg | Bohrium107Bh | Hassium108Hs | Meitnerium109Mt | Darmstadtium110Ds | Roentgenium111Rg | Copernicium112Cn | Nihonium113Nh | Flerovium114Fl | Moscovium115Mc | Livermorium116Lv | Tennessine117Ts | Oganesson118Og | ||
| Cerium58Ce | Praseodymium59Pr | Neodymium60Nd | Promethium61Pm | Samarium62Sm | Europium63Eu | Gadolinium64Gd | Terbium65Tb | Dysprosium66Dy | Holmium67Ho | Erbium68Er | Thulium69Tm | Ytterbium70Yb | Lutetium71Lu | ||||||
| Торий90Th | Protactinium91Pa | Uranium92U | Neptunium93Np | Plutonium94Pu | Americium95Am | Curium96Cm | Berkelium97Bk | Californium98Cf | Einsteinium99Es | Fermium100Fm | Mendelevium101Md | Nobelium102No | Lawrencium103Lr | ||||||
–
–
–
Температуры плавления и кипения – теплоты испарения и плавления, обычные материалы
Температуры плавления и кипения, скрытая теплота испарения и теплота плавления обычных веществ, таких как медь, золото, свинец и др.
 – единицы СИ.
– единицы СИ.Спонсируемые ссылки
Температура плавления и кипения, скрытая теплота испарения и тепло плавления от твердого до жидкости. ( или С)
– L f –
(kJ/kg)
– t –
( o C)
– L v –
(kJ/kg)
 0
0- T( o C) = 5/9 [T( o F) – 32]
- 1 kJ/kg = 0.
 4299 Btu/ lb m = 0.23884 kcal/kg
4299 Btu/ lb m = 0.23884 kcal/kg
Sponsored Links
Related Topics
Related Documents
Engineering ToolBox — Расширение SketchUp — 3D-моделирование онлайн!
Добавляйте стандартные и настраиваемые параметрические компоненты, такие как балки с полками, пиломатериалы, трубопроводы, лестницы и т. д., в свою модель Sketchup с помощью Engineering ToolBox — расширения SketchUp, которое можно использовать с потрясающими, увлекательными и бесплатными программами SketchUp Make и SketchUp Pro. .Добавьте расширение Engineering ToolBox в свой SketchUp из хранилища расширений SketchUp Pro Sketchup!
Перевести
О Инженерном наборе инструментов!
Мы не собираем информацию от наших пользователей. В нашем архиве сохраняются только электронные письма и ответы. Файлы cookie используются только в браузере для улучшения взаимодействия с пользователем.
Некоторые из наших калькуляторов и приложений позволяют сохранять данные приложения на локальном компьютере.

