Как обозначается медь в химии: Медь – Применение меди в промышленности
alexxlab | 13.03.2023 | 0 | Разное
История меди
Медь – один из главных химических элементов. Она выглядит как оранжево-красный металл и обладает хорошими свойствами теплопроводности и электропроводности. Медь применяют при производстве огромного ряда инструментов и изделий: электрическая проводка, бытовая посуда, радиаторы в автомобильной и бытовой технике, из нее производят трубы, трансформаторы, широко используют в сплавах с иными металлами. Медью пользуются как пигментом и консервантом при производстве тканей и красок. Наибольшее применение этот металл находит в различных сплавах, самые известные из которых медь и латунь.
Медь стоит в ряде первых металлов, освоенных человечеством, в связи со своей относительной доступностью извлечения из руд и низкой температурой плавки. В природе медь в чистом виде можно встретить гораздо чаще, нежели серебро, золото и даже железо.
Использование меди в древние времена
Считается, что медь начали использовать более чем 10 000 назад. В районе северной части Ирака археологами был добыт медный кулон возрастом порядка 10700 лет. Существуют факты того, что к 6400г до н.э. медь использовали на территории современной Турции. Во время раскопок поселения Чатал-Гююк были обнаружены медные изделия и шлак, оставшийся после медной выплавки из руды. Еще через 2000 лет технология выплавки меди началась использоваться Египтянами. Так, древний египетский письменный источник повествует о горных работах по добыче медной руды на Синайском полуострове.
В районе северной части Ирака археологами был добыт медный кулон возрастом порядка 10700 лет. Существуют факты того, что к 6400г до н.э. медь использовали на территории современной Турции. Во время раскопок поселения Чатал-Гююк были обнаружены медные изделия и шлак, оставшийся после медной выплавки из руды. Еще через 2000 лет технология выплавки меди началась использоваться Египтянами. Так, древний египетский письменный источник повествует о горных работах по добыче медной руды на Синайском полуострове.
Такую популярность в древнейшие времена медь обрела за счет выигрыша в скорости работы медных орудий труда, относительно каменных или костяных. Это показали исследования группы С.А. Семенова. Еще больше в обиход людей медь вошла примерно 5000 лет назад, когда впервые был получен ее сплав с оловом – бронза. Хорошая прочность и ковка, возможность изготовления из бронзы орудий труда, посуды и оружия, сделали ее незаменимым помощником человека тех времен.
В то же время, когда была получена бронза, Римской Империей был завоеван остров Кипр, где были открыты массовые месторождения медной руды. Римляне дали металлу название aes cyprium, впоследствии сократившееся до более привычного cuprum. От этого названия произошел и символ Cu, которым ныне обозначается медь в качестве химического элемента.
Римляне дали металлу название aes cyprium, впоследствии сократившееся до более привычного cuprum. От этого названия произошел и символ Cu, которым ныне обозначается медь в качестве химического элемента.
Открытие меди на американском континенте
Начало производства из меди в Южной Америке датируется 5в. до н.э. Медная руда добывалась вдоль северного побережья современного Перу. Инки вели активные разработки своих месторождений вплоть до 1500-х годов, когда их завоевали испанцы.
В США открытие первых медных шахт в Брэнби и Ланкастере пришлось соответственно на 1705 и 1732гг. Однако еще до середины 19-го века медную руду в штаты завозили из Чили, до того момента, пока не были открыты методы обработки обедненных медных руд.
История меди в России
На территории современной РФ первыми выплавлять медь еще задолго до нашей эры начали племена скифов. В Киевской Руси же активное использование данного металла началось на рубеже 9-го и 10-го веков. Из меди изготавливались монеты, а из ее сплавов оружие и украшения.
Из меди изготавливались монеты, а из ее сплавов оружие и украшения.
Резкое увеличение медного производства постигло Россию в результате реформ Петра Великого. В 1730г. медь приобрела народнохозяйственное значение, а ее выпуск увеличился в 40 раз и составил более 200 тонн. В 1846г в Екатеринбурге в первый раз была начата прокатка меди.
На данные момент мировое производство нефти составляет более 20 млн. тонн, а Российская Федерация, добывая чуть менее миллиона тонн в год, занимает по этому показателю 6-е место в мире, уступая лишь США, Чили, Китаю, Перу и Австралии.
Добавить комментарий
Химия. Цвета некоторых неорганических соединений.
Для успешного выполнения заданий ЕГЭ требуется помнить внешний вид и цвета соединений. Проще всего их запомнить, один раз увидев. Ниже приводятся фотографии наиболее «популярных» соединений. В подписях под картинками указаны те цвета, которыми в ЕГЭ чаще всего обозначают эти вещества.
| Соединения меди | |
| Металлическая медь, (красный или золотисто-красный) | Оксид меди (II), (чёрный порошок) |
| Медный купорос, (синее кристаллическое вещество) | Малахит, (сине-зелёный осадок) |
| Гидроксид меди (II), (синий студенистый осадок) | |
| Соединения железа | |
| Оксид железа (III), (красный порошок) | |
| Соединения хрома | |
| Оксид хрома (III), (зелёный порошок) | Оксид хрома (VI), (Красные кристаллы) |
| Дихромат калия, (оранжевый порошок или раствор) | Хромат калия, (жёлтый порошок или раствор) |
| Соединения серебра | |
| Хлорид серебра, (белый творожистый осадок) | Бромид серебра, (бледно-желтый творожистый осадок) |
| Йодид серебра, (желтый творожистый осадок) | Фосфат серебра, (жёлтый осадок) |
| Соединения марганца | |
| Перманганат калия, (фиолетовые кристаллы или раствор) | Манганат калия, (зелёный раствор или кристаллы) |
| Диоксид марганца, (чёрно-коричневый порошок) | Сульфат марганца (II), (бледно-розовый порошок или раствор) |
| Прочие вещества | |
| Диоксид азота, (бурый газ) | Бром, (коричневая жидкость с красными парами) |
| Йод, (серо-коричневые кристаллы с фиолетовыми парами) | Сера, (жёлтый порошок) |
| Красный фосфор, (красный порошок) | Белый фосфор, (бледно-жёлтое воскообразное вещество) |
Если вам понравился наш материал – записывайтесь на курсы подготовки к ЕГЭ по химии онлайн
Спасибо за то, что пользуйтесь нашими материалами. Информация на странице «Цвета некоторых неорганических соединений.» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать необходимые и поступить в ВУЗ или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из данного раздела.
Информация на странице «Цвета некоторых неорганических соединений.» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать необходимые и поступить в ВУЗ или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из данного раздела.
Публикация обновлена: 08.01.2023
Медная проволока – MEL Chemistry
Похоже, вы посещаете наш сайт из Германия . Пожалуйста, перейдите на наш региональный сайт для получения более актуальных цен, сведений о продуктах и специальных предложениях.
Выбрать другую страну
- Молекулярная формула:
- Cu
- Химическое соединение:
- медь
- Общее название:
Cu – медь – мягкий, ковкий, пластичный металл розовато-оранжевого цвета в чистом виде. Медь и ее сплавы (включая латунь и бронзу) использовались с древних времен для таких целей, как чеканка. С тех пор он нашел применение во многих аспектах нашей повседневной жизни. Благодаря своей электропроводности и коррозионной стойкости большая часть производимой сегодня меди используется в электропроводке и кабелях. Медь также используется в сантехнике, кровле, промышленном оборудовании, посуде и электродвигателях. Медьсодержащие покрытия наносятся на большинство морских судов для защиты их корпусов от моллюсков и других биологических помех.
Медь и ее сплавы (включая латунь и бронзу) использовались с древних времен для таких целей, как чеканка. С тех пор он нашел применение во многих аспектах нашей повседневной жизни. Благодаря своей электропроводности и коррозионной стойкости большая часть производимой сегодня меди используется в электропроводке и кабелях. Медь также используется в сантехнике, кровле, промышленном оборудовании, посуде и электродвигателях. Медьсодержащие покрытия наносятся на большинство морских судов для защиты их корпусов от моллюсков и других биологических помех.
Аналогичные реагенты
- Пластина с медным покрытием
- Медная монета
- Медная монета
- Медь
- Медная проволока
- Медная монета
Эксперименты
Лимонная батарейка
Гальванический элемент DanielЭксперименты с аналогичными реагентами
Газовый хвост лисы
Остановка коррозии
Испытание пламенем
Цветное пламя
Защита от ржавчины
Алхимия
Алхимия
Информация об опасности
Этот реагент считается безопасным по классификации GHS. Обращайтесь со всеми реагентами с осторожностью.
Обращайтесь со всеми реагентами с осторожностью.
Расчет на медь | Природа Химия
Расчет на медь
Скачать PDF
Ваша статья скачана
Карусель с тремя слайдами одновременно. Используйте кнопки «Назад» и «Далее» для перехода по трем слайдам за раз или кнопки с точками в конце для перехода по трем слайдам за раз.
Скачать PDF
- Опубликовано:
- Тибериу Г. Мога 1
Химия природы том 4 , страница 334 (2012)Процитировать эту статью
5878 доступов
8 цитирований
-
28 Альтметрический
Сведения о показателях
Предметы
- Неорганическая химия
Медь, обычно встречающаяся в повседневной жизни, на первый взгляд может показаться немного неинтересной. Tiberiu G. Moga рассказывает, как наука, тем не менее, не пренебрегла своим обещанием.
Tiberiu G. Moga рассказывает, как наука, тем не менее, не пренебрегла своим обещанием.
Предыстория © GETTY IMAGES
В конце финского эпоса «Калевала » герой Вяйнямёйнен отправляется в небеса, покидая царство смертных на медной лодке. Современные инженеры, кажется, приняли это близко к сердцу: корпуса кораблей облицованы материалами на основе меди, которые подавляют рост бактерий, ракушек и других нежелательных пассажиров. Сосуд Вяйнямёйнена — лишь один из примеров того, как красновато-коричневый блеск меди на протяжении всей истории стимулировал человеческое воображение.
Древним римлянам медь была известна как cuprum в связи с островом Кипр, где добывалась большая часть меди. В настоящее время слово «медь» обычно вызывает в воображении видения копеек, электропроводки или, возможно, Статуи Свободы, которая обязана своим зеленым цветом карбонату меди (II). Но, несмотря на свое, казалось бы, ничем не примечательное присутствие в повседневной жизни, медь постоянно играет активную роль в науке благодаря своим жизненно важным биологическим функциям и разнообразным химическим свойствам.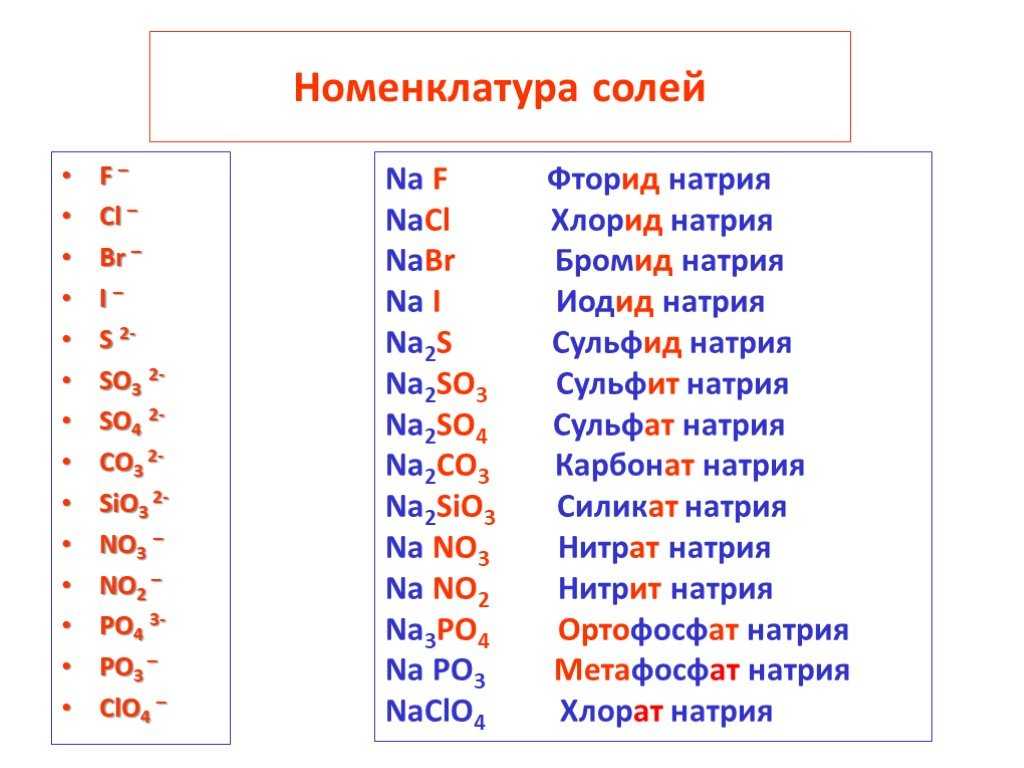 Универсальность меди во многом обусловлена ее способностью осуществлять три различных химических процесса: катализ кислотой Льюиса, процессы с переносом одного электрона и реакции с переносом двух электронов.
Универсальность меди во многом обусловлена ее способностью осуществлять три различных химических процесса: катализ кислотой Льюиса, процессы с переносом одного электрона и реакции с переносом двух электронов.
При кислотном катализе Льюиса ионы Cu + или Cu 2+ объединяют разные молекулы и облегчают химическую реакцию между ними. Известным примером является катализируемое медью циклоприсоединение азид-алкин, известное как клик-химия. В этой реакции один из исходных материалов помечен азидным фрагментом, тогда как другой несет алкиновую группу; два из них сначала координируются с медью, затем ковалентно связываются друг с другом с образованием триазольного кольца 1 . Ни один переходный металл не является столь же эффективным катализатором, как медь, для этой стадии. Благодаря своей надежности и высокой селективности эта клик-реакция широко используется от полного синтеза природных продуктов и их производных до получения и модификации полимеров.
Другим примером катализа кислотой Льюиса, опосредованного ионами меди, является синтез циклических пептидов — класса соединений с многочисленными биологическими приложениями. Например, циклоспорин А и грамицидин S являются антибиотиками; октреотид и кальцитонин действуют на эндокринную систему; а эптифибатид помогает предотвратить образование тромбов и инсульты. Благодаря своему положительному заряду Cu 2+ (наряду с другими ионами) способен связываться с электронными парами атомов кислорода, азота и серы линейных предшественников пептидов, тем самым изгибая их в изогнутые формы, которые легче образуют замкнутые кольцевые структуры 2 .
Механически более сложные, чем катализ кислотой Льюиса, процессы переноса одного электрона, осуществляемые медью — чередование ее форм Cu + и Cu 2+ — незаменимы в биологии. В клеточном дыхании, при котором организм извлекает энергию из глюкозы, участвуют медьсодержащие ферменты митохондриальной мембраны. Эти ферменты окисляют глюкозу и восстанавливают кислород посредством ступенчатого одноэлектронного переноса, также образуя в процессе воду.
Эти ферменты окисляют глюкозу и восстанавливают кислород посредством ступенчатого одноэлектронного переноса, также образуя в процессе воду.
Другие ферменты, которые осуществляют медь-опосредованный одноэлектронный перенос, включают несколько менее известные, но также важные супероксиддисмутазу и тирозиназу 3 . Супероксиддисмутаза на основе меди и цинка защищает клетки от активных форм кислорода, превращая их в менее токсичную молекулу перекиси водорода, которая впоследствии сама превращается в кислород и воду. Медьсодержащая тирозиназа превращает тирозин в L-дофа, предшественник гормона адреналина, который опосредует реакцию «бей или беги» при остром стрессе. L-допа также используется для лечения болезни Паркинсона; он метаболизируется до дофамина, который обеспечивает связь между нервными клетками головного мозга.
Последним типом обычного медного катализа являются реакции переноса двух электронов, также называемые реакциями сочетания, которые происходят в три этапа: окислительное присоединение, трансметаллирование и восстановительное отщепление. Сначала Cu(0) разрывает связь углерод-галоген с образованием связи углерод-медь и медь-галоген, при этом окисляясь до Cu 2+ . Затем ион галогенида вытесняется из центра металлической меди нуклеофилом или другой входящей группой. Наконец, связи углерод-медь и медь-нуклеофил расщепляются с образованием связи углерод-нуклеофил, и катализатор Cu(0) регенерируется 4 .
Сначала Cu(0) разрывает связь углерод-галоген с образованием связи углерод-медь и медь-галоген, при этом окисляясь до Cu 2+ . Затем ион галогенида вытесняется из центра металлической меди нуклеофилом или другой входящей группой. Наконец, связи углерод-медь и медь-нуклеофил расщепляются с образованием связи углерод-нуклеофил, и катализатор Cu(0) регенерируется 4 .
Реакции сочетания были впервые популяризированы с использованием палладиевых катализаторов и принесли Хеку, Негиши и Судзуки Нобелевскую премию по химии 2010 года. Эти реакции в настоящее время находят широкое применение в синтезе лекарств и, скорее всего, будут продолжать привлекать внимание. В качестве катализатора медь дает хорошие выходы в мягких условиях реакции и относительно устойчива к ядам, которые могут разрушить другие катализаторы, что делает ее желательной альтернативой палладию.
От синтеза фармпрепаратов до проектирования новых структур в нанотехнологиях 5 , медь постоянно открывается заново в качестве катализатора и универсального строительного блока. Эта тенденция не собирается ослабевать, что, возможно, свидетельствует о том, что использование меди может быть ограничено только чьей-то фантазией.
Эта тенденция не собирается ослабевать, что, возможно, свидетельствует о том, что использование меди может быть ограничено только чьей-то фантазией.
Это эссе было выбрано победителем нашего конкурса писателей, см. http://go.nature.com/oi187X
Ссылки
Adzima, B.J. et al. Природа Хим. 3 , 256–259 (2011).
Артикул КАС Google ученый
White, C.J. & Yudin, A.K. Nature Chem. 3 , 509–524 (2011).
Артикул КАС Google ученый
Липпард, С.Дж. и Берг, Дж.М. Принципы бионеорганической химии (Университетские научные книги, 1994).
Google ученый
Кар, А. и др.