Как пишется латунь в химии: Латунь, свойства, характеристики — обзорная статья
alexxlab | 22.04.2023 | 0 | Разное
Химический состав алмаза и химические свойства бриллиантов
По химическому составу алмаз представляет собой одну из четырех известных в природе модификаций кристаллического углерода (наряду с графитом, лонсдэлеитом и чаоитом).
По сути, алмаз — это чистый углерод (С).
Благодаря особенностям своей кристаллической структуры (прочная связь между всеми четырьмя атомами электрона углерода), в идеале «алмазный» кристалл должен быть абсолютно прозрачен. То есть, алмаз должен пропускать весь видимый свет (обладать свойством диэлектрика). Однако, в природе далеко не все устроено «идеально». Поэтому в реальных кристаллах алмаза всегда имеется некоторое количество примесей и дефектов решётки. Даже в наиболее чистых ювелирных алмазах содержание примесей достигает 1018 атомов на 1 см3. Если выразить этот показатель более понятным языком, то считается, что максимальное содержание примесей составляет 5%, причём количество одной примесной компоненты не превосходит 2%.
Химический состав алмаза: примеси
В состав алмаза может входить некоторое число примесей. Чаще всего среди них встречаются:
- азот
- кремний
- кальций
- магний
- бор
- аллюминий
реже — железо, медь, барий и другие.
Большинство из этих элементов входят в состав алмаза в виде механических минеральных включений. Например, значительная часть кремния может находиться в форме микровключений муассанита. В некоторых непрозрачных алмазах содержание таких включений достигает 4% и более.
Некоторые элементы, такие как кремний, алюминий, бор и азот изоморфно входят в состав алмаза, занимая места углерода в кристаллической решетке.
Для справки: изоморфизм — свойство элементов замещать друг друга в структуре минерала.
Такие включения часто определяют заметные различия в физических свойствах у разных алмазов.
Распределение примесей в алмазах может быть неравномерным, например на периферии их больше, чем в центре.
В алмазах также встречаются твёрдые (оливин, пироксен, гранаты, хромшпинелиды, графит, кварц, окислы железа и тому подобное), жидкие (вода, углекислота) и газообразные (азот и другие) включения.
ВСЕ КАМНИ — КАТАЛОГ | АЛМАЗЫ (БРИЛЛИАНТЫ) — КАТАЛОГ
Физические свойства алмаза | Кристаллическая решетка алмаза | Формы природных кристаллов алмаза | Алмаз — какого цвета? | Украшения с черными бриллиантами | Куллинан — самый крупный алмаз в мире
Поделитесь статьей с друзьями
Работы дизайнеров из каталога ЮВЕЛИРУМ
Сканворды, Энциклопедический словарь, Толковый словарь, Академический словарь, Существительных, Поговорки, Словарь русского арго, Словарь сленга, Орфографический словарь, Формы слов, Синонимы, Морфемно-орфографический словарь, Этимология, Этимологический словарь, Словарь галлицизмов, Словарь иностранных слов, Грамматический словарь, Слитно.
 Раздельно. Через дефис, Словарь ударений, Полутолковый словарь, Язык Одессы
Раздельно. Через дефис, Словарь ударений, Полутолковый словарь, Язык ОдессыПОДГРУППА IIB. СЕМЕЙСТВО ЦИНКА
ЦИНК, КАДМИЙ, РТУТЬ
Положение элементов семейства цинка как членов рядов переходных металлов, рассмотрено ранее (см. разд. Подгруппа IB и Переходные элементы). Хотя валентный электрон, отличающий их от элементов подгруппы IB, поступает на ns-уровень и у каждого из них заполнена (n1)d 10-орбиталь, по своим химическим и физическим свойствам они все-таки очень отличаются от B-подгрупп; в то же время существует некоторое сходство с непереходными металлами. Так, есть аналогия с элементами подгруппы IIA все они проявляют степень окисления II. Эти переходные металлы имеют сравнительно невысокую плотность, низкие температуры плавления и кипения, проявляя тем самым сходство с непереходными металлами. Температуры плавления и кипения, в целом, увеличиваются к серединам рядов переходных металлов и затем постепенно, но нерегулярно, уменьшаются, поэтому металлы, завершающие серии переходных элементов, должны иметь относительно низкие значения этих величин, что мы и видим в табл. 18. Однако удивительно, что у этих элементов ионные радиусы M2+ меньше ионных радиусов M+ элементов подгруппы IB, хотя металлический радиус заметно больше. Неожиданное увеличение атомного радиуса цинка нарушает закономерность сжатия, начинающуюся с подгруппы IIIB вдоль рядов переходных металлов. Большие значения потенциалов ионизации (энергия, затрачиваемая на отрыв внешних электронов от атома, находящегося в газообразном состоянии) для элементов IIB подгруппы выглядят странно на фоне легкости, с которой Zn и Cd реагируют с кислотами-восстановителями (например, с HCl), вытесняя водород. Исчерпывающее объяснение этому находится за пределами данного рассмотрения, однако причина связана с реальным количеством энергии, выделяющимся при образовании ионов в растворе (энергия гидратации).
18. Однако удивительно, что у этих элементов ионные радиусы M2+ меньше ионных радиусов M+ элементов подгруппы IB, хотя металлический радиус заметно больше. Неожиданное увеличение атомного радиуса цинка нарушает закономерность сжатия, начинающуюся с подгруппы IIIB вдоль рядов переходных металлов. Большие значения потенциалов ионизации (энергия, затрачиваемая на отрыв внешних электронов от атома, находящегося в газообразном состоянии) для элементов IIB подгруппы выглядят странно на фоне легкости, с которой Zn и Cd реагируют с кислотами-восстановителями (например, с HCl), вытесняя водород. Исчерпывающее объяснение этому находится за пределами данного рассмотрения, однако причина связана с реальным количеством энергии, выделяющимся при образовании ионов в растворе (энергия гидратации).
Другой тенденцией, отличающей их от непереходных элементов, т.е. элементов A-подгрупп, является то, что цинк проявляет только степень окисления II, а кадмий реализует степень окисления II как наиболее стабильную, но может давать соединения и со степенью окисления I, и, наконец, для ртути стабильны обе степени окисления (I и II). Эта тенденция к проявлению низких степеней окисления нехарактерна для непереходных элементов. 6s2-Электронная пара ртути близка по поведению к инертной электронной паре. Например, у висмута инертная электронная пара стабилизирует состояние в низшей степени окисления III и дестабилизирует состояние V. Внутренний заполненный слой из 18 электронов сохраняется у каждого элемента, так как эти электроны не участвуют в образовании химической связи. В этой подгруппе больше сходства между Zn и Cd, чем между Cd и Hg, тогда как у непереходных элементов, наоборот, первый член подгруппы отличается от других. Цинк и кадмий не так явно различаются, как медь и серебро. Между подгруппами IB и IIB имеется небольшое сходство, при этом элементы IIB-подгруппы более реакционноспособны. Первые члены действительно имеют существенно более высокие электродные потенциалы.
Эта тенденция к проявлению низких степеней окисления нехарактерна для непереходных элементов. 6s2-Электронная пара ртути близка по поведению к инертной электронной паре. Например, у висмута инертная электронная пара стабилизирует состояние в низшей степени окисления III и дестабилизирует состояние V. Внутренний заполненный слой из 18 электронов сохраняется у каждого элемента, так как эти электроны не участвуют в образовании химической связи. В этой подгруппе больше сходства между Zn и Cd, чем между Cd и Hg, тогда как у непереходных элементов, наоборот, первый член подгруппы отличается от других. Цинк и кадмий не так явно различаются, как медь и серебро. Между подгруппами IB и IIB имеется небольшое сходство, при этом элементы IIB-подгруппы более реакционноспособны. Первые члены действительно имеют существенно более высокие электродные потенциалы.
Извлечение металлов из их сульфидных руд не представляет слишком сложной задачи, так как все сульфиды достаточно легко окислить до оксидов, а затем восстановить оксиды углеродом или металлом при термической обработке. Перед переработкой сульфидную руду цинка (сфалерит или цинковую обманку) подвергают обогащению, после грубого измельчения примерно до размера гравия добавляют к гомогенному шламу (в больших танках), состоящему из ферросилиция FeSi (получают в обжиговых печах сталеплавильной промышленности). Плотность этого жидкообразного шлама достаточна для флотации кремнистого материала из более тяжелых сульфидных руд ZnS в присутствии примеси PbS. Дальнейшее обогащение руды достигается после пенной флотации. Сульфид цинка при обжиге превращают в ZnO и затем восстанавливают до металла коксом при температурах, достаточных для испарения цинка из зоны восстановления. Если в руде присутствовал кадмий, его отделяют благодаря его большей летучести. Чистый цинк получают электролизом аналогично процессу рафинирования меди. Ртуть может быть как в свободном состоянии, так и в связанном в виде киновари HgS. При обжиге на воздухе металл улетучивается из печи, так как при температурах обжига HgO неустойчив и разлагается на ртуть с выделением кислорода.
Перед переработкой сульфидную руду цинка (сфалерит или цинковую обманку) подвергают обогащению, после грубого измельчения примерно до размера гравия добавляют к гомогенному шламу (в больших танках), состоящему из ферросилиция FeSi (получают в обжиговых печах сталеплавильной промышленности). Плотность этого жидкообразного шлама достаточна для флотации кремнистого материала из более тяжелых сульфидных руд ZnS в присутствии примеси PbS. Дальнейшее обогащение руды достигается после пенной флотации. Сульфид цинка при обжиге превращают в ZnO и затем восстанавливают до металла коксом при температурах, достаточных для испарения цинка из зоны восстановления. Если в руде присутствовал кадмий, его отделяют благодаря его большей летучести. Чистый цинк получают электролизом аналогично процессу рафинирования меди. Ртуть может быть как в свободном состоянии, так и в связанном в виде киновари HgS. При обжиге на воздухе металл улетучивается из печи, так как при температурах обжига HgO неустойчив и разлагается на ртуть с выделением кислорода. Сульфидная сера образует SO2. Очистку загрязненного материала проводят, отжимая через замшевый фильтр с последующей обработкой азотной кислотой и повторной перегонкой без доступа воздуха.
Сульфидная сера образует SO2. Очистку загрязненного материала проводят, отжимая через замшевый фильтр с последующей обработкой азотной кислотой и повторной перегонкой без доступа воздуха.
См. также ЦИНКОВАЯ ПРОМЫШЛЕННОСТЬ.
Применение. Металлы подгруппы находят разнообразное применение. Большие количества цинка применяют для коррозионной защиты железа и стали. Металлический цинк достаточно активен, но первоначально в природных условиях образуется инертное защитное покрытие из основного карбоната Zn2(OH)2CO3. Цинковое покрытие можно получать разными способами горячим погружением, как в электролитических методах, испарением цинка с последующей конденсацией на защищаемую поверхность, разбрызгиванием, распылением, напылением и сушкой сформованного материала в больших печах. Много цинка расходуется в производстве бронз и латуней из меди и цинка (см. табл. 17б). Эти сплавы применяют для придания высокой коррозионной стойкости, например, марганцевая бронза (90% Cu, 5% Zn, 3% Sn и 2% Mn) отличается особой коррозионной стойкостью. Кадмирование один из способов коррозионной защиты стальных поверхностей, однако это покрытие неустойчиво к кислотам. Кадмий используют в технологии низкоплавких сплавов, например, сплава Вуда (12,5% Cd), сплава Липовича (10% Cd). Кроме того, кадмий часто добавляют в подшипниковые сплавы. Все металлы подгруппы IIB находят широкое применение в технологии аккумуляторов и батарей. Например, цинк используют как оболочку в сухих батареях, где он выполняет двоякую функцию, контейнера и анода; кадмий используют как анод в никель-кадмиевых элементах типа щелочного аккумулятора Эдисона, в котором ставят кадмиевый анод вместо железного; оксид ртути(II) применяют в ртутных элементах; в стандартном элементе Вестона анод состоит из амальгамы Cd-Hg, а электролит из раствора CdSO4, такой элемент отличается стабильным и хорошо сохраняющимся напряжением. Ртуть единственный из металлов, который является жидкостью при обычной температуре (кроме ртути только галлий и цезий имеют очень низкие (около 29° С) температуры плавления, но они твердые при комнатной температуре).
Кадмирование один из способов коррозионной защиты стальных поверхностей, однако это покрытие неустойчиво к кислотам. Кадмий используют в технологии низкоплавких сплавов, например, сплава Вуда (12,5% Cd), сплава Липовича (10% Cd). Кроме того, кадмий часто добавляют в подшипниковые сплавы. Все металлы подгруппы IIB находят широкое применение в технологии аккумуляторов и батарей. Например, цинк используют как оболочку в сухих батареях, где он выполняет двоякую функцию, контейнера и анода; кадмий используют как анод в никель-кадмиевых элементах типа щелочного аккумулятора Эдисона, в котором ставят кадмиевый анод вместо железного; оксид ртути(II) применяют в ртутных элементах; в стандартном элементе Вестона анод состоит из амальгамы Cd-Hg, а электролит из раствора CdSO4, такой элемент отличается стабильным и хорошо сохраняющимся напряжением. Ртуть единственный из металлов, который является жидкостью при обычной температуре (кроме ртути только галлий и цезий имеют очень низкие (около 29° С) температуры плавления, но они твердые при комнатной температуре). Ртуть отличается большой химической инертностью, высокой электропроводностью и находит разнообразное применение в электротехнических контрольно-измерительных приборах, газоразрядных лампах, переключателях и контактах. Кадмий входит в состав сплава, из которого сделаны регулирующие стержни в активных зонах ядерных реакторов, так как ядро атома кадмия отличается большим сечением захвата нейтронов.
Ртуть отличается большой химической инертностью, высокой электропроводностью и находит разнообразное применение в электротехнических контрольно-измерительных приборах, газоразрядных лампах, переключателях и контактах. Кадмий входит в состав сплава, из которого сделаны регулирующие стержни в активных зонах ядерных реакторов, так как ядро атома кадмия отличается большим сечением захвата нейтронов.
Реакции. Цинк и кадмий активно реагируют со всеми кислотами и даже с водой (при достаточном нагревании), вытесняя из них h3. Реакции с кислотой протекают следующим образом:
Цинк растворяется в щелочах с выделением водорода и образованием цинкат-иона Zn(OH)42. Ртуть реагирует только с сильными кислотами-окислителями, такими, как HNO3 и царская водка. При этом могут образовываться нитраты ртути(I) и ртути(II), Hg2(NO3)2 и Hg(NO3)2. В этом заключается, в частности, ее отличие от меди, которая тоже способна проявлять степени окисления I и II, но с азотной кислотой образует только Cu(NO3)2. В зависимости от ряда факторов (размера реагирующих частиц, концентрации кислоты и температуры) медь реагирует с HNO3 с образованием различных соединений. Из раствора выделяются газообразные оксиды азота, азот и частично водород, в растворе образуются ион Cu(II), Nh3OH, N2h5, Nh5+, может образовываться осадок CuO.
В зависимости от ряда факторов (размера реагирующих частиц, концентрации кислоты и температуры) медь реагирует с HNO3 с образованием различных соединений. Из раствора выделяются газообразные оксиды азота, азот и частично водород, в растворе образуются ион Cu(II), Nh3OH, N2h5, Nh5+, может образовываться осадок CuO.
Оксиды. Все металлы подгруппы (Zn, Cd, Hg) при нагревании реагируют с кислородом. Цинк образует белый ZnO, который при повышении температуры желтеет. Белый ZnO получается при термической диссоциации солей оксокислот; его используют как пигмент. Кадмий при прямом окислении образует коричневый оксид CdO, который при повышении температуры до ЦИНКА СЕМЕЙСТВО700° C разлагается на кадмий и кислород. Напротив, ZnO исключительно стабилен (см. в табл. 18 более отрицательное значение энтальпии образования ZnO). Ртуть медленно окисляется до HgO на воздухе при ЦИНКА СЕМЕЙСТВО300° С и вновь разлагается до металла при температурах чуть выше этой. HgO имеет желтую и красную модификации. Нет данных, свидетельствующих об образовании Hg2O.
Нет данных, свидетельствующих об образовании Hg2O.
Амфотерность. Оксид цинка проявляет типичные амфотерные свойства, реагируя как с основаниями, так и с кислотами и образуя соответственно цинкат-ион Zn(OH)42и Zn2+. Гидроксид цинка Zn(OH)2 получается по реакции с основанием, но в избытке основания растворяется, образуя растворимый цинкат:
Zn(OH)2 +2OH- = Zn(OH)4 2-При использовании раствора аммиака в качестве основания тоже образуется вначале гидроксид, который в избытке Nh4 образует комплексный ион тетраамминцинка: Zn(OH)2 + 4Nh4 = [[Zn(Nh4)4]]2+ + 2OH
Кадмий образует аналогичный ион тетраамминкадмия [[Cd(Nh4)4]]2.
Оксид и гидроксид кадмия в отличие от таких же соединений цинка не проявляют амфотерных свойств. Кадмиат CdO22образуется только при сплавлении оксида кадмия(II) со щелочью. Оксид ртути(II) тоже устойчив к действию оснований, но амфотерность ртути проявляется в том, что HgS растворяется в растворе Na2S с образованием тиомеркурат(II)-иона HgS22.
Взаимодействие с кислотами. При обработке оксидов элементов подгруппы IIB кислотами образуются соли нитраты, сульфаты, галогениды, фосфаты и карбонаты. Карбонаты, нитраты и сульфаты при термической диссоциации разлагаются с образованием CO2, NO2, SO3 (SO2 + O2) соответственно. Карбонат ртути(I) Hg2CO3 получается при смешении растворов Hg2(NO3)2 и карбоната щелочного металла. Образование Hg2CO3 свидетельствует об отсутствии гидролиза иона Hg(I).
При обработке оксидов элементов подгруппы IIB кислотами образуются соли нитраты, сульфаты, галогениды, фосфаты и карбонаты. Карбонаты, нитраты и сульфаты при термической диссоциации разлагаются с образованием CO2, NO2, SO3 (SO2 + O2) соответственно. Карбонат ртути(I) Hg2CO3 получается при смешении растворов Hg2(NO3)2 и карбоната щелочного металла. Образование Hg2CO3 свидетельствует об отсутствии гидролиза иона Hg(I).
Галогениды. Все металлы подгруппы реагируют с галогенами, образуя галогениды; галогениды получаются также при действии галогеноводородов на оксиды и гидроксиды этих металлов. Хлорид цинка ZnCl2, получаемый хлорированием Zn, используют для консервации древесины. Расплав ZnCl2 является умеренным электролитом, что свидетельствует о частично ионном характере связи. Фторид цинка ZnF2 получают прямым фторированием цинка либо реакцией HF c ZnO или ZnCl2. Кадмий со всеми галогенами образует CdIIX2, а также CdICl. Ртуть образует галогениды ртути(I) и ртути(II). Хлорид ртути(II) (сулема), в отличие от хлорида ртути(I) Hg2Cl2, растворим в воде. HgCl2 получают по реакции обмена HgSO4 + 2NaCl -> HgCl2 + Na2SO4 Из раствора его выделяют сублимацией. Сулема высокотоксичное вещество. Хлорид ртути(I) (каломель) нерастворим в воде, неядовит и находит ограниченное применение в медицине как слабительное. Водному слою над осадком каломель придает красивый шелковистый оттенок. Ион ртути(I) Hg22+, или [[Hg:Hg]]2+, имеет необычный для ионов металлов состав, но он существует, что подтверждено результатами химических, электрохимических и спектральных исследований. Ртуть металлическая и HgCl2 находятся в равновесии с Hg2Cl2: Hg0 + HgCl2 = Hg2Cl2
HgCl2 получают по реакции обмена HgSO4 + 2NaCl -> HgCl2 + Na2SO4 Из раствора его выделяют сублимацией. Сулема высокотоксичное вещество. Хлорид ртути(I) (каломель) нерастворим в воде, неядовит и находит ограниченное применение в медицине как слабительное. Водному слою над осадком каломель придает красивый шелковистый оттенок. Ион ртути(I) Hg22+, или [[Hg:Hg]]2+, имеет необычный для ионов металлов состав, но он существует, что подтверждено результатами химических, электрохимических и спектральных исследований. Ртуть металлическая и HgCl2 находятся в равновесии с Hg2Cl2: Hg0 + HgCl2 = Hg2Cl2
Хлорид ртути(II) практически полностью неионное соединение с ковалентным типом связи. Однако то, что при действии h3S на раствор HgCl2 или на раствор с ионом Hg22+ выделяется только HgS, подтверждает наличие определенного количества ионов Hg2+. Аналогично при действии гидроксид-иона образуется только гидроксид ртути(II) Hg(OH)2. Галогениды металлов подгруппы IIB проявляют тенденцию к образованию галогено- и псевдогалогенокомплексов при реакциях растворимых галогенидов или псевдогалогенидов, например:
Комплексообразование настолько сильно выражено у Cd, что аутокомплексы существуют в растворах солей кадмия (например, в растворе CdCl2): 2CdCl2 = Cd[[CdCl4]] В соединениях XHgX (X галоген) ковалентная связь столь прочна, что комплексные соединения ртути намного менее стабильны, чем соответствующие соединения цинка или кадмия. Поэтому в растворе HgCl2 преобладают ионы HgCl+ и Cl, а добавление Cl-иона к раствору HgCl2 не увеличивает стабильность комплексных ионов типа HgCl42. При взаимодействии галогенидов (а также других солей) ртути с аммиаком в зависимости от его физического состояния (газ или раствор) получается белый плавкий либо неплавкий осадок: HgCl2 + 2Nh4 (газ) = Hg(Nh4)2Cl2 (плавкий белый осадок) HgCl2 + 2Nh4 (водн.) = Nh5Cl + HgNh3Cl (неплавкий белый осадок) Вторая реакция тормозится в присутствии больших количеств хлорида аммония Nh5Cl. Среди других реакций для обнаружения аммиака в воде используется реактив Несслера щелочной раствор K2[[HgI4]]. При его взаимодействии с Nh4 и солями аммония образуется красно-коричневый осадок: 2[[HgI4]]2+ Nh4 + 3OH -> [[OHg2Nh3]]I + 7I+ 2h3O Образование этого осадка возможно уже при ничтожных количествах аммиака в растворе. Таким способом можно обнаруживать начало разложения (гниения) продуктов животного или растительного происхождения. Известны и другие соединения ртути с азотом, например, аммиачные комплексы типа иона тетраамминртути(II) [[Hg(Nh4)4]]2+, получаемого из аммиака и соли ионного типа: Hg(ClO4)2 + 4Nh4 [[Hg(Nh4)4]]2+ + 2ClO4
Поэтому в растворе HgCl2 преобладают ионы HgCl+ и Cl, а добавление Cl-иона к раствору HgCl2 не увеличивает стабильность комплексных ионов типа HgCl42. При взаимодействии галогенидов (а также других солей) ртути с аммиаком в зависимости от его физического состояния (газ или раствор) получается белый плавкий либо неплавкий осадок: HgCl2 + 2Nh4 (газ) = Hg(Nh4)2Cl2 (плавкий белый осадок) HgCl2 + 2Nh4 (водн.) = Nh5Cl + HgNh3Cl (неплавкий белый осадок) Вторая реакция тормозится в присутствии больших количеств хлорида аммония Nh5Cl. Среди других реакций для обнаружения аммиака в воде используется реактив Несслера щелочной раствор K2[[HgI4]]. При его взаимодействии с Nh4 и солями аммония образуется красно-коричневый осадок: 2[[HgI4]]2+ Nh4 + 3OH -> [[OHg2Nh3]]I + 7I+ 2h3O Образование этого осадка возможно уже при ничтожных количествах аммиака в растворе. Таким способом можно обнаруживать начало разложения (гниения) продуктов животного или растительного происхождения. Известны и другие соединения ртути с азотом, например, аммиачные комплексы типа иона тетраамминртути(II) [[Hg(Nh4)4]]2+, получаемого из аммиака и соли ионного типа: Hg(ClO4)2 + 4Nh4 [[Hg(Nh4)4]]2+ + 2ClO4
Очевидно, что ртуть имеет координационное число 2 (как в HgCl2 или [[Hg(Nh4)2]]2+, оба линейного строения) или 4, как в [[Hg(Nh4)4]]2+ (тетраэдрического строения).
Гидриды. Все металлы подгруппы IIB образуют гидриды состава Mh3. Так, гидрид цинка Znh3 получается при взаимодействии ZnI2 с LiAlh5 или LiH. Все гидриды реагируют с водой, выделяя водород, аналогично поведению гидридов элементов подгрупп IA и IIA. Термическая устойчивость гидридов убывает в ряду Znh3 > Cdh3 > Hgh3, причем Hgh3 начинает разлагаться при 125° С.
Сульфиды. Сульфиды двухвалентных металлов образуются по реакции прямого синтеза, а также при действии сероводорода на растворы солей. Сульфид цинка ZnS белое и растворимое в кислотах вещество, одно время он как пигмент в смеси с наполнителем BaSO4 (литопон) широко применялся для приготовления красок, в производстве пластмасс, линолеума и т.п. Сульфид кадмия CdS светложелтое вещество также применяют как пигмент, но он растворяется только в сильных кислотах или с окислителями. Для ртути известен только сульфид HgS, так как Hg22+ при обработке сероводородом образует только HgS:
Hg22+ + h3S -> Hg0 + HgS + 2H+ Приведенная реакция является реакцией диспропорционирования и хорошим доказательством чрезвычайной нерастворимости HgS: только смесь HNO3 + HCl растворяет этот сульфид.
Реакции Льюиса. Все ионы рассматриваемых металлов Zn, Cd, Hg обладают большим сродством к электронной паре, и поэтому можно полагать, что они являются сильными кислотами Льюиса, однако ртуть в меньшей степени, чем цинк и кадмий. Координационное число цинка преимущественно равно 4, но может достигать и 6. Получение двух 6-координационных комплексных ионов с октаэдрической структурой приведено ниже: Zn2+ + 6Nh4 = [[Zn(Nh4)6]]2+ Zn2+ + 3Nh3Ch3Ch3Nh3 = [[Zn(en)3]]2+
Последнее соединение представляет собой комплексный ион с бидентатными лигандами: en молекула этилендиамина Nh3Ch3Ch3Nh3, донор двух электронных пар.
Составить слова из букв “цинка семейство”
Что такое латунь? – Определение из Corrosionpedia
Что означает латунь?
Латунь — цветной металл красного цвета и сплав, состоящий из меди и цинка. Пропорции меди и цинка можно варьировать для достижения различных желаемых механических и электрических свойств. Латунь содержит атомы двух составных элементов, которые могут замещать друг друга в пределах единой кристаллической структуры, поэтому ее называют сплавом замещения.
Латунь содержит атомы двух составных элементов, которые могут замещать друг друга в пределах единой кристаллической структуры, поэтому ее называют сплавом замещения.
Латунь была обнаружена около 500 г. до н.э. Хотя он в основном состоит из цинка и меди, он может содержать и другие элементы, как это иногда бывает с бронзой. Между латунью и бронзой есть несколько сходств, при этом латунь можно узнать по большому процентному содержанию цинка и отсутствию олова, хотя в случае луженых латунных сплавов это иногда может быть еще труднее различить.
Свинец обычно добавляют в латунь для улучшения ее обрабатываемости, наряду с другими уникальными элементами, встроенными в различные латунные сплавы.
Латунь является хорошим проводником тепла с низкой температурой плавления. Это мягкий металл, который, как правило, используется для приложений, где должна быть низкая вероятность образования искр при ударе по металлу.
Некоторые свойства латуни:
- Плотность: около 8,73 г/см 3
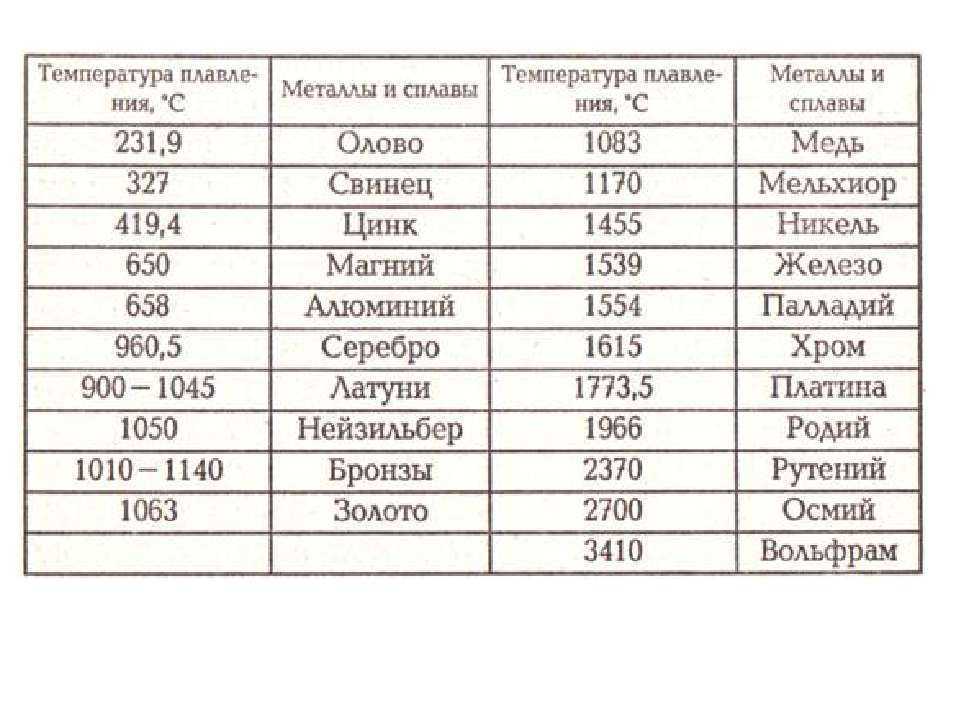
- Температура плавления: относительно низкая, 900°C – 1000°C (1652°F – 1832°F), в зависимости от сплава
- Цвет: Может проявляться как ярко-золотой, медный или иногда даже серебристый цвет, в зависимости от соотношения добавленного цинка и меди
- Коэффициент трения: Подобно бронзе, обладает низким трением при контакте с другими металлами
- Теплопроводность: Хороший проводник тепла
- Стойкость к коррозии, особенно в случае гальванической коррозии морской водой
Ковкость и типы латуни
Содержание цинка в латуни определяет ее ковкость. С латунью, содержащей более 45 процентов цинка, нельзя работать ни в горячем, ни в холодном состоянии. Тип латуни, известный как белая латунь, обычно не имеет большого промышленного значения, но в гранулированном виде используется для пайки твердым припоем. Белая латунь также является основой для некоторых сплавов, используемых при литье под давлением.
С латунью, содержащей более 45 процентов цинка, нельзя работать ни в горячем, ни в холодном состоянии. Тип латуни, известный как белая латунь, обычно не имеет большого промышленного значения, но в гранулированном виде используется для пайки твердым припоем. Белая латунь также является основой для некоторых сплавов, используемых при литье под давлением.
Ковкие латуни можно подразделить на поддающиеся холодной обработке и имеющие большее содержание цинка, требующие горячей обработки. Первые, называемые альфа-латунями, широко используются для изготовления штифтов, болтов и гильз для боеприпасов. Последние, известные как бета-латуни, не такие пластичные, но компенсируют это тем, что они прочнее и поэтому подходят для изготовления ручек кранов, оконной и дверной фурнитуры и других приспособлений.
Другая группа латуни включает латуни с другими элементами (помимо меди и цинка), добавленными для улучшения ряда физических и механических свойств, таких как коррозионная стойкость, обрабатываемость и цвет. Эта третья группа латуни включает свинцовые латуни, которые легко обрабатываются, военно-морские и адмиралтейские латуни, которые состоят из небольшого количества олова для повышения его устойчивости к коррозии в морской воде, и алюминиевые латуни, которые обеспечивают прочность и коррозионную стойкость.
Эта третья группа латуни включает свинцовые латуни, которые легко обрабатываются, военно-морские и адмиралтейские латуни, которые состоят из небольшого количества олова для повышения его устойчивости к коррозии в морской воде, и алюминиевые латуни, которые обеспечивают прочность и коррозионную стойкость.
Области применения для латуни
Латунь хорошо отливается, достаточно долговечна и привлекательна, а также обладает противомикробными свойствами благодаря высокому содержанию меди. Чаще всего латунь используется для изготовления музыкальных инструментов, декоративной отделки, застежек, гильз и многих других предметов.
Латунь часто и легко перерабатывается, поэтому многие детали изготовлены из переработанной латуни.
Реклама
Поделись этим термином
Связанные термины
- Сплав
- Медь
- Цинк
- Бронза
- Коррозия латуни
- Обрабатываемость
- Пластичность
- Пайка
- Литье
Латунь Определение и значение – Merriam-Webster
1 из 2бюстгальтер
1
: сплав, состоящий в основном из меди и цинка в различных пропорциях
2
: духовые инструменты оркестра или оркестра
— часто используется во множественном числе
б
: обычно латунная памятная табличка
с
: фурнитура, посуда или украшения из яркого металла
г
: пустые гильзы
3
: наглая самоуверенность : желчь
4
единственное или множественное число 90 0 60 80 в конструкции а
: высокопоставленные военные
б
: лица, занимающие высокие посты (в бизнесе или правительстве)
латунь
2 из 2
1
: из латуни
латунная пушка
см. также латунное кольцо, латунные кнопки
также латунное кольцо, латунные кнопки
2
: изготовленные из медных духовых музыкальных инструментов или составленные из них
духовая секция оркестра
см. также духовой оркестр
Синонимы
Существительное
- дерзость
- дерзость
- латунь
- наглость
- щека
- дерзость
- наглость
- наглость
- наглость
- наглость
- корка
- наглость
- лицо
- галл
- нерв
- нервозность
- дерзость
- презумпция
- самонадеянность
- соус
- дерзость
- безрассудство
Просмотреть все синонимы и антонимы в тезаурусе
Примеры предложений
Существительное
подсвечник из латуни Весь оркестр — струнные, перкуссия, деревянные духовые и латунь —заиграл. Латуни заиграли.
полировка латуни и серебра
Латуни заиграли.
полировка латуни и серебра
Последние примеры в Интернете
Несмотря на то, что Cubs латунный был занят рекламой будущего команды, настоящее очень похоже на прошлое.
— Пол Салливан, Chicago Tribune , 5 сентября 2022 г.
Этот распылитель из латуни объемом 10 унций идеально подходит для опрыскивания рассады, ростков и влаголюбивых комнатных растений.
— Алисса Готьери, Good Housekeeping , 1 сентября 2022 г. латунь которая делала первые четыре ролика не (задействована).
— Наледи Уше, USA TODAY , 5 июля 2022 г.
Милуоки медь ничуть не шокирован, увидев, что оба питчера добились успеха.
— Курт Хогг, Milwaukee Journal Sentinel , 21 мая 2022 г.
Краска была такой чистой и яркой, латунь была такой блестящей.
— Грег Догерти, 9 лет.0227 Smithsonian Magazine , 14 апреля 2022 г.
Ветры доносили полированные и хорошо смешанные звуки, а медные были выразительными и возбуждающими, не подавляя другие.
– Dallas News , 25 марта 2022 г.
Дерк говорит, что поначалу шпоры из латуни не были в восторге от его новой игрушки.
— Ричард А.
латунь которая делала первые четыре ролика не (задействована).
— Наледи Уше, USA TODAY , 5 июля 2022 г.
Милуоки медь ничуть не шокирован, увидев, что оба питчера добились успеха.
— Курт Хогг, Milwaukee Journal Sentinel , 21 мая 2022 г.
Краска была такой чистой и яркой, латунь была такой блестящей.
— Грег Догерти, 9 лет.0227 Smithsonian Magazine , 14 апреля 2022 г.
Ветры доносили полированные и хорошо смешанные звуки, а медные были выразительными и возбуждающими, не подавляя другие.
– Dallas News , 25 марта 2022 г.
Дерк говорит, что поначалу шпоры из латуни не были в восторге от его новой игрушки.
— Ричард А. Марини, , Сан-Антонио, экспресс-ньюс 9.02:28 , 14 января 2022 г.
Хотя материал может быть тяжелее, чем вы привыкли,
Марини, , Сан-Антонио, экспресс-ньюс 9.02:28 , 14 января 2022 г.
Хотя материал может быть тяжелее, чем вы привыкли,
Эти примеры предложений автоматически выбираются из различных онлайн-источников новостей, чтобы отразить текущее использование слова «латунь». Мнения, выраженные в примерах, не отражают точку зрения Merriam-Webster или ее редакторов. Отправьте нам отзыв.
История слов
Этимология
Существительное
Среднеанглийский bras , от древнеанглийского bræs ; сродни средне-нижненемецкому бюстгальтеры
металлПервое известное использование
Существительное
до 12 века, в значении, определенном в смысле 1
Прилагательное
15 век, в значении, определенном в смысле 1
0
Путешественник во времени Первое известное использование латуни было до 12 века
Посмотреть другие слова из того же века
Словарные статьи рядом с
латуньБрашов
латунь
поглаживание
Посмотреть другие записи поблизости
Процитировать эту запись “Латунь.
 ” Словарь Merriam-Webster.com
” Словарь Merriam-Webster.com Copy Citation
Kids Definition
латунь
Существительное
ˈbras
1
: Сплав с медной и цинком
2
: Красной желтый цвет латуни
3
: .
— часто используется во множественном числе
4
: Яркие металлические украшения, светильники или посуда
5
: Смельница.
латунь прилагательное
Еще от Merriam-Webster о
латуниАнглийский: Перевод латунь для говорящих на испанском языке
Britannica English: перевод латунь для говорящих на арабском языке
Britannica.

