Как пишется медь в химии: Как в химии пишется медь
alexxlab | 09.02.2023 | 0 | Разное
как определить и что это такое в химии
Слово «валентность» звучит красиво и одновременно загадочно. В этой статье вместе с экспертом разберемся, что скрывается за этим словом: что такое валентность, как ее определить и какова ее роль в химии. Напоследок проверим свои знания с помощью «химического» теста
Игорь Геращенко
Автор КП
Анастасия Чистякова
Старший методист по естественно-научному направлению Домашней школы «ИнтернетУрок»
Термин «валентность» появился еще в Средние века, где в научных трудах он имел значение «препарат», «экстракт». И только в конце ХIХ столетия его стали использовать для обозначения связей между мельчайшими частицами вещества.
В 1852 году английский химик Э. Франкленд ввел в химию понятие «соединительная сила», которое положило начало учению о валентности. В 1857 году немецкий ученый Ф. А. Кекуле, изучая свойства углерода в метане, пришел к выводу о существовании «основности» атомов – таком же важном и постоянном свойстве, как атомный вес. Спустя три года российский химик А. М. Бутлеров усовершенствовал учение о валентности, распространив его на органические соединения.
А. Кекуле, изучая свойства углерода в метане, пришел к выводу о существовании «основности» атомов – таком же важном и постоянном свойстве, как атомный вес. Спустя три года российский химик А. М. Бутлеров усовершенствовал учение о валентности, распространив его на органические соединения.
Что такое валентность в химии
Валентность – это способность атома образовывать химические связи с другими атомами. Такие связи создаются за счет электронов, расположенных на внешнем электронном слое. Поэтому количественной мерой валентности становится число совместных связей между атомами.
Химические соединения предполагают формирование общих электронных пар. Этот процесс получил наименование «ковалентная химическая связь». В зависимости от числа общих электронных пар выделяют одинарную, двойную и тройную ковалентную связь.
Большим достижением в химии стало наглядное изображение молекул, с помощью которого легко представить себе понятие валентности и ковалентной связи. К примеру, водород имеет сокращенную химическую формулу H₂ и структурную формулу: Н – Н. Во втором случае видно, что водород обладает одновалентностью, поскольку связан в молекуле только с одним своим собратом.
К примеру, водород имеет сокращенную химическую формулу H₂ и структурную формулу: Н – Н. Во втором случае видно, что водород обладает одновалентностью, поскольку связан в молекуле только с одним своим собратом.
Формула воды H₂O и Н – О – Н наглядно свидетельствует о двухвалентности кислорода, так как он способен создавать две ковалентные связи с атомами водорода.
Углекислый газ CO₂ и О = С = О состоит из двух атомов кислорода и атома углерода, у которого валентность равна четырем. Он может присоединять 2 двухвалентных атома кислорода либо 4 одновалентных атома водорода, как в метане СН₄.
Как определить валентность химических элементов
Существуют разные способы определения валентности химических элементов. Самый простой заключается в том, чтобы обратиться к специальной таблице валентности химических элементов.
Другой способ связан с расчетом валентности по химической формуле. За единицу валентности принимается валентность атома водорода, так как он способен образовывать с другими атомами только одну связь. Химические элементы, взаимодействуя с водородом, показывают собственную валентность. Например, в молекуле хлористого водорода (HCl) хлор имеет валентность I. В молекуле аммиака (NН₃) азот соединен с тремя атомами водорода, следовательно, его валентность – III.
Химические элементы, взаимодействуя с водородом, показывают собственную валентность. Например, в молекуле хлористого водорода (HCl) хлор имеет валентность I. В молекуле аммиака (NН₃) азот соединен с тремя атомами водорода, следовательно, его валентность – III.
Кроме водорода, валентность химических элементов можно определять по кислороду, который во всех своих соединениях двухвалентен. Так, в оксиде серы (IV) SO₂ валентность серы равна IV (валентность кислорода умножаем на 2). А в соединении SO₃ валентность серы уже VI (два умножаем на три).
Когда речь идет о сложных соединениях, где присутствует более двух химических элементов, определить валентность каждого из них становится сложнее. О молекуле HClO₄ можно только сказать, что остаток ClO₄ одновалентен, а в соединении H₂SO₄ остаток SO₄ двухвалентен.
В сложных соединениях, где присутствует более двух химических элементов, определить валентность можно по химическим формулам. Фото: pixabay.com
Таблица валентности химических элементов
Приведем в качестве примера таблицу валентности наиболее распространенных химических элементов. Звездочкой отмечены элементы с постоянной валентностью.
Звездочкой отмечены элементы с постоянной валентностью.
Популярные вопросы и ответы
Отвечает Анастасия Чистякова, старший методист по естественно-научному направлению Домашней школы «ИнтернетУрок»
Что такое постоянная валентность?
– В таблице Менделеева существуют так называемые элементы с постоянной валентностью. Свое название они получили из-за способности образовывать строго определенное количество химических связей. Постоянная валентность чаще всего совпадает с номером группы, где находится элемент. Таких элементов сравнительно немного, поэтому их можно легко запомнить.
Постоянную валентность I (могут присоединять или замещать только один атом другого элемента) имеют щелочные металлы (Li, Na, K, Rb, Cs, Fr) и фтор (F).
Постоянную валентность II (способность присоединить или заместить только два атома других элементов) имеют металлы второй группы, главной подгруппы (Be, Mg, Ca, Sr, Ba, Ra) и кислород (O).
Постоянную валентность III имеет всего лишь один элемент – алюминий (Al), так как только он способен присоединить либо заместить три атома других химических элементов.
Как определить валентность по таблице Менделеева?
– Большинство химических элементов обладают переменной валентностью, и ее можно определить по таблице Менделеева. В этой таблице номер группы соответствует высшей валентности элемента. Если от восьми отнять номер группы, где находится элемент, мы узнаем его низшую валентность. Например, высшая валентность серы (S) – 6, так как она находится в шестой группе, а низшая – 2 (8 – 6 = 2).
Правда, бывают и исключения, которые нужно запомнить. Кремний (Si) находится в IV группе, и можно сделать предположение, что его низшая валентность – IV. Однако это не так. Низшая валентность кремния – II. Азот (N) расположен в V группе, но его низшая валентность также II.
Чем валентность отличается от степени окисления?
– Понятия «валентность» и «степень окисления» являются близкими по своему значению, но далеко не тождественными. Валентность определяет количество химических связей, которыми атом элемента связан с другими атомами в молекуле. Степень окисления используется для описания тех реакций, которые сопровождаются присоединением либо отдачей электронов.
Валентность определяет количество химических связей, которыми атом элемента связан с другими атомами в молекуле. Степень окисления используется для описания тех реакций, которые сопровождаются присоединением либо отдачей электронов.
Валентность нейтральна, а степень окисления может быть положительной, отрицательной или нулевой. Положительная степень окисления соответствует количеству отданных электронов, отрицательная – числу присоединенных. Нулевая степень окисления говорит о том, что данный элемент находится или в состоянии простого вещества, или был восстановлен до нуля после окисления, или окислен до нуля после предшествующего восстановления.
Чаще всего валентность и степень окисления количественно равны, однако бывают и исключения, которые необходимо запомнить. Например, в азотной кислоте (HNO₃) валентность атома N равна IV, а степень окисления +5. В молекуле CO углерод имеет валентность II, а степень окисления +2
Валентность элементов
Выполните несложные задания и проверьте, насколько хорошо вы разобрались в теме.
| Пройти тест |
В Древней Греции
В Средние века
В Новое время
| Дальше |
| Проверить |
| Узнать результат |
Способность атома отдавать электроны
Способность атома присоединять электроны
Способность атома образовывать химические связи с другими атомами
| Дальше |
| Проверить |
| Узнать результат |
Водород (Н)
Сера (S)
Хлор (Cl)
| Дальше |
| Проверить |
| Узнать результат |
Железо (Fe)
Кислород (O)
Бром (Br)
| Дальше |
| Проверить |
| Узнать результат |
Ковалентная
Металлическая
Ионная
| Дальше |
| Проверить |
| Узнать результат |
| Дальше |
| Проверить |
| Узнать результат |
| Дальше |
| Проверить |
| Узнать результат |
Перечитайте статью еще раз. Уверены: результат будет лучше!
Уверены: результат будет лучше!
| Пройти еще раз |
Перечитайте статью еще раз. Уверены: результат будет лучше!
| Пройти еще раз |
Перечитайте статью еще раз. Уверены: результат будет лучше!
| Пройти еще раз |
Вы освоили материал, однако ошибки еще есть.
| Пройти еще раз |
Вы освоили материал, однако ошибки еще есть.
| Пройти еще раз |
Поздравляем! У вас отличный результат.
| Пройти еще раз |
Фото на обложке: pexels.com
Химический диктант
Химический диктант14 мая 2022 в 13:00
В этом году тема диктанта — «Химия — свет науки через стекло жизни».
Традиционно диктант состоится сразу в двух форматах — онлайн для всех желающих и очно на отдельных площадках России.
Диктант завершён
О Химдиктанте 2022
Тема диктанта: Химия — свет науки через стекло жизни
Всероссийский химический диктант традиционно проводится в середине мая.
В этом году диктант состоится в четвёртый раз и пройдёт 14 мая в 13:00 по местному времени.
Формат мероприятия — очно и онлайн.
Что ждёт участников
Участвовать в химдиктанте может любой желающий. Вам предстоит за 45 минут ответить на 25 вопросов разного уровня сложности очно или онлайн на сайте. Чтобы ответить правильно, специальные научные знания вовсе не требуются — важно лишь немного порассуждать, вспомнить пару примеров из жизни и, самое главное, мыслить логически.
Пройдите регистрацию, прежде чем писать диктант
Независимо от выбранного вами формата участия, очно или онлайн, перед выполнением диктанта пройдите регистрацию на сайте.
Когда будут известны результаты
Смотрите в ваших личных кабинетах. Для тех, кто писал диктант онлайн — сразу после завершения работы, а для очных участников — 20 мая 2022 года.
Для тех, кто писал диктант онлайн — сразу после завершения работы, а для очных участников — 20 мая 2022 года.
Широко простирает химия руки
свои в дела человеческие
М. В. Ломоносов
Прямая трансляция. Химический факультет МГУ
Как принять участие?
Выберите удобный вам формат участия в диктанте: онлайн или очно
Для участия в диктанте необходимо зарегистрироваться на сайте
Онлайн-участие
Всё, что необходимо для онлайн-участия:
- Регистрация онлайн-участника на сайте химдиктант.рф.
- Устойчивое интернет-соединение и устройство для выхода в интернет.
Важно!
Приступить к выполнению заданий можно в промежуток с 00:00 14 мая до 23:59 15 мая 2022 года по московскому времени.

- 45 минут свободного времени на выполнение заданий.
Очное участие
Участвуйте очно, выбрав ближайшую к вам официальную площадку химического диктанта.
Важно для очных участников!
Химдиктант состоится 14 мая в 13:00 по местному времени. Обязательно пройдите регистрацию очного участника на сайте химдиктант.рф
Центральная очная площадка в Москве — Химический факультет МГУ имени М. В. Ломоносова.
Посмотреть все очные площадки
Я участвую от школы
Если вас пригласил учитель то, прежде чем вы начнёте диктант, пройдите регистрацию на сайте. Для этого воспользуйтесь ссылкой, которую вам передал педагог для прикрепления к вашему классу.
Если вы педагог/представитель школы, изучите инструкцию, как принять участие в диктанте от школы или со своими учениками.
Важно! Если вы участвуете с вашими учениками:
- Пройдите регистрацию на сайте в роли педагога.

Откройте официальную площадку химического диктанта
в школе, институте, библиотеке…
Это просто. Выберите удобный вам формат участия и пройдите регистрацию
Заявить очную площадку
Важно для очных площадок!
Чтобы открыть очную площадку химдиктанта, вам необходимо быть готовым принять в аудиториях от 100 участников единовременно, обеспечить их регистрацию, рассадку и внесение результатов.
- Ознакомьтесь с инструкцией для очных площадок.
- Зарегистрируйтесь на сайте химдиктант.рф
- Заполните форму регистрации и отправьте её на адрес [email protected] с темой «Заявка на открытие очной площадки».
- Дождитесь подтверждения вашей площадки организатором.
Центральная очная площадка в Москве — Химический факультет МГУ имени М. В. Ломоносова.
В. Ломоносова.
Посмотреть все очные площадки
Открыть онлайн-площадку
Важно для онлайн-участия площадки!
Зарегистрируйте свою онлайн-площадку и прикрепляйте к ней участников. Диктант доступен к выполнению с 00:00 14 мая до 23:59 15 мая 2022 года по московскому времени.
- Ознакомьтесь с инструкцией для онлайн-площадок.
- Пройдите регистрацию онлайн-площадки на сайте химдиктант.рф.
- В личном кабинете площадки скопируйте ссылку для регистрации ваших участников и пригласите желающих на диктант.
- Организуйте проведение химдиктанта.
Вопросы и ответы
Кто может принять участие в диктанте?
Для участия в Химдиктанте не требуется специальная углублённая подготовка. Принять участие в диктанте могут школьники начиная с 5 класса. Вопросы диктанта содержат задания разного уровня сложности. Ознакомьтесь с вариантами диктанта прошлых лет. Мы уверены, участие в акции принесёт вам только положительные эмоции и позволит посмотреть на химию с новой стороны.
Как зарегистрировать класс?
Проведите Химдиктант в своём классе. Для этого вам и вашим ученикам необходимо пройти регистрацию на сайте. Чтобы вы видели своих учеников и их результаты в вашем личном кабинете, обязательно прикрепите учеников к вашему классу, для этого скопируйте ссылку-регистрации (она расположена на первой странице личного кабинета у учителя) и передайте её детям для регистрации. Мы рекомендуем проводить диктант для учеников начиная с 5 класса. Онлайн-диктант доступен для прохождения в промежуток с 00:00 часов 14 мая по 23:59 15 мая 2022 года. Все участники получат именные сертификаты, а педагоги благодарности.
Для чего необходимо проходить регистрацию?
Очным участникам регистрация необходима для получения персонального номера. Его вы укажете на бланке диктанта в аудитории. После обработки ваших результатов, площадка сможет внести данные на сайт, а вы получите свой результат и именной сертификат участника мероприятия.
Как стать официальной площадкой проведения Химдиктанта 2022?
Регистрация площадок возможна самостоятельно для всех организаций, желающих принять участие в образовательной акции. Регистрация онлайн-площадок возможна автоматически на сайте, регистрация очных площадок возможна через подачу заявки для согласования организаторами акции. Следуйте инструкциям для очных площадок, для онлайн-площадок.
Хотим стать очной площадкой. Это возможно?
Если вы хотите выступить очной площадкой и готовы обеспечить вместимость и рассадку от 100 человек в своих аудиториях, вам необходимо:
1. Ознакомиться с инструкцией для очных площадок.
Ознакомиться с инструкцией для очных площадок.
2. Убедиться, что вы сможете выполнить все условия. Согласовать с руководством университета/библиотеки/школы возможность проведение диктанта.
3. Заполнить форму и прислать её на адрес: [email protected] с темой «Химдиктант 2022. Заявка на открытие очной площадки»
Будем рады видеть вас в числе официальных очных площадок химического диктанта в 2022 году! С уважением, команда химического диктанта.
Как узнать свой результат?
Для онлайн-участников результат диктанта доступен сразу по завершении теста в личном кабинете на сайте Химдиктант.рф. Результат диктанта очного участника отобразится в личном кабинете на сайте начиная с 20 мая 2022 года по мере публикации очными площадками. Чтобы войти в личный кабинет участника, авторизуйтесь на сайте, используя тот же самый логин и пароль, указанные вами при регистрации. Если вы забыли свои логин и пароль, воспользуйтесь функцией восстановления пароля.
Как получить сертификат участника?
Вы приняли участие в Химдиктанте 2022 очно или онлайн.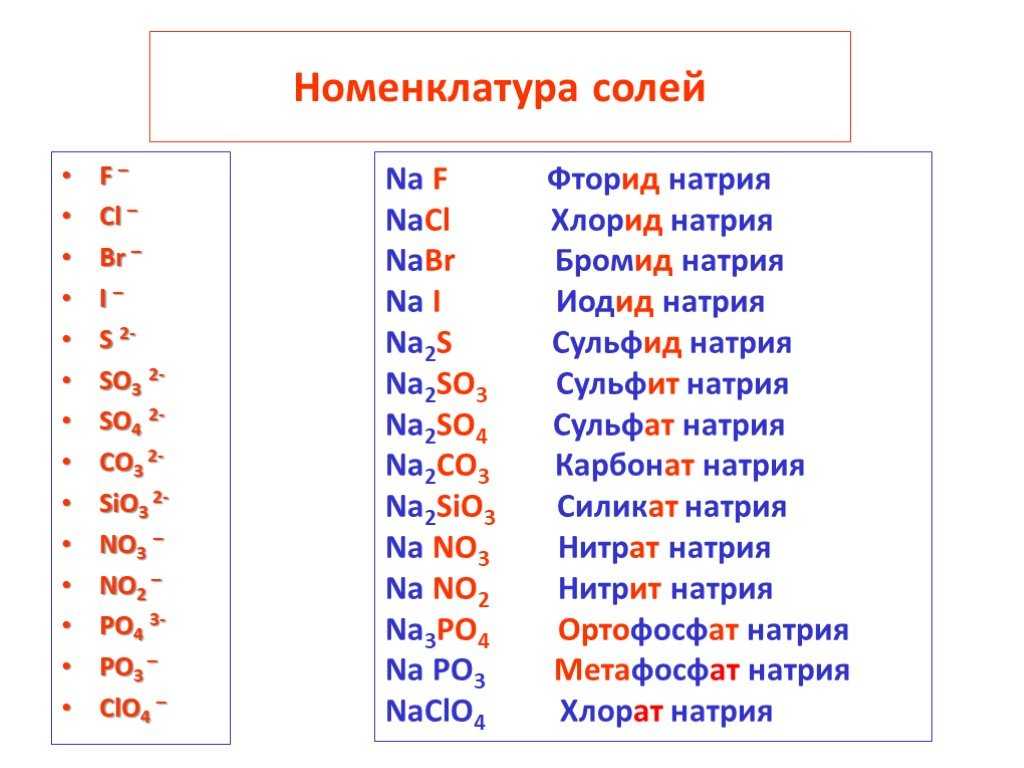 Ваш результат и сертификат участника вы можете скачать в личном кабинете на сайте Химдиктант.рф используя логин и пароль, указанные вами при регистрации. Если вы забыли свои логин и пароль, воспользуйтесь функцией восстановления пароля.
Ваш результат и сертификат участника вы можете скачать в личном кабинете на сайте Химдиктант.рф используя логин и пароль, указанные вами при регистрации. Если вы забыли свои логин и пароль, воспользуйтесь функцией восстановления пароля.
Я прошёл регистрацию как педагог. Смогу ли я принять участие в диктанте?
Да, вы сможете написать химический диктант самостоятельно, а также пригласить учеников. Важно! Чтобы вы видели своих учеников и их результаты в своём личном кабинете, обязательно скопируйте ссылку из вашего личного кабинета для присоединения детей к вашему профилю учителя и попросите ребят пройти регистрацию по вашей ссылке. Чтобы корректно отображались прикреплённые к вашему профилю ученики, используйте один и тот же адрес почты для входа в ваш личный кабинет участника химического диктанта.
Зарегистрировалась как организатор очной площадки, не могу внести результаты своих участников. Что делать?
Чтобы результаты были видны, ученики должны быть зарегистрированы по ссылке от площадки.
Почему организатор в своем личном кабинете видит результаты не всех участников/учеников?
Чтобы результаты были видны, участники/ученики должны быть зарегистрированы по ссылке от площадки/учителя. Ссылка расположена в вашем личном кабинете организатора на сайте.
Есть вопросы о химдиктанте? Пишите на [email protected]
Готовимся к химдиктанту
Купить
Купить
Купить
Купить
Купить
Купить
Купить
Купить
Купить
Купить
Купить
Купить
Купить
Задания прошлых лет
- 2018, вариант 1, PDF
- 2018, вариант 2, PDF
- 2018, ответы вариант 1, PDF
- 2018, ответы вариант 2, PDF
- 2019, вариант 1, PDF
- 2019, вариант 2, PDF
- 2019, ответы вариант 1, PDF
- 2019, ответы вариант 2, PDF
- 2021, вариант 1, PDF
- 2021, вариант 2, PDF
- 2021, ответы вариант 1, PDF
- 2021, ответы вариант 2, PDF
- 2022, вариант 1, PDF
- 2022, вариант 2, PDF
- 2022, ответы вариант 1, PDF
- 2022, ответы вариант 2, PDF
Рекомендуем цифровые ресурсы
Домашние
задания
Интерактивные задания, тесты и контрольные работы с автоматической проверкой
Подробнее
Лаборатория
проектов
Сопровождение проектной деятельности школьников 5‑11 классов
Подробнее
ПРОвоспитание
Комплексное решение для организации системы воспитательной работы в школе
Подробнее
Функциональная грамотность.
Банк заданий
Интерактивные комплексные задания по пяти компонентам функциональной грамотности для учеников 3‑9 классов
Подробнее
Организаторы и партнёры Химдиктанта
Организаторы мероприятия — Химический факультет МГУ им. Ломоносова,
Группа компаний «Просвещение»
и Ассоциация учителей и преподавателей химии
При поддержке
Министерства просвещения Российской Федерации, Министерства науки и высшего образования Российской Федерации, Министерства промышленности и торговли Российской Федерации, Российского союза химиков, Фонда Андрея Мельниченко, Российского химического общества имени Д.И. Менделеева, Российской академии наук, Российской академии образования, Министерства природных ресурсов и экологии Российской Федерации, Министерства здравоохранения Российской Федерации, Федеральной службы по надзору в сфере природопользования, Всероссийской ассоциации естественных наук, ПАО «Транснефть», ООО «ОнкоТаргет», ООО «Компания Бентонит»
Расскажите о Химдиктанте
Расскажите о Химдиктанте друзьям, коллегам и ученикам — мы ждём всех, кто интересуется наукой и твёрдо знает, что химия повсюду!
Всероссийский химический диктант — лауреат II степени всероссийской премии «Золотой медвежонок» в номинации «Социальный маркетинговый проект года»
Реакционная способность металлов и полууравнения
Реакционная способность металлов и полууравнения – VCE ChemistryХимия ВКЭ
. РЕАКЦИОННАЯ СПОСОБНОСТЬ МЕТАЛЛОВ
РЕАКЦИОННАЯ СПОСОБНОСТЬ МЕТАЛЛОВ
• Когда магний помещают в раствор сульфата меди, происходит
реакция, в результате которой на магнии образуется металлическая медь, и темно-синий цвет раствора бледнеет.
• Уравнение:
Mg (тв.) + CuSO4 (водн.) → Cu (тв.) + MgSO4 (водн.)
• Если поместить медную полоску в раствор сульфата магния,
не происходит.
•Поэтому можно заключить, что магний более реакционноспособен, чем медь.
•Опыт подсказывает нам, что разные металлы по-разному реагируют с другими веществами.
•Например,
настолько реакционноспособен, что
встречается в природе как соединение, а не как чистый металл.
•
, с другой стороны, очень
нереактивный . Встречается в природе как чистый элемент
Встречается в природе как чистый элемент
Калий и золото противоположны ряду реактивности металлов
(также называемому рядом активности).
•
: Реакция между металлическим магнием и раствором сульфата меди.
•
:
Mg (тв.) + CuSO4 (водн.) → Cu (тв.) + MgSO4 (водн.) Cu 2+ (водн.) → Cu (тв.) + Mg 2+ (водн.)
Ряд реакционной способности металлов
Полууравнения
• Полууравнения полезны для понимания процессов, происходящих в окислительно-восстановительной реакции.
•Хотя
происходят одновременно, две реакции можно записать отдельно .
• Два реагента (окислитель и восстановитель) имеют свои полууравнения.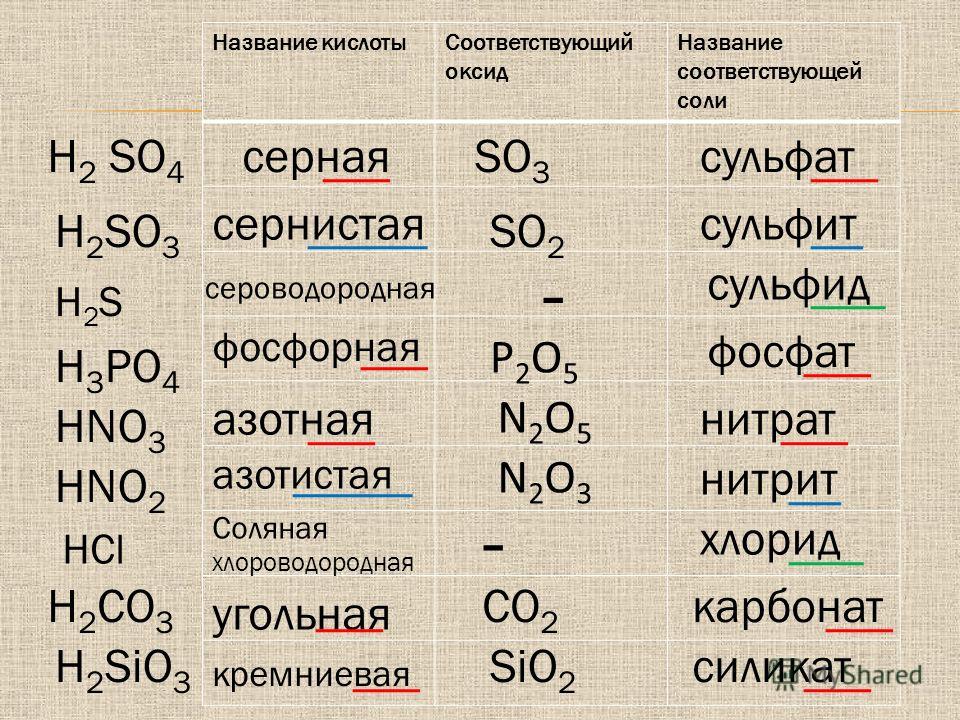
•
: Реакция между металлическим магнием и раствором сульфата меди. 9Уравнение ионов (s) → Mg 2+ (водн.) + 2e-
• Полууравнение восстановления :
Cu 2+ (водн.) + 2e- → Cu (s)
• Сопряженная окислительно-восстановительная пара состоит из двух компонентов (
), которые отличаются количеством электронов, перешедших от окислителя к восстановителю в ходе химической реакции.
• Сопряженные окислительно-восстановительные пары записываются как:
окислитель / восстановитель
• Например: Mg 2+ / Mg; Cu 2+ / Cu
• Электрохимический ряд металлов ранжирует металлы в порядке их реакционной способности.
• Наиболее активные металлы находятся в нижней части таблицы, так как они легче теряют электроны.
• Наиболее активные металлы являются сильнейшими восстановителями.
•Полууравнения записываются в том направлении, в котором происходит приведение.
•Двойная стрелка (↔ ) используется для обозначения того, что реакция может протекать в обоих направлениях.
•Окислители слева.
•Восстановители справа.
•Самые сильные окислители указаны вверху слева в таблице.
Схема электрохимического ряда предоставлена Tem5psu (собственная работа) [CC BY-SA 3.0 (http://creativecommons.org/licenses/by-sa/3.0)], через Wikimedia Commons
Использование электрохимических рядов для предсказания окислительно-восстановительных реакций.
•Для окислительно-восстановительной реакции
вам понадобится окислитель
(левая сторона таблицы) и
восстановитель (правая часть таблицы).
•Для самопроизвольной реакции окислитель должен быть выше восстановителя в таблице.
•
: Металлический натрий (Na), добавленный к раствору нитрата свинца (Pb(NO3)2).
1. Посмотрите на Электрохимическую серию.
2.Pb 2+ – окислитель, Na – восстановитель.
3.Pb 2+ в таблице выше Na.
4. Произойдет спонтанная окислительно-восстановительная реакция.
5. Ионное уравнение:
2Na (тв.) + Pb 2+ (водн.) → Pb (тв.) + 2Na + (водн.)
восстановитель окислитель восстановитель окислитель
• Пример 2 : Металлическое олово (Sn), добавленное к раствору нитрата алюминия (Al(NO3)3).
1. Посмотрите на Электрохимическую серию.
2.Al 3+ – окислитель, Sn – восстановитель.
3.Al 3+ ниже Sn по таблице.
4. Самопроизвольной окислительно-восстановительной реакции не произойдет (нет реакции).
Подробнее о спонтанных окислительно-восстановительных реакциях | Викторина о окислительно-восстановительных реакциях |
Kahoot quiz – серия реактивности и окислительно-восстановительный потенциал
youtube.com/embed/UqxIsiN8do0″ frameborder=”0″ allowfullscreen=””>Именование соединений – Общая химия
Именование соединений – Общая химияИменование соединений — общая химия
Используйте следующие рабочие листы, чтобы научиться называть соединения и писать формулы. Если дана формула, запишите имя, а если имя дано, напишите вниз по формуле. Используйте эти страницы в качестве учебного пособия.
Как правило, вы должны знать имена и символы для элементов 1-36. Кроме того, вы должны знать имена и символы для всех элементы групп I и II, а также галогены (группа VII), благородные газы (Группа VIII) и некоторые другие часто используемые металлы. Эти металлы включают Ag (серебро), Au (золото), Pb (свинец), Sn (олово) и Cd (кадмий).
- Названия бинарных ионных соединений типа I — группа I, II, III (только Al) ионы металлов с ионами неметаллов
- Имена бинарных ионных соединений типа II — переход ионы металлов (плюс металлы групп III, IV, V, VI) с ионами неметаллов
- Названия бинарных ковалентных соединений типа III – неметаллы атомы с атомами неметаллов (ковалентные соединения)
- Общие названия кислот и анионов
- Рабочий лист №1
- Рабочий лист № 2
- Рабочий лист №3
Называя соединения, помните следующие правила:
Бинарные ионные соединения (тип I)
- Катион (положительно заряженный ион; Na +, Al 3+ ) представляет собой
всегда называют первым и анион (отрицательно заряженный ион; Cl –, O 2-)
второй.

- Одноатомный (то есть одноатомный) катион получил свое название от названия элемент. Например, Na + называется натрием в названиях соединения, содержащие этот ион.
- Одноатомный анион называют, беря корень имени элемента и добавляя -иде . Так, ион Cl – называется хлоридом, ион S 2- ион называется сульфидом, а ион O 2- — оксидом.
Бинарные ионные соединения (тип II)
- Катион переходного металла всегда называют первым (как и любой катион) и анион второй.
- Одноатомный (то есть одноатомный) катион получил свое название от названия элемент. Например, Cu + называется Медь(I), а Cu 2+ называется Медь(II) по названиям соединений, содержащих эти ионы. в скобках указан заряд катиона.
- Все катионы переходных металлов , кроме Zn 2+ , Cd 2+ ,
и Ag + (у которых всегда имеют показанные здесь заряды), должен показывать степень окисления (заряда) в скобках после
Английское написание элемента, например Iron(III), Copper(I) или
Ванадий(V), всякий раз, когда соединение, содержащее эти ионы, которые имеют несколько
обвинения, именуется.

- Для катионов групп IIIA-VIA (включая Sn, Pb, Ga, Bi и др.) также имеют несколько зарядов, даже если они не являются переходными металлами. Для всех металлы этих групп (кроме Al, который, конечно, всегда имеет заряд +3), включите скобки после имени и покажите его положительный заряд в виде римской цифры (Pb 2+ – свинец (II) в именах)
Бинарные ковалентные соединения (тип III)
Соединения, содержащие только неметаллические элементы, называются с использованием двоичного кода типа III. составные правила. Эти соединения всегда нейтральны (не ионы, имеющие заряды) и состоят только из двух элементов (см. названия кислот ниже для соединений содержащие только неметаллические элементы, но содержащие более двух элементов. прототипом соединения является CO 2 , который называется двуокисью углерода.
- Первый элемент, показанный в соединении, называется элементом (например, для CO 2 , первый элемент — «углерод»)
- Второй элемент, показанный в соединении, назван в соответствии с анионом.
 имя, оканчивающееся на -ide (например, для CO 2 второй элемент
название «оксид»)
имя, оканчивающееся на -ide (например, для CO 2 второй элемент
название «оксид») - Второй элемент всегда имеет префикс, указывающий, сколько раз он присутствует в соединении (например, для CO 2 , второй элемент (оксид) присутствует дважды, поэтому он имеет префикс «ди»)
- Количество первого элемента отображается только в том случае, если его присутствует более однажды. Предполагается, что он присутствует только один раз, отсюда и название элемент. Однако, если он присутствует более одного раза, вы должны указать количество повторений (ди, три, тетра и т. д.)
Следующие префиксы используются для указания количества повторений элемента. присутствует в бинарных ковалентных соединениях:
Обратите внимание, что ионные соединения (названия бинарных соединений типа I и II) никогда не используйте префиксы, чтобы указать, сколько раз присутствует элемент. Префиксы только используются для ковалентных соединений, образованных из неметалла.
элементы.
Префиксы только используются для ковалентных соединений, образованных из неметалла.
элементы.
Распространенные названия кислот и анионов
Кислоты представляют собой соединения, содержащие ионизируемый протон (H + ), поскольку
кислота является донором протона (атом водорода, потерявший свой электрон).
многоатомные анионы, полученные из кислот, названы путем опускания -ic (или -ous ) суффикс от названия кислоты и добавление -ate (или -ite ) суффикс соответственно. Соединения, содержащие
многоатомные анионы названы с использованием обозначения Type I или Type II .
системы, описанные выше. Например, натриевая соль азотной кислоты представляет собой натриевую
нитрат (NaNO 3 ). Если вы знаете формулу кислоты, вы всегда будете .
получить правильную формулу аниона и его заряд, так как заряд равен
количество ионизируемых атомов водорода в кислоте и всегда отрицательно.

