Как покрыть медью металл: простой способ в домашних условиях
alexxlab | 05.01.2023 | 0 | Разное
технология покрытия, область применения, покрытие металлов медью способ в домашних условиях
Процесс гальваники металлов и сплавов медью (пластик покрыть невозможно!) получил название меднения (или – реже – омеднения). Слой меди разной толщины не только улучшает внешний вид изделия, но и способствует улучшению целого ряда механических свойств детали, среди которых – пластичность, электропроводимость, коррозионная стойкость. При трении между медьсодержащими поверхностными слоями существенно улучшаются условия скольжения, что препятствует абразивному износу деталей. Наконец, медь обладает антибактериальными свойствами. Одним словом, имеются все предпосылки для широкого применения указанных операций на практике, причём не только в промышленных целях, но и для меднения в домашних условиях.
Тэги:Химико-термическая обработка
Процесс осуществления покрытия
Практическое применение получили два способа – гальванический и электрохимический. Химия обеих процессов по своей основе практически одинакова, только во втором случае в раствор подаётся электрический ток, что интенсифицирует перенос металла на поверхность заготовки.
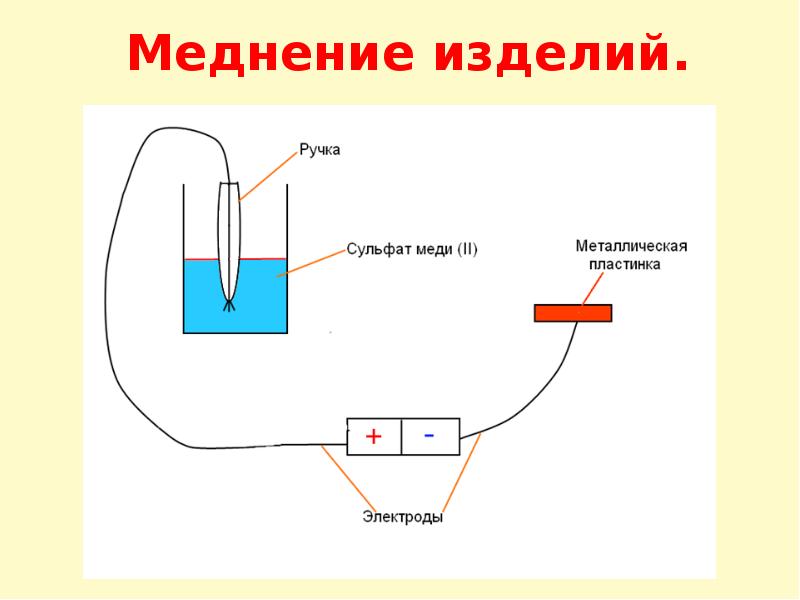
Концепция гальванического покрытия стали медным слоем проста: пластина (или вообще любая токопроводящая деталь) погружается в ванну с электролитом для обработки, и в результате реакции замещения ионы меди будут мигрировать, и осаждаться в областях с уже существующим металлом (см. рис. 1). При меднении используются свойства различной химической активности металлов, открытые ещё в 1793 году Алессандро Вольтой.
Согласно известному ряду химической активности, слева от водорода находятся более химически активные элементы, слева – менее активные. Медь относится ко вторым, поэтому легко образует слой на всех остальных металлах и сплавах, например, вольфраме или чугуне, исключая сурьму, висмут и палладий. Чем больше разница в электрохимических потенциалах, тем активнее происходит обработка в электролите.
Электролит для покрытия медью содержит в своей основе три неорганических компонента:
- Сульфат меди (CuSO4), который является источником ионов.
- Серная кислота (H2SO4) делает раствор токопроводящим и действует как носитель заряда.

- Ионы хлорида (Cl-) объединяются с органическими частицами, образуя комплекс, который замедляет скорость покрытия на отдельных участках детали.
При использовании гальванической технологии в ванну заливают концентрированный раствор медного купороса CuSO4 или хлористой меди CuCl3. Являясь сильными электролитами, они инициируют реакцию замещения и без такого катализатора, которым является постоянный электрический ток.
Преимущество электролиза перед гальваническим вариантом заключается в том, что основными параметрами процесса – скоростью и местом осаждения – можно управлять, изменяя силу тока.В гальваническом способе это можно делать только за счёт увеличения концентрации двухвалентной меди Cu2+ в растворе медного купороса, однако лишь до определённых пределов.
В ванну с электролитом для гальванического покрытия медью обычно добавляют ряд органических веществ, которые позволяют улучшить качество изделия. Например, добавка Chemeta RV (блескообразователя) способствует улучшению внешнего вида металлической поверхности (практически до уровня чистой меди), растворимые соли палладия увеличивают проводимость и т. п.
п.
Используемые добавки могут не только ускорять, но и замедлять процесс. Ускорители образуют электрически активные частицы, ответственные за повышенную скорость покрытия, а подавители объединяются с ионами хлорида, чтобы ингибировать образование покрытия на участках, где желательна сниженная скорость покрытия. Ряд добавок предназначены для улучшения смачиваемости поверхности детали. Особую роль играют выравнивающие добавки: они поляризуют области с высокой плотностью тока и выравнивают его распределение, контролируя конечную морфологию поверхности изделия.
Области применения промышленного меднения
В широких масштабах гальваника используется как часть двойной системы благодаря совместимости процесса с дополнительными операциями. Подобный подход позволяет использовать преимущества двух различных способов поверхностного покрытия, например, одновременного обеспечения высокой износостойкости и коррозионной стойкости стали.
В нефте- и газодобывающих отраслях народного хозяйства меднение применяется как способ предотвращения заедания вращающегося бурового инструмента, особенно в начальный и конечный момент бурения скважины. С этой целью нанесение покрытия производится на такие детали и компоненты, как резьбы, трубы, муфты, штанги.Медь также чрезвычайно эффективна в качестве грунтовочного слоя для других металлов, повышая коррозионную стойкость при эксплуатации в химически агрессивных средах.
С этой целью нанесение покрытия производится на такие детали и компоненты, как резьбы, трубы, муфты, штанги.Медь также чрезвычайно эффективна в качестве грунтовочного слоя для других металлов, повышая коррозионную стойкость при эксплуатации в химически агрессивных средах.
В электронной промышленности используется такое свойство меди как высокая тепло- и электропроводность (по данным показателям медь уступает только серебру). Немногие металлы могут сравниться с медью и по эффективности передачи электрических импульсов. Поэтому некоторые ответственные катушки индуктивности с внутренней стороны покрываются слоем меди, как это показано на рис. 3.
В полупроводниковой отрасли при производстве печатных плат, описываемое гальванопокрытие ю используется в нескольких важных приложениях, среди которых следует выделить получение сквозных кремниевых переходных отверстий и медных подложек фоторезисторов. В последнем случае, например, опорные пластины имеют затравочный слой меди только в нижней части, а сверху наносится фоторезистивный слой. Подавитель смачивает этот слой, а выравниватель вводится в переходное отверстие. И выравниватель, и подавитель являются поляризующими агентами, которые помогают контролировать однородность покрытия на различных кристаллах и пластинах.Ускоритель действует как измельчитель зёрен меди, образуя на опоре фоторезистора гладкую блестящую поверхность. Гальваника процесса представлена на рис. 4.
Подавитель смачивает этот слой, а выравниватель вводится в переходное отверстие. И выравниватель, и подавитель являются поляризующими агентами, которые помогают контролировать однородность покрытия на различных кристаллах и пластинах.Ускоритель действует как измельчитель зёрен меди, образуя на опоре фоторезистора гладкую блестящую поверхность. Гальваника процесса представлена на рис. 4.
Важной областью применения данного процесса в машиностроении является получение искробезопасных инструментов. Они обладают низким уровнем нагрева, снижая тем самым риск возникновения искры. Такие инструменты применяются при монтажных работах в присутствии сероуглерода – газа, имеющего самую низкую температуру воспламенения среди всех известных человеку веществ.
Искробезопасные инструменты обеспечивают защиту от пожаров и взрывов в условиях, когда существует опасность возгорания легковоспламеняющихся растворителей, паров, жидкостей, пыли или остатков от искр.
Обычно используемые ручные монтажные инструменты часто изготавливаются из обычной или нержавеющей стали, поскольку «неискрящие» металлы имеют меньшую прочность. Следовательно, они мягче, изнашиваются быстрее, и их нужно чаще затачивать. Из подобных соображений поверхность такой оснастки и подвергают меднению (см. рис. 5).
Следовательно, они мягче, изнашиваются быстрее, и их нужно чаще затачивать. Из подобных соображений поверхность такой оснастки и подвергают меднению (см. рис. 5).
Специфической сферой меднения – для декоративных целей – является строительство и архитектура. Например, сделать медную кровлю из листового металла – весьма дорогое удовольствие, поэтому во многих случаях ограничиваются получение поверхностного слоя из меди.
Инвестирование в медную кровлю увеличивает стоимость жилья, поскольку покрытие приобретает привлекательный внешний вид и хорошо сопротивляется внешним факторам, ускоряющим ржавление обычной стали. То же касается покрытия металлом перил, кованых решёток и других элементов внешнего и внутреннего декора помещений.
Меднение в домашних условиях
Доступность процесса своими руками обуславливает повсеместное применение такого простого способа поверхностной защиты железа. Процесс использует пропускание электрического тока через раствор электролита (например, медного купороса), что позволяет переносить ионы металлов из металла-донора к металлу-реципиенту. Данный гальванический процесс можно выполнять и дома, но надо учесть, что покрытие в соляной кислоте требует соблюдения более тщательных мер предосторожности, чем покрытие электролитом с ионами металлов. В частности, при работе с кислотой следует использовать средства индивидуальной защиты: перчатки, очки и фартук. Очень важна также хорошая вентиляция помещения, в котором вы будете работать.
Данный гальванический процесс можно выполнять и дома, но надо учесть, что покрытие в соляной кислоте требует соблюдения более тщательных мер предосторожности, чем покрытие электролитом с ионами металлов. В частности, при работе с кислотой следует использовать средства индивидуальной защиты: перчатки, очки и фартук. Очень важна также хорошая вентиляция помещения, в котором вы будете работать.
Получение медьсодержащего покрытия своими руками выполняется в ходе реализации следующих этапов:
- Подготовки необходимых материалов и составляющих – воды, соляной кислоты, 6-вольтовой батареи постоянного тока, двух зажимов типа «крокодил», медной пластины (или проволоки), металлического предмета, который вы хотите покрывать медью, и контейнера (см. рис. 6), достаточно большого для того, чтобы полностью разместить этот предмет в растворе электролита.
- Подготовки необходимого защитного снаряжения.
- Тщательного обезжиривания детали, для чего лучше использовать обычное средство для мытья посуды, а затем протереть предмет абразивным кислотным составом.
 Можно использовать смесь уксуса и пищевой соды (см. рис. 7).
Можно использовать смесь уксуса и пищевой соды (см. рис. 7). - Подготовить рабочий раствор: смешать в пропорции 5 частей воды с 1 частью соляной кислоты. Никогда не добавляйте воду непосредственно в кислоту! Снаружи контейнер станет тёплым, потому что в случае добавления кислоты в воду происходит экзотермическая реакция. Перемешивать раствор лучше стеклянной или пластиковой мешалкой, потому что кислота разлагает металл.
- Присоединить каждый из зажимов к клеммам источника питания. Полярность на данном этапе значения не имеет (см. рис.8).
- Подсоедините медь к положительной клемме и с помощью зажима типа «крокодил» прикрепите ПОЛОЖИТЕЛЬНЫЙ полюс батареи к медному проводу. На стандартной 6-вольтовой батарее положительный полюс — это штекер батареи. Подсоедините металлическую деталь, подлежащую покрытию, к ОТРИЦАТЕЛЬНОЙ клемме, а затем – к металлу, который вы собираетесь покрыть медью. Дважды проверьте правильность подключения клемм и погрузите сборку в раствор с электролитом.
 Медная деталь не должна полностью погружаться в состав (см. рис.9). Во время гальванизации следует непрерывно перемешивать раствор стеклянной или деревянной палочкой, чтобы получить равномерный слой. Обе металлические части следует располагать на расстоянии не менее 30 мм друг от друга, чтобы избежать неравномерного отложения металла на поверхности.
Медная деталь не должна полностью погружаться в состав (см. рис.9). Во время гальванизации следует непрерывно перемешивать раствор стеклянной или деревянной палочкой, чтобы получить равномерный слой. Обе металлические части следует располагать на расстоянии не менее 30 мм друг от друга, чтобы избежать неравномерного отложения металла на поверхности. - После достижения требуемого результата отключить клеммы от батареи и извлечь сборку из раствора, положив её на чистую тряпку для просушки.
Заключение
Качественно сформированное медное покрытие улучшает следующие характеристики изделия:
- Повышает электропроводность.
- Улучшает пластичность.
- Позволяет увеличить адгезию, что может быть полезным для последующего дополнительного покрытия, например, краской.
- Повышает коррозионную стойкость.
Меднение является также и весьма экономичным процессом, поскольку медь дешевле и доступнее, чем благородные металлы – платина, золото или серебро.
Как покрыть медью металл в домашних условиях?
- Для чего это нужно?
- Сферы использования гальваностегии
- Гальваностегия электролитным раствором
- Гальваностегия другим способом
- Видеоматериал
Для того чтобы подготовить металлический предмет к дальнейшей обработке, его нужно покрыть медью — такой процесс называют гальваностегией. Принцип его действия заключается в осаждении на поверхность обрабатываемой детали из другого металла, который растворен подходящим средством. Из данной статьи вы узнаете, как покрыть медью металл в домашних условиях, чтобы реализовать все последующие свои задумки с заготовкой.
к содержанию ↑
Для чего это нужно?
Технология гальваностегии включает в себя создание раствора и образование различных электродов. Во время этого процесса медные ионы, которые растворены в электролите, притягиваются минусовым полюсом обрабатываемой детали на свою поверхностную точку.
Гальваностегия металлических деталей в промышленности применяется не только как завершающий обрабатывающий процесс. Она может применяться для того, чтобы подготовить детали к последующей операции (к примеру, хромированию, никелированию, серебрению каких-либо предметов).
В домашних условиях чаще всего проводится химическое меднение деталей. Также стоит заметить, что есть множество способов проведения такой процедуры, каждый из которых имеет свои преимущества и недостатки.
к содержанию ↑
Сферы использования гальваностегии
Покрывать медью металл в домашних условиях в последнее время стало очень полезно. Чаще всего к такой процедуре подходят в следующих целях:
- В декоративных. Например, таким способом состаривают различные детали для того, чтобы придать винтажный вид.
- В гальванопластике. Очень часто наносят медный слой на сувениры, ювелирные украшения.
- В отрасли техники. Это связано с низкой стоимостью омеднения.

- Для нанесения защитно-декоративной прослойки того или иного изделия.
- Для того чтобы реставрировать или восстанавливать какие-либо детали.
к содержанию ↑
Гальваностегия электролитным раствором
Таким способом можно покрыть медью сталь в домашних условиях, а также другие детали за исключением алюминия и цинка.
Для дальнейшей процедуры необходимо подготовить следующие материалы:
- Небольшие пластины из меди.
- Токопроводящая проволока (лучше запастись несколькими метрами).
- Источник тока, напряжение которого не должно быть более, чем 6 В.
- Реостат, чтобы регулировать ток.
- Амперметр.
- Электролит.
Важно! Последний компонент можно приобрести в специальном магазине, а можно и изготовить самостоятельно. Для этого нужно сделать раствор серной кислоты и дистиллированной воды при соотношении 2/100 мл. Нужный раствор получится, когда вы добавите к составу не больше 20 г медного купороса.

Суть работы заключается в следующем:
- Очистить обрабатываемую деталь наждачной бумагой — это нужно для того, чтобы снять оксидную пленку. Далее покрыть медью металл в домашних условиях будет не так трудно.
- Обезжирить металлическим предмет горячим раствором соды, промыть его чистой водой.
- В подходящую по объему емкость из стекла налить приготовленный электролит.
- Опустить в жидкость две пластины из меди на подготовленных токопроводящих проводках. Между двумя пластинками из меди подвешивается уже обезжиренная деталь на таком же проводке.
Важно! Проследите за тем, чтобы пластины из меди были полность погружены в электролит.
- Далее концы проводов от пластин из меди присоединяются к положительной клемме источника тока, а деталь — к отрицательной. Далее в созданную электросеть нужно подключить амперметр с реостатом. После того, как ток подключится к цепи, реостатом нужно установить его примерно 15 мА на 1 см площади детальной поверхности.

- Далее деталь выдерживается примерно 15-20 минут.
- По истечении времени нужно отключить электропитание и вытащить обрабатываемый металл из раствора.
В конечном итоге вы заметите, что смогли покрыть медью металл в домашних условиях, ведь он полностью покроется тонкой блестящей пленкой.
Важно! Толщина медного слоя будет зависеть от того, как долго была выдержана деталь в электролите.
к содержанию ↑
Гальваностегия другим способом
Данный способ отлично подойдет для металлов-исключений, что были названы ранее — цинка и алюминия.
Алгоритм работы:
- Вооружиться многожильным проводом из меди, снять изоляцию с обоих его концов.
- Растеребить мягкий провод с одной стороны, получив имитированную кисточку. Привязать к этому концу предмет, похожий на рукоятку.
- Противоположную сторону провода необходимо соединить к плюсовой клемме источника электротока.

Важно! Напряжение должно быть не более, чем 6 В.
- Подготовить электролит описанным выше способом, вылить его в широкую тару — это нужно для удобства макания туда “кисточки”.
- Положить внутрь подготовленной емкости небольшую деталь из металла. Соединить ее, используя при этом провод, к отрицательной клемме токового источника также с напряжением 6 В.
Важно! Деталь должна быть предварительно очищена и обезжирена.
- Процесс покрытия алюминия медью в домашних условиях заключается в следующем: кистообразный конец провода нужно промакивать электролитным раствором и проводить им по поверхности обрабатываемого металлического предмета, не касаясь его. Дальше — отрицательно заряженный металл притянет к себе медные ионы и ее поверхность приобретет медную пленку.
Важно! Следите за тем, чтобы между концом растеребленной проволоки и металла был маленький слой электролитного раствора (и катод, и анод обязательно должны быть смочены этим раствором).

- После того, как деталь приобретет нужный цвет, ее нужно тщательно высушить, после чего натереть до блеска.
к содержанию ↑
Видеоматериал
youtube.com/embed/51GucXrZUp8?feature=oembed” frameborder=”0″ allow=”autoplay; encrypted-media” allowfullscreen=””>Покрыть тонкой медной пленкой можно практически каждую металлическую деталь, при этом она будет отлично защищена от нежелательных внешних факторов. О том, как покрыть медью металл самостоятельно, условиях вы узнали из данной статьи, и теперь сможете все сделать как положено.
21.12A: Металлическая медь — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 34468
- Роберт Дж.
 Ланкашир
Ланкашир - Университет Вест-Индии в Моне
Информацию об истории меди можно найти в Ассоциации развития меди, Inc., где отмечается, что: «В течение почти 5000 лет медь была единственным металлом, известным человеку. металлы». Люди впервые использовали медь около 10 000 лет назад. Считается, что медный кулон, обнаруженный в Северном Ираке, датируется примерно 8700 годом до нашей эры. Доисторический человек, вероятно, использовал медь для изготовления оружия. Древние египтяне, похоже, тоже ценили коррозионную стойкость металла. Они использовали медные ленты и гвозди в судостроении, а медные трубы использовались для транспортировки воды. Некоторые из этих артефактов сохранились до наших дней в хорошем состоянии. По оценкам, общий объем производства меди в Египте за 1500 лет составляет 10 000 тонн.
Спустя годы появились медные сплавы. Сначала появились бронзы (сплавы меди и олова), а гораздо позже — латуни (сплавы меди и цинка). В «бронзовом веке» медь и бронза широко использовались для изготовления оружия, монет, домашней утвари, мебели и других предметов. Самым ранним известным примером использования латуни является римская монета, отчеканенная во время правления Августа с 27 г. до н.э. по 14 г. н.э. Позже медь сыграла важную роль в появлении электричества и сегодня по-прежнему остается одним из самых ценных материалов.
Самым ранним известным примером использования латуни является римская монета, отчеканенная во время правления Августа с 27 г. до н.э. по 14 г. н.э. Позже медь сыграла важную роль в появлении электричества и сегодня по-прежнему остается одним из самых ценных материалов.
Использование соединений меди также восходит к периоду до 4000 г. до н.э. Сульфат меди, например, был особенно важным соединением в ранние времена. Древние египтяне использовали его в качестве протравы в процессе окрашивания. Соединение также использовалось для изготовления мазей и других подобных препаратов. Позже медный купорос стал применяться в лечебных целях с его назначением при легочных заболеваниях. Сульфат меди по-прежнему широко используется сегодня, и о вредных побочных эффектах его применения не сообщалось.
Возникновение
Медь является 25-м -м -м наиболее распространенным элементом Земли, но одним из менее распространенных переходных металлов первого ряда. Он встречается в виде мягкого красноватого металла, который можно найти в виде больших валунов весом в несколько сотен тонн или в виде сульфидных руд. Последние представляют собой сложные смеси меди, железа и серы в сочетании с другими металлами, такими как мышьяк, цинк и серебро. Концентрация меди в таких рудах обычно составляет 0,5-2%.
Последние представляют собой сложные смеси меди, железа и серы в сочетании с другими металлами, такими как мышьяк, цинк и серебро. Концентрация меди в таких рудах обычно составляет 0,5-2%.
Самая распространенная руда — халькопирит, CuFeS 2 , медно-желтая руда, на долю которой приходится примерно 50% мировых месторождений меди. Существует множество других медных руд разного цвета и состава. Примерами являются малахит Cu 2 CO 3 (OH) 2 , ярко-зеленая руда и красный рудный куприт Cu 2 O.
Медь встречается в биологических системах как часть простетической группы. определенных белков. Примеры белков, содержащих медь, см. в статье Университета Лидса, факультета биохимии и молекулярной биологии Института Скриппса. Красный пигмент мягкоклювой птицы T(o)uraco содержит медно-порфириновый комплекс. Пигмент хорошо растворяется в воде в щелочных условиях, о чем сообщалось в 1952, попытки работников зоопарка помыть птицу привели к тому, что вода окрасилась в красный цвет. Говорят, что Т(о)урако — единственные птицы, обладающие настоящим красным и зеленым цветом. Как правило, цвет, который вы воспринимаете, наблюдая за птицами, обусловлен отражениями, создаваемыми структурой пера. Красный и зеленый пигменты (турацин и тураковердин), содержащиеся в перьях Т(о)урако, содержат медь.
Говорят, что Т(о)урако — единственные птицы, обладающие настоящим красным и зеленым цветом. Как правило, цвет, который вы воспринимаете, наблюдая за птицами, обусловлен отражениями, создаваемыми структурой пера. Красный и зеленый пигменты (турацин и тураковердин), содержащиеся в перьях Т(о)урако, содержат медь.
Добыча меди
Медь извлекается из руды двумя основными способами:
- Пирометаллургический метод
- Гидрометаллургический метод
Пирометаллургический метод
Этот метод часто используется при добыче сульфидных руд. Существует четыре основных этапа:
- Добыча и измельчение: руда дробится и измельчается в порошок, обычно содержащий менее 1% меди. Минералы концентрируются в суспензию, содержащую около 15% меди. Минералы меди отделяют от бесполезного материала флотацией с использованием пенообразующих растворов.
- Плавка: Плавка медного концентрата и экстракция путем нагревания, флюса и добавления кислорода.
 Сера, железо и другие нежелательные элементы удаляются, и продукт называется черновой медью.
Сера, железо и другие нежелательные элементы удаляются, и продукт называется черновой медью. - Рафинирование: это заключительный этап процесса получения высококачественной меди. Используются методы огневого и электрорафинирования. Последний производит медь высокой чистоты, пригодную для использования в электротехнике.
Гидрометаллургический метод -SX/EW
Экстракция растворителем/Электровыделение является наиболее распространенным процессом выщелачивания, используемым в настоящее время для извлечения меди из химических растворов. Как следует из названия, метод включает в себя два основных этапа:
- Экстракция растворителем – процесс, при котором ионы меди выщелачиваются или иным образом извлекаются из сырой руды с использованием химических реагентов.
- Электровыделение – электролиз раствора, содержащего ионы металла, при котором ионы меди в нем осаждаются на катоде, а затем удаляются в виде элемента.
Процесс происходит в следующие этапы:
- Выщелачивающий раствор (выщелачивающий раствор) выбирают для выщелачивания ионов Cu из руды.
 Обычными реагентами являются слабые кислоты, т.е. Н 2 SO 4 , H 2 SO 4 + Fe 2 (SO 4 ) 3 , кислые растворы хлоридов, например FeCl 2 , композиции хлорида аммония и соли аммония.
Обычными реагентами являются слабые кислоты, т.е. Н 2 SO 4 , H 2 SO 4 + Fe 2 (SO 4 ) 3 , кислые растворы хлоридов, например FeCl 2 , композиции хлорида аммония и соли аммония. - При нанесении на руду выбранный выщелачиватель растворяет присутствующие ионы меди с образованием выщелачивающего продукта, называемого «содержащим выщелачивающим раствором».
- Затем выбирают органический экстрагент для удаления ионов меди из водного раствора. Предпочтительные органические экстрагенты состоят из гидроксифенилоксимов, имеющих основную химическую формулу:
- C 6 H 3 (R)(OH) CNOHR*, R= C 9 H 19 или C 12 H 25 и R* или C, CH 3 6 Н 5
Примерами таких экстрагентов являются 5-нонилсалицилальдоксим и смесь этого соединения и 2-гидрокси-5-нонилацетофеноноксима. Имеющиеся в продаже реагенты обычно содержат 5-10% оксима в 90-95%-ном нефтяном разбавителе, таком как керосин.
Имеющиеся в продаже реагенты обычно содержат 5-10% оксима в 90-95%-ном нефтяном разбавителе, таком как керосин.
Перед смешиванием с выщелачивающим продуктом экстрагент будет содержать мало меди или совсем не содержать ее и на данном этапе называется «бесплодным органическим экстрагентом».
- Ионы меди переходят из выщелачивающего раствора в органический экстрагент при смешивании двух реагентов. Происходит разделение фаз с получением водной и органической фаз, называемых соответственно первой водной и первой органической фазами. Первая водная фаза, «рафинат», представляет собой выщелачиватель, лишенный ионов меди, в то время как первая органическая фаза представляет собой «загруженный органический экстрагент», т.е. экстрагент с присутствующими ионами меди.
- Рафинат рециркулируется на площадку выщелачивания, в то время как загруженный органический экстрагент смешивается с раствором электролита, называемым «тощим электролитом» (т.е. не содержащим меди).
 Типичными электролитами являются кислые растворы, такие как серная кислота, H 2 СО 4 . Таким образом, ионы меди, которые присутствовали в органическом экстрагенте, растворяются в растворе электролита, образуя медьсодержащий «богатый электролит». Здесь снова происходит фазовое разделение. Вторая органическая фаза представляет собой обедненный органический экстрагент, тогда как вторая водная фаза представляет собой «богатый электролит». Бесплодный органический экстрагент затем рециркулируют для повторного использования при применении к выщелачивающему продукту.
Типичными электролитами являются кислые растворы, такие как серная кислота, H 2 СО 4 . Таким образом, ионы меди, которые присутствовали в органическом экстрагенте, растворяются в растворе электролита, образуя медьсодержащий «богатый электролит». Здесь снова происходит фазовое разделение. Вторая органическая фаза представляет собой обедненный органический экстрагент, тогда как вторая водная фаза представляет собой «богатый электролит». Бесплодный органический экстрагент затем рециркулируют для повторного использования при применении к выщелачивающему продукту. - Заключительной стадией процесса является электролиз кислого раствора ионов металлов. В результате растворенные ионы меди оседают на катоде, а элементарная медь удаляется. Таким образом, процесс восстановления завершен.
Примечание о примесях
Присутствие взвешенных загрязняющих веществ в системе SX/EW может значительно снизить эффективность ее работы. Такие загрязнители могут попасть в систему из руды или из окружающей среды. Система восприимчива к загрязнению дождем, ветром и другими факторами окружающей среды, поскольку первая защитная оболочка, в которой хранится выщелачивающий продукт, обычно не накрыта и расположена на открытом воздухе. Таким образом, твердые отходы в виде грязи, песка, каменной пыли, растительных остатков, минеральных остатков и взвешенных веществ часто попадают в систему на ранних стадиях и сохраняются на последующих стадиях процесса.
Система восприимчива к загрязнению дождем, ветром и другими факторами окружающей среды, поскольку первая защитная оболочка, в которой хранится выщелачивающий продукт, обычно не накрыта и расположена на открытом воздухе. Таким образом, твердые отходы в виде грязи, песка, каменной пыли, растительных остатков, минеральных остатков и взвешенных веществ часто попадают в систему на ранних стадиях и сохраняются на последующих стадиях процесса.
Влияние этих загрязняющих веществ значительно и включает:
- увеличение времени разделения фаз на стадиях, когда органические и водные растворители смешиваются. Отсутствие полного разделения фаз после экстракции приводит к потерям дорогостоящего органического экстрагента, так как большая его часть остается в водном растворе.
- снижение выхода по току и снижение чистоты гальванического изделия из меди на стадии электролиза.
В большинстве систем SX/EW для решения этой проблемы введены этапы очистки. В патенте США (номер 573341), например, по меньшей мере часть второй органической фазы фильтруется для удаления твердых загрязняющих примесей перед повторным использованием при обработке выщелачивающего продукта. Таким образом, рециркулируемый органический экстрагент содержит мало или совсем не содержит примесей в зависимости от того, была ли отфильтрована часть второй органической фазы или вся вторая органическая фаза. Было обнаружено, что эта стадия фильтрации значительно повышает эффективность работы, даже когда обрабатывается только часть экстрагента.
В патенте США (номер 573341), например, по меньшей мере часть второй органической фазы фильтруется для удаления твердых загрязняющих примесей перед повторным использованием при обработке выщелачивающего продукта. Таким образом, рециркулируемый органический экстрагент содержит мало или совсем не содержит примесей в зависимости от того, была ли отфильтрована часть второй органической фазы или вся вторая органическая фаза. Было обнаружено, что эта стадия фильтрации значительно повышает эффективность работы, даже когда обрабатывается только часть экстрагента.
Использование меди и ее соединений
Медь на протяжении веков уступает по полезности только железу. Металл и его соединения используются во всех сферах жизни от электротехники до медицины и сельского хозяйства.
Использование металлической меди
Электротехническая промышленность является бенефициаром большей части производства меди в мире. Металл используется в производстве электрических приборов, таких как катоды и провода. Другое использование включает:
Другое использование включает:
- Кровля
- Посуда
- Монеты
- Металлообработка
- Сантехника
- Змеевики для холодильников и кондиционеров
- Сплавы напр. бронза, латунь
Использование соединений меди
Соединения меди наиболее широко используются в сельском хозяйстве. С тех пор как была обнаружена их токсичность для некоторых насекомых, грибков и водорослей, эти соединения использовались в инсектицидах, фунгицидах и для предотвращения развития водорослей в резервуарах с питьевой водой. Поэтому они используются для борьбы с болезнями животных и растений. Удобрения также часто дополняют соединениями меди, т.е. медный купорос для повышения плодородия почвы и, следовательно, ускорения роста сельскохозяйственных культур. Соединения меди также используются в фотографии и в качестве красителей для стекла и фарфора.
Медь для хорошего здоровья
Медь является одним из многих микроэлементов, необходимых для хорошего здоровья. Он является частью простетических групп многих белков и ферментов и, таким образом, необходим для их правильного функционирования. Поскольку организм не может синтезировать медь, ее необходимо принимать с пищей. Орехи, семечки, крупы, мясо (например, печень) и рыба являются хорошими источниками меди.
Он является частью простетических групп многих белков и ферментов и, таким образом, необходим для их правильного функционирования. Поскольку организм не может синтезировать медь, ее необходимо принимать с пищей. Орехи, семечки, крупы, мясо (например, печень) и рыба являются хорошими источниками меди.
Медь также нашла применение в медицине. С давних времен он использовался для лечения ран грудной клетки и очистки воды. Недавно было высказано предположение, что медь помогает предотвратить воспаление, связанное с артритом и другими подобными заболеваниями. Продолжаются исследования лекарственных средств, содержащих медь, для лечения этого и других заболеваний.
Соединения меди
Медь состоит из множества соединений, многие из которых окрашены. Двумя основными степенями окисления меди являются +1 и +2, хотя известны некоторые комплексы +3. Ожидается, что соединения меди (I) будут диамагнитными по своей природе и обычно бесцветны, за исключением случаев, когда цвет возникает в результате переноса заряда или аниона. Ион +1 имеет тетраэдрическую или плоскоквадратную геометрию. В твердых соединениях медь (I) часто находится в более стабильном состоянии при умеренных температурах.
Ион +1 имеет тетраэдрическую или плоскоквадратную геометрию. В твердых соединениях медь (I) часто находится в более стабильном состоянии при умеренных температурах.
Ион меди(II) обычно находится в более стабильном состоянии в водных растворах. Соединения этого иона, часто называемые соединениями меди, обычно окрашены. На них влияют искажения Ян-Теллера, и они демонстрируют широкий спектр стереохимии с преобладанием четырех-, пяти- и шестикоординационных соединений. Ион +2 часто имеет искаженную тетраэдрическую геометрию.
Галогениды меди
Известно, что все галогениды меди(I) существуют, хотя фторид еще не был получен в чистом виде. Хлорангидриды, бромиды и йодиды меди — бесцветные диамагнитные соединения. Они кристаллизуются при обычных температурах со структурой цинковой обманки, в которой атомы Cu тетраэдрически связаны с четырьмя галогенами. Соли хлорида и бромида меди (I) получают кипячением кислого раствора ионов меди (II) в избытке меди. При разбавлении образуется белый CuCl или бледно-желтый CuBr. Добавление растворимого йодида к водному раствору ионов меди(II) приводит к образованию осадка йодида меди(I), который быстро разлагается на Cu(I) и йод.
При разбавлении образуется белый CuCl или бледно-желтый CuBr. Добавление растворимого йодида к водному раствору ионов меди(II) приводит к образованию осадка йодида меди(I), который быстро разлагается на Cu(I) и йод.
Галогениды меди(I) умеренно растворимы в воде, и большая часть меди в водном растворе находится в состоянии Cu(II). Тем не менее, плохая растворимость соединений меди (I) увеличивается при добавлении ионов галогенидов. В таблице ниже показаны некоторые свойства галогенидов меди (I).
| Формула | цвет | МП | БП | м (БМ) | Структура |
|---|---|---|---|---|---|
| CuF 2 | белый | 950разложение | – | 1,5 | |
| CuCl 2 | коричневый | 632 | 993разложить | 1,75 | CdCl 2 |
| CuBr 2 | черный | 498 | – | 1,3 |
Все четыре галогенида меди(II) известны, хотя йодид меди быстро разлагается на йодид меди и йод. Желтый хлорид меди (II) и почти черный бромид меди (II) являются обычными галогенидами. Эти соединения имеют структуру с бесконечными параллельными квадратными полосами CuX 4 единиц. Хлорангидриды и бромиды меди хорошо растворимы в воде и донорных растворителях, таких как ацетон, спирт и пиридин.
Желтый хлорид меди (II) и почти черный бромид меди (II) являются обычными галогенидами. Эти соединения имеют структуру с бесконечными параллельными квадратными полосами CuX 4 единиц. Хлорангидриды и бромиды меди хорошо растворимы в воде и донорных растворителях, таких как ацетон, спирт и пиридин.
Галогениды меди(II) являются умеренными окислителями из-за пары Cu(I)/Cu(II). В воде, где потенциал в значительной степени равен потенциалу аквакомплексов, большой разницы между ними нет, но в неводных средах окислительная (галогенирующая) способность возрастает в ряду;
\[\ce{CuF2 \ll CuCl2 \ll CuBr2}\]
Их можно получить прямой реакцией с соответствующими галогенами:
\[\ce{Cu + F2 → CuF2}\]
\[\ce{Cu + Cl2 / 450 C → CuCl2}\]
\[\ce{Cu + Br2 → CuBr2}\]
В качестве альтернативы они могут быть получены из CuX 2 .aq путем нагревания -> CuX 2
| Формула | цвет | МП | БП | Структура |
|---|---|---|---|---|
| CuCl | белый | 430 | 1359 | – |
| CuBr | белый | 483 | 1345 | – |
| CuI | белый | 588 | 1293 | Цинковая смесь |
Получено восстановлением CuX 2 -> CuX;
, за исключением F, который не был получен в чистом виде.
Обратите внимание, что CuI 2 не был выделен из-за легкости восстановления до CuI.
Оксиды меди
Оксиды меди(I) более стабильны, чем оксиды меди(II) при высоких температурах. Оксид меди(I) встречается в самородном виде в виде красного куприта. В лаборатории восстановление раствора Фелинга восстанавливающим сахаром, таким как глюкоза, дает красный осадок. Тест достаточно чувствителен даже для 1 мг сахара, чтобы получить характерный красный цвет соединения. Закись меди также можно получить в виде желтого порошка контролируемым восстановлением щелочной соли меди (II) гидразином. Термическое разложение оксида меди(II) также дает оксид меди(I), так как последний обладает большей термической стабильностью. Тот же метод можно использовать для получения соединения из нитрата, карбоната и гидроксида меди (II).
Оксид меди(II) встречается в природе в виде тенорита. Это черное кристаллическое твердое вещество может быть получено пиролизом нитратных, гидроксидных или карбонатных солей. Он также образуется при нагревании порошкообразной меди на воздухе или в кислороде. В таблице ниже приведены некоторые характеристики оксидов меди.
Он также образуется при нагревании порошкообразной меди на воздухе или в кислороде. В таблице ниже приведены некоторые характеристики оксидов меди.
| Формула | цвет | Степень окисления | МП |
|---|---|---|---|
| CuO | черный | Медь 2+ | 1026разложить |
| Медь 2 О | красный | Медь + | 1230 |
Окислительно-восстановительная химия меди
Cu 2+ + e- → Cu + E=0,15 В
Cu + + e- → Cu E=0,52 В
Cu 2+ + 2e- → Cu E=0,34 В
При рассмотрении этих данных будет видно, что любой окислитель, достаточно сильный для превращения Cu в Cu + , более чем достаточно силен для превращения Cu + в Cu 2+ (0,52 по сравнению с 0,14 В). Поэтому не ожидается, что какие-либо стабильные соли Cu + будут существовать в водном растворе.
Поэтому не ожидается, что какие-либо стабильные соли Cu + будут существовать в водном растворе.
Также может произойти диспропорционирование:
2Cu + → Cu 2+ + Cu E=0,37 В или K=10 6
Координационные комплексы
Реакция ЭДТА 4- с медью(II) дала комплекс, в котором ЭДТА оказался пентадентатным, а НЕ гексадентатным, в отличие от других ионов M(II).
Cu(ЭДТА) 2-
Структура иона [Cu(ox) 2 ] 2- может быть описана как плоскоквадратная или как искаженный октаэдр, если рассматривать упаковку в кристаллической решетке. . В случае соли натрия отдельные единицы параллельны в ячейке с медью, связанной с атомами кислорода, координированными с медью в единицах, расположенных как вверху, так и внизу, тогда как в соли калия единицы не параллельны и если смотреть в трех единицах центральная находится почти под прямым углом к двум другим. Здесь медь связана с одним из некоординированных атомов кислорода в единицах выше и ниже ее.
Здесь медь связана с одним из некоординированных атомов кислорода в единицах выше и ниже ее.
Na+ и K+ соли [Cu(ox) 2 ] 2-
Cu(OH) 2 реагирует с NH 3 с образованием раствора, растворяющего целлюлозу. Это используется в промышленной подготовке района. Растворы содержат тетраммины и пентамины. С пиридином образуются только тетрамины, например, Cu(py) 4 SO 4 .
Взаимодействие меди(II) с аминокислотами широко изучено. Почти во всех случаях продукт содержит группы в -транс-, которая, как ожидается, будет более стабильной. В случае глицина первым осаждаемым продуктом всегда является цис- изомер, который при нагревании превращается в транс-. Для получения более подробной информации см. лабораторное руководство для C31L.
Аналитическое определение меди(II)
Полезным реагентом для аналитического определения иона меди(II) является натриевая соль N,N-диэтилдитиокарбамата. В разбавленных спиртовых растворах наличие следовых количеств Cu 2+ обозначается желтым цветом, который можно измерить спектрофотометром, а концентрацию определяют по графику закона Бера. Комплекс представляет собой Cu(Et 2 dtc) 2 , который можно выделить в виде коричневого твердого вещества.
В разбавленных спиртовых растворах наличие следовых количеств Cu 2+ обозначается желтым цветом, который можно измерить спектрофотометром, а концентрацию определяют по графику закона Бера. Комплекс представляет собой Cu(Et 2 dtc) 2 , который можно выделить в виде коричневого твердого вещества.
Cu(Et 2 dtc) 2
Ссылки
- Комплексы и переходные элементы первого ряда», D. Nicholls
- «Основы неорганической химии», Ф.А. Коттон, Г. Уилкинсон и П.Л. Гаус
- «Продвинутая неорганическая химия», Ф. А. Коттон, Г. Уилкинсон, К. А. Мурильо и М. Бохманн
- «Химия элементов», Гринвуд и Эрншоу
Авторы и авторство
Эта страница под названием 21.12A: Copper Metal распространяется по незаявленной лицензии, ее автором, ремиксом и/или куратором является Роберт Дж. Ланкашир.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Роберт Ланкашир
- Показать страницу TOC
- № на стр.

- Теги
- медь
Инновации: Медь: прочный металл
Применение меди в здравоохранении и окружающей среде
Патрисия Т. Фоли
Медь хорошо известна как красный металл и в равной степени хорошо воспринимается как зеленый металл. Зеленый, потому что медь долговечна, легко переплавляется или повторно очищается, а ее переработка экономична. В 1997 г. из лома, переработанного в США, было извлечено 1,45 млн т меди и еще 379 т меди.,000 тонн лома меди и медных сплавов было экспортировано. Общее производство первичной рафинированной меди в США из отечественных руд и зарубежных материалов составило 2,06 млн тонн. Примерно две трети медьсодержащего лома составляли новый лом, а одна треть — старый лом (терминологию см. на сопроводительной странице).
Основные рынки сбыта меди
Данные: CDA
Медь долговечна
Медь долговечна. Он сохраняет свою электропроводность и, как правило, не портится и не подвергается коррозии со временем. В результате медь часто используется в изделиях, рассчитанных на пожизненный срок службы или даже дольше. В 1997, на строительство зданий приходилось почти 42% потребления меди в США по сравнению с 22% в 1960 году. Сегодня в домах используется гораздо больше меди, чем 50 или 100 лет назад.
Инфраструктура здания может быть расширена или модернизирована, но медные провода, трубы и латунные фитинги в доме или офисе редко нуждаются в замене. Из-за долгого срока службы меди и того, что в старых домах содержится меньше меди, чем в современных постройках, в строительном секторе доступно лишь небольшое количество металлолома.
Для строительной проволоки, труб и фитингов коэффициент переработки старого лома, т. е. отношение потребления старого лома к общему потреблению меди, относительно низок по сравнению со сталью, алюминием и пластиком. Причина этого в том, что упаковочные материалы (основное конечное использование стали, алюминия и пластика) имеют жизненный цикл всего несколько недель и могут перерабатываться несколько раз в год. С другой стороны, изделия на основе меди, как правило, имеют очень долгий срок службы. Это ограничивает поставки медного лома для переработки.
Причина этого в том, что упаковочные материалы (основное конечное использование стали, алюминия и пластика) имеют жизненный цикл всего несколько недель и могут перерабатываться несколько раз в год. С другой стороны, изделия на основе меди, как правило, имеют очень долгий срок службы. Это ограничивает поставки медного лома для переработки.
Электрические и электронные приложения были крупнейшим рынком меди в 1960 году, на него приходилось 28% от общего объема. В 1997 году это было второе по величине конечное использование меди с долей 25%. Во многих электротехнических изделиях, таких как силовые кабели, шины, обмотки трансформаторов, двигатели для тяжелых бытовых приборов, а также телефонные провода и кабели, медь имеет длительный срок службы и может быть недоступна для переработки в течение 20–50 лет после ее первоначального использования. . Другие медьсодержащие электрические и электронные изделия, такие как небольшие бытовые электроприборы и электронные товары, имеют более короткий срок службы, возможно, порядка 5-10 лет. Коммерческие электронные продукты и крупная бытовая техника обычно перерабатываются, так как они могут содержать драгоценные металлы вместе с медью. Несмотря на то, что скорость переработки мелких предметов бытовой электроники ниже, они содержат очень мало меди.
Коммерческие электронные продукты и крупная бытовая техника обычно перерабатываются, так как они могут содержать драгоценные металлы вместе с медью. Несмотря на то, что скорость переработки мелких предметов бытовой электроники ниже, они содержат очень мало меди.
В связи с быстрым изменением технологий в области электроники некоторые старые изделия, содержащие медь, устарели. Например, в 1980-х годах телефонные коммутационные станции и центральные офисы были основным источником лома меди и медных сплавов, поскольку появление цифровой коммутации сделало эти громоздкие металлоемкие устройства устаревшими.
Транспортное оборудование является третьим по величине рынком сбыта меди с 13% от общего объема, примерно столько же, сколько и в 1960 году. Хотя значение транспортного сектора не изменилось, характер использования меди сильно изменился. В течение многих лет автомобильный радиатор был наиболее важным конечным продуктом в этом секторе; однако использование меди в автомобильных электрических и электронных устройствах быстро росло, в то время как рынок теплообменников сокращался. Средний срок службы автомобилей составляет 10-15 лет, и почти вся медь, включая радиатор и жгут проводов, восстанавливается до того, как кузов измельчается и перерабатывается.
Средний срок службы автомобилей составляет 10-15 лет, и почти вся медь, включая радиатор и жгут проводов, восстанавливается до того, как кузов измельчается и перерабатывается.
Промышленные машины и оборудование — еще одно применение, в котором медь обычно имеет длительный срок службы. Однако использование меди на этом рынке не растет и в настоящее время составляет всего 12% использования по сравнению с 21% в 1960 году. Относительная важность потребительских товаров и товаров общего назначения также снизилась с 13% от общего объема в 1960 году. до 9% в 1997 году. Чеканка монет или боеприпасов являются основными областями продукта в этом конечном использовании. Пули редко перерабатываются, и хотя некоторые монеты могут быть переплавлены, многие из них находятся в руках коллекционеров или хранителей и недоступны для переработки.
Медь легко перерабатывается
Медь и медные сплавы легко перерабатываются. Соединенные Штаты имеют хорошо развитую инфраструктуру, которая обеспечивает медным ломом плавильные, аффинажные заводы, латунные заводы, литейные заводы, производителей слитков и другие. Этим переработчикам требуется медный лом для контроля процесса и/или затрат.
Этим переработчикам требуется медный лом для контроля процесса и/или затрат.
Около 19% меди, переработанной в 1997 г., было переработано плавильными заводами. Основная часть меди, выплавляемой в США, поступает от плавильных заводов, интегрированных с горнодобывающими предприятиями. Большинство этих заводов не используют металлолом, хотя некоторые могут покупать небольшое количество, которое используется для контроля температуры расплавленной меди в конвертере. В Соединенных Штатах есть два плавильных завода вторичной меди, завод Chemetco в Иллинойсе и завод Southwire в Джорджии, которые перерабатывают медный лом. Большая часть сырья для этих заводов представляет собой старый нелегированный лом, который необходимо улучшить, прежде чем его можно будет использовать повторно.
Потребители медного лома
Данные: CDA
Большинство первичных нефтеперерабатывающих заводов в Соединенных Штатах полагаются на блистерную или анодную продукцию первичных плавильных заводов в качестве основного источника сырья. Некоторые, тем не менее, будут перерабатывать высококачественный лом № 1 или покупать блистеры и/или аноды, полученные из лома. Как правило, огнеупорный слиток или катод, изготовленные в основном из вторичного материала, не могут использоваться во всех областях применения. Большая часть этого материала используется латунными заводами. Вторичный катод может не подходить для тонкой проволоки и использоваться в первую очередь в строительстве. Некоторое количество смешивается с катодом с первичных нефтеперерабатывающих заводов и используется в других операциях по производству проволоки и кабелей.
Некоторые, тем не менее, будут перерабатывать высококачественный лом № 1 или покупать блистеры и/или аноды, полученные из лома. Как правило, огнеупорный слиток или катод, изготовленные в основном из вторичного материала, не могут использоваться во всех областях применения. Большая часть этого материала используется латунными заводами. Вторичный катод может не подходить для тонкой проволоки и использоваться в первую очередь в строительстве. Некоторое количество смешивается с катодом с первичных нефтеперерабатывающих заводов и используется в других операциях по производству проволоки и кабелей.
Southwire использует высококачественный лом для производства катода, который используется вместе с покупным катодом в производстве проволоки и кабелей. Warrenton Refining, еще одно предприятие, работающее на металлоломе, производит слитки огнеупорной очистки. Reading Industries и Cerro Copper управляют заводами по переработке металлолома, которые производят сырье для своих трубных заводов. Noranda в Канаде и Asarco используют высококачественный лом на своих основных нефтеперерабатывающих заводах. Нефтеперерабатывающие заводы США перерабатывают около 10% лома, полученного в США.
Noranda в Канаде и Asarco используют высококачественный лом на своих основных нефтеперерабатывающих заводах. Нефтеперерабатывающие заводы США перерабатывают около 10% лома, полученного в США.
Латунные заводы являются крупнейшими потребителями лома в США, на долю которых приходится чуть более 50% общего потребления лома. Латунные заводы используют как лом меди, так и лом медных сплавов. Материал должен быть высококачественным, так как он просто переплавляется без возможности переработки. В основном это новый лом. Например, большая часть лома на заводах по производству легированных стержней является возвратным ломом от операций клиентов. Возвратный лом также является важным источником для производителей полосы и листа, но трубные заводы полагаются на покупной лом, а не на давальческий материал. В среднем лом составлял 56% потребности медных заводов США в меди.
Производители слитков и литейные заводы используют лом для получения большей части своей меди, и в 1997 году лом составлял 93% их потребностей в меди. Поскольку требования к свойствам материала для литых изделий, как правило, менее строгие, чем для проката и волочения, производители слитков и литейные заводы могут использовать более низкие сорта меди и лома медных сплавов.
Поскольку требования к свойствам материала для литых изделий, как правило, менее строгие, чем для проката и волочения, производители слитков и литейные заводы могут использовать более низкие сорта меди и лома медных сплавов.
| Продукт | Рафинированный | Лом | % Лом |
|---|---|---|---|
| Проволочный стан | 2 129 | 31 | 1% |
| Латунные заводы | 596 | 769 | 56% |
| Изготовители слитков и литейные заводы | 15 | 207 | 93% |
| Прочие отрасли | 18 | 54 | 75% |
| Итого | 2 759 | 1 055 | 28% |
Медь экономически выгодна для вторичной переработки
Медь имеет высокую внутреннюю стоимость, и переработка меди имеет экономический смысл. Инфраструктура сборщиков, дилеров, переработчиков и потребителей металлолома развивалась без стимулов муниципалитетов или программ возврата.
Инфраструктура сборщиков, дилеров, переработчиков и потребителей металлолома развивалась без стимулов муниципалитетов или программ возврата.
Когда латунные заводы принимают лом от своих клиентов, цена на этот лом часто составляет около 90% стоимости металла в ломе. Например, когда заводы по производству латунных стержней корректируют свои цены, они устанавливают цифру для «цены продажи металлического латунного стержня» и «цены выкупа стружки, возвращенной покупателем».
На рынке США медный лом обычно продается с небольшой скидкой по сравнению с ценой на медь, установленной на бирже Comex. В 1998 г. медный лом продавался по цене около 98% от цены первичной меди.
Также в этом выпуске:
- Терминология и классификация металлолома
- Медь: прочный металл
- ARI принимает новый стандарт для оценки тепловых насосов с прямым геообменом
- Обзор жилых систем ОВКВ и Х в 2020 году
- Медь повышает эффективность солнечных батарей




 Можно использовать смесь уксуса и пищевой соды (см. рис. 7).
Можно использовать смесь уксуса и пищевой соды (см. рис. 7). Медная деталь не должна полностью погружаться в состав (см. рис.9). Во время гальванизации следует непрерывно перемешивать раствор стеклянной или деревянной палочкой, чтобы получить равномерный слой. Обе металлические части следует располагать на расстоянии не менее 30 мм друг от друга, чтобы избежать неравномерного отложения металла на поверхности.
Медная деталь не должна полностью погружаться в состав (см. рис.9). Во время гальванизации следует непрерывно перемешивать раствор стеклянной или деревянной палочкой, чтобы получить равномерный слой. Обе металлические части следует располагать на расстоянии не менее 30 мм друг от друга, чтобы избежать неравномерного отложения металла на поверхности.




 Ланкашир
Ланкашир Сера, железо и другие нежелательные элементы удаляются, и продукт называется черновой медью.
Сера, железо и другие нежелательные элементы удаляются, и продукт называется черновой медью. Обычными реагентами являются слабые кислоты, т.е. Н 2 SO 4 , H 2 SO 4 + Fe 2 (SO 4 ) 3 , кислые растворы хлоридов, например FeCl 2 , композиции хлорида аммония и соли аммония.
Обычными реагентами являются слабые кислоты, т.е. Н 2 SO 4 , H 2 SO 4 + Fe 2 (SO 4 ) 3 , кислые растворы хлоридов, например FeCl 2 , композиции хлорида аммония и соли аммония. Типичными электролитами являются кислые растворы, такие как серная кислота, H 2 СО 4 . Таким образом, ионы меди, которые присутствовали в органическом экстрагенте, растворяются в растворе электролита, образуя медьсодержащий «богатый электролит». Здесь снова происходит фазовое разделение. Вторая органическая фаза представляет собой обедненный органический экстрагент, тогда как вторая водная фаза представляет собой «богатый электролит». Бесплодный органический экстрагент затем рециркулируют для повторного использования при применении к выщелачивающему продукту.
Типичными электролитами являются кислые растворы, такие как серная кислота, H 2 СО 4 . Таким образом, ионы меди, которые присутствовали в органическом экстрагенте, растворяются в растворе электролита, образуя медьсодержащий «богатый электролит». Здесь снова происходит фазовое разделение. Вторая органическая фаза представляет собой обедненный органический экстрагент, тогда как вторая водная фаза представляет собой «богатый электролит». Бесплодный органический экстрагент затем рециркулируют для повторного использования при применении к выщелачивающему продукту.