Как получить карбид кальция из кальция: как получить карбид кальция(CaC2) из кальция
alexxlab | 23.02.2023 | 0 | Разное
Карбид кальция « Попаданцев.нет
Что такое «карбид», знает любой мальчишка. Если бросить кусочек карбида в лужу, то кроме дикого шипения получается еще дичайшая вонь. А как получается сам карбид?
Вообще карбидов существует множество, как и применений ему. Но нас пока интересует карбид кальция CaC2 — то есть тот, который используют для получения ацетилена при соединении карбида с водой.
Слишком сложного в получении карбида кальция нет. Сейчас для этого в электропечах пережигают негашеную известь с коксом. При всей этой простоте — впервые карбид кальция был получен в лаборатории в 1836-м году, а промышленно его начали получать в 1892 году. Для попаданца — широчайшее поле для внедрения!
Все реакция — CaO + 3C = CaC2 + CO
Негашеная известь соединяется с углеродом. Негашеную известь получали с древних времен, пережигая известняк, ну и древесный уголь тоже дефицитом не был никогда. Полученный попутно угарный газ (СО) окисляется до углекислого газа прямо при выходе из печи, хотя сейчас часто печи делают закрытыми для сбора угарного газа.
На 100 весовых частей негашеной извести нужно 70-80 весовых частей углерода.
При производстве лучше иметь избыток угля, чем извести — такой карбид отдает больше ацетилена.
Готовый карбид кальция технического качества почти на 80% состоит из самого карбида кальция, 17% — известь, остальное примеси.
Карбид выходит в виде расплава, который после затвердевания измельчают.
Но, несмотря на простоту реакции получения, есть некоторые неприятные нюансы.
Главное — процесс этот эндотермический, он поглощает дикое количество тепла в процессе производства — 3000 кВт на тонну продукта. Именно из-за этого его делают электродуговым способом. При этом сам процесс идет в жидкой фазе — то есть расплавленная известь постепенно реагирует с кусками углерода. При этом нужна температура примерно 2000°С, что совсем немало. И что совсем неприятно — при перегреве до 2200-2400°С карбид кальция распадается на составляющие.
Поэтому, если нам не доступно электричество в больших объемах, у нас есть два выхода.
Первый — это плавить в тигле. Проблема в том, что тигель должен выдержать эти самые 2000°С, а в древние времена ни графитовый, ни вольфрамовый тигель нам будут недоступны.
Второй — построить небольшую доменную печь. Требуемое тепло даст избыточное количество угля. Уголь и известь насыпаются туда слоями и печь поддувается большим количеством воздуха. Такие печи пытались строить и главная проблема — поддержка точных условий реакции, что регулируется силой поддува.
С одной стороны — такую печь можно построить только когда уже работают доменные печи для железа. А с другой стороны — а нам точно нужен карбид, если нет даже железа?
Трудность вызовет хранение карбида. Он должен быть абсолютно изолирован от воды — много лучше, чем порох. Потому что если порох намокнет, то он не взорвется, а если намокнет карбид — то взрыв обеспечено. И что хуже всего — при хранении не должна использоваться медь, серебро или золото.
Проблем с производством карбида будет немало. Но при каком производстве их будет мало?
Зато все проблемы — решаемые чуть ли не с технологиями Древнего Египта.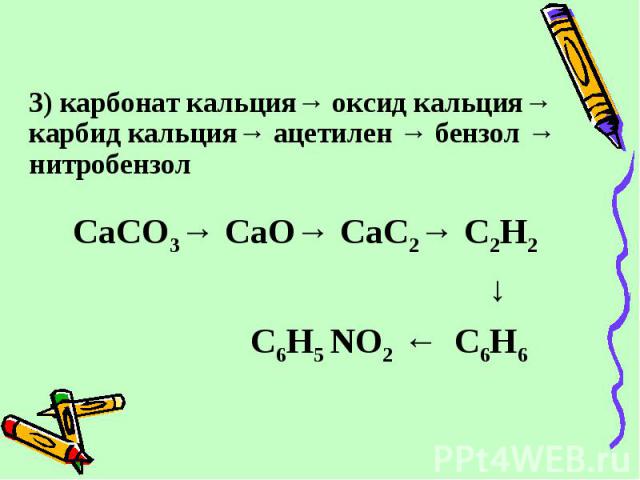
А пользы от карбида будет много…
И последнее — ацетилен, который получается после контакта карбида с водой — ничем не пахнет, человек просто не имеет обонятельных рецепторов для него. Та вонь, по которой мы безошибочно определяем карбид — это примеси, которых в техническом карбиде несколько процентов.
Карбид кальция
Карбид кальция (углеродистый кальций, ацетиленид кальция) — CaC2 — в чистом виде белое кристаллическое вещество. Бинарное неорганическое соединение кальция с углеродом.
Содержание
- 1 История получения
- 2 Получение
- 3 Физические свойства
- 4 Химические свойства
- 5 Внешний вид и характеристики технического карбида кальция
- 6 Область применения карбида кальция
- 7 Физиологическое действие
История получения
Впервые получен в 1861 году Фридрихом Вёлером нагреванием сплава цинка и кальция с углём.
Получение
В настоящее время получают прокаливанием в электрических печах (температура 1900—1950 °C) смеси оксида кальция с коксом.
- CaO + 3C → CaC2 + CO
Полученный таким образом технический продукт имеет чисто-черный цвет вследствие загрязнения углём и другими красящими примесями. Он содержит также примеси фосфида и сульфида кальция, вследствие чего такой карбид кальция и полученный из него ацетилен имеют неприятный запах.
Физические свойства
- Бесцветные тетрагональные кристаллы.
- Плотность: 228 (+20 °C, г/см3).
- Удельная теплоёмкость при постоянном давлении (в Дж/г·K): 0,92 (+20—325 °C).
- Стандартная энтальпия образования ΔfH (298 К, кДж/моль): −62,8 (т).
- Стандартная энергия Гиббса образования ΔfG (298 К, кДж/моль): −67,8 (т).
- Стандартная энтропия образования S (298 К, Дж/моль·K): 70,3 (т).
- Стандартная мольная теплоёмкость Cp (298 К, Дж/моль·K): 62,34 (т).
- Энтальпия плавления ΔHпл (кДж/моль): 32,2.
- Карбид кальция имеет резкий чесночный запах.

Химические свойства
При взаимодействии c водой карбид кальция гидролизуется с образованием ацетилена и гидроксида кальция (гашёной извести):
- CaC2 + 2H2O → Ca(OH)2 + C2H2↑
Представленная выше реакция является экзотермической.
Внешний вид и характеристики технического карбида кальция
Карбид кальция получают сплавлением в электрических печах кокса и негашеной извести. Расплавленный карбид кальция выпускается из печи в специальные формы — изложницы, в которых он затвердевает. Застывший карбид кальция дробится и сортируется на куски определённых размеров.
Технический карбид кальция представляет собой твёрдое кристаллическое вещество. По внешнему виду карбид кальция представляет собой твёрдое вещество тёмно-серого или коричневого цвета. Он даёт кристаллический излом серого цвета с различными оттенками в зависимости от чистоты. Карбид кальция жадно поглощает воду.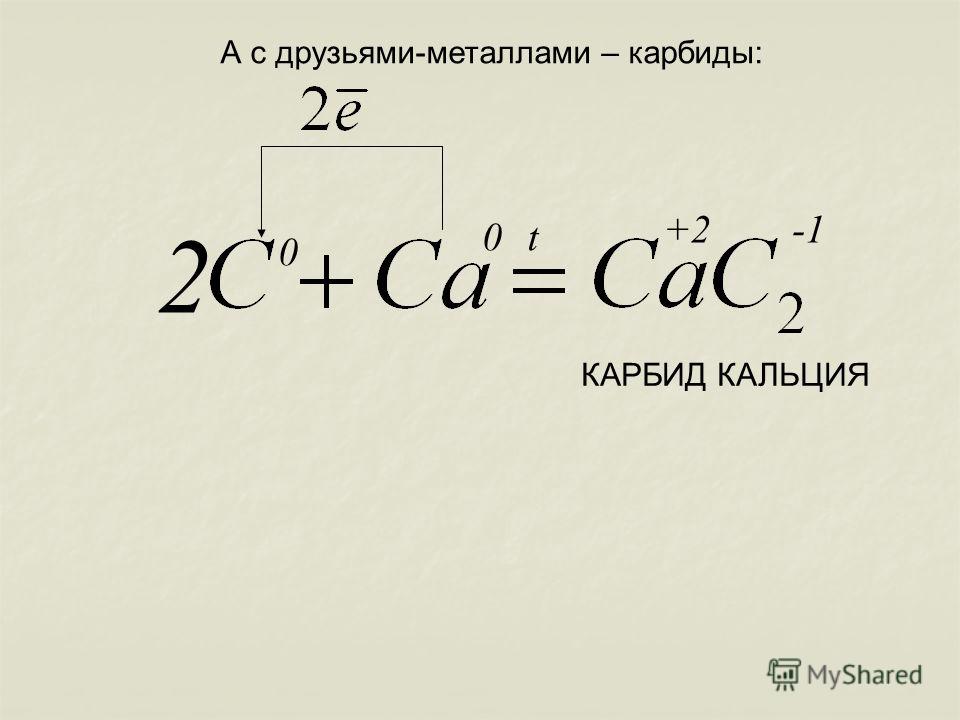 При взаимодействии с водой даже на холоде карбид кальция разлагается с бурным выделением ацетилена и большого количества тепла. Разложение карбида кальция происходит и под влиянием атмосферной влаги.
При взаимодействии с водой даже на холоде карбид кальция разлагается с бурным выделением ацетилена и большого количества тепла. Разложение карбида кальция происходит и под влиянием атмосферной влаги.
По ГОСТ 1460-56 установлены следующие размеры (грануляция) кусков карбида кальция: 2×8; 8×15; 15×25; 25×80. Технический карбид кальция содержит до 80 % химически чистого карбида кальция, остальное составляют примеси — негашеная известь, углерод, кремнекислота и другое.
Область применения карбида кальция
Карбид кальция используют при проведении автогенных работ и освещения, а также в производстве ацетиленовой сажи и продуктов органического синтеза, из которых главным является синтетический каучук.
Карбид кальция применяют в производстве цианамида кальция, из которого получают удобрения, цианистые соединения. Карбид кальция используют для получения карбидно-карбамидного регулятора роста растений, изготовления порошкового карбидного реагента.
Из 1 кг технического карбида получается от 235 до 285 л ацетилена в зависимости от его сорта и грануляции: чем чище и крупнее карбид кальция, тем большее количество ацетилена он даёт при разложении.
Для разложения 1 кг карбида кальция теоретически требуется 0,56 л воды. Практически берут от 5 до 20 л воды с целью лучшего охлаждения ацетилена и обеспечения безопасности при работе. Скорость разложения карбида кальция водой зависит от его чистоты, грануляции, температуры и чистоты воды. Чем чище карбид кальция, меньше размер его кусков, выше температура и чище вода, тем больше скорость.
Физиологическое действие
- Среди всех неорганических производных кальция CaC2 очень ядовит.
- По степени воздействия на организм человека карбид кальция относится к 1-му классу опасности согласно ГОСТ 12.1.007.
- Попадание карбида кальция внутрь организма также является опасным.
- Пыль карбида кальция оказывает раздражающее действие на кожу, слизистые оболочки органов дыхания.
- Карбид кальция CaC2 чрезвычайно опасен для окружающей среды.
Как сделать карбид кальция
••• уголь изображение Роберта Мобли с сайта Fotolia. com
com
Обновлено 29 сентября 2017 г. В сочетании с водой он производит ацетиленовый газ, который используется в сварочных и газовых горелках. По данным Совета по развитию торговли Гонконга, карбид кальция также является ключевым компонентом большей части поливинилхлорида (ПВХ), производимого в Китае. Соединение производится с конца 1800-х годов путем взаимодействия извести и угля в печи. Агентство по охране окружающей среды США обнаружило, что твердые частицы и другие побочные продукты попадают в окружающую среду в результате производства карбида кальция, но выбросы углеводородов при производстве карбида кальция минимальны. Изготовление карбида кальция представляет собой сложный процесс.
- Лайм
- Уголь
- Электрическая дуговая печь
- Электродная паста
- Охлаждающее оборудование
- Среда под открытым небом
- МЕХАНИЗМА
Соблюдайте все законы и правила, касающиеся производства химических соединений. Температуры, связанные с производством карбида кальция, означают, что только профессионалы, обученные использованию необходимого оборудования, должны пытаться производить карбид кальция.

Твердый карбид кальция измельчают либо на открытом воздухе, либо в инертной среде до его полного охлаждения. Невыполнение этого требования может привести к опасности взрыва.
Слишком много примесей в извести и угле, используемых для создания карбида кальция, приведет к появлению примесей в карбиде кальция.
Вставьте известь и уголь в электродуговую печь.
Нагрейте электродуговую печь до температуры не менее 3632 градусов по Фаренгейту. Не допускайте превышения температуры 3812 градусов по Фаренгейту.
Подайте обожженную электродную пасту в печь. Он будет действовать как катализатор для извести и угля.
Переместите полученный расплав карбида кальция в охлаждающее оборудование (охлаждающий механизм). Это позволит ему затвердеть.
Перерабатывайте затвердевший карбид кальция в дробильном механизме, пока он не достигнет желаемого размера.
Вещи, которые вам понадобятся
- 9002. Идеализм. извести, 1 1/2 фунта угля и 0,04 фунта электродной пасты должны дать конечный продукт в виде 2,2 фунта карбида кальция.
Добывайте и очищайте известь, уголь и электродную пасту рядом с печью, чтобы максимизировать эффективность.
Предупреждения
Связанные статьи
Ссылки
- Агентство по охране окружающей среды США: AP-42, Сборник коэффициентов выбросов загрязнителей воздуха – Производство карбида кальция; Январь 1995 г.
- Совет по развитию торговли Гонконга: Промышленный профиль — Проблемы в производстве ПВХ
Об авторе
Дэмиен Трин имеет степень бакалавра политических наук Калифорнийского университета в Беркли. Специализируясь на написании текстов о видеоиграх, он играет в компьютерные игры более 20 лет и написал множество классических произведений. Он также является заядлым консольным игроком.
Фото предоставлено
Уголь, изображение Роберта Мобли с сайта Fotolia. com
com
Карбид кальция — Sciencemadness Wiki0083 CaC
2 , карбид, реагирующий с водой с образованием ацетилена.Карбид кальция часто называют просто карбид .
Содержание
- 1 Свойства
- 1.1 Химическая промышленность
- 1.2 Физический
- 2 Наличие
- 3 Подготовка
- 4 проекта
- 5 Обращение
- 5.1 Безопасность
- 5.2 Хранение
- 5.3 Утилизация
- 6 Каталожные номера
- 6.1 Соответствующие темы Sciencemadness
Свойства
Химический
Карбид кальция энергично реагирует с водой с образованием гидроксида кальция и газообразного ацетилена.
- CaC 2 + 2 H 2 O → C 2 H 2 + Ca(OH) 2
Нечистые технические соединения, такие как кальциевый карбид такие как сульфид кальция, нитрид кальция, фосфид кальция, которые при контакте с водой также образуют фосфин/дифосфан, аммиак или сероводород.
Чистый карбид кальция медленно реагирует с безводными кислотами.
Карбид кальция будет реагировать с азотом при высокой температуре с образованием цианамида кальция в процессе Франка-Каро:
- CaC 2 + N 2 → CaCN 2 + C
Карбид кальция, как и все ионные карбиды, является супероснованием. Он способен депротонировать не только воду, но и спирты, выделяя ацетилен.
Он способен депротонировать не только воду, но и спирты, выделяя ацетилен.
Физический
Чистый карбид кальция имеет белый цвет, но следы примесей обычно придают материалу серый, синий или коричневый оттенок. В то время как чистое соединение не имеет запаха в сухом воздухе, технический сорт издает неприятный запах. Он нерастворим во всех растворителях, но реагирует с водой и спиртами.
Доступность
Карбид кальция технический можно найти в некоторых строительных магазинах, но этот тип содержит следы других ионных соединений кальция, таких как фосфид кальция, нитрид кальция, сульфид кальция, которые при взаимодействии с водой выделяют неприятный запах. Ацетилен, полученный из карбида кальция, обеспечивает движущую силу многих типов игрушечных пушек, поэтому карбид кальция можно приобрести в качестве топлива в магазинах или на веб-сайтах, где они продаются. Более чистые образцы можно найти у поставщиков лаборатории.
Некоторые средства для уничтожения сурков или репелленты содержат кусочки карбида кальция. Эти образцы не очень чистые, а также имеют определенные добавки, биоциды и отдушки, такие как 2-ундеканон, цитриодиол, нанесенные на поверхность валунов и внутри пор материала. Они действуют как репелленты от сурков и не ограничивают гидролиз карбида, как можно было бы подумать.
Эти образцы не очень чистые, а также имеют определенные добавки, биоциды и отдушки, такие как 2-ундеканон, цитриодиол, нанесенные на поверхность валунов и внутри пор материала. Они действуют как репелленты от сурков и не ограничивают гидролиз карбида, как можно было бы подумать.
Приготовление
Карбид кальция производят в промышленных масштабах в электродуговой печи из смеси оксида кальция и кокса (или чистого углерода) при температуре приблизительно 2000 °C.
- CaO + 3 C → CaC 2 + CO
Другой метод включает реакцию между тонкоизмельченным металлическим кальцием и порошкообразным углеродом (например, активированным углем) при 810°C в инертной атмосфере. Эта реакция сильно экзотермична, кальций не требует дальнейшего нагревания после расплавления. [1]
Преимущество последнего метода заключается в получении очень чистого продукта, который при гидролизе больше не выделяет типичный запах фосфина, характерный для технического карбида, а выделяет чистый ацетилен, который не несет опасности самопроизвольного воспламеняется на воздухе.
Хотя карбид кальция можно изготовить в домашних условиях из сырья, для достижения таких высоких температур требуется много топлива, и дешевле просто купить соединение.
Проекты
- Производство ацетилена
- Сделать ацетилиды металлов, которые можно получить путем барботирования ацетилена через раствор соли металла.
- Синтез цианамида кальция
Обращение
Безопасность
С карбидом кальция следует обращаться в перчатках, так как, хотя он не такой едкий, как щелочные металлы, например, он все же может раздражать кожу, реагируя на пот и влагу. Реакция с водой сопровождается выделением ядовитых паров, поэтому ее следует проводить на улице или в вытяжном шкафу; он также представляет опасность возгорания из-за потенциального образования фосфина и дифосфана из-за примесей фосфора в коммерческих образцах. В порошкообразном виде может сильно раздражать глаза и слизистые оболочки.
Хранение
Карбид кальция следует хранить в сухих контейнерах вдали от влаги. Поскольку технический сорт издает неприятные запахи, лучше хранить его в закрытой таре или в хорошо проветриваемом помещении.
Поскольку технический сорт издает неприятные запахи, лучше хранить его в закрытой таре или в хорошо проветриваемом помещении.
Не храните карбид в подвале! В случае наводнения или утечки воды любой карбид, вступивший в контакт с водой, выделит ацетилен, накопление которого может привести к взрыву. Старайтесь хранить его в самом высоком месте из комнаты или на чердаке, если это возможно. Убедитесь, что дождевая вода не просачивается в зону хранения.
Хорошим контейнером для хранения является обычная стальная банка из-под краски. Банка обеспечивает отличную защиту от воздуха и воды. Однако обычные стальные банки подвержены ржавчине, что иногда может быть хорошо, так как это показатель того, что среда, в которой хранится CaC 2 , слишком влажная, чтобы быть безопасной. Герметичные банки из нержавеющей стали еще лучше и обеспечивают хорошую защиту от большинства коррозионных агентов.
Утилизация
Карбид кальция можно нейтрализовать добавлением различных видов спирта, например, этанола, изопропанола, образующихся при разложении алкоксидов кальция ацетилена, виниловых эфиров, алкоксидов кальция и высших спиртов.



