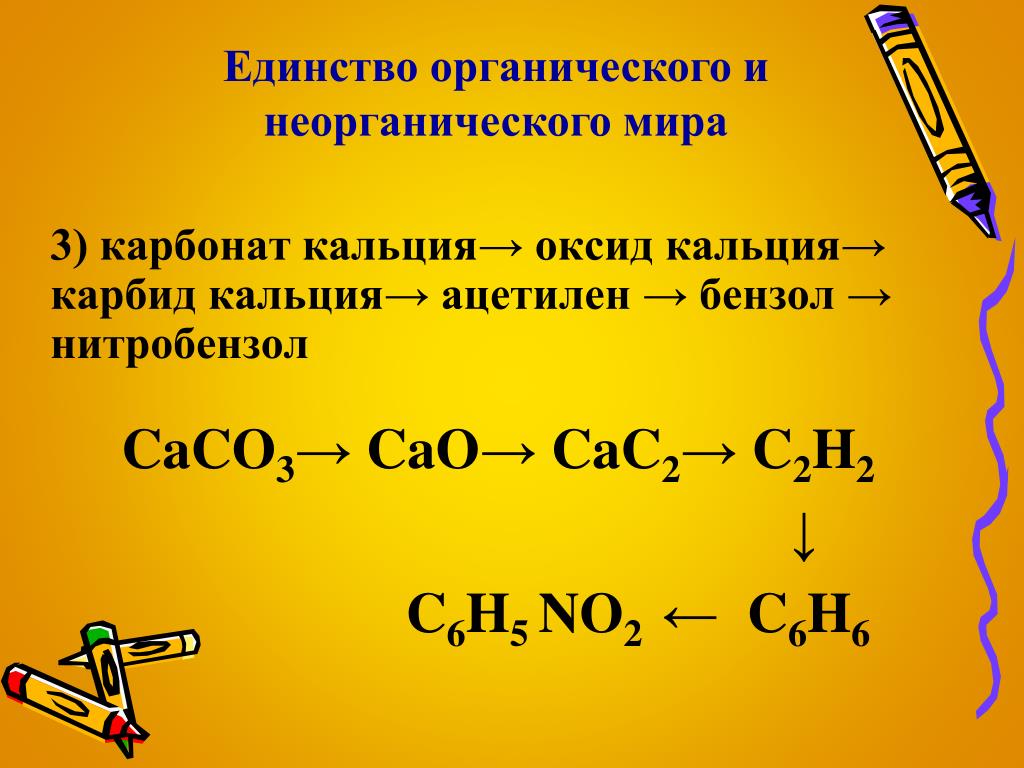
Как получить карбид кальция из оксида кальция: CaO -> CaC2 уравнение реакции
alexxlab | 21.03.2023 | 0 | Разное
Оксид кальция — характеристика, применение, получение
Обновлено: 06.01.2023
Негашеная известь называется так для отличия от гашеной извести, когда при соединении оксида кальция с водой проходит бурная реакция — известь «гасится» водой. Получается гашеная известь Ca(OH)2, востребованная во многих областях.
Жженой известью реактив называют с отсылкой на способ получения: известь (карбонат кальция CaCO3) обжигают до тех пор, пока она не начинает разлагаться, в результате чего получается жженая известь (окись кальция).
Обычно негашеной или жженой известью называют техническую квалификацию реактива.
Получить окись кальция можно разными методами.
• Промышленный способ описан выше: разложением известняка CaCO3 при нагревании.
• Разложением при нагревании гидроокиси кальция или солей кальция (солей определенных кислот, содержащих кислород). Например, разложением нитрита кальция Ca(NO3)2 получают CaO высокой чистоты.
• Прямым окислением (сжиганием) кальция в воздухе.
Свойства
Реагент представляет собой порошкообразное вещество белого или сероватого цвета без запаха. Структура кристаллов подобна структуре поваренной соли. Реактив гигроскопичен, поглощает из воздуха влагу и углекислый газ. Хорошо растворяется в глицерине, не растворяется в этиловом спирте. В воде не растворяется, а вступает с ней в химическую реакцию. Не горит. Токсичен.
С химической точки зрения очень активное соединение, осно́вный оксид. Реагирует с водой с образованием щелочи Ca(OH)2 и выделением большого количества тепла. В реакции с кислотами и кислотными оксидами образует соли. Взаимодействует с углеродом (получается карбид CaC2). Вступает в реакцию с метиловым спиртом, оксидами металлов, с металлами, с хлором, бромом и другими галогенами, углекислым газом, серой, фосфором, кремнием и многими другими веществами.
Меры предосторожности
Негашеная известь — едкое вещество, которое относится ко 2-му (высокоопасному) классу веществ. Особенно опасно смешивать оксид с водой. Во-первых, можно обжечься; во-вторых, образующаяся щелочь разъедает кожу. Но даже без воды оксид действует на кожу как щелочь: вытягивает влагу из кожи, разрушает белки, омыляет жиры, вызывает химический ожог.
Во-первых, можно обжечься; во-вторых, образующаяся щелочь разъедает кожу. Но даже без воды оксид действует на кожу как щелочь: вытягивает влагу из кожи, разрушает белки, омыляет жиры, вызывает химический ожог.
Опасность представляют известковая пыль, ее пары и аэрозольные частицы. Они попадают в органы дыхания, вызывая раздражение и кашель. При попадании в легкие могут вызвать пневмонию. Проглатывание оксида кальция вызывает ожог пищевода и желудка.
Очень опасен реактив для слизистых носа и особенно глаз. Способен вызвать язвы слизистой носа и даже прободение носовой перегородки.
Пострадавшему от контакта с химикатом обязательно следует вызвать скорую помощь. До приезда скорой нужно хорошо промыть место поражения: кожу, глаза, пищевод.
 Места высокого риска пыления дополнительно снабжаются локальной вытяжной вентиляцией.
Места высокого риска пыления дополнительно снабжаются локальной вытяжной вентиляцией.Хранят реактив в герметичной упаковке.
В лабораториях работы следует проводить в вытяжном шкафу. Хранят реактив в герметичных стеклянных или пластиковых сосудах с обязательными предупреждающими этикетками.
3. Оксид кальция можно получить сжиганием кальция в в кислороде при температуре выше 300º С:
2Ca + O2 = 2CaO.
1. Оксид кальция реагирует с простыми веществами :
Оксид кальция реагирует с углеродом (коксом) при температуре 1900 — 1950º С и образует угарный газ и карбид кальция:
CaO + 3C = CaC2 + CO.
2. Оксид кальция взаимодействует со сложными веществами:
2.1. Оксид кальция взаимодействует с кислотами:
2.1.1. О ксид кальция с разбавленной соляной кислотой образует хлорид кальция и воду:
CaO + 2HCl = CaCl2 + H2O.
2.1.2. Оксид кальция вступает во взаимодействие с разбавленной плавиковой кислотой с образованием фторида кальция и воды:
CaO + 2HF = CaF2↓ + H2O.
2.1.3. Оксид кальция вступает в реакцию с разбавленной фосфорной кислотой, образуя фосфат кальция и воду:
2.2. Оксид кальция реагирует с оксидами:
2.2.1. Оксид кальция при комнатной температуре реагирует с углекислым газом с образованием карбоната кальция:
CaO + CO2 = CaCO3
2.2.2. Взаимодействуя с оксидом кремния при 1100 — 1200º С оксид кальция образует силикат кальция:
CaO + SiO2 = CaSiO3
2.3. Оксид кальция взаимодействует с водой при комнатной температуре, образуя гидроксид кальция.
Физические свойства
Оксид кальция – неорганическое кристаллическое вещество в виде белого или серо-белого порошка без запаха и вкуса. Твёрдое вещество кристаллизуется в кубические гранецентрированные кристаллические решётки по типу хлорида натрия (NaCl).
Рис. 1. Кубические гранецентрированные кристаллические решётки.
Общее описание вещества представлено в таблице.
В глицерине. В этаноле не растворяется, с водой образует гидроксид.
В этаноле не растворяется, с водой образует гидроксид.
Оксид кальция – едкое вещество, относящееся ко второму классу опасности. Агрессивные свойства проявляет при взаимодействии с водой, образуя гашёную известь.
Рис. 2. Порошок оксида кальция.
Получение
Оксид кальция также называют жжёной известью из-за способа получения. Получают негашёную известь путём нагревания и разложения известняка – карбоната кальция (CaCO3).
Реакция получения оксида кальция из известняка выглядит следующим образом:
Кроме того, негашёную известь можно получить двумя способами:
- из простых веществ, наращивая оксидный слой на металле -.
Реакции протекают при высоких температурах. Температура сожжения известняка – 900-1200°C. При 200-300°C на поверхности металла начинает образовываться оксид. Для разложения солей и гидроксида необходима температура в 500-600°C.
Химические свойства
Оксид кальция является высшим оксидом и максимально проявляет окислительные свойства. Соединения взаимодействует с неорганическими веществами и свободными галогенами. Основные химические свойства оксида приведены в таблице.
Соединения взаимодействует с неорганическими веществами и свободными галогенами. Основные химические свойства оксида приведены в таблице.
Реакции
Что образуется
Молекулярное уравнение
Образуется гидроксид (гашёная известь). Реакция протекает бурно с выделением тепла.
Растворяется, образуя соли.
С оксидами неметаллов (кислотными остатками).
С углеродом при нагревании.
Образуется карбид кальция.
CaO + 3С → СаС2 + CO.
Восстанавливает кальций. Образуется оксид алюминия.
Применение
Оксид используется в пищевой промышленности в качестве:
- улучшителя муки и хлеба;
- пищевой добавки Е529;
- регулятора кислотности;
- питательной среды для дрожжей;
- катализатора гидрогенизации (присоединения водорода) жиров.
Кроме того, негашёная известь применяется в химической и строительной промышленности для производства различных веществ:
Читайте также:
- Высшее образование замедляет старение
- Перерывы в обучении позволяют лучше усвоить информацию – исследование
- Похмельный синдром: отличительный признак алкоголизма
Оксид кальция – хим.
 свойства и получение CHEMEGE.RU
свойства и получение CHEMEGE.RU
Оксид кальция CaO — бинарное неорганическое вещество. Белый, гигроскопичный. Тугоплавкий, термически устойчивый, летучий при очень высоких температурах. Проявляет основные свойства.
Относительная молекулярная масса Mr = 56,08; относительная плотность для тв. и ж. состояния d = 3,35; tпл ≈ 2614º C; tкип = 2850º C.
1. Оксид кальция получается при разложении карбоната кальция при температуре 900 — 1200º C. В результате разложения образуется оксид кальция и углекислый газ:
CaCO3 = CaO + CO2
2. В результате взаимодействия гидрида кальция и кислорода при температуре 300 — 400º С образуется оксид кальция и вода:
CaH2 + O2 = CaO + H2O
3. Оксид кальция можно получить сжиганием кальция в в кислороде при температуре выше 300º С:
Оксид кальция можно получить сжиганием кальция в в кислороде при температуре выше 300º С:
2Ca + O2 = 2CaO
1. Оксид кальция реагирует с простыми веществами:
Оксид кальция реагирует с углеродом (коксом) при температуре 1900 — 1950º С и образует угарный газ и карбид кальция:
CaO + 3C = CaC2 + CO
2. Оксид кальция взаимодействует со сложными веществами:
2.1. Оксид кальция взаимодействует с кислотами:
2.1.1. Оксид кальция с разбавленной соляной кислотой образует хлорид кальция и воду:
CaO + 2HCl = CaCl2 + H2O
2. 1.2. Оксид кальция вступает во взаимодействие с разбавленной плавиковой кислотой с образованием фторида кальция и воды:
1.2. Оксид кальция вступает во взаимодействие с разбавленной плавиковой кислотой с образованием фторида кальция и воды:
CaO + 2HF = CaF2↓ + H2O
2.1.3. Оксид кальция вступает в реакцию с разбавленной фосфорной кислотой, образуя фосфат кальция и воду:
3CaO + 2H3PO4 = Ca3(PO4)2↓ + 3H2O
2.2. Оксид кальция реагирует с оксидами:
2.2.1. Оксид кальция при комнатной температуре реагирует с углекислым газом с образованием карбоната кальция:
CaO + CO2 = CaCO3
2.2.2. Взаимодействуя с оксидом кремния при 1100 — 1200º С оксид кальция образует силикат кальция:
CaO + SiO2 = CaSiO3
2. 3. Оксид кальция взаимодействует с водой при комнатной температуре, образуя гидроксид кальция:
3. Оксид кальция взаимодействует с водой при комнатной температуре, образуя гидроксид кальция:
CaO + H2O = Ca(OH)2
Понравилось это:
Нравится Загрузка…
Индекс цен на карбид кальция – businessanalytiq
Business Analytiq не несет никакой ответственности за любые ошибки или упущения в содержании этого сайта. Информация, содержащаяся на этом сайте, предоставляется на условиях «как есть» без каких-либо гарантий полноты, точности, полезности, пригодности для цели или своевременности. Она не может удалять влагу из воздуха и газов. Он часто используется в производстве электронных устройств для предотвращения повреждений от влаги.
Карбид кальция Индекс цен в Китае
Этот пост является кратким изложением динамики цен на карбид кальция. Динамика цен на карбид кальция выражена в ценах в долларах США, конвертированных в обменные курсы, действующие на момент, когда цена была действительна.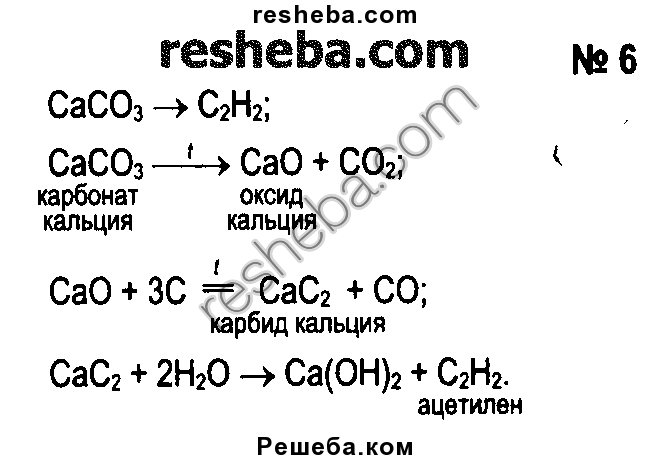
Прогноз цен на карбид кальция на второй вкладке формируется на основе различных данных, включая:
- Самые последние изменения цен на непосредственные факторы затрат на карбид кальция
- Последние изменения цен на основное сырье, которые влияют на цену карбида кальция
- Рыночные фьючерсы как на цены на карбид кальция, так и на сырье
- Корректировка текущих диспропорций спроса/предложения на рынке карбида кальция
- Долгосрочные тенденции вероятных условий спроса
Дополнительная информация об индексе цен на карбид кальция
Что такое карбид кальция
Карбид кальция — это химическое соединение с формулой CaC2. Это серовато-белое твердое вещество, обладающее высокой реакционной способностью и образующее газообразный ацетилен при взаимодействии с водой.
Карбид кальция имеет ряд важных промышленных применений. Он используется для производства газообразного ацетилена, который является сырьем для производства различных химических веществ, таких как уксусная кислота, этилен и другие полимеры. Карбид кальция также используется в качестве восстановителя при производстве некоторых металлов, а также при производстве железа и стали.
Помимо промышленного использования, карбид кальция имеет ряд других применений. Он используется в качестве осушителя для удаления влаги из воздуха и газов, а также используется в производстве взрывчатых веществ и фейерверков. Карбид кальция также используется в качестве агента для созревания фруктов и используется в производстве ацетиленового газа для сварки и резки.
Как получают карбид кальция
Карбид кальция получают реакцией оксида кальция (извести) с углеродом, обычно в виде кокса. Реакция проходит в электродуговой печи при температуре около 2200 градусов Цельсия.
Для чего используется карбид кальция
Карбид кальция используется для ряда целей, в том числе:
Производство газообразного ацетилена
различные химические вещества, такие как уксусная кислота, этилен и другие полимеры. Газообразный ацетилен также используется в качестве топлива в сварочных и газовых горелках, а также в производстве некоторых видов пластмасс.Восстановитель
Карбид кальция используется в качестве восстановителя при производстве некоторых металлов, таких как алюминий, титан и цирконий. Он также используется в производстве железа и стали.
Осушитель
Карбид кальция используется в качестве осушителя для удаления влаги из воздуха и газов. Он часто используется в производстве электронных устройств для предотвращения повреждений от влаги.
Взрывчатые вещества и фейерверки
Карбид кальция используется в производстве взрывчатых веществ и фейерверков. При взаимодействии с водой образуется газообразный ацетилен, который можно использовать в качестве горючего в пиротехнических смесях.
Средство для созревания
Карбид кальция используется в качестве средства для созревания фруктов. Его часто используют для ускорения процесса созревания бананов, манго и других фруктов.
Другое применение
Карбид кальция также используется в производстве инсектицидов, пестицидов и гербицидов, а также в производстве некоторых видов каучука. Он также используется в качестве флюса при производстве некоторых видов стекла.
Размер рынка карбида кальция
Трудно точно определить объем рынка карбида кальция, поскольку он зависит от различных факторов, таких как мировой спрос на химикаты и другие продукты, содержащие карбид кальция, доступность и цена сырья, а также региональные различия в производстве. и потребление. Однако карбид кальция является широко используемым химическим веществом, и рынок этого соединения, вероятно, будет довольно большим.
Согласно отчету Mordor Intelligence, мировой рынок карбида кальция в 2020 году оценивался примерно в 2,7 миллиарда долларов, и ожидается, что в период с 2021 по 2026 год совокупный годовой темп роста составит 5,3%. спрос на газообразный ацетилен, который является основным конечным продуктом карбида кальция, является основным фактором роста рынка. Другие факторы, способствующие росту рынка карбида кальция, включают растущий спрос на металлы и сталь, а также растущее использование карбида кальция в качестве осушителя и агента созревания.
спрос на газообразный ацетилен, который является основным конечным продуктом карбида кальция, является основным фактором роста рынка. Другие факторы, способствующие росту рынка карбида кальция, включают растущий спрос на металлы и сталь, а также растущее использование карбида кальция в качестве осушителя и агента созревания.
Согласно https://oec.world/ :
Карбид кальция является 3531-м самым продаваемым продуктом в мире.
В 2020 году крупнейшими экспортерами карбида кальция были Китай (68,8 млн долларов), Словакия (40,6 млн долларов), Австрия (18 млн долларов), Казахстан (16,5 млн долларов) и Германия (11,4 млн долларов).
В 2020 г. крупнейшими импортерами карбида кальция были Индия (23,1 млн долл. США), Франция (16 млн долл. США), Россия (15,7 млн долл. США), Германия (10,9 млн долл. США) и Канада (9 долл. США)..52М).
Дополнительная информация
- Википедия для общей информации, информации об истории, производстве и использовании
- PubChem для информации о химии и собственности
карбид кальция
- Главная
- Результаты для “карбид кальция”
| ID | КАС | Имя | Синонимы | Молекулярная формула | Категория |
|---|---|---|---|---|---|
| 1 | 75-20-7 | Карбид кальция | Карбид кальция карбокальцико Кристалл кварца 9049 Карбид кальция0149 carburedecalcium calcium acetylide calcium ethynediide calciumcarbide(cac2) carburedecalcium(french) Calcium Carbide , 10-40 Mesh Calcium Carbide, Anhydrous Calciumcarbidemetallurggradegreylumpsmm | C2Ca | Carbides;Ceramics;Inorganics;Inorganic salt;Non металлический минерал; наука о металлах и керамике; неорганическая химическая инженерия; неорганическое химическое сырье |
| ID | КАС | Название продукта | Поставщики | Описания |
|---|---|---|---|---|
| 1 | 75-20-7 | Calcium carbide Main Product | Shanghai Macklin Biochemical Co. Package:250g | |
| 2 | ||||
| 2 | ||||
| 2 | ||||
| 2 | ||||
| 2 | ||||
| 2 | ||||
| 3 | 75-20-7 | Основной продукт карбида кальция | Shanghai Macklin Biochemical Co., Ltd Premium Suppliers : 250G | |
| 4 | 75-20-7 | Calcium carbide Main Product | Shanghai Macklin Биокемикал Ко, ООО Поставщики премиум-класса Пакет : 50G |


 , Ltd
, Ltd