Какая температура плавления меди и серы: Агрегатное состояние Меди в цвет меди запах меди плотность меди растворимость в воде меди теплопро…
alexxlab | 01.04.2023 | 0 | Разное
Агрегатное состояние меди и серы. Цвет меди и серы. Запах меди и серы если есть. Плотность меди и
ArinaSubbotina2002 ArinaSubbotina2002
- Химия
- 5 – 9 классы
ответ дан • проверенный экспертом
Ursun Ursun
Оба твердые, оба не имеют запаха.
Сера желтого цвета, медь темно-оранжевого.
Плотность серы 2,070 г/см³, плотность меди 8,92 г/см³
Ни сера, ни медь не растворяются в воде.
Теплопроводность серы низкая, у меди высокая
Электричество сера проводит плохо, медь очень хорошо
t плавления меди 1083 С, кипения 2567 С
t плавления серы 112 С, кипения 444 С
Новые вопросы в Химия
1. Заповніть таблицю.
Хід роботи
Назва і порядок виконання досліду
Спостереження, рівняння реакції і висновок
I. Добування кисню каталітичним розклад
…
анням гідроген пероксиду з використанням сирого м’яса 1.
 Що спостерігаємо? ______________________________________________ Добування кисню з гідроген пероксиду каталітичним розкладанням h3O2 → ________________________ Про перебіг хімічної реакції свідчить _____________ ______________________________________________
IV. Доведення наявності кисню
Через 30 секунд після початку реакції піднесіть до отвору пробірку тліючу скіпку.
Що спостерігаємо? ______________________________________________ Напишіть рівняння горіння деревини. ______________________________________________ Наявність кисню в пробірці доводять _____________ __________________________________________
Що спостерігаємо? ______________________________________________ Добування кисню з гідроген пероксиду каталітичним розкладанням h3O2 → ________________________ Про перебіг хімічної реакції свідчить _____________ ______________________________________________
IV. Доведення наявності кисню
Через 30 секунд після початку реакції піднесіть до отвору пробірку тліючу скіпку.
Що спостерігаємо? ______________________________________________ Напишіть рівняння горіння деревини. ______________________________________________ Наявність кисню в пробірці доводять _____________ __________________________________________СРОЧНО ДАЮ 100 БАЛОВ. При взаимодействии аммиака объемом 33,6л (при н. у.) образовался фосфат аммония массой 74,5г. Определите, какую массовую долю со … ставляет этот выход от теоретического.
СРОЧНО ДАМ 100 БАЛОВ. Укажите, каким каким реактивом можно определить каждое из веществ в раствор Na3PO4, HCl, NaOH.
СРОЧНОО ДАЮ 100 БАЛОВ. Запишите взаимодействия разбавленной оксидом алюминия и сульфитом полном и кратком ионном виде. уравнения реакций серной кислот
…
ы с калия в молекулярном,полном и кратким ионном виде
уравнения реакций серной кислот
…
ы с калия в молекулярном,полном и кратким ионном виде
розкладання крейди утворюється вапно та вуглукислий газ який процес відбувається чи може він протікати за звичайних умов
Предыдущий
Следующий
Красноломкость металлов
МенюАвтономная газификация — Общее — Газгольдер — Групповые баллонные установки — Отопление домаТехнические газы — Общее – Технические газы — Аргон — Кислород — Азот — Ацетилен — Гелий — УглекислотаСварочная смесь — Общее – Сварочная смесь — Заправка сварочной смеси — Сварочные смеси — Полезное (сварочная смесь)Оборудование — Горелки — Редукторы — Резаки — Сварочные аппараты — Клапаны — ОгнетушителиПищевые газовые смеси — Общее – Пищевые смеси — Пивной газО компании — Контактная информация — Лаборатория Промтехгаз — Освидетельствование баллоновТерминология
Красноломкость — это свойство некоторых металлов проявлять хрупкость при обработке давлением на повышенных температурах.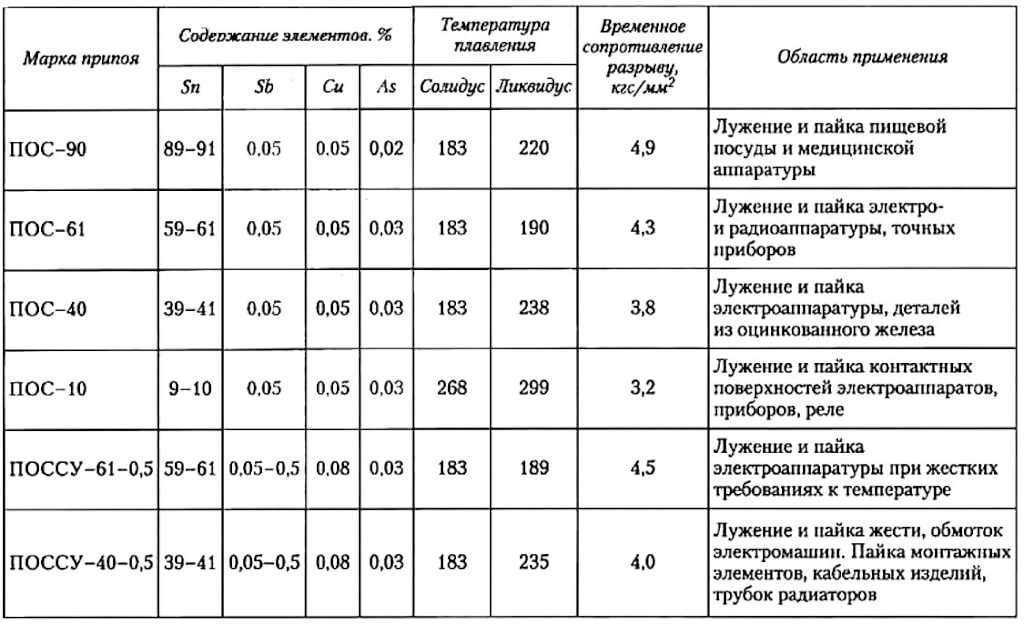 Красноломкость обусловливается главным образом распределением некоторых примесей (меди, серы) по границам зёрен металла.
Красноломкость обусловливается главным образом распределением некоторых примесей (меди, серы) по границам зёрен металла.
В качестве примера можно рассмотреть стали. Содержание серы в сталях промышленных марок составляет обычно 0.015-0.050 %. Сера образует с железом легкоплавкое соединение FеS, обычно располагающееся вокруг зерен, закристаллизовавшихся ранее. При горячей механической обработке (ковка, прокатка) FeS плавится, что вызывает потерю связи между зернами стали, и изделие разваливается на части. Всему виной красноломкость.
Таким образом, одним из основных механизмов красноломкости является образование на границах зерен фаз, плавящихся при температурах обработки давлением (850- 1200° С). Температура плавления меди составляет всего 1084° С, ее сульфида – 1100° С, образование других легкоплавких медесодержащих фаз в стали маловероятно.
При комнатной и близких к ней температурах включения сульфидов понижают механические свойства стали, характеризующие пластичность (относительные сужение и удлинение) и ударную вязкость.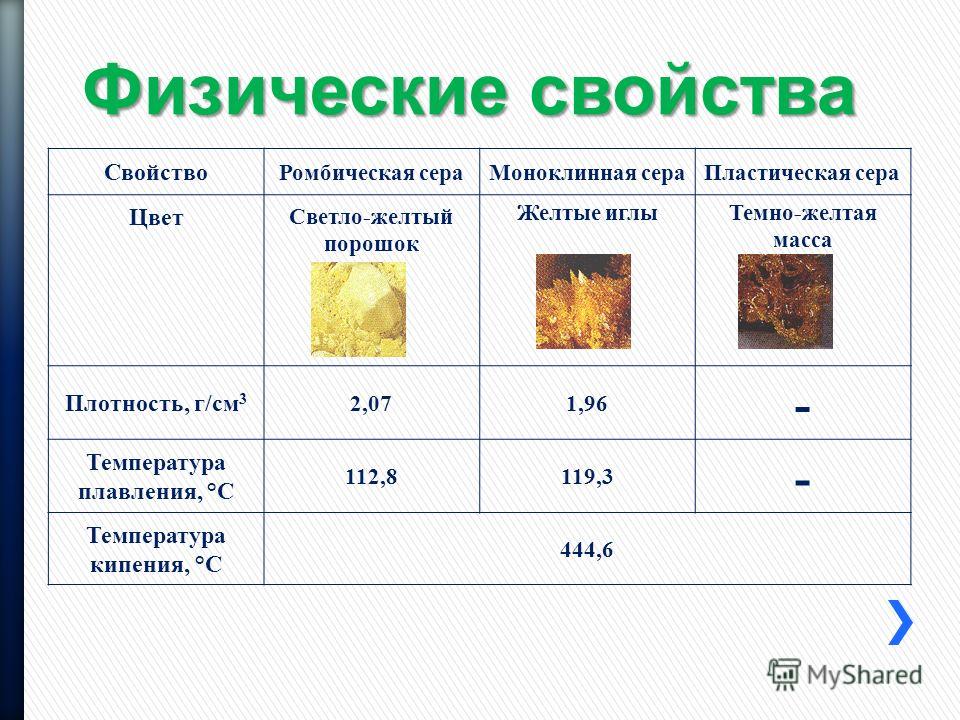 В литом металле это влияние может проявляться во всех направлениях. В катаных или кованых стальных изделиях, где сульфидные включения вытянуты в виде строчек в направлении горячей пластической деформации, отрицательное влияние серы в стали проявляется лишь в направлении, поперечном к линии вытяжки в процессе этой деформации.
В литом металле это влияние может проявляться во всех направлениях. В катаных или кованых стальных изделиях, где сульфидные включения вытянуты в виде строчек в направлении горячей пластической деформации, отрицательное влияние серы в стали проявляется лишь в направлении, поперечном к линии вытяжки в процессе этой деформации.
О противоположном явлении вы можете узнать по ссылке – хладноломкость.
Для предотвращения красноломкости в перлитные стали добавляют марганец. Он заметно повышает прочность металла, практически не снижает пластичность, резко уменьшает красноломкость и негативное влияние серы. Сера при этом находится в материале в виде тугоплавкого сернистого марганца MnS (температура плавления 1620° С).
Для этих же целей в состав аустенитной стали добавляют молибден.
Для технически чистого железа температура красноломкости находится в пределах 850— 1150°, поэтому горячую деформацию следует начинать при 850° либо производить при 1250—1300°, прерывая ее при охлаждении железа в интервале 850—1150°.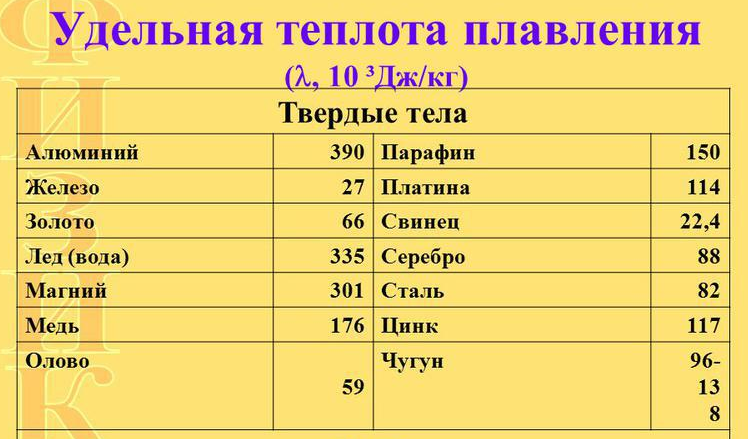
На красноломкость также влияют алюминий, титан, цирконий, кальций, магний и редкие элементы, способствующие образованию тугоплавких сульфидов, располагающихся в структуре стали в виде цепочек или отдельных включений. Следует иметь в виду, что низкоплавкие сульфиды располагаются, как правило, по границам зерен, вызывая красноломкость стали.
Практикой металлургического производства установлено, что отношение концентраций марганца и серы, необходимое для получения высокой технологической пластичности металла, обеспечивающей горячую обработку давлением без возникновения красноломкости, равно 10—20 для стали с содержанием серы до 0,05%.
Что такое сульфид меди (Cu2S), Cas No 22205-45-4 Руководство
Описание
Сульфид меди(I), Cu2S, [22205-45-4], молекулярная масса 159,15, встречается в природе в виде синего или серого минерала халькозин, [21112-20-9]. Сульфид меди(I) или медный глянец нерастворим в воде, но разлагается в азотной кислоте и концентрированной серной кислоте.
Сульфид меди(I) получают нагреванием смесей меди и серы в атмосфере водорода или осаждением раствора аммиачной соли меди(II) сероводородом или сульфидами щелочных металлов. Используется в смазочных материалах, солнечных элементах, полуфабрикатах
Basic Attributes
Molecular Weight:
159.16
Exact Mass:
157.831268
EC Number:
244-842-9
Characteristics
XLogP3:
0.64320
Appearance:
Black powder
Плотность:
5,6 г/мл при 25ºC (лит.)
Температура плавления:
1100 °C
Растворимость в воде:
Слабо растворим в соляной кислоте. Нерастворим в воде.
Характеристики воспламеняемости:
Негорючий; выделяет токсичные медьсодержащие пары оксида серы при пожаре -40
инструкции по технике безопасности:
7-22-36/37/39
Номер RTECS:
GL8910000
Особенности хранения:
Склад низкотемпературный, вентилируемый, сухой
Меры предосторожности:
P273, P501
Краткая характеристика опасности:
h513
Использование и производство
В светящихся красках; в электродах для термоэлементов; при получении CuSO4; в твердосмазочных композициях; как катализатор.
Узнать больше Другие химические вещества
Что такое 5-ацетил-5H-[1,2,4]триазино[5,6-b]индол-3-ил 2-(4-морфолинил)этилсульфид
1019010-90-2
Что такое гексановая кислота, 2-этил-, медная соль, компд. с (1R,4aS,10aR)-1,2,3,4,4a,9,10,10a-октагидро-1,4a-диметил-7-(1-метилэтил)-1-фенантренметанамином (2:?:1 )
53404-24-3
Что такое ЭТИЛИЗОБУТИЛСУЛЬФИД
1613-45-2
Что такое Этанол, 2,2′-иминобис-, продукты реакции с сероводородом
68855-33-4
68909-89-7
Что такое БЕНЗИЛ-4-БРОМФЕНИЛСУЛЬФИД
53136-21-3
Что такое 2,4-дихлорбензил 4-(2-фурилметил)-5-(2-пиразинил)-4H-1,2,4-триазол-3-илсульфид
676459-22-6
Что такое 4-хлорбензил-6,7-дигидро-5Н-пирроло[1,2-а]имидазол-2-илсульфид
352553-74-3
Что такое сульфид таллия (Tl2S3)
12039-17-7
Что такое сульфид оксида гадолиния
37265-36-4
- Горячие запросы
- триэтаноламин
- что такое барий
- диметилртуть
- 1 хлорбутан
- шентай
- 3-метил-1-бутанол
Энтальпии теплоемкости меди и сульфидов меди
Содержание
Настоящее исследование низкотемпературной теплоемкости и высокотемпературной энтальпии синтетических сульфидов меди и сульфидов меди является одним из серии термодинамических исследований, проведенных Горным бюро по металлургически важным соединениям меди.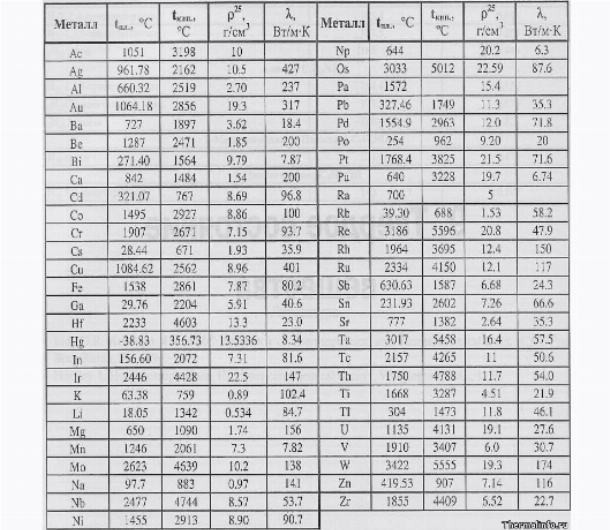 . Несмотря на важность меди и сульфидов меди в переработке меди, термодинамические данные для этих веществ либо неполны, либо недостаточны. Такие термодинамические свойства необходимы для более эффективного извлечения меди из сульфидных руд обжигом, а также для контроля загрязняющих веществ оксидов серы, образующихся в процессе обжига. Таким образом, термодинамические данные будут способствовать максимальной производительности и минимальным энергозатратам при переработке меди и родственных веществ.
. Несмотря на важность меди и сульфидов меди в переработке меди, термодинамические данные для этих веществ либо неполны, либо недостаточны. Такие термодинамические свойства необходимы для более эффективного извлечения меди из сульфидных руд обжигом, а также для контроля загрязняющих веществ оксидов серы, образующихся в процессе обжига. Таким образом, термодинамические данные будут способствовать максимальной производительности и минимальным энергозатратам при переработке меди и родственных веществ.
В этом исследовании низкотемпературные теплоемкости измерялись адиабатическим калориметром, а высокотемпературные энтальпии – капельным калориметром с медным блоком. Результаты этих калориметров были объединены с теплотой образования при 298,15 К из литературы, чтобы получить табличные значения основных термодинамических свойств для сульфида меди (Cu2S) и сульфида меди (CuS).
Это исследование CuS (ковеллита) было предпринято: (1) для увеличения низкотемпературной теплоемкости Андерсона ниже 56 до почти 0 К и (2) для измерения высокотемпературных энтальпий.
Термодинамические исследования Cu2S (халькоцит) были предприняты: (1) чтобы расширить низкотемпературные данные Андерсона ниже 56 до почти 0 K; (2) расширить значения теплоемкости, указанные Кубашевским, Йостом и Кубашевским, выше 823 К; (3) для измерения высокотемпературных энтальпий, поскольку значения, рассчитанные Келли от 350 до 1400 К, были основаны на неполных и разрозненных данных, сообщенных Беллати и Луссаной в 1888-89 гг. для температуры между 273 и 463 К, Борнеманном и Хенгстенбергом в 1920 для диапазона от 273 до 1373 К и Уайтом в 1933 г. для диапазона от 303 до 1173 К; и для измерения энтальпий жидкого состояния.
Настоящим исследованием установлена температура перехода 720 К для Cu2S, что заметно отличается от 623 К, рассчитанных Келли по приведенным ранее разрозненным данным исследователей. Температуры перехода 376, 720 и 1400 К Cu2S из настоящего исследования согласуются с фазовыми равновесиями и термодинамическими исследованиями, представленными в ссылках, перечисленных ниже.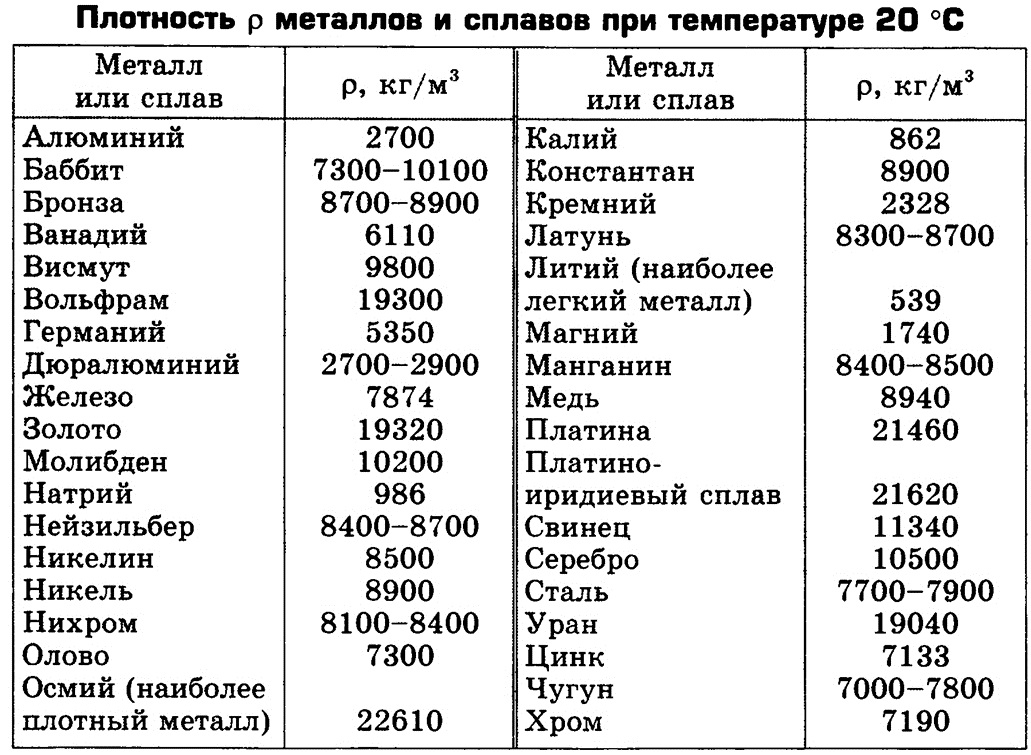 В связи с тем, что подобным исследованиям сульфидов меди в последние годы уделяется значительное внимание ученых различных специальностей, публикации, касающиеся фазовых переходов, широко рассеяны в литературе различных направлений. Хотя перечисление всех авторов, работавших над Cu2S и CuS, выходит за рамки данной статьи, список некоторых публикаций дает руководство по поиску первоначальных исследователей. Это Кинг, Мах и Панкрац, Крейг и Скотт, Роузбум, Юнд и Куллеруд, Хансен и Андерко, а также дополнения к последнему, сделанные Эллиоттом и Шанком.
В связи с тем, что подобным исследованиям сульфидов меди в последние годы уделяется значительное внимание ученых различных специальностей, публикации, касающиеся фазовых переходов, широко рассеяны в литературе различных направлений. Хотя перечисление всех авторов, работавших над Cu2S и CuS, выходит за рамки данной статьи, список некоторых публикаций дает руководство по поиску первоначальных исследователей. Это Кинг, Мах и Панкрац, Крейг и Скотт, Роузбум, Юнд и Куллеруд, Хансен и Андерко, а также дополнения к последнему, сделанные Эллиоттом и Шанком.
В недавних исследованиях термодинамических свойств соединений меди, проведенных Горным бюро, Стьюв, Ричардсон и Кинг измерили низкотемпературную теплоемкость и стандартную энтальпию образования оксисульфата меди; Ко и Ричардсон сообщили о стандартных энтальпиях образования бромидов меди и меди; Ричардсон и Браун определили энтальпию образования малахита; Ферранте измерил высокотемпературные энтальпии сульфата и оксисульфата меди; Тейлор, Браун и Тейлор получили теплоту образования и низкотемпературную теплоемкость цианида меди; Панкратц и Кинг исследовали энтальпии выше 29.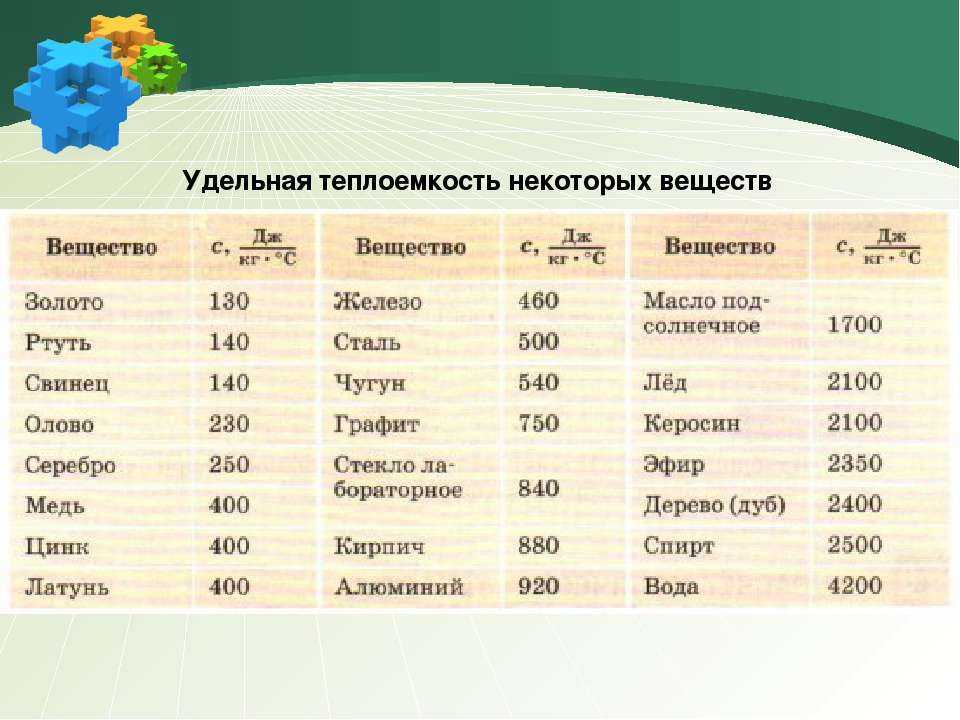 8,15 К для халькопирита и борнита; Мах, Панкрац, Веллер и Кинг представили теплоемкости, энтальпии, энтальпии образования и энергии Гиббса образования для оксидов меди и меди; Адами и Кинг сообщили о теплоте образования безводного сульфата меди; Веллер измерил низкотемпературную теплоемкость безводного сульфата меди; Барани, Панкрац и Веллер исследовали низкотемпературную теплоемкость, высокотемпературную энтальпию и стандартную энтальпию образования медных и медных ферритов. Кроме того, монография о термодинамических свойствах меди и ее неорганических соединений была составлена Кингом, Ма и Панкрацем.
8,15 К для халькопирита и борнита; Мах, Панкрац, Веллер и Кинг представили теплоемкости, энтальпии, энтальпии образования и энергии Гиббса образования для оксидов меди и меди; Адами и Кинг сообщили о теплоте образования безводного сульфата меди; Веллер измерил низкотемпературную теплоемкость безводного сульфата меди; Барани, Панкрац и Веллер исследовали низкотемпературную теплоемкость, высокотемпературную энтальпию и стандартную энтальпию образования медных и медных ферритов. Кроме того, монография о термодинамических свойствах меди и ее неорганических соединений была составлена Кингом, Ма и Панкрацем.
Материалы
Синтетический Cu2S был приготовлен реакцией меди с соответствующим количеством сублимированной серы. Медь была свежеприготовлена в виде порошка путем превращения пластины чистотой 99,999% в порошок оксида меди с последующим восстановлением водородом при 800°С. Медь и сера были запечатаны в вакуумированную колбу Vycor и нагревались при 285°С в течение 1 день и 685°С в течение 5 дней. Этот продукт измельчали, просеивали, анализировали и корректировали по составу. Затем повторялся тот же цикл нагревания. Химический анализ образца показал 790,79% меди и 20,20% серы по сравнению с теоретическими 79,85% меди и 20,15% серы. Оптическая эмиссионная спектроскопия показала, что образец содержал менее 0,01% металлических примесей. Рентгеновская дифрактограмма продукта совпадала с той, что приведена в Каталоге порошковых рентгеновских данных ASTM для орто-гомбического Cu2S, который, как недавно показал Эванс, на самом деле имеет сложную моноклинную структуру.
Этот продукт измельчали, просеивали, анализировали и корректировали по составу. Затем повторялся тот же цикл нагревания. Химический анализ образца показал 790,79% меди и 20,20% серы по сравнению с теоретическими 79,85% меди и 20,15% серы. Оптическая эмиссионная спектроскопия показала, что образец содержал менее 0,01% металлических примесей. Рентгеновская дифрактограмма продукта совпадала с той, что приведена в Каталоге порошковых рентгеновских данных ASTM для орто-гомбического Cu2S, который, как недавно показал Эванс, на самом деле имеет сложную моноклинную структуру.
Синтетический CuS готовили так же, как описано для Cu2S, за исключением циклов нагревания. Реагенты нагревали при 285°С в течение 1 сут, при 500°С в течение 2 сут и при 400°С в течение 6 сут. После анализов корректировали состав продукта и повторяли тот же цикл нагревания. Окончательный химический анализ показал 66,43% меди и 33,50% серы по сравнению с теоретическими 66,46% меди и 33,54% серы. Металлических примесей методом оптической эмиссионной спектроскопии обнаружено не было. Рентгеновская дифрактограмма соответствовала приведенной в каталоге ASTM для гексагонального CuS.
Рентгеновская дифрактограмма соответствовала приведенной в каталоге ASTM для гексагонального CuS.
Экспериментальная работа и результаты
Результаты измерений калориметрических исследований выражены в терминах термохимической калорийности (1 калория = 4,1840 Дж). Температуры относятся к Международной практической температурной шкале 1968 года. Взвешивания были скорректированы на вакуум. В Таблице атомных весов 1973 г. указана молекулярная масса 159,152 для Cu2S и 95,606 для CuS.
Низкотемпературная теплоемкостьИзмерения теплоемкости образцов проводились в диапазоне от 5 до 310 К с помощью адиабатического калориметра, описанного Стьювом, Ричардсоном и Кингом. Температуры образцов в диапазоне от 16 до 310 К измерялись платиновым
термометр, калиброванный Национальным бюро стандартов. Температуры ниже 16 К измерялись калиброванным германиевым термометром. Изменения температуры в калориметре до ±0,0001 К определялись потенциометрически.
Калориметр имеет медный сосуд для проб вместимостью 90 мл, который был заполнен пробой массой 272,781 г Cu2S или 109,468 г CuS. После вакуумирования сосуда его снова заполнили примерно 5,4 х 10 -5 моль газообразного гелия для лучшего теплообмена с порошкообразным образцом. Экспериментальные измерения теплоемкости для обоих сульфидов перечислены в таблице 1 и показаны графически на рисунке 1. Общая неопределенность измерений для любого соединения оценивается как ±5 % ниже 10 K, ±1 % от 10 до 30 K, ±0,1 % от 30 до 310 К. Измерения для Cu2S в целом имели меньшие отклонения от гладкой кривой, чем для CuS. Измеренная теплоемкость Cu2S была плавной функцией температуры, тогда как теплоемкость CuS имела очень небольшой скачок около 48–52 К. Никаких переходов не наблюдалось ни с одним из сульфидов в измеренном диапазоне температур.
Теплоемкость сульфидов была экстраполирована до 0 К путем построения графика зависимости Cp/T от T2. Эти экстраполированные данные и экспериментальные значения были компьютерно аппроксимированы гладкими кривыми полиномиальными функциями.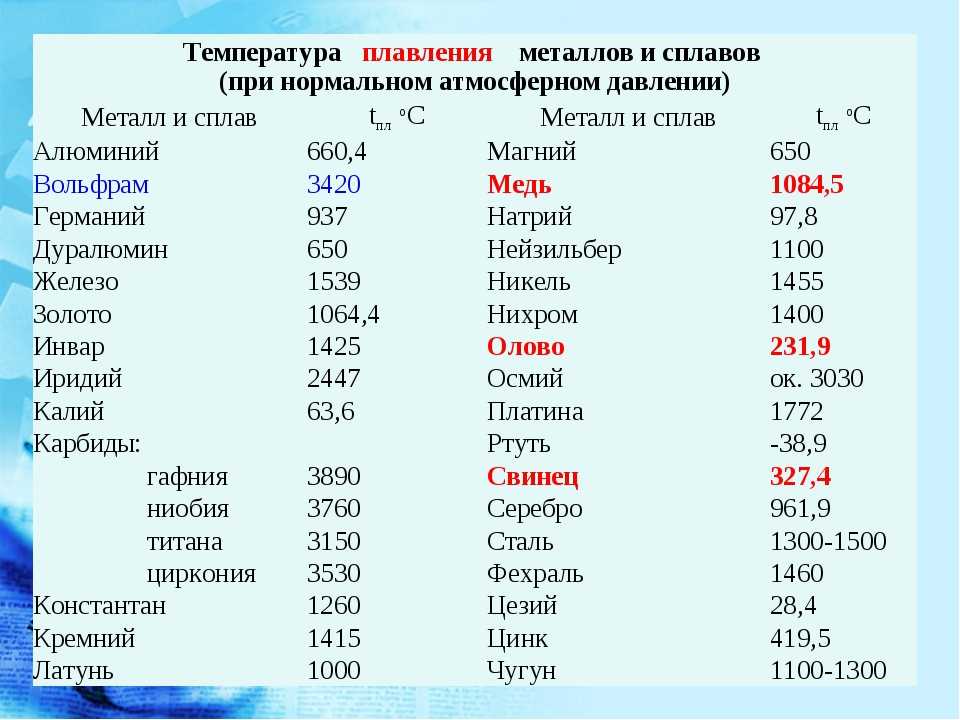 Затем эти функции использовались для расчета гладких теплоемкостей и соответствующих термодинамических величин при выбранных температурах, показанных в таблицах 2-3.
Затем эти функции использовались для расчета гладких теплоемкостей и соответствующих термодинамических величин при выбранных температурах, показанных в таблицах 2-3.
Энтальпии выше 298,15 К измерялись с помощью капельного калориметра, описанного Дугласом и Кингом. Этот калориметр с изотермической рубашкой имеет медный блок с теплоемкостью примерно 1,51 ккал/град. Термометр сопротивления был намотан на медный блок и имел перенесенный мостовой тип, описанный Майером. Устройство было модифицировано, чтобы включить более чувствительный потенциометр и систему нулевого детектора. Эта система может разрешать изменения температуры, эквивалентные ±0,00005 К. Температура образца в печи измерялась с помощью термопары платина-10% родий-платина, которая была откалибрована по температуре плавления чистого золота. До и после измерения энтальпии вещества калориметр калибровали электрически и всю аппаратуру проверяли измерением энтальпии чистого оксида магния (периклаз). Масса образца плюс контейнер периодически проверялась на постоянство во время экспериментальных измерений.
Масса образца плюс контейнер периодически проверялась на постоянство во время экспериментальных измерений.
Контейнеры для образцов для экспериментальных измерений представляли собой капсулы из чистого кварцевого стекла; энтальпии для пустых капсул измерялись в отдельных экспериментах. Капсулы заполняли порошкообразными образцами, вакуумировали и герметизировали пламенем, а часть капсулы, содержащую образец, погружали в ледяную воду. Масса образца CuS составила 7,79049 г. Массы образцов для Cu2S составили 7,82646, 7,80144, 8,17838 и 8,84168 г. Дополнительные образцы Cu2S были необходимы для установления кривой энтальпийной функции в жидком состоянии, т. е. выше 1400 К, поскольку стеклянные ампулы в калориметре растрескивались при измерениях выше температуры плавления.
Экспериментальные энтальпии относительно 298,15 К для сульфидов меди и меди приведены в таблице 4. Для получения наилучшего соответствия гладких кривых этим данным значения были аппроксимированы полиномиальными функциями с помощью компьютера.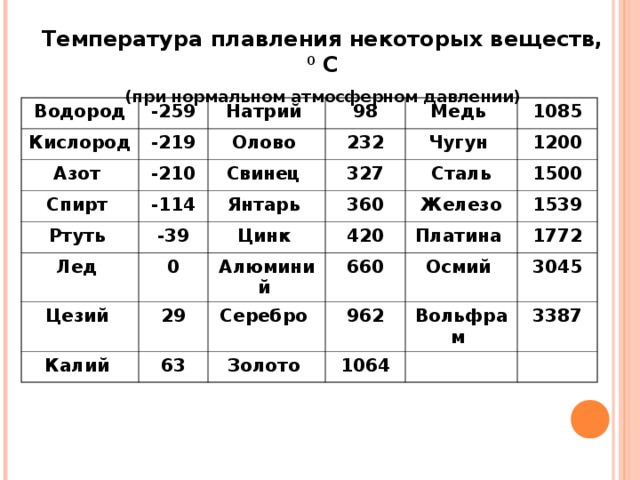 . Во время этой процедуры были предприняты меры для плавного объединения высокотемпературных энтальпий с низкотемпературными данными, приведенными в предыдущем разделе. Затем полиномиальные функции использовались для расчета гладких значений энтальпий и связанных с ними свойств теплоемкости, энтропии и функций энергии Гиббса выше 298,15 К. Эти термодинамические величины приведены в таблицах 5-6 для выбранных температурных интервалов. Значения при 298,15 и 300 К взяты из низкотемпературных данных. Энтальпии больше 10 и меньше 50 ккал/моль округляли до 0,005 единицы. Экстраполяция значений CuS до 780 K из последнего достоверного экспериментального измерения при 740,9 была основана на разумных проекциях гладких значений. Постоянство данных по теплоемкости в жидком состоянии Cu2S позволило экстраполировать данные до 1600 К от последнего достоверного измерения 15090,3 K. Стандартная погрешность измерения составляла 0,1% для CuS и 0,2% или меньше для Cu2S. Последнее исключает 0,9 % для трех измерений ниже перехода 376 К, где точность измерений значительно меньше, чем при температуре выше 400 К.
. Во время этой процедуры были предприняты меры для плавного объединения высокотемпературных энтальпий с низкотемпературными данными, приведенными в предыдущем разделе. Затем полиномиальные функции использовались для расчета гладких значений энтальпий и связанных с ними свойств теплоемкости, энтропии и функций энергии Гиббса выше 298,15 К. Эти термодинамические величины приведены в таблицах 5-6 для выбранных температурных интервалов. Значения при 298,15 и 300 К взяты из низкотемпературных данных. Энтальпии больше 10 и меньше 50 ккал/моль округляли до 0,005 единицы. Экстраполяция значений CuS до 780 K из последнего достоверного экспериментального измерения при 740,9 была основана на разумных проекциях гладких значений. Постоянство данных по теплоемкости в жидком состоянии Cu2S позволило экстраполировать данные до 1600 К от последнего достоверного измерения 15090,3 K. Стандартная погрешность измерения составляла 0,1% для CuS и 0,2% или меньше для Cu2S. Последнее исключает 0,9 % для трех измерений ниже перехода 376 К, где точность измерений значительно меньше, чем при температуре выше 400 К.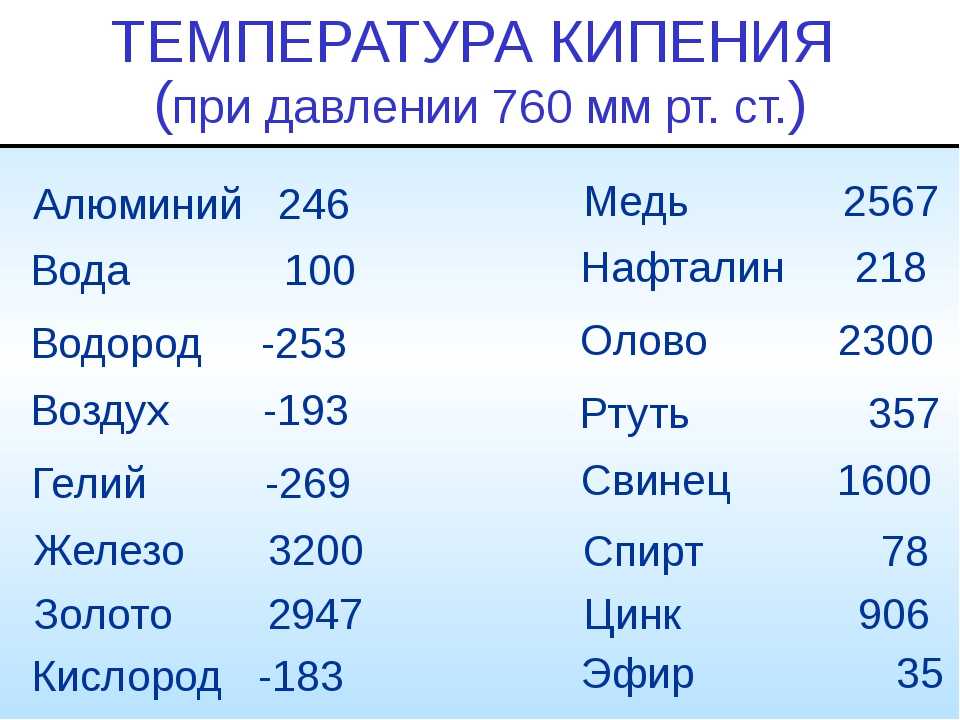 Оценки энтальпий в таблицах 5-6 имеют абсолютную погрешность около ±0,4 %.
Оценки энтальпий в таблицах 5-6 имеют абсолютную погрешность около ±0,4 %.
Примечание. -Значения в скобках являются экстраполяцией.
В дополнение к перечислению значений энтальпии в таблицах 4-6 для Cu2S и CuS, эти данные показаны графически на рисунке 2 как (H°-H°298)/(Т-298.15) в зависимости от температуры. Это выражение представляет собой среднюю теплоемкость и поэтому выражается в кал/градус моль. Хотя при объединении высокотемпературных и низкотемпературных данных непрерывность была установлена вплоть до 260 К, кривые на рис. 2 были расширены только до низкотемпературного значения 300 К.
Кривая средней теплоемкости для CuS на рис. 2 имеет закономерный ход от 300 до 780 К. Разложение CuS проявлялось аномально высоким тепловым эффектом, эквивалентным 1,7% выше кривой для экспериментального измерения при 7790,4 K, и глобулярной серой, появляющейся на внутренней стенке стеклянной капсулы. Разложение было также подтверждено рентгеноструктурным анализом содержимого капсулы, который показал, что образец содержал небольшое количество дигенита (Cu1,8S) и серы, помимо CuS. Однако небольшое количество разложения, вероятно, имело место в последнем зарегистрированном измерении при 760,8 К. Это измерение было на 0,4 % выше кривой, тогда как предыдущие семь измерений в температурном диапазоне 123 К отличались от кривой только на 0,04 % или менее. Разложенный образец рекомбинирует с образованием CuS после нагревания примерно до 725 К в течение 2 часов в герметичной капсуле. Затем оказалось возможным воспроизвести значения энтальпии, ранее полученные при более низких температурах. Для проверки фазовой стабильности ниже 780 К отдельные образцы охлаждали от 600 и 700 К до 298 К в калориметре таким же образом, как и при энтальпийных измерениях, а затем подвергают рентгеноструктурному анализу. В обоих случаях дифрактограммы соответствовали картинам исходного материала для гексагональной формы CuS при комнатной температуре.
Однако небольшое количество разложения, вероятно, имело место в последнем зарегистрированном измерении при 760,8 К. Это измерение было на 0,4 % выше кривой, тогда как предыдущие семь измерений в температурном диапазоне 123 К отличались от кривой только на 0,04 % или менее. Разложенный образец рекомбинирует с образованием CuS после нагревания примерно до 725 К в течение 2 часов в герметичной капсуле. Затем оказалось возможным воспроизвести значения энтальпии, ранее полученные при более низких температурах. Для проверки фазовой стабильности ниже 780 К отдельные образцы охлаждали от 600 и 700 К до 298 К в калориметре таким же образом, как и при энтальпийных измерениях, а затем подвергают рентгеноструктурному анализу. В обоих случаях дифрактограммы соответствовали картинам исходного материала для гексагональной формы CuS при комнатной температуре.
Сложное термическое поведение Cu2S показано тремя обратимыми переходами на рис. 2. Переходы твердое тело-твердое были обнаружены при 376 и 720 К с изотермическим поглощением тепла 0,865 и 0,280 ккал/моль. Над каждым из этих переходов данные по теплоемкости таблицы 5, полученные из энтальпий, показывают довольно необычное поведение уменьшающихся значений с
Над каждым из этих переходов данные по теплоемкости таблицы 5, полученные из энтальпий, показывают довольно необычное поведение уменьшающихся значений с
повышение температуры. Измерения энтальпии, проведенные выше, а затем ниже переходов при 376 и 720 К, подтвердили обратимость фазовых переходов, вновь оказавшись на кривой средней теплоемкости. Третий переход из твердого состояния в жидкое был обнаружен при температуре около 1400 К с теплотой плавления 3,070 ккал/моль. Быстрая обратимость фазовых переходов была подтверждена охлаждением отдельных образцов от температур выше трех переходов 376, 720 и 1400 К до 298 K в калориметре при тех же условиях, что и для измерения энтальпии, а затем в течение нескольких минут подвергают эти образцы рентгеноструктурному анализу. Такие испытания проводились примерно при 600, 1000 и 1500 К. Было проведено дополнительное испытание примерно при 350 К, чтобы нагреть образец ниже перехода при 376 К. Все образцы вернулись к стабильной эталонной форме моноклинного Cu2S, и ни один форма выявляется рентгенологически. Повторный анализ тех же образцов через 2 месяца не выявил структурных изменений. Эта тщательная программа была соблюдена, чтобы убедиться, что после закалки в калориметре форма при комнатной температуре была такой же, как и у каждой формы, обнаруженной в этом исследовании, и чтобы гарантировать отсутствие очень медленных переходов при комнатной температуре. Закалка из жидкого состояния, в частности, вызывала подозрения ввиду малой измеренной теплоты плавления 3,070 ккал/моль. Рентгеноструктурным анализом образцов, использованных для измерения энтальпии, была обнаружена только комнатная форма моноклинной формы Cu2S.
Повторный анализ тех же образцов через 2 месяца не выявил структурных изменений. Эта тщательная программа была соблюдена, чтобы убедиться, что после закалки в калориметре форма при комнатной температуре была такой же, как и у каждой формы, обнаруженной в этом исследовании, и чтобы гарантировать отсутствие очень медленных переходов при комнатной температуре. Закалка из жидкого состояния, в частности, вызывала подозрения ввиду малой измеренной теплоты плавления 3,070 ккал/моль. Рентгеноструктурным анализом образцов, использованных для измерения энтальпии, была обнаружена только комнатная форма моноклинной формы Cu2S.
Переход при 720 К для Cu2S был установлен 12 измерениями энтальпии, выполненными в пределах 34° от температуры перехода. На рис. 2 и в табл. 4 показаны результаты четырех измерений, расположенных вдоль линии изотермического перехода в пределах 1° от перехода при 720 К. Эта температура перехода была первоначально определена из измерений энтальпии при минимальном времени пребывания в печи 1,5 часа. Для подтверждения температуры перехода были проведены дополнительные измерения с временем пребывания, намного превышающим минимальное. Измерения со временем пребывания в 11–46 раз больше, чем минимальные установленные энтальпии ниже, в и выше точки перехода при температурах 700,5 (17 часов), 720,5 (19ч), 720,9 (43 ч), 727,1 (69 ч) и 740,6 К (21 ч).
Для подтверждения температуры перехода были проведены дополнительные измерения с временем пребывания, намного превышающим минимальное. Измерения со временем пребывания в 11–46 раз больше, чем минимальные установленные энтальпии ниже, в и выше точки перехода при температурах 700,5 (17 часов), 720,5 (19ч), 720,9 (43 ч), 727,1 (69 ч) и 740,6 К (21 ч).
Измерения энтальпии Cu2S выше точки плавления 1400 К привели к растрескиванию капсул из кварцевого стекла. Это растрескивание было вызвано легким видимым расстеклованием кварцевого стекла, чему, вероятно, способствовало либо изменение объема образца при быстром замораживании в калориметре, либо смачивание стенок капсулы жидкостью с последующей деформацией капсулы при замораживание. Растрескивание стеклянной капсулы произошло внутри калориметра без потери образца, так что было получено достаточное количество успешных измерений для жидкого состояния, прежде чем оно было прекращено при 1,509..3 K. Рентгеноструктурный анализ образцов из треснутых капсул не показал отличий от исходного материала.
Сглаженные значения энтальпии для сульфидов из таблиц 5-6 были дополнены уравнениями для лучшего удовлетворения потребностей различных пользователей, особенно в инженерных приложениях. Келли описал метод вывода, основанный на уравнении, впервые рекомендованном Майером и Келли, и на графической процедуре, разработанной Шорнейтом. Далее следуют полученные уравнения, выраженные в ккал/моль, вместе с температурными диапазонами достоверности и средними отклонениями от гладких данных.
Стандартные энтальпии и энергии Гиббса образования Стандартные энтальпии и энергии Гиббса образования были рассчитаны как функции температуры для Cu2S и CuS путем объединения приращений энтальпии и энтропии настоящего исследования с дополнительными данными из литературы. Были проведены расчеты и для реакций меди с S2(г). Дополнительные данные, необходимые для расчетов, были получены из различных источников. Стандартная энтальпия образования при 298,15 К для S2(g) взято у Вагмана и др. Кинг, Маха и Панкратц были источником энтальпий и энтропий для Cu(s,l) и стандартных энтальпий образования для Cu2S и CuS. Приращения энтальпии и энтропии выше 298,15 К для S(c,l) были получены от West и скорректированы для соответствия Международной практической температурной шкале 1968 г. Остальные термодинамические свойства для S(c,l) и S2(g) были из таблиц JANAF.
Кинг, Маха и Панкратц были источником энтальпий и энтропий для Cu(s,l) и стандартных энтальпий образования для Cu2S и CuS. Приращения энтальпии и энтропии выше 298,15 К для S(c,l) были получены от West и скорректированы для соответствия Международной практической температурной шкале 1968 г. Остальные термодинамические свойства для S(c,l) и S2(g) были из таблиц JANAF.
Результаты расчетов приведены в таблицах 7-10, в которых помимо энтальпий и энергий Гиббса также указаны константы равновесия. 9Кинг, Мах и Панкрац составили монографию по термодинамическим свойствам веществ, важных для металлургии меди. Этот сборник был спонсирован Международной ассоциацией исследований меди. На момент публикации сборника настоящее исследование высокотемпературных энтальпий для Cu2S и CuS было завершено. Таким образом, сглаженные значения энтальпии были включены в компиляцию, чтобы сделать ее максимально полной. Эти энтальпии были указаны в сборнике с низкотемпературными теплоемкостями, измеренными Андерсоном.
Низкотемпературная теплоемкость Cu2S и CuS измерялась с помощью адиабатического калориметра в настоящем исследовании и калориметра с изотермической рубашкой в исследованиях Андерсона. Его данные в среднем примерно на 1% превышали теплоемкость этого исследования, за исключением около 295 К, где разница была ближе к -0,5% для Cu2S и 0,5% для CuS. Андерсон получил приращение энтропии для CuS как S ° 298-S ° 56 = 13,29 кал / градус моль, а часть ниже 56 К оценивается как 2,64 кал / градус моль. Эти значения привели к S ° 298 = 15,9 ± 0,3 кал / град моль, что хорошо сравнимо с S ° 298 = 16,05 кал / град моль этого исследования. В случае Cu2S Андерсон сообщил о S°298 = 28,9±0,5 кал/град моль, что хорошо согласуется с S°298 = 27,76 кал/град моль настоящей работы. Его оценка энтропии ниже 56 К как 6,06 кал/град моль примерно на 0,6 единицы выше, чем определено в настоящей работе.
Эти значения привели к S ° 298 = 15,9 ± 0,3 кал / град моль, что хорошо сравнимо с S ° 298 = 16,05 кал / град моль этого исследования. В случае Cu2S Андерсон сообщил о S°298 = 28,9±0,5 кал/град моль, что хорошо согласуется с S°298 = 27,76 кал/град моль настоящей работы. Его оценка энтропии ниже 56 К как 6,06 кал/град моль примерно на 0,6 единицы выше, чем определено в настоящей работе.
В литературе не сообщалось об измерениях высокотемпературных энтальпий для CuS. Верхний температурный предел стабильности CuS в 780 К был принят из исследований Куллеруда. Эта температура согласуется с результатами настоящего исследования, которое показало, что разложение произошло при 779 К и, возможно, началось около 761 К.
Измерения энтальпии Cu2S показали три обратимых перехода, о которых сообщалось ранее. Для первого перехода от моноклинной к гексагональной структуре в литературе приведены температуры от 364 до 388 К. Настоящее исследование установило этот переход между 370,2 и 380,2 К для средней температуры 375 К. Однако 376 К было принято у Йоста и Кубашевского и Кубашевского, поскольку их измерения теплоемкости с помощью адиабатической калориметрии ниже 400 К более чувствительны, чем измерения энтальпии с помощью капли. калориметрия. Изотермическая теплота перехода 0,865 ккал/моль из настоящей работы выгодно отличается от значения около 0,920 ккал/моль, о которых сообщают Йост и Кубашевски, и 0,889 ккал/моль, измеренные Кубашевски. Настоящие результаты также хорошо согласуются с температурой перехода 388 К и поглощением тепла 0,896 ккал/моль, измеренными с помощью калориметра постоянного нагрева Уеда, и 376 К и 0,920 ккал/моль, рассчитанными Келли.
Однако 376 К было принято у Йоста и Кубашевского и Кубашевского, поскольку их измерения теплоемкости с помощью адиабатической калориметрии ниже 400 К более чувствительны, чем измерения энтальпии с помощью капли. калориметрия. Изотермическая теплота перехода 0,865 ккал/моль из настоящей работы выгодно отличается от значения около 0,920 ккал/моль, о которых сообщают Йост и Кубашевски, и 0,889 ккал/моль, измеренные Кубашевски. Настоящие результаты также хорошо согласуются с температурой перехода 388 К и поглощением тепла 0,896 ккал/моль, измеренными с помощью калориметра постоянного нагрева Уеда, и 376 К и 0,920 ккал/моль, рассчитанными Келли.
Второй переход для Cu2S был установлен при температуре 720 К. Сообщалось о разбросе температур примерно от 678 до 743 К для перехода из-за медленного поведения. Бартон писал: «Инверсия плохо определена; он подвержен значительному гистерезису, потому что атомы серы должны переходить из гексагональной в наиболее плотную кубическую упаковку при нагревании». Роузбум заявил: «Хотя эту структуру нельзя охладить до комнатной температуры, инверсия происходит медленно вблизи температуры перехода, и этот факт объясняет погрешность в 20 градусов. Однако инверсия происходит быстро на 50° выше или ниже перехода». Это медленное поведение не наблюдалось в настоящих измерениях энтальпии, выполненных при времени пребывания в печи, в 11 раз превышающем минимальное значение 1,5 часа. Температура 720 К и поглощение тепла 0,280 ккал/моль, определенные для перехода из этого исследования, хорошо согласуются с 717 К и 0,287 ккал/моль, указанными Йостом и Кубашевским, 708 К, и 0,306 ккал/моль, измеренными Кубашевским, 723 К. и 0,090 ккал/моль по данным Уеды, и 703 К и 0,110 ккал/моль по данным Вехефрица по измерениям гальванических элементов. Температура перехода в настоящем исследовании не соответствует 623 К, рассчитанным Келли, но согласуется с его теплотой перехода 0,200 ккал/моль.
Роузбум заявил: «Хотя эту структуру нельзя охладить до комнатной температуры, инверсия происходит медленно вблизи температуры перехода, и этот факт объясняет погрешность в 20 градусов. Однако инверсия происходит быстро на 50° выше или ниже перехода». Это медленное поведение не наблюдалось в настоящих измерениях энтальпии, выполненных при времени пребывания в печи, в 11 раз превышающем минимальное значение 1,5 часа. Температура 720 К и поглощение тепла 0,280 ккал/моль, определенные для перехода из этого исследования, хорошо согласуются с 717 К и 0,287 ккал/моль, указанными Йостом и Кубашевским, 708 К, и 0,306 ккал/моль, измеренными Кубашевским, 723 К. и 0,090 ккал/моль по данным Уеды, и 703 К и 0,110 ккал/моль по данным Вехефрица по измерениям гальванических элементов. Температура перехода в настоящем исследовании не соответствует 623 К, рассчитанным Келли, но согласуется с его теплотой перехода 0,200 ккал/моль.
Третьим переходом Cu2S было конгруэнтное плавление при 1400 К, взятое из измерений, сделанных Дженсеном с использованием дифференциального термического анализа. Текущие измерения энтальпии не определили точку плавления из-за эффекта предварительного плавления при 1381,9.K, что показало аномально высокий тепловой эффект на 1,2% выше кривой на рисунке 2. Следовательно, данные были экстраполированы до 1400 K из последнего достоверного экспериментального измерения при 1304,4 K. В литературе сообщается о температурах от 1400 до 1403 K для точка плавления. Настоящее исследование определило теплоту плавления как 3,070 ккал/моль по сравнению с 2,700 ккал/моль, измеренными с помощью водяного калориметра Йохансена и Фоллмера, 2,700 ккал/моль по измерениям дифференциального термического анализа Менделевича, Крестовникова и Глазора, 2,300 ккал/моль. из экстраполяции данных о равновесии Ричардсона и Антилла и значений, рассчитанных Келли, что дает либо 2,900 ккал/моль по исследованию Фридриха или 5.500 ккал/моль по усреднению данных Труте и Фридриха.
Текущие измерения энтальпии не определили точку плавления из-за эффекта предварительного плавления при 1381,9.K, что показало аномально высокий тепловой эффект на 1,2% выше кривой на рисунке 2. Следовательно, данные были экстраполированы до 1400 K из последнего достоверного экспериментального измерения при 1304,4 K. В литературе сообщается о температурах от 1400 до 1403 K для точка плавления. Настоящее исследование определило теплоту плавления как 3,070 ккал/моль по сравнению с 2,700 ккал/моль, измеренными с помощью водяного калориметра Йохансена и Фоллмера, 2,700 ккал/моль по измерениям дифференциального термического анализа Менделевича, Крестовникова и Глазора, 2,300 ккал/моль. из экстраполяции данных о равновесии Ричардсона и Антилла и значений, рассчитанных Келли, что дает либо 2,900 ккал/моль по исследованию Фридриха или 5.500 ккал/моль по усреднению данных Труте и Фридриха.
Высокотемпературные измерения Cu2S другими организациями ограничены. Йост и Кубашевски сообщили об измерениях теплоемкости между 203 и 803 К; однако их значения не были занесены в таблицу, а были представлены графически.

