Какие компоненты окружающей среды вызывают коррозию: Какие компоненты окружающей среды вызывают химическую коррозию. Коррозия металлов и её виды
alexxlab | 04.04.1986 | 0 | Разное
Страница не найдена – Инженерная практика
Свежий выпуск: № 05/2022
Популярное в этом месяце Применение трубопроводов из альтернативных материалов на месторождениях ООО «ИНК». Результаты применения. Анализ, перспективы развития МАКСИМОВ Геннадий Львович, ООО «Иркутская нефтяная компания»ПРОМАХОВ Василий Александрович, ООО «Иркутская нефтяная компания»ФЕДОТОВА Анна Владимировна, АО «Трубодеталь»ПЕРОВ Кирилл Алексеевич, ООО «Иркутская нефтяная компания» Эффективные решения Hilong в области антикоррозионной защиты объектов нефтегазовой отрасли ПЕТРОВ Никита Сергеевич, ООО «ТД Хайлон-Рус» / Hilong Russia Анализ промысловых данных и динамическое моделирование механизированной добычи малодебитными скважинами ЮЩЕНКО Тарас Сергеевич, ООО «Газпромнефть – Технологические партнерства»ДЕМИН Евгений Викторович, ООО «Газпромнефть НТЦ» Результаты работы с механизированным фондом скважин ПАО «ЛУКОЙЛ» за 2021 год РЕНЕВ Дмитрий Юрьевич, ПАО «ЛУКОЙЛ» Анализ и моделирование процесса образования АСПО на внутренней поверхности НКТ с внутренним покрытием и без покрытия ВЕРЕВКИН Александр Григорьевич, ООО «НПЦ «Самара»БЕРКОВ Денис Валентинович, ООО «НПЦ «Самара»БОГАТОВ Максим Валерьевич, ООО «НПЦ «Самара»ЮДИН Павел Евгеньевич, ООО «НПЦ «Самара»
Ближайшие совещания
Отраслевая техническая Конференция
СЕРВИС-2022. Эффективный нефтесервис Российских нефтегазодобывающих компаний. Развитие отечественного технологического потенциала. Новые отраслевые вызовы
4-6 октября 2022 г., г. Когалым
Ближайшие тренинги
Семинар-практикум
Защитные антикоррозионные покрытия 2022. Эффективные методы применения защитных покрытий в нефтедобыче
25-27 октября 2022 г.
Эффективный нефтесервис Российских нефтегазодобывающих компаний. Развитие отечественного технологического потенциала. Новые отраслевые вызовы
4-6 октября 2022 г., г. Когалым
Ближайшие тренинги
Семинар-практикум
Защитные антикоррозионные покрытия 2022. Эффективные методы применения защитных покрытий в нефтедобыче
25-27 октября 2022 г.
Коррозия металлов.Сплавы – химия, уроки
Конспект урока по химии в 9 классе
Тема урока: «Сплавы. Коррозия металлов.
При плавлении металлы обычно смешиваются, образуя сплавы. Ещё в глубокой древности люди заметили, что в большинстве случаев сплавы обладают другими, нередко более полезными для человека свойствами, чем составляющие их чистые металлы.
Компонентами сплавов могут быть и неметаллы, и соединения.
По состоянию компонентов сплавы могут быть однородными, когда при сплавлении образуется как бы раствор одного металла в другом, например сплавы меди и олова, золота и серебра, и неоднородными, например чугун, представляющий собой механическую смесь железа и углерода.
Сплавы классифицируют по-разному, в зависимости от того, какой признак взят за основу. Чаще всего сплавы подразделяют по составу. Например, выделяют медные, алюминиевые, никелевые, титановые и другие сплавы.
Есть группы сплавов, носящие общие названия: бронзы, латуни и др. Иногда в названии сплава отмечают особо ценные компоненты: бериллиевые бронзы, вольфрамовая сталь и др.
В металлургии железо и все его сплавы выделяют в одну группу под названием чёрные металлы
Подавляющее большинство железных (или чёрных) сплавов содержит углерод. Их разделяют на чугуны и стали. См. учебник
Их разделяют на чугуны и стали. См. учебник
Коррозия металлов
Ржавчина, которая появляется на поверхности стальных и чугунных изделий – это яркий пример коррозии.
Ежегодно из-за коррозии теряется около четверти всего произведённого в мире железа. Коррозия вызывает серьёзные экологические последствия. Утечка газа, нефти и других опасных химических продуктов из разрушенных коррозией трубопроводов приводит к загрязнению окружающей среды, что отрицательно влияет на здоровье и жизнь людей.
По механизму протекания разрушений различают 2 типа коррозии: химическую и электрохимическую.
Коррозию металлов и сплавов (их окисление) вызывают такие компоненты окружающей среды, как вода, кислород, оксиды углерода и серы, содержащиеся в воздухе, водные растворы солей (морская вода, грунтовые воды). Эти компоненты непосредственно окисляют металлы – происходит химическая коррозия. Рис.43
Электрохимическая коррозия – это разрушение металлов при контакте двух металлов в воде или среде электролита. Электрохимическая коррозия распространена значительно шире, чем химическая. Рассм. рис. 44, а затем написать:
Электрохимическая коррозия распространена значительно шире, чем химическая. Рассм. рис. 44, а затем написать:
Для борьбы с коррозией существует много способов. Назовём некоторые из них.
1. Нанесение защитных покрытий на поверхности предохраняемого от коррозии металла. Для этого часто используют масляные краски, эмали, лаки.
2. Использование нержавеющих сталей, содержащих специальные добавки. Например, «нержавейка», из которой изготавливают столовые приборы, содержит до 12% хрома и до 10% никеля.
3. Введение в рабочую среду, где находятся металлические детали, веществ, которые в десятки и сотни раз уменьшают агрессивность среды. Такие вещества называют ингибиторами коррозии.
4. Создание контакта с более активным металлом — протектором. Например, для защиты стальных корпусов морских судов обычно используют цинк.
Задания на закрепление материала:
1. Коррозию металлов и сплавов вызывает
Коррозию металлов и сплавов вызывает
А) вода и кислород
Б) оксиды углерода и серы
В) растворы солей
Г) все перечисленные компоненты
2. Наиболее сильно металл коррозирует
А) в растворе хлорида натрия
Б) в кипяченой дистиллированной воде
В) в сухом воздухе
Г) в дистиллированной воде
3. Для защиты стальных корпусов морских судов обычно используют
А) Na
Б) Zn
В) Сu
Г) Fe
4.Более активный металл, предотвращающий коррозию менее активного металла, называется
А) катализатор коррозии
Б) активатор коррозии
В) ингибитор коррозии
Г) протектор
5. Вещества, введение которых уменьшает агрессивность среды, называют
А) катализаторы коррозии
Б) активаторы коррозии
В) ингибиторы коррозии
Г) протектор
Ответы: 1Г; 2А; 3Б; 4Г; 5В
Просмотр содержимого документа
«Коррозия металлов.
 Сплавы»
Сплавы»
Конспект урока по химии в 9 классе
Тема урока: «Сплавы. Коррозия металлов.
При плавлении металлы обычно смешиваются, образуя сплавы. Ещё в глубокой древности люди заметили, что в большинстве случаев сплавы обладают другими, нередко более полезными для человека свойствами, чем составляющие их чистые металлы.
Компонентами сплавов могут быть и неметаллы, и соединения.
По состоянию компонентов сплавы могут быть однородными, когда при сплавлении образуется как бы раствор одного металла в другом, например сплавы меди и олова, золота и серебра, и неоднородными, например чугун, представляющий собой механическую смесь железа и углерода.
Сплавы классифицируют по-разному, в зависимости от того, какой признак взят за основу. Чаще всего сплавы подразделяют по составу. Например, выделяют медные, алюминиевые, никелевые, титановые и другие сплавы.
Есть группы сплавов, носящие общие названия: бронзы, латуни и др. Иногда в названии сплава отмечают особо ценные компоненты: бериллиевые бронзы, вольфрамовая сталь и др.
В металлургии железо и все его сплавы выделяют в одну группу под названием чёрные металлы; остальные металлы и их сплавы имеют техническое название цветные металлы.
Подавляющее большинство железных (или чёрных) сплавов содержит углерод. Их разделяют на чугуны и стали. См. учебник
Коррозия металлов
Ржавчина, которая появляется на поверхности стальных и чугунных изделий – это яркий пример коррозии.
Ежегодно из-за коррозии теряется около четверти всего произведённого в мире железа. Коррозия вызывает серьёзные экологические последствия. Утечка газа, нефти и других опасных химических продуктов из разрушенных коррозией трубопроводов приводит к загрязнению окружающей среды, что отрицательно влияет на здоровье и жизнь людей.
По механизму протекания разрушений различают 2 типа коррозии: химическую и электрохимическую.
Коррозию металлов и сплавов (их окисление) вызывают такие компоненты окружающей среды, как вода, кислород, оксиды углерода и серы, содержащиеся в воздухе, водные растворы солей (морская вода, грунтовые воды). Эти компоненты непосредственно окисляют металлы – происходит химическая коррозия. Рис.43
Электрохимическая коррозия – это разрушение металлов при контакте двух металлов в воде или среде электролита. Электрохимическая коррозия распространена значительно шире, чем химическая. Рассм. рис. 44, а затем написать:
Для борьбы с коррозией существует много способов. Назовём некоторые из них.
1. Нанесение защитных покрытий на поверхности предохраняемого от коррозии металла. Для этого часто используют масляные краски, эмали, лаки.
2. Использование нержавеющих сталей, содержащих специальные добавки. Например, «нержавейка», из которой изготавливают столовые приборы, содержит до 12% хрома и до 10% никеля.
3. Введение в рабочую среду, где находятся металлические детали, веществ, которые в десятки и сотни раз уменьшают агрессивность среды. Такие вещества называют ингибиторами коррозии.
4. Создание контакта с более активным металлом — протектором. Например, для защиты стальных корпусов морских судов обычно используют цинк.
Задания на закрепление материала:
1. Коррозию металлов и сплавов вызывает
А) вода и кислород
Б) оксиды углерода и серы
В) растворы солей
Г) все перечисленные компоненты
2. Наиболее сильно металл коррозирует
А) в растворе хлорида натрия
Б) в кипяченой дистиллированной воде
В) в сухом воздухе
Г) в дистиллированной воде
3. Для защиты стальных корпусов морских судов обычно используют
Для защиты стальных корпусов морских судов обычно используют
А) Na
Б) Zn
В) Сu
Г) Fe
4.Более активный металл, предотвращающий коррозию менее активного металла, называется
А) катализатор коррозии
Б) активатор коррозии
В) ингибитор коррозии
Г) протектор
5. Вещества, введение которых уменьшает агрессивность среды, называют
А) катализаторы коррозии
Б) активаторы коррозии
В) ингибиторы коррозии
Г) протектор
Ответы: 1Г; 2А; 3Б; 4Г; 5В
Ингибиторы коррозии
Коррозия
Коррозия – это естественный процесс. Ингибирование является профилактической мерой против коррозийного воздействия на металлические материалы. Ингибиторы коррозии часто изучались, поскольку они предлагают простое решение для защиты металлов от коррозии в водной среде. Минеральные кислоты, такие как соляная и серная кислоты, наиболее широко используются в процессах травления для удаления образующихся на поверхности оксидов металлов. Ингибиторы используются в промышленных и коммерческих процессах, чтобы минимизировать как потери металла, так и потребление кислоты.
Ингибиторы коррозии часто изучались, поскольку они предлагают простое решение для защиты металлов от коррозии в водной среде. Минеральные кислоты, такие как соляная и серная кислоты, наиболее широко используются в процессах травления для удаления образующихся на поверхности оксидов металлов. Ингибиторы используются в промышленных и коммерческих процессах, чтобы минимизировать как потери металла, так и потребление кислоты.
Ключевые слова: ингибиторы коррозии, кислотные ингибиторы, летучие ингибиторы, ингибитор паровой фазы
Введение
Коррозия является основным средством разрушения металлов. Подавляющее большинство из нас лично ощущают важность защиты от коррозии. Слишком многие наблюдают появление ржавых дыр в панелях кузова относительно новых автомобилей. Наружная ржавчина стали бытовой и садовой техники является обычным явлением жизни. Многие знают, каково готовить горячие блюда в ржавой посуде, все ощущали металлический привкус в кислых продуктах, которые слишком долго хранились в открытых банках. То, что эти эффекты вызваны коррозией, хорошо известно.
То, что эти эффекты вызваны коррозией, хорошо известно.
Ярким примером, связанным с коррозией, является появление трещин на некоторых участках памятника монументального искусства, идеала и символа советской эпохи, признанного «эталоном социалистического реализма» – «Рабочий и колхозница» Они вызваны тем, что стальные дюбели, которые были встроены внутрь, сильно корродировали и проржавели, и это привело к его разрушению. Однако коррозия так же распространена в других классах материалов, таких как керамика, пластик и резина. Поскольку практически все среды в некоторой степени являются коррозийными, это является основными причинами материального разрушения, а также оборачивается большими экономическими издержками для общества.
Историческая справка
Коррозию можно рассматривать как универсальное явление. Есть везде – с воздухом, водой, почвой и в любой среде, с которой мы сталкиваемся. Известная людям как ржавчина, коррозия является нежелательным явлением, которое разрушает блеск и красоту материалов и уменьшает их жизнь. Ежегодные потери ВВП нашей страны могут достигать 3,5% по причинам, напрямую связанным именно с коррозией. Недавние исследования показывают, что и другие страны также увеличивают свои расходы на ингибиторы коррозии.
Известная людям как ржавчина, коррозия является нежелательным явлением, которое разрушает блеск и красоту материалов и уменьшает их жизнь. Ежегодные потери ВВП нашей страны могут достигать 3,5% по причинам, напрямую связанным именно с коррозией. Недавние исследования показывают, что и другие страны также увеличивают свои расходы на ингибиторы коррозии.
Расходы на коррозию проявляются в форме преждевременного износа или отказа, требующего технического обслуживания, ремонта и замены поврежденных частей. Коррозия оказывает огромное экологическое и экономическое воздействие на все элементы национальной инфраструктуры: автомагистрали, мосты, здания, объекты химической обработки, сточные воды. Помимо потерь материала, коррозия негативно влияет не только на окружающую среду, но также угрожает безопасности человека и производственных операций. Осведомленность о коррозии и адаптация своевременных и надлежащих мер контроля являются ключом к снижению коррозионных отказов.
Определение коррозии
Самопроизвольное окисление металла называется коррозией, то есть коррозия – это разрушение металлов и сплавов в присутствии окружающей среды химическими или электрохимическими средствами. Среда, в которой металл подвергается коррозии, называется агрессивной. Образующиеся продукты коррозии представляют собой химические соединения, содержащие металл в окисленной форме. За исключением золота и платины все другие металлы разъедаются и превращаются в вещества, подобные минеральным рудам, из которых они извлекаются.
Среда, в которой металл подвергается коррозии, называется агрессивной. Образующиеся продукты коррозии представляют собой химические соединения, содержащие металл в окисленной форме. За исключением золота и платины все другие металлы разъедаются и превращаются в вещества, подобные минеральным рудам, из которых они извлекаются.
Неблагоприятные экономические и социальные последствия коррозии
Коррозия негативно влияет на безопасную, надежную и эффективную работу оборудования и конструкций, это хуже чем простая потеря массы металла. Отказы всех видов оборудования и необходимость дорогостоящих замен могут возникнуть, даже если количество разрушенного металла довольно мало. Некоторые из основных вредных воздействий коррозии могут быть перечислены ниже:
Замена корродированного оборудования, что приводит к большим расходам.
Высокая стоимость профилактического обслуживания, такого как покраска.

Потеря эффективности.
Потеря продукта из поврежденного корродированного контейнера.
Меры безопасности при пожаре, взрыве или выбросе токсичного продукта.
Проблемы со здоровьем, например, загрязнение питьевой воды свинцом, вероятно, связано с коррозией.
Химия коррозии
В целом металлы обладают уникальными свойствами, они непрозрачные, блестящие, проводящие, пластичные, легко образуют металлические связи с другими металлами и ионные связи с неметаллами. Имеют перекрывающиеся зоны проводимости и валентные зоны в своей электронной структуре.
Рис. 1. Процесс цикла образования коррозии
Металлы получаются из их руды путем расходования большого количества энергии. Металлы сохраняют тепло в качестве потенциальной энергии во время процесса плавки и рафинирования и выделяют эту энергию во время процесса коррозии после реакции с окружающей средой. Следовательно, эти металлы можно рассматривать как находящиеся в метастабильном состоянии, и они будут терять свою энергию, возвращаясь к соединениям, более или менее похожим на их исходное состояние. Например, исходный материал для производства железа (и стали) и ржавчина продукта коррозии имеют одинаковые химический состав (Fe2O3).
Следовательно, эти металлы можно рассматривать как находящиеся в метастабильном состоянии, и они будут терять свою энергию, возвращаясь к соединениям, более или менее похожим на их исходное состояние. Например, исходный материал для производства железа (и стали) и ржавчина продукта коррозии имеют одинаковые химический состав (Fe2O3).
Энергия, накопленная во время плавления и выделенная во время коррозии, обеспечивает потенциал для процесса коррозии. Поскольку большинство металлических соединений, и особенно продукты коррозии, имеют небольшую механическую прочность, сильно корродированный кусок металла совершенно бесполезен для своего первоначального назначения. Металлы (такие как Mg, Al, Zn и Fe), которые требуют большего количества энергии для рафинирования, более подвержены коррозии, чем металлы, которые требуют меньшего количества для рафинирования, такие как золото, серебро, платина. Цикл коррозии показан на (рисунок 1).
Классификация
Коррозия была классифицирована на различные методы.
Низкотемпературная коррозия и высокотемпературная коррозия.
Электрохимическая коррозия и химическая коррозия.
Влажная и сухая коррозия.
Влажная коррозия происходит, когда металл находится в контакте с электролитически проводящей жидкостью или когда два разнородных металла или сплава погружены либо частично погружены в электролитически проводящие растворы. Это всегда связано с низкотемпературными условиями. Процесс коррозии включает две реакции.
На аноде:
M (металл) → Mn + + ne- (окисление)
Mn + (ион металла) → Растворяется в растворе
Mn + (ион металла) → Образует соединение, такое соединение как оксид
На катоде:
2H + + 2e− → h3 ↑ (в кислотном растворе)
2h3O + 2e− → h3 ↑ + 2OH- (в щелочном растворе)
O2 + 2h3O + 4e− → 4OH- (в нейтральном растворе)
Сухая коррозия происходит главным образом в результате прямого химического воздействия атмосферных газов и паров, присутствующих в окружающей среде. Это чаще всего связано с высокой температурой.
Это чаще всего связано с высокой температурой.
Формы коррозии
Коррозия может проявляться во многих формах, таких как равномерная коррозия или общая коррозия, гальваническая коррозия, щелевая коррозия, точечная коррозия, межкристаллитная коррозия, селективное выщелачивание, эрозионная коррозия, коррозия под напряжением, коррозионная усталость и истирающая коррозия. Чтобы улучшить взаимопонимание между специалистами по коррозии и проектированию, она подразделяется на две широкие категории. Выражено в блок-схеме (рисунок 2).
Рис. 2. Формы коррозии
Общая коррозия
Эта общая коррозия, также называемая равномерной атакой, является наиболее распространенной формой коррозии. Обычно характеризуется химической или электрохимической реакцией, которая протекает равномерно по всей открытой поверхности или по большой ее площади. Металл становится тоньше, и в конечном итоге изделие выходит из строя.
Металл становится тоньше, и в конечном итоге изделие выходит из строя.
Гальваническая коррозия
Происходит, когда существует разность потенциалов между двумя разнородными металлами, погруженными в коррозийный раствор. Эта разность потенциалов создает поток электронов между металлами. Несколько исследований показали, что гальваническая коррозия прямо пропорциональна площади катода анодному металлу. ГОСТ 9.005-72 Группа Т92 МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ Единая система защиты от коррозии и старения МЕТАЛЛЫ, СПЛАВЫ, МЕТАЛЛИЧЕСКИЕ И НЕМЕТАЛЛИЧЕСКИЕ НЕОРГАНИЧЕСКИЕ ПОКРЫТИЯ Допустимые и недопустимые контакты с металлами и неметаллами
Принципиальная схема гальванической коррозии показана ниже (рисунок 3).
Рис. 3. Изображение гальванической коррозии.
Щелевая коррозия или отложения коррозии
Этот вид коррозии в основном подвержен трещинам, связанным с небольшими объемами застойного раствора, захваченными в отверстиях, поверхностях, соединениях и щелях под головками болтов и заклепок (рис. 4). Это также известно как коррозия отложения.
4). Это также известно как коррозия отложения.
Рис. 4. Изображение щелевой коррозии.
Питтинговая (точечная) коррозия или локальная коррозия
Питтинговая коррозия – это локальная атака, приводящая к образованию отверстий в металлах. Эти отверстия относительно маленькие и выглядят как шероховатости поверхности (рис. 5), иногда они были изолированы или расположены близко друг к другу. Питтинг является одной из самых разрушительных и коварных форм коррозии.
Рис. 5. Изображение питтинговой коррозии
Межкристаллитная коррозия
Большинство металлов и сплавов подвержено межкристаллитной коррозии при воздействии специфической коррозионной среды, которая показана на рисунке 6. Границы зерна обычно более реакционноспособны, чем матрица зерна. Следовательно, локализованная атака происходит на границах зерен и рядом с ними с относительно небольшой коррозией матрицы. Этот тип атаки обычно быстр и проникает глубоко в металл, что приводит к потере прочности и к катастрофическим отказам. Причины:
Этот тип атаки обычно быстр и проникает глубоко в металл, что приводит к потере прочности и к катастрофическим отказам. Причины:
Примеси на границах зерна
Обогащение одного из элементов в сплаве
Истощение одного из элементов в пограничной зоне.
Рис. 6. Схематическое изображение межкристаллитной коррозии
Выборочное выщелачивание
Выборочное выщелачивание – это удаление элемента из сплава путем коррозии. Выборочное удаление цинка из латуни является ярким примером этой формы атаки. Подобное нападение наблюдалось с другими сплавами, в которых железо, алюминий, кобальт и хром удалены. Этот тип коррозии нежелателен, так как дает пористый металл с плохими механическими свойствами.
Эрозийная коррозия
Это увеличение атаки металла из-за относительного движения коррозийной среды и поверхности металла. Эту коррозию можно наблюдать в элементах трубопроводной системы, таких как изгибы, колена, насосы, конденсаторы и т. д. Представление эрозионной коррозии показано на рисунке 7. Факторами, влияющими на эрозионную коррозию, являются природа поверхностной пленки, коррозионная среда и наличие пузырьков воздуха с его размерами, химическим составом, взвешенными веществами, коррозионной стойкостью и металлургическими свойствами металлов и сплавов.
Эту коррозию можно наблюдать в элементах трубопроводной системы, таких как изгибы, колена, насосы, конденсаторы и т. д. Представление эрозионной коррозии показано на рисунке 7. Факторами, влияющими на эрозионную коррозию, являются природа поверхностной пленки, коррозионная среда и наличие пузырьков воздуха с его размерами, химическим составом, взвешенными веществами, коррозионной стойкостью и металлургическими свойствами металлов и сплавов.
Рис. 7. Изображение эрозионной коррозии.
Коррозия под напряжением
Растрескивание металла или сплава в результате совместного действия растягивающего напряжения и коррозии (рис. 8) известно как коррозионное растрескивание под напряжением. Восприимчивость к коррозионному растрескиванию под напряжением обусловлена определенными металлургическими факторами, такими как:
Химический состав
Преимущественная ориентация зерен
Состав и распределение осадков
Структура дислокации и факторы окружающей среды и структура металла.

Рис. 8. Изображение коррозии под напряжением.
Коррозионная усталость
Определяется как «снижение усталостной прочности из-за наличия агрессивной среды». Коррозионная усталость возникает из-за комбинированного действия растягивающего и сжимающего напряжения альтернативно. Усталость возникает при снижении нагрузки в агрессивной среде.
Фреттинг-коррозия
Фреттинг – это явление износа, усиленное коррозией. Это связано с износом металла или сплава при контакте с другим твердым материалом в сухом или влажном воздухе. Фреттинг является результатом абразивного износа поверхностных оксидных пленок, которые образуют контактирующие поверхности под нагрузкой в атмосферном воздухе, что показано на рисунке 9. Факторами, влияющими на фреттинговую коррозию, являются:
Величина относительного движения
Температура
Окружающая обстановка
Металлургические факторы
Из-за легкого движения (такого как вибрация) поверхность оксида и подстилающий металл портится. Частицы металла в результате износа окисляются до твердых оксидов, которые действуют как дополнительная абразивная среда. Кроме того, движение размалывает частицы оксидов, вызывая износ.
Частицы металла в результате износа окисляются до твердых оксидов, которые действуют как дополнительная абразивная среда. Кроме того, движение размалывает частицы оксидов, вызывая износ.
Рис. 9. Изображение фреттинг-коррозии
Коррозия кавитации
Это особый тип эрозионной коррозии, которая возникает из-за образования пузырьков пара в коррозийной среде вблизи металлической поверхности, и когда пузырьки разрушаются, возникает атака, например, гидравлическая турбулентность,. От такого типа коррозии повреждаются, например, судовые гребные винты. Кавитация аналогична точечной коррозии, но в этом случае поверхность шероховатая и имеет много близко расположенных ям (Рисунок 10).
Рис. 10. Изображение коррозии кавитации
Факторы, влияющие на коррозию
Степень и скорость коррозии зависят от природы металлов и окружающей среды.
Природа металла
- Положение металлов.
- Перенапряжение.
- Относительная площадь анодной и катодной частей металла.
- Чистота металла.
- Физическая природа металла.
- Природа поверхности пленки.
- Растворимость продуктов.
- Летучие продукты коррозии.
Природа окружающей среды
- Диапазон температур
- Влажность воздуха
- Примеси в воде
- Наличие взвешенных частиц в атмосфере
- Влияние рН
- Природа растворенных газов, растворенных солей, загрязняющих веществ и т. д.
- Проводимость корродирующей среды
- Формирование ячейки концентрации кислорода
- Скорость потока технологического пара
- Поляризация электродов.
Факторы, контролирующие скорость коррозии
Определенные факторы имеют тенденцию ускорять действие коррозионной ячейки, которая включает в себя создание четко определенных мест на поверхности металла для анодной и катодной реакций. Металлы, имеющие более положительный (благородный) потенциал в гальваническом ряду, будут стремиться извлечь электроны из металла, который находится в более отрицательном (базовом) положении в ряду, и, следовательно, ускорить его коррозию при контакте с ним. Агрессивные ионы, такие как хлорид, имеют тенденцию предотвращать образование защитных оксидных пленок на поверхности металла и, таким образом, увеличивать коррозию.
Металлы, имеющие более положительный (благородный) потенциал в гальваническом ряду, будут стремиться извлечь электроны из металла, который находится в более отрицательном (базовом) положении в ряду, и, следовательно, ускорить его коррозию при контакте с ним. Агрессивные ионы, такие как хлорид, имеют тенденцию предотвращать образование защитных оксидных пленок на поверхности металла и, таким образом, увеличивать коррозию.
Скорость коррозии
Скорость коррозии выражается на основе потерь в единицу времени. Скорость, с которой происходит атака, имеет первостепенное значение и обычно выражается одним из двух способов:
- Потеря веса на единицу площади в единицу времени, как правило, нечетное число (миллиграммов на квадратный дециметр в день).
- Уменьшение толщины за единицу времени, то есть скорости проникновения или толщины потерянного металла.
Методы контроля коррозии
Коррозия – это разрушительные и бесшумные рабочие процессы. Это создает проблемы как для крупных, так и для небольших отраслей. Поскольку коррозия неизбежна для устранения, но ее можно минимизировать, приняв определенный антикоррозийный метод, а не предотвращая его. Практические методы защиты металла от коррозии:
Это создает проблемы как для крупных, так и для небольших отраслей. Поскольку коррозия неизбежна для устранения, но ее можно минимизировать, приняв определенный антикоррозийный метод, а не предотвращая его. Практические методы защиты металла от коррозии:
- Модификация металла
- Модификация дизайна
- Модификация агрессивной среды
- Модификация металлического потенциала среды
- Использование ингибиторов
- Модификация поверхности
Эти методы могут использоваться по отдельности или в комбинации. Одним из наиболее известных методов защиты от коррозии является использование ингибиторов коррозии вместо использования различных методов, чтобы избежать или предотвратить разрушение или разрушение поверхности металла. Потому что использование ингибиторов является следствием отстаивания из-за низкой стоимости и практического метода.
Ингибиторы
Ингибитор представляет собой химическое вещество или комбинацию веществ, которые при добавлении в очень низких концентрациях в агрессивную среду эффективно предотвращают или уменьшают коррозию без значительной реакции с компонентами окружающей среды. Концентрации ингибиторов коррозии могут варьироваться от 1 до 15000 частей на миллион (от 0,0001 до 1,5 мас.%). Ингибиторы играют жизненно важную роль в закрытых системах окружающей среды, которые имеют хорошую циркуляцию, так что обеспечивается адекватная и контролируемая концентрация ингибитора. Такие условия могут быть выполнены, например, в системах рециркуляции охлаждающей воды, добычи нефти, нефтепереработки и кислотного травления стальных компонентов. Одним из наиболее узнаваемых применений ингибиторов является антифриз для автомобильных радиаторов. Ингибиторы могут быть органическими или неорганическими соединениями, и они обычно растворяются в водных средах.
Концентрации ингибиторов коррозии могут варьироваться от 1 до 15000 частей на миллион (от 0,0001 до 1,5 мас.%). Ингибиторы играют жизненно важную роль в закрытых системах окружающей среды, которые имеют хорошую циркуляцию, так что обеспечивается адекватная и контролируемая концентрация ингибитора. Такие условия могут быть выполнены, например, в системах рециркуляции охлаждающей воды, добычи нефти, нефтепереработки и кислотного травления стальных компонентов. Одним из наиболее узнаваемых применений ингибиторов является антифриз для автомобильных радиаторов. Ингибиторы могут быть органическими или неорганическими соединениями, и они обычно растворяются в водных средах.
Определение ингибитора
Ингибитор – это вещество, которое при добавлении в окружающую среду в небольших концентрациях сводит к минимуму потери металла, уменьшает степень водородного показателя, защищает металл от точечной коррозии, уменьшает количество травления и испарения кислоты, возникающего в результате чрезмерной реакции между кислотой и основными металлами, и уменьшает потребление кислоты. Они уменьшают коррозию, действуя в качестве барьера и образуя адсорбированный слой или замедляя катодный, анодный или оба процесса. Схематическое представление процесса ингибитора показано на рисунке 12.
Они уменьшают коррозию, действуя в качестве барьера и образуя адсорбированный слой или замедляя катодный, анодный или оба процесса. Схематическое представление процесса ингибитора показано на рисунке 12.
Любой процесс замедления коррозии или снижения скорости окисления металла путем добавления химического соединения в систему вызван ингибиторами коррозии. Ингибиторы часто легко наносятся и дают преимущество применения на месте, не вызывая значительного нарушения процесса. Использование ингибиторов коррозии является одним из лучших методов борьбы с коррозией.
Чтобы их можно было эффективно использовать, необходимо учитывать три фактора:
- Выявление проблем коррозии.
Как правило, ингибиторы коррозии могут воздействовать на компоненты коррозионной ячейки (анод, катод, электролит и электронный проводник), чтобы уменьшить коррозию. Ингибитор может вызвать:
Ингибитор может вызвать:
- Анодное торможение (увеличение поляризации анода)
- Катодное торможение (увеличение поляризации катода)
- Ингибирование сопротивления (увеличение электрического сопротивления цепи при образовании тонкого или толстого осадка на поверхности металла)
- Ограничение диффузии (ограничение диффузии деполяризаторов, например, DO).
Однако при выборе ингибитора следует учитывать несколько факторов.
- Стоимость ингибитора.
- Токсичность ингибитора может оказывать вредное воздействие на людей и других живых организмов.
- Наличие ингибитора определяет его выбор.
- Ингибитор должен быть экологически чистым.
Чтобы избежать или уменьшить коррозию металлических материалов, ингибитор, используемый в
системах охлаждения, должен удовлетворять следующим критериям
- Должен обеспечивать хорошую защиту от коррозии при очень низкой концентрации ингибитора.

- Должен защищать все открытые материалы от воздействия коррозии.
- Должен оставаться эффективным в экстремальных условиях эксплуатации (более высокая температура и скорость).
- В случае недостаточной или избыточной дозы ингибитора скорость коррозии не должна увеличиваться коренным образом.
- Ингибитор или продукты реакции ингибитора не должны образовывать отложений.
на металлической поверхности, особенно в местах, где происходит передача тепла.
- Подавлять как равномерную, так и локальную коррозию.
- Иметь долгосрочный эффект.
- Не должно вызывать проблем с токсичностью и загрязнением.
Определение ингибирования
Одной из широко изученных тем в области коррозии является ингибирование. Ингибирование – это процесс превентивных мер против агрессивного воздействия на металлические материалы. Могут использоваться химические соединения, которые при добавлении в небольших концентрациях в агрессивную среду способны уменьшить коррозию открытого металла.
Могут использоваться химические соединения, которые при добавлении в небольших концентрациях в агрессивную среду способны уменьшить коррозию открытого металла.
Ингибиторы коррозии
Ингибиторы коррозии могут быть любых форм (твердых веществ, жидкостей и газов). На основании растворимости или диспергируемости в жидкостях выбираются ингибиторы коррозии, которые должны быть ингибированы. Установлено, что ингибиторы коррозии являются эффективным и гибким средством уменьшения коррозии. Использование химических ингибиторов для снижения скорости коррозионных процессов довольно разнообразно. Ингибиторы коррозии используются в разведке и добыче нефти и газа, на нефтеперерабатывающих заводах, в химическом производстве, тяжелом производстве, для очистки воды и добавок к продуктам. В нефтедобывающей, перерабатывающей и химической промышленности ингибиторы коррозии всегда считались первой линией защиты. Большое количество научных исследований было посвящено теме ингибиторов коррозии.
Большое количество научных исследований было посвящено теме ингибиторов коррозии.
Роль ингибиторов
Органические и неорганические соединения представляют собой большой класс ингибиторов коррозии, которые, как правило, воздействуют на всю поверхность корродирующего металла, когда присутствуют в достаточной концентрации. Большинство органических / неорганических соединений, содержащих элементы групп V B, VI B или функциональных групп типа аминной, карбонильной и спиртовой групп, являются более эффективными ингибиторами коррозии. Ингибитор адсорбируется на всей поверхности металла корродирующего металла и таким образом предотвращает воздействие коррозии. Органические ингибиторы адсорбируются на поверхности металлов. Ингибиторы можно рассматривать как два основных типа: они образуют защитную барьерную пленку на анодах или катодах в результате реакции между металлом и окружающей средой. Ингибиторы этого типа функционируют в нейтральном или в некоторых случаях в щелочном растворе, в котором основной катодной реакцией является реакция восстановления кислорода, в которой поверхность корродирующего металла покрыта пленкой оксида или гидроксида.
Другой тип первоначально адсорбируется непосредственно на поверхность металла взаимодействием поверхностных зарядов с ионными и / или молекулярными дипольными зарядами. Такое разделение типов ингибиторов происходит главным образом из-за рН-раствора, в котором они действуют. Ингибиторы должны присутствовать в минимальной концентрации, чтобы они были полностью эффективными. Это очень часто встречается у анодных ингибиторов.
Эффективность органических ингибиторов может быть улучшена в присутствии определенных ионов галогена. Также известно, что ионы галогенов в некоторой степени ингибируют коррозию в растворах кислот. Эффективность ингибирования коррозии в порядке; I-> Br-> Cl-. Фтор не проявляет ингибирующих свойств. Синергизм ионов галогенов можно объяснить тем, что металл адсорбирует ионы галогенов, заряд которых смещает поверхность в отрицательном направлении, увеличивая тем самым адсорбцию катионного органического ингибитора. Возможность обнаружить возможные соединения, которые можно использовать в качестве ингибиторов коррозии, требует большой кропотливой работы, инноваций и лабораторного анализа / синтеза.
Возможность обнаружить возможные соединения, которые можно использовать в качестве ингибиторов коррозии, требует большой кропотливой работы, инноваций и лабораторного анализа / синтеза.
Известно, что некоторые ионы галогенов, присутствующие в органических ингибиторах, в некоторой степени ингибируют коррозию в растворах кислот. Эффективность ингибирования коррозии следующая в порядке I−> Br−> Cl−. Фтор не проявляет каких-либо ингибирующих свойств. Синергизм ионов галогенов можно объяснить тем, что металл адсорбирует ионы галогенов, заряд которых смещает поверхность в отрицательном направлении, увеличивая тем самым адсорбцию катионного органического ингибитора.
Классификация ингибиторов коррозии
Ингибиторы коррозии кратко классифицируются (рис. 11) следующим образом:
Классификация ингибиторов коррозии
На основе электродного процесса
Анодные ингибиторы
Анодный ингибитор увеличивает анодную поляризацию и, следовательно, перемещает потенциал коррозии в катодном направлении. Также называется пассивирующими ингибиторами. Анодные ингибиторы, такие как хроматы, фосфаты, вольфраматы и другие ионы переходных элементов с высоким содержанием кислорода, являются такими, которые подавляют реакцию коррозии, происходящую на аноде, путем образования труднорастворимого соединения с недавно полученным ионом металла. Они адсорбируются на поверхности металла, образуя защитную пленку или барьер, тем самым снижая скорость коррозии. Анодные ингибиторы образуют тонкую защитную пленку вдоль анода и увеличивают их потенциал и тем самым замедляют реакцию коррозии.
Также называется пассивирующими ингибиторами. Анодные ингибиторы, такие как хроматы, фосфаты, вольфраматы и другие ионы переходных элементов с высоким содержанием кислорода, являются такими, которые подавляют реакцию коррозии, происходящую на аноде, путем образования труднорастворимого соединения с недавно полученным ионом металла. Они адсорбируются на поверхности металла, образуя защитную пленку или барьер, тем самым снижая скорость коррозии. Анодные ингибиторы образуют тонкую защитную пленку вдоль анода и увеличивают их потенциал и тем самым замедляют реакцию коррозии.
Хотя этот тип контроля подвержен влиянию, он все же может быть опасным, поскольку может произойти серьезная локальная атака, если некоторые области остаются незащищенными из-за истощения ингибиторов. Ряд неорганических ингибиторов, таких как ортофосфаты, силикаты и т.д., подпадают под анодный тип. Несмотря на то, что анодные ингибиторы широко используются, некоторые из них обладают нежелательными свойствами.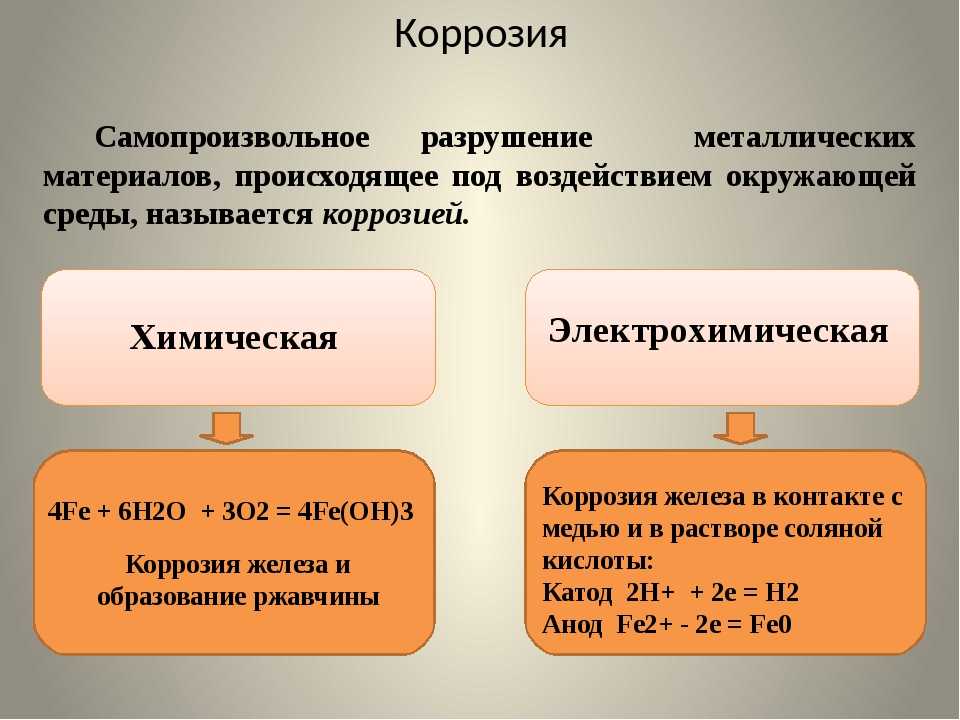 Если такие ингибиторы используются в очень низких концентрациях, они вызывают стимуляцию коррозии, например, точечной коррозии, и по этой причине анодные ингибиторы обозначаются как опасные.
Если такие ингибиторы используются в очень низких концентрациях, они вызывают стимуляцию коррозии, например, точечной коррозии, и по этой причине анодные ингибиторы обозначаются как опасные.
Существует два типа пассивирующих ингибиторов.
- Окисляющие анионы, такие как хроматы, нитриты и нитраты, которые могут пассивировать сталь в отсутствие кислорода.
- Неокисляющие ионы, такие как фосфаты, вольфраматы и молибдаты, которые требуют присутствия кислорода для пассивации стали.
Как правило, ингибиторы пассивации могут вызвать точечную коррозию и ускорить коррозию, когда концентрации упадут ниже минимальных пределов. По этой причине важно контролировать концентрацию ингибитора.
Катодные ингибиторы
Катодные ингибиторы уменьшают коррозию за счет замедления скорости реакции электрохимической коррозии. Это делается путем блокирования катодных участков осадками. Катодные ингибиторы эффективны, когда они замедляют катодную реакцию. Элементы As, Bi и Sb называются катодными ядами, которые снижают скорость реакции восстановления водорода и снижают общую скорость коррозии. Удаление кислорода из агрессивной среды значительно снизит скорость коррозии. Это можно сделать с помощью:
Это делается путем блокирования катодных участков осадками. Катодные ингибиторы эффективны, когда они замедляют катодную реакцию. Элементы As, Bi и Sb называются катодными ядами, которые снижают скорость реакции восстановления водорода и снижают общую скорость коррозии. Удаление кислорода из агрессивной среды значительно снизит скорость коррозии. Это можно сделать с помощью:
- Использование поглотителей кислорода, таких как сульфит натрия и гидразин, которые реагируют с кислородом и удаляют его из раствора.
- Вакуумная деаэрация
- Кипячение для снижения концентрации растворенного кислорода.
Катодные ингибиторы смещают потенциал коррозии в анодном направлении. Здесь катионы мигрируют к катодным поверхностям, где они осаждаются химически или электрохимически, и таким образом блокируют эти поверхности. Ингибирующее действие катодных ингибиторов происходит по трем механизмам:
- Катодные яды.
 Процесс катодного восстановления подавляется, препятствуя рекомбинации водорода и режиму защитного разряда, но увеличивает склонность металла к восприимчивости к водородному растрескиванию.
Процесс катодного восстановления подавляется, препятствуя рекомбинации водорода и режиму защитного разряда, но увеличивает склонность металла к восприимчивости к водородному растрескиванию.
- Катодные осадки: соединения, такие как кальций и магний, осаждаются в виде оксидов, образуя защитный слой, который действует как барьер на поверхности металла.
- Поглотитель кислорода: эти соединения реагируют с кислородом, присутствующим в системе, с образованием продукта и снижают коррозию. Например, As3 + и Sb3 + при растворении Fe в кислотах.
Смешанные ингибиторы
Эти ингибиторы замедляют как анодные, так и катодные процессы, вовлеченные в процесс коррозии, и поэтому называются смешанными ингибиторами. Как правило, они представляют собой пленкообразующие соединения, которые вызывают образование осадков на поверхности, косвенно блокируя как анодные, так и катодные участки. Анодные ингибиторы являются, по большей части, опасными ингибиторами, особенно если их концентрации слишком малы. Но катодные ингибиторы, как правило, безопасны. Смешанные ингибиторы менее опасны, чем чистые анодные ингибиторы, и в ряде случаев они могут не увеличивать интенсивность коррозии. Наиболее распространенными ингибиторами этой категории являются силикаты и фосфаты. Такие ингибиторы будут иметь большее преимущество в том, что они контролируют как катодную, так и анодную реакции коррозии.
Анодные ингибиторы являются, по большей части, опасными ингибиторами, особенно если их концентрации слишком малы. Но катодные ингибиторы, как правило, безопасны. Смешанные ингибиторы менее опасны, чем чистые анодные ингибиторы, и в ряде случаев они могут не увеличивать интенсивность коррозии. Наиболее распространенными ингибиторами этой категории являются силикаты и фосфаты. Такие ингибиторы будут иметь большее преимущество в том, что они контролируют как катодную, так и анодную реакции коррозии.
На основе окружающей среды
Ингибиторы кислой среды
Неорганические ингибиторы
Такие соединения, как As2O3, Sb2O3, были описаны в качестве ингибиторов в кислых средах. В этом случае защита обусловлена уменьшением электро положительных ионов и осаждением на поверхности металла и снижением перенапряжения главной катодной реакции деполяризации. Недавно было показано, что добавление ионов тяжелых металлов, таких как Pb2 +, Ti +, Mn2 + и Cd2 +, как установлено, ингибирует коррозию железа в кислотах.
Недавно было показано, что добавление ионов тяжелых металлов, таких как Pb2 +, Ti +, Mn2 + и Cd2 +, как установлено, ингибирует коррозию железа в кислотах.
Органические ингибиторы
Органические соединения, содержащие кислород, азот, серу с множественными связями, являются хорошими ингибиторами коррозии. Многие органические ингибиторы, такие как амины, альдегиды, алкалоиды, нитро- и нитрозосоединения, были изучены и опробованы в качестве ингибиторов коррозии. Органические ингибиторы могут быть анодного, катодного и смешанного типа в зависимости от их реакции на поверхности металла и потенциала. Они эффективны в зависимости от его размера, длины углеродной цепи, ароматичности, сопряжения и природы атомов связи.
Щелочные ингибиторы
Металлы, которые образуют амфотерные оксиды, подвержены коррозии в щелочных растворах. Многие органические соединения часто используются в качестве ингибиторов для металлов в основных растворах [41]. Соединения, такие как тиомочевина, замещенные фенолы, нафтол, β-дикетон и т. Д., Использовались в качестве эффективных ингибиторов в основных растворах вследствие образования металлические комплексы.
Многие органические соединения часто используются в качестве ингибиторов для металлов в основных растворах [41]. Соединения, такие как тиомочевина, замещенные фенолы, нафтол, β-дикетон и т. Д., Использовались в качестве эффективных ингибиторов в основных растворах вследствие образования металлические комплексы.
Нейтральные ингибиторы
Ингибиторы, которые эффективны в кислых растворах, не работают эффективно в нейтральных растворах, поскольку механизм в обоих растворах различен. В нейтральных растворах происходит взаимодействие ингибиторов с покрытой оксидом поверхностью металла и предотвращение реакции восстановления кислорода на катодных участках. Такие ингибиторы защищают поверхностные слои от агрессивности. Было обнаружено, что некоторые поверхностно-активные хелатные ингибиторы являются эффективными ингибиторами в почти нейтральных растворах.
В зависимости от режима защиты
Химические пассиваторы
Вещества, которые обычно имеют достаточно высокий равновесный потенциал (окислительно-восстановительный или электродный потенциал) и достаточно низкий по сравнению с потенциалом, снижают скорость коррозии при достижении пассивности и называются химическими пассиваторами. Например, нитриты используются в качестве ингибиторов охлаждающей воды от замерзания. Хроматы в основном используются в качестве ингибиторов для рециркуляции охлаждающей воды. Молибдат цинка используется в качестве ингибирующего пигмента для красок.
Например, нитриты используются в качестве ингибиторов охлаждающей воды от замерзания. Хроматы в основном используются в качестве ингибиторов для рециркуляции охлаждающей воды. Молибдат цинка используется в качестве ингибирующего пигмента для красок.
Ингибиторы адсорбции
Они представляют собой наиболее широко используемый класс ингибиторов. Как правило, они представляют собой органические соединения, которые адсорбируются на поверхности металла и обеспечивают защитный эффект по всей поверхности, то есть как в катодном, так и в анодном случаях. Обычно они одинаково влияют как на катодную, так и на анодную реакцию, но во многих случаях эффект может быть не одинаковым. Они обычно используются при кислотном травлении горячекатаных продуктов для удаления окалины и, таким образом, известны как ингибиторы травления. Примеры: соединения, содержащие неподеленные пары электронов, такие как атомы азота в аминах, хинолины, атомы серы в тиосоединениях и атомы кислорода в альдегидах.
Ингибиторы пленкообразования
В отличие от ингибиторов адсорбции, которые образуют прямую адсорбированную пленку ингибирующих частиц, многие вещества, называемые ингибиторами пленкообразования, по-видимому, останавливают коррозию, образуя блокирующую или барьерную пленку из материала, отличного от фактических ингибирующих частиц. Такие материалы имеют тенденцию быть специфичными либо к катоду, либо к аноду. Соли цинка и кальция являются наиболее распространенными примерами катодных пленкообразующих ингибиторов. Бензоат является распространенным примером ингибиторов формирования анодной пленки, которые ингибируют коррозию во время рейсов.
Ингибиторы паровой фазы
Атмосферная коррозия металлов в закрытых помещениях, например, во время хранения и транспортировки может быть предотвращена путем использования определенных веществ, называемых ингибиторами паровой фазы, также называемыми летучими ингибиторами (VCI). Это вещества низкого, но значительного давления пара. Пар входит в контакт с поверхностью металла, и происходит адсорбция ингибитора. Влага затем гидролизует ее и выделяет защитные ионы, которые обладают свойствами, препятствующими коррозии. Рисунок 12 показывает схематическое изображение паровой фазы ингибиторов. Примеры: дициклогексиламин хромат и бензотриазол для защиты меди. Хромат фенилтиомочевины и циклогексиламина для латуни. Нитрит дициклогексиламина для черных и цветных металлов.
Это вещества низкого, но значительного давления пара. Пар входит в контакт с поверхностью металла, и происходит адсорбция ингибитора. Влага затем гидролизует ее и выделяет защитные ионы, которые обладают свойствами, препятствующими коррозии. Рисунок 12 показывает схематическое изображение паровой фазы ингибиторов. Примеры: дициклогексиламин хромат и бензотриазол для защиты меди. Хромат фенилтиомочевины и циклогексиламина для латуни. Нитрит дициклогексиламина для черных и цветных металлов.
Рис. 12. Схематическое изображение паровой фазы ингибиторов.
Летучие ингибиторы или ингибиторы паровой фазы
Летучие ингибиторы коррозии (VCI) представляют собой соединения, которые переносятся в закрытой среде на место коррозии путем испарения из источника (рис. 15). Если продукт коррозии является летучим, он испаряется, как только он образуется, тем самым оставляя основную металлическую поверхность открытой для дальнейшего воздействия. Это вызывает быструю и постоянную коррозию, ведущую к чрезмерной коррозии. Например, оксид молибдена (MoO3), продукт окислительной коррозии молибдена, является летучим. В процессе с закрытым паром (транспортировочные контейнеры) летучие твердые вещества, такие как соли дициклогексиламина, циклогексиламина и экзаметиленамина, используются в качестве летучих ингибиторов коррозии [52].
Это вызывает быструю и постоянную коррозию, ведущую к чрезмерной коррозии. Например, оксид молибдена (MoO3), продукт окислительной коррозии молибдена, является летучим. В процессе с закрытым паром (транспортировочные контейнеры) летучие твердые вещества, такие как соли дициклогексиламина, циклогексиламина и экзаметиленамина, используются в качестве летучих ингибиторов коррозии [52].
Синергетические ингибиторы
Это единственный ингибитор, который используется в системах охлаждения воды. Чаще всего комбинация ингибиторов (анодных и катодных) используется для улучшения антикоррозионных свойств. Примеры включают хромат-фосфаты, полифосфатсиликаты, цинк-дубильные вещества и цинк-фосфаты.
Ингибиторы осадков
Это соединения, которые образуют осадки на поверхности металла, обеспечивая тем самым защитную пленку. Наиболее распространенными ингибиторами этой категории являются силикаты и фосфаты. Например, силикат натрия, используется во многих бытовых умягчителях воды для предотвращения возникновения ржавчины.
Наиболее распространенными ингибиторами этой категории являются силикаты и фосфаты. Например, силикат натрия, используется во многих бытовых умягчителях воды для предотвращения возникновения ржавчины.
Зеленые ингибиторы коррозии
Не существует четкого и общепринятого определения «экологически чистых» или «зеленых» ингибиторов коррозии. На практике исследования по ингибированию коррозии стали ориентироваться на здоровье и безопасность человека. С этой целью в последнее время исследователи сосредоточились на использовании экологически чистых соединений, таких как растительные экстракты, нетоксичные лекарства с истекшим сроком годности и т. д., которые содержат много органических соединений. Используются аминокислоты, алкалоиды, пигменты и дубильные вещества
как более экологичные альтернативы для токсичных и опасных соединений. Из-за способности к биологическому разложению, экологичности, низкой стоимости и доступности, экстракты некоторых распространенных растений и лекарственных растений и их продуктов были изучены как ингибиторы коррозии для различных металлов и сплавов в различных условиях окружающей среды.
Из-за способности к биологическому разложению, экологичности, низкой стоимости и доступности, экстракты некоторых распространенных растений и лекарственных растений и их продуктов были изучены как ингибиторы коррозии для различных металлов и сплавов в различных условиях окружающей среды.
Механизм ингибирования коррозии
Механизм процесса ингибирования рассматриваемых ингибиторов коррозии обусловлен главным образом адсорбцией. Явление адсорбции зависит от природы и поверхностного заряда металла, а также от химической структуры ингибиторов. Поверхностный заряд металла обусловлен электрическим полем, возникающим на границе раздела при погружении в электролит. Ингибирование обычно является результатом одного или нескольких из следующих механизмов
- Адсорбция ингибиторов коррозии на металлы
Эффективность ингибирования обычно зависит от доли покрытой поверхности, θ с адсорбированным ингибитором. Но при низком покрытии поверхности (θ <0,1) эффективность адсорбированных частиц ингибитора в замедлении реакций коррозии может быть выше, чем при высоком покрытии поверхности.
Но при низком покрытии поверхности (θ <0,1) эффективность адсорбированных частиц ингибитора в замедлении реакций коррозии может быть выше, чем при высоком покрытии поверхности.
- Наличие поверхностного заряда на металле
Адсорбция ингибитора на поверхности металла может быть обусловлена диполями адсорбированных частиц или электростатической силой притяжения между ионными зарядами и электрическим зарядом на металле на границе раздела металл / раствор.
- Влияние функциональной группы и структуры
Обычно, когда металл содержит свободные электронные орбитали низкой энергии, такие как переходные металлы. Анионы и нейтральные органические молекулы, содержащие неподеленную пару электронов или электронные системы, связанные с множественными связями, особенно с тройными связями или ароматическими кольцами. Плотность электронов в функциональной группе прямо пропорциональна ингибирующей эффективности в ряду родственных соединений.
- Ингибитор и взаимодействие молекул воды
Молекулы адсорбированной воды удаляются с поверхности металла за счет реакции вытеснения адсорбированных молекул ингибитора и увеличивают размер углеводородной части ингибитора, что приводит к снижению растворимости и увеличению адсорбционной способности. Это согласуется с увеличением ингибирующей эффективности, наблюдаемым при постоянных концентрациях с увеличением размера молекулы в ряду родственных соединений.
- взаимодействие между адсорбированными видами ингибиторов
Боковое взаимодействие между адсорбированными видами ингибиторов может значительно увеличить покрытие поверхности и адсорбированные виды. Эти взаимодействия либо привлекательны, либо отвратительны. Если между молекулами, содержащими большие углеводородные компоненты (например, н-алкильные цепи), происходят привлекательные взаимодействия, возможно, длина цепи увеличивается. Тогда возрастающая сила притяжения Ван-дер-Ваальса между соседними молекулами приводит к более сильной адсорбции при большом покрытии.
Тогда возрастающая сила притяжения Ван-дер-Ваальса между соседними молекулами приводит к более сильной адсорбции при большом покрытии.
- Адсорбированная реакция ингибиторов
Адсорбированный ингибитор коррозии может обычно реагировать путем химического или электрохимического восстановления с образованием продукта, который может проявлять ингибирующее действие. Процесс добавления небольшого количества вещества называется первичным ингибированием, а продукт реакции – вторичным ингибированием. В этих случаях ингибирующая эффективность может увеличиваться или уменьшаться со временем, это зависит от степени вторичного ингибирования, более эффективного, чем первичное ингибирование. Например, сульфоксиды могут быть восстановлены до сульфидов, которые являются более эффективными ингибиторами.
- Формирование диффузионного барьера
Поглощенные молекулы ингибитора могут образовывать поверхностный слой, который действует как физический барьер для диффузии ионов или молекул и к поверхности металла или с нее и, следовательно, замедляет скорость реакций коррозии. Поверхностная пленка этих типов ингибиторов влияет как на анодную, так и на катодную реакцию.
Поверхностная пленка этих типов ингибиторов влияет как на анодную, так и на катодную реакцию.
- Блокировка сайтов реакции
Блокировка уменьшает количество атомов металла, при которых могут происходить реакции коррозии. При этом механизмы реакций не затрагиваются, а наклоны Тафеля на поляризационных кривых остаются неизменными.
- Электродные реакции
Реакции коррозии включают образование адсорбированных промежуточных молекул с поверхностными атомами металла. Адсорбированные ингибиторы будут препятствовать образованию этих адсорбированных промежуточных продуктов, но электродные процессы могут протекать альтернативными путями через промежуточные продукты, содержащие ингибитор. В этом процессе ингибитор действует как катализатор и остается неизменным. Такие реакции ингибитора характеризуются увеличением тафелевского наклона при анодном растворении металла. Ингибиторы могут также замедлять скорость выделения водорода на металлах, влияя на механизм реакции. Этот эффект наблюдался на железе в присутствии ингибиторов, таких как фенилтиомочевина, производные анилина, бензальдегид производные и соли пиридиния.
Этот эффект наблюдался на железе в присутствии ингибиторов, таких как фенилтиомочевина, производные анилина, бензальдегид производные и соли пиридиния.
- Электрическая двухслойная переделка
Адсорбция ионов или частиц, которые могут образовывать ионы на металлических поверхностях, изменит двойной электрический слой на границе раздела металл / раствор, и это повлияет на скорость электрохимических реакций]. Адсорбция катионов, таких как ионы четвертичного аммония и протонированные амины, делает потенциал более положительным в плоскости ближайшего сближения с ионами металлов из раствора. Этот положительный сдвиг потенциала препятствует разряду положительно заряженных ионов водорода. Эти эффекты наблюдались для сульфосалицилат-ионов и бензоат-ионов.
Вывод
- Коррозия – это естественный процесс, который снижает энергию связи в металлах и ухудшает полезные свойства материалов.
- Конечный результат коррозии включает окисление атома металла, в результате чего он теряет один или несколько электронов.

- Коррозия проявляется в распаде сыпучего металла до металлического порошка.
- Ингибиторы коррозии – отличный эффективный метод предотвращения коррозии.
- Знание метода действия облегчает выбор ингибиторов, повышает эффективность, позволяет избежать нарушения процесса и побочных эффектов.
- При выборе ингибитора важно, каким бы ни был метод, выяснить последующее воздействие этого на окружающую среду.
- Экологически чистые ингибиторы показали отличные результаты, превосходя обычные ингибиторы.
Загрязнение атмосферного воздуха: источники и причины загрязнения
Чебоксарский район Чувашской Республики Чăваш Республикин Шупашкар районĕ
Версия для слабовидящих
- Главная
- Пресс-центр
- Новости иных ведомств
Загрязнение воздуха – это основная причина глобальной экологической угрозы. Международная организация труда определяет загрязнение воздуха как наличие в воздухе веществ, которые вредны для здоровья или опасны по другим причинам, независимо от их физической формы. Сжигание ископаемого топлива, сельскохозяйственная деятельность и добыча полезных ископаемых – это лишь некоторые причины загрязнения воздуха. Чаще всего и больше всего загрязняют атмосферу: углекислый газ, двуокись серы, оксиды азота и пыль.
Международная организация труда определяет загрязнение воздуха как наличие в воздухе веществ, которые вредны для здоровья или опасны по другим причинам, независимо от их физической формы. Сжигание ископаемого топлива, сельскохозяйственная деятельность и добыча полезных ископаемых – это лишь некоторые причины загрязнения воздуха. Чаще всего и больше всего загрязняют атмосферу: углекислый газ, двуокись серы, оксиды азота и пыль.
Источники загрязнения воздуха
Воздух загрязняют любые вещества: газообразные, твердые и жидкие, если они содержаться в нем в количествах, превышающих их среднее содержание. Загрязнение атмосферного воздуха делится на пылевое и газовое. Всемирная организация здравоохранения определяет загрязненный воздух как таков, если его химический состав может отрицательно влиять на здоровье людей, растений и животных, а также на другие элементы окружающей среды (воду, почву). Загрязнение воздуха – это наиболее опасное из всех видов загрязнений, поскольку оно мобильно и может загрязнять практически все компоненты окружающей среды на больших территориях.
Основные источники загрязнения воздуха:
- индустриализация и растущее население,
- энергетическая отрасль,
- транспортная индустрия,
- природные источники.
Растущий спрос на энергию сделал сжигание углеводородов главным источником загрязнения атмосферы антропогенного происхождения.
Чем загрязнен воздух?
Наиболее опасными загрязнителями атмосферы являются:
- диоксид серы (SO2),
- оксиды азота (NxOy),
- угольная пыль (X2),
- летучие органические соединения (бензапирен),
- окись углерода (СО),
- диоксид углерода (CO2),
- тропосферный озон (O3),
- свинец (Pb),
- взвешенная пыль.
Антропогенные источники загрязнения воздуха включают:
- выбросы на малых высотах,
- химическая конверсия топлива,
- добыча и транспортировка сырья,
- химическая промышленность,
- перерабатывающая промышленность,
- металлургическая промышленность,
- производство цемента,
- свалки для сырья и отходов,
- моторизация.

Природные источники загрязнения воздуха:
- извержения вулканов,
- химическое выветривание горных пород,
- лесные и степные пожары,
- молнии,
- космическая пыль,
- биологические процессы.
Загрязненный воздух поглощается людьми в основном во время дыхания. Он способствует развитию респираторных заболеваний, аллергии, а также нарушений репродуктивной функции. В быту человека загрязнение атмосферного воздуха вызывает коррозию металлов и строительных материалов. Оно также негативно влияет на растительный мир, нарушая процессы фотосинтеза, транспирации и дыхания. Загрязненный воздух также ухудшает состояние воды и почвы. В глобальном масштабе загрязнение воздуха оказывает влияние на изменение климата. Загрязнение воздуха также повышает кислотность питьевой воды. Это вызывает увеличение содержания свинца, меди, цинка, алюминия и даже кадмия в воде, поступающей в наши квартиры. Вода с повышенной кислотностью разрушает водопроводные системы, вымывая из них различные токсичные вещества.
Вода с повышенной кислотностью разрушает водопроводные системы, вымывая из них различные токсичные вещества.
Существует три основных вида источников выбросов в атмосферу:
- точечные – это в основном крупные промышленные предприятия, выделяющие пыль, диоксид серы, оксид азота, оксид углерода, тяжелые металлы;
- площадные (рассеянные) – это домашние котлы и печи, локальные котельные, небольшие промышленные предприятия, выделяющие в основном пыль и диоксид серы;
- линейные – это загрязняющие источники, которые имеют большую протяжность. Ответственные за выбросы оксидов азота, оксидов углерода, ароматических углеводородов, тяжелых металлов (прежде всего свинца из этила, в настоящее время платины, палладия и родия из автомобильных катализаторов).
Последствия загрязнения воздуха включают:
- Кислотные дожди – осадки с низким уровнем pH. Они содержат серную кислоту, образованную в атмосфере, загрязненной оксидами серы в результате сжигания сульфатированного угля, а также азотную кислоту, образованную из оксидов азота.
 По некоторой информации, кислотные дожди увеличивают младенческую смертность и риск развития болезней легких, а также вызывают окисление рек и озер, уничтожение флоры и фауны, деградацию почв, разрушение памятников и архитектуры.
По некоторой информации, кислотные дожди увеличивают младенческую смертность и риск развития болезней легких, а также вызывают окисление рек и озер, уничтожение флоры и фауны, деградацию почв, разрушение памятников и архитектуры. - Смог – загрязненный воздух, содержащий высокую концентрацию пыли и токсичных газов, источником которого являются в основном автомобили и промышленные предприятия.
- Вонь (неприятные запахи) – результат присутствия в воздухе загрязнителей, которые раздражают обонятельные рецепторы. Чаще всего вонь представляет собой смесь большого количества различных соединений, присутствующих в очень небольших количествах. Влияние неприятных запахов на здоровье человека обычно психосоматическое. Решение проблемы загрязнения воздуха, связанной с неприятным запахом, требует использования специальных аналитических методов (сенсорный анализ, ольфактометр).
- Озоновые дыры – уменьшение содержания озона (O3) на высоте 15-20 км, в основном на Южном полюсе, которое наблюдается с конца 1980-х годов.
 Скорость снижения составляет около 3% в год. Наибольшее значение в этом процессе имеют хлорфторуглероды (фреоны), из которых выделившийся хлор (под воздействием ультрафиолетового излучения) атакует молекулы озона, что приводит к выделению кислорода (O2) и оксида хлора(II) (ClO). Скорость глобального снижения уровня стратосферного озона в результате деятельности человека (за исключением Антарктиды), оцененная на основе спутниковых исследований, составляет 0,4-0,8% в год в северных умеренных широтах и менее 0,2% в тропиках. Озоновый слой – это природный фильтр, который защищает живые организмы от вредного ультрафиолетового излучения. В 1995 году Нобелевская премия по химии была присуждена за исследования влияния фреонов на атмосферный озон, а также за исследования образования и реакций атмосферного озона.
Скорость снижения составляет около 3% в год. Наибольшее значение в этом процессе имеют хлорфторуглероды (фреоны), из которых выделившийся хлор (под воздействием ультрафиолетового излучения) атакует молекулы озона, что приводит к выделению кислорода (O2) и оксида хлора(II) (ClO). Скорость глобального снижения уровня стратосферного озона в результате деятельности человека (за исключением Антарктиды), оцененная на основе спутниковых исследований, составляет 0,4-0,8% в год в северных умеренных широтах и менее 0,2% в тропиках. Озоновый слой – это природный фильтр, который защищает живые организмы от вредного ультрафиолетового излучения. В 1995 году Нобелевская премия по химии была присуждена за исследования влияния фреонов на атмосферный озон, а также за исследования образования и реакций атмосферного озона. - Парниковый эффект – явление, происходящее в атмосфере планеты, вызывающее повышение температуры планеты, в том числе и Земли. Эффект вызван атмосферными газами, называемыми парниковыми газами, которые ограничивают тепловое излучение от поверхности Земли и нижней атмосферы в космос.

- Загрязнение воздуха, вызванное автомобилями, является причиной около 1/4 смертей в крупных городах. Помимо пыли, автотранспорт является источником эмиссии двуокиси азота, вещества, из-за которого в центре скандала оказался немецкий автопроизводитель Volkswagen, подделывавший результаты экологических испытаний своих автомобилей.
Распечатать
Поделиться
Этапы урока |
Деятельность учителя – организация работы в группе, наблюдение за результатами, оценка деятельности консультантов, подведение итогов |
Деятельность учащихся – индивидуальные ответы, работа в парах внутри основной группы, работа групп, взаимооценка. |
|||||||||
1. Организационный |
При входе в класс каждый учащийся получает карточку определенного цвета (случайный выбор), рассаживаются по группам в соответствии с цветом карточки. Объявление темы и целей урока (слайд №1). Выдаются карточки для работы у доски. |
||||||||||
2. Актуализация знаний |
1. У доски 3 отвечающих, вопросы записаны на карточках (приложение №1), ответы оценивает учитель, возможны дополнения и комментарии учащихся. |
||||||||||
2. «Тихий» опрос, работа в парах, на местах, вопросы записаны на карточках (приложение №2), ответы оценивают обучающиеся – взаимооценка, оценки выставляются в оценочный лист (по 1 баллу) (слайд №2): |
|||||||||||
|
Высокая электрическая проводимость металлов обусловлена присутствием в их кристаллических решетках подвижных электронов, которые направленно перемещаются под действием электрического поля. |
||||||||||
|
Это наука о методах и процессах производства металлов из руд и других металлосодержащих продуктов, о получении сплавов и способах обработки металлов |
||||||||||
|
Это методы переработки руд, основанные на химических реакциях, происходящих при высоких температурах. |
||||||||||
|
Металлы находятся в природе как в свободном виде – самородные металлы, так и в виде различных соединений. В свободном состоянии в природе встречаются такие металлы, которые трудно окисляются кислородом воздуха, например, Pt, Au, Ag и др. |
||||||||||
3. Изучение нового материала – 17 мин. (5-минут на изучение вопроса, по 3 минуты для каждой группы на выступление лидера). |
Максимальная оценка за работу по изучению нового материала – 10 баллов. Распределяют баллы внутри группы сами участники, согласно вкладу каждого из них (взаимооценка). |
||||||||||
1 группа (красные карточки). Что такое коррозия, и какой вред она наносит промышленности? Почему? Работа со справочной литературой. На экране слайд №1 |
В мире ежегодно получают огромное количество различных металлов и сплавов, и примерно 10% этого количества разрушается в результате коррозии. Коррозией (от лат. corrodere — разъедать) называется самопроизвольное разрушение металлов и сплавов под влиянием окружающей среды. Коррозию металлов и сплавов (их окисление) вызывают такие компоненты окружающей среды, как вода, кислород, оксиды углерода и серы, появившиеся в воздухе, водные растворы солей (морская вода, грунтовые воды). Эти компоненты непосредственно окисляют металлы — происходит. И так, коррозия приводит к разрушению металлов и сплавов. Но только потеря металлов, но и порча изготовленных из них изделий обходится очень дорого. Затраты на ремонт или на замену деталей судов, автомобилей, аппаратуры химических производств, приборов и коммуникаций во много раз превышают стоимость металла, из которого они изготовлены. Кроме этого коррозия вызывает серьезные экологические последствия. |
||||||||||
2 группа (синие карточки) Вспомните, как действуют кислоты на металлы? Вода на активные металлы? Как взаимодействуют металлы с кислородом? Запишите уравнения реакций.Ответьте на вопрос: «Что такое химическая коррозия?» Работа со справочной литературой. Дополнительный вопрос: назовите типы реакций и их характер. |
Уравнения записаны на листе, затем на доске: Zn + 2HCl = ZnCl2 + H2 Cu + HCl ≠ Вывод: активные металлы, стоящие в ряду напряжений левее водорода, взаимодействуют с кислотами с выделением Н2. 2K + 2H2O = 2KOH + H2 Вывод: активные металлы вытеснят водород из воды 2Zn + O2 = 2ZnO Вывод: образуются оксиды металлов. Металл разрушается – корродирует. При этом разности потенциалов не возникает – коррозия называется химической. Реакции замещения, окислительно-восстановительные. |
||||||||||
3 группа – (желтые карточки) Химически чистое железо почти не корродирует. Вместе с тем, техническое железо, которое содержит различные примеси, ржавеет. Почему? Что такое электрохимическая коррозия?
Проведите исследование, сделайте выводы: 1. Сравните результаты опытов: №1 – гвоздь опущен в раствор хлорида натрия и №2 – гвоздь/медь + раствор хлорида натрия. |
Одной из причин возникновения коррозии является наличие примесей в металле, его неоднородность. Особенно сильно корродирует металл во влажном воздухе и воде. В местах соприкосновения двух металлов возникает разность потенциалов, происходит окислительно-восстановительная реакция. Очевидно, что скорость процесса коррозии при контакте железа с медью намного больше (образуется гальванический элемент), т.к. в опыте №2 образуется намного больше ржавчины по сравнению с результатом опыта №1. Железо, как более активный металл, будет постепенно растворяться, переходя в раствор в виде ионов железа: Fe0 – 2e = Fe2+. При этом электроны, высвободившиеся из атомов железа, перейдут к меди и на ее поверхности соединятся с ионами водорода, выделившимися из компонентов водной среды: Н20 + 2e = Н2 + 2ОН–. Образование ржавчины можно записать с помощью уравнений реакций: Fe2+ + 2OH– = Fe(OH)2↓ 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3↓ |
||||||||||
|
Сделайте вывод. |
Результат опыта №3 показывает, что разрушается (корродирует) цинк как более активный металл, образуется не ржавчина, а гидроксид цинка: Zn2+ + 2OH– = Zn(OH)2 Результаты можно объяснить исходя из положения металлов в электрохимическом ряду. Если два различных металла, находящихся в контакте между собой, опустить в водный раствор электролита, то металл более активный, расположенный в электрохимическом ряду напряжений левее, будет разрушаться, предохраняя тем самым менее активный металл от коррозии. |
|||||||||
4 группа (зеленые карточки) Рассмотрите, как влияет на процессы коррозии внешняя среда. С этой целью сравните результаты опытов: а)опыты №4 – гвоздь + водная среда и №1 – гвоздь + раствор хлорида натрия. б)опыты №1 – гвоздь + раствор хлорида натрия и №5 – гвоздь + раствор хлорида натрия + раствор гидроксида натрия. |
а) Скорость коррозии больше в среде, содержащей хлорид натрия. В реальных условиях металл окружают грунтовые воды, содержащие ионы хлора, сульфат-ионы и др., сконденсированная влага из атмосферы, которая не имеет нейтральной реакции, а содержат часто ионы водорода, известно такое выражение, как «кислотные дожди». б) При добавлении в раствор хлорида натрия гидроксида натрия скорость коррозии уменьшается. Ионы хлора усиливают коррозию, а гидроксид-ионы – подавляют ее. |
||||||||||
4. Закрепление – 10 мин. |
На защиту металлов и сплавов от коррозии тратятся большие средства. Зная об условиях течения процессов коррозии, вы сможете сами предложить способы защиты от нее. Составить таблицу. |
Приложение №5 Максимальная оценка – 3 балла.
Запись на экране (слайд №3,4). Проверка на экране (слайд №5). |
|||||||||
|
В заключение урока подведем итог: сможем ли мы применить полученные знания на практике? Вопросы на экране (слайд №6). |
||||||||||
В подвале дома обнаружили ящик с гвоздями, но от неправильных условий хранения многие из них были покрыты ржавчиной. |
|||||||||||
Что представляет собой ржавчина с химической точки зрения? |
Гидроксид железа (III) |
||||||||||
Каким простым способом можно удалить ржавчину? |
Протереть раствором соляной кислоты или уксуса. |
||||||||||
Молодая хозяйка повесила сушить белье на железную проволоку, натянутую между стойками. Когда белье высохло, она с ужасом обнаружила на чистом белье желтые полосы. |
|||||||||||
Как объяснить появление полос на белье? |
Ржавчина. |
||||||||||
Как можно избавиться от этих пятен? |
Лимонной кислотой. |
||||||||||
В домашней мастерской всегда много инструментов, запчастей и материалов, которые в основном изготовлены из металлов и их сплавов. Но вот беда — при хранении металлические изделия подвергаются коррозии. |
|||||||||||
Укажите условия хранения металлических изделий, которые продлят срок их службы. |
Использовать защитные покрытия – смазки, краски, лаки.
|
||||||||||
Соляная кислота с добавкой ингибитора нашла применение для очистки паровых котлов от отложений накипи и удаления с поверхности металлов ржавчины и окалины. |
|||||||||||
Почему? |
Накипь, ржавчина и оксиды металлов в кислоте растворяются, а металл в кислоте в присутствии ингибитора не растворяется. |
||||||||||
Домашнее задание (слайд№7) |
учебник Г.Е. Рудзитис, Химия-11, Москва, Просвещение, 2008 |
||||||||||
Общие способы получения металлов. Коррозия 11 класс онлайн-подготовка на Ростелеком Лицей
Нахождение металлов в природе
Металлы присутствуют в природе как в самородном состоянии (самородные металлы), так и в виде различных соединений. В свободном состоянии присутствуют в природе металлы, которые либо плохо окисляются кислородом, либо совсем не окисляются. Например, платина, золото, серебро. Реже – медь, ртуть и некоторые другие. Самородные металлы встречаются в природе в небольших количествах в виде зерен или вкраплений в различных минералах. Лишь изредка они образуют большие куски – самородки. Самый большой самородок золота весил 112 кг. Иногда металлы практически в чистом виде содержатся в метеоритах. Так, некоторые предметы из высокочистого железа, найденные археологами, объясняются именно тем, что они были изготовлены из метеоритного железа. Но чаще всего металлы существуют в природе в связанном состоянии в составе минералов.
В свободном состоянии присутствуют в природе металлы, которые либо плохо окисляются кислородом, либо совсем не окисляются. Например, платина, золото, серебро. Реже – медь, ртуть и некоторые другие. Самородные металлы встречаются в природе в небольших количествах в виде зерен или вкраплений в различных минералах. Лишь изредка они образуют большие куски – самородки. Самый большой самородок золота весил 112 кг. Иногда металлы практически в чистом виде содержатся в метеоритах. Так, некоторые предметы из высокочистого железа, найденные археологами, объясняются именно тем, что они были изготовлены из метеоритного железа. Но чаще всего металлы существуют в природе в связанном состоянии в составе минералов.
Минерал – это химически и физически индивидуализированный продукт природной физико-химической реакции, находящийся в кристаллическом состоянии.
Очень часто это оксиды. Например, оксид железа (III) Fe2O3 – гематит, или красный железняк (рис. 1).
1).
Рис. 1
Fe3O4 – магнетит, или магнитный железняк. Нередко минералами являются сульфидные соединения: галенит ZnS, киноварь HgS.
Активные металлы часто присутствуют в природе в виде солей (сульфаты, нитраты, хлориды, карбонаты).
Минералы входят в состав горных пород и руд. Рудами называются природные образования, содержащие минералы в таком количестве, чтоб из этих руд было выгодно получать металлы. Обычно перед получением металла из руды руду обогащают, удаляя пустую породу и различные примеси. При этом образуется концентрат, который и является исходным сырьем для металлургической промышленности.
Способы получения металлов
Существуют различные способы обогащения руды. Один из них – флотация.
Для получения металлов из руд необходимо перевести металлы из руд в какую-нибудь единую форму, чаще всего в форму оксидов.
2CuS +3O2 2CuO + 2SO2
4FeS2 + 11O2 2Fe2O3 + 8SO2
Полученные оксиды можно восстанавливать несколькими способами.
1. Один из основных – это металлотермия.
- Алюмотермия (алюминотермия)
Cr2O3 + 2Al 2Al2O3 + 2Cr
- Магниетермия
Fe2O3 + 3Mg 3MgO + 2Fe
Можно проводить восстановление и другими веществами.
CuO + C → Cu + CO↑
NiO + H2 → Ni + H2O
2. Термическое разложение соединений металлов.
2AlH3 2Al + 3H2↑
Fe(CO)5 Fe + 5CO↑
TiI4 Ti + 2I2
Этот метод применяется для получения высокочистых металлов.
3. Электролитическое получение металлов.
Металлы, особенно активные, можно получить при электролизе расплавов электролитов. Для щелочных металлов – это единственный способ их получения. Возможно получение металлов при электролизе водных растворов солей. Катионы металлов, расположенных в электрохимическом ряду напряжений до водорода, разряжаются на катоде в той или иной степени одновременно с молекулами воды. А в случае солей металлов, расположенных правее водорода, на катоде получается только соответствующий металл.
А в случае солей металлов, расположенных правее водорода, на катоде получается только соответствующий металл.
4. Более активный металл вытесняет менее активный из раствора его соли.
CuSO4 + Fe → FeSO4 + Cu
В таких реакциях нельзя использовать щелочные и щелочноземельные металлы, потому что они реагируют с водой.
Коррозия металлов и сплавов
Коррозия – самопроизвольное разрушение металлов и сплавов под воздействием окружающей среды. Коррозию металлов и сплавов вызывают такие компоненты окружающей среды, как вода, кислород, оксиды углерода и серы, содержащиеся в воздухе, морская вода и грунтовые воды.
По типу агрессивных сред, в которых протекает коррозия, она может быть следующих видов:
- Газовая коррозия
- Атмосферная коррозия
- Коррозия в неэлектролитах
- Коррозия в электролитах
- Подземная коррозия
- Биокоррозия
Рис. 2
2
Чаще всего коррозии подвергаются изделия из железа (рис. 2).
Особенно сильно корродируют металлы во влажном воздухе и в воде. В повседневной жизни для сплавов железа чаще всего использую термин «ржавление». Химически чистое железо ржавеет медленно, техническое железо, содержащее различные примеси, ржавеет быстро. Коррозия зависит не только от химического состава объекта, но и от того, какие примеси и в каком количестве этот объект содержит.
Способы борьбы с коррозией
1. Нанесение различных покрытий на поверхность металла (краски, эмали, другой металл) (рис. 3).
Рис. 3
2. Использование нержавеющих сплавов, добавки к железу Cr. Ni. Ti (рис. 4).
Рис. 4
3. Введение ингибиторов коррозии.
4.Контакт с более активным металлом, протектором. Сначала будет корродировать протектор, потом защищаемый металл.
Йодистое рафинирование и галогеновые лампы
Для многих целей необходим высокочистый титан. Он широко используется в судостроении, авиации и космической технике, так как он прочный, пластичный и коррозионностойкий. Для получения высокочистого титана и некоторых других металлов используется метод йодистого рафинирования (рис. 5). Этот метод заключается в следующем. Титан с примесями и твердый йод загружают в нижнюю часть аппарата и начинают нагревание. Образуется летучий тетрайодид титана.
Он широко используется в судостроении, авиации и космической технике, так как он прочный, пластичный и коррозионностойкий. Для получения высокочистого титана и некоторых других металлов используется метод йодистого рафинирования (рис. 5). Этот метод заключается в следующем. Титан с примесями и твердый йод загружают в нижнюю часть аппарата и начинают нагревание. Образуется летучий тетрайодид титана.
Рис. 5
TiI4 Ti + 2I2
Который перемещается к верхней части камеры, где разлагается на металл и йод на раскаленной вольфрамовой проволоке. Примеси не проявляют таких химических свойств и поэтому в верхнюю часть камеры не переходят.
Принцип йодистого рафинирования реализуется в галогеновых лампах. Ведь вольфрам, из которых состоит лампа накаливания, с нее постепенно испаряется, из-за чего нить утончается и, в конце концов, рвется. Но при добавлении небольшого количества йода, убежавшие атомы вольфрама могут образовывать с ним летучие йодиды, которые разлагаются на раскаленные вольфрамовые нити, возвращая металл на место. Чем тоньше участок спирали, тем выше на нем температура, соответственно, тем легче и быстрее на нем разлагается иодид вольфрама. Поэтому более тонкие участки спирали залечиваются быстрее. Из-за этого срок службы галогеновых ламп в 10 и более раз превышает срок службы обычных ламп накаливания.
Чем тоньше участок спирали, тем выше на нем температура, соответственно, тем легче и быстрее на нем разлагается иодид вольфрама. Поэтому более тонкие участки спирали залечиваются быстрее. Из-за этого срок службы галогеновых ламп в 10 и более раз превышает срок службы обычных ламп накаливания.
Подведение итога урока
В ходе урока вы изучили тему «Общие способы получения металлов. Коррозия». Вы узнали, что такое самородные металлы. Исследовали некоторые способы получения металлов, получили представление, что такое коррозия, ее виды, механизм появления коррозии, типы агрессивных сред, в которых протекает процесс коррозии, и способы защиты от коррозии. Самые любознательные узнали о йодистом рафинировании и галогеновых лампах.
Список литературы
- Рудзитис Г. Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.

- Попель П. П. Химия: 8 кл.: учебник для общеобразовательных учебных заведений / П. П. Попель, Л. С. Кривля. – К.: ИЦ «Академия», 2008. – 240 с.: ил.
- Габриелян О. С. Химия. 11 класс. Базовый уровень. 2-е изд., стер. – М.: Дрофа, 2007. – 220 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Интернет-портал «internerurok.ru» (Источник)
- Интернет-портал «hemi.nsu.ru» (Источник)
- Интернет-портал «chemport.ru» (Источник)
- Интернет-портал «Химик.ру» (Источник)
Домашнее задание
- №№ 6, 7, 8 (с. 174) Габриелян О. С. Химия. 11 класс. Базовый уровень. 2-е изд., стер. – М.: Дрофа, 2007. – 220 с.
- Перечислите способы борьбы с коррозией.
- Какие металлы встречаются в природе в самородном виде?
Причины коррозии и мониторинг коррозии
Введение
В промышленных условиях существует множество факторов окружающей среды, которые могут вызвать коррозию печатных плат в электронных системах измерения технологических процессов и управления. Среди них температура, влажность и газообразные загрязнители. Из них газообразные загрязнители являются наиболее разрушительными.
Среди них температура, влажность и газообразные загрязнители. Из них газообразные загрязнители являются наиболее разрушительными.
Газовое загрязнение сегодня вызвано главным образом сжиганием топлива на электростанциях, фабриках, коммерческих и жилых зданиях и автомобилях. Два основных типа газообразных промышленных загрязнителей воздуха можно классифицировать как кислотные или окисляющие. С годами эти два типа объединились, и теперь три основных загрязняющих газа, встречающихся в промышленно развитых странах, — это диоксид серы (SO 2 ), озон (O 3 ) и диоксид азота (NO 2 ). К другим веществам, представляющим первостепенное значение, относятся хлориды (хлор [Cl 2 ] и хлористый водород [HCl]), уксусная кислота (CH 3 COOH) и формальдегид (HCHO).
В 1985 году был разработан стандарт для классификации качества воздуха с точки зрения влияния переносимых по воздуху загрязняющих веществ на надежность оборудования. Как правило, этот стандарт требует поддержания концентрации газообразных загрязнителей на минимально возможном уровне путем газофазной фильтрации воздуха. Наиболее часто упоминаемые контрольные уровни для газообразных загрязнителей показаны ниже.
Как правило, этот стандарт требует поддержания концентрации газообразных загрязнителей на минимально возможном уровне путем газофазной фильтрации воздуха. Наиболее часто упоминаемые контрольные уровни для газообразных загрязнителей показаны ниже.
| Сероводород (H 2 S) | <3 частей на миллиард |
| Диоксид серы, триоксид серы (SO 2 , SO 3 ) | <10 частей на миллион |
| Хлор (Cl 2 ) | <1 частей на миллиард |
| Оксиды азота (NO X ) | <50 частей на миллиард |
| Фторид водорода (HF) | <1 частей на миллиард |
| Аммиак (NH 3 ) | <500 частей на миллиард |
| Озон (O 3 ) | <2 частей на миллиард |
Инструменты и методы мониторинга воздуха
Мониторинг воздуха занимает центральное место в любой программе экологического контроля для достижения и поддержания стандартов качества воздуха на основе наличия (или отсутствия) газообразных загрязнителей воздуха. Такой мониторинг также может предоставить краткосрочные данные, необходимые для управления и смягчения последствий эпизодов, связанных с конкретными загрязнителями. Помимо непосредственного применения в программах контроля загрязнения, данные мониторинга воздуха могут использоваться для (1) оценки долгосрочных тенденций качества воздуха на объекте и (2) научных исследований, предназначенных для определения взаимосвязей, если таковые имеются, между уровнями загрязняющих веществ и возможное повреждающее воздействие. Измерения качества воздуха в условиях консервации часто предъявляют строгие требования к контрольно-измерительным приборам и методологиям. Часто требуются специальные модификации и протоколы для адаптации методов для использования в этих средах.
Такой мониторинг также может предоставить краткосрочные данные, необходимые для управления и смягчения последствий эпизодов, связанных с конкретными загрязнителями. Помимо непосредственного применения в программах контроля загрязнения, данные мониторинга воздуха могут использоваться для (1) оценки долгосрочных тенденций качества воздуха на объекте и (2) научных исследований, предназначенных для определения взаимосвязей, если таковые имеются, между уровнями загрязняющих веществ и возможное повреждающее воздействие. Измерения качества воздуха в условиях консервации часто предъявляют строгие требования к контрольно-измерительным приборам и методологиям. Часто требуются специальные модификации и протоколы для адаптации методов для использования в этих средах.
Некоторые характеристики любого метода измерения должны быть оценены, чтобы определить его пригодность для использования в мониторинге качества воздуха. Среди наиболее важных характеристик — чувствительность, стоимость и сложность. Чувствительность является особенно важным параметром для сред, где могут встречаться уровни многих загрязняющих веществ, близкие к температуре окружающей среды, а контрольные уровни приближаются к уровню частей на миллиард (частей на миллиард). Точно так же стоимость может быть очень важной при выборе метода измерения, особенно в крупных обследованиях. Последним моментом рассмотрения является сложность техники и степень мастерства и подготовки, необходимые для получения качественных результатов. Другими факторами, заслуживающими внимания, являются селективность и переносимость. Большинство методов измерения не оптимизированы для этих параметров, и необходимо взвешивать различные характеристики, чтобы наилучшим образом достичь желаемых целей. Часто компромиссы будут необходимы при выборе методов, которые будут использоваться для конкретного исследования.
Чувствительность является особенно важным параметром для сред, где могут встречаться уровни многих загрязняющих веществ, близкие к температуре окружающей среды, а контрольные уровни приближаются к уровню частей на миллиард (частей на миллиард). Точно так же стоимость может быть очень важной при выборе метода измерения, особенно в крупных обследованиях. Последним моментом рассмотрения является сложность техники и степень мастерства и подготовки, необходимые для получения качественных результатов. Другими факторами, заслуживающими внимания, являются селективность и переносимость. Большинство методов измерения не оптимизированы для этих параметров, и необходимо взвешивать различные характеристики, чтобы наилучшим образом достичь желаемых целей. Часто компромиссы будут необходимы при выборе методов, которые будут использоваться для конкретного исследования.
Мониторинг реактивности
Несмотря на то, что можно идентифицировать и количественно определить (почти) все химические вещества, с которыми можно столкнуться в условиях консервации, остается вопрос: «Что мне делать с этой информацией?» Из-за этого многие отрасли промышленности обратились к экологической классификации с помощью так называемого мониторинга реактивности или коррозии.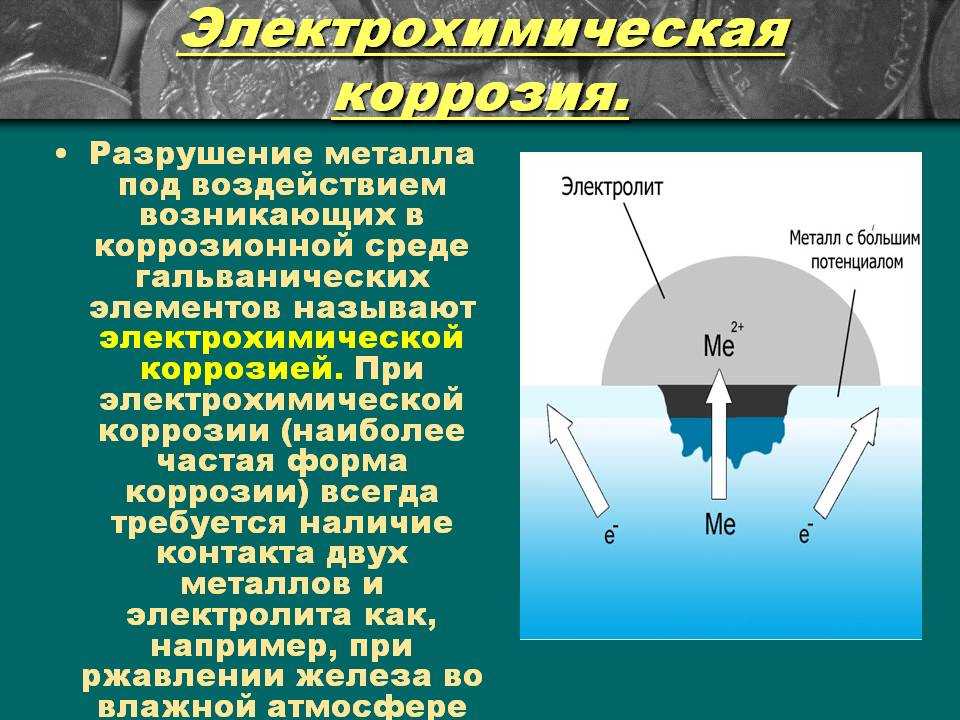 Применимость этого метода мониторинга воздуха заключается в том факте, что многие из загрязняющих веществ, подлежащих контролю, являются коррозионными по своей природе и, следовательно, могут быть эффективно измерены с помощью этого метода.
Применимость этого метода мониторинга воздуха заключается в том факте, что многие из загрязняющих веществ, подлежащих контролю, являются коррозионными по своей природе и, следовательно, могут быть эффективно измерены с помощью этого метода.
Мониторинг реактивности может характеризовать разрушительный потенциал окружающей среды. Рост различных коррозионных пленок на специально подготовленных медных и серебряных датчиках обеспечивает превосходную индикацию типа(ов) и уровня(ей) практически всех коррозионно-активных химических веществ, присутствующих в местной среде. Они дают прямую причинно-следственную связь между конкретными уровнями газообразных загрязнителей и ущербом, который они могут причинить медным и/или серебряным компонентам печатных плат. В настоящее время компания Purafil предлагает как пассивные, так и работающие в режиме реального времени мониторы реактивности, и каждый из них можно использовать для сбора необходимой информации о газообразных загрязнителях и их уровнях в окружающей среде.
Купоны Purafil для классификации коррозии (CCC) . CCC
— это пассивные мониторы, которые обычно подвергаются воздействию окружающей среды в течение 30–90 дней, а затем анализируются на предмет количества и типа образовавшейся коррозии (рис. 1). Этот метод может обеспечить кумулятивную скорость реактивности, оценку «средних» условий окружающей среды с течением времени и указание типа (типов) и относительного уровня (уровней) агрессивных газообразных загрязнителей.
 Кроме того, медные купоны не могут обнаружить присутствие хлора, особенно опасного загрязняющего вещества для металлов.
Кроме того, медные купоны не могут обнаружить присутствие хлора, особенно опасного загрязняющего вещества для металлов.Имея это в виду, компания Purafil разработала мониторинг реактивности серебра для этих сред. Серебро чувствительно к хлору, и при использовании с контролем реакционной способности меди его можно использовать для обнаружения изменений уровней газообразных загрязнителей в окружающей среде до 1 ppb и различения различных классов загрязнителей.
Коррозия, зарегистрированная в результате мониторинга реактивности с CCC, представляет собой сумму отдельных коррозионных пленок. Для медных образцов чаще всего производятся сульфидные и оксидные пленки, которые представлены как сульфид меди (Cu 2 S) и оксид меди (Cu 2 O) соответственно. Для серебряных купонов могут быть получены сульфидные, хлоридные и оксидные пленки, которые обозначаются как сульфид серебра (Ag 2 S), хлорид серебра (AgCl) и оксид серебра (Ag 2 O) соответственно. Каждый образец анализируется с точки зрения типа и количества присутствующей пленки и ее относительного вклада в общую вызванную коррозию.1,2
Каждый образец анализируется с точки зрения типа и количества присутствующей пленки и ее относительного вклада в общую вызванную коррозию.1,2
Узнайте больше о Purafil CCC
Электронные мониторы надежности Purafil (ERM)
При разработке программы мониторинга качества воздуха необходимо учитывать выбор между пассивным и активным отбором проб. Немедленная обратная связь активного монитора является наиболее желательным аспектом и часто препятствует использованию пассивных мониторов. Основным ограничением использования ССС является их неспособность обеспечить непрерывную экологическую классификацию. Чтобы решить эту проблему, мониторинг реактивности был сделан на шаг вперед за счет разработки устройства мониторинга в реальном времени, использующего микровесы с металлическим кварцевым кристаллом (МККМ)3,4,5. Эти управляемые микропроцессором устройства способны измерять общую коррозию окружающей среды, связанную с газообразными загрязнителями. ERM, использующие QCM, могут обнаруживать и регистрировать изменения <1 ppb. Эта способность считается одним из основных требований к любому протоколу мониторинга в реальном времени, который будет использоваться в средах сохранения.
Эта способность считается одним из основных требований к любому протоколу мониторинга в реальном времени, который будет использоваться в средах сохранения.
OnGuard Smart предоставляет поток данных в реальном времени и регистрирует данные, чтобы помочь оценить тенденции. Он может работать независимо в качестве регистратора данных с батарейным питанием, подключенного напрямую к центральной компьютерной системе через соединение 4–20 мА или через Интернет через кабель Ethernet или Wi-Fi. Можно получить самую последнюю информацию об уровнях агрессивных загрязнителей, а также создать и поддерживать базы данных классификации окружающей среды для предоставления исторических данных.
Можно получить самую последнюю информацию об уровнях агрессивных загрязнителей, а также создать и поддерживать базы данных классификации окружающей среды для предоставления исторических данных.
Узнайте больше о OnGuard Smart
Классификация по окружающей среде
В таблице 1 приведена стандартная схема классификации, опубликованная в стандарте ANSI/ISA 71.04-20136, в которой скорость коррозии напрямую соотносится с классификацией по окружающей среде. Недавно они были доработаны на основе результатов тестирования и конкретных потребностей этого рынка. На сегодняшний день мониторинг реактивности обычно используется для характеристики наружного воздуха, используемого для вентиляции, выявления «горячих точек» на объекте и эффективности различных профилактических мер. В этой таблице также показана корреляция между уровнями коррозии и максимальными концентрациями газа, допустимыми для данного конкретного класса коррозии.

Скорость коррозии как меди, так и серебра должна соответствовать классу G1 или выше, если не оговорено иное. Отдельные коррозионные пленки, количественно определенные с помощью мониторинга реакционной способности, могут использоваться для дальнейшей характеристики окружающей среды и определения надлежащих стратегий контроля. На основе этих рекомендуемых контрольных уровней и результатов испытаний серебряных купонов в лаборатории и в полевых условиях были определены критерии приемлемости, относящиеся к этим приложениям. Эти критерии учитывают общую коррозию, а также относительный вклад каждой отдельной коррозионной пленки. Спецификации контроля для отдельных коррозионных пленок перечислены в ТАБЛИЦЕ 2. Эти спецификации являются более общими по своему применению, чем те, которые перечислены выше, и чаще всего используются для характеристики окружающей среды до осуществления мер по контролю загрязнения.
 ЛЮБОЙ невыполненный критерий указывает на то, что местная окружающая среда не контролируется в достаточной степени, чтобы свести к минимуму коррозию чувствительного электронного оборудования из-за присутствия газообразных загрязняющих веществ. Необходимо предпринять шаги для определения существующих проблем и возможных корректирующих действий.
ЛЮБОЙ невыполненный критерий указывает на то, что местная окружающая среда не контролируется в достаточной степени, чтобы свести к минимуму коррозию чувствительного электронного оборудования из-за присутствия газообразных загрязняющих веществ. Необходимо предпринять шаги для определения существующих проблем и возможных корректирующих действий. CCC Результаты и обсуждение
При интерпретации результатов анализа отдельных коррозионных пленок обнаружение пленки сульфида серебра (Ag 2 S) без соответствующей пленки сульфида меди (Cu 2 S) обычно указывает на присутствие окисленных форм серы, таких как диоксид серы (SO 2 ) и триоксид серы (SO 3 ).
- Окисленные формы серы образуются в результате сжигания серосодержащих ископаемых видов топлива. Низкие уровни оксидов серы в частях на миллиард могут пассивировать химически активные металлы и, таким образом, замедлять коррозию. На более высоких уровнях они атакуют определенные типы каменной кладки, металлов, эластомеров и пластмасс.
 Реакция с каменной кладкой и металлами обычно происходит, когда эти газы растворяются в воде с образованием сернистой кислоты и серной кислоты.
Реакция с каменной кладкой и металлами обычно происходит, когда эти газы растворяются в воде с образованием сернистой кислоты и серной кислоты. - Железо является основным металлом, который страдает от присутствия диоксида серы. Железо разъедает электролитически. Это означает, что на поверхности железа должны присутствовать и влага, и электролит. Все водорастворимые соли, кислоты и щелочи образуют электролиты. Те электролиты, которые притягивают влагу, образуют растворимые продукты коррозии и нелетучи, являются наиболее агрессивными. Серная кислота и сульфат аммония, в который она часто частично превращается, удовлетворяют всем этим условиям.
- Обнаружение обеих пленок чаще всего указывает на наличие активных соединений серы, таких как элементарная сера, сероводород (H 2 S), а также органических соединений серы (например, меркаптаны). Когда присутствуют обе пленки и количество Cu 2 S превышает 50% от общей коррозии, это является еще одним свидетельством присутствия активных соединений серы в окружающей среде.

- Активные соединения серы включают сероводород, элементарную серу и органические соединения серы, такие как меркаптаны. При низком уровне содержания в частях на миллиард они быстро разрушают медные, серебряные, алюминиевые и железные сплавы. Наличие влаги и небольших количеств неорганических соединений хлора значительно ускоряет сульфидную коррозию. Обратите внимание, однако, что атака все еще происходит в условиях низкой относительной влажности. Активные серы стоят в ряду с неорганическими хлоридами как преобладающая причина атмосферной коррозии.
- Хлорная коррозия (AgCl) указывает на присутствие неорганического(ых) соединения(й) хлора, например, хлора (Cl 2 ), диоксида хлора (ClO 2 ), хлористого водорода (HCl). Повышенные уровни загрязнения хлоридами (галогенами) также могут служить для эффективной маскировки любых признаков загрязнения серой на соответствующих медных образцах и могут вызвать появление большой «неизвестной» коррозионной пленки меди.

- Загрязнение хлором, будь то хлор или хлористый водород, является наиболее опасным загрязнителем для металлов. При повышенных уровнях многие эластомеры и некоторые пластмассы окисляются под воздействием хлорированных газов.
- Особое внимание следует уделять материалам, которые подвергаются воздействию сред, содержащих хлорсодержащие загрязняющие вещества.
Выводы
Количество коррозии, образовавшейся за любой заданный период, является основным показателем того, насколько хорошо может контролироваться окружающая среда. Там, где используется фильтрация газа для поддержания внутренней концентрации газообразных загрязнителей на как можно более низком уровне, можно легко достичь уровней реактивности, находящихся в пределах общих и конкретных критериев приемлемости. Считается, что если среда имеет скорость реактивности G1 (<300 коррозии меди/30 дней И <200 коррозии серебра/30 дней), мало что можно сделать с экономической точки зрения для улучшения окружающей среды.
Когда общее количество измеренной коррозии меди или серебра превышает уровень жесткости ISA G1 и подтверждено присутствие оксидов серы, хлоридов и/или активной серы, воздух следует обрабатывать для удаления этих загрязнителей и предотвращения коррозии. Система химической фильтрации Purafil должна быть в состоянии специально устранять загрязнения серой и хлором.
Как правило, на входах подпитки должна быть установлена химическая фильтрация, чтобы снизить и поддерживать химическое загрязнение на приемлемом уровне. Обнаружение загрязнения активной серой и/или хлором особенно вредно для металлов – даже при очень низких уровнях, и необходимо предпринять шаги для снижения уровня загрязнения до уровня, который не оказывает воздействия на металлические компоненты.
Кроме того, рекомендуется установить программу мониторинга реактивности — либо с CCC, либо с помощью интеллектуального монитора OnGuard — для обеспечения непрерывной оценки качества воздуха. В то время как информация об отдельных видах загрязнителей может быть получена с помощью CCC, мониторинг реактивности в реальном времени с помощью OnGuard Smart может обеспечить более точную оценку общей коррозии, возникающей из-за присутствия химических загрязнителей. Мониторинг реактивности можно также использовать для измерения производительности систем химических фильтров Purafil, Inc. (если они установлены) и служить в качестве руководства по замене фильтрующего материала.
Мониторинг реактивности можно также использовать для измерения производительности систем химических фильтров Purafil, Inc. (если они установлены) и служить в качестве руководства по замене фильтрующего материала.
Прямой мониторинг газа может быть показан для определения источников коррозии серы и/или хлора. Это могло бы помочь определить, являются ли эти результаты типичными для этого места, аномалией, следствием эпизодических событий или присутствуют какие-либо другие газообразные загрязнители, которые могут иметь синергетический эффект и должны учитываться.
Ссылки
- Abbott, W.H., «Влияние условий эксплуатации на надежность электрического и электронного оборудования в целлюлозно-бумажной промышленности», Протокол конференции IEEE, Institute of Electrical and Electronic Engineers, Inc., Нью-Йорк, 1983.
- Райс, Д.В., и др., «Атмосферная коррозия меди и серебра», Электрохимическое общество, 128(2), стр.
 275-284, 1981.
275-284, 1981. - WG England и др., «Применение электронного контактного монитора коррозии в режиме реального времени», Proceedings of Advances in Instrumentation and Control, Vol 46: pp 929-955, Instrument Society of America, Anaheim, 1991.
- А.Дж. Вейллер, «Электронный мониторинг загрязнителей атмосферы в помещениях», Proceedings of Healthy Buildings ’94, стр. 241-243, Национальная коалиция по качеству воздуха в помещениях, 1994.
- Форслунд, М., «Кварцевый микровесовой зонд для мониторинга атмосферной коррозии на месте», Отдел материаловедения и инженерии, Отдел коррозионных наук, Королевский технологический институт, стр. 1-44, Стокгольм, 1996.
- Стандарт ISA ANSI/ISA-S71.04-2013, «Условия окружающей среды для технологических систем измерения и управления: загрязняющие вещества в воздухе», Международное общество измерений и контроля, Research Triangle Park, NC, 2013.
Агрессивные среды и факторы
Коррозия — враг инструментов и оборудования, поэтому выбор подходящих материалов и оборудования для вашей рабочей среды жизненно важен для предотвращения ржавчины и других форм коррозии. Например, лебедка с трещоткой Lug-All Marine Grade изготовлена из анодированного алюминиевого сплава, который защищает от опасной ржавчины от морской соли. Важно соблюдать надлежащие меры предосторожности при работе с рабочим оборудованием, поэтому операторы и рабочие должны быть в состоянии определить, где может возникнуть коррозия, и какие меры предосторожности следует принять для предотвращения.
Например, лебедка с трещоткой Lug-All Marine Grade изготовлена из анодированного алюминиевого сплава, который защищает от опасной ржавчины от морской соли. Важно соблюдать надлежащие меры предосторожности при работе с рабочим оборудованием, поэтому операторы и рабочие должны быть в состоянии определить, где может возникнуть коррозия, и какие меры предосторожности следует принять для предотвращения.
Прибрежная и морская среда
Прибрежная и морская среда вызывает коррозию металлов из-за содержания хлорида натрия (соли) в воде. Соль из морской воды будет перемещаться через прибрежные ветры, туман, туман и морские брызги на расстояние до пяти миль от береговой линии. Подъемники и другое оборудование следует держать на значительном расстоянии от океана, если они не изготовлены из защитных материалов. Ниже приведены вопросы, которые помогут определить, считается ли место морской средой:
- Работа находится в пределах пяти миль от большого водоема с соленой водой?
- Виден ли океан с крыши соседнего здания?
- Есть ли видимая коррозия на наружных конструкциях, оборудовании HVAC или другом оборудовании, изготовленном из подобных металлов?
Если ответ «да» на любой из приведенных выше вопросов, то следует принять меры для защиты от коррозии, например, использовать материалы морского класса для защиты от коррозии в морской воде. В конце концов, материалы морского класса снижают риск неисправности из-за ржавчины и стоимость замены.
В конце концов, материалы морского класса снижают риск неисправности из-за ржавчины и стоимость замены.
Переменные коррозии в прибрежной и морской среде
Несмотря на множество переменных, основными переменными скорости коррозии вблизи побережья являются:
- количество соли в воздухе.
- время увлажнения поверхности металла.
- температура.
- уровень других загрязнителей атмосферы.
Приведенные выше переменные сильно зависят от факторов окружающей среды, таких как расстояние от океана, высота над уровнем моря, направление ветра, воздействие волн, количество осадков, влажность, степень защищенности и уровень промышленного загрязнения воздуха. По этим причинам скорость коррозии сильно различается от места к месту и даже в разное время дня в одном и том же месте.
Промышленная коррозия
Хотя прибрежная и морская среда часто связана с коррозией, морская среда не единственная среда, способствующая ускоренной коррозии. В высокопромышленных средах загрязняющие вещества в воздухе могут способствовать коррозии. Выбросы, исходящие от заводов, транспортных средств или электростанций, потенциально могут ослабить ваше оборудование. Такие газы, как сера и оксид азота, которые выбрасываются в атмосферу на промышленных объектах, возвращаются в виде конденсата, например, кислотной росы или кислотного дождя.
В высокопромышленных средах загрязняющие вещества в воздухе могут способствовать коррозии. Выбросы, исходящие от заводов, транспортных средств или электростанций, потенциально могут ослабить ваше оборудование. Такие газы, как сера и оксид азота, которые выбрасываются в атмосферу на промышленных объектах, возвращаются в виде конденсата, например, кислотной росы или кислотного дождя.
Промышленные выбросы — не единственная проблема промышленности. Частицы промышленной пыли могут быть загрязнены вредными оксидами металлов, хлоридами, сульфатами, серной кислотой, углеродом и соединениями углерода. Эти частицы в сочетании с кислородом, водой или средами с высокой влажностью могут вызывать сильную коррозию.
Сельская местность
Сельская среда также может быть питательной средой для коррозии, особенно на фермах. Нитраты из удобрений могут вызвать коррозию инструментов и оборудования. Кроме того, аммиак и азот, содержащиеся в большом количестве отходов животноводства и дизельного топлива, способствуют ускорению коррозии, если за ними не ухаживать должным образом.
Предотвращение и защита от коррозии
Распространенным методом предотвращения и защиты от коррозии является гальванизация стали слоем цинка. Испытания в морской среде показывают, что цинк подвергается коррозии примерно в 20 раз медленнее, чем обычные стальные сплавы. Чем толще оцинкованное покрытие, тем дольше металл будет сопротивляться коррозии. Другим возможным решением является использование нержавеющей стали 304 или 316. Хотя нержавеющая сталь 304 считается подходящей для большинства морских сред, нержавеющая сталь 316 подвергается коррозии медленнее, что делает ее лучшим вариантом, чем нержавеющая сталь 304. После 40 лет пребывания на берегу океана образцы нержавеющей стали 304 и 316 использовались в 19В экспериментах 40-х годов не было ржавчины или потери прочности. Единственная проблема с нержавеющей сталью 304 и 316 заключается в том, что она значительно дороже, чем другие методы защиты от коррозии. Хотя методы предотвращения и защиты от коррозии изначально стоят дороже, эти первоначальные затраты компенсируются более низкими затратами на техническое обслуживание и замену.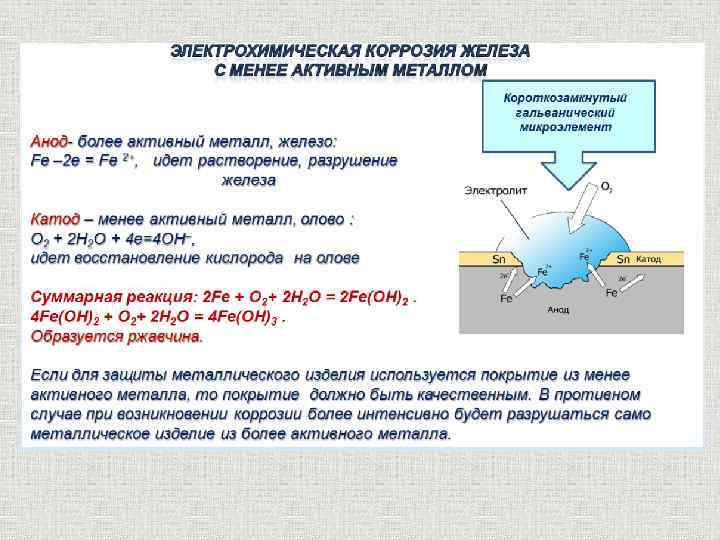
Независимо от того, в какой среде вы работаете, если инструменты и оборудование не защищены и не обслуживаются должным образом, вы подвергаете опасности свои инструменты и оборудование, не говоря уже о ваших работниках, использующих потенциально неисправное оборудование. Функциональность и безопасность оборудования зависят от вашей способности понимать факторы, которыми вы можете управлять. Чтобы обеспечить защиту ваших инструментов и рабочих, соблюдайте следующие правила:
- Покупка инструментов и материалов, которые производятся для элементов окружающей среды.
- Проведение плановых проверок.
- Выполните соответствующую очистку, чтобы удалить остатки после использования.
- Правильно храните оборудование, чтобы избежать воздействия агрессивных элементов после использования.
Коррозия продуктов неизбежна, но коррозию можно уменьшить, если понять основные причины коррозии, выполнить профилактическое обслуживание и потратить дополнительные деньги на более устойчивые к коррозии материалы.
Источники:
Коррозия в соленом воздухе
Идентификация потенциально агрессивных сред
5 факторов атмосферной коррозии
Атмосферная коррозия хорошо заметна по сравнению с другими процессами коррозии. Вы можете увидеть его воздействие на флагштоки, ржавые мосты, памятники и здания. Поскольку это очевидно почти во всех операциях и отраслях промышленности, огромная часть лакокрасочной промышленности посвящена производству металлических протекторов, которые вносят свой вклад в борьбу с атмосферной коррозией.
Реклама
Здесь мы рассмотрим факторы, влияющие на атмосферную коррозию.
Влияние атмосферной коррозии
Почти все виды общей коррозии происходят в атмосфере. В большинстве случаев металлы, подвергающиеся коррозии, не подвергаются воздействию больших количеств электролита, поэтому атмосферная коррозия в таких условиях активизируется в очагах коррозии, имеющих высокую локализацию. Иногда атмосферная коррозия создает различные узоры, которые трудно объяснить, например, на ржавых оцинкованных крышах.
Иногда атмосферная коррозия создает различные узоры, которые трудно объяснить, например, на ржавых оцинкованных крышах.
Реклама
Факторы, влияющие на атмосферную коррозию
Существуют различные факторы, влияющие на атмосферную коррозию, и их следует знать и методично устранять, чтобы предотвратить ее вредное воздействие. Что это за факторы? Обратите внимание на следующее:
1. Влага, роса и конденсат
Влага в виде росы, дождя или конденсата является очень важным фактором, когда речь идет о атмосферной коррозии. Хотя дождь может смывать из атмосферы опасные загрязнители воздуха, которые осели на открытых участках, например, в морской среде, дождь также скапливается в щелях и карманах. Дождь также может ускорить процесс коррозии из-за постоянной влажности, особенно в местах с оцинкованными болтами и стальными деталями или конструкциями.
Более того, конденсат и роса являются нежелательными типами влаги, если они не смываются повторяющимся дождем, который может устранить или разбавить загрязнение. Пленки росы, пропитавшиеся кислыми сульфатами, морской солью и другими кислотами, могут создавать агрессивную электролитную среду, способствующую возникновению коррозии.
Пленки росы, пропитавшиеся кислыми сульфатами, морской солью и другими кислотами, могут создавать агрессивную электролитную среду, способствующую возникновению коррозии.
Во влажных тропических зонах на поверхностях может образовываться конденсат. На таких поверхностях может застаиваться влага, которая переходит в щелочную реакцию с металлом или поглощает углекислый газ с образованием разбавленной кислоты.
Реклама
2. Температура
Температура влияет на атмосферную коррозию. По сути, каждые 50°F (10°C) повышение температуры может удвоить коррозионную активность. Кроме того, металлические предметы страдают от так называемого отставания по температуре из-за теплоемкости, связанной с изменениями температуры окружающей среды. Когда температура окружающей среды вечером падает, поверхности металлических предметов или конструкций становятся теплее по сравнению с влажным воздухом, который их окружает. Таким образом, конденсация не начнется, пока не будет достигнут пик росы. Когда температура воздуха в окружающей среде повышается, температура запаздывания в этих металлах превращает их в конденсаторы, поддерживающие пленку влаги на своих поверхностях. Это увеличивает период влажности по сравнению с периодом, когда окружающий воздух находится ниже точки росы. Это также зависит от толщины металла, структуры, воздушных потоков и солнечного излучения.
Когда температура воздуха в окружающей среде повышается, температура запаздывания в этих металлах превращает их в конденсаторы, поддерживающие пленку влаги на своих поверхностях. Это увеличивает период влажности по сравнению с периодом, когда окружающий воздух находится ниже точки росы. Это также зависит от толщины металла, структуры, воздушных потоков и солнечного излучения.
Циклическая температура может привести к сильной коррозии металла в тропических зонах, особенно в неотапливаемых складах, предметах в полиэтиленовых пакетах, металлических инструментах и т.д. (Частный случай защиты от коррозии на складах обсуждается в разделе «Временная защита от коррозии при хранении, транспортировке и погрузочно-разгрузочных работах».) Точка росы в окружающем воздухе является признаком равновесия испарения и конденсации. При этом настоятельно рекомендуется поддерживать температуру примерно на 50–59 °F (от 10 °C до 15 °C) выше точки росы, чтобы гарантировать отсутствие коррозии из-за конденсации на поверхности, которая может быть более холодной по сравнению с окружающий воздух.
3. Относительная влажность
Относительная влажность определяется как количество водяного пара, которое можно найти в атмосфере, по отношению к количеству насыщения при определенной температуре. Обычно выражается в процентах. Одним из обязательных требований в процессе атмосферной коррозии является наличие электролита в виде тонкой пленки, которая может образовываться на стальных или металлических поверхностях, подвергающихся воздействию критических уровней влажности. Хотя пленка невидима, она может содержать агрессивные загрязнители в высоких концентрациях, особенно в ситуациях, когда происходит попеременное высыхание и смачивание.
Критический уровень влажности считается переменной величиной, зависящей от материала, подвергающегося коррозии. Это также зависит от склонности продукта к коррозии и поглощению влаги поверхностными отложениями, а также от наличия загрязняющих веществ. Например, критический уровень влажности составляет 60% в тех случаях, когда окружающая среда не содержит загрязняющих веществ. При наличии электролитов в тонких пленках атмосферная коррозия протекает за счет комбинированных катодных и анодных реакций. Анодное окисление включает коррозионное воздействие на металлы.
При наличии электролитов в тонких пленках атмосферная коррозия протекает за счет комбинированных катодных и анодных реакций. Анодное окисление включает коррозионное воздействие на металлы.
Как правило, морская среда и аэрозоли, богатые солью, имеют высокий уровень относительной влажности. Существуют различные исследования, которые показали, что слой адсорбированной воды на цинке может увеличиваться по толщине вместе с увеличением относительной влажности. Это приводит к увеличению скорости коррозии. (Подробнее см. в разделе «Пять ключевых факторов понимания роли растворимых солей в разрушении покрытий».)
4. Осаждение аэрозольных частиц
Поведение аэрозольных частиц во внешней среде можно объяснить законами, описывающими их движение, образование и улавливание. Их можно найти во всех слоях планетарной границы, и их концентрация зависит от нескольких факторов, таких как время, местоположение, местные источники, атмосферные условия, скорость ветра и высота над уровнем моря. Есть также исследования, которые показывают, что улавливание аэрозолей, осаждение и скорость ветра связаны. Эти исследования включают соленые ветры, которые имеют прекрасную корреляцию между скоростью осаждения хлоридов и определенным порогом скорости ветра.
Есть также исследования, которые показывают, что улавливание аэрозолей, осаждение и скорость ветра связаны. Эти исследования включают соленые ветры, которые имеют прекрасную корреляцию между скоростью осаждения хлоридов и определенным порогом скорости ветра.
Аэрозоли, которые являются основным фактором атмосферной коррозии, могут образовываться либо в результате химических процессов в атмосфере, либо в результате выброса. Некоторыми из распространенных аэрозолей являются ветровая пыль и морские брызги. Существуют также вторичные аэрозоли, образующиеся при конденсации и реакции атмосферных газов или при превращении газа в частицы охлаждающего конденсата. Когда аэрозоли остаются во взвешенном состоянии в окружающей среде, их можно удалить, изменить или уничтожить. Аэрозоли не останутся в окружающей среде на неопределенный срок, так как их среднее время жизни колеблется от дней до одной недели, но это еще зависит от местоположения и размера частиц.
Большинство аэрозолей осаждаются вблизи береговой линии, и обычно это огромные частицы с коротким сроком жизни и зависящие от сил гравитации. На аэрозоли также влияют сила тяжести, сопротивление ветру, столкновение с твердой поверхностью и высыхающие капли.
На аэрозоли также влияют сила тяжести, сопротивление ветру, столкновение с твердой поверхностью и высыхающие капли.
5. Наличие загрязняющих веществ
Наличие загрязняющих веществ является фактором атмосферной коррозии. Например, диоксид серы, который образуется при сжигании топлива, содержащего бензин, дизельное топливо, природный газ и серу, считается одним из самых вредных загрязнителей, вызывающих коррозию металлов. (Подробнее читайте в статье «6 коррозионно-активных компонентов, которые можно найти в сырой нефти».)
Другие загрязняющие вещества включают оксиды азота, которые также являются продуктами сгорания. Их можно найти в выхлопных газах автомобилей, и они могут реагировать с ультрафиолетовым излучением и влагой, создавая новые химические вещества, которые можно переносить в виде аэрозолей. Типичным примером является дымка в летнее время, особенно в крупных городах, где большая часть дымки является результатом сочетания азотной и серной кислот.
Когда металлы подвергаются воздействию вышеупомянутых факторов, атмосферная коррозия может происходить быстрее и по различным механизмам. Таким образом, знание этих основных факторов может значительно помочь в борьбе с коррозией и ее вредными последствиями.
Реклама
Связанные термины
- Атмосферная коррозия
- Оксид азота
- Анодное оксидирование
- Критическая влажность
- Относительная влажность
- Температурная задержка
- Ячейка локальной коррозии
- Ячейка коррозии
- Точка росы
- Точка росы Коррозия
Поделиться этой статьей
Факторы, влияющие на скорость коррозии
Введение На скорость коррозии влияет несколько факторов, включая диффузию, температуру, проводимость, тип ионов, значение pH и электрохимический потенциал. Скорость коррозии можно контролировать или снижать путем нанесения антикоррозионных покрытий или методов защиты от коррозии, включая композитные ремонтные составы, шпаклевки для ремонта металла и армирующую пленку. Здесь мы рассмотрим различные факторы, влияющие на скорость коррозии.
Здесь мы рассмотрим различные факторы, влияющие на скорость коррозии.
В большинстве случаев скорость коррозии металлов контролируется диффузией реагентов к поверхности металла и от нее. Свежеобнаженные стальные поверхности будут подвергаться коррозии с большей скоростью, чем те, которые покрыты плотным слоем ржавчины. Скорость коррозии также сильно контролируется диффузией кислорода через воду к поверхности стали. В областях, где преобладает диффузия кислорода, коррозия протекает быстрее. Области с интенсивным потоком, такие как вблизи раструбов, будут иметь тенденцию к более высокой скорости коррозии из-за повышенного уровня кислорода, хотя эрозия также является фактором. Области, покрытые тонкой проводящей влагой пленкой, будут подвергаться коррозии быстрее, чем области, находящиеся под водой. Следовательно, пространство для корпуса в верхней части балластных цистерн и в верхней части цистерн с двойным дном, где задерживается воздух, имеет тенденцию к коррозии быстрее, чем глубоко погруженные участки, где доступ кислорода ниже.
Поскольку скорость коррозии определяется диффузией, скорость диффузии также контролируется температурой. Сталь и другие металлы корродируют быстрее при более высоких температурах, чем при более низких температурах. В результате области под палубой и области, прилегающие к машинному отделению или к нагретым грузовым танкам, будут иметь тенденцию к коррозии быстрее или предпочтительнее. Одной из особенностей современных танкеров с двойным корпусом и полностью изолированными балластными цистернами является то, что при полной загрузке грузовых емкостей пустые балластные цистерны действуют как термосы или термосы и сохраняют тепло в грузе значительно дольше, чем однокорпусная конструкция. Это повышение температуры грузовой/балластной переборки в сочетании с более прохладной внешней обшивкой переборки (в подводных районах) создает сложный набор коррозионных условий и приводит к увеличению скорости коррозии стали в балластных цистернах. Скорость коррозии в самих грузовых танках также будет выше из-за повышенной температуры.
Скорость коррозии в самих грузовых танках также будет выше из-за повышенной температуры.
Проводимость
Для возникновения коррозии между двумя частями реакции коррозии должна быть проводящая среда. Коррозия не возникает в дистиллированной воде, и скорость коррозии будет увеличиваться по мере увеличения проводимости из-за присутствия большего количества ионов в растворе. Скорость коррозии стали достигает максимума, близкого к нормальному ионному содержанию морской воды. Пресная вода разъедает сталь в меньшей степени, чем солоноватая или устьевая вода, при этом морская вода обычно вызывает наибольшую коррозию стали.
Тип ионов Некоторые типы ионов, присутствующие в морской воде или в грузах, более агрессивны, чем другие. Ионы хлорида обычно являются наиболее разрушительными, а сульфаты и другие ионы, содержащие серу, также представляют серьезные проблемы. Ионы хлорида оказывают разрушительное воздействие на защитные свойства любой ржавчины, вызванной тем, что препятствуют образованию более защитных, плотно упакованных оксидов. Ионы, содержащие серу, вовлекаются в дополнительные реакции генерации электронов внутри самой ржавчины, что, в свою очередь, формирует циклический самовосстанавливающийся процесс. Это может привести к интенсивному изъязвлению внутреннего днища грузовых танков в танкерах для перевозки нефти и нефтепродуктов. Сера может поступать как из системы инертного газа, так и из грузов, содержащих серу, таких как высокосернистая сырая нефть.
Ионы, содержащие серу, вовлекаются в дополнительные реакции генерации электронов внутри самой ржавчины, что, в свою очередь, формирует циклический самовосстанавливающийся процесс. Это может привести к интенсивному изъязвлению внутреннего днища грузовых танков в танкерах для перевозки нефти и нефтепродуктов. Сера может поступать как из системы инертного газа, так и из грузов, содержащих серу, таких как высокосернистая сырая нефть.
pH – это мера кислотности или щелочности по шкале от 1 до 14. pH 7 – нейтральный. В нейтральной морской воде рН составляет около 7,5, что означает, что ионы водорода (кислоты) и гидроксильные ионы (щелочи) почти сбалансированы. В таких условиях реакцией, уравновешивающей растворение железа, является восстановление растворенного кислорода с образованием ионов гидроксила. Однако, если среда становится более кислой и рН падает ближе к 1, то в растворе присутствует большее количество ионов водорода, чем ионов гидроксила.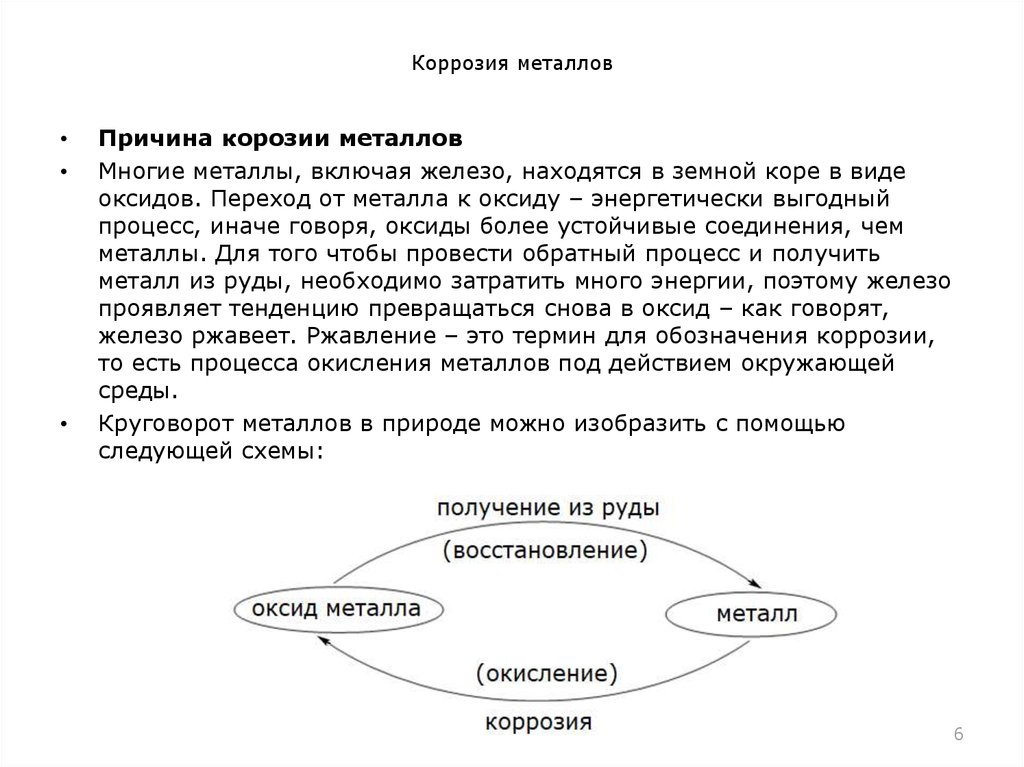 Избыточные ионы водорода могут быть вовлечены в уравновешивающую (катодную) реакцию, которая приводит к выделению газообразного водорода. Поскольку и ионы водорода, и газообразный водород могут диффундировать очень быстро, сталь может подвергаться коррозии быстрее. Это обычный эффект при перевозке таких грузов, как нефтяной кокс, сера и высокосернистая сырая нефть. В щелочных условиях, где имеется избыток гидроксильных ионов и уровень pH стремится к 14, сталь не подвергается коррозии и остается неизменной. Многие пузыри в балластных цистернах, особенно в двойных днищах, заполнены жидкостью с высоким pH. Когда блистерные крышки сняты, сталь под ними блестит. Тем не менее, он начнет разъедать, как только крышка будет удалена, поэтому после проверки одного или двух из группы пузырей и обнаружения щелочной жидкости остальные пузыри следует оставить нетронутыми.
Избыточные ионы водорода могут быть вовлечены в уравновешивающую (катодную) реакцию, которая приводит к выделению газообразного водорода. Поскольку и ионы водорода, и газообразный водород могут диффундировать очень быстро, сталь может подвергаться коррозии быстрее. Это обычный эффект при перевозке таких грузов, как нефтяной кокс, сера и высокосернистая сырая нефть. В щелочных условиях, где имеется избыток гидроксильных ионов и уровень pH стремится к 14, сталь не подвергается коррозии и остается неизменной. Многие пузыри в балластных цистернах, особенно в двойных днищах, заполнены жидкостью с высоким pH. Когда блистерные крышки сняты, сталь под ними блестит. Тем не менее, он начнет разъедать, как только крышка будет удалена, поэтому после проверки одного или двух из группы пузырей и обнаружения щелочной жидкости остальные пузыри следует оставить нетронутыми.
Каждый металл приобретает определенный электрохимический потенциал при погружении в проводящую жидкость. Этот потенциал называется потенциалом полуэлемента, поскольку его можно измерить только путем сравнения с другим известным эталонным потенциалом, создаваемым эталонным электродом. Обычными электродами сравнения являются насыщенный каломельный электрод (SCE), электроды сравнения серебро/хлорид серебра и медь/сульфат меди. Потенциал, который металл поглощает в растворе, может определить, будет ли он подвергаться коррозии и как быстро. Потенциал можно изменить, подключив его к другому разнородному металлу (как при гальванической коррозии или с помощью расходуемых анодов) или подав внешний потенциал, как это происходит с активной системой катодной защиты, используемой на внешнем корпусе.
Этот потенциал называется потенциалом полуэлемента, поскольку его можно измерить только путем сравнения с другим известным эталонным потенциалом, создаваемым эталонным электродом. Обычными электродами сравнения являются насыщенный каломельный электрод (SCE), электроды сравнения серебро/хлорид серебра и медь/сульфат меди. Потенциал, который металл поглощает в растворе, может определить, будет ли он подвергаться коррозии и как быстро. Потенциал можно изменить, подключив его к другому разнородному металлу (как при гальванической коррозии или с помощью расходуемых анодов) или подав внешний потенциал, как это происходит с активной системой катодной защиты, используемой на внешнем корпусе.
Каковы последствия коррозии?
Некоторые последствия коррозии включают значительный износ природных и исторических памятников. Загрязнение воздуха вызывает коррозию, и во всем мире ситуация становится все хуже.
Одним из последствий загрязнения воздуха, о котором редко говорят, является коррозия искусственных материалов во всем мире. По мере роста уровня загрязнения воздуха в промышленно развитых странах, соответственно увеличился и уровень коррозии. Но это касается не только рукотворных памятников; он также влияет на предметы, расположенные ближе к дому, такие как автомобили, грили для барбекю, уличная мебель и бытовые инструменты.
По мере роста уровня загрязнения воздуха в промышленно развитых странах, соответственно увеличился и уровень коррозии. Но это касается не только рукотворных памятников; он также влияет на предметы, расположенные ближе к дому, такие как автомобили, грили для барбекю, уличная мебель и бытовые инструменты.
Коррозия также разрушает важную инфраструктуру, такую как армированные сталью дороги, опоры электропередач, парковочные сооружения и мосты. Короче говоря, коррозия требует дальнейшего изучения, чтобы вы могли понять, как эта скрытая деградация влияет на вашу жизнь.
Что такое коррозия?
Согласно EonCoat, коррозия — это процесс разложения материала, вызванный химической реакцией с окружающей средой. Коррозия металла возникает при контакте открытой поверхности с газом или жидкостью, и этот процесс ускоряется при воздействии высоких температур, кислот и солей». (1)
Хотя слово «коррозия» используется для описания распада металлов, все природные и искусственные материалы подвержены распаду, и уровень загрязняющих веществ в воздухе может ускорить этот процесс.
Причина в том, что переносимые по воздуху загрязняющие вещества, такие как твердые частицы (ТЧ), образуются в результате химических реакций между жидкостями и твердыми веществами. Те же самые жидкости и твердые вещества, включая соль и черный углерод, могут взаимодействовать с молекулами внутри металлов и ускорять распад.
Специалисты по коррозии определили, что диоксид серы, образующийся при выбросах электростанций и транспортных средств, является одним из основных факторов, способствующих коррозии. (2)
Высокие уровни двуокиси серы могут повредить деревья и растения, уничтожая листву и препятствуя будущему росту.
Но диоксид серы не только помогает разлагать металл и другие материалы; это также имеет некоторые вредные последствия для здоровья. Агентство по охране окружающей среды США (EPA) обнаружило, что кратковременное воздействие диоксида серы может усугубить симптомы астмы и затруднить дыхание. (3)
Исследование атмосферной коррозии проливает больше света Недавнее исследование атмосферной коррозии помогло пролить больше света на то, как переносимые по воздуху загрязнители непосредственно влияют на металлы в промышленной городской среде.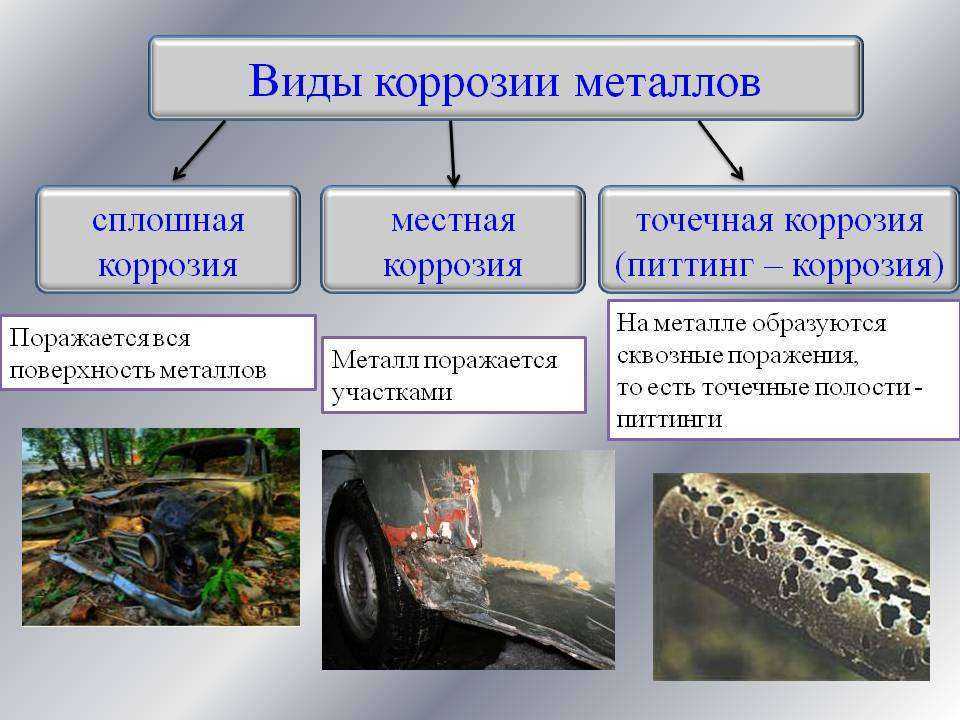
Исследователи исходили из тезиса о том, что атмосферная коррозия металлов и их сплавов очень распространена в промышленной городской среде из-за высокой концентрации агрессивных загрязняющих веществ в воздухе. (4)
Другими словами, исследователи предположили, что загрязнение воздуха в крупном городе ускорит процесс коррозии и поможет быстрее разлагать металлы, чем если бы загрязнение было на более низком уровне.
Чтобы проверить эту теорию, исследователи в течение 12 месяцев подвергали образцы различных металлов воздействию промышленных условий города, чтобы определить влияние взвешенных в воздухе твердых частиц на скорость коррозии. Они выбрали район в пределах испытательного города с высоким уровнем загрязняющих веществ.
Исследование показало, что металлы подвержены коррозии гораздо быстрее зимой, когда уровень загрязнения был самым высоким. Это увеличение загрязнения было вызвано более высокими выбросами от близлежащих электростанций и теплоцентралей, а также от выбросов транспортных средств и отопительных печей, которые широко использовались из-за холодной погоды.
Наиболее распространенными загрязняющими веществами, ускоряющими коррозию, были двуокись серы, двуокись углерода, пыль и влага.
Последствия коррозииКакие же последствия коррозии могут реально повлиять на вашу повседневную жизнь?
- Vortex Energy Saver идентифицирует некоторые прямые эффекты коррозии, в том числе: (5)
- Повреждение коммерческих самолетов, которое может привести к возможным проблемам в полете
- Повреждение нефтепроводов, которое может привести к дорогостоящему и опасному разрыву, наносящему значительный ущерб окружающей среде.
- Повреждение опор моста, которое может привести к разрушению моста
- Выброс вредных загрязняющих веществ в результате коррозии железа, загрязняющей воздух
- Затраты на ремонт или замену вышедшего из строя бытового оборудования
«Мы знаем, что многие коммерческие отрасли, такие как нефть и газ, строительство и электроника, уязвимы к воздействию коррозии», — заявил Трент Тиль, руководитель отдела молекулярной фильтрации Camfil USA
. «Без методов контроля возможны отказы оборудования и конструкций, которые могут иметь катастрофические последствия. Вот почему молекулярная фильтрация так важна для удаления коррозионно-активных веществ из воздуха и обеспечения структурной целостности».
«Без методов контроля возможны отказы оборудования и конструкций, которые могут иметь катастрофические последствия. Вот почему молекулярная фильтрация так важна для удаления коррозионно-активных веществ из воздуха и обеспечения структурной целостности».
Есть несколько способов предотвратить коррозию дома. Во-первых, вы можете использовать обработку поверхности для всех металлов, чтобы защитить их от переносимых по воздуху загрязнителей. Во-вторых, все металлические изделия можно оцинковывать, что придает им высокую устойчивость к коррозии. И в-третьих, вы можете инвестировать в высокоэффективные воздушные фильтры, чтобы улучшить качество воздуха в помещении и устранить вредные загрязнители, способствующие процессу коррозии.
CAMFIL:
Уже более 50 лет компания Camfil поставляет самые современные системы фильтрации воздуха. Camfil предлагает самые эффективные решения для промышленной фильтрации клиентам по всему миру и заработала свою репутацию, предлагая качество по доступной цене. Camfil работает в соответствии с руководящим принципом, что чистый воздух является правом всех людей, независимо от того, где они живут. Компания предлагает решения для очистки воздуха, которые улучшат качество воздуха в помещении и устранят вредные загрязнители, которые способствуют процессу коррозии.
Camfil работает в соответствии с руководящим принципом, что чистый воздух является правом всех людей, независимо от того, где они живут. Компания предлагает решения для очистки воздуха, которые улучшат качество воздуха в помещении и устранят вредные загрязнители, которые способствуют процессу коррозии.
Другие ресурсы для вас
- Узнайте о том, как молекулярная фильтрация воздуха предотвращает коррозию
- Прочтите запись в нашем блоге: Фильтрация воздуха для центров обработки данных
Lynne Laake
Воздушные фильтры Camfil USA
T: 888.599.6620
USA Friend на Facebook0006
T: следите за Camfil USA в Twitter
Y: смотрите видео Camfil на YouTube
L: следите за нашей страницей в LinkedIn
ИСТОЧНИКИ
- коррозия/
- http://corrosion-doctors.
 org/Corrosion-Atmospheric/Factors-atmospheric.htm
org/Corrosion-Atmospheric/Factors-atmospheric.htm - https://www.epa.gov/so2-pollution/sulphur-dioxide-basics#what%20is%20so2
- http://www.sciencedirect.com/science/article/pii/S2352340915000281
- http://www.vortexenergysaver.com/effects-of-corrosion/
Причины коррозии
Коррозия или повреждение поверхности металла в результате окисления всегда была одной из самых вредных и дорогостоящих технических проблем в авиации. промышленность. Без принятия надлежащих профилактических мер и рассмотрения различных факторов, коррозионный процесс может привести самолет в негодность в течение несколько лет. К счастью, сегодня есть много средств для борьбы с коррозией любой металлической поверхности.
Для правильного выбора системы очистки
для коррозии, причины должны быть в первую очередь
понял. Наиболее заметные последствия связаны с условиями окружающей среды, разливом,
хранения и загрязнения. Эффекты также могут усугубляться дизайном и конструкцией.
техники, использующие разнородные материалы. Учет этих вопросов при проектировании любого
система с металлическими поверхностями может смягчить хотя бы часть неизбежных проблем.
Эффекты также могут усугубляться дизайном и конструкцией.
техники, использующие разнородные материалы. Учет этих вопросов при проектировании любого
система с металлическими поверхностями может смягчить хотя бы часть неизбежных проблем.
Это руководство даст вам краткий обзор причин коррозии, относящихся к проектирование и обслуживание металлических систем. Мы внимательно посмотрим на механику позади коррозионные процессы. Наша цель — вооружить вас знаниями, необходимыми для облегчения коррозионное повреждение, понимая способствующие факторы.
1. Природные и техногенные факторы окружающей среды
В первую очередь необходимо изучить окружающую среду оборудования, как естественную, так и техногенную. Воздействие определенных элементов вызывает коррозионный процесс, поэтому важно ограничить время проводит в таких опасностях или рядом с ними. Во-первых, давайте рассмотрим ключевые антропогенные факторы:
- Отгрузка
- Хранение
- Производство
- Легкая защита от износа
- Промышленное загрязнение
Транспортировка и хранение говорят сами за себя: металлические поверхности
длительное воздействие влаги, озона, соли и суровых температур делают их
более подвержены коррозии. Хранение оборудования в герметичных контейнерах с климат-контролем
контейнеры и/или соответствующие ангарные условия, когда они не используются, могут значительно
снизить риск коррозионных атак.
Хранение оборудования в герметичных контейнерах с климат-контролем
контейнеры и/или соответствующие ангарные условия, когда они не используются, могут значительно
снизить риск коррозионных атак.
Производственные операции могут нести в себе присущие им угрозы. За Например, такие конструктивные особенности, как особое расположение батарейных отсеков, могут сильно влияет на скорость коррозии. Аналогично, разлив, происходящий в ванные комнаты или камбуз могут вызвать необычное накопление влаги внутри система. Хороший проект будет учитывать эти факторы, но не каждый инженер считает их. Чтобы защититься от подобных проблем, процессы являются критическими.
Промышленные загрязнители одинаково вредны и их трудно защищать от. К ним относятся несколько загрязняющих веществ:
- Озон (воздействие на большой высоте, двигатели и сварка)
- Соединения углерода (воздействие выхлопных газов двигателей внутреннего сгорания)
- Двуокись серы (воздействие выхлопных газов двигателей, дымовых труб и кислотных дождей)
Здесь основной путь к профилактике лежит через избегание. Мы рекомендуем этот самолет
держаться подальше от крупных промышленных предприятий и любых других районов с высокой концентрацией
этих химических веществ, чтобы уменьшить воздействие. На карте ниже показаны
Тепловая карта коррозионной активности США
с использованием методологии факторов коррозионной активности и ESC ISO. Шесть категорий
указать, какие районы в США имеют высокую суровость окружающей среды или коррозию
местная среда – и идентифицируются как:
Мы рекомендуем этот самолет
держаться подальше от крупных промышленных предприятий и любых других районов с высокой концентрацией
этих химических веществ, чтобы уменьшить воздействие. На карте ниже показаны
Тепловая карта коррозионной активности США
с использованием методологии факторов коррозионной активности и ESC ISO. Шесть категорий
указать, какие районы в США имеют высокую суровость окружающей среды или коррозию
местная среда – и идентифицируются как:
- C1 – очень низкий
- C2 – низкий
- С3 – средний
- С4 – высокий
- C5 – очень высокий
- CX – крайний
Категории коррозионной активности
Природные среды создают еще один набор рисков, ускоряющих коррозию. Ниже приведен список наиболее распространенных:
- Влага и вода
- Соль
- Песок, пыль и пепел
- Экстремальные температуры
- Другие климатические факторы
Вода и другие источники влаги часто содержат хлориды, сульфаты,
и нитраты. Эти соединения ускоряют коррозионный процесс на металлических поверхностях, потому что
они способствуют окислению. Кроме того, соли функционально являются
особый тип хлорида, который также действует как электролит и ускоряет коррозию.
Настоятельно рекомендуется регулярно проверять воду для мойки самолетов на правильный уровень pH.
Эти соединения ускоряют коррозионный процесс на металлических поверхностях, потому что
они способствуют окислению. Кроме того, соли функционально являются
особый тип хлорида, который также действует как электролит и ускоряет коррозию.
Настоятельно рекомендуется регулярно проверять воду для мойки самолетов на правильный уровень pH.
Пыль, зола и песок представляют собой соединения, действующие как адсорбенты, удерживающие
влага. Они воздействуют на металлические поверхности, когда встраиваются в оборудование, и позволяют
возникает водная коррозия. В результате, что касается коррозионного воздействия,
идеальная среда для самолета – это среда с высокой температурой и низкой влажностью.
где любая затяжная влага быстро испаряется. Естественно, это означает, что тропический климат
наиболее вредными, и по возможности следует избегать длительного хранения в таких помещениях.
2. Коррозионно-активные элементы
Коррозионно-активные элементы
Помимо вышеупомянутых факторов окружающей среды, основной причиной коррозии является
сам выбор материала. Размещение разнородных металлических поверхностей в контакте друг с другом
создает проблемы. На металлических поверхностях атомы склонны к окислению и отдают электроны
молекул кислорода в окружающей среде. Когда это происходит, кислород
увеличивает количество электронов и образует оксид с металлом. Это окисление является
вызывает коррозию и приводит к значительному повреждению поверхности металла. Один из многих
распространенные виды, называемые
гальваническая коррозия,
происходит, когда эта окислительно-восстановительная реакция протекает на границе двух разнородных
металлы. Это происходит потому, что два металла содержат разные заряды и создают потенциал.
разница между поверхностями, которая затем увеличивает ионный обмен и, таким образом, способствует окислению.




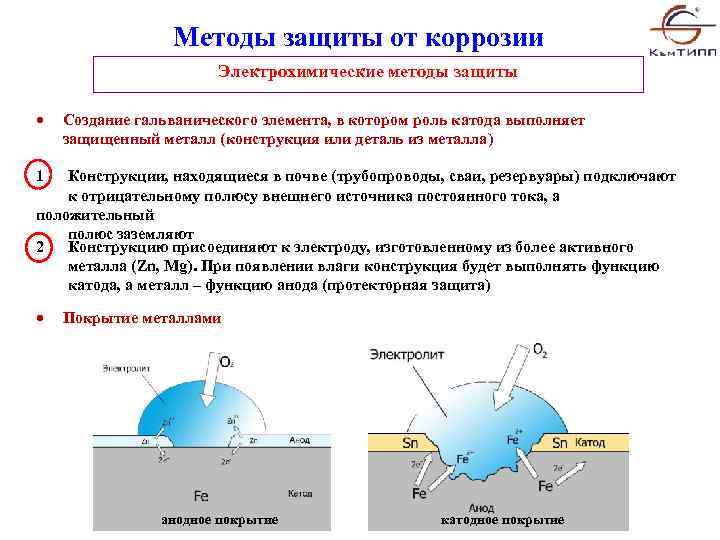
 Процесс катодного восстановления подавляется, препятствуя рекомбинации водорода и режиму защитного разряда, но увеличивает склонность металла к восприимчивости к водородному растрескиванию.
Процесс катодного восстановления подавляется, препятствуя рекомбинации водорода и режиму защитного разряда, но увеличивает склонность металла к восприимчивости к водородному растрескиванию.
 По некоторой информации, кислотные дожди увеличивают младенческую смертность и риск развития болезней легких, а также вызывают окисление рек и озер, уничтожение флоры и фауны, деградацию почв, разрушение памятников и архитектуры.
По некоторой информации, кислотные дожди увеличивают младенческую смертность и риск развития болезней легких, а также вызывают окисление рек и озер, уничтожение флоры и фауны, деградацию почв, разрушение памятников и архитектуры. Скорость снижения составляет около 3% в год. Наибольшее значение в этом процессе имеют хлорфторуглероды (фреоны), из которых выделившийся хлор (под воздействием ультрафиолетового излучения) атакует молекулы озона, что приводит к выделению кислорода (O2) и оксида хлора(II) (ClO). Скорость глобального снижения уровня стратосферного озона в результате деятельности человека (за исключением Антарктиды), оцененная на основе спутниковых исследований, составляет 0,4-0,8% в год в северных умеренных широтах и менее 0,2% в тропиках. Озоновый слой – это природный фильтр, который защищает живые организмы от вредного ультрафиолетового излучения. В 1995 году Нобелевская премия по химии была присуждена за исследования влияния фреонов на атмосферный озон, а также за исследования образования и реакций атмосферного озона.
Скорость снижения составляет около 3% в год. Наибольшее значение в этом процессе имеют хлорфторуглероды (фреоны), из которых выделившийся хлор (под воздействием ультрафиолетового излучения) атакует молекулы озона, что приводит к выделению кислорода (O2) и оксида хлора(II) (ClO). Скорость глобального снижения уровня стратосферного озона в результате деятельности человека (за исключением Антарктиды), оцененная на основе спутниковых исследований, составляет 0,4-0,8% в год в северных умеренных широтах и менее 0,2% в тропиках. Озоновый слой – это природный фильтр, который защищает живые организмы от вредного ультрафиолетового излучения. В 1995 году Нобелевская премия по химии была присуждена за исследования влияния фреонов на атмосферный озон, а также за исследования образования и реакций атмосферного озона.
 Лидер группы (выбор учащихся) выставляет оценки в оценочный лист: максимальное количество баллов -15.)
Лидер группы (выбор учащихся) выставляет оценки в оценочный лист: максимальное количество баллов -15.) 
 Большинство металлов в природе существуют в связанном состоянии в виде различных химических природных соединений – минералов. А минералы входят в состав горны пород и руд.
Большинство металлов в природе существуют в связанном состоянии в виде различных химических природных соединений – минералов. А минералы входят в состав горны пород и руд. А из всего количества сплавов на основе железа теряется примерно 25%. Что же это за процесс – коррозия?
А из всего количества сплавов на основе железа теряется примерно 25%. Что же это за процесс – коррозия? Утечка газа, нефти и других опасных химических продуктов из разрушенных коррозией трубопроводов приводит к загрязнению окружающей среды, что отрицательно воздействует на здоровье и жизнь людей.
Утечка газа, нефти и других опасных химических продуктов из разрушенных коррозией трубопроводов приводит к загрязнению окружающей среды, что отрицательно воздействует на здоровье и жизнь людей.
 Такая коррозия называется электрохимической.
Такая коррозия называется электрохимической.

 Улучшение состава сплава
Улучшение состава сплава


 Реакция с каменной кладкой и металлами обычно происходит, когда эти газы растворяются в воде с образованием сернистой кислоты и серной кислоты.
Реакция с каменной кладкой и металлами обычно происходит, когда эти газы растворяются в воде с образованием сернистой кислоты и серной кислоты.

 275-284, 1981.
275-284, 1981. org/Corrosion-Atmospheric/Factors-atmospheric.htm
org/Corrosion-Atmospheric/Factors-atmospheric.htm