Каковы области применения воды углекислого газа алюминия меди: Каковы области применения: а) воды: б) углекислого газа; в) алюминия; г) меди; д) серебра?
alexxlab | 23.12.1985 | 0 | Разное
Как производится алюминий
Сайт об алюминии
Несмотря на то, что алюминий самый распространенный металл на нашей планете, в чистом виде на Земле его не встретить. Из-за высокой химической активности атомы алюминия легко образуют соединения с другими веществами. При этом «крылатый металл» нельзя получить плавлением руды в печи, как это происходит, например, с железом. Процесс получения алюминия значительно сложнее и основан на использовании электричества огромной мощности. Поэтому алюминиевые заводы всегда строятся рядом с крупными источниками электроэнергии – чаще всего гидроэлектростанциями, не загрязняющими окружающую среду. Но обо всем по порядку.
- Бокситы
- Глинозем
- Криолит
- Алюминий
- Литейное производство
- Новые технологии
- Переработка
«В природе ничто не возникает мгновенно и ничто не появляется в свете в совершенно готовом виде».
Александр Герцен
русский публицист, писатель
Добыча бокситов
Производство металла делится на три основных этапа: добыча бокситов – алюминийсодержащей руды, их переработка в глинозем – оксид алюминия, и, наконец, получение чистого металла с использованием процесса электролиза – распада оксида алюминия на составные части под воздействием электрического тока. Из 4-5 тонн бокситов получается 2 тонны глинозема, из которого производят 1 тонну алюминия.
В мире существуют несколько видов алюминиевых руд, но основным сырьем для производства этого металла являются именно бокситы. Это горная порода, состоящая, в основном, из оксида алюминия с примесью других минералов. Боксит считается качественным, если он содержит более 50% оксида алюминия.
Запасы бокситов
Бокситы могут сильно отличаться друг от друга. По структуре они бывают твердые и плотные либо рыхлые и рассыпчатые. По цвету – как правило, кирпично-красные, рыжеватые или коричневые из-за примеси оксида железа. При небольшом содержании железа бокситы имеют белый или серый цвет. Но иногда встречаются руды желтого, темно-зеленого цвета и даже пестрые – с голубыми, красно-фиолетовыми или черными прожилками.
Около 90% мировых запасов бокситов сосредоточено в странах тропического и субтропического поясов – из них 73% приходится на пять стран: Гвинею, Бразилию, Ямайку, Австралию и Индию. В Гвинее бокситов больше всего – 5,3 миллиарда тонн (28,4%), при этом они высокого качества, содержат минимальное количество примесей и залегают практически на поверхности.
Крупнейшие страны по добыче бокситов, 2014 год
Чаще всего добыча бокситов ведется открытым способом – специальной техникой руду «срезают» слой за слоем с поверхности земли и транспортируют для дальнейшей переработки. Однако в мире есть места, где алюминиевая руда залегает очень глубоко, и для ее добычи приходится строить шахты – одна из самых глубоких шахт в мире «Черемуховская-Глубокая» находится в России, на Урале, ее глубина – 1550 метров.
Однако в мире есть места, где алюминиевая руда залегает очень глубоко, и для ее добычи приходится строить шахты – одна из самых глубоких шахт в мире «Черемуховская-Глубокая» находится в России, на Урале, ее глубина – 1550 метров.
Производство глинозема
Следующим этапом является производственной цепочки является переработка бокситов в глинозем – это оксид алюминия Al2O3, который представляет собой белый рассыпчатый порошок. Основным способом получения глинозема в мире является метод Байера, открытый более ста лет назад, но актуальный до сих пор – около 90% глинозема в мире производятся именно так. Этот способ весьма экономичен, но использовать его можно только при переработке высококачественных бокситов со сравнительно низким содержанием примесей – в первую очередь кремнезема.
Метод Байера основан на следующем: кристаллическая гидроокись алюминия, входящая в состав боксита, хорошо растворяется при высокой температуре в растворе едкого натра (каустической щёлочи, NaOH) высокой концентрации, а при понижении температуры и концентрации раствора вновь кристаллизуется. Посторонние, входящие в состав боксита (так называемый балласт), не переходят при этом в растворимую форму или перекристаллизовываются и выпадают в осадок до того, как производится кристаллизация гидроокиси алюминия. Поэтому после растворения гидроокиси алюминия балласт легко может быть отделен – он называется красный шлам.
Посторонние, входящие в состав боксита (так называемый балласт), не переходят при этом в растворимую форму или перекристаллизовываются и выпадают в осадок до того, как производится кристаллизация гидроокиси алюминия. Поэтому после растворения гидроокиси алюминия балласт легко может быть отделен – он называется красный шлам.
Красный шлам
Это густая масса красно-бурого цвета, состоящая из соединений кремния, железа, титана и других элементов. Его складируют на тщательно изолированных территориях – шламохранилищах. Их обустраивают таким образом, чтобы содержащиеся в отходах щёлочи не проникали в грунтовые воды. Как только хранилище отрабатывает свой потенциал, территорию можно вернуть в первоначальный вид, покрыв её песком, золой или дёрном и посадив определённые виды деревьев и трав. На полное восстановление могут уйти годы, но в итоге местность возвращается в изначальное состояние.
Многие специалисты не считают красный шлам отходом, так как он может служить сырьем для переработки. Например, из него извлекают скандий для дальнейшего производства алюминиево-скандиевых сплавов. Скандий придает таким сплавом особую прочность, сферы использования – автомобиле- и ракетостроение, спортивная экипировка, производство электропроводов.
Например, из него извлекают скандий для дальнейшего производства алюминиево-скандиевых сплавов. Скандий придает таким сплавом особую прочность, сферы использования – автомобиле- и ракетостроение, спортивная экипировка, производство электропроводов.
Также красный шлам может использоваться для производства чугуна, бетона, получения редкоземельных металлов.
Крупные частицы гидроксида алюминия легко отделяются от раствора фильтрованием, их промывают водой, высушивают и кальцинируют – то есть нагревают для удаления воды. Так получают глинозем.
Нефелин
Бокситы – самое распространенное, но не единственное сырье для производства глинозема. Его также можно получить из нефелина. В природе он встречается в виде апатито-нефелиновых пород (апатит – материал из группы фосфорнокислых солей кальция). В процессе производства глинозема из нефелина также получают сода, поташ (используется в строительном секторе, производстве бытовой химии, кондитерской промышленности и так далее), редкий металл галлий. А из отходов производства – белого шлама – высококачественный цемент. Чтобы получить 1 тонну глинозема в среднем требуется 4 тонны нефелина и 7,5 тонн известняка.
А из отходов производства – белого шлама – высококачественный цемент. Чтобы получить 1 тонну глинозема в среднем требуется 4 тонны нефелина и 7,5 тонн известняка.
У глинозема нет срока годности, но хранить его непросто, так как при малейшей он возможности активно впитывает влагу – поэтому производители предпочитают как можно быстрее отправлять его на алюминиевое производство. Сначала глинозем складывают в штабели весом до 30 тысяч тонн – получается своеобразный слоеный пирог высотой до 10-12 метров. Потом пирог «нарезают» и грузят для отправки в железнодорожные вагоны – в среднем, в один вагон от 60 до 75 тонн (зависит от вида самого вагона).
Существует еще один, гораздо менее распространенный способ получения глинозема – метод спекания. Его суть заключается в получения твердых материалов из порошкообразных при повышенной температуре. Бокситы спекают с содой и известняком – они связывают кремнезем в нерастворимые в воде силикаты, которые легко отделить от глинозема.
Криолит
Ивиттуут
Одно из единичных месторождений природного криолита на Земле. Расположено в Гренландии и было обнаружено в 1799 году. Добыча криолита прекратилась там в 1987 году, когда был изобретен способ искусственного получения этого редкого минерала. Позднее криолит был найден в Ильменских горах на Южном Урале (Миасс) и в штате Колорадо (США).
Глинозем выступает непосредственным источником металла в процессе производства алюминия. Но для создания среды, в которой этот процесс будет происходить, необходим еще один компонент – криолит.
Это редкий минерал из группы природных фторидов состава Na3AlF6. Обычно он образует бесцветные, белые или дымчато-серые кристаллические скопления со стеклянным блеском, иногда – почти черные или красновато-коричневые. Криолит хрупкий и легко плавится.
Природных месторождений этого минерала крайне мало, поэтому в промышленности используется искусственный криолит. В современной металлургии его получают взаимодействием плавиковой кислоты с гидроксидом алюминия и содой.
Производство алюминия
Итак, мы добыли боксит, получили из него глинозем, запаслись криолитом. Все готово для последней стадии – электролизу алюминия. Электролизный цех является сердцем алюминиевого завода и не похож на цеха других металлургических предприятий, производящих, например, чугун или сталь. Он состоит из нескольких прямоугольных корпусов, протяженность которых зачастую превышает 1 км. Внутри рядами установлены сотни электролизных ванн, последовательно подключенных массивными проводами к электричеству. Постоянное напряжение на электродах каждой ванны находится в диапазоне всего 4-6 вольт, в то время как сила тока составляет 300 кА, 400 кА и более. Именно электрический ток является здесь главной производственной силой – людей в этом цехе крайне мало, все процессы механизированы.
Ток для производства алюминия
Для запуска двигателя автомобильный аккумулятор должен обеспечить электрический ток в 300-350 А в течение 30 секунд. То есть в 1000 раз меньше, чем нужно одному электролизеру для постоянной работы.
В каждой ванне происходит процесс электролиза алюминия. Емкость ванны заполняется расплавленным криолитом, который создает электролитическую (токопроводящую) среду при температуре 950°С. Роль катода выполняет дно ванны, а анода – погружаемые в криолит угольные блоки длиной около 1,5 метров и шириной 0,5 метра, со стороны они выглядят как впечатляющих размеров молот.
Каждые полчаса при помощи автоматической системы подачи глинозема в ванну загружается новая порция сырья. Под воздействием электрического тока связь между алюминием и кислородом разрывается – алюминий осаждается на дне ванны, образуя слой в 10-15 см, а кислород соединяется с углеродом, входящим в состав анодных блоков, и образует углекислый газ.
Примерно раз в 2-4 суток алюминий извлекают из ванны при помощи вакуумных ковшей. В застывшей на поверхности ванны корке электролита пробивают отверстие, в которое опускают трубу. Жидкий алюминий по ней засасывается в ковш, из которого предварительно откачан воздух. В среднем, из одной ванны откачивается около 1 тонны металла, а в один ковш вмещается около 4 тонн расплавленного алюминия. Далее этот ковш отправляется в литейное производство.
При производстве каждой тонны алюминия выделяется 280 000 м3 газов. Поэтому каждый электролизер независимо от его конструкции оснащен системой газосбора, которая улавливает выделяющиеся при электролизе газы и направляет их в систему газоочистки. Современные «сухие» системы газоочистки для улавливания вредных фтористых соединений используют ни что иное, а глинозем. Поэтому перед тем как использоваться для производства алюминия, глинозем на самом деле сначала участвует в очистке газов, которые образовались в процессе производства металла ранее. Вот такой замкнутый цикл.
Вот такой замкнутый цикл.
Для процесса электролиза алюминия требуется огромное количество электроэнергии, поэтому важно использовать возобновляемые и не загрязняющие окружающую среду источники этой энергии. Чаще всего для этого используются гидроэлектростанции – они обладают достаточной мощностью и не имеют выбросов в атмосферу. Например, в России 95% алюминиевого мощностей обеспечены гидрогенерацией. Однако есть в места в мире, где угольная генерация пока доминирует – в частности, в Китае на нее приходится 93% производства алюминия. В результате для производства 1 тонны алюминия с использованием гидрогенерации в атмосферу выделяется чуть более 4 тонн углекислого газа, а при использовании угольной генерации – в пять раз больше – 21,6 тонны.
Углекислый газ
Для сравнения – за один солнечный день 1 гектар леса поглощает из воздуха 120-280 кг углекислого газа и выделяет 180-200 кг кислорода.
Литейное производство
Расплавленный алюминий в ковшах доставляется в литейный цех алюминиевого завода. На этой стадии металл все еще содержит небольшое количество примесей железа, кремния, меди и других элементов. Но даже доли процента, приходящиеся на примеси, могут изменить свойства алюминия, поэтому здесь их удаляют методом переплавки в специальной печи при температуре 800°С. Полученный чистый алюминий разливают в специальные формы, в которых металл приобретает свою твердую форму.
На этой стадии металл все еще содержит небольшое количество примесей железа, кремния, меди и других элементов. Но даже доли процента, приходящиеся на примеси, могут изменить свойства алюминия, поэтому здесь их удаляют методом переплавки в специальной печи при температуре 800°С. Полученный чистый алюминий разливают в специальные формы, в которых металл приобретает свою твердую форму.
Самые маленькие слитки алюминия называются чушками, они имеют вес 6 до 22,5 кг. Получив алюминий в чушках, потребители вновь расплавляют его и придают тот состав и форму, которые требуются для их целей.
Самые большие слитки – 30-тонные параллелепипеды длиной 11,5 метров. Их изготавливают в специальных формах, уходящих в землю на примерно 13 метров. Горячий алюминий заливается в нее в течение двух часов – слиток «растет» в форме как сосулька, только в обратном направлении. Одновременно его охлаждают водой и к моменту завершения выливки он уже готов к дальнейшей транспортировке. Прямоугольные слитки называются слябами (от англ. slabs) – они используются для проката в тонкие листы и производства алюминиевой фольги, банок для напитков или, к примеру, автомобильных кузовов.
Прямоугольные слитки называются слябами (от англ. slabs) – они используются для проката в тонкие листы и производства алюминиевой фольги, банок для напитков или, к примеру, автомобильных кузовов.
Алюминий в форме цилиндрических слитков достигает в длину 7 метров – их используют для экструзии, то есть выдавливание через отверстие необходимой формы. Именно так производится большая часть алюминиевых изделий.
В литейном цехе алюминию придают не только разные формы, но и состав. Дело в том, что в чистом виде этот металл используется гораздо реже, чем в виде сплавов.
Сплавы производятся путем введения в алюминий различных металлов (так называемых легирующих добавок) – одни повышает его твердость, другие плотность, третьи приводят к изменению его теплопроводности и т.д. В качестве добавок используются бор, железо, кремний, магний, марганец, медь, никель, свинец, титан, хром, цинк, цирконий, литий, скандий, серебро и др. Кроме этих элементов, в алюминиевых сплавах могут присутствовать еще около десятка легирующих добавок, таких как стронций, фосфор и другие, что значительно увеличивает возможное число сплавов. На сегодняшний день в промышленности используется свыше 100 марок алюминиевых сплавов.
На сегодняшний день в промышленности используется свыше 100 марок алюминиевых сплавов.
Новые технологии
Производители алюминия постоянно совершенствуют свои технологии, дабы научиться производить металл наилучшего качества с наименьшими затратами и минимальным воздействием на экологию. Уже сконструированы и работают электролизеры, мощность силы тока у который по 400 и 500кА, модернизируются электролизеры прошлых поколений.
Одна из передовых мировых разработок – производство металла с использованием инертного анода. Эта уникальная революционная технология позволит алюминщикам отказаться от использования угольных анодов. Инертный анод, упрощенно говоря, вечен, но что самое важное – при его использовании в атмосферу выделяется не углекислый газ, а чистейший кислород. Причем 1 электролизная ванна сможет вырабатывать столько же кислорода, сколько 70 га леса. Пока эта технология секретна и проходит промышленные испытания, но кто знает – может быть, в будущем она сделает из алюминиевой промышленности еще одни легкие нашей планеты.
Переработка
Алюминий обладает полезным свойством – не терять своих свойств в процессе использования, поэтому изделия из него могут подвергаться переплавке и вторичной переработке в уже новые изделия. Это позволяет сохранить ту колоссальную энергию, затраченную на производство алюминия впервые.
По расчетам Международного алюминиевого института с 1880 года в мире произведен почти 1 млрд тонн алюминия и три четверти всего этого объема до сих пор используется. Около 35% в зданиях и сооружениях, 30% – в электрических кабелях и оборудовании и 30% – в транспорте.
Здания и сооружения
Электрические кабели
Транспорт
По всему миру собирают отходы алюминия – в быту это, в основном, алюминиевые банки из-под напитков. Подсчитано, что 1 кг собранных и сданных в переработку банок позволяет сэкономить 8 кг боксита, 4 кг различных фторидов и 14 кВт/ч электроэнергии. Кроме этого, это позволяет существенно сократить экологический урон от все разрастающихся свалок. Развитие экологической ответственности делает все более популярной идею раздельного сбора мусора во всем мире.
Кроме этого, это позволяет существенно сократить экологический урон от все разрастающихся свалок. Развитие экологической ответственности делает все более популярной идею раздельного сбора мусора во всем мире.
Алюминиевая банка – самый часто перерабатываемый продукт. Примерно через 6 недель после использования они вновь оказываются на полках магазинов.
Ежегодно в мире производится более 220 млрд банок для напитков, в Европе 90% из них вторично перерабатываются – причем зачастую снова в банки, поэтому именно алюминиевую банку называют вечной. Но переработать можно что угодно – и корпуса автомобилей, и использованную фольгу для запекания, и раму велосипеда.
В статье использованы фотоматериалы © Shutterstock и © Rusal.
Очистка природного газа от сернистых соединений – Газоподготовка
Методы очистки метана от сероводорода и меркаптанов
Абсорбционные и адсорбционные методы [6].
При взаимодействии меркаптанов RSH со щелочами в присутствии O2 и CO2, которые всегда, хоть и в небольших количествах, находятся в газах, образуются ди- и полисульфиды, плохо растворимые в абсорбенте. Нейтральные по характеру сероокись углерода, органические сульфиды RSR’ (и ряд других соединений) растворяются в этих абсорбентах, хотя их сорбционная способность значительно меньше, чем у RSH. Наличие в газах CO2 выше 0,1–0,3 % приводит к ее преимущественному растворению, значительно снижая абсорбцию RSH. В природных газах содержание CO2, как правило, выше 0,7 %, что затрудняет использование этих методов для тонкой очистки. Методы неэффективны также для очистки от тиофена C4H4S и его производных.
Для очистки от кислых сернистых веществ широко используются также растворы моно- и диэтаноламина с различными активирующими добавками, такими, как N-метилпирролидон-2, дипропаноламин и др.
Значительное распространение получили адсорбционные методы. Они основаны на избирательном поглощении (адсорбции) сернистых соединений твердыми сорбентами. Как правило, адсорбцию ведут при температуре 20–50 °C и повышенном давлении, а регенерацию (десорбцию) насыщенного сернистыми веществами адсорбента – при низком давлении и температуре 100–350 °С. Для регенерации через слой адсорбента пропускается какой-либо из инертных газов, малосернистый природный или нефтяной газ, водяной пар и др. [5–7].
В ряде случаев одновременно с адсорбцией протекают каталитические реакции, вследствие чего сернистые вещества превращаются в элементарную серу, которую извлекают при регенерации и затем используют.
В качестве адсорбента применяют активированный уголь марок АР-3, СКТ-1 и других, а также уголь с добавками щелочи. При этом, наряду с очисткой от сернистых веществ, из газов извлекаются также бензол и толуол, которые затем выделяют при регенерации.
Для очистки многосернистых природных и нефтяных газов большое распространение в качестве адсорбентов получили молекулярные сита (цеолиты) марок СаА и, особенно, NaX. Их адсорбционная емкость в большей мере зависит от содержания в газах H2O, CO2 и высших углеводородов, условий эксплуатации и степени очистки и колеблется в пределах от 2 до 18 %.
Существенное влияние на емкость цеолитов по сернистым соединениям оказывает присутствие в газе паров тяжелых углеводородов. По степени сорбируемости на цеолитах соединения, входящие в состав природного газа, могут быть расположены в ряд: H2O>RSH>H2S>COS>CO2.
Основная проблема адсорбционной очистки газа на цеолитах от сероводорода в присутствии СО2 состоит в том, что при адсорбции СО2 и H2S происходит образование серооксида углерода (COS) по реакции:
СО2 + H2S Û COS + H2O.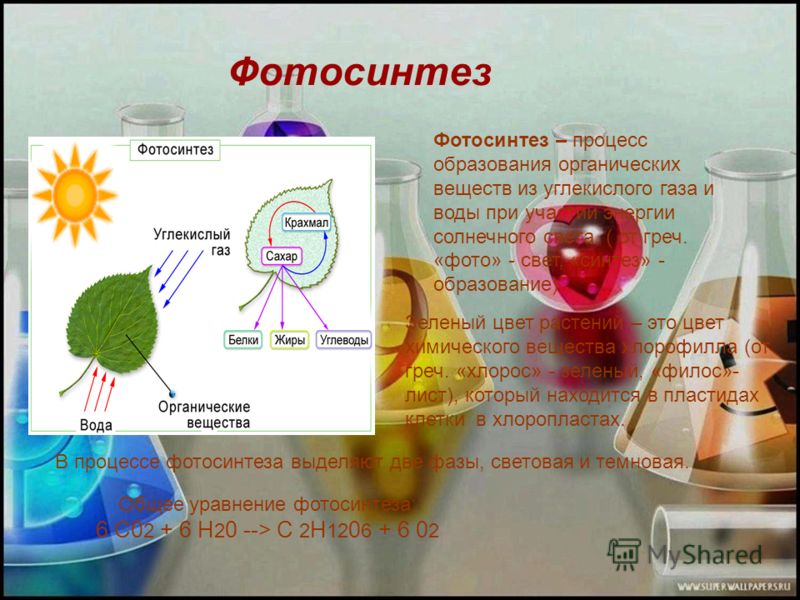
Хотя константа равновесия этой реакции невелика и составляет 6,6∙10-6 при 298 K, однако практически полное удаление паров H2O в лобовом слое цеолита сдвигает равновесие вправо, и это приводит к образованию значительных концентраций COS. Регенерация цеолитов производится азотом, малосернистым природным или нефтяным газом, причем в газах регенерации (регенератах) содержание сернистых веществ возрастает в 5–10 раз по сравнению с исходным. Кроме углей и цеолитов, в процессе очистки применяются также окись алюминия, бокситы, алюмосиликаты и др. Преимуществом адсорбционных методов является возможность проведения процесса при низких температурах, а также тонкая очистка газов не только от сероводорода, меркаптанов, органических сульфидов, но и от таких трудноудаляемых другими способами веществ, как тиофен и его производные.
Этот метод имеет и ряд существенных недостатков. Практически во всех газах имеется определенное количество паров H2O, CO2, высших углеводородов, хорошо адсорбируемых углями и цеолитами, что снижает сероемкость адсорбентов. Периодический процесс очистки требует установления нескольких параллельно работающих колонн: на одних производится поглощение сернистых веществ (стадия адсорбции), а на других регенерация адсорбентов.
Периодический процесс очистки требует установления нескольких параллельно работающих колонн: на одних производится поглощение сернистых веществ (стадия адсорбции), а на других регенерация адсорбентов.
Хемосорбционные и каталитические методы
Недостатки, присущие абсорбционным и адсорбционным методам, заставляют использовать более универсальные каталитические и хемосорбционные способы.
Их можно разделить на следующие группы:
а) каталитическую: сероорганические вещества подвергаются гидрогенолизу до насыщенных углеводородов CnH2n+2 и H2S, деструкции (крекингу) с образованием ненасыщенных углеводородов CnH2n и H2S, гидролизу с отщеплением H2S и его окислением до SO2;
б) хемосорбционную: происходит взаимодействие сернистых веществ с металлами или их оксидами с образованием сульфидов металлов;
в) хемосорбционно-каталитическую: в первой ее стадии протекают хемосорбционные процессы, во второй после частичного сульфидирования контакта – одновременно хемосорбционные и каталитические процессы на образовавшихся сульфидах металлов как на катализаторах, а в третьей после полного осернения – только каталитические процессы.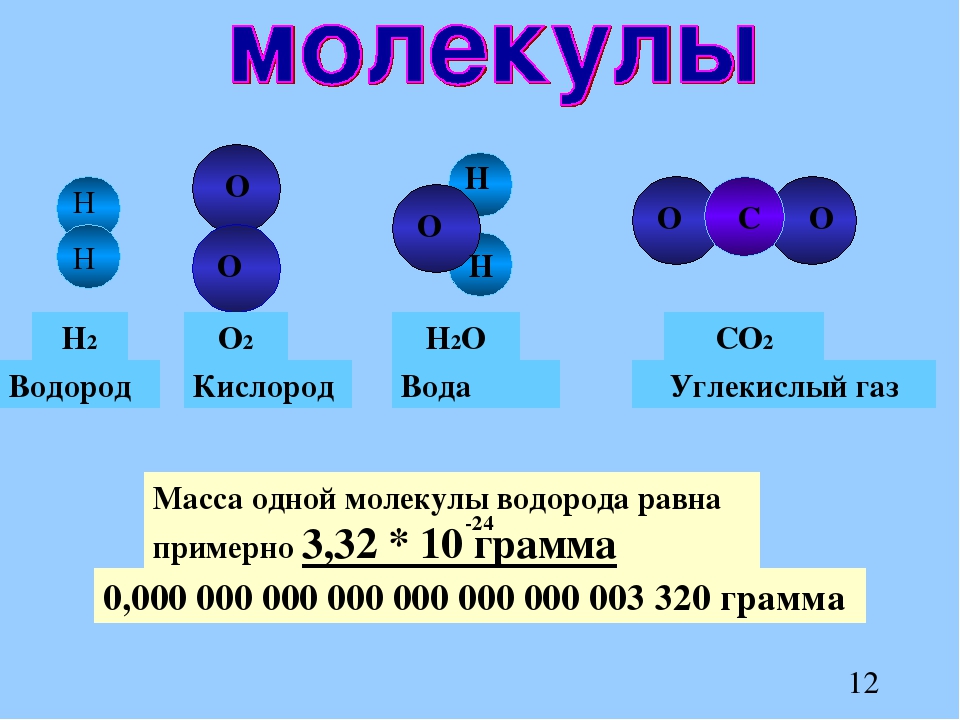
Наибольшее распространение среди каталитических методов получили способы гидрогенолиза сероорганических веществ [5-9]. Для этой цели широко используются катализаторы на основе Ni, Мо, Co, W и др. При этом в области температур 300–450 °C могут идти следующие реакции:
RSH + H2 Û RH + H2S,
RSR’ + 2H2Û RH + R’H + H2S,
C4H4S + 4H2Û C4H10 + H2S,
COS + H2Û CO + H2S,
COS + 4H2 Û CH4 + H2O + H2S,
CS2 + 2H2 Û C + 2H2S,
CS2
+ 4H2 Û CH4 + 2H2S.
Широкое распространение для гидрообессеривания получили катализаторы на основе элементов VI и VIII групп. В основном, используются Co или более дешевый Ni (3–5 %) и Мо (10–15 %), нанесенные на активную γ-Al2O3. Для устойчивой работы катализаторов необходимо, чтобы в газе было не менее 5 % (желательно 9–11 %) водорода. Наличие в очищаемом газе CO и CO2 в количестве 1–2 % не влияет на процесс очистки.
Упрощенный подход к расчету стадии гидрирования состоит в следующем [5;20]. Считая, что: а) порядок реакции по органической суммарной сере – первый; б) температура по ходу газа постоянная; в) в слое катализатора происходит идеальное вытеснение, получим
V = k/ln(cвх /cвых),
где V – объемная скорость газового потока; k – константа скорости; cвх и cвых – входное и выходное содержания органической суммарной серы, соответственно.
При разных входных содержаниях c1вхи c2вх для соответствующих им объемных скоростей V1 и V2, при которых значения cвых одинаковы, имеем:
V2 / V1 = ln(c1вх /cвых)/ ln(c2вх /cвых).
При допустимом содержании органической серы после стадии гидрирования 1 мг/м3, номинальном значении c1вх = 80 мг/нм3, фактическом максимальнм разовом содержании (ОАО «Метафракс», г. Губаха, Пермской обл., см. раздел 3) c2вх = 11,1 мг/м3, V1= 1650 ч-1 (номинальная нагрузка аппарата гидрирования), получим для максимально допустимой объемной скорости гидрирования при реальном содержании серы V2 » 3000 ч-1. Более активного катализатора, с более высоким значением k, можно загрузить еще меньше.
Более активного катализатора, с более высоким значением k, можно загрузить еще меньше.
Этот подход оправдал себя при разработке в ООО «НИАП-КАТАЛИЗАТОР» оптимальных загрузок узлов сероочистки.
В последние годы все более широкое распространение в очистке от сероводорода газов с его высоким содержанием (природный газ на месторождениях, попутные газы нефтедобычи и заводские газы нефтепереработки и т.п.) получает процесс Клауса [10]. Он состоит из двух стадий:
I стадия – термическое окисление сероводорода до диоксида серы воздухом при 900–1350 °C:
2H2S + 3O2 Þ 2SO2 + 2H2O.
На этой стадии расходуется до 70 % мас. сероводорода и выделяется значительное количество тепла, которое перед каталитической стадией должно быть утилизировано.
II стадия – каталитическое превращение сероводорода и диоксида серы при 220–250 °C (реакция Клауса):
2H2S + SO2 Þ 3S + 2H2O.
Катализаторы состоят из оксида алюминия, оксида титана, а также из их смеси. В процессе Клауса также возможно образование серы по реакции прямого окисления сероводорода:
2H2S + O2 Þ 2S + 2H2O.
Хемосорбционная очистка [5; 8–11]
При взаимодействии сероорганических веществ и H2S с металлами и их окислами могут протекать следующие реакции (Ме – металл: Zn, Cu, Fe и др.):
MeO + H2S Û MeS + H2O,
MeO + CnH2n+1SH Û MeS + H2O + CnH2n,
MeO + 2CnH2n+1SH Û MeS + H2O + (CnH2n+1)2S,
MeO + (CnH2n+1)2S Û MeS + H2O + 2CnH2n,
MeO + COS Û MeS + CO2,
2MeO + CS2 Û 2MeS + CO2,
Me + H2S Û MeS + H2,
Me + CnH2n+1SH Û MeS + CnH2n+2,
Me + (CnH2n+1)2S Û MeS + CnH2n+2
+ CnH2n.
В настоящее время в связи с развитием различных методов сероочистки, использование процессов, базирующихся на хемосорбции сероводорода сорбентами на основе оксидов железа при низких температурах (оптимальная температура сорбции 28–30 °С), занимает в промышленности весьма скромное место. Основным их недостатком является выделение соединений серы в поток газа при попадании паров воды на уже осерненный сорбент [12-14].
Для тонкой очистки водяного газа используется железо-содовая сероочистная масса, состоящая из Fe2O3 (40–45 %), Na2CO3 (30 %), Al2O3, SiO2, CaO и др. Процесс весьма эффективен для очистки от COS, CS2 и RSH. Он проводится при сравнительно низких температурах (150–200 °С), причем остаточное содержание сернистых веществ может быть ниже 1 мг/м3.
Очень дешевые хемосорбенты на основе окислов железа используются для очистки газов при содержании сернистых веществ в них до 2–3 г/м3. Однако допустимые объемные скорости на таких хемосорбентах в 5–10 раз меньше, чем на активной окиси цинка и меди. С другой стороны, в [15]
утверждается, что Fe2O3 как высокотемпературный поглотитель превосходит CaO и ZnO.
Однако допустимые объемные скорости на таких хемосорбентах в 5–10 раз меньше, чем на активной окиси цинка и меди. С другой стороны, в [15]
утверждается, что Fe2O3 как высокотемпературный поглотитель превосходит CaO и ZnO.
В газо- и нефтехимии преимущественно используются сероочистные массы на основе оксидов цинка, меди, хрома, получившие значительное распространение. Хемосорбенты могут применяться и при одноступенчатой очистке, если в исходном газе содержится практически только H2S или сероорганические вещества в количестве не более 5–7 мг/м3 (содержание в очищенном газе не более 0,5–1 мг/м3). При их большем количестве в исходном газе хемосорбенты эффективно работают лишь при использовании двухступенчатой очистки.
В случае ZnO и CuO процесс идет при температурах 250–400 °С. Хемосорбенты, содержащие CuO, перед использованием следует восстановить, при этом CuO переходит в Cu и Cu2O.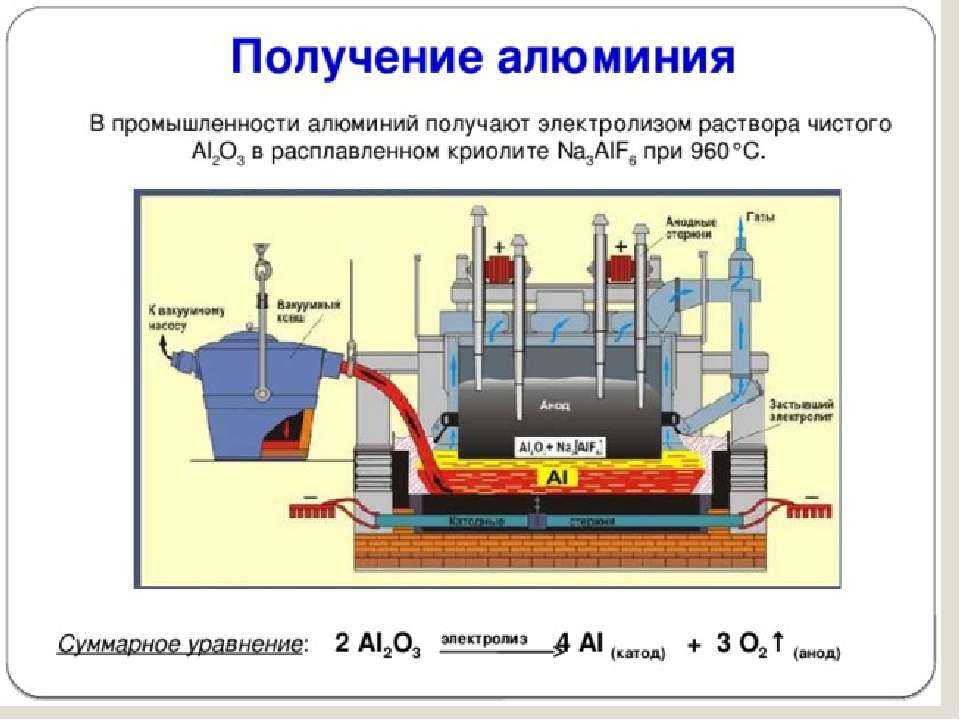
В последние годы появилась новая область применения хемосорбционной очистки газов от сероводорода, связанная с разработкой месторождений нефти в Северном море.
Обычно применявшиеся для этих целей в нефтяной промышленности алканоламиновые установки сами по себе неприемлемы в этом случае из-за большой массы и габаритов и потребности в паре для регенерации абсорбента. Компания Johnson Matthey разработала, применительно к условиям очистки газов на морских нефтяных платформах, новый эффективный хемосорбент на основе оксида цинка с фирменным названием ICI 75-1. Этот сорбент имеет высокую удельную поверхность, что делает возможным использование его при относительно низких температурах. Он характеризуется несколько меньшей плотностью, но, практически, той же механической прочностью, что и хемосорбент ICI 32-4, выпускаемый для очистки газов в производстве аммиака и метанола.
Результаты сравнительных испытаний на пилотной установке обоих хемосорбентов при очистке природного газа, содержащего 0,2 % об. H2S и 4,0 % об. СО2, показали, что их динамическая емкость (в процентах от теоретически возможной) при объемной скорости 1000 ч-1 зависит от температуры следующим образом (табл.1).
H2S и 4,0 % об. СО2, показали, что их динамическая емкость (в процентах от теоретически возможной) при объемной скорости 1000 ч-1 зависит от температуры следующим образом (табл.1).
Таблица 1. Влияние температуры на динамическую сероёмкость цинковых поглотителей.
|
t, °С |
0 |
50 |
100 |
150 |
200 |
300 |
|
|
Динамическая емкость, % |
ICI 32-4 |
16 |
16 |
18 |
27 |
41 |
68 |
|
ICI 75-1 |
34 |
45 |
54 |
64 |
72 |
84 |
|
При температуре выше 400 °C емкости обоих сорбентов практически одинаковы.
Как видно из представленных результатов испытаний, хемосорбент ICI-75-1 имеет существенные преимущества при пониженных температурах. Именно этот сорбент используется для очистки попутных нефтяных газов на морских платформах в Северном море.
Следует отметить, что, хотя хемосорбенты на основе оксидов цинка, меди и хрома уже десятилетиями выпускаются промышленностью многих стран, интенсивные исследования их продолжаются, в том числе, направленные на более глубокое изучение механизма и кинетики процессов хемосорбции сернистых соединений [5; 9; 16–20].
Оказалось, например, что осернение гранулы поглотителя происходит по модели «сжимающегося ядра» (рис. 1), т.е., есть резкая граница между осерненным внешним слоем (светлые области) и непрореагировавшим ядром (темные области).
Рис.1. Обработанные гранулы поглотителя НИАП-02-05, выгруженного из II ступени сероочистки, расколотые по сечениям: а – поперечному, б – продольному.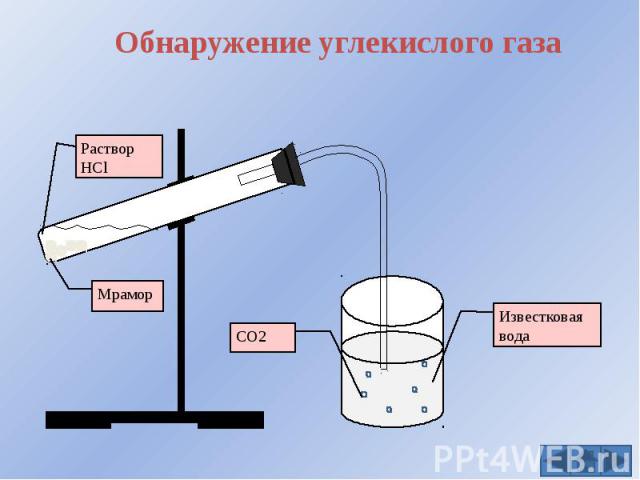
В работах [21;22] представлена достаточно реалистичная модель работы слоя поглотителя, учитывающая внутреннюю диффузию и кинетику реакции H2S в грануле хемосорбента. Это позволяет создавать сорбенты, обладающие новыми, заранее заданными свойствами, например, высокой емкостью при низких температурах, повышенной термической стойкостью, способностью к многократной регенерации. Также это позволило оценить динамику работы поглотителя в твердой и газовой фазах (рис. 2).
Рис. 2. Вид фронтов серы в газовой и твердой фазах аппарата сероочистки в начале работы, во время пробега и при проскоке. Δх – ширина фронта серы по положению касательной в точке перегиба фронта.
Поглотители ООО «НИАП-КАТАЛИЗАТОР»
В настоящее время ООО «НИАП-КАТАЛИЗАТОР» – ведущий в России производитель катализаторов сероочистки для производств, получающих синтез-газ из природного газа.
Его катализаторное производство выпускает несколько типов поглотителей для разных условий эксплуатации и требований потребителей. Цинковые композиты НИАП-02-02 (таблетки) и НИАП-02-05 (экструдаты) были рассчитаны на диапазон температур 300–390 °С. НИАП-02-05 устойчиво работает при температурах до 450 °С, а цинкмедные композиты НИАП-02-03 (экструдаты) и НИАП-02-04 (таблетки) рассчитаны на диапазон температур 150–350 °С.
В 2017 г. объем производства поглотителей превысил 400 т.
В табл. 2 приведены некоторые характеристики цинковых катализаторов ООО «НИАП-КАТАЛИЗАТОР».
Имеются два важных их отличия от выпускавшихся ранее: а) цинксодержащим сырьем для их приготовления служат более дорогие цинковые белила, существенной особенностью которых является практическое отсутствие вредных примесей, в первую очередь, свинца; б) промежуточной стадией при их производстве является получение основного карбоната цинка; это существенно снижает размер кристаллитов ZnO, что позволяет, в частности, получить более мелкие частицы оксида цинка при помоле и, таким образом, улучшает сероемкость, а также динамические характеристики процесса образования ZnS. Использование карбоната цинка при приготовлении цинковых поглотителей было впервые описано в [13].
Использование карбоната цинка при приготовлении цинковых поглотителей было впервые описано в [13].
Таблица 2.
|
Марка |
Удельная поверхность, м2/г |
Пористость, % |
Сероемкость , % |
|
НИАП-02-02 |
34 |
35 |
25 |
|
НИАП-02-05 |
56 |
54 |
32 |
Существенную роль в формировании стабильной структуры поглотителя играет добавление небольшого количества (5–7 % мас. ) MgO при получении экструдатов. В [14] показано, что размер частиц ZnO (около 300 Å) и сероемкость сохраняются при промышленной эксплуатации поглотителей именно благодаря MgO.
) MgO при получении экструдатов. В [14] показано, что размер частиц ZnO (около 300 Å) и сероемкость сохраняются при промышленной эксплуатации поглотителей именно благодаря MgO.
При нынешнем качестве природного газа полной загрузки современного же поглотителя (при правильной его эксплуатации) хватает на десятки лет. Такие пробеги поглотителя НИАП-02-05 имели место, например, в АО «НАК «Азот» (компания «Еврохим»), г. Новомосковск, и в ОАО «Метафракс» (г. Губаха).
К тому же, еще в 70-е годы было обнаружено, что при содержании серы менее 10 мг/м3 гидрирование и гидродеструкция сероорганических соединений, типичных для природного газа, полностью происходят в уже осернившемся лобовом слое поглотителя.
Знание динамики поглощения серы позволяет рассчитать прогноз работы конкретной загрузки в виде графика зависимости отношения содержания серы в газе на выходе ко входу от общего количества поступившей в аппарат серы.
Зависимость сероемкости формованных поглотителей от температуры в рабочем диапазоне показана на рис. 3.
3.
Всего с 1992 г. в ООО «НИАП-КАТАЛИЗАТОР» изготовлено около 3000 т различных поглотителей для 18 предприятий. Бóльшая часть этих загрузок успешно эксплуатируется до сих пор.
Рис. 3. Влияние температуры эксплуатации поглотителя НИАП-02-05 на его сероёмкость.
Поглотители на другой основе
В последнее время делаются попытки расширить спектр веществ, используемых для поглощения серы. Весьма перспективны оксиды La и Ce, в качестве высокотемпературных (800–1000 °С) регенерируемых поглотителей.
Согласно [6], исследовательской лабораторией японской фирмы Hitachi предложен нетрадиционный хемосорбент для очистки газов от сероводорода, состоящий из МоО3 и TiO2. Он работает при относительно низких температурах (100–300 °С) и легко регенерируется с образованием диоксида серы кислородсодержащим газом при тех же температурах.
Фирма Mitsubishi запатентовала способ очистки топливного газа от сероводорода с помощью аналогичного поглотителя, содержащего, по крайней мере, один из металлов группы Fe, Ni, Со и оксид Мо на носителе, состоящем из TiO2, стабилизированного оксидом W. Адсорбент регенерируют при повторном использовании нагреванием в атмосфере кислородсодержащего газа.
Адсорбент регенерируют при повторном использовании нагреванием в атмосфере кислородсодержащего газа.
В качестве высокотемпературных регенерируемых поглотителей испытаны смешанные оксиды, компоненты которых в качестве индивидуальных поглотителей хорошо известны (Fe2O3, CaO и ZnO). Это позволило получить стабильные сульфиды в заданных температурных диапазонах [1].
Другим вариантом комбинирования известных индивидуальных поглотителей является ZnO, нанесенный на цеолит. Предложен также способ приготовления хемосорбента сероводорода путем пропитки при 60–80 °C гранул носителя (Al2O3) насыщенным раствором CuSO4 или NiSO4 в течение 3–5 часов. Затем гранулы высушивают при постепенном повышении температуры от 20 до 105 °C.
Таким образом, явно прослеживается тенденция нанесения хемосорбентов на носители с развитой поверхностью и пористой структурой. Это обеспечивает высокую скорость и полноту отработки сорбента, как в режиме сорбции, так и в режиме регенерации, что делает привлекательным использование таких сорбентов в циклических процессах очистки, несмотря на сниженное содержание собственно поглотителя.
Очистка на катализаторах-хемосорбентах
К этой группе относятся вещества, работа которых включает три стадии: хемосорбционную, каталитическую и промежуточную [3–5]. На хемосорбционной идут реакции образования сульфидов, на каталитической – гидрогенолиза, крекинга и ряд других, на промежуточной могут одновременно протекать те и другие реакции. Для обеспечения процессов хемосорбции и катализа сероочистные массы должны включать в себя вещества с бифункциональными свойствами. Катализаторы-хемосорбенты могут использоваться как для одноступенчатой очистки, когда содержание сернистых веществ относительно невелико (до 20–25 мг/м3), так и в качестве катализаторов первой ступени. В последнем случае они значительно увеличивают сероемкость всего узла очистки в целом.
В ГИАП (г. Москва) и НФ ГИАП (ныне ООО «НИАП-КАТАЛИЗАТОР») в начале 70-х годов были созданы и выпущены в опытно-промышленном масштабе бифункциональные контакты: цинкхроммедный КС-4, созданный на базе отработанного катализатора низкотемпературной конверсии окиси углерода, и цинкалюминиевый ГИАП-943Н без промоторов или с небольшими (0. 5–4%) добавками никеля и молибдена. Первый работает в области температур 280–350 °C, второй – 350–380 °C, при объемных скоростях 1000–1500 ч-1 в зависимости от серосодержания сернистых вещеcтв в газах и необходимой степени очистки. Сероемкость КС-4 составляет 10–12 %, ГИАП-943Н – 8–20 %.
5–4%) добавками никеля и молибдена. Первый работает в области температур 280–350 °C, второй – 350–380 °C, при объемных скоростях 1000–1500 ч-1 в зависимости от серосодержания сернистых вещеcтв в газах и необходимой степени очистки. Сероемкость КС-4 составляет 10–12 %, ГИАП-943Н – 8–20 %.
Перед работой КС-4 необходимо его восстановить, а перед выгрузкой – пассивировать. ГИАП-943Н не требует восстановления и пассивации, но для его нормальной эксплуатации необходимо в очищаемый газ дозировать не менее 8–9 % водорода.
КС-4 эффективно очищает газ при содержании в нем сероорганических веществ до 20 мг/м3, причем первые 6–7 месяцев он может работать без водорода, а затем в газ необходимо подавать 5–7 % водорода. После осернения контакта на 10–12 % его следует заменять свежим. Катализатор-хемосорбент ГИАП-943Н, в отличие от КС-4, после осернения может эксплуатироваться как катализатор гидрогенолиза сероорганических соединений, превращая последние в сероводород и углеводороды.
Практически одновременно фирма Haldor Topsoe разработала и выпустила катализатор-хемосорбент HTZ.
Термодинамика хемосорбционных реакций очистки газов от сернистых соединений
Наибольшее распространение в качестве хемосорбентов для очистки углеводородных газов получили сероочистные массы, содержащие оксиды цинка и меди, причем оксиды меди в ряде процессов восстанавливаются до металла. Качественный состав сернистых веществ в составе природного газа разнообразен. В большинстве газов содержание H2S, RSH, RSR, COS и CS2 составляет более 90 % от общего количества. Меркаптаны и сульфиды представлены, главным образом, C2H5SH и (C2H5)2S, соответственно.
В табл. 3 [16] приведены данные по термодинамике реакций ZnO, CuO и Cu с H2S. Значения констант равновесия Kp были рассчитаны методом Темкина-Шварцмана.
Таблица 3. Термодинамические характеристики хемосорбционных реакций.
Термодинамические характеристики хемосорбционных реакций.
|
№ п.п. |
Реакции |
ΔH298, ккал/моль |
lg Kp |
|||
|
500 K |
600 K |
700 К |
800 К |
|||
|
1 |
H2S + ZnO Û ZnS + H2O |
– |
8,4 |
7,1 |
6,1 |
5,4 |
|
2 |
H2S + CuO Û CuS + H2O |
– |
12,2 |
10,2 |
8,8 |
7,8 |
|
3 |
H2S + Cu Û CuS + H2 |
– |
0,7 |
0,2 |
-0,1 |
-0,4 |
|
4 |
2Cu + S2 Û 2CuS |
-53,68 |
15,0 |
11,1 |
8,3 |
6,3 |
|
5 |
8Cu + S8 Û 8CuS |
-112,83 |
40,0 |
31,8 |
25,9 |
21,5 |
|
6 |
S2 + 2Н2 Û 2H2S |
-40,48 |
13,5 |
10,5 |
8,3 |
6,6 |
|
7 |
S8 + 8Н2 Û 8H2S |
-64,35 |
35,7 |
30,5 |
26,6 |
23,3 |
Видно, во-первых, что реакции взаимодействия ZnO, CuO и Cu с H2S идут практически
без теплового эффекта, что позволяет рассматривать их как изотермические даже
при заметном содержании H2S. Во-вторых, в интересующем нас
температурном диапазоне образование сульфидов можно считать практически
необратимым [6].
Во-вторых, в интересующем нас
температурном диапазоне образование сульфидов можно считать практически
необратимым [6].
Что касается реакций (6) и (7), их также можно считать практически необратимыми в условиях работы II ступени сероочистки.
Промышленные узлы сероочистки
Узел сероочистки природного газа агрегата аммиака или метанола состоит, как правило, из аппарата гидрирования и двух аппаратов поглощения серы. Регламентные объемы загрузки аппаратов узла сероочистки агрегата аммиака составляют: 40 м3 катализатора гидрирования и два аппарата по 50 м3 поглотителя. На рис. 4 приведена схема для крупного производства метанола, такого, как на ОАО “Метафракс” ( г. Губаха, Пермской обл.).
Проектные объемы загружаемых катализатора и поглотителя были приняты, исходя из высокого содержания серы в магистральном природном газе (до 80 мг/м3).
В
связи со значительным снижением в последнее время содержания серы в магистральном
природном газе загрузки узла сероочистки можно существенно уменьшить, тем
более, что при длительных сроках пробега поглотителя (до 15 и более лет)
сероемкость его тыльных слоев может заметно снизиться.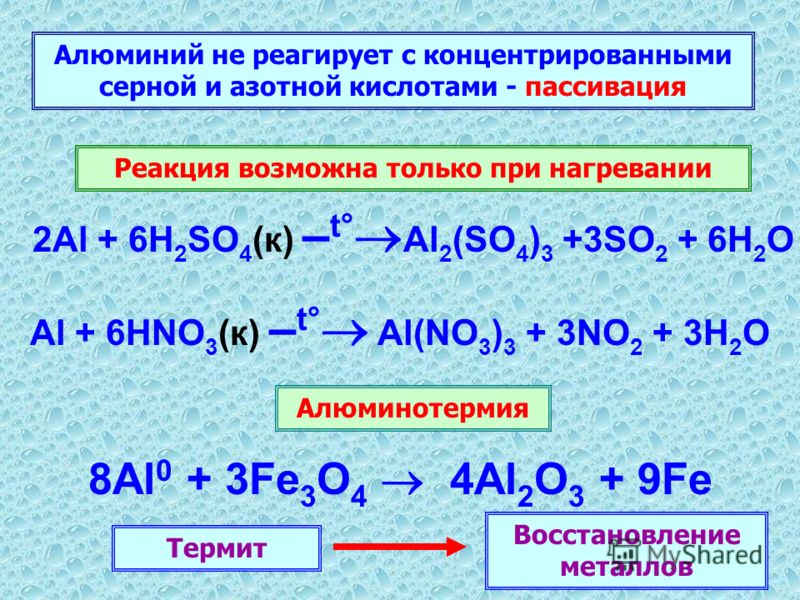
В настоящее время и в России, и за рубежом, как, например, на производственных участках Севернсайд и Биллингем (Великобритания) компании Terra Nitrogen (UK), ныне принадлежащих CF Fertilisers (США), имеется опыт эксплуатации катализатора гидрирования и поглотителя при их загрузке в один аппарат.
Рис. 4. Узел сероочистки агрегата метанола М-750.
Примером может служить загрузка узла сероочистки агрегата метанола М-750 в ОАО «Метафракс» (г. Губаха) в сентябре 1999 г. Вместо 67 м3 катализатора гидрирования и 268 м3 поглотителя было загружено (совместно с компанией ICI) 35 м3 катализатора гидрирования и 40 м3 поглотителя послойно в одном аппарате [1;19]. Сокращенная загрузка проработала 10 лет при средней концентрации серы около 1 мг/м3.
В
последние годы появилось еще одно направление использования сероочистки
промышленных газов, в первую очередь, цинковыми поглотителями. Речь идет о
процессе «Midrex» (компании Midland Ross corp.) получения губчатого
железа прямым восстановлением окатышей, содержащих железную руду.
Восстановление производится продуктами паро-углекислотной конверсии природного
или попутного газов, причем H2O и CO2 поступают с газами, выходящими из шахтной печи после
восстановления окатышей. Поскольку сера содержится и в природном /попутном газе,
и в колошниковых (в результате восстановления FeS, содержащегося в руде), причем на вход узла конверсии
поступает до 40 ppm
Речь идет о
процессе «Midrex» (компании Midland Ross corp.) получения губчатого
железа прямым восстановлением окатышей, содержащих железную руду.
Восстановление производится продуктами паро-углекислотной конверсии природного
или попутного газов, причем H2O и CO2 поступают с газами, выходящими из шахтной печи после
восстановления окатышей. Поскольку сера содержится и в природном /попутном газе,
и в колошниковых (в результате восстановления FeS, содержащегося в руде), причем на вход узла конверсии
поступает до 40 ppm
(в пересчете на S), перед конверсией ее следует удалить. При этом в некоторых установках на вход сероочистки приходится подавать газовую смесь с температурой до 450 °C.
В
России такие производства работают в АО «Лебединский ГОК» (г. Губкин) и ПАО
«Оскольский электрометаллургический комбинат» (г. Старый Оскол), под
управлением ООО «УК Металлоинвест». Опыт нескольких лет эксплуатации на этих
производствах поглотителя НИАП-02-05 производства ООО «НИАП-КАТАЛИЗАТОР» оказался успешным.
Опыт нескольких лет эксплуатации на этих
производствах поглотителя НИАП-02-05 производства ООО «НИАП-КАТАЛИЗАТОР» оказался успешным.
Литература
1. Афанасьев С.В., Садовников А.А., Гартман В.Л., Обысов А.В., Дульнев А.В. Промышленный катализ в газохимии. Монография под ред. д.т.н. С.В. Афанасьева. Самара; Изд. СНЦ РАН. 2018. – 160 с.
2. Fenouil L.A., Towler G.P., Linn S. Removal of H2S from coal gas using limestone: kinetic considerations // Ind. Eng. Chem. Res. 1994. Vol. 33, No 2. P. 265–272.
3. Данциг М.Л., Турченинова Е.В., Данциг Г.А., Соболевский В.С., Меньшов В.Н., Жаворонков В.В., Кондращенко Т.А., Ермина З.Е. Разработка промышленной технологии получения активной окиси цинка для производства сероочистных масс // Химическая промышленность. 1980. № 8. С. 30–32.
4. Иконников В.Г., Тительман Л.И., Данциг Г.А., Обысов
А.В., Данциг М.Л. Опыт приготовления и промышленной эксплуатации
окисноцинковых формованных поглотителей сернистых соединений //
Химическая промышленность. 1983. № 9. С. 25–28.
1983. № 9. С. 25–28.
5. Гартман В.Л. Динамика хемосорбции серы твёрдым поглотителем и её применение для оптимизации промышленной сероочистки/ Дисс. на соис. уч. степени канд. техн. наук. М.: 2000. 111 с.
6. Лазарев В.И. Методы очистки природного газа от сероводорода твердыми сорбентами // Обз. инф. Науч. и техн. аспекты охраны окруж. среды / ВИНИТИ. 1999. № 4. С. 84–113.
7. Артамонов В.И., Голосман Е.З., Рубинштейн А.М., Якерсон В.И. Исследование свойств и активности цинковых хемосорбентов на носителях // Изв. АН СССР. Сер. хим. 1986. № 5. С. 988–992.
8. Кипнис М.А., Калиневич А.Ю., Гончарук С.Н., Довганюк В.Ф., Данилова Л.Г. Катализаторы сероочистки и паровой конверсии установок производства водород//Нефтепереработка и нефтехимия. 1994. № 5. С. 12–15.
9.
Фурмер Ю.В., Бесков В.С., Бруй О.И., Юдина В.В., Данциг М.Л. Кинетика хемосорбции
сероводорода окисноцинковыми поглотителями // Химическая промышленность. 1982. № 12. С. 37–40.
1982. № 12. С. 37–40.
10. Ахметов С.А. Физико-химическая технология глубокой переработки нефти и газа: Учебное пособие. 4.2. Уфа; Изд-во УГНТУ, 1997. 304 с. ISBN 5-7831-0077-3.
11. Данциг Г.А., Греченко А.Н., Григорьев В.В., Серова Л.П., Ягодкина Г.Н. Влияние способа введения оксида меди на хемосорбционные свойства цинксодержащих сероочистных масс // Ж. прикл. химии. 1988. № 6. С. 1240–1246.
12. Catalyst Handbook. 2-nd ed./Ed. By M.V. Twigg. Wolfe Publishing Ltd, 1989. С. 209.
13. Зельвенский Я.Д., Герчикова С.Ю., Тр. ГИАП, вып. 2. ГНТИХЛ. М.-Л. (1953) С. 132–159.
14.
Гартман В.Л., Сухоручкина Л.А., Боевская Е.А., Шкитина В.И. Динамика рекристаллизации
оксида цинка в промышленном поглотителе сероводорода // Российская конференция
«Научные основы приготовления и технологии катализаторов» и V Российская конференция «Проблемы дезактивации
катализаторов». г. Туапсе, 4–9 сентября 2008 г. Тезисы докладов, Новосибирск-2008,
т. II, с. 27–28.
II, с. 27–28.
15. Yumura M., Furimsky E. Comparison of CaO, ZnO and Fe2O3 as H2S adsorbent at high temperatures // Ind. and Eng. Chem. Process Des. and Dev. 1985. Vol.24, No. 4. P. 1165–1168.
16. Данциг Г.А., Шаркин Г.А., Якерсон В.И., Рыбакова С.М. Термодинамика реакций очистки газов от сернистых веществ // Ж. прикл. химии. 1976. № 2. С. 329–333.
17. Данциг Г.А., Воронцова Н.Ф., Крутина С.А., Данциг М.Л., Якерсон В.И. Определение сероемкости катализаторов и сорбентов динамическим методом // Кинетика и катализ. 1974. Т.15, № 6. С. 1601–1603.
18. Гартман В.Л., Данциг Г.А., Кондращенко Т.А.. Динамические показатели качества сероочистных масс // Ж. прикл. химии. 1982. № 2. С. 358 – 361.
19.
Даут В.А., Гартман В.Л., Коновалов С.Я., Тарарышкин М.В., Обысов А.В., Бесков
В.С., Голосман Е.З. Опыт экономичной загрузки узла сероочистки агрегата синтеза
метанола // Химическая промышленность. 2000. № 10. С. 507–511.
2000. № 10. С. 507–511.
20. Гартман В.Л. Моделирование двухслойного реактора сероочистки. Сб. матер. 1 Всеросс. научно-практ. конф. «Ресурсосбережение и экологическое развитие территорий. /Тольятти, 25–27 апреля 2017 г., ТГУ. 2017. С. 46–50.
21. V.L. Hartmann, Effect of sulphur removal catalyst granules properties on the commercial-scale bed macrokinetics, Chem. Eng. J. 107 (2005) 39–43.
22. V.L. Hartmann, Gas–solid reaction modeling as applied to the fine desulfurization of gaseous feedstocks, Chem. Eng. J. 134 (2007) 190–194
Keywords: sulfur content, natural gas, gas purification, sulfur compounds, desulphurization.
Статья «Очистка природного газа от сернистых соединений» опубликована в журнале «Neftegaz.RU» (№10, Октябрь 2018)
404 Cтраница не найдена
Размер:
AAA
Изображения
Вкл.
Выкл.
Обычная версия сайта
К сожалению запрашиваемая страница не найдена.
Но вы можете воспользоваться поиском или картой сайта ниже
|
|
Химические свойства солей — реакции, определение и примеры
Соли — это сложные вещества, в состав которых входят катионы металла и анионы кислотного остатка. Иногда в состав солей входят водород или гидроксид-ион.
Иногда в состав солей входят водород или гидроксид-ион.
Классификация и номенклатура солей
Так как соли — это продукт полного или частичного замещения металлом атома водорода в кислоте, по составу их можно классифицировать следующим образом.
Кислые соли
Образованы неполным замещением атомов водорода на металл в кислоте.
В наименованиях кислых солей указывают количество водорода приставками «гидро-» или «дигидро-», название кислотного остатка и название металла. Если металл имеет переменную валентность, то в скобках указывают валентность.
Примеры кислых солей и их наименования:
LiHCO3 — гидрокарбонат лития,
NaHSO4 — гидросульфат натрия,
NaH2PO4 — дигидрофосфат натрия.
Средние соли
Образованы полным замещением атомов водорода в кислоте на металл.
Наименования средних солей складываются из названий кислотного остатка и металла. При необходимости указывают валентность.
При необходимости указывают валентность.
Примеры средних солей с названиями:
Основные соли
Продукт неполного замещения гидроксогрупп на кислотный остаток.
В наименованиях основных солей указывают количество гидроксид-ионов приставкой «гидроксо-» или «дигидроксо-», название кислотного остатка и название металла с указанием валентности.
Пример: Mg(OH)Cl — гидроксохлорид магния.
Двойные соли
В состав входят два разных металла и один кислотный остаток.
Наименование складывается из названия аниона кислотного остатка и названий металлов с указанием валентности (если металл имеет переменную валентность).
Примеры двойных солей и их наименования:
Смешанные соли
Содержат один металл и два разных кислотных остатка.
Наименования смешанных солей складываются из названия кислотных остатков (по усложнению) и названия металла с указанием валентности (при необходимости).
Примеры смешанных солей с наименованиями:
Комплексные соли
Образованы комплексным катионом или анионом, связанным с несколькими лигандами.
Называют комплексные соли по схеме: координационное число + лиганд с окончанием «-о» + комплексообразователь с окончанием «-ат» и указанием валентности + внешняя сфера, простой ион в родительном падеже.
Пример: K[Al(OH)4] — тетрагидроксоалюминат калия.
Гидратные соли
В состав входит молекула кристаллизационной воды.
Число молекул воды указывают численной приставкой к слову «гидрат» и добавляют название соли.
Пример: СuSO4∙5H2O — пентагидрат сульфата меди (II).
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Получение солей
Получение средних солей
Средние соли можно образовать в ходе следующих реакций:
Металл + неметалл:
2Na + Cl2 = 2NaCl
Fe + S =FeS
Так получают только соли бескислородных кислот.
Металл, стоящий левее h3 в ряду активности, с раствором кислоты:
Mg + 2HCl = MgCl2 + h3
Металл с раствором соли менее активного металла:
Fe + CuCl2 = FeCl2 + Cu
Основный оксид + кислотный оксид:
Na2O + CO2 = Na2CO3
Основный оксид и кислота:
CuO + H2SO4= CuSO4 + H2O
Основание с кислотным оксидом:
2NaOH + SO3 = Na2SO4 + H2O
Основание с кислотой (реакция нейтрализации):
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
Взаимодействие соли с кислотой:
MgCO3 + 2HCl = MgCl2 + H2O + CO2
BaCl2 + H2SO4 = BaSO4 + 2HCl
Взаимодействие возможно, если одним из продуктов реакции будет нерастворимая соль, вода или газ.

Реакция раствора основания с раствором соли:
2NaOH + CuSO4 = Na2SO4 + Ba(OH)2
Взаимодействие растворов двух солей с образованием новых солей:
NaCl + AgNO3 = AgCl + NaNO3
Получение кислых солей
Кислые соли образуются при взаимодействии:
Кислот с металлами:
Zn + 2H2SO4 = H2 + Zn(HSO4)2
Кислот с оксидами металлов:
CaO + H3PO4 = CaHPO4 + H2O
Гидроксидов металлов с кислотами:
Ba(OH)2 + H3PO4 = BaHPO4 + 2H2O
Кислот с солями:
Ca3PO4 + 4H3PO4 = 3Ca(H2PO4)2
Аммиака с кислотами:
NH3 + H3PO4 = NH4H2PO4
Получение кислых солей возможно, если кислота в избытке.
Также кислые соли образуются в ходе реакции основания с избытком кислотного оксида:
KOH + CO2 = KHCO3
2SO2 + Ca(OH)2 = Ca(HSO3)2
Получение основных солей
Взаимодействие кислоты с избытком основания:
Fe(OH)3 + HCl = Fe(OH)2Cl + H2O
Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов:
Cu(NO3)2 + NaOH = CuOHNO3 + NaNO3
Взаимодействие солей слабых кислот со средними солями:
2MgCl2 + 2Na2CO3 + H2O = [Mg(OH)]2CO3 + CO2 + 4NaCl
Растворимые соли являются электролитами, следовательно, могут распадаться на ионы.
 Средние соли диссоциируют сразу:
Средние соли диссоциируют сразу:NaCl → Na+ + Cl–
Термическое разложение:
CaCO3 = CaO + CO2
Нитраты разлагаются в зависимости от активности металла соли:
Получение комплексных солей
Реакции солей с лигандами:
AgCl + 2Nh4 = [Ag(NH3)2]Cl
FeCl3 + 6KCN = K3[Fe(CN)6] + 3KCl
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Al2O3 + 2NaOH +3H2O = 2Na[Al(OH)4]
Получение двойных солей
Двойные соли получают совместной кристаллизацией двух солей:
Cr2(SO4)3 + K2SO4 + 24H2O = 2[KCr(SO4) 2 • 12H2O]
Химические свойства солей
Химические свойства средних солей
Влияние свободного углекислого газа на коррозионное поведение меди в моделируемой воде
ScienceDirectРегистенс. 665
https://doi.org/10.1016/S0257-8972(03)00049-5Получить права и содержание
Влияние свободного диоксида углерода на коррозионное поведение меди было исследовано с помощью иммерсионных испытаний с электрохимической импедансной спектроскопией. . Скорость коррозии меди увеличивалась с увеличением концентрации свободного углекислого газа. Свободный диоксид углерода постоянно обеспечивает воду H + , если в атмосфере существовал газ CO 2 . Производство H + может помочь восстановить растворенный кислород, чтобы начать окисление меди. Это может быть причиной того, что свободный углекислый газ способствует окислению меди.
Медные трубы широко применяются в системах водоснабжения. Несмотря на хорошую коррозионную стойкость, медные трубы иногда страдают от точечной коррозии I типа. Точечная коррозия I типа чаще всего возникает в системах холодного водоснабжения, использующих жесткую воду. Ямки покрыты зеленоватыми продуктами коррозии, имеющими бугры полусферической формы. Курган в основном состоит из основного карбоната меди и карбоната кальция. Сообщалось, что питтинговая коррозия типа I возникает из-за углеродистых пленок, образующихся из остатков смазки для волочения в процессе отжига при производстве, и что углеродистые пленки обеспечивают большую и эффективную катодную поверхность [1].
Влияние химических компонентов, растворенных в воде, на скорость коррозии меди изучено нами с помощью статистического анализа [2]. Этот анализ показал, что скорость коррозии меди может увеличиваться с увеличением концентрации свободного диоксида углерода. В этом исследовании экспериментально изучалось влияние свободного диоксида углерода на коррозионное поведение меди.
Фрагменты сечений
Образцы меди, раскисленной фосфором (Cu>99,9 мас.%, P=0,026 мас.%, 15×15×1 мм 3 ) использовались для иммерсионных испытаний с измерениями электрохимической импедансной спектроскопии (ЭИС). Проводники в стеклянных трубках и медные образцы были залиты эпоксидной смолой для формирования медных электродов. Исследуемые поверхности медных электродов механически шлифовали наждачной бумагой зернистостью 600 и промывали дистиллированной водой. Имитация водопроводной воды (pH 7,7) была приготовлена из аналитической чистоты
. На рис. 2 показаны фотографии образцов меди после 48-часовых испытаний погружением и изменение pH во время испытаний погружением. Как показано на рис. 2 (а–в), площадь изменения цвета на поверхности образца увеличивалась с увеличением концентрации свободного углекислого газа. Значения рН не изменились в течение всего времени иммерсионных испытаний. Как показано на рис. 2(d–f), четкой разницы в коррозионном поведении образцов, погруженных в растворы, содержащие H 9 , не наблюдалось. 0022 2 SO 4 , HCl и HNO 3 .
0022 2 SO 4 , HCl и HNO 3 .
Скорость коррозии меди увеличивается с увеличением концентрации свободного диоксида углерода. Свободный углекислый газ непрерывно снабжает воду ионами H + , если в атмосфере присутствует газ CO 2 . Производство H + может помочь восстановить растворенный кислород, чтобы начать окисление меди. Это может быть причиной того, что свободный углекислый газ способствует окислению меди.
Авторы благодарят Японскую ассоциацию развития меди.
Каталожные номера (3)
- H.S. Кэмпбелл
Дж. Инст. Металлы
(1950)
Дополнительные ссылки доступны в полной текстовой версии этой статьи.
Анализ коррозионного разрушения полого медного змеевика, используемого во внутренней системе охлаждающей воды генератора, работающей на низкокислородном/нейтральном водно-химическом режиме
2022, Анализ технических отказов
В этом документе сообщается об анализе коррозионного разрушения полого медного змеевика, используемого в системе внутренней охлаждающей воды генератора (GICW), работающей на низкокислородной/нейтральной водной химии на атомной электростанции.
 Для характеристики морфологии поверхности медной катушки использовались оптический микроскоп, трехмерный профилировщик поверхности, СЭМ и трубчатый эндоскоп. XRD, XPS, EDS и TOF-SIMS использовались для определения химического состава продуктов коррозии. Результаты показывают, что медная катушка сильно проржавела и забита. Продукты коррозии в основном состоят из CuO, Cu(OH) 2 , Cu 2 O и CuCO 3 ·Cu(OH) 2 . Этот сбой связан с утечкой O 2 и утечкой CO 2 во время работы и остановки системы GICW. Затем их негативное влияние на систему выявляется в сочетании с термодинамическим анализом и полевыми данными. Низкокислородный/нейтральный химический состав воды требует строго стабильного состояния качества воды GICW, в то время как оно было заметно изменено утечками O 2 и CO 2 . Таким образом, пассивная пленка была дестабилизирована за счет фазового превращения продуктов коррозии и кислотной эрозии, что привело к высвобождению частиц соединений меди и последующему закупориванию системы.
Для характеристики морфологии поверхности медной катушки использовались оптический микроскоп, трехмерный профилировщик поверхности, СЭМ и трубчатый эндоскоп. XRD, XPS, EDS и TOF-SIMS использовались для определения химического состава продуктов коррозии. Результаты показывают, что медная катушка сильно проржавела и забита. Продукты коррозии в основном состоят из CuO, Cu(OH) 2 , Cu 2 O и CuCO 3 ·Cu(OH) 2 . Этот сбой связан с утечкой O 2 и утечкой CO 2 во время работы и остановки системы GICW. Затем их негативное влияние на систему выявляется в сочетании с термодинамическим анализом и полевыми данными. Низкокислородный/нейтральный химический состав воды требует строго стабильного состояния качества воды GICW, в то время как оно было заметно изменено утечками O 2 и CO 2 . Таким образом, пассивная пленка была дестабилизирована за счет фазового превращения продуктов коррозии и кислотной эрозии, что привело к высвобождению частиц соединений меди и последующему закупориванию системы. Кроме того, на основе этого анализа отказов делаются предложения по полевым операциям. Это тематическое исследование может служить предупреждением и руководством по безопасному управлению системой GICW.
Кроме того, на основе этого анализа отказов делаются предложения по полевым операциям. Это тематическое исследование может служить предупреждением и руководством по безопасному управлению системой GICW.Изготовление перфторированной полидофаминовой пленки, вдохновленной мидиями, на латунных подложках: супергидрофобное и антикоррозионное нанесение
2018, Progress in Organic Coatings
Вдохновленная адгезионными свойствами белка мидий, пленка перфторированного полидофамина ( f PDA) на поверхности латуни была получена путем спонтанной полимеризации мономера дофамина с последующей функционализацией 1H,1H, 2H,2H- перфтордекантиол (PFDT). Сканирующая электронная микроскопия (SEM), рентгеновская фотоэлектронная спектроскопия (XPS), инфракрасная спектроскопия с преобразованием Фурье (FTIR) и измерения краевого угла смачивания водой (WCA) выявили образование однородной, компактной и супергидрофобной пленки. Электрохимические испытания показали, что латунь, покрытая ф ПДА обладал низкой плотностью тока коррозии и высокой пленочной стойкостью.
 Модифицированный образец, погруженный в 3 мас.% водный раствор NaCl, хорошо сохранился. Результаты ясно показывают, что замечательная антикоррозионная способность является результатом синергетического/совместного действия супергидрофобности и повышенной адгезии пленки f PDA.
Модифицированный образец, погруженный в 3 мас.% водный раствор NaCl, хорошо сохранился. Результаты ясно показывают, что замечательная антикоррозионная способность является результатом синергетического/совместного действия супергидрофобности и повышенной адгезии пленки f PDA.Химический состав и морфология поверхности металла
2018, Справочник по технологии очистки кремниевых пластин
Металлизация является одним из важнейших этапов в производстве микроэлектроники, в котором металлы подвергаются различным методам обработки, таким как осаждение, полировка и очистка. Металлы могут нежелательно диффундировать в активные области устройства или подвергаться коррозии на различных этапах обработки, поэтому настоятельно рекомендуется пассивация этих металлических поверхностей. Выбор подходящего пассивирующего агента необходим, особенно во время процессов полировки и очистки, чтобы контролировать проблемы загрязнения, которые могут возникнуть на поверхности металла.
 Эта глава разделена на четыре основных раздела, посвященных четырем ключевым металлам, используемым в производстве полупроводников: алюминию, меди, вольфраму и кобальту. Поскольку процесс пассивации при полировке и очистке сильно зависит от морфологии поверхности, обсуждаются микроструктура и текстура напыленных металлов, полученных с помощью различных методов напыления. Затем представлен процесс пассивации с использованием мокрой химии и результирующая химия поверхности пассивированных поверхностей. Наконец, описываются различные проблемы загрязнения пассивированных металлов и процессы очистки, используемые для преодоления загрязнения.
Эта глава разделена на четыре основных раздела, посвященных четырем ключевым металлам, используемым в производстве полупроводников: алюминию, меди, вольфраму и кобальту. Поскольку процесс пассивации при полировке и очистке сильно зависит от морфологии поверхности, обсуждаются микроструктура и текстура напыленных металлов, полученных с помощью различных методов напыления. Затем представлен процесс пассивации с использованием мокрой химии и результирующая химия поверхности пассивированных поверхностей. Наконец, описываются различные проблемы загрязнения пассивированных металлов и процессы очистки, используемые для преодоления загрязнения.Эмпирическая модель истощения растворенного кислорода во время коррозии медных труб для питьевой воды
2010, Corrosion Science
Прогнозные модели, характеризующие эволюцию и взаимодействие ключевых параметров химического состава воды, необходимы для лучшего понимания процессов коррозии в трубах для питьевой воды. Мы провели эксперименты с новыми медными трубами при различных сочетаниях pH, растворенного кислорода (DO), температуры, хлора и растворенного неорганического углерода.
 Мы обнаружили, что потребление DO в течение 24 ч застоя не ограничивается диффузией, поэтому скорость потребления DO в объемной воде можно использовать для исследования процессов, происходящих на поверхности трубы. Мы предлагаем количественную зависимость скорости расхода РК от достаточно ограниченного набора физико-химических параметров.
Мы обнаружили, что потребление DO в течение 24 ч застоя не ограничивается диффузией, поэтому скорость потребления DO в объемной воде можно использовать для исследования процессов, происходящих на поверхности трубы. Мы предлагаем количественную зависимость скорости расхода РК от достаточно ограниченного набора физико-химических параметров.Химический состав и морфология поверхности
2008, Справочник по технологии очистки кремниевых пластин: второе издание
Исследовательская статья
Роль pH раствора и SDS в эволюции формы гексагонального диска PbS и нанокристаллов в форме звезды/цветка в водной среде
Physica E: Низкоразмерные системы и наноструктуры, том 56, 2014, стр. 386-392
Наночастицы (НЧ) PbS различных форм, включая цветы, звезды, сферы и была исследована умеренная температура 90 °C, а также влияние pH раствора и добавленного поверхностно-активного вещества SDS на морфологию продуктов.
 Было замечено, что в основной среде взаимодействие ионов ОН – и адсорбция ДСН через головную группу на энергетических кристаллографических гранях определяют эволюцию формы НЧ. Предполагается, что изначально зародышевые зародыши усеченного октаэдра с гранями {1 1 1} и {1 0 0} ответственны за преобразование формы в различные наноструктуры в процессе роста в различных условиях реакции. Продукты, полученные в различных реакциях, были охарактеризованы с помощью рентгеновской дифракции (XRD), сканирующей электронной микроскопии (SEM) и энергодисперсионной рентгеновской спектроскопии (EDX) для определения кристалличности, фазы, состава, размера и морфологии продуктов. Инфракрасный спектральный анализ с преобразованием Фурье (FTIR) использовали для наблюдения за адсорбцией SDS на поверхности НЧ. Спектральный анализ в УФ-видимой области был проведен для определения оптических свойств материалов PbS.
Было замечено, что в основной среде взаимодействие ионов ОН – и адсорбция ДСН через головную группу на энергетических кристаллографических гранях определяют эволюцию формы НЧ. Предполагается, что изначально зародышевые зародыши усеченного октаэдра с гранями {1 1 1} и {1 0 0} ответственны за преобразование формы в различные наноструктуры в процессе роста в различных условиях реакции. Продукты, полученные в различных реакциях, были охарактеризованы с помощью рентгеновской дифракции (XRD), сканирующей электронной микроскопии (SEM) и энергодисперсионной рентгеновской спектроскопии (EDX) для определения кристалличности, фазы, состава, размера и морфологии продуктов. Инфракрасный спектральный анализ с преобразованием Фурье (FTIR) использовали для наблюдения за адсорбцией SDS на поверхности НЧ. Спектральный анализ в УФ-видимой области был проведен для определения оптических свойств материалов PbS.Исследовательская статья
Оценка взаимодействия между фраксинеллоном и бычьим сывороточным альбумином методами оптической спектроскопии и молекулярного моделирования
Journal of Luminescence, Volume 137, 2013, pp.
 альбумин (БСА) исследовали с помощью флуоресцентной спектроскопии, поглощения в ультрафиолетовом и видимом (УФ-видимом) диапазоне, инфракрасной спектроскопии с преобразованием Фурье (FT-IR) и исследований стыковки белок-лиганд. Результаты показали, что тушение флуоресценции БСА фраксинеллоном является статическим процессом. Константа связывания K a при 298 К было рассчитано как 6,61×10 4 л моль -1 , и указано количество сайтов связывания n . Термодинамические параметры, изменение энтальпии (Δ H ) и изменение энтропии (Δ S ) при различных температурах составляли -66,22 кДж моль -1 и -129,77 Дж моль -1 К -1 соответственно. . Фраксинеллон был связан с БСА в участке I, а расстояние между фраксинеллоном и БСА составляло 2,31 нм, как рассчитано на основе теории Фёрстера о безызлучательном переносе энергии. Кроме того, полученные спектры УФ-видимой области, синхронной флуоресценции и ИК-Фурье показали, что микроокружение и вторичная структура БСА модифицировались в присутствии фраксинеллона.
альбумин (БСА) исследовали с помощью флуоресцентной спектроскопии, поглощения в ультрафиолетовом и видимом (УФ-видимом) диапазоне, инфракрасной спектроскопии с преобразованием Фурье (FT-IR) и исследований стыковки белок-лиганд. Результаты показали, что тушение флуоресценции БСА фраксинеллоном является статическим процессом. Константа связывания K a при 298 К было рассчитано как 6,61×10 4 л моль -1 , и указано количество сайтов связывания n . Термодинамические параметры, изменение энтальпии (Δ H ) и изменение энтропии (Δ S ) при различных температурах составляли -66,22 кДж моль -1 и -129,77 Дж моль -1 К -1 соответственно. . Фраксинеллон был связан с БСА в участке I, а расстояние между фраксинеллоном и БСА составляло 2,31 нм, как рассчитано на основе теории Фёрстера о безызлучательном переносе энергии. Кроме того, полученные спектры УФ-видимой области, синхронной флуоресценции и ИК-Фурье показали, что микроокружение и вторичная структура БСА модифицировались в присутствии фраксинеллона. Результаты молекулярного моделирования согласуются с проведенными исследованиями режима смещения и связывания.
Результаты молекулярного моделирования согласуются с проведенными исследованиями режима смещения и связывания.Научная статья
Коррозия углеродистой стали в концентрированном растворе LiNO
3 при высокой температуреCorrosion Science, Volume 74, 2013, pp. раствор при высокой температуре исследовали методом потери веса. Результаты показали, что повышение температуры и pH повысит скорость коррозии, а увеличение концентрации и добавление Li 2 CrO 4 уменьшит скорость коррозии. Коррозия в растворе LiNO 3 была общей коррозией, а продукты коррозии состояли из Fe 3 O 4 и Fe 2 O 3 . Компактный пассивный слой, состоящий из Cr 2 O 3 , Fe 3 O 4 и Fe 2 O 3 , наблюдался при добавлении Li 2 O 3 , и он мог эффективно подавлять 2 CrO 3 9002. коррозия. Коррозия углеродистой стали в LiNO 3 было значительно меньше, чем в растворе LiBr.

Исследовательская статья
Актуальность новых решений для мышления, принятия решений и действий. Пример Smart Grids
Экологическое моделирование, том 271, 2014 г., стр. 62-71
В статье представлена настоящая новинка в математическом моделировании, которая может иметь огромное значение для нашего мышления, принятия решений и действий. В то же время он хотел бы выразить явную «дань уважения» профессору Одуму, потому что исходная концепция уже изначально присутствует в его известных правилах эмерджентной алгебры.
Это новшество в математическом моделировании представлено так называемыми «Эмерджентными решениями», которые радикально отличаются от решений традиционных математических задач. Это связано с тем, что любое традиционное решение алгебраической или дифференциальной задачи всегда представляется формальным выражением, которое при повторном введении в исходную формулировку задачи сводит последнюю к совершенному тождеству.
Появляющиеся решения, наоборот, показывают порядковое информационное содержание, которое всегда намного выше, чем соответствующее содержание, относящееся к исходной постановке задачи.
 Появляющиеся решения фактически возникают из любой физической проблемы, если она моделируется в соответствии с принципом максимальной ординальности и, таким образом, понимается в порядковых терминах.
Появляющиеся решения фактически возникают из любой физической проблемы, если она моделируется в соответствии с принципом максимальной ординальности и, таким образом, понимается в порядковых терминах.Такое свойство, представляющее один из наиболее интересных аспектов принципа максимальной ординальности, предлагает нам принять генеративный способ мышления при разработке нового практического приложения. То же самое происходит и на уровне Воли, то есть на уровне Принятия Решений. Понятно, если мы действительно хотим воспользоваться теми «Эмерджентными выходами», которые возникают из-за физического поведения системы. Наконец, на уровне действия, если мы действительно заинтересованы в том, чтобы способствовать любому «появляющемуся поведению» системы, которое решительно способно улучшить наш дизайн. Например, чтобы получить максимальную внутреннюю стабильность системы, чтобы предотвратить любое возможное возмущение, которое может значительно изменить ее ожидаемое поведение.
Все эти аспекты будут проиллюстрированы на примере интеллектуальных сетей с особым упором на их крупномасштабную «внутреннюю» нестабильность и их признанную сильную уязвимость к «кибератакам».

Исследовательская статья
Высоковольтные вводы SPIDER: проектирование, разработка и первые экспериментальные испытания
Fusion Engineering and Design, Volume 123, 2017, pp. 362-365 NBI), каждый из которых ускоряет до 1 МВ пучок отрицательных ионов дейтерия силой 40 А, чтобы передать в плазму мощность около 33 МВт в течение одного часа в качестве дополнительного нагрева. Выполнение таких требований потребовало реализации полноразмерного прототипа источника отрицательных ионов (SPIDER — источник для производства ионов дейтерия, извлеченного из ВЧ-плазмы), а также полноразмерного прототипа всего инжектора ИТЭР на 1 МВ ( MITICA — Megavolt ITER Injector & Concept Advancement) на PRIMA, испытательном стенде для нейтральных пучков ITER, который сейчас строится в Consorzio RFX в Падуе, Италия.
Источник плазмы SPIDER, размещенный в сосуде из нержавеющей стали, который поддерживается в высоком вакууме, поляризован при 112 кВ (вытягивающее напряжение 12 кВ и ускоряющее напряжение 100 кВ), поэтому вакуумный сосуд должен быть оснащен тремя большими вводами из оксида алюминия, кольцо фасонные изоляторы (диаметром 820 мм), необходимые для подачи электрического, гидравлического газа и диагностического обслуживания к источнику плазмы.
 Эти изоляторы (вводы) относятся к наиболее важным элементам в сборке SPIDER, и они потребовали особых усилий при проектировании, изготовлении и испытаниях. В этом документе дается обзор конструкции, разработки и производства изолятора, а также представлены результаты приемочных испытаний высокого напряжения.
Эти изоляторы (вводы) относятся к наиболее важным элементам в сборке SPIDER, и они потребовали особых усилий при проектировании, изготовлении и испытаниях. В этом документе дается обзор конструкции, разработки и производства изолятора, а также представлены результаты приемочных испытаний высокого напряжения.Исследовательская статья
Исследование эффективности ингибитора коррозии в CO
2 коррозия углеродистой стали в присутствии окалины карбоната железаJournal of Natural Gas Science and Engineering, Volume 61, 2019, pp. 197- 205
В данной работе исследована эффективность ингибирования коррозии углеродистой стали СО 2 ингибиторами коррозии производными имидазолина в присутствии окалины карбоната железа и сероводорода. Использование ингибиторов коррозии является одним из наиболее распространенных методов контроля выбросов CO 9 .0022 2 Коррозия углеродистой стали в нефтяной и газовой промышленности. Одно из производных имидазолина использовалось в качестве ингибитора коррозии, защищающего поверхность по механизму пленкообразования.
 Материалом исследования была углеродистая сталь API 5L X65, вырезанная из трубопровода для транспортировки влажного газа. Внутренняя поверхность трубы была покрыта карбонатом железа как продуктом коррозии. Для исследования эффективности ингибитора была проведена поляризационная спектроскопия Тафеля и спектроскопия электрохимического импеданса в CO 9 .0022 2 – насыщенный 3,5 мас.% раствор хлорида натрия. Согласно результатам, наличие пленки карбоната железа снижает эффективность ингибирования. Кроме того, было обнаружено, что в присутствии газа H 2 S эффективность ингибирования снижалась из-за уменьшения адсорбции ингибитора на поверхности.
Материалом исследования была углеродистая сталь API 5L X65, вырезанная из трубопровода для транспортировки влажного газа. Внутренняя поверхность трубы была покрыта карбонатом железа как продуктом коррозии. Для исследования эффективности ингибитора была проведена поляризационная спектроскопия Тафеля и спектроскопия электрохимического импеданса в CO 9 .0022 2 – насыщенный 3,5 мас.% раствор хлорида натрия. Согласно результатам, наличие пленки карбоната железа снижает эффективность ингибирования. Кроме того, было обнаружено, что в присутствии газа H 2 S эффективность ингибирования снижалась из-за уменьшения адсорбции ингибитора на поверхности.
- 1
Текущий адрес: Fujisash Co., Ltd, 135 Накамаруко Накахара-ку, Кавасаки-ши 211-0012, Япония.
Copyright © 2003 Elsevier Science B.V. Все права защищены.
Вода, координированная на катализаторах на основе Cu(I), является источником кислорода при восстановлении CO2 до CO
Вода, координируемая на катализаторах на основе Cu(I), является источником кислорода при восстановлении CO 2 восстановление до CO
Скачать PDF
Скачать PDF
- Артикул
- Открытый доступ
- Опубликовано:
- Yajun Zheng 1 na1 ,
- Hedan Yao 1 na1 ,
- Ruinan Di 2 na1 ,
- Zhicheng Xiang 1 ,
- Qiang Wang ORCID: orcid.org/0000-0001-7309-9580 2 ,
- Фанфан Лу 1 ,
- Ю Ли 1 ,
- Гуансин Ян ORCID: orcid.org/0000-0002-9416-4780 3 ,
- Цян Ма ORCID: orcid.org/0000-0002-7887-2031 4 и
- …
- Чжипин Чжан ORCID: orcid.org/0000-0002-2733-6976 1
Связь с природой том 13 , Номер статьи: 2577 (2022) Процитировать эту статью
3914 доступов
2 Альтметрика
Сведения о показателях
Субъекты
- Электрокатализ
- Масс-спектрометрия
Abstract
Каталитическое восстановление CO 2 с помощью катализаторов на основе Cu может производить различные продукты на основе углерода, такие как критический промежуточный CO, однако остаются серьезные проблемы, связанные с прояснением основных механизмов. Здесь мы разрабатываем модифицированный трехэтапный квадрупольный масс-спектрометр для мониторинга восстановления CO 2 на CO в газовой фазе онлайн. Наши экспериментальные наблюдения показывают, что координированный H 2 O на катализаторах на основе Cu(I) способствует адсорбции CO 2 и восстановлению до CO, и результирующая эффективность на два порядка выше, чем без H 2 O. Исследования изотопной маркировки предоставляют убедительные доказательства того, что атом O в произведенном CO происходит от координированного H 2 O на катализаторах, а не от самого CO 2 . Объединив экспериментальные наблюдения и вычислительные расчеты с теорией функционала плотности, мы предлагаем подробный механизм реакции CO 9Восстановление 0022 2 до CO на катализаторах на основе Cu(I) с координированным H 2 O. Это исследование предлагает эффективный метод выявления жизненно важной роли H 2 O в промотировании металлических катализаторов до восстановления CO 2 .
Здесь мы разрабатываем модифицированный трехэтапный квадрупольный масс-спектрометр для мониторинга восстановления CO 2 на CO в газовой фазе онлайн. Наши экспериментальные наблюдения показывают, что координированный H 2 O на катализаторах на основе Cu(I) способствует адсорбции CO 2 и восстановлению до CO, и результирующая эффективность на два порядка выше, чем без H 2 O. Исследования изотопной маркировки предоставляют убедительные доказательства того, что атом O в произведенном CO происходит от координированного H 2 O на катализаторах, а не от самого CO 2 . Объединив экспериментальные наблюдения и вычислительные расчеты с теорией функционала плотности, мы предлагаем подробный механизм реакции CO 9Восстановление 0022 2 до CO на катализаторах на основе Cu(I) с координированным H 2 O. Это исследование предлагает эффективный метод выявления жизненно важной роли H 2 O в промотировании металлических катализаторов до восстановления CO 2 .
Введение
Каталитическое сокращение выбросов CO 2 в продукты на основе углерода с высокой добавленной стоимостью является многообещающей стратегией для удовлетворения текущих потребностей в энергии и сокращения выбросов парниковых газов 1,2,3,4,5 . За последние несколько лет были предприняты огромные усилия для изучения реакции восстановления CO 2 (CO 2 RR) и нескольких продуктов, включая CH 4 6 , CO 7 , CH 3 OH. 8 , HCOOH , HCHO 10 , C 2 H 4 11 , C 2 H 6 12 , C 2 H 5 3 12121, C 2 H 5 3 21, C 2 H 5 3 3 , C 2 H 5 3 21, C 2 H 5 . и H 2 C 2 O 4 14 , были получены из CO 2 восстановление с помощью фото-, электро- или термической активации 3,4,5,15,16,17,18 . Для повышения селективности и эффективности преобразования CO 2 RR основное внимание было уделено изучению новых катализаторов 2,3,19,20 . Несмотря на прогресс, многие детали механизмов СО 2 RR на поверхности катализаторов остаются неясными. Методы, используемые для исследования механизмов RR CO 2 , включают спектроскопию комбинационного рассеяния 21 , рентгеновская абсорбционная спектроскопия 22 , рентгеновская фотоэлектронная спектроскопия 23 , электронная микроскопия 24 и расчеты с использованием теории функционала плотности (DFT) 25,26 . Однако прямое наблюдение высокореакционноспособных промежуточных соединений по-прежнему остается сложной задачей.
Для повышения селективности и эффективности преобразования CO 2 RR основное внимание было уделено изучению новых катализаторов 2,3,19,20 . Несмотря на прогресс, многие детали механизмов СО 2 RR на поверхности катализаторов остаются неясными. Методы, используемые для исследования механизмов RR CO 2 , включают спектроскопию комбинационного рассеяния 21 , рентгеновская абсорбционная спектроскопия 22 , рентгеновская фотоэлектронная спектроскопия 23 , электронная микроскопия 24 и расчеты с использованием теории функционала плотности (DFT) 25,26 . Однако прямое наблюдение высокореакционноспособных промежуточных соединений по-прежнему остается сложной задачей.
Масс-спектрометрия (МС) — мощный инструмент химического анализа, который также использовался для изучения механизмов различных химических реакций 27,28,29,30,31 . Тем не менее, было немного сообщений об использовании МС для изучения CO 2 Механизмы RR в работе 32 . Это можно объяснить следующими препятствиями: (i) CO 2 и его образующиеся продукты (например, CO, CH 4 и CH 3 OH) являются нейтральными молекулами и редко наблюдаются в масс-спектрах без добавления зарядов через ионизация; (ii) время жизни реактивных промежуточных продуктов обычно составляет менее миллисекунд, что затрудняет их захват с помощью автономного МС. Для решения этих проблем в этом исследовании предлагается стратегия изучения CO 2 Механизмы RR за счет использования особенностей трехступенчатого квадрупольного (TSQ) масс-спектрометра, в котором различные стадии квадруполей в TSQ используются для разделения ионов металлов и соответствующих катализаторов, полученных в результате ионизации наноэлектрораспылением (nanoESI) 33 (первый стадия), блок реакции металлических катализаторов и СО 2 (вторая стадия) и пропускание образующихся ионов (третья стадия) (рис. 1). На втором этапе CO 2 и его продукты могут заряжаться благоприятно за счет взаимодействия с ионами металлов и образования комплексов металлов.
Это можно объяснить следующими препятствиями: (i) CO 2 и его образующиеся продукты (например, CO, CH 4 и CH 3 OH) являются нейтральными молекулами и редко наблюдаются в масс-спектрах без добавления зарядов через ионизация; (ii) время жизни реактивных промежуточных продуктов обычно составляет менее миллисекунд, что затрудняет их захват с помощью автономного МС. Для решения этих проблем в этом исследовании предлагается стратегия изучения CO 2 Механизмы RR за счет использования особенностей трехступенчатого квадрупольного (TSQ) масс-спектрометра, в котором различные стадии квадруполей в TSQ используются для разделения ионов металлов и соответствующих катализаторов, полученных в результате ионизации наноэлектрораспылением (nanoESI) 33 (первый стадия), блок реакции металлических катализаторов и СО 2 (вторая стадия) и пропускание образующихся ионов (третья стадия) (рис. 1). На втором этапе CO 2 и его продукты могут заряжаться благоприятно за счет взаимодействия с ионами металлов и образования комплексов металлов. Что еще более важно, CO 2 Процессы RR могут выполняться одновременно с онлайн-детектированием. Таким образом, пути реакции CO 2 RR могут быть хорошо идентифицированы.
Что еще более важно, CO 2 Процессы RR могут выполняться одновременно с онлайн-детектированием. Таким образом, пути реакции CO 2 RR могут быть хорошо идентифицированы.
(на вставках в верхнем левом углу указаны различные пути образования СО из СО 2 , где * означает катализатор).
Изображение в полный размер
Чтобы продемонстрировать подтверждение концепции, в этом исследовании исследуется реакция восстановления CO 2 в CO с использованием меди (Cu) в качестве катализатора. Cu является единственным известным металлическим катализатором, образующим углеводороды через CO 2 RR 5,34,35,36,37,38,39 , но низкая селективность и эффективность реакции для продуктов с добавленной стоимостью значительно ограничивают его коммерческое применение 6 ,40 . Несмотря на то, что было предпринято много усилий, чтобы понять каталитическую активность Cu в CO 2 RR, доступные методы, которые могут прояснить лежащие в основе механизмы реакции, остаются ограниченными 41 . В CO 2 RR СО широко определяется как важный продукт или первичный промежуточный продукт реакции образования углеводородов 15,16,17,42,43 . Следовательно, понимание реакции восстановления CO 2 до CO на катализаторах на основе Cu необходимо для повышения эффективности преобразования.
В CO 2 RR СО широко определяется как важный продукт или первичный промежуточный продукт реакции образования углеводородов 15,16,17,42,43 . Следовательно, понимание реакции восстановления CO 2 до CO на катализаторах на основе Cu необходимо для повышения эффективности преобразования.
Согласно общему мнению, существует три пути восстановления CO 2 до CO: (i) CO 2 + H 2 → CO + H 2 O 1,17,44 , (II) *CO 2 + 2E – + H + → CO + OH – 45 и (III) *CO 2 + 2e − + 2H + → CO + H 2 O 43,46,47,48,49,50 (рис. 1). Для всех трех путей атом O в генерируемом CO происходит из CO 2 . В отличие от описанных выше путей, здесь мы впервые обнаружили, что источником атома O в CO является H 2 O координируется на катализаторах на основе переходных металлов (например, Cu, Ag и Pd), а не на CO 2 . H 2 O широко распространен в природе и, как было показано, играет жизненно важную роль во многих реакциях, таких как окисление спирта до альдегида 51 , окисление CH 4 до CH 3 OH 52,53 и CO 2 восстановление до CH 4 , CH 3 OH и HCOOH 54 . Однако роль Н 2 О в восстановлении СО 2 до СО неоднозначна. Чтобы выяснить роль H 2 O в CO 2 RR, мы исследовали поведение Cu + и [Cu(H 2 O)] + и обнаружили, что координированный H 2 O в [Cu(H 2 O)] + не только способствует адсорбции CO 2 на Cu + , но также способствует восстановлению CO 2 до CO. атом в CO был из координированного H 2 O на Cu + . Путем объединения экспериментальных результатов и вычислительных расчетов с DFT был предложен подробный механизм реакции восстановления CO 2 до CO на катализаторе [Cu(H 2 O)] + .
H 2 O широко распространен в природе и, как было показано, играет жизненно важную роль во многих реакциях, таких как окисление спирта до альдегида 51 , окисление CH 4 до CH 3 OH 52,53 и CO 2 восстановление до CH 4 , CH 3 OH и HCOOH 54 . Однако роль Н 2 О в восстановлении СО 2 до СО неоднозначна. Чтобы выяснить роль H 2 O в CO 2 RR, мы исследовали поведение Cu + и [Cu(H 2 O)] + и обнаружили, что координированный H 2 O в [Cu(H 2 O)] + не только способствует адсорбции CO 2 на Cu + , но также способствует восстановлению CO 2 до CO. атом в CO был из координированного H 2 O на Cu + . Путем объединения экспериментальных результатов и вычислительных расчетов с DFT был предложен подробный механизм реакции восстановления CO 2 до CO на катализаторе [Cu(H 2 O)] + . Данные, представленные в этой работе, позволили нам выяснить роль H 2 O в CO 2 RR и предложили новые идеи для разработки эффективных систем, повышающих селективность и эффективность преобразования CO 2 в CO и другие углеродсодержащие вещества. продукты на основе.
Данные, представленные в этой работе, позволили нам выяснить роль H 2 O в CO 2 RR и предложили новые идеи для разработки эффективных систем, повышающих селективность и эффективность преобразования CO 2 в CO и другие углеродсодержащие вещества. продукты на основе.
Результаты и обсуждение
Реакционный аппарат и генерация соединений Cu(I)
Чтобы выявить основную роль H 2 O в восстановлении CO 2 до CO посредством катализа на основе меди, мы использовали модифицированный Аппарат TSQ для онлайн наблюдения за CO 2 RR и обнаружения промежуточных продуктов и продуктов реакции. Как показано на рис. 1, nanoESI использовался в качестве источника ионизации для генерации ионов на основе меди. Когда ионы катализатора вводили в аппарат TSQ, желаемые соединения Cu выделяли из Q1, а затем переносили в Q2. В реакционном блоке Q2 ионы на основе Cu взаимодействовали с CO 2 при приложенном напряжении 5 В и образовался СО. Из-за низкой эффективности реакции при низких температурах (см. к реакции с катализатором Cu в газовой фазе. После завершения реакции восстановления полученные продукты переносили непосредственно в Q3 с последующим онлайн-детектированием.
Из-за низкой эффективности реакции при низких температурах (см. к реакции с катализатором Cu в газовой фазе. После завершения реакции восстановления полученные продукты переносили непосредственно в Q3 с последующим онлайн-детектированием.
Многие предыдущие исследования 8,26,55,56,57,58,59 продемонстрировали, что из различных степеней окисления соединения Cu(I) являются одним из наиболее важных катализаторов в CO 2 руб. Учитывая, что в текущем исследовании изучались различные комплексы на основе меди при восстановлении CO 2 , наноESI использовался для создания разновидностей Cu(I), а не индуктивно-связанной плазмы (ICP) 60,61 , которая производит только Cu(I ). Было обнаружено, что в процессе наноESI типы частиц Cu и растворителя оказывают заметное влияние на результирующие масс-спектры. При растворении CuX (X = Cl, Br или I) в ацетонитриле в масс-спектрах появлялись сопоставимые и интенсивные пики ионов на основе Cu (например, 63 Cu + , 65 Cu + , [ 63 Cu(H 2 O)] + , and [ 65 Cu(H 2 O)] + ), и появилось несколько видов, отличных от Cu (дополнительные рисунки 1–3). Таким образом, CuCl использовался для генерации различных ионов на основе Cu(I).
Таким образом, CuCl использовался для генерации различных ионов на основе Cu(I).
Влияние H
2 O на восстановление CO 2 до COПриведенная выше установка МС позволила нам исследовать восстановление CO 2 до CO in situ. Как 63 Cu + или 65 Cu + ионы были выделены для взаимодействия с CO 2 , явных результирующих частиц не наблюдалось, и только Cu + и [Cu(H 2 ) ] + появлялись в масс-спектрах (рис. 2а, б). Примечательно, что при введении в реакционную установку вместе с СО 2 , а не только продукт реакции CO появляется в виде [ 63 Cu(CO)] + и [ 65 Cu(CO)] + , а также реагент CO 2 в виде комплексов [ 63 Cu(CO
2 3 ) 9 ] + и [ 65 Cu(CO 2 )] + , в дополнение к [ 63 Cu(H 2 O)] + 9020 Cu(H 2 O)] + 9020 2 0 , [ 2 0 , [ O)] + и их осколочные ионы 63 Cu + и 65 Cu + (рис. 2в, г). Эти результаты показали, что в отличие от голого Cu + , координированный H 2 O в [Cu(H 2 O)] + играет жизненно важную роль во взаимодействии с CO 2 , что обеспечивает как адсорбцию CO 2 , так и восстановление СО 2 до СО на катализаторе Cu(I). Мы также обнаружили, что координированный H 2 O способствует переносу ионов других металлов (например, [Ag(H 2 O)] + и [Pd(H 2 O)] + ). из CO 2 RR (дополнительные рисунки 4 и 5), показывая, что H 2 Молекулы O на металлических катализаторах были активными центрами для облегчения эффективного восстановления CO 2 до CO. Эффект H 2 O также может быть отражен реакцией обратной конверсии водяного газа (WGSR) с использованием Cu /ZnO/Al 2 O 3 в качестве катализатора (дополнительный рисунок 6a–c) и инфракрасная спектроскопия диффузного отражения с преобразованием Фурье in situ (DRIFTS in situ) с использованием Cu/γ-Al 2 O 3 и Pt /γ-Al 2 O 3 в качестве катализаторов (дополнительный рисунок 7).
2в, г). Эти результаты показали, что в отличие от голого Cu + , координированный H 2 O в [Cu(H 2 O)] + играет жизненно важную роль во взаимодействии с CO 2 , что обеспечивает как адсорбцию CO 2 , так и восстановление СО 2 до СО на катализаторе Cu(I). Мы также обнаружили, что координированный H 2 O способствует переносу ионов других металлов (например, [Ag(H 2 O)] + и [Pd(H 2 O)] + ). из CO 2 RR (дополнительные рисунки 4 и 5), показывая, что H 2 Молекулы O на металлических катализаторах были активными центрами для облегчения эффективного восстановления CO 2 до CO. Эффект H 2 O также может быть отражен реакцией обратной конверсии водяного газа (WGSR) с использованием Cu /ZnO/Al 2 O 3 в качестве катализатора (дополнительный рисунок 6a–c) и инфракрасная спектроскопия диффузного отражения с преобразованием Фурье in situ (DRIFTS in situ) с использованием Cu/γ-Al 2 O 3 и Pt /γ-Al 2 O 3 в качестве катализаторов (дополнительный рисунок 7). Это намекнуло на то, что дозировка подходящего количества H 2 O может способствовать гетерогенной термической каталитической конверсии CO 2 в CO в реальных условиях.
Это намекнуло на то, что дозировка подходящего количества H 2 O может способствовать гетерогенной термической каталитической конверсии CO 2 в CO в реальных условиях.
а 63 Медь + б 65 Медь + . c [ 63 Cu(H 2 O)] + . d [ 65 Cu(H 2 O)] + (температура газового контура: 280 или С; давление реакции: 1,5 мТорр).
Изображение полного размера
Для количественного описания роли координированного H 2 O на металлических поверхностях в адсорбции CO 2 2 и восстановлении до CO мы использовали катализаторы на основе Cu в качестве примера. На рис. 3а и дополнительном рис. 8а показано влияние давления реакционного газа на адсорбцию CO 2 на Cu + . Характеристики адсорбции исследовали по абсолютной интенсивности пиков генерируемого [Cu(CO 2 )] + в масс-спектрометрическом анализе. При использовании чистого Cu + адсорбционная способность CO 2 на катализаторе Cu + постепенно увеличивалась с увеличением давления реакционного газа от 0 до 4 мТорр. Однако в присутствии [Cu(H 2 O)] + адсорбция СО 2 на Cu + увеличивалась с увеличением давления реакционного газа и достигала максимального значения в диапазоне 1,5 – 2,5 mTorr, а затем уменьшалась. Что еще более интересно, при наличии [ 63 Cu(H 2 O)] + , интенсивность пика [ 63 Cu(CO 2 )] + была в 48,6 раза выше, чем у 2 1 + 20 Cu 20 613 в оптимальных для них условиях. Это показало, что после того, как H 2 O был координирован с Cu + , CO 2 был более склонен взаимодействовать с [ 63 Cu(H 2 O)] + с образованием [ 213 Cu (CO 2 )] + по сравнению с чистым Cu + .
Характеристики адсорбции исследовали по абсолютной интенсивности пиков генерируемого [Cu(CO 2 )] + в масс-спектрометрическом анализе. При использовании чистого Cu + адсорбционная способность CO 2 на катализаторе Cu + постепенно увеличивалась с увеличением давления реакционного газа от 0 до 4 мТорр. Однако в присутствии [Cu(H 2 O)] + адсорбция СО 2 на Cu + увеличивалась с увеличением давления реакционного газа и достигала максимального значения в диапазоне 1,5 – 2,5 mTorr, а затем уменьшалась. Что еще более интересно, при наличии [ 63 Cu(H 2 O)] + , интенсивность пика [ 63 Cu(CO 2 )] + была в 48,6 раза выше, чем у 2 1 + 20 Cu 20 613 в оптимальных для них условиях. Это показало, что после того, как H 2 O был координирован с Cu + , CO 2 был более склонен взаимодействовать с [ 63 Cu(H 2 O)] + с образованием [ 213 Cu (CO 2 )] + по сравнению с чистым Cu + . Помимо CO 2 , мы также обнаружили, что, в отличие от Cu + , [Cu(H 2 O)] + , вероятно, образует комплексы на основе Cu с другими молекулами, такими как метанол (дополнительный рисунок 9). ), этанол (дополнительный рисунок 10), ацетонитрил (дополнительный рисунок 11), бензол (дополнительный рисунок 12), толуол (дополнительный рисунок 13) и дихлорметан (дополнительный рисунок 14). Такой факт свидетельствует о том, что координированный H 2 O в структуре [Cu(H 2 O)] + представляет собой уникальный активный центр для адсорбции различных молекул. Насколько нам известно, это можно предположить по следующим причинам. Поскольку H 2 O был связан с Cu + , полученный [Cu(H 2 O)] + более вероятно имел тенденцию к образованию водородной связи 62,63,64,65,66 или OH- π-взаимодействий 67,68,69 с изученными молекулами, чем голые Cu + .
Помимо CO 2 , мы также обнаружили, что, в отличие от Cu + , [Cu(H 2 O)] + , вероятно, образует комплексы на основе Cu с другими молекулами, такими как метанол (дополнительный рисунок 9). ), этанол (дополнительный рисунок 10), ацетонитрил (дополнительный рисунок 11), бензол (дополнительный рисунок 12), толуол (дополнительный рисунок 13) и дихлорметан (дополнительный рисунок 14). Такой факт свидетельствует о том, что координированный H 2 O в структуре [Cu(H 2 O)] + представляет собой уникальный активный центр для адсорбции различных молекул. Насколько нам известно, это можно предположить по следующим причинам. Поскольку H 2 O был связан с Cu + , полученный [Cu(H 2 O)] + более вероятно имел тенденцию к образованию водородной связи 62,63,64,65,66 или OH- π-взаимодействий 67,68,69 с изученными молекулами, чем голые Cu + . После дальнейших структурных перестроек хорошо образуются комплексы на основе Cu(I). Несмотря на это, необходимо детально изучить причины.
После дальнейших структурных перестроек хорошо образуются комплексы на основе Cu(I). Несмотря на это, необходимо детально изучить причины.
Влияние давления реакции на ( a ) адсорбцию CO 2 на 63 Cu + и ( b ) образование CO путем восстановления CO 2 192 92 в присутствии либо 602 900 + или [ 63 Cu(H 2 O)] + катализаторы (температура газового контура: 280 или С). Влияние температуры газового контура на ( c ) адсорбцию CO 2 на Cu + и ( d ) образование CO за счет восстановления CO 2 в присутствии 63 Cu + или [ 63 Cu(H 2 O)] + катализаторы (реакционное давление: 1,5 мТорр).
Изображение полного размера
Хорошо известно, что адсорбция на поверхности катализатора является очень важным шагом для восстановления CO 2 и более благоприятного для CO 2 адсорбция может способствовать более эффективному восстановлению до CO 15 . Для оценки восстановительной способности СО 2 до СО в присутствии Cu + и [Cu(H 2 O)] + мы сравнили разницу в количестве образовавшегося [Cu(CO)] + при различных давлениях газа (рис. 3b и дополнительный рис. 8b). Для чистого Cu + пиковая интенсивность [ 63 Cu(CO)] + резко возрастала при 0 – 0,5 мТорр, с последующим постепенным увеличением при 1 – 4 мТорр. Иная картина наблюдалась для [Cu(H 2 O)] + , где пиковая интенсивность сначала увеличивалась до максимального значения при 1,5 мТорр, а затем уменьшалась. При сравнении обеих систем с Cu + и [Cu(H 2 O)] + было примечательно, что [Cu(CO)] + образовывался более благоприятно для [Cu(H 2 O) ] + . Подобно количеству адсорбированного СО 2 , количество СО, образующегося в присутствии [ 63 Cu(H 2 O)] + , было в 84,7 раза выше, чем в присутствии 63 Cu + в оптимальных условиях. Эти результаты показали, что координированный H 2 O в [ 63 Cu(H 2 O)] + не только значительно облегчает адсорбцию CO 2 на Cu + , но также значительно способствует образованию CO.
Подобно количеству адсорбированного СО 2 , количество СО, образующегося в присутствии [ 63 Cu(H 2 O)] + , было в 84,7 раза выше, чем в присутствии 63 Cu + в оптимальных условиях. Эти результаты показали, что координированный H 2 O в [ 63 Cu(H 2 O)] + не только значительно облегчает адсорбцию CO 2 на Cu + , но также значительно способствует образованию CO.
Аналогичный процесс был также проведен для сравнения адсорбции CO 2 и образования CO при разных температурах, которые контролировались путем изменения температуры нагревательной ленты вокруг газового контура (рис. 1). При повышении температуры от комнатной (20 °C) до 350 °C CO 2 адсорбция с использованием 63 Cu + продемонстрировала постепенный рост. Однако для системы с использованием [ 63 Cu(H 2 O)] + наблюдалась иная картина, в которой наблюдалась первоначальная устойчивая тенденция роста от комнатной температуры до 280 °C с последующим небольшим снижением один в диапазоне 280–350 ° C (рис. 3c и дополнительный рис. 8c). В оптимальном интервале температур величина адсорбции СО 2 в присутствии [ 63 Cu(H 2 O)] + более чем на два порядка (в 158,7 раза) выше, чем 63 Cu + . Для образования СО обе каталитические системы 63 Cu + и [ 63 Cu(H 2 O)] + продемонстрировали сопоставимую картину, в которой образование СО сначала увеличивалось и достигало максимума. значение при 280 ° C, а затем уменьшилось (рис. 3d и дополнительный рис. 8d). Путем сравнения обеих систем было установлено, что использование [ 63 Cu(H 2 O)] + привело к образованию CO более чем на два порядка (в 160,9 раза), чем при использовании 63 Cu + . Таким образом, мы можем с уверенностью заключить, что координированный H 2 O в [ 63 Cu(H 2 O)] + был определяющим фактором в адсорбции CO 2 и генерации CO.
3c и дополнительный рис. 8c). В оптимальном интервале температур величина адсорбции СО 2 в присутствии [ 63 Cu(H 2 O)] + более чем на два порядка (в 158,7 раза) выше, чем 63 Cu + . Для образования СО обе каталитические системы 63 Cu + и [ 63 Cu(H 2 O)] + продемонстрировали сопоставимую картину, в которой образование СО сначала увеличивалось и достигало максимума. значение при 280 ° C, а затем уменьшилось (рис. 3d и дополнительный рис. 8d). Путем сравнения обеих систем было установлено, что использование [ 63 Cu(H 2 O)] + привело к образованию CO более чем на два порядка (в 160,9 раза), чем при использовании 63 Cu + . Таким образом, мы можем с уверенностью заключить, что координированный H 2 O в [ 63 Cu(H 2 O)] + был определяющим фактором в адсорбции CO 2 и генерации CO.
Из вышеизложенного видно, что максимальная адсорбционная способность CO 2 и максимальная скорость образования CO наблюдаются, когда [Cu(H 2 O)] + использовали в качестве катализатора во всем исследованном диапазоне температур и давлений (рис. 3). Это явление, предположительно, связано с нестабильностью [Cu(H 2 O)] + при повышении давления и температуры реакции. В качестве примера повышения давления реакции содержание CO 2 в Q2 масс-спектрометра (рис. 1) неуклонно увеличивалось и, следовательно, высокие выходы [Cu(CO 2 )] + и [Cu( CO)] + , тогда как в диапазоне 2 – 4 мТорр наблюдалась обратная тенденция (рис. 3а, б). Как упоминалось выше, [Cu(H 2 O)] + был более благоприятен для образования [Cu(CO 2 )] + и [Cu(CO)] + , чем Cu + . Однако генерируемое количество [Cu(H 2 O)] + продемонстрировало тенденцию к уменьшению с увеличением давления реакции с 2 до 4 мТорр (дополнительный рисунок 15a). Меньшее количество [Cu(H 2 O)] + приведет к снижению эффективности генерации до [Cu(CO 2 )] + и [Cu(CO)] + . В качестве компромисса между реакционным давлением и количеством [Cu(H 2 O)] + 1,5 мТорр обеспечивает оптимальную производительность. Что касается температуры, то наблюдалась та же закономерность, что и для давления реакции (рис. 3c, d), и 280 °C обеспечивали наивысшую эффективность генерации как [Cu(CO 2 )] + , так и [Cu(CO )] + . Этот случай может быть связан с нарушением стабильности [Cu(H 2 O)] + (дополнительный рисунок 15b) и термодинамической реакционной активности между CO 2 и [Cu(H 2 O)] + при повышении температуры.
Меньшее количество [Cu(H 2 O)] + приведет к снижению эффективности генерации до [Cu(CO 2 )] + и [Cu(CO)] + . В качестве компромисса между реакционным давлением и количеством [Cu(H 2 O)] + 1,5 мТорр обеспечивает оптимальную производительность. Что касается температуры, то наблюдалась та же закономерность, что и для давления реакции (рис. 3c, d), и 280 °C обеспечивали наивысшую эффективность генерации как [Cu(CO 2 )] + , так и [Cu(CO )] + . Этот случай может быть связан с нарушением стабильности [Cu(H 2 O)] + (дополнительный рисунок 15b) и термодинамической реакционной активности между CO 2 и [Cu(H 2 O)] + при повышении температуры.
Происхождение атома o в генерируемом CO
Эксперименты по маркировке изотопа (H 2 16 O, H 2 18 O, C 16 O 2 и C 18 O. 2 ) позволили сделать вывод, что происхождение атома O в генерируемом CO происходит от координированного H 2 O, а не от самого CO 2 . В предыдущих исследованиях 1,17,34,43,44,45,46,47,48,49,50 , были предложены различные механистические сценарии для выяснения пути восстановления CO 2 до CO, и образование CO было условно внесено к потере атома O в CO 2 . Однако до сих пор не было подтверждено никаких прямых экспериментальных доказательств, полученных с помощью изотопной маркировки. Было продемонстрировано, что МС является очень мощным инструментом, который дает возможность определить происхождение атома O в генерируемом CO из CO 9.0022 2 .
2 ) позволили сделать вывод, что происхождение атома O в генерируемом CO происходит от координированного H 2 O, а не от самого CO 2 . В предыдущих исследованиях 1,17,34,43,44,45,46,47,48,49,50 , были предложены различные механистические сценарии для выяснения пути восстановления CO 2 до CO, и образование CO было условно внесено к потере атома O в CO 2 . Однако до сих пор не было подтверждено никаких прямых экспериментальных доказательств, полученных с помощью изотопной маркировки. Было продемонстрировано, что МС является очень мощным инструментом, который дает возможность определить происхождение атома O в генерируемом CO из CO 9.0022 2 .
Как и ожидалось, мониторинг реакции между [ 63 Cu(H 2 16 O)] + и C 16 O 2 привел к наблюдению [ 6 30 9020 Cu 16 О)] + (рис. 4а). Неспособность выделить [ 63 Cu(H 2 18 O)] + путем растворения CuCl или других химических веществ на основе Cu в смеси ацетонитрила и H 2 18 O означает, что невозможно было зондировать продукты реакции в присутствии [ 63 Cu(H 2 18 O)] + и C 16 O 2 . Этот случай может быть связан с тем, что в воздухе много H 2 16 O, а H 2 18 O образуется [ 63 Cu(H 2 18 O 18 O )] + будет быстро заменен на H 2 16 O в шлейфе наноЭСИ или в процессе переноса в Q1 масс-спектрометра (рис. 1). В результате недостаточно [ 63 Cu(H 2 18 O)] + ионы могли генерироваться и не благоприятствовали обнаружению МС. Чтобы решить эту проблему, [ 63 Cu(H 2 16 O)] + был сначала выделен в первом квартале, а H 2 16 O или H 2 9023 90 впрыскивается в газовый контур СО 2 (рис. 1). После взаимодействия реагентов в реакционной зоне Q2 анализировали полученные продукты. Как Н 2 16 O (рис. 4б), масс-спектр аналогичен только [ 63 Cu(H 2 16 O)] + и C 22 O 2 (рис.
Этот случай может быть связан с тем, что в воздухе много H 2 16 O, а H 2 18 O образуется [ 63 Cu(H 2 18 O 18 O )] + будет быстро заменен на H 2 16 O в шлейфе наноЭСИ или в процессе переноса в Q1 масс-спектрометра (рис. 1). В результате недостаточно [ 63 Cu(H 2 18 O)] + ионы могли генерироваться и не благоприятствовали обнаружению МС. Чтобы решить эту проблему, [ 63 Cu(H 2 16 O)] + был сначала выделен в первом квартале, а H 2 16 O или H 2 9023 90 впрыскивается в газовый контур СО 2 (рис. 1). После взаимодействия реагентов в реакционной зоне Q2 анализировали полученные продукты. Как Н 2 16 O (рис. 4б), масс-спектр аналогичен только [ 63 Cu(H 2 16 O)] + и C 22 O 2 (рис. 4а). Примечательно, что при добавлении H 2 18 O в систему, содержащую [ 63 Cu(H 2 16 O)] + и C 16 3 O (рис. , а не только [ 63 Cu(H 2 18 O)] + появляется в масс-спектре, но также появляются [ 63 Cu(C 16 O)] + и [ 63 Cu(C 18 O)] + . Эти результаты показали, что это была эффективная стратегия для получения [ 63 Cu(H 2 18 O)] + , и, что более важно, происхождение атома O в CO предполагалось из координированной воды.
4а). Примечательно, что при добавлении H 2 18 O в систему, содержащую [ 63 Cu(H 2 16 O)] + и C 16 3 O (рис. , а не только [ 63 Cu(H 2 18 O)] + появляется в масс-спектре, но также появляются [ 63 Cu(C 16 O)] + и [ 63 Cu(C 18 O)] + . Эти результаты показали, что это была эффективная стратегия для получения [ 63 Cu(H 2 18 O)] + , и, что более важно, происхождение атома O в CO предполагалось из координированной воды.
a [ 63 Cu(H 2 16 O)] + и C 16 O 2 . b [ 63 Cu(H 2 16 O)] + , H 2 16 O, и C 9002 3 2 O 2 2 2 2 2 O 16 9002 c [ 63 Cu(H 2 16 O)] + , H 2 18 O и C 902 2 O 2 2 2 2 2 2 2 O 16 9002 d [ 63 Cu(H 2 16 О)] + и С 18 О 2 . e [ 63 Cu(H 2 16 O)] + . H 2 16 O и C 18 O 2 ; f [ 63 Cu(H 2 16 O)] + , H 2 18 O and C 18 O 2 (gas circuit temperature: 280 o C ; реакционное давление: 1,5 мТорр).
e [ 63 Cu(H 2 16 O)] + . H 2 16 O и C 18 O 2 ; f [ 63 Cu(H 2 16 O)] + , H 2 18 O and C 18 O 2 (gas circuit temperature: 280 o C ; реакционное давление: 1,5 мТорр).
Полноразмерное изображение
Более убедительные доказательства были получены из -за реакции между [ 63 CU (H 2 16 O)] + , C 18 O 2 и H 2 16 O/ O/ H 2 16 1 O/ O/ H 2 16 1 O/ H 2 16 1 O/ H H 2 18 O. Интересно, как [ 63 CU (H 2 16 O)] + взаимодействовал с C 18 O 2 (Fig. 4D), [ 63. Cu(C 16 O)] + , а не [ 63 Cu(C 18 O)] + , что указывает на то, что атом O в CO действительно происходит от H 2 O. Такой же результат был получен для системы с [ 63 Cu(H 2 16 O)] + , C 18 O 2 и H 2 16 O (рис. 4e). Однако при инжекции H 2 18 O в систему газового контура C 18 O 2 (рис. 4f) масс-спектр был аналогичен системе с [ 63 Cu (H 2 16 O)] + , C 16 O 2 и H 2 18 O (Fig. 4C), в котором оба [ 63 Cu Cu. (C 16 O)] + и [ 63 Cu(C 18 O)] + . Это явление, а также реакции на основе 65 Cu (дополнительный рис. 16), 107 Ag и 104 Pd (дополнительный рис. 17) позволили нам сделать определенный вывод, что в CO 9В процессе 0022 2 RR два атома O в CO 2 были полностью устранены за счет потери двух молекул H 2 O 46,48,70 , а атом O в CO образовался из координированного H 2 O.
Такой же результат был получен для системы с [ 63 Cu(H 2 16 O)] + , C 18 O 2 и H 2 16 O (рис. 4e). Однако при инжекции H 2 18 O в систему газового контура C 18 O 2 (рис. 4f) масс-спектр был аналогичен системе с [ 63 Cu (H 2 16 O)] + , C 16 O 2 и H 2 18 O (Fig. 4C), в котором оба [ 63 Cu Cu. (C 16 O)] + и [ 63 Cu(C 18 O)] + . Это явление, а также реакции на основе 65 Cu (дополнительный рис. 16), 107 Ag и 104 Pd (дополнительный рис. 17) позволили нам сделать определенный вывод, что в CO 9В процессе 0022 2 RR два атома O в CO 2 были полностью устранены за счет потери двух молекул H 2 O 46,48,70 , а атом O в CO образовался из координированного H 2 O. Кроме того, были проведены эксперименты по мечению O H 2 18 в тандеме с автономным анализом GC-MS, чтобы подтвердить источник атома O в полученном CO из обращенного WGSR. Как показано на дополнительном рис. 6f–h, по сравнению с системой введения H 2 16 O, в масс-спектре системы H 2 18 O появился обильный пик m/z 30 (C 18 O). O был источником кислорода для полученного CO. Что еще более важно, наблюдаемые результаты восстановления CO 2 в масс-спектрометре TSQ можно было экстраполировать на реалистичный гетерогенный катализ. Эти результаты в газовой фазе также напрямую коррелировали с CO 2 RR в растворенной фазе. Чтобы понять этот момент, мы провели электрохимическое восстановление CO 2 в водном растворе KCl с использованием Au-электрода, поскольку полученное количество CO было ниже предела обнаружения с использованием Cu или Ag-электрода. Продукты реакции контролировали с помощью онлайн-дифференциального электрохимического масс-спектрометра (дополнительный рисунок 18).
Кроме того, были проведены эксперименты по мечению O H 2 18 в тандеме с автономным анализом GC-MS, чтобы подтвердить источник атома O в полученном CO из обращенного WGSR. Как показано на дополнительном рис. 6f–h, по сравнению с системой введения H 2 16 O, в масс-спектре системы H 2 18 O появился обильный пик m/z 30 (C 18 O). O был источником кислорода для полученного CO. Что еще более важно, наблюдаемые результаты восстановления CO 2 в масс-спектрометре TSQ можно было экстраполировать на реалистичный гетерогенный катализ. Эти результаты в газовой фазе также напрямую коррелировали с CO 2 RR в растворенной фазе. Чтобы понять этот момент, мы провели электрохимическое восстановление CO 2 в водном растворе KCl с использованием Au-электрода, поскольку полученное количество CO было ниже предела обнаружения с использованием Cu или Ag-электрода. Продукты реакции контролировали с помощью онлайн-дифференциального электрохимического масс-спектрометра (дополнительный рисунок 18). В отличие от системы H 2 16 O, значительное количество C 18 O (m/z 30) образовалось в присутствии H 2 18 O (дополнительные рисунки 19– 21). Это также указывало на то, что H 2 O был источником кислорода для полученного CO в результате восстановления CO 2 и предоставил убедительные доказательства обобщения текущего вывода на связанные реакции в конденсированной фазе (дополнительная таблица 1).
В отличие от системы H 2 16 O, значительное количество C 18 O (m/z 30) образовалось в присутствии H 2 18 O (дополнительные рисунки 19– 21). Это также указывало на то, что H 2 O был источником кислорода для полученного CO в результате восстановления CO 2 и предоставил убедительные доказательства обобщения текущего вывода на связанные реакции в конденсированной фазе (дополнительная таблица 1).
Определение влияния H
2 O на генерацию COКоличество координированных H 2 O в [ 63 CU (H 2 O) x ] + ( x
3 x ] + ( x3 = x ] + ( x x ] + ( x x ] + . 0, 1 или 2) оказывает значительное влияние на снижение содержания CO 2 в CO. Эффективность реакции оценивали путем сравнения абсолютных интенсивностей пиков образующихся [ 63 Cu(CO)] + в масс-спектрометрическом анализе. Когда в качестве катализатора использовался чистый 63 Cu + , наблюдался низкий сигнал (рис. 5a и дополнительный рис. 22). Примечательно, что для [ 63 Cu(H 2 O)] + наблюдалось значительное улучшение, а эффективность реакции была в 193,8 раза выше, чем с 63 Cu + . Однако дальнейшее увеличение количества координированных H 2 O до 2 (например, [ 63 Cu(H 2 O) 2 ] + ) привело к эффективности реакции, сравнимой с [ 63 Cu (H 2 O)] + , что указывает на то, что одной координированной молекулы H 2 O достаточно для высокоэффективного восстановления CO 2 до CO Рис. 5: Влияние количества координированных H 2 O, свободный H 2 O и посторонняя кислота на образование CO.
Когда в качестве катализатора использовался чистый 63 Cu + , наблюдался низкий сигнал (рис. 5a и дополнительный рис. 22). Примечательно, что для [ 63 Cu(H 2 O)] + наблюдалось значительное улучшение, а эффективность реакции была в 193,8 раза выше, чем с 63 Cu + . Однако дальнейшее увеличение количества координированных H 2 O до 2 (например, [ 63 Cu(H 2 O) 2 ] + ) привело к эффективности реакции, сравнимой с [ 63 Cu (H 2 O)] + , что указывает на то, что одной координированной молекулы H 2 O достаточно для высокоэффективного восстановления CO 2 до CO Рис. 5: Влияние количества координированных H 2 O, свободный H 2 O и посторонняя кислота на образование CO. a Влияние количества координированного H 2 O и свободного H 2 O на CO 2 восстановление до CO при различных условиях на основе Cu Каталитические системы ( 63 CU + , [ 63 CU (H 2 O)] + и [ 63 CU (H 2 O) 2 ] + ). b Влияние посторонней кислоты на восстановление СО 2 до СО в различных каталитических системах на основе меди. Примечание: бесплатный H 2 O и HOAc (уксусная кислота) вводили в систему газового контура с помощью инжектора; температура газового контура: 280 o С; давление реакции: 1,5 мТорр; n = 5).
b Влияние посторонней кислоты на восстановление СО 2 до СО в различных каталитических системах на основе меди. Примечание: бесплатный H 2 O и HOAc (уксусная кислота) вводили в систему газового контура с помощью инжектора; температура газового контура: 280 o С; давление реакции: 1,5 мТорр; n = 5).
Полный размер
В реакции между [ 63 Cu(H 2 O)] + и CO 2 , было неясно, как молекулы H 2 O взаимодействовали с CO 2 902 909 а именно, было ли это (i) прямое взаимодействие между [ 63 Cu(H 2 O)] + и CO 2 , или если (ii) CO 2 сначала взаимодействует с диссоциированной молекулой H 2 O из [ 63 Cu(H 2 O)1 + ] , затем реагировал с диссоциированным 63 Cu + или [ 63 Cu(H 2 O)] + . Для проверки вышеизложенных предположений в систему газового контура CO 2 было введено 2 мкл свободного H 2 O при температуре 280 °C (рис. 1). После инъекции свободный H 2 O molecules immediately evaporated and interacted with CO 2 in the gas circuit by forming H 2 CO 3 (H 2 O + CO 2 → H 2 CO 3 ) 71,72,73 , что было косвенно подтверждено экспериментами по мечению изотопов, а именно H 2 18 O и C 16 O 2 (дополнительный рисунок 23). Если маршрут (ii) был выбран в CO 2 RR, задействованный свободный H 2 O будет способствовать восстановлению CO 2 до CO. Однако наблюдалась сопоставимая эффективность реакции с системой без свободного H 2 O (рис. 5a и дополнительная рис. 22), что указывает на то, что восстановление CO 2 до CO произошло по маршруту (i). А именно, [Cu(H 2 O)] + сначала взаимодействует с CO 2 с образованием [Cu(H 2 O)(CO 2 )] + , которое поддерживается эксперименты по мечению изотопов (дополнительный рисунок 24), а затем произошла реакция восстановления для преобразования CO 2 в CO.
1). После инъекции свободный H 2 O molecules immediately evaporated and interacted with CO 2 in the gas circuit by forming H 2 CO 3 (H 2 O + CO 2 → H 2 CO 3 ) 71,72,73 , что было косвенно подтверждено экспериментами по мечению изотопов, а именно H 2 18 O и C 16 O 2 (дополнительный рисунок 23). Если маршрут (ii) был выбран в CO 2 RR, задействованный свободный H 2 O будет способствовать восстановлению CO 2 до CO. Однако наблюдалась сопоставимая эффективность реакции с системой без свободного H 2 O (рис. 5a и дополнительная рис. 22), что указывает на то, что восстановление CO 2 до CO произошло по маршруту (i). А именно, [Cu(H 2 O)] + сначала взаимодействует с CO 2 с образованием [Cu(H 2 O)(CO 2 )] + , которое поддерживается эксперименты по мечению изотопов (дополнительный рисунок 24), а затем произошла реакция восстановления для преобразования CO 2 в CO. Приведенные выше результаты также показали, что координированный H 2 O на Cu + , а не свободный H 2 O, играет решающую роль в восстановлении CO 2 до CO. переходные металлы, такие как Cu + , не только обеспечивали эффективные активные центры для образования ионов [Cu(H 2 O)] + или других комплексных ионов металлов на основе H 2 O, но также давали возможность заряжать нейтральные частицы, такие как CO 2 и CO для благоприятного масс-спектрометрического анализа формами [Cu(CO 2 )] + и [Cu(CO)] + (рис. 2 и 4).
Приведенные выше результаты также показали, что координированный H 2 O на Cu + , а не свободный H 2 O, играет решающую роль в восстановлении CO 2 до CO. переходные металлы, такие как Cu + , не только обеспечивали эффективные активные центры для образования ионов [Cu(H 2 O)] + или других комплексных ионов металлов на основе H 2 O, но также давали возможность заряжать нейтральные частицы, такие как CO 2 и CO для благоприятного масс-спектрометрического анализа формами [Cu(CO 2 )] + и [Cu(CO)] + (рис. 2 и 4).
Основываясь на предыдущих экспериментах, атом O в CO происходит из H 2 O, а не из CO 2 . Таким образом, два атома O в CO 2 должны были быть удалены до образования CO. Согласно предыдущим механизмам CO 2 RR 46,48,70 , генерация CO достигалась первым протоном. процессы переноса электрона (H + /e − ) на CO 2 , с последующим устранением H 2 O. Чтобы способствовать образованию CO, был необходим эффективный шаг к генерации и захвату протонов 46 . В этом исследовании также было обнаружено, что протон (H + ) имеет решающее значение для образования CO. Для реакции [Cu(H 2 O)] + и CO 2 Считалось, что H + вызван диссоциацией воды. Однако дальнейшая диссоциация воды может повлиять на ее способность участвовать в образовании [Cu(H 2 O)(CO 2 )] + и снижают эффективность реакции. Добавление дополнительных H + может смягчить диссоциацию воды и увеличить образование CO. Для подтверждения этой гипотезы в систему газового контура CO 2 было введено 2 мкл уксусной кислоты (HOAc). Для системы, содержащей [Cu(H 2 O)] + , наблюдалось 8,9-кратное увеличение образования CO при добавлении HOAc, тогда как для чистой Cu 9 существенной разницы не наблюдалось.0020 + (рис. 5b и дополнительные рис.
Чтобы способствовать образованию CO, был необходим эффективный шаг к генерации и захвату протонов 46 . В этом исследовании также было обнаружено, что протон (H + ) имеет решающее значение для образования CO. Для реакции [Cu(H 2 O)] + и CO 2 Считалось, что H + вызван диссоциацией воды. Однако дальнейшая диссоциация воды может повлиять на ее способность участвовать в образовании [Cu(H 2 O)(CO 2 )] + и снижают эффективность реакции. Добавление дополнительных H + может смягчить диссоциацию воды и увеличить образование CO. Для подтверждения этой гипотезы в систему газового контура CO 2 было введено 2 мкл уксусной кислоты (HOAc). Для системы, содержащей [Cu(H 2 O)] + , наблюдалось 8,9-кратное увеличение образования CO при добавлении HOAc, тогда как для чистой Cu 9 существенной разницы не наблюдалось.0020 + (рис. 5b и дополнительные рис. 25 и 26). Эти результаты показали, что дополнительный H + действительно важен для повышения эффективности восстановления CO 2 до CO в присутствии катализатора [Cu(H 2 O)] + , в котором H + из координированный H 2 O участвовал в отщеплении атомов O в CO 2 46,48,70 .
25 и 26). Эти результаты показали, что дополнительный H + действительно важен для повышения эффективности восстановления CO 2 до CO в присутствии катализатора [Cu(H 2 O)] + , в котором H + из координированный H 2 O участвовал в отщеплении атомов O в CO 2 46,48,70 .
Многие предыдущие исследования 8,26,55,56,57,58,59,74,75 показали, что поверхность Cu(I) была активным центром, закрепляющим CO 2 руб. Из-за этого несколько стратегий, включая добавление кислорода 59 или носителя из нитрида меди 76 , легирование борсодержащими элементами 39 , плазменную обработку 77 , электроосаждение катализатора 78 и покрытие поверхности катализатора с нанополостями 55 , использовались для стабилизации активной степени окисления Cu(I). Несмотря на эти усилия, точное влияние одного валентного состояния Cu на восстановление CO 2 до CO остается неоднозначным. Ионы могут быть легко выделены с помощью МС, что позволяет исследовать взаимодействие между CO 2 и Cu с разными степенями окисления. В этом исследовании мы не только исследовали влияние Cu(I) в CO 2 RR, но также исследовали действие Cu(II) на производство CO. С учетом степени окисления меди и упомянутого выше эффекта H 2 O [ 63 Cu(OH)·H 2 O] + и [ 65 Cu(OH)·H 2 O ] + (дополнительный рис. 27a, b) были выделены для взаимодействия с CO 2 . Однако, в отличие от системы Cu(I) (рис. 4), гораздо меньшее количество [ 63 Cu(CO)] + или [ 65 Cu(CO)] + наблюдалось в масс-спектре (дополнительный рисунок 27c, d). Эти результаты показали, что Cu(I) лучше восстанавливала CO 2 до CO, чем Cu(II) даже в присутствии воды, что хорошо согласуется с приведенным выше обсуждением.
Ионы могут быть легко выделены с помощью МС, что позволяет исследовать взаимодействие между CO 2 и Cu с разными степенями окисления. В этом исследовании мы не только исследовали влияние Cu(I) в CO 2 RR, но также исследовали действие Cu(II) на производство CO. С учетом степени окисления меди и упомянутого выше эффекта H 2 O [ 63 Cu(OH)·H 2 O] + и [ 65 Cu(OH)·H 2 O ] + (дополнительный рис. 27a, b) были выделены для взаимодействия с CO 2 . Однако, в отличие от системы Cu(I) (рис. 4), гораздо меньшее количество [ 63 Cu(CO)] + или [ 65 Cu(CO)] + наблюдалось в масс-спектре (дополнительный рисунок 27c, d). Эти результаты показали, что Cu(I) лучше восстанавливала CO 2 до CO, чем Cu(II) даже в присутствии воды, что хорошо согласуется с приведенным выше обсуждением.
Исследования механизмов
На основании неопровержимых доказательств экспериментальных наблюдений на рис. 6а был предложен путь восстановления CO 2 до CO на катализаторе на основе Cu(I). Этот процесс начался с образования [Cu(H 2 O)] + , который взаимодействовал с CO 2 с образованием [Cu(H 2 O)(CO 2 )] + . Как упоминалось выше, H 2 CO 3 образуется после реакции CO 2 и H 2 O, в результате чего происходит переход из [Cu(H 2 O)(CO 2 )] + в [Cu(H 2 CO 3 )] + , что было аналогично прямому захвату CO 2 и преобразованию в топливо наночастицами магния 54 . Последующие реакции переноса H + /e − 46,48,70 привели к образованию [Cu(CO)] + наряду с отщеплением двух молекул H 2 O. В CO 2 RR ионы H + образуются в результате диссоциации H 2 O/H 2 CO 3 или добавленной кислоты, а необходимые электроны участвуют в восстановлении CO 2 до CO, вероятно, образовался из H 2 CO 3 (дополнительный рисунок 28 и соответствующее обсуждение).
6а был предложен путь восстановления CO 2 до CO на катализаторе на основе Cu(I). Этот процесс начался с образования [Cu(H 2 O)] + , который взаимодействовал с CO 2 с образованием [Cu(H 2 O)(CO 2 )] + . Как упоминалось выше, H 2 CO 3 образуется после реакции CO 2 и H 2 O, в результате чего происходит переход из [Cu(H 2 O)(CO 2 )] + в [Cu(H 2 CO 3 )] + , что было аналогично прямому захвату CO 2 и преобразованию в топливо наночастицами магния 54 . Последующие реакции переноса H + /e − 46,48,70 привели к образованию [Cu(CO)] + наряду с отщеплением двух молекул H 2 O. В CO 2 RR ионы H + образуются в результате диссоциации H 2 O/H 2 CO 3 или добавленной кислоты, а необходимые электроны участвуют в восстановлении CO 2 до CO, вероятно, образовался из H 2 CO 3 (дополнительный рисунок 28 и соответствующее обсуждение). При восстановлении CO 2 атом O в [Cu(H 2 O)] + соединяется с атомом C в CO 2 с образованием CO, тогда как два атома O в CO 2 удалялись за счет потери двух молекул H 2 O. Высвобожденные молекулы H 2 O могут соединиться с Cu + с образованием [Cu(H 2 O)] + для следующего цикла восстановления CO 2 . Несмотря на это, степень окисления меди оставалась +1, что хорошо согласуется с предыдущим отчетом 9.0020 77 .
При восстановлении CO 2 атом O в [Cu(H 2 O)] + соединяется с атомом C в CO 2 с образованием CO, тогда как два атома O в CO 2 удалялись за счет потери двух молекул H 2 O. Высвобожденные молекулы H 2 O могут соединиться с Cu + с образованием [Cu(H 2 O)] + для следующего цикла восстановления CO 2 . Несмотря на это, степень окисления меди оставалась +1, что хорошо согласуется с предыдущим отчетом 9.0020 77 .
a Схематическое изображение восстановления CO 2 до CO согласно экспериментальным наблюдениям. B Микроскопический путь реакции DFT [синглетные реагенты 1 CU + + 1 H 2 O + 1 CO 2 ( 1 – 0,00, 0,00). в качестве ссылки], демонстрируя термодинамическую и кинетическую осуществимость предложенного пути.
в качестве ссылки], демонстрируя термодинамическую и кинетическую осуществимость предложенного пути.
Изображение в натуральную величину
Чтобы получить детальное представление о механизме реакции, были проведены расчеты DFT для изучения ключевых промежуточных продуктов реакции и возможных путей реакции. Для понимания всех возможностей были рассмотрены как синглетный, так и триплетный пути реакции. Путь синглетной реакции был более термодинамически благоприятным, чем путь триплетной реакции, и оба пути были похожи (рис. 6b, дополнительная рис. 29 и дополнительная таблица 2–4). Из-за этого факта обсуждение здесь было сосредоточено в основном на пути синглетной реакции с более низкой энергией.
Активация CO 2 была инициализирована столкновением между 1 CO 2 , 1 Cu + и 1 H 2 9002plement (дополнительный рисунок). Все расчеты по бимолекулярным взаимодействиям показали, что 1 [Cu-OH 2 ] + ( 1 МС1), при столкновении 1 Cu + и 1 3 H 2 900 наиболее предпочтительная возможность в отличие от других, таких как 1 Cu + and 1 CO 2 or 1 CO 2 and 1 H 2 O. The binding energy of 1 Cu + and 1 H 2 O в 1 MS1 достигала −40,18 ккал моль −1 , что было больше, чем у 1 Cu + и 1 CO 2 (1 CO 2 ( = C = O] + , −19,68 ккал моль −1 ) и 1 CO 2 и 1 H 2 O ( 1 [H 2 O-O = C = O] + , 2,53 ккал 01902 моль 90). При столкновении 1 Cu + с 1 H 2 O, 1 Cu + склонен взаимодействовать с центральным атомом O в H 2 2 O с образованием 19002 -OH 2 ] + за счет сочетания O-Cu с длиной связи 1,90 Å.
The binding energy of 1 Cu + and 1 H 2 O в 1 MS1 достигала −40,18 ккал моль −1 , что было больше, чем у 1 Cu + и 1 CO 2 (1 CO 2 ( = C = O] + , −19,68 ккал моль −1 ) и 1 CO 2 и 1 H 2 O ( 1 [H 2 O-O = C = O] + , 2,53 ккал 01902 моль 90). При столкновении 1 Cu + с 1 H 2 O, 1 Cu + склонен взаимодействовать с центральным атомом O в H 2 2 O с образованием 19002 -OH 2 ] + за счет сочетания O-Cu с длиной связи 1,90 Å.
Наличие активированного 1 [Cu-OH 2 ] + ( 1 MS1) способствовал восстановлению 1 CO 2 . Сначала 1 CO 2 взаимодействовал с 1 МС1 с образованием 1 ) промежуточное соединение со слабой водородной связью O-H···O. Длина связи О-С 1 СО 2 изменилась с 1,16 Å до 1,17 и 1,15 Å в 1 МС2. Впоследствии 1 MS2 изомеризуется в 1 [Cu-O(H)-C(O)OH] + ( 1 MS3, −2,84 ккал моль −1 ) через переходное состояние, 1 TS2/3 (10,08 ккал моль -1 ). Стоит отметить, что при превращении из 1 ТС2/3 в 1 МС3 произошел разрыв связи О-Н в Н 2 О и образование связей О-Н и С-О между связями Н 2 О и CO 2 (дополнительный рисунок 31–34). Этот процесс был лимитирующей стадией CO 2 восстановление с активационным барьером до 50,41 ккал моль −1 . Дальнейшая изомеризация превратила 1 MS3 в 1 [Cu-O-C(OH) 2 ] + ( 1 MS4, −2,84 ккал моль −1 ), которая включала только внутримолекулярную миграцию водорода переходное состояние 1 TS3/4 (18,74 ккал моль −1 ), а активационный барьер от 1 MS3 до 1 TS3/4 составил 21,58 ккал моль −1 .
Длина связи О-С 1 СО 2 изменилась с 1,16 Å до 1,17 и 1,15 Å в 1 МС2. Впоследствии 1 MS2 изомеризуется в 1 [Cu-O(H)-C(O)OH] + ( 1 MS3, −2,84 ккал моль −1 ) через переходное состояние, 1 TS2/3 (10,08 ккал моль -1 ). Стоит отметить, что при превращении из 1 ТС2/3 в 1 МС3 произошел разрыв связи О-Н в Н 2 О и образование связей О-Н и С-О между связями Н 2 О и CO 2 (дополнительный рисунок 31–34). Этот процесс был лимитирующей стадией CO 2 восстановление с активационным барьером до 50,41 ккал моль −1 . Дальнейшая изомеризация превратила 1 MS3 в 1 [Cu-O-C(OH) 2 ] + ( 1 MS4, −2,84 ккал моль −1 ), которая включала только внутримолекулярную миграцию водорода переходное состояние 1 TS3/4 (18,74 ккал моль −1 ), а активационный барьер от 1 MS3 до 1 TS3/4 составил 21,58 ккал моль −1 .
После образования 1 MS4 две молекулы воды были потеряны в процессе переноса H + /e − , что привело к образованию 1 [Cu-O-C] + ( 1 MS6, −90,19 ккал моль −1 ). При этом H + /e − первоначально переносится из реакционной системы в ОН-группу 1 MS4, что приводит к высвобождению одной молекулы H 2 O с образованием 1 [Cu-O-COH] + ( 2 MS5, −29,30 ккал моль −1 ) промежуточное соединение. Поскольку группа ОН в 2 MS5 была дополнительно атакована H + /e – , промежуточное соединение 1 MS6 образовалось за счет высвобождения другой молекулы H 2 O. Процесс дегидратации будет конкурировать с реакцией выделения водорода (HER). При расчете их соответствующей свободной энергии значения составили -4,76 кал моль -1 и -60,89 кал моль -1 , когда 1 MS4 и 2 MS5 были переведены в 2 MS5 и 1 MS6 соответственно. Для стандартного водородного электрода свободная энергия составляет −19,09 кал моль −1 , так как H + переносится в H 2 в основном растворе, эта система благоприятна для водного электрохимического CO 2 RR, предотвращая при этом HER . По-видимому, в отличие от переноса 1 МС4 на 2 МС5 он был подвержен HER, тогда как при 2 MS5 был перенесен на 1 MS6. Наряду с процессами 2 MS5 также имеет тенденцию объединяться с H + с образованием [Cu(HCOOH)] + в качестве побочной реакции, которая была зафиксирована в нашем текущем исследовании (дополнительные рисунки 7a, b). и 35).
Для стандартного водородного электрода свободная энергия составляет −19,09 кал моль −1 , так как H + переносится в H 2 в основном растворе, эта система благоприятна для водного электрохимического CO 2 RR, предотвращая при этом HER . По-видимому, в отличие от переноса 1 МС4 на 2 МС5 он был подвержен HER, тогда как при 2 MS5 был перенесен на 1 MS6. Наряду с процессами 2 MS5 также имеет тенденцию объединяться с H + с образованием [Cu(HCOOH)] + в качестве побочной реакции, которая была зафиксирована в нашем текущем исследовании (дополнительные рисунки 7a, b). и 35).
На последнем этапе связанная группа СО диссоциирует от 1 MS6 с образованием изолированной молекулы СО и нетронутой 1 Cu + , таким образом завершая каталитический цикл и высвобождая -82,46 ккал моль −1 тепловой энергии. Путь реакции предлагает дополнительные убедительные теоретические доказательства гипотетического механизма, полученные из масс-спектрометрического анализа. В нем также подробно описано, как молекула H 2 O участвует в восстановлении CO 2 до CO и как она заменяет два атома O в CO 2 на один в своей структуре.
В нем также подробно описано, как молекула H 2 O участвует в восстановлении CO 2 до CO и как она заменяет два атома O в CO 2 на один в своей структуре.
Таким образом, мы разработали модифицированный масс-спектрометр TSQ, который позволяет онлайн-наблюдение CO 2 RR и обнаружение промежуточных продуктов и продуктов реакции. Результаты показали, что координированный H 2 O на катализаторах на основе Cu(I) сыграл решающую роль как в эффективности адсорбции CO 2 на катализаторе Cu(I), так и в восстановлении CO 2 до CO, и улучшение на два порядка величина была достигнута в присутствии координированного H 2 O, чем без H 2 O. Дальнейшие эксперименты показали, что существующая форма H 2 O и количество координированного H 2 O также оказывали значительное влияние на снижение СО 2 в CO. Что еще более важно, исследования изотопной маркировки показали, что происхождение атома O в образовавшемся CO происходит от H 2 O, а не от CO 2 . На основании экспериментальных наблюдений и расчетных расчетов был предложен конкретный путь восстановления СО 2 до СО. Эта работа не только предлагает новую стратегию раскрытия процесса реакции CO 2 RR, но также дает полезную информацию о роли H 2 O, предполагая, что эффективность CO 2 RR может быть улучшена путем создания новых типов катализаторов с координированным H 2 O.
На основании экспериментальных наблюдений и расчетных расчетов был предложен конкретный путь восстановления СО 2 до СО. Эта работа не только предлагает новую стратегию раскрытия процесса реакции CO 2 RR, но также дает полезную информацию о роли H 2 O, предполагая, что эффективность CO 2 RR может быть улучшена путем создания новых типов катализаторов с координированным H 2 O.
Методы
Приготовление различных растворов на основе Cu
Для приготовления различные растворы на основе меди. В частности, 0,1 г частиц на основе меди, таких как CuCl, сначала растворяли в 1,0 мл дважды деионизированной воды. После обработки ультразвуком в течение 30 мин с использованием ультразвукового очистителя KQ3200DB (Kunshan Ultrasonic Instrument Co., Ltd., Куньшань, Китай) 1 мкл водного раствора CuCl добавляли в 999 мкл ацетонитрила. Наконец, полученный раствор перемешивали с помощью генератора Vortex QL-901 (Haimen Qilin Beier Instrument Manufacturing Co. , Ltd., Хаймен, Китай) в течение 1 мин.
, Ltd., Хаймен, Китай) в течение 1 мин.
Изготовление стеклянного капилляра с отверстием на кончике 1 мкм
Стеклянный капилляр с отверстием на конце 1 мкм вытягивали из капилляра из боросиликатного стекла с помощью нити (Sutter Instrument, США, 1,5 мм нар. диам., 0,86 мм внутр. диам., длина 10 см ) с помощью съемника микропипеток (модель P-97, Sutter Instrument Co., Новато, Калифорния, США). Отверстие наконечника измеряли с помощью металлографического микроскопа, оснащенного цифровой камерой DCA 10.0 (разрешение 1 миллион), и точность отверстия наконечника составляла ± 1 мкм.
Онлайн-реакция и МС-анализ
Все эксперименты по масс-спектрометрии с ионизацией наноэлектрораспылением (nanoESI-MS) проводились либо с помощью масс-спектрометра TSQ Quantum Access Max, либо с помощью масс-спектрометра Orbitrap Elite Hybrid Ion Trap-Orbitrap (Thermo Fisher Scientific, San Хосе, Калифорния, США). Для nanoESI 20 мкл 100 мкг -1 раствора CuCl вводили в стеклянный капилляр с отверстием на кончике 1 мкм, а затем к раствору CuCl прикладывали 1,0 кВ постоянного напряжения для генерации различных CuCl. ионы на основе. Расстояние между наконечником nanoESI и входным капилляром MS составляло около 10 мм. Масс-спектры записывали в режиме положительных ионов при температуре капилляра 270 °С. Идентификация ионов на основе меди была подтверждена с помощью масс-спектрометрии высокого разрешения (HRMS) и тандемной масс-спектрометрии (МС/МС) с использованием диссоциации, индуцированной столкновениями (CID). Газ аргон (99,995% чистоты) использовали в качестве коллизионного газа. Для реакции между ионами на основе Cu и CO 2 ионы на основе Cu, такие как Cu + и [Cu(H 2 O)] + , сначала выделяли из Q1, а затем вводили в Q2 (см. Рисунок 1). В реакционной установке Q2 ионы на основе Cu взаимодействовали с CO 2 с образованием CO при энергии столкновения 5 V, и полученные продукты впоследствии переносились в Q3 с последующим обнаружением. Следует отметить, что энергия столкновения CO 2 восстановление контролировалось операционной программой используемого коммерческого масс-спектрометра.
ионы на основе. Расстояние между наконечником nanoESI и входным капилляром MS составляло около 10 мм. Масс-спектры записывали в режиме положительных ионов при температуре капилляра 270 °С. Идентификация ионов на основе меди была подтверждена с помощью масс-спектрометрии высокого разрешения (HRMS) и тандемной масс-спектрометрии (МС/МС) с использованием диссоциации, индуцированной столкновениями (CID). Газ аргон (99,995% чистоты) использовали в качестве коллизионного газа. Для реакции между ионами на основе Cu и CO 2 ионы на основе Cu, такие как Cu + и [Cu(H 2 O)] + , сначала выделяли из Q1, а затем вводили в Q2 (см. Рисунок 1). В реакционной установке Q2 ионы на основе Cu взаимодействовали с CO 2 с образованием CO при энергии столкновения 5 V, и полученные продукты впоследствии переносились в Q3 с последующим обнаружением. Следует отметить, что энергия столкновения CO 2 восстановление контролировалось операционной программой используемого коммерческого масс-спектрометра. Чтобы изучить влияние кислоты на реакцию ионов на основе Cu и CO 2 , 2 мкл уксусной кислоты вводили через шестиходовой клапан (Beijing Yijia Technology Co., Ltd., Пекин, Китай) в CO. 2 /Система газового контура Ar. Для повышения эффективности реакции между ионами на основе Cu и CO 2 систему газового контура нагревали до различных температур с помощью нагревательной ленты, управляемой регулятором температуры XMT-815 (Shanghai Mike Instrument Co., Ltd., Шанхай, Китай). ). Фактическую температуру нагревательной ленты определяли с помощью мультиметра 17В Fluke (Shanghai Fluke Corporation, Шанхай, Китай).
Чтобы изучить влияние кислоты на реакцию ионов на основе Cu и CO 2 , 2 мкл уксусной кислоты вводили через шестиходовой клапан (Beijing Yijia Technology Co., Ltd., Пекин, Китай) в CO. 2 /Система газового контура Ar. Для повышения эффективности реакции между ионами на основе Cu и CO 2 систему газового контура нагревали до различных температур с помощью нагревательной ленты, управляемой регулятором температуры XMT-815 (Shanghai Mike Instrument Co., Ltd., Шанхай, Китай). ). Фактическую температуру нагревательной ленты определяли с помощью мультиметра 17В Fluke (Shanghai Fluke Corporation, Шанхай, Китай).
Эксперимент с обратным WGSR
Эксперименты проводились на аппарате WGSR (Tianjin Tongyuan Hengli Technology Co., Ltd, Тяньцзинь, Китай). В реактор загружали 1,0 г катализатора Cu/ZnO/Al 2 O 3 . Давление H 2 16 O и H 2 18 O контролировали с помощью шприцевого насоса со скоростью потока в диапазоне от 1 до 50 мкл мин -1 . После регулировки расхода время балансировки 1,5 часа использовалось для установления равновесия CO 2 реакция восстановления. Воздух и сопутствующие загрязнения были заменены на H 2 путем последовательной продувки. В процессе реакции парциальное давление H 2 и CO 2 поддерживали постоянными на уровне 2,7 МПа и 0,3 МПа соответственно, а температуру реактора поддерживали на уровне 230 o °C. Газовые продукты анализировали в режиме онлайн. с помощью газового хроматографа Fuli GC9790, оснащенного насадочной колонкой с молекулярными ситами TDX-01 (2 м x 3 мм). Для Н 2 18 В экспериментах по O-мечению собранные газообразные продукты анализировали в автономном режиме с помощью газового хроматографа Agilent Technologies 7890B, оснащенного капиллярной колонкой GS-CarbonPLOT (30 м x 0,32 мм, внутренний диаметр, толщина пленки 1,50 мкм) и Технологии 5977 Масс-спектрометр. В качестве газа-носителя использовался гелий с расходом 15 мл мин -1 .
После регулировки расхода время балансировки 1,5 часа использовалось для установления равновесия CO 2 реакция восстановления. Воздух и сопутствующие загрязнения были заменены на H 2 путем последовательной продувки. В процессе реакции парциальное давление H 2 и CO 2 поддерживали постоянными на уровне 2,7 МПа и 0,3 МПа соответственно, а температуру реактора поддерживали на уровне 230 o °C. Газовые продукты анализировали в режиме онлайн. с помощью газового хроматографа Fuli GC9790, оснащенного насадочной колонкой с молекулярными ситами TDX-01 (2 м x 3 мм). Для Н 2 18 В экспериментах по O-мечению собранные газообразные продукты анализировали в автономном режиме с помощью газового хроматографа Agilent Technologies 7890B, оснащенного капиллярной колонкой GS-CarbonPLOT (30 м x 0,32 мм, внутренний диаметр, толщина пленки 1,50 мкм) и Технологии 5977 Масс-спектрометр. В качестве газа-носителя использовался гелий с расходом 15 мл мин -1 . Начальную температуру печи устанавливали равной 35 °C и поддерживали в течение 3 мин. Затем ее повышали до 100 °С со скоростью 40 °С мин −1 с последующим поддержанием в течение 1 мин. Температура инжектора составляла 185 °C, а объем впрыска – 250 мкл с коэффициентом деления 100:1.
Начальную температуру печи устанавливали равной 35 °C и поддерживали в течение 3 мин. Затем ее повышали до 100 °С со скоростью 40 °С мин −1 с последующим поддержанием в течение 1 мин. Температура инжектора составляла 185 °C, а объем впрыска – 250 мкл с коэффициентом деления 100:1.
Анализ DRIFTS in situ
Результаты инфракрасной спектроскопии диффузного отражения с преобразованием Фурье in situ (in situ DRIFTS) были получены на FTIR (Nicolet 6700), оснащенном ячейкой Pike DRIFT (PIKE Technologies) с окном KBr и MCT/ Детектор (охлаждаемый жидким азотом). Спектры снимались в диапазоне от 900 до 4000 см -1 с 32 сканами и разрешением 4 см -1 . Все использованные баллонные газы были высокой чистоты и перед поступлением в камеру in situ осушались во влагоуловителе (Agilent Technologies). Чтобы свести к минимуму влияние окружающей среды, камеру FTIR продували аргоном (99,999 %) со скоростью потока 4 л мин -1 . Перед экспериментом образец обрабатывали водородом (99,9999 %) с расходом 5 мл мин −1 в течение 2 ч, а затем переводили на гелий (99,9999%). 9,9999%) со скоростью потока 5 мл мин -1 в течение 2 ч при 500 °C для уменьшения поверхностного оксида и удаления всех возможных органических загрязнений. Далее в токе гелия реактор охлаждали до 150 °С или 250 °С для гидрирования СО 2 . Когда была получена устойчивая базовая линия, последовательно вводили водород (3 мл мин -1 ) и CO 2 (4 мл мин -1 , 5% CO 2 /95% Ar). Исследовать влияние воды на CO 2 RR игла шприца, заполненная 1 мкл воды, была вставлена в трубку, содержащую поток водорода, что позволило ввести следовые количества воды в реакционную систему. Используемый катализатор Cu/γ-Al 2 O 3 был приготовлен методом пропитки по начальной влажности с использованием предшественников Cu(NO 3 ) 2 (>99,0%, Guangzhou Chemical Reagent Factory, Гуанчжоу, Китай) и порошок γ-Al 2 O 3 (99,99%, Energy Chemical Co., Гуанчжоу, Китай).
9,9999%) со скоростью потока 5 мл мин -1 в течение 2 ч при 500 °C для уменьшения поверхностного оксида и удаления всех возможных органических загрязнений. Далее в токе гелия реактор охлаждали до 150 °С или 250 °С для гидрирования СО 2 . Когда была получена устойчивая базовая линия, последовательно вводили водород (3 мл мин -1 ) и CO 2 (4 мл мин -1 , 5% CO 2 /95% Ar). Исследовать влияние воды на CO 2 RR игла шприца, заполненная 1 мкл воды, была вставлена в трубку, содержащую поток водорода, что позволило ввести следовые количества воды в реакционную систему. Используемый катализатор Cu/γ-Al 2 O 3 был приготовлен методом пропитки по начальной влажности с использованием предшественников Cu(NO 3 ) 2 (>99,0%, Guangzhou Chemical Reagent Factory, Гуанчжоу, Китай) и порошок γ-Al 2 O 3 (99,99%, Energy Chemical Co., Гуанчжоу, Китай).
Электрохимическое восстановление СО
2 и онлайн-мониторинг масс-спектрометра Для электрохимического восстановления СО 2 до СО продукты реакции и СО 2 контролировали с помощью онлайн-дифференциального электрохимического масс-спектрометра (DEMS, Linglu Instrument Co., Ltd, Шанхай, Китай). Конфигурация электрохимической ячейки показана на дополнительном рисунке 18. Ячейка была заполнена 2,5 мл 0,5 М раствора KCl, насыщенного CO 9 .0022 2 газ. Во время электрохимического испытания в раствор KCl вводили непрерывный поток газа CO 2 . Рабочий электрод изготавливался путем напыления наночастиц золота на пористую мембрану. Электродом сравнения был электрод Ag/AgCl в насыщенном растворе KCl, а противоэлектродом был проволочный электрод Pt. Линейную свип-вольтамперометрию проводили на электрохимической рабочей станции (CHI Instruments, Inc., Остин, Техас, США) со скоростью свипирования 10 мВ с −1 от –0,8 В до –1,6 В. Одновременно с помощью МС были зарегистрированы сигналы МС с отношением массы/заряда 4430 и 28. 18 O-меченый H 2 O (чистота: 99,0%, содержание 18 O: ≥98,0%) был приобретен у Wuhan Isotope Technology Co., Ltd (Ухань, Китай).
Одновременно с помощью МС были зарегистрированы сигналы МС с отношением массы/заряда 4430 и 28. 18 O-меченый H 2 O (чистота: 99,0%, содержание 18 O: ≥98,0%) был приобретен у Wuhan Isotope Technology Co., Ltd (Ухань, Китай).
Детали расчета
Все расчеты электронной структуры были выполнены с помощью пакета Gaussian 09 (редакция B.01; Gaussian, Inc., Wallingford CT, 2010) 79 . Для оптимизации геометрии мы использовали метод двойного гибридного функционала плотности B2PLYP 80 в сочетании с расширенным корреляционно-согласованным поляризованным тройным дзета-базисом (aug-cc-pVTZ) с неявной обработкой скалярно-релятивистских эффектов с использованием псевдопотенциала эффективного основного потенциала (ECP) для атомов металлов 81 , и полный электронный базис aug-cc-pVTZ для всех остальных атомов 82 . Частоты гармонических колебаний вычислялись для проверки природы стационарных точек. Минимальные структуры, описанные в этой работе, показали только положительные собственные значения матрицы Гессе, тогда как переходные состояния имели одно отрицательное собственное значение. Также были выполнены расчеты внутренних координат реакции, чтобы подтвердить, что переходные состояния коррелируют с указанными промежуточными продуктами 9.0020 83,84,85,86 . Энергия нулевых колебаний (ZPVE) и тепловые поправки к энтальпии были рассчитаны для структур, оптимизированных на уровне B2PLYP/cc-pVTZ. Термодинамические функции (ΔH) оценивались в приближениях идеального газа, жесткого ротора и гармонического осциллятора при 298 K и 1 атм. Для простоты обсуждения символы « S IS» и « S FS» используются для описания начального состояния (IS), промежуточного состояния (MS) и конечного состояния (FS), а « S TSm/n» используется для переходного состояния взаимного преобразования между промежуточными состояниями, S m и S n. Левый верхний индекс «S» обозначает кратность спина (1 и 3 для синглета и триплета соответственно).
Также были выполнены расчеты внутренних координат реакции, чтобы подтвердить, что переходные состояния коррелируют с указанными промежуточными продуктами 9.0020 83,84,85,86 . Энергия нулевых колебаний (ZPVE) и тепловые поправки к энтальпии были рассчитаны для структур, оптимизированных на уровне B2PLYP/cc-pVTZ. Термодинамические функции (ΔH) оценивались в приближениях идеального газа, жесткого ротора и гармонического осциллятора при 298 K и 1 атм. Для простоты обсуждения символы « S IS» и « S FS» используются для описания начального состояния (IS), промежуточного состояния (MS) и конечного состояния (FS), а « S TSm/n» используется для переходного состояния взаимного преобразования между промежуточными состояниями, S m и S n. Левый верхний индекс «S» обозначает кратность спина (1 и 3 для синглета и триплета соответственно).
Доступность данных
Исходные данные предоставляются вместе с настоящей статьей, которые также могут быть получены у соответствующих авторов по обоснованному запросу.
Ссылки
Джессоп, П. Г., Икария, Т. и Нойори, Р. Гомогенное гидрирование диоксида углерода. хим. 95 , 259–272 (1995).
КАС Статья Google ученый
Цяо Дж., Лю Ю., Хун Ф. и Чжан Дж. Обзор катализаторов для электровосстановления диоксида углерода с целью получения низкоуглеродистого топлива. Хим. соц. 43 , 631–675 (2014).
КАС пабмед Статья Google ученый
Вагнер, А., Сам, С.Д. и Рейснер, Э. На пути к молекулярному пониманию локальных эффектов химической среды в электро- и фотокаталитическом CO 2 сокращение. Нац. Катал. 3 , 775–786 (2020).
КАС Статья Google ученый
Endrődi, B.
 et al. Катодная активация Operando катионами щелочных металлов для работы с высокой плотностью тока электролизеров диоксида углерода с нулевым зазором, питаемых водой. Нац. Энергия 6 , 439–448 (2021).
et al. Катодная активация Operando катионами щелочных металлов для работы с высокой плотностью тока электролизеров диоксида углерода с нулевым зазором, питаемых водой. Нац. Энергия 6 , 439–448 (2021).ПабМед ПабМед Центральный Статья ОБЪЯВЛЕНИЯ КАС Google ученый
Динь, К.-Т. и другие. CO 2 электровосстановление до этилена посредством катализа меди с помощью гидроксида на резкой границе раздела. Наука 360 , 783–787 (2018).
КАС пабмед Статья Google ученый
Рендон-Калле, А. и др. Как факторы симметрии вызывают зависящие от потенциала и фасет-зависимых путей сдвиги во время восстановления CO 2 до CH 4 на медных электродах. Заяв. Катал. Б: Окружающая среда. 285 , 119776 (2021).
Артикул КАС Google ученый
“>Ле, М. и др. Электрохимическое восстановление CO 2 в CH 3 OH на поверхности оксида меди. Дж. Электрохим. соц. 158 , Е45 (2011).
КАС Статья ОБЪЯВЛЕНИЯ Google ученый
Chen, L. et al. Молекулярный катализ электрохимического и фотохимического восстановления СО 2 комплексами металлов с избытком земли. Селективное производство CO по сравнению с HCOOH путем переключения металлического центра. г. Дж. Ам. хим. соц. 137 , 10918–10921 (2015).
КАС пабмед Статья Google ученый
“>Wang, X. et al. Морфология и механизм высокоселективных оксидных нанолистовых катализаторов Cu(II) для электровосстановления диоксида углерода. Нац. коммун. 12 , 794 (2021).
КАС пабмед ПабМед Центральный Статья ОБЪЯВЛЕНИЯ Google ученый
Сен, С., Лю, Д. и Палмор, Г. Т. Р. Электрохимическое восстановление CO 2 в нанопенах меди. ACS Катал. 4 , 3091–3095 (2014).
КАС Статья Google ученый
Ли, С., Парк, Г. и Ли, Дж.
 Важность двухфазных границ Ag-Cu для селективного электрохимического восстановления CO 2 до этанола. ACS Катал. 7 , 8594–8604 (2017).
Важность двухфазных границ Ag-Cu для селективного электрохимического восстановления CO 2 до этанола. ACS Катал. 7 , 8594–8604 (2017).КАС Статья Google ученый
Рудольф М., Даутц С. и Ягер Э.-Г. Макроциклический [N 4 2-] координированные комплексы никеля в качестве катализаторов образования оксалата электрохимическим восстановлением диоксида углерода. Дж. Ам. хим. соц. 122 , 10821–10830 (2000).
КАС Статья Google ученый
Chang, X., Wang, T. & Gong, J. CO 2 фотовосстановление: понимание CO 2 активация и реакция на поверхности фотокатализаторов. Энерг. Окружающая среда. науч. 9 , 2177–2196 (2016).
КАС Статья Google ученый
“>Робатжази, Х. и др. Селективная конверсия углекислого газа, индуцированная плазмоном, на распространенных на Земле наночастицах антенны-реактора из оксида алюминия и меди. Нац. коммун. 8 , 27 (2017).
ПабМед ПабМед Центральный Статья ОБЪЯВЛЕНИЯ КАС Google ученый
Тан, X. и др. Последние достижения в инновационных стратегиях реакции электровосстановления CO 2 . Энерг. Окружающая среда. науч. 14 , 765–780 (2021).
КАС Статья Google ученый
“>Jiang, X., Nie, X., Guo, X., Song, C. & Chen, JG. Последние достижения в области гидрирования диоксида углерода до метанола с помощью гетерогенного катализа. Хим. Ред. 120 , 7984–8034 (2020 г.).
КАС пабмед Статья Google ученый
Deng, Y. & Yeo, B.S. Характеристика электрокаталитического расщепления воды и реакций восстановления CO 2 с использованием рамановской спектроскопии in situ/operando. ACS Катал. 7 , 7873–7889 (2017).
КАС Статья Google ученый
“>Нгуен Л., Тао Ф. Ф., Тан Ю., Доу Дж. и Бао Х.-Дж. Понимание поверхности катализатора во время катализа с помощью рентгеновской фотоэлектронной спектроскопии при атмосферном давлении. Хим. Ред. 119 , 6822–6905 (2019).
ПабМед Статья КАС Google ученый
Цзоу, Ю. и Ван, С. Исследование активных центров электрохимических реакций восстановления CO 2 : от определения характеристик in situ до рационального проектирования. Доп. науч. 8 , 2003579 (2021).
КАС Статья Google ученый
“>Мишра, А. К. и де Леу, Н. Х. Изучение механизмов катализируемого оксидом меди (I) превращения CO 2 в топливо и химические вещества: подход DFT. J. CO2 Util. 15 , 96–106 (2016).
КАС Статья Google ученый
Wang, X. et al. Выяснение механизмов реакции между триазином и сероводородом с изменением pH с помощью масс-спектрометрии. Анал. хим. 90 , 11138–11145 (2018).
КАС пабмед Статья Google ученый
Банерджи, С., Башир, К. и Заре, Р. Н. Исследование гетерогенного катализа с помощью масс-спектрометрии с ионизацией распылением бумаги с включенными наночастицами.
 Анжю. хим. Междунар. Эд. 55 , 12807–12811 (2016).
Анжю. хим. Междунар. Эд. 55 , 12807–12811 (2016).КАС Статья Google ученый
Li, Y., Yan, X. & Cooks, R.G. Роль границы раздела в реакциях, ускоренных тонкими пленками и каплями, изученных с помощью конкурентных эффектов заместителей. Анжю. хим. Междунар. Эд. 55 , 3433–3437 (2016).
КАС Статья Google ученый
Фрик, Э., Анастасаки, А., Хаддлтон, Д.М. и Барнер-Коволлик, К. Освещение механизма фотоРДРФ, опосредованного медью, с помощью масс-спектрометрии высокого разрешения. г. Дж. Ам. хим. соц. 137 , 6889–6896 (2015).
КАС пабмед Статья Google ученый
Гу, К. и др. Изучение механизма восстановления кислорода на границе раздела жидкость/жидкость с помощью гибридных ультрамикроэлектродов и масс-спектрометрии.
 Дж. Ам. хим. соц. 141 , 13212–13221 (2019).
Дж. Ам. хим. соц. 141 , 13212–13221 (2019).КАС пабмед Статья Google ученый
Clark, E.L. & Bell, A.T. Прямое наблюдение за локальной реакционной средой во время электрохимического восстановления CO 2 . Дж. Ам. хим. соц. 140 , 7012–7020 (2018).
КАС пабмед Статья Google ученый
Wilm, M. & Mann, M. Аналитические свойства источника ионов наноэлектроспрея. Анал. хим. 68 , 1–8 (1996).
КАС пабмед Статья Google ученый
Гусман, Х., Руссо, Н. и Эрнандес, С. CO 2 Повышение ценности спиртов с помощью электрокатализаторов на основе меди: проблемы и перспективы. Зеленый. хим. 23 , 1896–1920 (2021).
Артикул Google ученый
“>Yoshio, H., Katsuhei, K. & Shin, S. Получение CO и CH 4 при электрохимическом восстановлении CO 2 на металлических электродах в водном растворе гидрокарбоната. Хим. лат. 14 , 1695–1698 (1985).
Артикул Google ученый
Zhu, C. et al. Специфичные для продукта мотивы активного центра меди для электрохимического восстановления CO 2 . Chem 7 , 406–420 (2021).
КАС Статья Google ученый
Wang, Y. et al. Синтез катализатора при электровосстановлении CO 2 способствует огранке и способствует электросинтезу возобновляемых топлив.
 Нац. Катал. 3 , 98–106 (2020).
Нац. Катал. 3 , 98–106 (2020).КАС Статья Google ученый
Zhou, Y. et al. Локализация электронов, вызванная легирующей примесью, приводит к восстановлению CO 2 до углеводородов C 2 . Нац. хим. 10 , 974–980 (2018).
КАС пабмед Статья Google ученый
Чжао, К., Мартирес, Дж. М. П. и Картер, Э. А. Новый взгляд на электрохимический CO 2 восстановление на Cu(111): конкурирующие механизмы реакции переноса электрона, связанные с протонами, выявленные с помощью встроенной теории коррелированных волновых функций. Дж. Ам. хим. соц. 143 , 6152–6164 (2021).
КАС пабмед Статья Google ученый
Li, X., Wang, S., Li, L., Sun, Y. & Xie, Y.
 Прогресс и перспективы in situ исследований сокращения CO 2 . Дж. Ам. хим. соц. 142 , 9567–9581 (2020).
Прогресс и перспективы in situ исследований сокращения CO 2 . Дж. Ам. хим. соц. 142 , 9567–9581 (2020).КАС пабмед Google ученый
Ван, В.-Н. и другие. Размер и структура имеют значение: повышенная эффективность фотовосстановления CO 2 за счет сверхмелких наночастиц Pt с разрешением по размеру на монокристаллах TiO 2 . Дж. Ам. хим. соц. 134 , 11276–11281 (2012).
КАС пабмед Статья Google ученый
Li, J. et al. Межфазная инженерия нанопроволок Bi 19 Br 3 S 27 повышает металлическую фотокаталитическую восстановительную активность CO 2 под действием ближнего инфракрасного излучения. Дж. Ам. хим. соц. 143 , 6551–6559 (2021).
КАС пабмед Статья Google ученый
“>Леунг, К., Нильсен, И. М. Б., Сай, Н., Медфорт, К. и Шелнутт, Дж. А. Кобальт-порфириновое катализируемое электрохимическое восстановление диоксида углерода в воде. 2. Механизм первого Принц. Дж. Физ. хим. А 114 , 10174–10184 (2010).
КАС Статья Google ученый
Wang, X. et al. Стратегия захвата протона для усиления электрохимического восстановления CO 2 на атомарно-дисперсных активных центрах металл-азот. Анжю. хим. Междунар. Эд. 133 , 12066–12072 (2021).
Артикул ОБЪЯВЛЕНИЯ Google ученый
“>Бонетто, Р., Крисанти, Ф. и Сарторел, А. Восстановление двуокиси углерода, опосредованное железными катализаторами: механизм и промежуточные продукты, определяющие селективность. САУ Омега 5 , 21309–21319 (2020).
КАС пабмед ПабМед Центральный Статья Google ученый
Чжу, Х.-Дж. и другие. Эффективная передача электронов в нанолистах ковалентного органического каркаса для высокоактивного электрокаталитического восстановления диоксида углерода. Нац. коммун. 11 , 497 (2020).
КАС пабмед ПабМед Центральный Статья ОБЪЯВЛЕНИЯ Google ученый
“>Wei, Q. et al. Признание воздействия воды на усиление взаимодействия между катализатором и реагентом при окислении спирта. Дж. Ам. хим. соц. 143 , 6071–6078 (2021).
КАС пабмед Статья Google ученый
Койшибай А. и Шанц Д. Ф. Вода Является источником кислорода для метанола, получаемого при парциальном окислении метана в проточном реакторе на Cu-SSZ-13. Дж. Ам. хим. соц. 142 , 11962–11966 (2020).
КАС пабмед Статья Google ученый
Лю, З. и др. Промотируемые водой межфазные пути окисления метана в метанол на катализаторе CeO 2 /Cu 2 O.
 Наука 368 , 513–517 (2020).
Наука 368 , 513–517 (2020).КАС пабмед Статья ОБЪЯВЛЕНИЯ Google ученый
Rawool, S.A. et al. Прямое улавливание CO 2 и его преобразование в топливо на наночастицах магния в условиях окружающей среды просто с использованием воды. Хим. науч. 12 , 5774–5786 (2021).
КАС пабмед ПабМед Центральный Статья Google ученый
Ян П.-П. и другие. Защита степени окисления меди посредством промежуточного удержания для селективного электровосстановления CO 2 до топлива C 2+ . Дж. Ам. хим. соц. 142 , 6400–6408 (2020).
КАС пабмед Статья Google ученый
Wang, W. et al. Фотокаталитическое сочетание C – C в результате восстановления диоксида углерода на оксиде меди с медью (I) / медью (II) смешанной валентности.
 г. Дж. Ам. хим. соц. 143 , 2984–2993 (2021).
г. Дж. Ам. хим. соц. 143 , 2984–2993 (2021).КАС пабмед Статья Google ученый
Чоу Т.-К. и другие. Контроль степени окисления медного электрода и промежуточных продуктов электрохимического восстановления СО 2 до этилена. Дж. Ам. хим. соц. 142 , 2857–2867 (2020).
КАС пабмед Статья Google ученый
Ву, З.-З., Гао, Ф.-Ю. и Гао, М.-Р. Регулирование степени окисления наноматериалов для электрокаталитического восстановления CO 2 . Энерг. Окружающая среда. науч. 14 , 1121–1139 (2021).
КАС Статья Google ученый
Крефт, С. и др. Повышение селективности и активности фотокатализаторов восстановления СО 2 кислородом. Химия 5 , 1818–1833 (2019).

КАС Статья Google ученый
He, Q. et al. Быстрый скрининг промежуточных соединений меди в катализируемом Cu(I) азид-алкиновом циклоприсоединении с использованием модифицированной платформы ICP-MS/MS. Хим. коммун. 52 , 10501–10504 (2016).
КАС Статья Google ученый
He, Q. et al. Быстрый скрининг газообразных катализаторов активации метана с использованием ICP-QQQ-MS. Дж. Анал. В. Спектр. 33 , 563–568 (2018).
КАС Статья Google ученый
Суда, Р., Каванова, Х., Кондо, М. и Гото, Ю. Изучение водородных связей между водой и метанолом с помощью масс-спектрометрии вторичных ионов с программируемой температурой. J. Chem. физ. 119 , 6194–6200 (2003 г.).
КАС Статья ОБЪЯВЛЕНИЯ Google ученый
“>Хантал, Г., Терлецкий, П., Хорваи, Г., Нюласи, Л. и Едловски, П. Свойства молекулярного уровня границы раздела вода-дихлорметан жидкость/жидкость, как видно из моделирования молекулярной динамики и идентификации действительно межфазный молекулярный анализ. г. J. Phys. хим. C. 113 , 19263–19276 (2009).
КАС Статья Google ученый
Гопи, Р., Раманатан, Н. и Сундарараджан, К. Взаимодействие водородной связи ацетонитрила и воды: инфракрасная изоляция матрицы и расчет ab initio. Дж. Мол. Структура 1094 , 118–129 (2015).

КАС Статья ОБЪЯВЛЕНИЯ Google ученый
Финнеран, И. А., Кэрролл, П. Б., Аллоди, М. А. и Блейк, Г. А. Водородные связи в димере этанол-вода. Физ. хим. хим. физ. 17 , 24210–24214 (2015).
КАС пабмед Статья Google ученый
Dawes, A. et al. Исследование взаимодействия твердого бензола с водой с помощью вакуумной ультрафиолетовой и инфракрасной спектроскопии. Физ. хим. хим. физ. 20 , 15273–15287 (2018).
КАС пабмед Статья Google ученый
Мишулье, Э. и др. Возмущение поверхности аморфной твердой воды адсорбцией полициклических ароматических углеводородов. J. Phys. хим. C. 124 , 2994–3001 (2020).
КАС Статья Google ученый
“>Юань, X. и др. Ультратонкие оболочки Pd–Au с контролируемой степенью легирования нанокубов pd в сторону снижения содержания углекислого газа. Дж. Ам. хим. соц. 141 , 4791–4794 (2019).
КАС пабмед Статья Google ученый
Сасаки М., Татибана Ю. и Фуджинака Ю. Каталитическая активность Н 2 O/CO 2 система при разложении лигноцеллюлозного материала. Индивидуальный инж. хим. Рез. 58 , 9239–9245 (2019).
КАС Статья Google ученый
“>Tossell, J. A. H 2 CO 3 (s): Новый кандидат на CO 2 захват и изоляция. Окружающая среда. науч. Технол. 43 , 2575–2580 (2009).
КАС пабмед Статья ОБЪЯВЛЕНИЯ Google ученый
Чжао, Дж. и др. Обзор гетерогенных электрокатализаторов на основе Cu для восстановления CO 2 . Дж. Матер. хим. А 8 , 4700–4734 (2020).
КАС Статья Google ученый
Веласко-Велес, Х.-Х. и другие. Роль степени окисления меди в электрокаталитическом восстановлении СО 2 до ценных углеводородов.
 ACS Sustain. хим. англ. 7 , 1485–1492 (2019).
ACS Sustain. хим. англ. 7 , 1485–1492 (2019).Артикул КАС Google ученый
Лян З.-К. и другие. Нитрид меди усиливает стабильный электросинтез многоуглеродных продуктов из CO 2 . Нац. коммун. 9 , 3828 (2018).
ПабМед ПабМед Центральный Статья ОБЪЯВЛЕНИЯ КАС Google ученый
Мистри, Х. и др. Высокоселективные плазменно-активируемые медные катализаторы восстановления диоксида углерода до этилена. Нац. коммун. 7 , 12123 (2016).
ПабМед ПабМед Центральный Статья ОБЪЯВЛЕНИЯ КАС Google ученый
Де Луна, П. и др. Электроосаждение катализатора контролирует морфологию и степень окисления для селективного восстановления диоксида углерода. Нац.
 Катал. 1 , 103–110 (2018).
Катал. 1 , 103–110 (2018).Артикул КАС Google ученый
Frisch, M.J. et al. Gaussian 09 Rev. B.01 (Gaussian, Inc., Уоллингфорд, Коннектикут, США, 2010 г.).
Гримм, С. Полуэмпирический гибридный функционал плотности с пертурбативной корреляцией второго порядка. J. Chem. физ. 124 , 034108 (2006 г.).
ПабМед Статья ОБЪЯВЛЕНИЯ КАС Google ученый
Петерсон, К. А. и Пузарини, К. Систематически конвергентные базисные наборы для переходных металлов. II. Основанные на псевдопотенциале корреляционные согласованные базисные наборы для элементов группы 11 (Cu, Ag, Au) и 12 (Zn, Cd, Hg). Теор. хим. Акк. 114 , 283–296 (2005).
КАС Статья Google ученый
“>Трухлар Д. Г. и Гордон М. С. От силовых полей к динамике: классические и квантовые пути. Наука 249 , 491–498 (1990).
КАС пабмед Статья ОБЪЯВЛЕНИЯ Google ученый
Гонсалес, К. и Шлегель, Х. Б. Следование пути реакции во внутренних координатах, взвешенных по массе. J. Phys. хим. 94 , 5523–5527 (1990).
КАС Статья Google ученый
Фукуи, К. Путь химических реакций – подход IRC. Согл. хим. Рез. 14 , 363–368 (1981).
КАС Статья Google ученый
“>
Marcandalli, G., Goyal, A. & Koper, M.T.M. Влияние электролита на фарадеевскую эффективность восстановления CO 2 до CO на золотом электроде. ACS Катал. 11 , 4936–4945 (2021).
КАС пабмед ПабМед Центральный Статья Google ученый
Хоу, В. и др. Фотокаталитическая конверсия CO 2 в углеводородное топливо посредством плазмонно-усиленного поглощения и металлических межзонных переходов. ACS Катал. 1 , 929–936 (2011).
КАС Статья Google ученый
Чой, К. М. и др. Плазмонно-усиленная фотокаталитическая конверсия CO 2 в металлоорганических каркасах в видимом свете. Дж. Ам. хим. соц. 139 , 356–362 (2017).
КАС пабмед Статья Google ученый
Guo, W. et al. Атомарно-индиевые катализаторы переключения CO 2 продукты электровосстановления из формиата в CO. J. Am. хим. соц. 143 , 6877–6885 (2021).
КАС пабмед Статья Google ученый
Лин С.-К. и другие. Рентгеновская абсорбционная спектроскопия с временным разрешением Operando раскрывает химическую природу высокоселективного CO 2 сокращение. Нац. коммун. 11 , 3525 (2020).
КАС пабмед ПабМед Центральный Статья ОБЪЯВЛЕНИЯ Google ученый
Bendavid, L. I. & Carter, E. A. CO 2 адсорбция на Cu 2 O(111): исследование DFT+U и DFT. J. Phys. хим. С. 117 , 26048–26059 (2013).
КАС Статья Google ученый
Gawande, M.B. et al. Cu и наночастицы на основе Cu: синтез и применение в катализе. хим. 116 , 3722–3811 (2016).
КАС пабмед Статья Google ученый
Ra, E.C. et al. Рециркуляция диоксида углерода посредством каталитического гидрирования: последние ключевые разработки и перспективы. САУ Катал. 10 , 11318–11345 (2020).
КАС Статья Google ученый
Буркарт, М. Д., Хазари, Н., Твей, К. Л. и Цейтлер, Э. Л. Возможности и проблемы катализа при использовании диоксида углерода. САУ Катал. 9 , 7937–7956 (2019).
КАС Статья Google ученый
Francke, R., Schille, B. & Roemelt, M. Гомогенно-катализируемое электровосстановление диоксида углерода – методы, механизмы и катализаторы. хим. Ред. 118 , 4631–4701 (2018).
КАС пабмед Статья Google ученый
Фёрингер-Мартинес, Э. и др. Динамика водородных связей перегретой воды и метанола с помощью сверхбыстрой ИК-накачки и ЭУФ-фотоэлектронной зондовой спектроскопии. Физ. хим. хим. физ. 16 , 19365–19375 (2014).
ПабМед Статья КАС Google ученый
Queiroz, M.H., Alves, T.V. & Rivelino, R. Теоретический скрининг взаимодействия OH···π между водой и бензолом с использованием подходов, основанных на функционале плотности: эффекты нелокального обмена и поправки на дальнюю дисперсию в истинной минимум. Вычисл. Теор. хим. 1206 , 113464 (2021).
КАС Статья Google ученый
Stirling, A. & Pápai, I. H 2 CO 3 образуется через HCO 3 − в воде. J. Phys. хим. B 114 , 16854–16859 (2010).
КАС пабмед Статья Google ученый
Dunning, TH Jr Базисные наборы Гаусса для использования в коррелированных молекулярных расчетах. I. Атомы бора через неон и водород. J. Chem. физ. 90 , 1007–1023 (1989).
КАС Статья ОБЪЯВЛЕНИЯ Google ученый
Фукуи, К. Формулировка координаты реакции. J. Phys. хим. 74 , 4161–4163 (1970).
КАС Статья Google ученый
Скачать ссылки
Благодарности
Авторы благодарят профессора Р. Заре из Стэнфордского университета, профессора Д. Ли из Китайского университета трех ущелий и профессора Ю. Лан из Нанкинского педагогического университета за ценные предложения, а также доктора Л. Дин из Сианьского университета Шию за проведение экспериментов по реакции обратного конверсии водяного газа. З.З. благодарит Национальный фонд естественных наук Китая за проект 21777128, Программу фундаментальных исследований естественных наук китайской провинции Шэньси за проект 2019JC-33 и Молодежной инновационной группы университетов Шэньси для проекта Z19257. Ю.З. благодарит Программу фундаментальных исследований в области естественных наук китайской провинции Шэньси за проект 2021GY-247.
Информация об авторе
Примечания автора
Эти авторы внесли равный вклад: Yajun Zheng, Hedan Yao, Ruinan Di.

Авторы и организации
Школа химии и химической инженерии, Сианьский университет Шию, Сиань, 710065, Китай
Yajun Zheng, Hedan Yao, Zhicheng Xiang, Fangfang Lu, Yu Li & Zhiping Zhang
School of Chemistry and Molecular Engineering, Nanjing Tech University, Nanjing, 211816, China
Ruinan Di & Qiang Wang
Школа химии и химического машиностроения Южно-Китайского технологического университета, Гуанчжоу, 510641, Китай
Гуансин Ян
Китайская академия инспекции и карантина, Пекин, 100176, Китай
Qiang Ma
Авторы
- Yajun Zheng
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Hedan Yao
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Ruinan Di
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Академия
- Zhicheng Xiang
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Qiang Wang
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Fangfang Lu
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Yu Li
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Guangxing Yang
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Qiang Ma
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Zhiping Zhang
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
Contributions
Z. Z., Y.Z., Q.W. и G.Y. разработал первоначальную концепцию работы, З.З. и Ю.З. разработали эксперименты, Х.Ю., Р.Д., З.Х., Ф.Л., Г.Ю. и Ю.Л. провел эксперименты и проанализировал данные. З.З., К.В., Ю.З., Г.Ю. и К.М. соавтором рукописи. Все авторы обсуждали результаты и комментировали рукопись на всех этапах.
Z., Y.Z., Q.W. и G.Y. разработал первоначальную концепцию работы, З.З. и Ю.З. разработали эксперименты, Х.Ю., Р.Д., З.Х., Ф.Л., Г.Ю. и Ю.Л. провел эксперименты и проанализировал данные. З.З., К.В., Ю.З., Г.Ю. и К.М. соавтором рукописи. Все авторы обсуждали результаты и комментировали рукопись на всех этапах.
Авторы, переписывающиеся
Соответствие Цян Ван, Гуансин Ян или Чжипин Чжан.
Заявление об этике
Конкурирующие интересы
Авторы не заявляют об отсутствии конкурирующих интересов.
Рецензирование
Информация о рецензировании
Nature Communications благодарит Казухиро Таканабе, Алимохаммада Бахманпура и другого анонимного рецензента за их вклад в рецензирование этой работы. Доступны отчеты рецензентов.
Дополнительная информация
Примечание издателя Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Дополнительная информация
Дополнительная информация
Файл рецензирования
исходные данные
исходные данные
Права и разрешения. , который разрешает использование, совместное использование, адаптацию, распространение и воспроизведение на любом носителе или в любом формате, при условии, что вы укажете первоначальных авторов и источник, предоставите ссылку на лицензию Creative Commons и укажете, были ли внесены изменения. сделанный. Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons для статьи, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.
 0/.
0/.Перепечатка и разрешения
Об этой статье
Комментарии
Отправляя комментарий, вы соглашаетесь соблюдать наши Условия и правила сообщества. Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Двуокись углерода в качестве исходного сырья — управление выбросами углерода
Кэрол Кройц и Эцуко Фуджита
Брукхейвенская национальная лаборатория
Эта глава представляет собой обзор двуокиси углерода в качестве исходного материала для органического синтеза, представляющего потенциальный коммерческий интерес, и использования двуокиси углерода в качестве субстрата для производства топлива. Он широко опирается на литературные источники, 1 , 2 и 3 , в частности отчет о семинаре 1999 г. по теме катализа в CO 2 использование, 1 , но с акцентом на системы, представляющие наибольший интерес для нас.
Атмосферный диоксид углерода является обильным (750 миллиардов тонн углерода в атмосфере), но разбавленным источником углерода (всего 0,036% по объему), 3 , поэтому технологии утилизации в источнике производства имеют решающее значение как для секвестрации, так и для утилизации. Секвестрация — например, откачка CO 2 в моря или на землю — выходит за рамки этой главы, за исключением случаев, когда он пересекается с использованием — например, при преобразовании CO 2 в полимеры. Тем не менее секвестрация доминирует в современных представлениях о краткосрочных решениях проблемы глобального потепления, как должно быть ясно из докладов этого и других семинаров. 4 , 5 Чистый антропогенный прирост в 13 000 миллионов тонн двуокиси углерода, который, по оценкам, ежегодно добавляется в атмосферу в настоящее время, можно сравнить со 110 миллионами тонн CO 2 используется для производства химикатов, в основном мочевины (75 миллионов тонн CO 2 ), салициловой кислоты, циклических карбонатов и поликарбонатов. 1 Более широкое использование CO 2 в качестве исходного материала, однако, весьма желательно, поскольку это недорогой, нетоксичный исходный материал. В настоящее время предпринимаются попытки заменить фосген в качестве исходного материала. 6 Создание новых материалов и рынков для них увеличит это использование, оказывая все более положительное, хотя и относительно небольшое, воздействие на глобальный выброс CO 2 уровня. Другими интересными видами применения являются использование в качестве растворителя и для производства топлива, и они обсуждаются по очереди.
1 Более широкое использование CO 2 в качестве исходного материала, однако, весьма желательно, поскольку это недорогой, нетоксичный исходный материал. В настоящее время предпринимаются попытки заменить фосген в качестве исходного материала. 6 Создание новых материалов и рынков для них увеличит это использование, оказывая все более положительное, хотя и относительно небольшое, воздействие на глобальный выброс CO 2 уровня. Другими интересными видами применения являются использование в качестве растворителя и для производства топлива, и они обсуждаются по очереди.
ОСНОВНЫЕ ТЕКУЩИЕ ПРИМЕНЕНИЯ ДВУОКИСИ УГЛЕРОДА
Синтез мочевины в настоящее время является самым распространенным применением двуокиси углерода в органическом синтезе. Мочевина, C(O)(NH 2 ) 2 , является самым важным азотным удобрением в мире. Мочевина также является промежуточным звеном в органическом синтезе, таком как производство меламина и мочевинных смол, которые используются в качестве клеев и связующих веществ. Углекислый газ также используется для производства салициловой кислоты, которая содержится в фармацевтике, и циклических органических карбонатов, высокоплавких, но чрезвычайно высококипящих растворителей для природных и синтетических полимеров, таких как лигнин, целлюлоза, нейлон и поливинилхлорид (). Последние широко используются в производстве полиакриловых волокон и красок. Этилен- и пропиленкарбонаты имеют множество применений в химическом синтезе, в том числе реакции с аммиаком и аминами с образованием карбаматов и последующие реакции с диаминами с образованием ди(гидроксиэтил)карбаматов, которые могут в дальнейшем реагировать с мочевиной с образованием полиуретанов.
Углекислый газ также используется для производства салициловой кислоты, которая содержится в фармацевтике, и циклических органических карбонатов, высокоплавких, но чрезвычайно высококипящих растворителей для природных и синтетических полимеров, таких как лигнин, целлюлоза, нейлон и поливинилхлорид (). Последние широко используются в производстве полиакриловых волокон и красок. Этилен- и пропиленкарбонаты имеют множество применений в химическом синтезе, в том числе реакции с аммиаком и аминами с образованием карбаматов и последующие реакции с диаминами с образованием ди(гидроксиэтил)карбаматов, которые могут в дальнейшем реагировать с мочевиной с образованием полиуретанов.
РИСУНОК 5.1
Примеры реакций с участием диоксида углерода, приводящих к промежуточным продуктам в промышленном синтезе. Вверху: реакция диоксида углерода с фенолятом натрия с образованием салицилата натрия. Внизу: Реакция двуокиси углерода с эпоксидом с образованием (подробнее…)
дает общее представление о текущем и прогнозируемом использовании двуокиси углерода. Реакции, в которых используется CO 2 для производства органических химикатов или промежуточных продуктов для химической промышленности, суммированы на диаграмме с 6 до 11 часов. Первые примеры, такие как салициловая кислота, используются в современной практике. Сюда также включены реакции, которые обещают широкое использование в будущем. Многие из них связаны с введением углекислого газа в связи Y—X, часто в связь C—H. Интересующие продукты включают сложные эфиры, сложные эфиры карбаминовой кислоты, салициловую кислоту и циклические карбонаты. Эти реакции обычно включают формальное внедрение диоксида углерода в связь X—H, как и в связь NH при образовании мочевины. Новые вставки, находящиеся в стадии активного изучения, включают в себя включение CO 2 в полимеры — поликарбонаты, полипироны, промежуточные лактоны и полиуретаны. Особый интерес представляет включение диоксида углерода в полимеры, активная область исследований, которая очень многообещающа для будущих применений.
Реакции, в которых используется CO 2 для производства органических химикатов или промежуточных продуктов для химической промышленности, суммированы на диаграмме с 6 до 11 часов. Первые примеры, такие как салициловая кислота, используются в современной практике. Сюда также включены реакции, которые обещают широкое использование в будущем. Многие из них связаны с введением углекислого газа в связи Y—X, часто в связь C—H. Интересующие продукты включают сложные эфиры, сложные эфиры карбаминовой кислоты, салициловую кислоту и циклические карбонаты. Эти реакции обычно включают формальное внедрение диоксида углерода в связь X—H, как и в связь NH при образовании мочевины. Новые вставки, находящиеся в стадии активного изучения, включают в себя включение CO 2 в полимеры — поликарбонаты, полипироны, промежуточные лактоны и полиуретаны. Особый интерес представляет включение диоксида углерода в полимеры, активная область исследований, которая очень многообещающа для будущих применений. 1 , 7 Однако влияние новых материалов и процессов в этой области в конечном счете будет зависеть от рыночных сил, фактор, который может разочаровать исследователей. Другие реакции, показанные на рис., – это реакции гидрирования с 2 до 6 часов, а с 12 до 2 часов – реакции гидрирования, осуществляемые электронами и протонами, – обе направлены на образование топлива.
1 , 7 Однако влияние новых материалов и процессов в этой области в конечном счете будет зависеть от рыночных сил, фактор, который может разочаровать исследователей. Другие реакции, показанные на рис., – это реакции гидрирования с 2 до 6 часов, а с 12 до 2 часов – реакции гидрирования, осуществляемые электронами и протонами, – обе направлены на образование топлива.
РИСУНОК 5.2
Использование CO 2 в синтетической химии. ИСТОЧНИК: Ареста (1998). 6
Двуокись углерода как растворитель
Сверхкритическая двуокись углерода представляет собой гидрофобный растворитель, который может заменить органические растворители в ряде применений. Его критическая температура составляет 31 ° C, и он имеет очень низкую вязкость. Когда органический растворитель заменяется диоксидом углерода, стоимость растворителя и выброс токсичных органических веществ могут быть снижены. Кроме того, разделением продуктов и катализатора можно легко управлять, изменяя давление диоксида углерода. В настоящее время сверхкритический диоксид углерода используется для экстракции кофеина, химической чистки и обезжиривания деталей. В этих процессах могут участвовать установки большой производительности более 22,5×10 6 кг в год в случае процессов декофеинизации. 8 Потенциальные будущие или разрабатываемые приложения включают использование в пищевой и фармацевтической промышленности для покрытия будущих расходов, производство фармацевтических наночастиц для инъекций, полимеризация, 9 эмульсионная полимеризация водорастворимых мономеров, повышение нефтеотдачи и гомогенизация 10 фазораздельный катализ, в том числе на основе ионных жидких растворителей. 11
В настоящее время сверхкритический диоксид углерода используется для экстракции кофеина, химической чистки и обезжиривания деталей. В этих процессах могут участвовать установки большой производительности более 22,5×10 6 кг в год в случае процессов декофеинизации. 8 Потенциальные будущие или разрабатываемые приложения включают использование в пищевой и фармацевтической промышленности для покрытия будущих расходов, производство фармацевтических наночастиц для инъекций, полимеризация, 9 эмульсионная полимеризация водорастворимых мономеров, повышение нефтеотдачи и гомогенизация 10 фазораздельный катализ, в том числе на основе ионных жидких растворителей. 11
РЕАКЦИОННАЯ СПОСОБНОСТЬ ДВУОКИСИ УГЛЕРОДА
Двуокись углерода представляет собой линейную молекулу, в которой атомы кислорода являются слабыми основаниями Льюиса (и Бренстеда), а углерод является электрофильным. В реакциях двуокиси углерода преобладают нуклеофильные атаки на углерод, что приводит к изгибу угла O—C—O примерно до 120°. иллюстрирует четыре очень разные нуклеофильные реакции: атака гидроксида на CO 2 с образованием бикарбоната; первоначальное добавление аммиака к CO 2 , что в конечном итоге приводит к образованию мочевины; связывание CO 2 в макроциклический комплекс кобальта(I), который катализирует восстановление CO 2 ; 12 , 13 и добавление электрона к CO 2 с получением ион-радикала диоксида углерода. Первые три также иллюстрируют реакционную способность CO 2 в отношении нуклеофильной атаки на углерод.
иллюстрирует четыре очень разные нуклеофильные реакции: атака гидроксида на CO 2 с образованием бикарбоната; первоначальное добавление аммиака к CO 2 , что в конечном итоге приводит к образованию мочевины; связывание CO 2 в макроциклический комплекс кобальта(I), который катализирует восстановление CO 2 ; 12 , 13 и добавление электрона к CO 2 с получением ион-радикала диоксида углерода. Первые три также иллюстрируют реакционную способность CO 2 в отношении нуклеофильной атаки на углерод.
РИСУНОК 5.3
В реакциях с двуокисью углерода преобладают нуклеофильные атаки на атом углерода.
Термодинамические барьеры для использования CO2
Углекислый газ — очень стабильная молекула, и, соответственно, для осуществления желаемого превращения обычно требуется подача энергии. Высокие температуры, чрезвычайно реактивные реагенты, электричество или энергия фотонов могут использоваться для проведения реакций с углекислым газом.
обозначает реакции, в которых источник энергии является возобновляемым или ядерным. («Возобновляемые» относятся к солнечным электрическим, ветровым, гидроэлектрическим, геотермальным, солнечным тепловым источникам и источникам энергии на основе биомассы.) Реакция CH 4 + CO 2 = 2 CO + 2 H 2 называется углекислотным риформингом метана. Эта реакция в сочетании с производством металла на месте с использованием солнечных печей для достижения необходимых высоких температур (например, 1200 °C) может быть использована для значительного снижения выбросов CO 2 , образующихся в цементе, извести и металле (железо, алюминий). ) производство, которое составляет около 10% от общего количества CO 2 , выбрасываемого ежегодно. 3 Для электрохимического восстановления CO 2 к метану, энергия может быть получена от солнечной батареи или ядерной энергии. Восстановление также может быть достигнуто фотохимически с использованием красителя для поглощения видимого света, поскольку сам CO 2 этого не делает. Интересно, что при вакуумном ультрафиолетовом (ВУФ) облучении углекислого газа образуются кислород и окись углерода.
Интересно, что при вакуумном ультрафиолетовом (ВУФ) облучении углекислого газа образуются кислород и окись углерода.
РИСУНОК 5.4
Преодоление термодинамических барьеров на пути утилизации CO 2 .
Конверсия диоксида углерода в топливо
Прямое гидрирование
При наличии обильных возобновляемых источников энергии двуокись углерода может быть преобразована в топливо путем восстановления до метанола или метана. Высокая плотность энергии топлива на основе углерода и его доступность в виде газа, жидкости или твердого вещества являются важными причинами доминирующего положения ископаемого топлива на современном рынке. Поскольку ценность топлива основана на его энергетическом содержании и простоте транспортировки и хранения, метан менее желателен, чем метанол, из-за его низкой плотности топлива и высокой стоимости транспортировки. Сегодня углекислый газ является побочным продуктом использования топлива, а не сырьем для производства топлива. Конверсия СО 2 к топливу с использованием возобновляемой или ядерной энергии не производит чистых выбросов двуокиси углерода (за исключением CO 2 , образующегося в результате потребления энергии в процессе восстановления), и это дополнит возобновляемое производство топлива из биомассы, которое, вероятно, будет недостаточно для удовлетворения будущих мировых потребностей. Катализ может играть важную роль в этой области. Цель такого производства топлива состоит в том, чтобы разработать стратегии сокращения CO 2 , которые можно было бы адаптировать для использования в различных источниках и производить топливные продукты, широко используемые с текущими и будущими технологиями.
Конверсия СО 2 к топливу с использованием возобновляемой или ядерной энергии не производит чистых выбросов двуокиси углерода (за исключением CO 2 , образующегося в результате потребления энергии в процессе восстановления), и это дополнит возобновляемое производство топлива из биомассы, которое, вероятно, будет недостаточно для удовлетворения будущих мировых потребностей. Катализ может играть важную роль в этой области. Цель такого производства топлива состоит в том, чтобы разработать стратегии сокращения CO 2 , которые можно было бы адаптировать для использования в различных источниках и производить топливные продукты, широко используемые с текущими и будущими технологиями.
Гидрирование диоксида углерода в метанол несколько экзэргонично, а в метан в большей степени из-за благоприятной термодинамики образования воды (см. ).
РИСУНОК 5.5
Гидрирование диоксида углерода в метанол и метан.
Катализ гидрирования, приводящий к N, N -диметилформамиду (ДМФ), формиату и углеводородам, успешно решается. 10 , 14 Восстановление до моноксида углерода также полезно, когда смеси CO с водородом могут использоваться для увеличения сырья в промышленных процессах, таких как производство этилена и метанола. Метанол, низшие углеводороды (метан, этан, этилен и др.), СО и муравьиная кислота (НСООН) были получены из СО 2 и H 2 с использованием нескольких различных катализаторов на основе металлов и оксидов металлов при повышенных температуре и давлении. 15 Селективность и каталитическая активность зависят от используемого катализатора (например, металла или оксида металла), его размера, добавок, носителя, температуры, соотношения CO 2 и H 2 и давления. Медь на оксиде цинка (ZnO), по-видимому, является наиболее активным катализатором производства метанола. 15 , 16 В НИИ Инновационных Технологий Земли построена малотоннажная испытательная установка производительностью 50 кг метанола в сутки для проверки работоспособности многокомпонентного катализатор (Cu/ZnO/ZrO 2 /Al 2 O 3 /Ga 2 O 3 ) в практических условиях.
10 , 14 Восстановление до моноксида углерода также полезно, когда смеси CO с водородом могут использоваться для увеличения сырья в промышленных процессах, таких как производство этилена и метанола. Метанол, низшие углеводороды (метан, этан, этилен и др.), СО и муравьиная кислота (НСООН) были получены из СО 2 и H 2 с использованием нескольких различных катализаторов на основе металлов и оксидов металлов при повышенных температуре и давлении. 15 Селективность и каталитическая активность зависят от используемого катализатора (например, металла или оксида металла), его размера, добавок, носителя, температуры, соотношения CO 2 и H 2 и давления. Медь на оксиде цинка (ZnO), по-видимому, является наиболее активным катализатором производства метанола. 15 , 16 В НИИ Инновационных Технологий Земли построена малотоннажная испытательная установка производительностью 50 кг метанола в сутки для проверки работоспособности многокомпонентного катализатор (Cu/ZnO/ZrO 2 /Al 2 O 3 /Ga 2 O 3 ) в практических условиях. 17 Было обнаружено, что селективность производства метанола очень высока, и прямое производство метанола из CO 2 может быть коммерчески осуществимым с использованием недорогого источника водорода. 17 Однако использование водорода для этой восстановительной химии в настоящее время не является экономически привлекательным из-за его стоимости; недорогое производство водорода с помощью солнечных или ядерных источников энергии может радикально изменить этот сценарий.
17 Было обнаружено, что селективность производства метанола очень высока, и прямое производство метанола из CO 2 может быть коммерчески осуществимым с использованием недорогого источника водорода. 17 Однако использование водорода для этой восстановительной химии в настоящее время не является экономически привлекательным из-за его стоимости; недорогое производство водорода с помощью солнечных или ядерных источников энергии может радикально изменить этот сценарий.
Непрямое гидрирование
Водород может быть заменен электронами и протонами, доступными, например, при электрохимическом восстановлении в водных средах (). Одноэлектронное восстановление диоксида углерода до анион-радикала CO 2 представляет собой термодинамические и кинетические барьеры. В водном растворе потенциал восстановления составляет -1,9 В по сравнению со стандартным водородным электродом (SHE). 18 Барьер для переноса электронов во внешнюю сферу для пары велик из-за очень разных геометрий линейного нейтрального углекислого газа и изогнутого анион-радикала. 19 Таким образом, прямое (некаталитическое) электровосстановление требует значительного перенапряжения. Как показано на рисунке, термодинамические барьеры уменьшаются за счет протонирования продукта восстановления. 13 , 20 Однако из-за того, что водородный потенциал почти эквивалентен потенциалу протонно-стимулированного гидрирования CO 2 , восстановление H + или H 2 O до H 2 также может появиться в зависимости от системы.
19 Таким образом, прямое (некаталитическое) электровосстановление требует значительного перенапряжения. Как показано на рисунке, термодинамические барьеры уменьшаются за счет протонирования продукта восстановления. 13 , 20 Однако из-за того, что водородный потенциал почти эквивалентен потенциалу протонно-стимулированного гидрирования CO 2 , восстановление H + или H 2 O до H 2 также может появиться в зависимости от системы.
РИСУНОК 5.6
Термодинамические и кинетические аспекты восстановления CO 2 . ИСТОЧНИК: Сутин и др. (1997), Фудзита (1999).
Электрохимическое восстановление
Как отмечалось ранее, прямое электровосстановление достигается при высоком перенапряжении. Нереакционноспособный металлический или углеродный электрод образует анион-радикал диоксида углерода, который может подвергаться димеризации с образованием оксалата или диспропорционированию с образованием монооксида углерода и карбоната. 21 Напротив, небезопасные металлы через активные центры на своей поверхности могут направлять CO 2 восстановление до гидрированных продуктов при гораздо более низком приложенном напряжении из-за высокой эффективности гетерогенного катализа. Особого внимания заслуживает работа Hori, 22 , которая показала, что медь производит высокие выходы метана из водного бикарбоната при 0°C и высокие выходы этилена при 45°C. В этих системах металл выполняет двоякую роль, доставляя электроны и стабилизируя восстановленные фрагменты. Считается, что в случае меди восстановление включает последовательность, показанную на рис. Металлы рутений, кадмий, ртуть, индий, олово и свинец дают формиат; золото, серебро и цинк дают CO; в то время как алюминий, галлий, платина, железо, никель и титан проявляют небольшую активность. 3 Другими важными областями электрохимического восстановления являются гомогенный катализ, поверхностная модификация «молекулярным» катализатором и фотоэлектрохимические системы.
21 Напротив, небезопасные металлы через активные центры на своей поверхности могут направлять CO 2 восстановление до гидрированных продуктов при гораздо более низком приложенном напряжении из-за высокой эффективности гетерогенного катализа. Особого внимания заслуживает работа Hori, 22 , которая показала, что медь производит высокие выходы метана из водного бикарбоната при 0°C и высокие выходы этилена при 45°C. В этих системах металл выполняет двоякую роль, доставляя электроны и стабилизируя восстановленные фрагменты. Считается, что в случае меди восстановление включает последовательность, показанную на рис. Металлы рутений, кадмий, ртуть, индий, олово и свинец дают формиат; золото, серебро и цинк дают CO; в то время как алюминий, галлий, платина, железо, никель и титан проявляют небольшую активность. 3 Другими важными областями электрохимического восстановления являются гомогенный катализ, поверхностная модификация «молекулярным» катализатором и фотоэлектрохимические системы.
РИСУНОК 5.7
Последовательность электрохимического восстановления CO 2 медью с образованием метана.
Гомогенный катализ восстановления диоксида углерода
Гомогенные катализаторы могут выполнять роль поверхностных металлических каталитических центров в вышеуказанных системах (например, медь). Гомогенный катализ важен в системах электрохимического восстановления, а также в фотохимических системах. Действительно, эти два подхода имеют много общих черт, как будет показано ниже.
Катализаторы снижают перенапряжение для восстановления CO 2 путем восстановления при потенциале ( E cat ), менее отрицательном, чем для прямого восстановления CO 2 , связывания CO 2 или повторного восстановления при (или более положительный, чем) E cat . Для гомогенного катализа чаще всего наблюдается двухэлектронное восстановление 21 с образованием CO, HCO 2 – или C 2 O 4 2- , и могут потребоваться дополнительные источники протонов.
РИСУНОК 5.8 Способы связывания диоксида углерода с центрами переходных металлов
Катализ переходных металлов
Связывание диоксида углерода с центрами переходных металлов было рассмотрено. 23 , 24 Среди нескольких режимов, в которых металл может связывать CO 2 , есть три, показанные на концах C η 1 ; мостиковая, C, O η 2 ; и биметаллические мотивы, в которых один металл связывает C η 1 , а другой металл связывает O η 1 .
Электрохимические системы
Электрокатализ комплексами переходных металлов элегантно иллюстрируется работой Дюбуа и его коллег. 25 В отсутствие СО 2 комплекс палладия (II) подвергается двухэлектронному восстановлению, но в присутствии СО 2 продукт одноэлектронного восстановления связывает СО 2 (ДМФА в качестве растворителя) ( ). При добавлении кислоты монооксид углерода образуется каталитически из диоксида углерода. Эта химия, вероятно, включает аддукт протонированного диоксида углерода (гидроксикарбонильный комплекс), показанный на и . 26 Сообщалось о каталитических оборотах выше 100 для этого и родственных соединений. Параллельно образуется некоторое количество водорода, очевидно, через гидридный комплекс.
Эта химия, вероятно, включает аддукт протонированного диоксида углерода (гидроксикарбонильный комплекс), показанный на и . 26 Сообщалось о каталитических оборотах выше 100 для этого и родственных соединений. Параллельно образуется некоторое количество водорода, очевидно, через гидридный комплекс.
РИСУНОК 5.9
Восстановление палладия (II) до палладия (I) в присутствии CO 2 .
РИСУНОК 5.10
Аддукт протонированного диоксида углерода, используемый в восстановительной химии.
Другие системы для электрохимического восстановления CO 2 используют комплексы переходных металлов азотсодержащих (никель и кобальт) макроциклов (включая порфирины и фталоцианины) и (рутений, кобальт и рений) комплексы 2,2′-бипиридина. 27
Фотохимические системы
28 Системы фотохимического восстановления () требуют эффективного сбора света, обычно с помощью так называемого красителя или сенсибилизатора, а также эффективного разделения заряда и использования энергии. Комплексы переходных металлов, особенно трис(2,2′-бипиридин)рутений(II), служат сенсибилизаторами. Общая проведенная реакция должна быть полезной. То есть, помимо восстановления диоксида углерода, желательным должен быть дополнительный процесс окисления (который дает электроны). Как восстановительные, так и окислительные процессы обычно требуют катализа. Для восстановления диоксида углерода ряд катализаторов, используемых в электрохимических системах, также эффективны в фотохимических системах, как указано ниже.
Комплексы переходных металлов, особенно трис(2,2′-бипиридин)рутений(II), служат сенсибилизаторами. Общая проведенная реакция должна быть полезной. То есть, помимо восстановления диоксида углерода, желательным должен быть дополнительный процесс окисления (который дает электроны). Как восстановительные, так и окислительные процессы обычно требуют катализа. Для восстановления диоксида углерода ряд катализаторов, используемых в электрохимических системах, также эффективны в фотохимических системах, как указано ниже.
РИСУНОК 5.11
Фотоиндуцированный перенос заряда с комплексами переходных металлов.
Сравнение электрохимических и фотохимических систем
Когда каталитическое восстановление диоксида углерода действительно гомогенно (происходит в растворе), электрохимические и фотохимические системы могут иметь много общего. Способы доставки электронов, конечно, различаются, поскольку фотоиндуцированные процессы переноса электронов выполняют роль электрода в фотохимической системе. Многие из изученных до сих пор каталитических систем — например, системы макроциклов кобальта и никеля — работают как в электрохимических, так и в фотохимических системах. В обоих подходах конечным источником этих электронов является проблема (). Жертвенные реагенты (как правило, органические соединения, которые окисляются) широко используются, и одна из проблем состоит в том, чтобы заменить эти реакции процессами, которые являются менее дорогостоящими и расточительными. Для водных систем весьма желательно использовать полуреакцию окисления воды, т. е.
Многие из изученных до сих пор каталитических систем — например, системы макроциклов кобальта и никеля — работают как в электрохимических, так и в фотохимических системах. В обоих подходах конечным источником этих электронов является проблема (). Жертвенные реагенты (как правило, органические соединения, которые окисляются) широко используются, и одна из проблем состоит в том, чтобы заменить эти реакции процессами, которые являются менее дорогостоящими и расточительными. Для водных систем весьма желательно использовать полуреакцию окисления воды, т. е.
РИСУНОК 5.12
Сравнение фотохимических и электрохимических систем для восстановления CO 2 .
H 2 O = 2 e − + 1/2 O 2 + 2 H +
для этой цели, так что общая реакция будет 2 O → Ch4 O H + 3/2 O 2 .
Проблемой остается эффективная разработка и внедрение катализаторов окисления воды.
В настоящее время электрохимическое восстановление CO 2 дает моноксид углерода, формиат, метан и т. д. с хорошим выходом по току и, в фотохимических системах, с квантовым выходом моноксида углерода (или формиата, или обоих) до 40%.
д. с хорошим выходом по току и, в фотохимических системах, с квантовым выходом моноксида углерода (или формиата, или обоих) до 40%.
ВОЗМОЖНОСТИ
Существует множество областей, в которых текущие и будущие исследования могут привести к новым способам использования углекислого газа. К ним относятся следующие:
Использование CO 2 в новых полимерах
Разработка и понимание как гомо-, так и гетерогенных катализаторов для следующих процессов:
Полимеризация, гидрирование, электрохимические и фотохимические процессы
Использование растворимых и закрепленных на поверхности наночастиц металлов и полупроводниковых кластеров 3 9003 9003
Реакции или катализ в сверхкритическом CO 2
Электрохимические и фотохимические источники электронов в присутствии источников протонов позволяют избежать использования дорогостоящего H 2 , но оба требуют:
Более быстрые каталитические процессы и более стабильные каталитические системы
Развитие полезной второй полуреакции (т.
 е. удаление жертвенного реагента или полезная анодная реакция).
е. удаление жертвенного реагента или полезная анодная реакция).
БЛАГОДАРНОСТЬ
Благодарим Д.Л. Дюбуа за полезные комментарии. Это исследование было проведено в Брукхейвенской национальной лаборатории по контракту DE-AC02-98Ch20886 с Министерством энергетики США и при поддержке его Отдела химических наук Управления фундаментальных энергетических наук.
ССЫЛКИ
- 1.
Aresta M, Armor JN, Barteau MA, Beckman EJ, Bell AT, Bercaw JE, Creutz C, Dinjus E, Dixon DA, Domen K, Dubois DL, Eckert J, Fujita E, Гибсон Д.Х., Годдард В.А., Келлер Дж., Кубас Г.Дж., Кунг Х.Х., Лайонс Э., Манцер Л.Е., Маркс Т.Дж., Морокума К., Николас К.М., Периана Р., Куэ Л., Роструп-Нильсон Дж., Захтлер В.М.Х., Шмидт Л.Д., Сен А, Somorjai GA, Stair PC, Stults BR, Tumas W. Chem. Ред. 2001. в печати. [PubMed: 11709862]
- 2.
Бер А. Активация углекислого газа комплексами металлов. ВЧ; Cambridge: 1988.
- 3.

Халманн М.М., Стейнберг М. Снижение выбросов углекислого газа, вызывающего парниковый эффект. КПР Пресс; Бока-Ратон, Флорида: 1999.
- 4.
Бенсон С., Чендлер В., Эдмондс Дж., Левин М., Бейтс Л., Чам Х., Дули Дж., Гретер Д., Хоутон Дж., Логан Дж., Уилтси Г., Райт Л. Управление выбросами углерода: оценка потребностей в фундаментальных исследованиях. Министерство энергетики США; Вашингтон, округ Колумбия: 1998.
- 5.
Райхле Д., Хоутон Дж., Кейн Б., Экманн Дж., Бенсон С., Кларк Дж., Далман Р., Хендри Г., Херцог Х., Хантер-Севера Дж., Джейкобс Г., Джадкинс Р., Огден Дж. , Пальмизано А., Соколов Р., Стрингер Дж., Сурлес Т., Вольский А., Вудворд Н., Йорк М. Исследования и разработки в области секвестрации углерода. Министерство энергетики США; Вашингтон, округ Колумбия: 1999.
- 6.
Ареста М. Достижения в области химических преобразований для уменьшения выбросов углекислого газа. Исследования в области науки о поверхности и катализа.
 1998;114:65–76.
1998;114:65–76.- 7.
Darensbourg DJ, Holtcamp MW. Координ. хим. 1996; 153:155–174.
- 8.
Генчиу Э.Г., Бекман Э.Дж. “Углекислый газ”. 1998. www
- 9.
Кендалл Дж.Л., Канелас Д.А., Янг Дж.Л., Дезимоун Дж.М. хим. Ред. 1999; 99: 543–563. [PubMed: 11848992]
- 10.
Jessop PG, Ikariya T, Noyori R. Chem. Ред. 1999; 99: 475–493. [В паблике: 11848990]
- 11.
Бланшар Л.А., Ханку Д., Бекман Э.Дж., Бреннеке Дж.Ф. Природа. 1999; 399: 28–29.
- 12.
Fujita E, Creutz C, Sutin N, Szalda DJ. Варенье. хим. соц. 1991; 113: 343–353.
- 13.
Fujita E. Координ. хим. 1999; 185–186: 373–384.
- 14.
Jessop PG, Ikariya T, Noyori R. Chem. 1995; 99: 259–271.
- 15.
Аракава Х. Достижения в области химической конверсии для уменьшения выбросов углекислого газа.
 Исследования в области науки о поверхности и катализа. 1998;114:19–30.
Исследования в области науки о поверхности и катализа. 1998;114:19–30.- 16.
Киффер Р., Удрон Л. Достижения в области химической конверсии для уменьшения выбросов углекислого газа. Исследования в области науки о поверхности и катализа. 1998; 114:87–96.
- 17.
Инуи Т., Анпо М., Изуи К., Янагида С., Ямагучи Ю. Достижения в области химических преобразований для уменьшения выбросов углекислого газа. Делмон Б., Йейтс Дж. Т., редакторы. Эльзевир; Амстердам: 1998.
- 18.
Schwarz HA, Dodson RW. Дж. Физ. хим. 1989;93: 409–414.
- 19.
Schwarz HA, Creutz C, Sutin N. Inorg. хим. 1985; 24: 433–439.
- 20.
Сутин Н., Кройц С., Фуджита Э. Комм. неорг. хим. 1997; 19:67–92.
- 21.
Keene FR, Sullivan BP. Механизмы электрохимического восстановления углекислого газа, катализируемого комплексами переходных металлов. В: Салливан Б.П., Крист К.
 , Гард Х.Е., редакторы. Эльзевир; Нью-Йорк: 1993. С. 118–140.
, Гард Х.Е., редакторы. Эльзевир; Нью-Йорк: 1993. С. 118–140.- 22.
Hori Y, Murata A, Takahashi R. J. Chem. Soc., Faraday Trans. 1989;185:2309–2326.
- 23.
Creutz C. Связывание углекислого газа с центром переходного металла. В: Анлливан Б.П., редактор. Электрохимические и электрокаталитические реакции углекислого газа. Амстердам: Эльзевир; 1993. С. 19–67.
- 24.
Гибсон ДХ. хим. Ред. 1996: 2063–2095. [PubMed: 11848822]
- 25.
Wander SA, Miedaner A, Noll BC, DuBois DL. Металлоорганические соединения. 1996:3360–3373.
- 26.
DuBois DL, Miedaner A, Haltiwanger RC. Варенье. хим. соц. 1991;113:8753.
- 27.
Коллин Дж.П., Соваж Дж.П. Координ. хим. 1989; 93: 245–268.
- 28.
Fujita E, Brunschwig BS. Гомогенный окислительно-восстановительный катализ фиксации СО2. Бальзани В., редактор. IV. Wiley-ВЧ; Вайнхайм: 2001.
 стр. 88–126.
стр. 88–126.
ОБСУЖДЕНИЕ
Гленн Кросби, Университет штата Вашингтон: Кэрол, я уже несколько лет не участвую в такого рода исследованиях в Министерстве энергетики, но что случилось с уровнем финансирования использования, скажем, протонов для содействия фотокатализу и фотоэлектронам за последние несколько лет?
Кэрол Кройтц: Я передам Биллу Миллману из отдела химических наук.
Билл Милман, Министерство энергетики: Что ж, в сценариях с фиксированным бюджетом за последние шесть лет он существенно снижался примерно на 1,5% в год. В реальном выражении — в постоянных долларах — это значительный процент. Если посмотреть на штатное расписание лабораторий, то это около 25%. Это один из эффектов постоянных бюджетов.
Тогда можно с уверенностью сказать, что усилия в области фотокатализа и фотоэлектрической химии, которые я наблюдал и которыми занимался четыре или пять лет назад, не поспевают за инфляцией, но на самом деле значительно уменьшились в абсолютном выражении.
Стехиометрия и уравновешивающие реакции — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 240
Стехиометрия — это раздел химии, который включает использование соотношений между реагентами и/или продуктами в химической реакции для определения желаемых количественных данных. В греческом языке стоихеин означает элемент, а метрон означает меру, поэтому стехиометрия в буквальном переводе означает меру элементов. Чтобы использовать стехиометрию для выполнения расчетов химических реакций, важно сначала понять отношения, которые существуют между продуктами и реагентами, и почему они существуют, что требует понимания того, как сбалансировать реакции.
Балансировка
В химии химические реакции часто записывают в виде уравнений с использованием химических символов. Реагенты отображаются в левой части уравнения, а продукты — в правой, с разделением одинарной или двойной стрелкой, обозначающей направление реакции. Значение одинарной и двойной стрелки важно при обсуждении констант растворимости, но мы не будем вдаваться в подробности в этом модуле. Чтобы сбалансировать уравнение, необходимо, чтобы в левой части уравнения было такое же количество атомов, как и в правой. Это можно сделать, подняв коэффициенты.
Реагенты для продуктов
Химическое уравнение похоже на рецепт реакции, поэтому оно отображает все ингредиенты или условия химической реакции. Он включает элементы, молекулы или ионы в реагентах и продуктах, а также их состояния и пропорцию того, сколько каждой частицы реагирует или образуется по отношению друг к другу через стехиометрический коэффициент. Следующее уравнение демонстрирует типичный формат химического уравнения:
\[\ce{2 Na(s) + 2HCl(aq) \rightarrow 2NaCl(aq) + h3(g)} \nonumber\]
В приведенном выше уравнении элементы, участвующие в реакции, представлены их химическими символами. Основываясь на Законе сохранения массы, который гласит, что материя не создается и не разрушается в результате химической реакции, каждая химическая реакция содержит одни и те же элементы в своих реагентах и продуктах, хотя элементы, с которыми они соединяются, часто меняются в ходе реакции. В этой реакции натрий (\(Na\)), водород (\(H\)) и хлорид (\(Cl\)) являются элементами, присутствующими в обоих реагентах, поэтому на основании закона сохранения массы они также присутствуют на стороне произведения уравнений. Отображение каждого элемента важно при использовании химического уравнения для преобразования между элементами.
Основываясь на Законе сохранения массы, который гласит, что материя не создается и не разрушается в результате химической реакции, каждая химическая реакция содержит одни и те же элементы в своих реагентах и продуктах, хотя элементы, с которыми они соединяются, часто меняются в ходе реакции. В этой реакции натрий (\(Na\)), водород (\(H\)) и хлорид (\(Cl\)) являются элементами, присутствующими в обоих реагентах, поэтому на основании закона сохранения массы они также присутствуют на стороне произведения уравнений. Отображение каждого элемента важно при использовании химического уравнения для преобразования между элементами.
Стехиометрические коэффициенты
В сбалансированной реакции обе части уравнения содержат одинаковое количество элементов. Стехиометрический коэффициент – это число, написанное перед атомами, ионами и молекулами в химической реакции, чтобы сбалансировать количество каждого элемента как в реагенте, так и в продукте уравнения. Хотя стехиометрические коэффициенты могут быть дробными, часто используются целые числа, и они часто предпочтительнее. Эти стехиометрические коэффициенты полезны, поскольку они устанавливают молярное соотношение между реагентами и продуктами. В сбалансированном уравнении:
Эти стехиометрические коэффициенты полезны, поскольку они устанавливают молярное соотношение между реагентами и продуктами. В сбалансированном уравнении:
\[\ce{2 Na(s) + 2HCl(aq) \rightarrow 2NaCl(aq) + h3(g)} \nonumber\]
мы можем определить, что 2 моля \(HCl\) будут реагировать с 2 моля \(Na_{(s)}\) с образованием 2 молей \(NaCl_{(aq)}\) и 1 моля \(H_{2(g)}\). Если мы знаем, сколько молей \(Na\) вступило в реакцию, мы можем использовать отношение 2 молей \(NaCl\) к 2 молям Na, чтобы определить, сколько молей \(NaCl\) было произведено, либо мы можем использовать отношение 1 моля \(H_2\) к 2 молям \(Na\) для преобразования в \(NaCl\). Это известно как фактор коэффициента. Сбалансированное уравнение позволяет преобразовать информацию об изменении одного реагента или продукта в количественные данные о другом реагенте или продукте. Понимание этого важно для решения стехиометрических задач.
Пример 1
Гидроксид свинца (IV) и серная кислота реагируют, как показано ниже. Уравновесить реакцию.
Уравновесить реакцию.
\[\ce{Pb(OH)4 + h3SO4 \rightarrow Pb(SO4)2 +h3O} \номер\]
Раствор
Начните с подсчета количества атомов каждого элемента.
НЕСБАЛАНСИРОВАННЫЙ
Элемент | Реагент (число атомов) | Продукт (число атомов) |
|---|---|---|
Пб | 1 | 1 |
О | 8 | 9 |
Х | 6 | 2 |
С | 1 | 2 |
Реакция не сбалансирована; реакция имеет 16 атомов реагентов и только 14 атомов продукта и не подчиняется принципу сохранения массы. Чтобы сделать уравнение сбалансированным, необходимо добавить стехиометрические коэффициенты. В этом примере на стороне реагента присутствует только один атом серы, поэтому перед \(H_2SO_4\) следует добавить коэффициент 2, чтобы получить одинаковое количество серы в обеих частях уравнения. Так как на стороне реагента 12 кислорода и только 9со стороны продукта следует добавить коэффициент 4 перед \(H_2O\), если имеется дефицит кислорода. Подсчитайте количество элементов, присутствующих в настоящее время по обе стороны уравнения. Поскольку числа одинаковы, уравнение теперь сбалансировано.
Чтобы сделать уравнение сбалансированным, необходимо добавить стехиометрические коэффициенты. В этом примере на стороне реагента присутствует только один атом серы, поэтому перед \(H_2SO_4\) следует добавить коэффициент 2, чтобы получить одинаковое количество серы в обеих частях уравнения. Так как на стороне реагента 12 кислорода и только 9со стороны продукта следует добавить коэффициент 4 перед \(H_2O\), если имеется дефицит кислорода. Подсчитайте количество элементов, присутствующих в настоящее время по обе стороны уравнения. Поскольку числа одинаковы, уравнение теперь сбалансировано.
\[\ce{ Pb(OH)4 + 2 h3SO4 \rightarrow Pb(SO4)2 + 4h3O} \номер\]
СБАЛАНСИРОВАННЫЙ
Элемент | Реагент (число атомов) | Продукт (число атомов) |
|---|---|---|
Пб | 1 | 1 |
О | 12 | 12 |
Х | 8 | 8 |
С | 2 | 2 |
Уравновешивающие реакции включают в себя нахождение наименьших общих кратных между числом элементов, присутствующих в обеих частях уравнения. Как правило, при применении коэффициентов добавляйте коэффициенты к молекулам или непарным элементам в последнюю очередь.
Как правило, при применении коэффициентов добавляйте коэффициенты к молекулам или непарным элементам в последнюю очередь.
Сбалансированное уравнение в конечном счете должно удовлетворять двум условиям.
- Числа каждого элемента в левой и правой частях уравнения должны быть равны.
- Заряд в обеих частях уравнения должен быть одинаковым. Особенно важно обращать внимание на заряд при балансировке окислительно-восстановительных реакций.
Стехиометрия и сбалансированные уравнения
В стехиометрии сбалансированные уравнения позволяют сравнивать различные элементы с помощью стехиометрического коэффициента , который обсуждался ранее. Это молярное соотношение между двумя факторами в химической реакции, определяемое через соотношение стехиометрических коэффициентов. Вот реальный пример, показывающий, как полезны стехиометрические факторы.
Пример 2
Имеется 12 приглашений на вечеринку и 20 марок. Каждое приглашение на вечеринку требует отправки 2 марок. Сколько приглашений на вечеринку можно отправить?
Сколько приглашений на вечеринку можно отправить?
Решение
Уравнение для этого можно записать как
\[\ce{I + 2S \rightarrow IS2}\nonumber\]
где
- \(I\) представляет приглашения,
- \(S\) представляет марки, а
- \(IS_2\) представляет собой отправленные партийные приглашения, состоящие из одного приглашения и двух штампов.
Исходя из этого, имеем соотношение 2 штампа к 1 отправленному приглашению, основанное на сбалансированном уравнении.
Приглашения Штампы Приглашения на вечеринку отправлены
В этом примере все реагенты (марки и приглашения) израсходованы? Нет, и это обычно происходит с химическими реакциями. Часто наблюдается избыток одного из реагентов. Лимитирующий реагент, тот, который заканчивается первым, препятствует продолжению реакции и определяет максимальное количество продукта, которое может образоваться.
Пример 3
Какой реагент является лимитирующим в этом примере?
Решение
Марки, потому что их хватило только на рассылку приглашений, тогда как приглашений хватило на 12 полных приглашений на вечеринку. Помимо простого взгляда на проблему, ее можно решить, используя стехиометрические коэффициенты.
Помимо простого взгляда на проблему, ее можно решить, используя стехиометрические коэффициенты.
12 I x (1IS 2 /1I) = 12 IS 2 возможно
20 S x (1IS 2 /2S) = 10 IS 2 , т.к. нет ограничений
3 90 соотношение всех реагентов, вызывающее их одновременное исчерпание, известно как стехиометрические пропорции .
Типы реакций
Существует 6 основных типов реакций.
- Горение : Горение – это образование CO 2 и H 2 O в результате реакции химического вещества и O 2
- Комбинация (синтез) : Комбинация – это добавление 2 или более простых реагентов с образованием сложного продукта.
- Разложение: Разложение — это разложение сложных реагентов на более простые продукты.
- Одиночное смещение : Однократное смещение – это когда элемент одного реагента переключается с элементом другого с образованием двух новых реагентов.

- Двойное смещение: Двойное смещение — это когда два элемента одного реагента меняются местами с двумя элементами другого, образуя два новых реагента.
- Кислотно-основные: Кислотно-основные реакции – это когда два реагента образуют соли и воду.
Молярная масса
Прежде чем применять стехиометрические коэффициенты к химическим уравнениям, вам необходимо понять молекулярную массу. Молярная масса – это полезное химическое соотношение между массой и молями. Атомная масса каждого отдельного элемента, указанная в периодической таблице, установила это соотношение для атомов или ионов. Для соединений или молекул необходимо взять сумму атомной массы, умноженной на число каждого атома, чтобы определить молярную массу
Пример 4
Какова молярная масса H 2 O?
Раствор
\[\text{Молярная масса} = 2 \times (1,00794\; г/моль) + 1 \times (15,9994\; г/моль) = 18,01528\; г/моль]
Используя молярную массу и коэффициенты, можно преобразовать массу реагентов в массу продуктов или наоборот.
Пример 5: Горение пропана
Пропан (\(\ce{C_3H_8}\)) горит в этой реакции: Сгорело 200 г пропана, сколько г \(H_2O\) образовалось?
Решение
Шаги для получения этого ответа: Поскольку вы не можете вычислить из граммов реагента в граммы продуктов, вы должны преобразовать граммы \(C_3H_8\) в моли \(C_3H_8\), а затем из молей \( C_3H_8\) в моли \(H_2O\). Затем переведите моли \(H_2O\) в граммы \(H_2O\).
- Этап 1: 200 г \(C_3H_8\) равно 4,54 моль \(C_3H_8\) .
- Шаг 2: Так как отношение \(H_2O\) к \(C_3H_8\) составляет 4:1, на каждые 4,54 моль \(C_3H_8\) приходится 18,18 моль \(H_2O\).
- Шаг 3: Переведите 18,18 моль \(H_2O\) в г \(H_2O\). 18,18 моль \(H_2O\) равно 327,27 г \(H_2O\).
Варианты стехиометрических уравнений
Почти каждое количественное отношение можно преобразовать в отношение, которое может быть полезно при анализе данных.
Плотность
Плотность (\(\rho\)) рассчитывается как масса/объем. Это соотношение может быть полезно при определении объема раствора по заданной массе или при нахождении массы по заданному объему. В последнем случае будет использоваться обратная зависимость.
Это соотношение может быть полезно при определении объема раствора по заданной массе или при нахождении массы по заданному объему. В последнем случае будет использоваться обратная зависимость.
Объем x (масса/объем) = масса
Масса x (объем/масса) = объем
Масса в процентах
Проценты также устанавливают взаимосвязь. Процент массы показывает, сколько граммов смеси приходится на определенный элемент или молекулу. Процент X% означает, что из каждых 100 граммов смеси X граммов приходится на указанный элемент или соединение. Это полезно при определении массы желаемого вещества в молекуле.
Пример 6
Вещество содержит 5% углерода по массе. Если общая масса вещества 10 граммов, какова масса углерода в пробе? Сколько молей углерода?
Раствор
10 г образца x (5 г углерода/100 г образца) = 0,5 г углерода
0,5 г углерода x (1 моль углерода/12,011 г углерода) = 0,0416 моль углерода моль/л) устанавливает связь между молями и литрами. Зная объем и молярность, можно рассчитать моль или использовать моли и молярность для расчета объема. Это полезно в химических уравнениях и разбавлениях.
Зная объем и молярность, можно рассчитать моль или использовать моли и молярность для расчета объема. Это полезно в химических уравнениях и разбавлениях.
Пример 7
Сколько 5 М исходного раствора необходимо для приготовления 100 мл 2 М раствора?
Раствор
100 мл разбавленного раствора (1 л/1000 мл)(2 моль/1 л раствора)(1 л исходного раствора/5 моль раствора)(1000 мл исходного раствора/1 л исходного раствора) = 40 мл исходного раствора решение.
Эти отношения молярности, плотности и массовых процентов полезны в сложных примерах, которые будут приведены ниже.
Определение эмпирических формул
Эмпирическую формулу можно определить с помощью химической стехиометрии, определяя, какие элементы присутствуют в молекуле и в каком соотношении. Соотношение элементов определяется путем сравнения количества молей каждого присутствующего элемента.
Пример 8: Горение органических молекул
1,000 г органической молекулы полностью сгорает в присутствии избытка кислорода. Получается 0,0333 моль СО 2 и 0,599 г Н 2 О. Какова эмпирическая формула органической молекулы?
Получается 0,0333 моль СО 2 и 0,599 г Н 2 О. Какова эмпирическая формула органической молекулы?
Раствор
Это реакция горения. Задача требует, чтобы вы знали, что органические молекулы состоят из некоторой комбинации элементов углерода, водорода и кислорода. Имея это в виду, напишите химическое уравнение, заменив неизвестные числа переменными. Не беспокойтесь о коэффициентах здесь.
\[ \ce{C_xH_yO_z(g) + O_2(g) \rightarrow CO_2(g) + H_2O(g)} \nonumber\]
Так как все моли C и H в CO 2 и H 2 O соответственно должны быть получены из 1-граммового образца неизвестного вещества, начните с подсчета количества молей каждого элемента, присутствующего в неизвестном образце.
0,0333 моль CO 2 (1 моль C/ 1 моль CO 2 ) = 0,0333 моль C в неизвестном0022 2 O)(2 моль H/1 моль H 2 O) = 0,0665 моль H в неизвестном
Рассчитайте конечные моли кислорода, взяв сумму молей кислорода в CO 2 и H 2 O Это даст вам количество молей как от неизвестной органической молекулы, так и от O 2 , поэтому вы должны вычесть моли кислорода, перенесенного из O 2 .
Моль кислорода в CO 2 :
0,0333 моль CO 2 (2 моль O/1 моль CO 2 ) = 0,0666 моль O
моль кислорода в H 2 O:
0,599 г H 2 O (1MOL H 2 O/18,01528 G H 2 O) O) O) O) (1MOL) (1MOL) (1MOL O) (1MOL) (1MOL) (1MOL) (1MOL) (1MOL) ( O) (1MOL) ( O) (1mol. /1моль H 2 O) = 0,0332 моль O
Используя закон сохранения, мы знаем, что масса до реакции должна равняться массе после реакции. При этом мы можем использовать разницу конечной массы продуктов и начальной массы неизвестной органической молекулы для определения массы O 2 реагент.
0,3333MOL CO 2 (44,0098G CO 2 / 1MOL CO 2 ) = 1,466G CO 2
1,466G CO 2 + 0,599G H 2 G -CO . = 1.065g O 2
Moles of oxygen in O 2
1. 065g O 2 (1mol O 2 / 31.9988g O 2 )(2mol O/1mol O 2 ) = 0,0666 моль O
065g O 2 (1mol O 2 / 31.9988g O 2 )(2mol O/1mol O 2 ) = 0,0666 моль O
Моль кислорода в неизвестном
(0,0666 моль O + 0,0332 моль O) – 0,0666 моль O = 0,0332 моль O
Рассчитайте молярное отношение C, H и O в неизвестном веществе и разделите на наименьшее число.
(1/0,0332)(0,0333 моль C : 0,0665 моль H : 0,0332 моль O) => 1 моль C: 2 моль H: 1 моль O
Определение молекулярных формул
Чтобы определить молекулярную формулу, сначала определите эмпирическую формулу соединения, как показано в разделе выше, а затем экспериментально определите молекулярную массу. Далее разделите молекулярную массу на молярную массу эмпирической формулы (рассчитывается путем нахождения суммы полных атомных масс всех элементов в эмпирической формуле). Умножьте индексы молекулярной формулы на этот ответ, чтобы получить молекулярную формулу.
Пример 9
В приведенном выше примере было определено, что неизвестная молекула имеет эмпирическую формулу CH 2 O.
1. Найдите молярную массу эмпирической формулы CH 2 O.
12,011 г C + (1,008 г H) * (2 H) + 15,999 г O = 30,026 г/моль CH 2 O
2. Экспериментально определить молекулярную массу. Для нашего соединения она составляет 120,056 г/моль.
3. Разделите экспериментально определенную молекулярную массу на массу эмпирической формулы.
(120,056 г/моль) / (30,026 г/моль) = 3,9984
4. Поскольку 3,9984 очень близко к четырем, можно безопасно округлить и предположить, что в экспериментально определенной молекулярной массе была небольшая ошибка . Если ответ не близок к целому числу, то имела место либо ошибка в расчете эмпирической формулы, либо большая ошибка в определении молекулярной массы.
5. Умножьте отношение из шага 4 на нижние индексы эмпирической формулы, чтобы получить молекулярную формулу.
СН 2 О * 4 = ?
C: 1 * 4 = 4
H: 2 * 4 = 8
O 1 * 4 = 4
Ch 2 O * 4 = C 4 H 8 O 4
6. Проверьте свой результат, рассчитав молярную массу молекулярной формулы и сравнив ее с экспериментально определенной массой.
Проверьте свой результат, рассчитав молярную массу молекулярной формулы и сравнив ее с экспериментально определенной массой.
молярная масса C 4 H 8 O 4 = 120,104 г/моль
экспериментально определенная масса = 120,056 г/моль
% ошибка = | теоретический – экспериментальный | / теоретическое * 100%
% ошибка = | 120,104 г/моль – 120,056 г/моль | / 120,104 г/моль * 100 %
% ошибка = 0,040 %
Пример 10: Комплексная задача стехиометрии
Сварщик-любитель плавит два металла, чтобы получить сплав, состоящий из 45 % меди и 55 % железа (II). по массе. Плотность сплава 3,15 г/л. Один литр сплава полностью заполняет форму объемом 1000 см 3 . Он случайно ломает 1,203 см 3 часть однородной смеси и выметает ее наружу, где она годами вступает в реакцию с кислотными дождями. Если предположить, что кислота реагирует со всем железом(II), а не с медью, сколько граммов Н 2 (г) выбрасывается в атмосферу из-за невнимательности любителя? (Обратите внимание, что ситуация вымышленная. )
)
Решение
Шаг 1 : Напишите сбалансированное уравнение после определения продуктов и реагентов. В этой ситуации, поскольку мы предполагаем, что медь не вступает в реакцию, реагентами являются только H 9{2+}(aq)} \nonumber\]
Шаг 2: Запишите всю предоставленную информацию
Плотность сплава = (3,15 г сплава/1 л сплава)
x грамм сплава = 45% меди = ( 45 г Cu(s)/100 г сплава)
x грамм сплава = 55% железа(II) = (55 г Fe(s)/100 г сплава)
1 литр сплава = 1000 см см 3 сплав
Шаг 3: Ответьте на вопрос о том, что задают. Вопрос спрашивает, сколько h3(g) было произведено. Ожидается, что вы определите количество образовавшегося продукта.
Шаг 4: Начните с соединения, о котором вы знаете больше всего, и используйте заданные соотношения, чтобы преобразовать его в желаемое соединение.
Преобразуйте данное количество реагента сплава в число молей прореагировавшего Fe(s).
1,203 см 3 сплав (1 л сплава/1000 см 3 сплав) (3,15 г сплава/1 л сплава) (55 г Fe(s)/100 г сплава) (1 моль Fe(s)/55,8 г Fe(s)) =3,74 x 10 -5 моль Fe(s)
Убедитесь, что все единицы сокращаются, чтобы получить моли \(\ce{Fe(s)}\). Приведенное выше преобразование включает использование нескольких стехиометрических соотношений плотности, процентной массы и молярной массы.
Теперь необходимо использовать сбалансированное уравнение для преобразования молей Fe(s) в моли H 2 (г). Помните, что коэффициенты сбалансированного уравнения определяют стехиометрический коэффициент или молярное соотношение реагентов и продуктов.
3,74 x 10 -5 моль Fe (т) (1 моль H 2 (г)/1 моль Fe(s)) = 3,74 x 10 -5 моль H 2 (г)
2 9 Шаг 5: Проверочные единицы Вопрос заключается в том, сколько граммов H 2 (g), поэтому моли H 2 (g) все еще должны быть преобразованы в граммы с использованием молярной массы H 2 (g). Поскольку в каждом H 2 содержится два H, его молярная масса в два раза больше, чем у одного атома H.
Поскольку в каждом H 2 содержится два H, его молярная масса в два раза больше, чем у одного атома H.
молярная масса = 2(1,00794 г/моль) = 2,01588 г/моль (г)) = 7,53 x 10 -5 г H 2 (г) освобожден
Задачи 9{2+}_{(водн.)} + Ag_{(s)}\)
2) Соляная кислота реагирует с твердым куском алюминия с образованием газообразного водорода и ионов алюминия. Напишите сбалансированное химическое уравнение этой реакции.
3) Учитывая исходный раствор 10,1 М, сколько мл необходимо добавить к воде, чтобы получить 200 мл раствора 5 М?
4) Если 0,502 г газообразного метана реагируют с 0,27 г кислорода с образованием углекислого газа и воды, какой реагент является лимитирующим и сколько молей воды образуется? Ниже приведено несбалансированное уравнение.
\[\ce{Ch5(г) + O2(г) \rightarrow CO2(г) + h3O(ж)} \номер\]
5) Образец органического соединения массой 0,777 г полностью сгорает. Он дает 1,42 г CO 2 и 0,388 г H 2 O. Зная, что все атомы углерода и водорода в CO 2 и H 2 O происходят из образца 0,777 г, какова эмпирическая формула органическое соединение?
Зная, что все атомы углерода и водорода в CO 2 и H 2 O происходят из образца 0,777 г, какова эмпирическая формула органическое соединение?
Веб-ссылки для получения дополнительной информации
- 1. См. http://chemistry.about.com/cs/stoich…/aa042903a.htm как внешний ресурс о том, как сбалансировать химические реакции.
- 2. Обратитесь к http://www.learnchem.net/tutorials/stoich.shtml как к внешнему ресурсу по стехиометрии.
Ссылки
- Т. Э. Браун, Х. Э. ЛеМэй, Б. Берстен, К. Мерфи. Химия: Центральная наука. Прентис Холл, 8 января 2008 г.
- Дж. К. Коц П.М. Трейчел, Дж. Таунсенд. Химия и химическая реактивность. Брукс Коул, 7 февраля 2008 г.
- Петруччи, Харвуд, Сельдь, Мадура. Общие принципы химии и современные приложения. Прентис Холл. Нью-Джерси, 2007.
Авторы и ссылки
- Джозеф Неймех (UCD), Марк Тай (DVC)
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Показать страницу TOC
- нет на странице
- Теги
- Кислотно-щелочной
- Балансировка
- Уравновешивающие реакции
- химическая реакция
- химические символы
- Комбинация
- сжигание
- разложение
- плотность
- Двойной рабочий объем
- элементов
- Эмпирические формулы
- закон сохранения массы
- масса
- метрон
- молекулярная формула
- Масса в процентах
- Продукция
- Реагенты
- Одинарный рабочий объем
- стехиометрический коэффициент
- стехиометрия
- стоихейн
- синтез
- том
| Общепринятое название | Химическое название | Формула |
| Спирт, древесный | метанол, метиловый спирт | CH 3 OH |
| Спирт зерновой | Этанол или этиловый спирт | C 2 H 5 OH |
| Спирт, протирочный | 2-пропанол, пропиловый спирт, изопропиловый спирт | |
| Алкоголь | Спирт этиловый | |
| Алка Зельцер | Бикарбонат натрия | |
| Квасцы | Сульфат алюминия калия додекагидрат | |
| Глинозем | Оксид алюминия | Алунд 2 О 3 |
| Алунд | Плавленый оксид алюминия | |
| Антифриз | Этиленгликоль | |
| Антиперспирант | Хлоргидрат алюминия | |
| царская водка | Смесь азотной и кислоты соляные | HNO 3 +HCl |
| Аспирин | Ацетилсалициловая кислота | |
| Пищевая сода | Гидрокарбонат натрия | NaHCO 3 |
| Разрыхлитель | Бикарбонат натрия | |
| Банановое масло | Амилацетат | |
| Барита | Оксид бария | |
| Барит | Сульфат бария | |
| Аккумуляторная кислота | Серная кислота | |
| Бокситы | Оксид алюминия гидратированный | |
| Бензол | Бензол | |
| Отбеливатель (для стирки) | Гипохлорит натрия | NaClO |
| Отбеливающий порошок | Гипохлорит хлорида кальция | |
| Синий витрол | Сульфат меди (II) | CuSO 4 *5H 2 O |
| Голубой камень | Пентагидрат сульфата меди II | CuSO 3 *5H 2 O |
| Борная кислота | Борная кислота | |
| Бура | Натрия тетрабората декагидрат | Na 2 B 4 O 7 *10H 2 O |
| Латунь | Сплав меди и цинка | |
| Сера | Сера | S |
| Бронза | Сплав меди и олова | |
| Каламин | Карбонат цинка | |
| Кальцит | Карбонат кальция | |
| Калгон | Гексаметафосфат кальция | |
| Каломель | Хлорид ртути | |
| Карболовая кислота | Фенол | |
| Четыреххлористый углерод | Тетрахлорметан | ССl 4 |
| Карборунд | Карбид кремния | |
| Сода каустическая | Гидроксид натрия | |
| Мел | Карбонат кальция | |
| Чилийская селитра | Нитрат натрия | |
| Хлороформ | Трихлорметан | CHCl 3 |
| Хлорокс | Хлорноватистая кислота | |
| Желтый хром | Хромат свинца | |
| Киноварь | Ртуть II сульфид | HgS |
| Газированная вода | Угольная кислота | |
| Копперас | Гидратированный сульфат железа | |
| Сулема коррозионная | Хлорид ртути | |
| Крем из зубного камня | Гидротартрат калия | KHC 4 H 4 O 6 |
| ДДТ | Дихлордифенилтрихлорэтан | |
| Декстроза | Глюкоза | |
| Алмаз | Углерод | С |
| Доломит | Карбонат кальция магния | CaCO 3 *MgCO 3 |
| Драно | Гидроксид натрия | |
| Средство для чистки духовки Easy-off | Гидроксид натрия | |
| Яичная скорлупа | Карбонат кальция | |
| Английская соль | Гептагидрат сульфата магния | MgSO 4 *7H 2 O |
| Эфир | Этиловый эфир | |
| Экс-слабый | Фенолфталеин | |
| Компонент удобрения | Нитрат аммония | |
| Флуростан | Фторид двухвалентного олова | |
| Золото дураков | Железный пирит | |
| Формалин | 40% раствор формальдегида | |
| Фреон (хладагент) | Дихлордифторметан | CCl 2 F 2 |
| Галенит | Сульфид цинка | |
| Галена | Сульфид свинца II | PbS |
| Глауберова соль | Гидратированный сульфат натрия | |
| Глицерин | Глицерин | |
| Зерновой спирт | Этанол или этиловый спирт | C 2 H 5 OH |
| Графит | Углерод | C |
| Зеленый купорос | Гидратированный сульфат железа | |
| Гипс | Дигидрат сульфата кальция | CaSO 4 *2H 2 O |
| Тяжелая вода | Оксид дейтерия | |
| Гипо | Пентагидрат тиосульфата натрия | Na 2 S 2 O 3 *5H 2 O |
| Ледяной укус | Хлорид кальция | |
| Инвертный сахар | Смесь глюкозы и фруктозы | |
| Веселящий газ | Закись азота | N 2 O |
| Левулоза | Фруктоза | |
| Лайм | Оксид кальция | CaO |
| Известняк | Карбонат кальция | CaCO 3 |
| Жидкая бумага | Диоксид титана | |
| Облегченная соль | Хлорид калия | |
| Литарг | Монооксид свинца | |
| Литопон | Смесь сульфида цинка и сульфат бария | |
| Печень серная | Сульфид калия | |
| LOX | Жидкий кислород | |
| Лунный каустик | Нитрат серебра | |
| Щелок | Гидроксид натрия | NaOH |
| Магнезия | Оксид магния | |
| Мрамор | Карбонат кальция | CaCO 3 |
| Маргарин | Частично насыщенная жирная кислота | |
| Болотный газ | Метан | |
| МЕК | Метилэтилкетон | CH 3 COC 2 H 5 |
| Микрокосмическая соль | Аммоний натрия гидратированный гидрофосфат | |
| Молочный сахар | Лактоза | |
| Магнезиальное молоко | Гидроксид магния | Mg(OH) 2 |
| Известковое молоко | Гидроксид кальция | |
| Соль Мора | Аммоний двухвалентного железа гидратированный сульфат | |
| Шарики от моли | Нафталин | |
| Сообщение | Гидроглутамат натрия | |
| Соляная кислота | Соляная кислота | HCl |
| Nutrasweet | Аспартам | |
| Масло горького миндаля | Бензальдегид | |
| Масло купоросное | Серная кислота (конц. ) ) | H 2 SO 4 |
| Мирбановое масло | Нитробензол | |
| Масло купоросное | Кислота серная концентрированная | |
| Масло зимней зелени | Метилсалицилат | |
| Олеум | Дымящая серная кислота | |
| Зеленый Париж | Двойная соль ацетата меди и арсенит меди | |
| Перье | Угольная кислота | |
| Олово | Сплав олова, сурьмы, меди, и свинец | |
| Фосген | Карбонилхлорид | |
| Фотографический гипо | Тиосульфат натрия | |
| Пикриновая кислота | Тринитрофенол | |
| Гипс | Гидроксид кальция | |
| Гипс | Полугидрат сульфата кальция | CaSO 4 *(1/2)H 2 O |
| Калий | Карбонат калия | K 2 CO 3 |
| Берлинская лазурь | Ферроцианид железа | |
| Пирит (золото дураков) | Дисульфид железа | FeS 2 |
| Кварц | Диоксид кремния | SiO 2 |
| Негашеная известь | Оксид кальция | |
| Ртуть | Меркурий | рт. ст. ст. |
| сегнетовая соль | Тартрат калия-натрия | |
| Ролайды | Дигидроксиалюминий натрия карбонат | |
| Руж | Оксид железа | |
| Медицинский спирт | 2-пропанол, пропиловый спирт, изопропиловый спирт | |
| Аммиачная соль | Хлорид аммония | NH 4 Cl |
| Содовая соль | Гидрированный карбонат натрия | |
| Аммиачная соль | Хлорид аммония | |
| Соль столовая | Хлорид натрия | NaCl |
| Соль, облегченная | Хлорид калия | |
| Селитра | Нитрат калия | КНО 3 |
| Песок | Диоксид кремния | SiO 2 |
| Промывка Sani | Бисульфат натрия | |
| Саранская пленка | Поли-1,1-дихлорэтилен | |
| Силикагель | Диоксид кремния | |
| Гашеная известь | Гидроксид кальция | Ca(OH) 2 |
| Нюхательные соли | Карбонат аммония | |
| Кальцинированная сода (стиральная сода) | Карбонат натрия | |
| Припой | Сплав олова и сурьмы | |
| Сахар | Сахароза | |
| Сахар столовый | Сахароза | C 12 H 22 O 11 |
| Свинцовый сахар | Гидратированный ацетат свинца | |
| Лосьон для загара | Парааминобензойная кислота | |
| Тефлон | Полимер тетрафторэтилена | |
| ТНТ | Тринитротолуол | |
| Толуол | Толуол | |
| ТСП | (три) фосфат натрия | Na 3 PO 4 |
| Tums | Карбонат кальция | |
| Синий Тернбулл | Феррицианид железа | |
| Тайленол | Ацетаминофен | |
| Уксус | Уксусная кислота, этановая кислота | |
| Витамин С | Аскорбиновая кислота | |
| Сода для стирки | Декагидрат карбоната натрия | NaCO 3 *10H 2 O |
| Сода для стирки | Гидратированный карбонат натрия | |
| Умягчитель воды | Бария гидроксид | |
| Свинцовые белила | Основной карбонат свинца | |
| Виндекс | Аммиак | |
| Древесный спирт | Спирт метиловый, метанол | CH 3 OH |
| Цинковая смесь | Сульфид цинка |
pH воды – системы измерения параметров окружающей среды
Что такое рН?
pH – это определенное значение, основанное на определенной шкале, аналогичной температуре. Это означает, что рН воды не является физическим параметром, который можно измерить как концентрацию или количество. Вместо этого это число от 0 до 14, определяющее, насколько кислым или щелочным является водоем по логарифмической шкале ¹. Чем меньше число, тем более кислая вода. Чем выше число, тем оно более базовое. pH 7 считается нейтральным. Логарифмическая шкала означает, что каждое число ниже 7 в 10 раз более кислое, чем предыдущее число при обратном отсчете. Точно так же при подсчете выше 7 каждое число в 10 раз больше основного, чем предыдущее число ².
Это означает, что рН воды не является физическим параметром, который можно измерить как концентрацию или количество. Вместо этого это число от 0 до 14, определяющее, насколько кислым или щелочным является водоем по логарифмической шкале ¹. Чем меньше число, тем более кислая вода. Чем выше число, тем оно более базовое. pH 7 считается нейтральным. Логарифмическая шкала означает, что каждое число ниже 7 в 10 раз более кислое, чем предыдущее число при обратном отсчете. Точно так же при подсчете выше 7 каждое число в 10 раз больше основного, чем предыдущее число ².
pH означает «сила водорода» ³. Численное значение pH определяется молярной концентрацией ионов водорода (H+) ³. Для этого возьмем отрицательный логарифм концентрации H+ (-log(H+)). Например, если раствор имеет концентрацию H+ 10 -3 М рН раствора будет -log(10 -3 ), что равно 3.
Например, если раствор имеет концентрацию H+ 10 -3 М рН раствора будет -log(10 -3 ), что равно 3.
Это определение обусловлено влиянием ионов водорода (Н+) и ионов гидроксила (ОН-) на рН. Чем выше концентрация H+, тем ниже pH, чем выше концентрация OH-, тем выше pH. При нейтральном рН 7 (чистая вода) концентрация как ионов Н+, так и ионов ОН- составляет 10⁻⁷ М. Таким образом, ионы Н+ и ОН- всегда спарены – при увеличении концентрации одного концентрация другого будет уменьшаться; независимо от рН сумма ионов всегда будет равна 10⁻¹⁴ М². Из-за этого влияния H+ и OH- связаны с основными определениями кислот и оснований.
Кислоты и основания
Кислотно-основные пары могут нейтрализовать друг друга, как H+ и OH- в этом уравнении. Согласно рабочему определению, кислота — это вещество, которое снижает pH при добавлении в чистую воду. Точно так же основание — это вещество, которое увеличивает pH воды ⁴. Для дальнейшего определения этих веществ Аррениус определил в 1884 году, что кислота выделяет ион водорода (H+) при растворении в воде, а основание выделяет ион гидроксила (OH-) в воде ⁴. Однако есть некоторые вещества, которые соответствуют рабочему определению (изменение рН), но не соответствуют определению Аррениуса (высвобождение иона). Чтобы учесть это, Бренстед и Лоури изменили определение кислот и оснований; кислота высвобождает ион водорода или протон (эквивалент H+), а основание принимает ион водорода или протон ⁴. Это означает, что кислоты и основания могут компенсировать друг друга, как показано в уравнении воды справа.
Однако есть некоторые вещества, которые соответствуют рабочему определению (изменение рН), но не соответствуют определению Аррениуса (высвобождение иона). Чтобы учесть это, Бренстед и Лоури изменили определение кислот и оснований; кислота высвобождает ион водорода или протон (эквивалент H+), а основание принимает ион водорода или протон ⁴. Это означает, что кислоты и основания могут компенсировать друг друга, как показано в уравнении воды справа.
Основной или щелочной
Типичные примеры щелочей включают магнезиальное молоко – Mg(OH)2, едкий калий – KOH, гашеную известь/известковую воду – Ca(OH)2 и едкий натр (щелок) – NaOH. Термины «щелочной» и «основной» означают примерно одно и то же. Согласно определению Бренстеда-Лоури, основание описывает любое вещество, которое снижает концентрацию ионов водорода и увеличивает рН воды, или, другими словами, основание ⁴. Щелочной происходит от щелочи, которая относится к ионным соединениям (солям), содержащим элементы щелочного металла или щелочноземельного металла, которые образуют гидроксид-ионы при растворении в воде ⁵. Щелочные соли очень распространены и легко растворяются. Из-за образующихся ими гидроксид-ионов (которые повышают pH) все щелочи являются основаниями. Некоторые источники определяют любое растворимое основание как щелочь ⁵. Таким образом, растворимые основания можно описать как «основные» или «щелочные». Однако нерастворимые основания (например, оксид меди) следует описывать только как основные, а не щелочные.
Щелочные соли очень распространены и легко растворяются. Из-за образующихся ими гидроксид-ионов (которые повышают pH) все щелочи являются основаниями. Некоторые источники определяют любое растворимое основание как щелочь ⁵. Таким образом, растворимые основания можно описать как «основные» или «щелочные». Однако нерастворимые основания (например, оксид меди) следует описывать только как основные, а не щелочные.
Щелочность и pH воды
Щелочность и pH напрямую связаны при 100% насыщении воздухом. Щелочность не относится к щелочам, как к щелочным ⁶. Хотя щелочность и pH тесно связаны между собой, между ними есть явные различия. Щелочность воды или раствора — это количественная способность этого раствора буферировать или нейтрализовать кислоту. Другими словами, щелочность — это мера способности воды противостоять изменениям рН. Этот термин используется взаимозаменяемо с кислотонейтрализующей способностью (ANC) ⁷. Если водоем имеет высокую щелочность, это может ограничить изменения pH из-за кислотных дождей, загрязнения или других факторов ⁸. Щелочность ручья или другого водоема повышается за счет богатых карбонатами почв (карбонатов и бикарбонатов), таких как известняк, и снижается за счет оттока сточных вод и аэробного дыхания. Из-за присутствия карбонатов щелочность более тесно связана с жесткостью, чем с pH (хотя все же есть явные различия). Однако изменения pH также могут влиять на уровень щелочности (по мере снижения pH буферная способность воды также снижается) ⁶. pH и щелочность напрямую связаны, когда вода на 100% насыщена воздухом ⁹.
Щелочность ручья или другого водоема повышается за счет богатых карбонатами почв (карбонатов и бикарбонатов), таких как известняк, и снижается за счет оттока сточных вод и аэробного дыхания. Из-за присутствия карбонатов щелочность более тесно связана с жесткостью, чем с pH (хотя все же есть явные различия). Однако изменения pH также могут влиять на уровень щелочности (по мере снижения pH буферная способность воды также снижается) ⁶. pH и щелочность напрямую связаны, когда вода на 100% насыщена воздухом ⁹.
Щелочность воды также играет важную роль в дневном уровне pH. В процессе фотосинтеза водорослями и растениями используется водород, что повышает уровень pH ¹⁰. Точно так же дыхание и разложение могут снизить уровень pH. Большинство водоемов способны амортизировать эти изменения из-за их щелочности, поэтому небольшие или локальные колебания быстро изменяются, и их может быть трудно обнаружить ¹⁰.
Единицы pH и щелочности
Значения pH определяются в логарифмической шкале.
Значения pH представляются в виде числа от 0 до 14 в качестве стандартной единицы pH. Эта единица эквивалентна отрицательному логарифму молярной концентрации ионов водорода (-log(H+)) в растворе. В зависимости от точности измерения значение рН может быть выполнено с точностью до одного или двух знаков после запятой.
Однако, поскольку шкала pH является логарифмической, попытка усреднения двух значений pH была бы математически неверной. Если требуется среднее значение, его можно указать как медиану или диапазон, а не как простой расчет ¹⁰.
Щелочность может быть выражена в мг/л или в микроэквивалентах на литр (мэкв/л). В мг/л это относится к концентрациям карбоната (CO3 2-), бикарбоната (HCO3 – ) или карбоната кальция (CaCO3), хотя чаще всего встречается карбонат кальция ¹¹.
1 мг/л щелочности в пересчете на CaCO3 = 0,01998 мг/л щелочности
1 мг/л щелочности в пересчете на CaCO3 = 0,5995 мг/л щелочности в пересчете на CO3 2-
1 мг/л щелочности в пересчете на CaCO3 = 1,2192 мг/л щелочности HCO3 –
Почему pH важен?
Если рН воды слишком высокий или слишком низкий, живущие в ней водные организмы погибнут. pH также может влиять на растворимость и токсичность химических веществ и тяжелых металлов в воде ¹². Большинство водных существ предпочитают диапазон рН 6,5-9,0, хотя некоторые могут жить в воде с уровнем рН за пределами этого диапазона.
pH также может влиять на растворимость и токсичность химических веществ и тяжелых металлов в воде ¹². Большинство водных существ предпочитают диапазон рН 6,5-9,0, хотя некоторые могут жить в воде с уровнем рН за пределами этого диапазона.
Когда уровень pH выходит за пределы этого диапазона (вверх или вниз), это может привести к стрессу для систем животных и снижению показателей вылупления и выживаемости. Чем дальше значение pH от оптимального диапазона, тем выше уровень смертности. Чем более чувствителен вид, тем сильнее на него влияют изменения рН. В дополнение к биологическим эффектам экстремальные уровни pH обычно увеличивают растворимость элементов и соединений, делая токсичные химические вещества более «подвижными» и увеличивая риск их поглощения водными организмами ¹³.
Водные виды не единственные, на кого влияет рН. В то время как люди более терпимы к уровням pH (уровни для питья варьируются от 4 до 11 с минимальным раздражением желудочно-кишечного тракта), все еще есть проблемы ¹⁴. Значения pH выше 11 могут вызвать раздражение кожи и глаз, равно как и pH ниже 4. Значение pH ниже 2,5 вызовет необратимое повреждение кожи и внутренних органов ¹⁴. Более низкие уровни pH повышают риск мобилизации токсичных металлов, которые могут быть поглощены даже людьми, а уровни выше 8,0 не могут быть эффективно продезинфицированы хлором, вызывая другие косвенные риски ¹⁴. Кроме того, уровни pH за пределами 6,5-9.5 может повредить и вызвать коррозию труб и других систем, что еще больше повысит токсичность тяжелых металлов.
В то время как люди более терпимы к уровням pH (уровни для питья варьируются от 4 до 11 с минимальным раздражением желудочно-кишечного тракта), все еще есть проблемы ¹⁴. Значения pH выше 11 могут вызвать раздражение кожи и глаз, равно как и pH ниже 4. Значение pH ниже 2,5 вызовет необратимое повреждение кожи и внутренних органов ¹⁴. Более низкие уровни pH повышают риск мобилизации токсичных металлов, которые могут быть поглощены даже людьми, а уровни выше 8,0 не могут быть эффективно продезинфицированы хлором, вызывая другие косвенные риски ¹⁴. Кроме того, уровни pH за пределами 6,5-9.5 может повредить и вызвать коррозию труб и других систем, что еще больше повысит токсичность тяжелых металлов.
Даже незначительные изменения pH могут иметь долгосрочные последствия. Небольшое изменение pH воды может повысить растворимость фосфора и других питательных веществ, что сделает их более доступными для роста растений ¹⁰. В олиготрофном озере или озере с низким содержанием питательных веществ для растений и высоким содержанием растворенного кислорода это может вызвать цепную реакцию. С более доступными питательными веществами процветают водные растения и водоросли, увеличивая потребность в растворенном кислороде. Это создает эвтрофное озеро, богатое питательными веществами и растениями, но с низким содержанием растворенного кислорода. В эвтрофном озере другие организмы, живущие в воде, будут подвергаться стрессу, даже если уровень pH остается в оптимальном диапазоне.
В олиготрофном озере или озере с низким содержанием питательных веществ для растений и высоким содержанием растворенного кислорода это может вызвать цепную реакцию. С более доступными питательными веществами процветают водные растения и водоросли, увеличивая потребность в растворенном кислороде. Это создает эвтрофное озеро, богатое питательными веществами и растениями, но с низким содержанием растворенного кислорода. В эвтрофном озере другие организмы, живущие в воде, будут подвергаться стрессу, даже если уровень pH остается в оптимальном диапазоне.
Факторы, влияющие на рН воды
На рН воды может влиять множество факторов, как естественных, так и техногенных. Большинство естественных изменений происходит из-за взаимодействия с окружающими породами (особенно карбонатными формами) и другими материалами. pH также может колебаться в зависимости от осадков (особенно кислотных дождей) и сточных вод или сбросов шахт ¹³. Кроме того, концентрация CO2 может влиять на уровень pH.
Двуокись углерода и pH
Уровни pH могут ежедневно колебаться из-за фотосинтеза и дыхания в воде. Степень изменения зависит от щелочности воды.Углекислый газ является наиболее частой причиной повышения кислотности воды ¹⁵. Фотосинтез, дыхание и разложение способствуют колебаниям pH из-за их влияния на уровень CO2. Экстремальность этих изменений зависит от щелочности воды, но часто наблюдаются заметные суточные (суточные) вариации¹⁶. Это влияние более ощутимо в водоемах с высокой скоростью дыхания и разложения.
Хотя диоксид углерода существует в воде в растворенном состоянии (подобно кислороду), он также может реагировать с водой с образованием угольной кислоты:
CO2 + h3O <=> h3CO3
h3CO3 может терять один или оба иона водорода :
h3CO3 <=> HCO3 – + H+ …. HCO3 – <=> CO3 2- + H+
Высвобожденные ионы водорода снижают pH воды¹⁵. Однако это уравнение может работать в обоих направлениях в зависимости от текущего уровня pH, работая как собственная буферная система. При более высоком pH эта бикарбонатная система сдвинется влево, и CO3 2- захватит свободный ион водорода.
При более высоком pH эта бикарбонатная система сдвинется влево, и CO3 2- захватит свободный ион водорода.
Эта реакция обычно минимальна, так как h3CO3 имеет низкую константу растворимости (закон Генри) ¹⁵. Однако по мере увеличения уровня CO2 во всем мире количество растворенного CO2 также увеличивается, и уравнение будет выполняться слева направо. Это увеличивает h3CO3, что снижает pH. Эффект становится все более очевидным в исследованиях pH океана с течением времени.
Общее изменение годового уровня pH океана с 1700-х по 1990-е годы. (данные: Атлас Мирового океана 2009 г.; фото предоставлено: Plumbago; Wikipedia Commons) Углекислый газ в атмосфере снижает pH осадков. Приведенные выше уравнения также объясняют, почему рН дождя составляет примерно 5,65 ¹⁵. Когда капли дождя падают в воздух, они взаимодействуют с молекулами углекислого газа в атмосфере. Это создает h3CO3 в каплях дождя, снижая значение pH дождя ¹⁷. Уровень pH 5,65, хотя и кислый, не считается кислотным дождем. Ожидается, что естественный незагрязненный дождь или снег будет иметь уровень pH около 5,6 при стандартной концентрации CO2 в атмосфере 0,0355% ¹⁵. Кислотный дождь требует pH ниже 5,0 ²¹.
Ожидается, что естественный незагрязненный дождь или снег будет иметь уровень pH около 5,6 при стандартной концентрации CO2 в атмосфере 0,0355% ¹⁵. Кислотный дождь требует pH ниже 5,0 ²¹.
5,65 — это также pH воды, уравновешенной воздухом и не контактировавшей с карбонатными материалами или известняком.
Природные факторы, влияющие на pH
Карбонатные материалы и известняк — два элемента, которые могут смягчить изменения pH в воде. Карбонат кальция (CaCO3) и другие бикарбонаты могут объединяться как с ионами водорода, так и с гидроксильными ионами для нейтрализации pH¹⁸. Когда в почве присутствуют карбонатные минералы, буферная способность (щелочность) воды увеличивается, поддерживая рН воды близким к нейтральному даже при добавлении кислот или оснований. Дополнительные карбонатные материалы помимо этого могут сделать нейтральную воду слегка щелочной.
Известняковые карьеры имеют более высокий уровень pH из-за карбонатных материалов в камне. Молния может снизить pH дождя.
Молния может снизить pH дождя.Как упоминалось ранее, незагрязненный дождь слегка кислый (рН 5,6). Уровень pH дождя также может быть снижен из-за вулканического пепла, сульфатредуцирующих бактерий на водно-болотных угодьях, переносимых по воздуху частиц от лесных пожаров и даже молний ¹⁹. Если дождь падает на источник воды с плохой буферизацией, он может снизить pH близлежащей воды из-за стока.
Разлагающиеся сосновые иголки могут снизить уровень pH. Хвоя сосны или пихты также может снизить pH почвы и любой воды, которая стекает по ней, поскольку они разлагаются ¹⁸. Интенсивный фотосинтез увеличивает pH воды, удаляя CO2, хотя это изменение обычно происходит в течение суток ²⁰.
Искусственные регуляторы pH
Загрязнение воздуха, почвы или непосредственно воды может влиять на pH. Антропогенные причины колебаний рН обычно связаны с загрязнением. Кислотные дожди — один из наиболее известных примеров влияния человека на рН воды. Любая форма осадков с уровнем pH менее 5,0 известна как кислотный дождь ²¹. Этот осадок возникает в результате реакции воды с оксидами азота, оксидами серы и другими кислыми соединениями, понижая ее и без того слабокислый рН. Эти выбросы обычно возникают в результате горнодобывающих и плавильных работ или сжигания ископаемого топлива (сжигание угля и автомобили) ¹⁸. Чрезвычайно высокий уровень CO2 также может еще больше снизить pH дождя ¹⁷.
Этот осадок возникает в результате реакции воды с оксидами азота, оксидами серы и другими кислыми соединениями, понижая ее и без того слабокислый рН. Эти выбросы обычно возникают в результате горнодобывающих и плавильных работ или сжигания ископаемого топлива (сжигание угля и автомобили) ¹⁸. Чрезвычайно высокий уровень CO2 также может еще больше снизить pH дождя ¹⁷.
Загрязнение из точечного источника является распространенной причиной, которая может повышать или понижать pH в зависимости от вовлеченных химических веществ ¹⁸. Эти химические вещества могут поступать из сельскохозяйственных стоков, сбросов сточных вод или промышленных стоков. Добыча полезных ископаемых (особенно угля) приводит к кислотным стокам и просачиванию кислых грунтовых вод, если окружающая почва плохо защищена ²². Сброс сточных вод, содержащих моющие средства и продукты на основе мыла, может привести к тому, что источник воды станет слишком щелочным.
Типичные уровни pH
Рекомендуемые минимальные уровни pH для водных организмов.
Типичные уровни pH варьируются в зависимости от воздействия окружающей среды, особенно щелочности. Щелочность воды меняется из-за присутствия растворенных солей и карбонатов, а также минерального состава окружающей почвы. Как правило, чем выше щелочность, тем выше pH; чем ниже щелочность, тем ниже pH ⁶. Рекомендуемый диапазон рН для большинства рыб составляет от 6,0 до 9,0 с минимальной щелочностью 20 мг/л, с идеальным уровнем CaCO3 от 75 до 200 мг/л²⁰.
Океанические организмы, такие как рыба-клоун и коралл, требуют более высокого уровня pH. Уровень pH ниже 7,6 приведет к разрушению коралловых рифов из-за недостатка карбоната кальция ³⁹. Чувствительные пресноводные виды, такие как лосось, предпочитают уровни pH от 7,0 до 8,0, при этом уровень pH ниже 6,0 ⁴⁰ вызывает серьезные расстройства и физиологические повреждения из-за поглощенных металлов.
Соображения по охране окружающей среды
Естественные осадки, как дождь, так и снег, имеют pH около 5,6 из-за контакта с CO2 и других атмосферных воздействий. Большинство трав и бобовых предпочитают почвы с pH 4,5-7,0, поэтому небольшая кислотность дождя может пойти на пользу карбонатным почвам ²³.
Большинство трав и бобовых предпочитают почвы с pH 4,5-7,0, поэтому небольшая кислотность дождя может пойти на пользу карбонатным почвам ²³.
Кислотность окружающей среды также может влиять на рН воды. Это наиболее очевидно вблизи районов добычи полезных ископаемых, но эффект может возникать и естественным путем. Кислотный сток истощает щелочность воды и снижает рН ниже оптимального уровня. Это может быть приемлемо для некоторых водных видов (например, лягушек), но не для большинства рыб. Некоторые лягушки и другие земноводные часто могут переносить уровень pH всего 4,0 ²⁴. Из-за кислых почв Амазонки многие озера и реки имеют низкий уровень pH ³⁸. Из-за растворенных гуминовых веществ из стока и поглощения источники «черной воды» могут иметь pH всего 4,43. Источники с «чистой водой» будут иметь немного более высокое, но все же кислое значение pH ³⁸. Вот почему рыбы-ангелы и дискусы из бассейна реки Амазонки могут вполне счастливо жить в водах с pH всего 5,0 ²⁵.
Морская вода имеет рН около 8,2, хотя он может варьироваться от 7,5 до 8,5 в зависимости от местной солености. Уровень pH будет увеличиваться с увеличением солености до тех пор, пока вода не достигнет насыщения карбонатом кальция (CaCO3) ¹⁶. Океаны, как правило, имеют более высокую щелочность из-за содержания карбонатов и, следовательно, обладают большей способностью буферизовать свободные ионы водорода ²⁷.
Уровень pH будет увеличиваться с увеличением солености до тех пор, пока вода не достигнет насыщения карбонатом кальция (CaCO3) ¹⁶. Океаны, как правило, имеют более высокую щелочность из-за содержания карбонатов и, следовательно, обладают большей способностью буферизовать свободные ионы водорода ²⁷.
Пресноводные озера, пруды и ручьи обычно имеют pH 6-8 в зависимости от окружающей почвы и коренных пород ²¹. В более глубоких озерах, где происходит расслоение, рН воды обычно выше (7,5-8,5) у поверхности и ниже (6,5-7,5) на больших глубинах ¹⁰. Некоторые штаты, такие как Аляска, пытаются поддерживать стандарт pH для качества воды. Стандарт качества воды Аляски требует уровня pH от 6,5 до 8,5 для защиты многих популяций лосося в штате ⁴⁰.
Вопросы стратификации
Стратификация может привести к тому, что уровни pH в водоеме будут различаться выше и ниже клин. Стратификация обычно вызывается разницей температур в водоеме, когда каждый слой воды не смешивается со слоями выше или ниже ³⁷. Эти слои разделены клинами, известными как термоклины (температурные границы) или хемоклины (химические градиенты). Хемоклины могут быть основаны на кислороде, солености или других химических факторах, которые не пересекают клин, таких как углекислый газ. Из-за влияния CO2 на pH воды стратификация может привести к тому, что уровни pH будут различаться в зависимости от склона.
Эти слои разделены клинами, известными как термоклины (температурные границы) или хемоклины (химические градиенты). Хемоклины могут быть основаны на кислороде, солености или других химических факторах, которые не пересекают клин, таких как углекислый газ. Из-за влияния CO2 на pH воды стратификация может привести к тому, что уровни pH будут различаться в зависимости от склона.
Различия в уровне pH между водными слоями обусловлены повышенным содержанием CO2 в результате дыхания и разложения ниже термоклина. В кратерных озерах, таких как озеро Ниос или озеро Монун, pH быстро падает с уровня поверхности примерно 7 до 5,5 ниже 60 м (в термоклине и хемоклине) ²⁶. Это значительное падение происходит из-за насыщенного CO2, который накапливается в нижних слоях озера.
Приспособляемость
В то время как идеальный уровень pH для рыб составляет 7–8 (pH крови рыб составляет 7,4) ²⁰, большинство рыб могут адаптироваться к уровню pH окружающей среды (6,0–9)..0), если нет резких колебаний. Резким колебанием считается сдвиг рН на 1,4 (вверх или вниз)²². Для морских рыб pH воды должен оставаться в пределах 7,5–8,5 ⁹.
Резким колебанием считается сдвиг рН на 1,4 (вверх или вниз)²². Для морских рыб pH воды должен оставаться в пределах 7,5–8,5 ⁹.
Необычные уровни pH и последствия
Каменистые кораллы начинают обесцвечиваться и портиться по мере падения уровня карбоната и pH.Вредные эффекты становятся заметными, когда pH воды падает ниже 5,0 или поднимается выше 9,6. Болезненные эффекты из-за подкисления более выражены у морских рыб из-за их адаптации к более высокому pH. Когда pH ниже оптимального уровня, рыба становится восприимчивой к грибковым инфекциям и другим физическим повреждениям ¹⁶. Когда рН воды падает, растворимость карбоната кальция снижается, что препятствует росту скорлупы водных организмов ¹⁶. Как правило, на воспроизводство рыб влияет уровень pH ниже 5,0, и многие виды (например, морские рыбы или чувствительные пресноводные рыбы, такие как малоротый окунь) покидают зону ²¹. Рыба начинает умирать, когда рН падает ниже 4,0 ¹².
Низкий уровень pH может способствовать растворимости тяжелых металлов ¹². По мере увеличения уровня ионов водорода катионы металлов, таких как алюминий, свинец, медь и кадмий, высвобождаются в воду вместо того, чтобы поглощаться осадком. С увеличением концентрации тяжелых металлов возрастает и их токсичность. Алюминий может ограничивать рост и размножение, повышая уровень смертности при таких низких концентрациях, как 0,1–0,3 мг/л²². Кроме того, мобилизованные металлы могут поглощаться организмами во время дыхания, вызывая физиологические повреждения ²². Это особенно губительно для таких видов, как радужная форель ¹³.
По мере увеличения уровня ионов водорода катионы металлов, таких как алюминий, свинец, медь и кадмий, высвобождаются в воду вместо того, чтобы поглощаться осадком. С увеличением концентрации тяжелых металлов возрастает и их токсичность. Алюминий может ограничивать рост и размножение, повышая уровень смертности при таких низких концентрациях, как 0,1–0,3 мг/л²². Кроме того, мобилизованные металлы могут поглощаться организмами во время дыхания, вызывая физиологические повреждения ²². Это особенно губительно для таких видов, как радужная форель ¹³.
С другой стороны, высокие уровни pH могут повредить жабры и кожу водных организмов и вызвать смерть при уровне выше 10,0. В то время как некоторые африканские цихлиды прекрасно себя чувствуют при высоком уровне pH (до 9,5), большинство рыб не переносят его. Смерть может наступить даже при типичном уровне (9,0), если в воде присутствует аммиак ²¹. При низком и нейтральном уровне pH аммиак соединяется с водой с образованием иона аммония:
Nh4 + h3O <=> Nh5 + + OH –
Устойчивые к низкому pH водоросли могут образовывать цветки, которые могут убить озеро.
Аммоний, Nh5⁺, не токсичен и не влияет на водную жизнь. Однако при уровне pH выше 9 уравнение меняется на противоположное, и в воду выделяется аммиак ²². Аммиак, Nh4, чрезвычайно токсичен для водных организмов, и по мере увеличения pH уровень смертности увеличивается с концентрацией Nh4.
Что касается экосистемы, то мхи могут начать заселять водоемы, когда pH воды падает ниже 5. В эвтрофных озерах могут доминировать устойчивые к pH водоросли, приводя уровни pH к дневным максимумам и минимумам, образуя цветение водорослей, которое может убить озеро ¹⁶.
Щелочные и кислотные озера
По всему миру разбросано множество озер с необычным уровнем pH. Щелочные озера, также известные как содовые, обычно имеют уровень pH от 9 до 12. Это часто связано с высоким содержанием соли (хотя не каждое соленое озеро имеет высокий pH). В этих озерах высокая концентрация минералов, особенно растворенных солей: карбонатов и бикарбонатов натрия, кальция, магния ²⁸. В зависимости от озера также могут присутствовать бораты, сульфаты и другие элементы (обычно ионы сильных оснований) ²⁹. Щелочные озера образуются, когда единственным выходом для воды является испарение, в результате чего минералы накапливаются ³⁰. Эти минералы часто образуют столбы месторождений полезных ископаемых, известные как столбы туфа. Многие щелочные озера являются коммерческим источником кальцинированной соды и поташа, в то время как другие являются популярными туристическими направлениями из-за их «волшебных» целебных свойств (из-за содержания минералов).
В зависимости от озера также могут присутствовать бораты, сульфаты и другие элементы (обычно ионы сильных оснований) ²⁹. Щелочные озера образуются, когда единственным выходом для воды является испарение, в результате чего минералы накапливаются ³⁰. Эти минералы часто образуют столбы месторождений полезных ископаемых, известные как столбы туфа. Многие щелочные озера являются коммерческим источником кальцинированной соды и поташа, в то время как другие являются популярными туристическими направлениями из-за их «волшебных» целебных свойств (из-за содержания минералов).
Печально известным примером щелочного озера является озеро Натрон в Танзании. Озеро Натрон имеет pH до 10,5 из-за высоких концентраций декагидрата карбоната натрия (кальцинированной соды) и бикарбоната натрия (пищевой соды), которые попадают в воду из окружающей почвы ³¹. В то время как озеро поддерживает процветающую экосистему, включая фламинго, щелочную тиляпию и устойчивые к pH водоросли, фотограф Ник Брант создал множество запоминающихся изображений животных, погибших в этом озере ³¹. Тела этих животных сохраняются с помощью карбоната натрия, как в древнеегипетском процессе мумификации.
В то время как озеро поддерживает процветающую экосистему, включая фламинго, щелочную тиляпию и устойчивые к pH водоросли, фотограф Ник Брант создал множество запоминающихся изображений животных, погибших в этом озере ³¹. Тела этих животных сохраняются с помощью карбоната натрия, как в древнеегипетском процессе мумификации.
Кислотные озера обычно образуются вблизи вулканов, где серная кислота, сероводород, плавиковая кислота, соляная кислота и углекислый газ могут выщелачиваться в воду ³². В невулканических районах кислотные озера также могут образовываться после кислотных отложений в результате таких явлений, как кислотные дожди, загрязнение или кислотные стоки при добыче полезных ископаемых ³³. Как и их щелочные аналоги, кислые озера не имеют выхода, кроме испарения, концентрирующего сульфаты и кислоты. Кислоты могут попасть в воду в результате атмосферной диффузии в результате сжигания угля, кислотных дождей или после извержения. В вулканических озерах кислоты могут попадать в воду через активную фумаролу или вулканическое отверстие.
Кислые озера в Даллоле в Эфиопии образовались в результате выщелачивания кислоты из близлежащих вулканов. Сера и железо в воде оставляют желтые и ржавые отложения у кромки воды.
При уровне pH ниже 5,0 в кислых озерах могут жить лишь немногие организмы. Однако есть одно заметное исключение: елец Осорезан, или японский елец. Эта рыба прекрасно себя чувствует в кислых водах озера Осорезан, комфортно отдыхая при рН 3,5, и плавает в водах с нейтральным рН только для нереста ³⁴.
Окисление океана
По мере увеличения содержания CO2 в атмосфере увеличивается количество растворенного CO2, а pH воды снижается. (данные: NOAA/ESRL и Гавайский университет; кредит: SERC EarthLabs) Закисление океана вызвано притоком растворенного углекислого газа. По мере того, как уровень CO2 в атмосфере увеличивается из-за антропогенных причин, также увеличивается количество растворенного CO2, что, в свою очередь, снижает pH воды.
Когда вода насыщается CO2, это не только снижает pH океана, но и истощает источники карбоната кальция ³⁵. Карбонат кальция, CaCO3, является необходимым компонентом для построения кораллов, раковин и экзоскелетов многих водных существ. По мере снижения уровня CO3²⁻ морским существам становится все труднее строить свои раковины.
Как уже упоминалось в разделе «Углекислый газ и pH», дополнительный CO2 увеличивает количество ионов водорода в воде, снижая pH:
CO2 + h3O <=> h3CO3 … h3CO3 <=> (H+) + HCO3⁻
При уровне pH от 6,4 до 10,33 некоторые из этих ионов водорода присоединяются к карбонат-ионам ²²:
(H+) + CO3 2- <=> HCO3 –
Таким образом, по мере увеличения уровня CO2 доступность карбоната , CO3 2- уменьшается, уменьшая количество, доступное для строительства раковин и кораллов ³⁶.
CO2 + h3O + CO3²⁻ <=> 2HCO3⁻
При рН океана 8,3 уровень карбоната достаточно высок для образования кораллов. По мере увеличения CO2 и снижения pH уровень карбоната быстро упадет ниже оптимального уровня.
По мере увеличения CO2 и снижения pH уровень карбоната быстро упадет ниже оптимального уровня.Высокие уровни CO2 также затрудняют поддержание текущей скорлупы из-за более низкого уровня pH и конкуренции за карбонат ³⁵.
Кроме того, насыщение воды воздухом основано на парциальном давлении согласно закону Генри. По мере увеличения уровня CO2 в воздухе увеличивается и его парциальное давление. Это снижает парциальное давление кислорода, снижая уровень его насыщения и способствуя гипоксии (с низким содержанием O2) ³⁵.
Хотя океаны никогда не станут «кислыми» (с pH ниже 7), даже незначительное снижение pH вызывает стресс у морских организмов и увеличивает уровень смертности. pH является логарифмическим, а это означает, что уменьшение на 0,1 эквивалентно увеличению кислотности почти на 30% ³⁵.
Процитировать эту работу
Fondriest Environmental, Inc. «pH воды». Основы экологических измерений. 19 ноября 2013 г. Интернет. < https://www.fondriest.com/environmental-measurements/parameters/water-quality/ph/ >.


 ru
ru
 Средние соли диссоциируют сразу:
Средние соли диссоциируют сразу: