Карбид кальция плюс вода: CaC2+H2O=? уравнение реакции
alexxlab | 12.12.2022 | 0 | Разное
Карбид вред для здоровья человека
Карбид для сварки или полное наименование карбид кальция – это главное вещество для получения ацетиленового газа. На самом деле, это активное химическое соединение кальция и углерода и в готовом виде представляет собой твердый состав с темно – серым или коричневым оттенком. По запаху, карбид напоминает резкий запах чеснока и вступает в реакцию водой с выделением тепла.
Для сварки карбид кальция является идеальным веществом, так как выделяет при контакте с водой ацетилен – летучий газ, основа кислородной сварки, напайки, металлизации и прочих процессов, связанных с обработкой металлов. Карбид кальция создают при температуре до 2300 градусов Цельсия с помощью сплавления кокса и негашеной извести в электрической дуговой печи (рис. 1). После этого, расплавленное вещество выливают на изложницы, и в них он остывает и принимает твердое состояние. После этого карбид для сварки дробят по кускам, размер которых не превышает 8 см. В результате вещество будет состоять из 75 процентов карбида кальция, а остальная часть – примеси, окиси извести и прочее.
Внешний вид и характеристики технического карбида кальция
Впервые рассматриваемый состав был получен в 1862 году. Проводимая процедура касалась отделения кальция от извести, в результате чего получился бледно-серый состав без признаков, свойственных металлам. В результате опыта был получен карбид, который в последствии стал активно использоваться при выпуске различной продукции.
В начале 20 века карбид кальция стали использовать для производства ацетилена в больших объемах. Именно поэтому стали вести активные исследования для выявления более производительной технологии.
Технические характеристики материала определяют его широкое распространение. Внешний вид вещества характеризуется светло-серым цветом, выпускаются карбиды в виде камня или порошка.
youtube.com/embed/qK9oXsQ0mwY?feature=oembed” frameborder=”0″ allow=”accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture” allowfullscreen=””/>
Физические свойства
При выборе практически любого материала следует уделять больше всего внимания физическим свойствам. У рассматриваемого они следующие:
- Соединение имеет кристаллическую структуру.
- Показатель температуры плавления составляет 2300 °С. Стоит учитывать, что подобная цифра свойственна только чистому составу. Добавление в состав различных примесей приводит к тому, что температура плавления существенно падает.
Гидролиз: Атакует вода [2] – Страна Знаний
Продолжение. Начало в №1, 2017
1.
 Секреты карбида и цианамида
Секреты карбида и цианамидаКарбид кальция СаС2 получают прокаливанием оксида кальция с коксом. В 1898 г. немецкий химик Ф. Роте обнаружил, что при нагревании в атмосфере азота до 1100 °С карбид кальция начинает самопроизвольно превращаться в цианамид кальция CaCN2.
Когда Роте погрузил гранулы карбида кальция и цианамида кальция в воду, то увидел выделение газа только в случае СаС2. Но, при этом, в обоих случаях красная лакмусовая бумага в жидкости посинела, а на дне сосудов выпали белые осадки.
Твёрдое вещество, выпавшее в сосуде с CaCN2, под действием соляной кислоты начало выделять углекислый газ.
Раскройте секрет взаимодействия карбида и цианамида кальция с водой.
2. Происхождение малахита
Необычайно эффектный поделочный камень густо-зелёного цвета, минерал малахит — продукт реакции гидролиза.
Как происходит этот гидролиз?
3. Загадочное предписание
Когда химики растворяют в воде бесцветные кристаллы дихлорида олова, то обязательно добавляют соляную кислоту, а в склянку с готовым раствором бросают несколько гранул металлического олова.
Зачем это делают?
4. Существенное различие
Тетрахлориды олова и свинца — жидкие вещества. Одно из них бесцветное, другое — жёлтого цвета. Они весьма сильно различаются своим отношением к воде.
В чем состоит это различие?
5. Галоген плюс азот равняется — чему?
Газообразный трифторид азота NF3 химически довольно устойчив. В последние 30 лет он не менял своего названия и формулы, в отличие от тёмно-жёлтого жидкого, похожего на масло, взрывоопасного соединения нитрида трихлора Cl3N, который раньше называли «трихлоридом азота» (NCl3).
Каким образом реакции гидролиза подсказали правильную формулу этого вещества?
6. Ионы в кристаллах
Французский химик Поль Лебо в 1895 г. впервые получил карбид бериллия при взаимодействии оксида бериллия с углем.
Лебо спрессовал из смеси ВеО и С таблетки и нагрел их в атмосфере водорода при 1900°С. По окончании реакции образовались красивые кирпично-красные кристаллы Ве2С.
Позднее, в 1924 г., другой французский химик — Жан Дюран, пропустив сухой ацетилен над нагретым до 450°С порошком бериллия, получил чёрные кристаллы карбида бериллия другого состава — ВеС2. Впрочем, чёрный цвет продуктов реакции скорее всего был вызван примесью углерода, который одновременно выделялся при термическом разложении ацетилена.
Позже установили, что карбид Лебо содержит в кристаллической решетке ионы Ве2+ и С4-, а карбид Дюрана — ионы Ве2+ и С22-.
Как эти карбиды будут реагировать с водой?
7. Дождь помог
В 1852 г. немецкий химик Фридрих Вёлер пытался выделить металлический кальций из карбоната кальция (известняка), прокаливая его с древесным углем.
Он получил спекшуюся массу сероватого цвета, в которой не обнаружилось никаких признаков металла.
С огорчением Вёлер выбросил эту массу на свалку во дворе лаборатории. Во время дождя лаборанты заметили, что каменистая масса выделяет неизвестный газ.
Что это за газ?
8. Гадание на воде
Две бесцветные, сильно дымящие на воздухе жидкости — оксид-трихлорид фосфора РСl3О и оксид-дихлорид серы SCl2O — вылили в воду. Образовались два раствора.
При нагревании раствор, полученный из PCl3O, выделил летучее вещество, окрасившее синюю лакмусовую бумагу в красный цвет, а при взаимодействии с нитратом серебра образовавшее белый осадок. Раствор, полученный из SCl2O, обесцветил перманганат калия, а затем при добавлении хлорида бария выделил белый осадок.
Что же произошло?
9. «Смущённый» ацетат
К раствору ацетата натрия добавили фенолфталеин, а потом нагрели. Раствор окрасился в малиновый цвет, как будто покраснел от смущения. Однако после охлаждения все признаки «смущения» исчезли, раствор обесцветился.
Почему это произошло?
10. Сами кислые и дают «кислый спирт»
В 1547 г. Иван Грозный поручил немцу Шлитте ехать посланником в Немецкую землю и вывезти оттуда «мастера для варения квасцов».
Но сделать это не удалось: Шлитте был схвачен и заключен в тюрьму во владениях Ливонского ордена. Алюмокалиевые квасцы (додекагидрат сульфата алюминия-калия KAl(SO4)2•12Н2O) широко использовались в медицине и для производства серной кислоты, которую в то время называли «кислым спиртом».
Вот как Михаил Ломоносов описывал квасцы: «Квасцы от своего кислого воздуха на российском языке и имя себе весьма правильно имеют, ибо кроме того, что оне очень кислы, ещё и через перегонку из реторты дают весьма кислый спирт, который с купоросной кислотой одной натуры».
Что происходит с квасцами при растворении в воде и при нагревании?
11. Чужой!
Американский химик Г. Классен в 1962 году первым получил тетрафторид ксенона XeF4.
Когда он внёс в воду очень небольшую порцию этого белого, очень гигроскопичного вещества, самого по себе невзрывоопасного, произошла бурная реакция. Содержимое сосуда было выброшено чуть ли не в лицо Классену.
Содержимое сосуда было выброшено чуть ли не в лицо Классену.
В продуктах реакции он установил присутствие триоксида ксенона, газообразного ксенона, кислорода и фтороводорода.
Тогда химик решил провести реакцию при более низкой температуре. Он охладил лёд до -80°С и посыпал его сухим XeF4. Через некоторое время на поверхности льда появился светло-жёлтый продукт, в молекуле которого содержался один атом кислорода, а плёнка жидкости, стекавшая со льда, представляла собой жидкий фтороводород.
Какое из проведенных Классеном превращений было реакцией гидролиза?
12. Удивительная соль — «Персоль»
Известный каждой хозяйке порошок для отбеливания при стирке «Персоль» — пероксокарбонат натрия состава 2Na2CO3•ЗН2O2 — в кипящей воде выделяет кислород и обесцвечивает загрязнения.
Можно ли считать, что действие персоли основано на реакциях гидролиза?
13. Задание: осветлить и смягчить
С помощью сульфата алюминия, который применяется на станциях городского водоснабжения, можно провести осветление и смягчение воды.
Как это происходит?
14. «Паяльная кислота»
Зачастую перед спаиванием металлических деталей их поверхность очищают от оксидной пленки, обрабатывая «паяльной кислотой» — раствором хлорида цинка.
Как же получилось, что эта соль действует и применяется как «кислота»?
15. Гидролиз в кипятке
Правда ли, что при длительном кипячении раствор хлорида аммония становится более кислым, а раствор сульфида натрия — более щелочным?
Почему это происходит?
Подсмотреть ответы
Н.Г. Антонюк, кандидат химических наук, доцент, Национальный университет «Киево-Могилянская академия»
Карбид кальция реагирует с водой с образованием: $ (a) {\ text {этан}} \\ (b) {\ text {эфир}} \\ (c) {\ text {ацетилен}} \\ (d){ \text{ Alcohol}} \\ $
Ответ
Подтверждено
261.3k+ просмотров
Подсказка. В этом вопросе используйте химическую реакцию, когда $Ca{C_2}$ реагирует с водой, которая представляет собой $Ca{C_2}\ влево( s \вправо) + 2{H_2}O\влево( l \вправо) \to {C_2}{H_2}\влево( g \вправо) + Ca{\влево({OH} \вправо)_2}\влево (г\справа)$. Продукты в правой части являются результатом действия реагентов.
Продукты в правой части являются результатом действия реагентов.
Полный ответ:
Как мы знаем, карбид кальция является твердым элементом и химическая формула карбида кальция =$Ca{C_2}$.
Теперь, как мы знаем, вода – это жидкость, химическая формула которой =${H_2}O$.
Теперь химическая реакция этих двух соединений показана ниже:
$ \Rightarrow Ca{C_2}\left( s \right) + 2{H_2}O\left( l \right) \to {C_2}{H_2}\ left( g \right) + Ca{\left( {OH} \right)_2}\left( g \right)$
Здесь мы используем одну единицу карбида кальция и две единицы воды, поэтому в результате получается ацетилен ($ {C_2}{H_2}$), который представляет собой газ.
Итак, когда карбид кальция реагирует с водой, образуется ацетилен.
Итак, это требуемый ответ.
Следовательно, вариант (C) является правильным ответом.
Примечание. ${C_2}{H_2}$, образующийся в результате этой реакции, также называется этином, формально известным как ацетилен. Это углеводород и простейший алкин. Ацетилен обычно используется для сварки и резки. Сварка с использованием ацетилена также известна как кислородная или газовая резка. Ацетилен в основном бесцветный газ.
Ацетилен обычно используется для сварки и резки. Сварка с использованием ацетилена также известна как кислородная или газовая резка. Ацетилен в основном бесцветный газ.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал Химический класс 12 JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 Химический класс 12 JEE_Main
Какой элемент обладает наибольшим радиусом атомов Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций класса 12 по химии JEE_Main
В Индии по случаю бракосочетания фейерверков класс 12 по химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть отнесены к классу 12 по химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из перечисленного является истинным пероксидом A rmSrmOrm2 12 класса химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А класса 11 химии JEE_Main
Phosphine is obtained from the following ore A Calcium class 12 chemistry JEE_Main
Trending doubts
Students Also Read
Calcium Carbide
Carbide
Tungsten Carbide
Silicon Carbide – SiC
Boron Carbide
Что происходит, когда металл реагирует с водой!
Кальций
Сульфат кальция
Хлорид кальция
Ацетат кальция
газ – Могу ли я сделать импровизированную систему отопления, использующую карбид кальция и воду?
спросил
Изменено 9 лет, 4 месяца назад
Просмотрено 2к раз
Сейчас в Австралии зима, и мне холодно.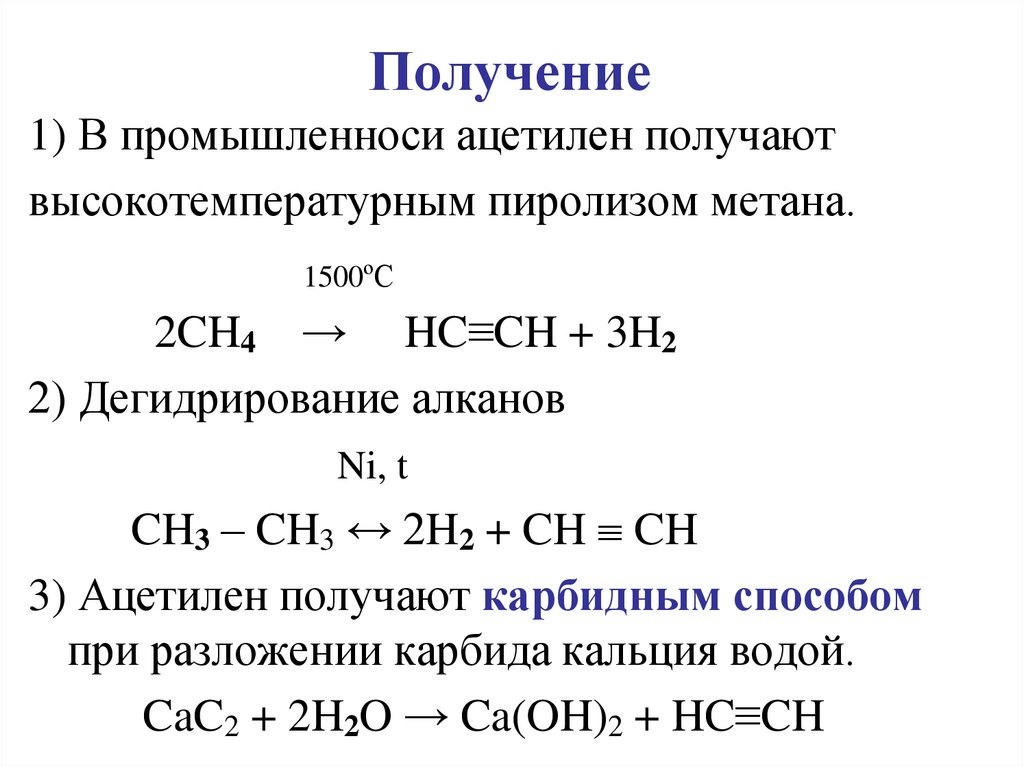 Сегодня я нашел несколько килограммов карбида кальция (CaC2), который при взаимодействии с водой дает значительное количество газообразного ацетилена. В настоящее время я использую его с этим устройством для освещения, но мне интересно, можно ли сделать из этого материала свой собственный газовый обогреватель (у нас здесь нет газовых линий, только электричество, которое дорого). Газообразный ацетилен горит довольно жарко, поэтому я не уверен, есть ли много материалов, которые могут выдержать такое тепло
Сегодня я нашел несколько килограммов карбида кальция (CaC2), который при взаимодействии с водой дает значительное количество газообразного ацетилена. В настоящее время я использую его с этим устройством для освещения, но мне интересно, можно ли сделать из этого материала свой собственный газовый обогреватель (у нас здесь нет газовых линий, только электричество, которое дорого). Газообразный ацетилен горит довольно жарко, поэтому я не уверен, есть ли много материалов, которые могут выдержать такое тепло
Возможно ли/целесообразно/безопасно сделать свой собственный газовый обогреватель с использованием ацетилена?
- отопление
- газ
4
Патент 1983 г.: Ацетиленовая печь или обогреватель использует карбид кальция.
Мне кажется, что капание воды может быть трудно контролировать в течение длительного периода времени. Кроме того, влажный осадок также может раздражать. Если бы я мог, я бы вместо этого использовал пропан.

