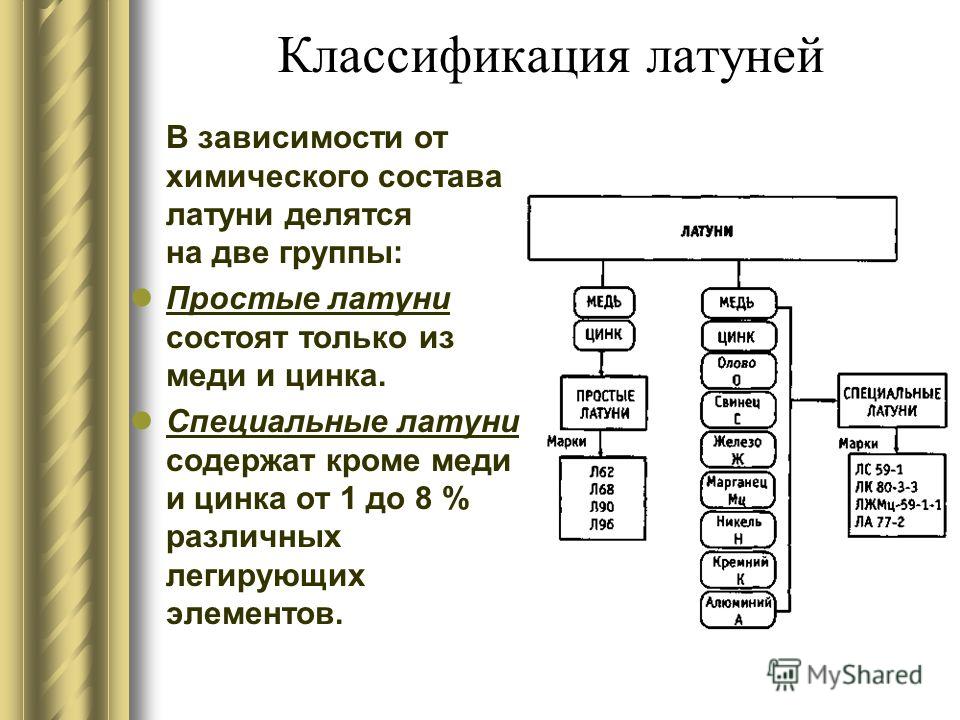
Классификация по назначению и по химическому составу: Классификация ЛКМ по химическому составу и обозначение по связующему
alexxlab | 18.09.1985 | 0 | Разное
по назначению и составу — «СпектрЦвет» (г. Москва)
Классификация сталей: по назначению и составу — «СпектрЦвет» (г. Москва)Ваш город: Москва
Ваш город
Москва?
Да Нет
03:12 | 20.12.2021
Сталь – это сплав железа (от 45%) и углерода (0.1-2.14%), который отличается от чугуна пониженным содержанием карбона, примесей и присутствием специальных добавок, изменяющих его физико-механические и химические свойства. Металлургия производит много видов стали с различной структурой, свойствами и сферой применения. Производители стальных изделий пользуются системой классификации и маркировки, которая ведется согласно стандартам ГОСТ Р 54384-2011.
Классификация основных видов стали производится с учетом трех главных параметров – химический состав, качество и назначение. Такой подход позволяет систематизировать большое количество стальных сплавов, определить их основные эксплуатационные показатели и сферу применения.
Классификация по составу
- Углеродистые – твердые, прочные стали, которые легко подвергаются металлообработке, имеют пластичный и упругий внутренний слой. Их свойства определяет универсальность металла и широкую сферу его использования. Сталь делится на низко- (менее 0.25%), средне- и высокоуглеродистую (более 0.6%).
- Легированные, содержащие в своем составе более 20 видов дополнительных элементов, которые придают металлу различные физические и химические свойства. Класс таких сталей делится на три группы – низко- (добавок не более 0.25%), средне- (до 0.6%) и высоколегированные, количество добавок в которых может превышать 10%.
Если углеродистые стали относятся к категории универсальных, то легированные сплавы являются специализированными. Существуют 5 структурных типов легированной стали с различной зернистостью и молекулярными связями, которые определяют сферу применения металла:
- аустенитная с высоким уровнем легирования, присутствием в числе добавок хрома и никеля, дающих сплаву пластичность, устойчивость к коррозии и сверхпрочность при критически низких температурах;
- ферритная, с наличием в кристаллической решетке мелкодисперсного зерна.
 Присутствие ванадия, карбидов и кремния увеличивает жаростойкость металла и снижает показатель хрупкости, позволяя избегать его растрескивания;
Присутствие ванадия, карбидов и кремния увеличивает жаростойкость металла и снижает показатель хрупкости, позволяя избегать его растрескивания; - мартенситная с высоким (до 17%) содержанием хрома и добавками (молибден, ванадий, вольфрам), отличается особым способом остывания металла после закалки, который обеспечивает стали;
- бейнитная – отличается возможностью сохранения промежуточной стадии формирования кристаллической решетки и включением компонентов (марганец, хром, кремний), которые обеспечивают металлу хорошую свариваемость и сопротивление растрескиванию;
- перлитная – широко распространенный тип инструментальной стали с низким уровнем легирования, прошедшей закалку и отпуск.
Специализированные сплавы могут, как улучшать эксплуатационные показатели металла, так и делать его недопустимым для применения в некоторых областях. Знание структуры металла и содержания добавок позволит не только провести классификацию, но и выбрать самую подходящую марку стали для условий производства.
Классификация по качеству
Эксплуатационные показатели сталей зависят не только от присутствия в их составе легирующих добавок, но и от количества вредных примесей, допущенных в производстве металла. Поэтому классификация сталей производится и по их качеству. Стали группируются в 4-х категориях:
- стандартная – с присутствием серы до 0.06 и фосфора не более 0.07%;
- качественная – содержание серы и фосфора не превышает 0.035%;
- высокого качества – сера и фосфор до 0.025%;
В четвертую группу входят стали особо высокого качества, в которых объем S и F не превышает 0.015%.
Классификация по назначению
В число особо высококачественных марок входят металлы, составляющие отдельную группу. Она позволяет провести классификацию сталей по их назначению:
- конструкционные;
- инструментальные;
- с особыми физико-механическими показателями;
- с особыми химическими характеристиками.

Система такой классификации достаточно условна. Некоторые обозначения сталей могут дублироваться в разных группах. Среди всего разнообразия марок можно выделить несколько общих групп:
- инструментальные,
- нержавеющие,
- шарикоподшипниковые,
- конструкционные,
- быстрорежущие,
- автоматные,
- жаростойкие.
Многие виды сталей по своим техническим характеристикам подходят и для соседних групп. Поэтому при разработке деталей инженеры и технологи отдают предпочтение маркам сталей с учетом таких важных показателей, как цена, совместимость с другими механизмами, обрабатываемость.
Популярное в блоге
Сфера применения нержавеющей…
Полоса нержавеющая – это прокатный профиль с цельным прямоугольным…
Требования к изготовлению…
К металлоконструкциям относят стойки, колонны, устойчивые балки…
Требования к антикоррозийной…
Широкая область применения и востребованность металлоконструкций…
Как происходит резка…
Чтобы сформировать из металла деталь проектных размеров или заготовку…
Листовой металл и области…
Листовой металл – продукция металлопроката, которая широко применяется…
Обратная связь
Наш менеджер свяжется с Вами в самое ближайшее время.
Наш менеджер свяжется с Вами в самое ближайшее время.
Наш менеджер свяжется с Вами в самое ближайшее время.
Классификация современных пломбировочных материалов
I. По назначению современные пломбировочные материалы делятся на следующие группы:
1. Материалы для повязок и временных пломб
2. Материалы для лечебных подкладок
3. Материалы для изолирующих подкладок
4. Материалы для постоянных пломб
5. Материалы для обтурации (заполнения) корневых каналов (будут рассмотрены в разделе “Эндодонтия”)
II.Классификация постоянных пломбировочных материалов (по пластичности в момент пломбирования и по химическому составу):
1. Цементы:
Цементы:
1.1. Минеральные цементы
а) цинк-фосфатные
б) силикатные
в) силикофосфатные
1.2. Полимерные цементы:
а) поликарбоксилатные
б) стеклоиономерные
2. Полимерные пломбировочные материалы:
2.1. Ненаполненные:
а) на основе акриловых смол
б) на основе эпоксидных смол
2.2. Наполненные (композитные)
3. Компомеры – композиционно-иономерные системы4. Металлические пломбировочные материалы
4.1. Амальгамы:
а) серебряные
б) медные
4.2. Сплавы галлия
4.3. Золото для прямого пломбирования
Б. Непластичные (первично твердые) (рассматриваются в разделе “Ортопедическая стоматология”):
1. Вкладки:
Вкладки:
а) металлические (литые)
б) фарфоровые
в) пластмассовые и композитные
г) комбинированные (металл+фарфор)
2. Виниры – адгезивные облицовки
3. Штифты:
а) парапульпарные штифты (пины)
б) внутрипульпарные штифты (посты) (раздел “Эндодонтия”)
III. По способу отверждения
Материалы химического отверждения – материалы, переходящие из пластичного в твердое состояние за счет происхождения в них химической реакции между двумя химическими компонентами после их смешивания (амальгама, минеральные и полимерные цементы, композиты химического отверждения).
Светоотверждаемые материалы – полимеризация этих материалов происходит за счет химической реакции, которая инициируется светом специального (полимеризующего) источника.

Материалы двойного отверждения – материалы, переходящие из пластичного в твердое состояние за счет химического взаимодействия своих компонентов и действия света полимеризующего источника (гибридные стеклоиономерные цементы, компомеры).
Требования к временным пломбировочным материалам:
1. Герметичное закрытие полости зуба
2. Достаточная прочность на сжатие
3. Индифферентность к пульпе, тканям зуба организму в целом и лекарственным средствам
4. Легкое введение и выведение из полости
5. Устойчивость к действию ротовой жидкости
6. Отсутствие в составе материала компонентов, нарушающих процесс адгезии и твердения постоянных пломбировочных материалов
Требования к “идеальному” постоянному пломбировочному материалу
Требования
к “идеальному” пломбировочному
материалу были сформулироаваны еще
Миллером в конце 19 века, но актуальны
до сих пор.
1.Быть химически стойким (не растворяться под действием слюны, ротовой жидкости и пищи )
2.Быть механически прочным, т.к. при жевании создаются нагрузки от 30 до 70 кг
3.Быть устойчивым к истиранию
4.Плотно прилегать к стенкам полости. Обладать хорошей адгезией.
5.Длительно сохранять форму и объем, не давать усадки, обеспечивая длительную пространственную стабильность
6.Быть минимально зависимым от влаги в процессе пломбирования и отверждения
7.Быть безвредным для организма в целом, для тканей зуба и слизистой оболочки полости рта (понятие биосовместимости)
8.Соответствовать по внешнему виду естественным зубам ( понятие эстетики цвета, прозрачности)
9.Обладать низкой теплопроводностью, чтобы предотвращать температурное раздражение пульпы зуба
10. Иметь
коэффициент теплового расширения,
сходный с таковым у тканей зуба
Иметь
коэффициент теплового расширения,
сходный с таковым у тканей зуба
11.Обладать хорошими манипуляционными свойствами (быть удобным в применении): достаточно пластичным, легко вводиться в полость, не прилипать к инструментам и т.д.
12.Быть рентгеноконтрастным
13.Обладать противокариозным действием
14.Иметь длительный срок действия, не требовать особых условий хранения и транспортировки
15.Быть доступным по цене
Несмотря на то, что современные пломбировочные материалы во многом соответствуют этим требованиям, тем не менее “идеальный” пломбировочный материал до сих пор не существует. В связи с этим стоматологи вынуждены комбинировать различные материалы, учитывая отрицательные и положительные их свойства, а также индивидуальные особенности течения кариеса у данного пациента.
Классификация пестицидов и их основные виды
Автор Мария Чурсина На чтение 8 мин. Просмотров 8.4k. Опубликовано
Просмотров 8.4k. Опубликовано
Пестициды — это химические вещества, которые при взаимодействии с вредоносными живыми организмами, вызывают у них различные физиологические и биологические нарушения функций, в результате чего происходит их гибель.
Впервые в 470 году до н.е. Плиний писал Демокриту о том, что растения необходимо опрыскивать водной настройкой из маслин, для защиты от мучнистой росы. Также люди постоянно испытывали действие токсических соединений, трав, и отваров на вредные для растений организмы.
Сейчас в мировой практике несколько сотен химических соединений, на основании которых запатентовано более 5000 пестицидов. С помощью такого огромного разнообразия можно построить систему химической защиты растений с чередованием действующего вещества, что спасет от привыкания вредного организма к данным ядам.
Содержание
- Классификация пестицидов по химическому составу
- Классификация пестицидов по объектам применения
- Классификация пестицидов по механизму действия
- Классификация пестицидов по токсичности
- Способы внесения пестицидов
- Основные препаративные формы пестицидов
Прежде всего виды пестицидов делятся на три группы по химическому составу:
- Химические и неорганические препараты — это соединения химического возникновения (соединения ртути, фтора, бария, меди и т.
 д.). Их преимуществом являются высокая эффективность и длительный период защиты.
д.). Их преимуществом являются высокая эффективность и длительный период защиты. - Органические или органо-синтетические пестициды — это широкая категория, которая является самой распространенной для использования в растениеводстве.
- Препараты растительного, грибного и бактериального происхождения. Они созданы из природных материалов или живых организмов (бактерии, грибы, растения, минералы и т.д.). Поэтому являются безопаснее, чем химические. К ним относятся биопрепараты, пиретрины, антибиотики и фитонциды.
Классификация пестицидов по объектам примененияО подробном описании биопрепаратов можно прочитать в статье:
«Что такое Биофунгициды их виды и список популярных препаратов»
- Инсектициды — это химические препараты для защиты от вредоносных насекомых и животных.
- Фунгициды — против возбудителей грибных заболеваний.
- Гербициды — это препараты, которые приводят к гибели сорняков.

- Овициды — препараты, которые убивают яйца насекомых и клещей.
- Лаврициды — пестициды против личинок насекомых.
- Акарициды — используются для борьбы с вредными клещами.
- Инсектоакарициды — пестициды, которые способны бороться сразу с насекомыми и клещами.
- Нематициды — препараты, которые используются для умертвления круглых червей (нематод).
- Лимациды — яды, убивающие слизней.
- Авициды — используются для борьбы с птицами-вредителями.
- Родентициды – пестициды для отравления грызунов.
- Зооциды — препараты для уничтожения животных.
- Афициды — препараты для борьбы с тлями.
- Бактерициды — против возбудителей бактериальных болезней растений.
- Вироциды — используются для борьбы с вирусными заболеваниями.
- Арборициды – пестициды, которые помогают избавиться от деревянистой и кустовой растительности.

- Акарициды — против злаковых сорняков.
- Альгициды — против водорослей и водной растительности.
- Дефолианты — ядохимикаты, которые ускоряют опадение листьев.
- Десиканты — пестициды, которые содействуют высыханию растений.
- Регуляторы роста — соединения, которые влияют на процессы роста и развития культур.
- Ретарданты — препараты, которые задерживают рост растений.
- Дефлоранты — используются для удаления цветков и завязей.
- Антирезистенты — специфические добавки, которые уменьшают резистентность вредителей к пестицидам.
- Гаметоциды — препараты, которые вызывают стерильность сорных растений.
- Синергисты — вещества, которые усиливают влияние пестицидов на вредоносный организм.
Вдобавок сейчас применяют множество биологически активных веществ, таких как:
- Репелленты — вещества, которые отпугивают насекомых и животных.

- Аттрактанты — препараты, которые приманивают насекомых и животных в ловушки.
- Синтетические феромоны – соединения, которые привлекают самцов насекомых и животных.
- Антифиданты — угнетают питание насекомых.
- Стерилянты (Хемостерилизаторы) — избавляют насекомых от способности к размножению.
Гербициды делятся по характеру воздействия на растения:
- Избирательные или селективные гербициды — воздействуют на одни виды сорных растений, но при этом не опасны для других, чаще всего культурных видов.
- Гербициды сплошного или общеистребительного действия убивают всю растительность.
Избирательность гербицидов является условной и работает при условии, что норма их внесения не превышена.
Также гербициды делятся по способу попадания в растение:
- Контактные гербициды — пагубно влияют только на те участки растений, на которые попал химический раствор.
- Системные гербициды — это химические препараты, которые при попадании на растение быстро в него проникают и приводят в полной гибели. Они очень эффективны против сорных растений с сильной корневой системой, в том числе против многолетних.
Инсектициды и некоторые виды пестицидов делятся по типу воздействия на вредителя:
- Контактные инсектициды – пестициды, которые приводят к гибели вредоносного объекта при попадании на него.
- Кишечные инсектициды – препараты, которые отравляют насекомое или животное после их поедания.
- Системные инсектициды – ядохимикаты, которые проникают в растение через сосуды и приводят к гибели насекомых, поедающих его.
- Фумиганты – отравляют вредителей газом, который проникает в их дыхательные пути.

Фунгициды делятся на два типа по характеру действия:
- Защитные фунгициды – используются для профилактики появления болезней.
- Лечащие фунгициды – препараты для лечения болезней (терапевтические, куративные, искореняющие и истребительные).
Кроме этого, фунгициды делят по способу проникновения во вредоносный организм:
- Контактные фунгициды – это препараты, которые воздействуют на возбудителя болезни при контакте с ним, а также препятствуют распространению инфекции на другие части растений.
- Системные фунгициды – это пестициды, которые способны усваиваться растениями в безопасных количествах и таким образом изменять обмен веществ культуры и усиливать ее способность сопротивляться болезни. Они предотвращают заражение здоровых частей растения и уничтожают возбудителя, который уже проник в него.

Все виды пестицидов делятся зависимо от степени воздействия на организм человека и животных при попадании в желудок или на кожу. Гигиеническая классификация пестицидов включает в себя такие классы:
- I класс – сильнодействующие или чрезвычайно опасные препараты. Большая часть из них уже давно запрещена к применению (например, ДДТ).
- II класс – высокотоксичные или опасные препараты. Они показывают высокую эффективность в борьбе с вредителями, но их нужно вносить нормировано с использованием всех мер безопасности (Децис, Базудин, Би-58 и др.)
- III класс – среднетоксичные или умеренноопасные пестициды. К ним относятся такие ядохимикаты: Актеллик, Хлорокись меди, Медный купорос, Карбофос и т.д.
- IV класс – малотоксичные или малоопасные препараты. Они включают в себя такие инсектициды, как Бордосская смесь и т.
 д. Также к данному классу принадлежат биопрепараты: Триходермин, Псевдобактерин, Лепидоцид, Битоксибациллин, Фитоверм, Метавайт и т.д.
д. Также к данному классу принадлежат биопрепараты: Триходермин, Псевдобактерин, Лепидоцид, Битоксибациллин, Фитоверм, Метавайт и т.д.
В зависимости от препаративной формы пестицида и вредного организма бывают такие методы внесения:
- Опрыскивание
- Опыливание
- Фумигация
- Аэрозоль
- Протравливание семенного и посадочного материала перед посадкой
- Разбрасывание гранул по поверхности почвы
- Внесение в почву
- Раскладывание ядовитых приманок и т.д.
Существует огромное разнообразие препаративных форм пестицидов. Самыми распространенными из них являются концентрат эмульсии, концентрат суспензии, смачивающийся порошок и гранулы.
Список препаративных форм пестицидов, которые применяются в сельском хозяйстве:
- Б – брикеты
- ВГ, ВРГ – водорастворимые гранулы
- ВГР – водно-гликолевый раствор
- ВДГ – водно-диспергируемые гранулы
- ВК, ВРК – водорастворимый концентрат
- ВКС – водный концентрат суспензии
- ВР – водный раствор
- ВРП – водорастворимый порошок
- ВС – водная суспензия
- ВСК – водно-суспензионный концентрат
- ВСР – водно-спиртовой раствор
- ВСХ – воздушно-сухая масса
- ВЭ – водная эмульсия
- Г – гранулы
- ГР – гликолиевый раствор
- Ж – жидкость
- ККР – концентрат коллоидного раствора
- КНЭ – концентрат наноэмульсии
- КОЛР – коллоидный раствор
- КРП – кристаллический порошок
- КС – концентрат суспензии
- КЭ – концентрат эмульсии
- МБ – мягкие брикеты
- МГ – микрогранулы
- МД – масляная дисперсия
- МК – масляный концентрат
- МКС – микрокапсулированная суспензия
- МКЭ – масляный концентрат эмульсии
- ММС – минерально-масляная суспензия
- ММЭ – минерально-масляная эмульсия
- МС – масляная суспензия
- МСК – масляно-суспензионный концентрат
- МЭ – микроэмульсия
- П – порошок
- ПР – приманка
- ПС – паста
- ПТП – пленкообразующая текучая паста
- Р – раствор
- РП – растворимый порошок
- СК – суспензионный концентрат
- СК-М – суспензионный концентрат масляный
- СП – смачивающийся порошок
- СТС – сухая текучая суспензия
- СХП – сухой порошок
- СЭ – суспензионная эмульсия
- ТАБ – таблетки
- ТБ – твердые брикеты
- ТКС – текучий концентрат суспензии
- ТПС – текучая паста
- ТС – текучая суспензия
- ФЛО – суспензионный концентрат
- ЭМВ – эмульсия масляно-водная
В данной статье Вы ознакомились с тем, что такое пестициды и какие виды
используют в сельском хозяйстве для выращивания растений.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Скачать статью в PDF
Биоинсектициды Биопрепараты Биофунгициды Гербициды Инсектициды Средства защиты растений Фунгициды
Оцените автора
Сварочные флюсы классификация и особенности
Содержание
1. Для чего нужен флюс при сварке
2. Условия использования сварочных флюсов
3. Недостатки
4. Как работают флюсы
5. Сварочные флюсы – классификация
6. Химический состав флюсов для сварки
7. Виды флюсов для сварки по назначению
8. Назначение сварочного флюса – примеры
9. Флюсы для газовой сварки
10. Флюсы для автоматической сварки
При электродуговой или газовой сварке в условиях высоких температур значительно увеличивается химическая активность обрабатываемой зоны. Металл усиленно окисляется под воздействием атмосферного воздуха, в результате шлаки и окислы попадают в него, снижая интенсивность металлургических процессов и в итоге ухудшая качество сварного шва. Для предотвращения этих процессов необходима защитная газовая или жидкая среда, которая изолирует зону сварки. Ее и создают флюсы — неметаллические композитные порошковые компоненты.
Для предотвращения этих процессов необходима защитная газовая или жидкая среда, которая изолирует зону сварки. Ее и создают флюсы — неметаллические композитные порошковые компоненты.
Таким образом, назначение флюсов при сварке — изоляция сварочной ванны от атмосферного воздуха, защита наплавляемого металла от интенсивных окислительных процессов, стабильное горение сварочной дуги и получение сварного шва необходимого качества.
Для чего нужен флюс при сварке
Использование флюсов обеспечивает следующие преимущества при сварке.
- Как при электродуговой, так и при газовой сварке флюс сварочный обеспечивает более интенсивное расплавление металла — (соответственно при больших токах или высокой концентрации кислорода). Благодаря этому нет необходимости заблаговременно разделывать кромки будущего сварного шва.
- В зоне шва и на прилегающих к нему поверхностях удается избежать угара металла — его потерь на окисление и испарение.

- Горение дуги имеет более высокую стабильность, что особенно важно при сложных конфигурациях шва
- Снижаются потери энергии источника тока на нагрев металла, соответственно увеличивается его КПД.
- Оптимизируется расход присадочного материала.
- Более удобное выполнение работ для сварщика, потому что флюс экранирует некоторую часть пламени дуги.
Условия использования сварочных флюсов
Задача флюса — стабилизация металлургических процессов при сохранении необходимой производительности электродов. Для этого в процессе сварки следует соблюдать определенные условия.
- Флюс не должен вступать в химическую реакцию с металлом стержня и основным металлом.
- Зона сварной ванны должна оставаться изолированной на протяжении всего сварочного процесса.
Остатки флюса, связанные со шлаковой коркой в результате сварки, по завершении работ должны легко удаляться. При этом до 80% материла после очистки можно использовать заново.
При этом до 80% материла после очистки можно использовать заново.
Недостатки
Условных минусов в использовании сварочных флюсов немного.
- Высокая стоимость, которая примерно сопоставима с ценой на сварочную проволоку.
- Yевозможность сразу осмотреть сварной шов. В силу этого, особенно в конструкциях сложной формы, место сварки предварительно тщательно подготавливается.
Как работают флюсы
- Перед сваркой на места соединений наносится толстый (40-60 мм) слой флюса.
- Электрод вводится в зону сварки, происходит поджиг дуги.
- Под воздействием высоких температур (до 6000 °C) флюс с его низкой плотностью быстро плавится в газовом пузыре, изолируя сверху сварную ванну, перекрывая к ней доступ газовых, водяных паров и других химических веществ.
- Имея высокое поверхностное натяжение, таким же образом расплав флюса предотвращает интенсивное разбрызгивание металла.
- Это позволяет значительно увеличить ток дуги (до 1000-2000 Ампер) без серьезных потер материала электрода и с сохранением хорошего качества шва.

- Под воздействием флюса в зоне дуги происходит концентрация тепловой мощности — в результате плавление металла происходит быстрее.
- При этом металлом заполняются все стыки, независимо от состояния кромок.
- Изменяется материальный баланс сварного шва — 60-65% процентов в нем составляет металл свариваемых деталей, и только остальное — это металл сварочного электрода.
Сварочные флюсы – классификация
Классификация флюсов чрезвычайно широка. Их различают по внешнему виду и физическому состоянию, химическому составу, способу получения, назначению. Так, например, для наплавки или дуговой сварки, как правило, используются гранулированные или порошковые флюсы с определенными показателями электропроводности, а для газовой — газы, порошки, пасты.
По способу получения композитов
Различают флюсы плавленые и неплавленые.
Флюс сварочный плавленый широко используют не только при сварке, но при наплавке. Он демонстрирует высокую эффективность в случаях, когда поверхность металла сварного шва путем добавления дополнительных химических элементов должна получить более высокие технические характеристики — например, повышенную стойкость к коррозии или очень ровный и гладкий шов.
Он демонстрирует высокую эффективность в случаях, когда поверхность металла сварного шва путем добавления дополнительных химических элементов должна получить более высокие технические характеристики — например, повышенную стойкость к коррозии или очень ровный и гладкий шов.
Наплавка под флюсом
Получают плавленые флюсы следующим способом: компоненты размалывают, смешивают, затем расплавляют в пламенных или электропечах при полном отсутствии кислорода. Далее нагретые частицы пропускаются через непрерывный поток воды, затвердевая и превращаясь таким образом в гранулят. Размер частиц различен — чем тоньше сварочный пруток, тем меньше должны быть и гранулы.
Неплавленые флюсы (керамические) для сварки изготавливаются путем перемешивания измельченных частиц шихты из ферросплавов, минералов, шлакообразующих без последующего плавления. Частицы смешиваются со стеклом и далее спекаются.
В ряду их преимуществ:
- низкий расход,
- возможность многократного использования,
- высокое качество получаемого шва.

Пример – керамический сварочный флюс марки UF (UF-01, UF-02, UF-03) который используется в энергетике и гражданском строительстве для сварки металлоконструкций из низколегированных сталей повышенной прочности.
Химический состав флюсов для сварки
Химический состав — важная составляющая в характеристике флюсов. Материал должен быть химически инертен в условиях очень высоких температур. Помимо этого, он должен обеспечивать эффективную диффузию отдельных элементов (например, легирующих) в металл шва.
Наибольшую массовую долю (от 35…80% от общего объема) в сварочном флюсе обычно (но не во всех) составляет диоксид кремния (кремнезём) — кислотный оксид, бесцветный прозрачный кристаллический минерал. Кремний препятствует процессу образования углерода, тем самым снижая риски появления трещин и пор в металле шва.
Значительную часть составляет марганец. Как активный раскислитель, этот компонент флюсов для сварки снижает образование окислов в зоне сварочной ванны, вступая в реакцию вначале с кислородом в окислах железа, затем и с оксидом кремния. Результат сложной реакции — оксид марганца, нерастворяемый в стали и впоследствии легко удаляемый. Кроме того, марганец реагирует с вредной для металла шва серой — он связывается с ней в сульфид, который затем также удаляется с поверхности шва.
Результат сложной реакции — оксид марганца, нерастворяемый в стали и впоследствии легко удаляемый. Кроме того, марганец реагирует с вредной для металла шва серой — он связывается с ней в сульфид, который затем также удаляется с поверхности шва.
Также в ряду химических элементов флюсов — легирующие добавки — помимо кремния и марганца это молибден, хром, титан, вольфрам, ванадий и другие. Из задача — восстановить первичный химический состав металла, а в ряде случаев — путем легирования восполнить собой выгоревшие основные примеси стали и обеспечить металлу шва дополнительные специальные свойства. Обычно во флюсе они представлены соединениями с железом — ферросплавами (феррохром и т. д.).
Виды флюсов для сварки по назначению
От назначения сварочных флюсов напрямую зависит их выбор по химическому составу.
- Для сварки низкоуглеродистых сталей применяются флюсы с большим содержанием кремния и марганца в сочетании с проволокой из низкоуглеродистой стали без легирующих добавок.
 Второй вариант — малая доля марганца (или вообще его отсутствие) во флюсе, но легирующие добавки присутствуют в стали сварочного прутка.
Второй вариант — малая доля марганца (или вообще его отсутствие) во флюсе, но легирующие добавки присутствуют в стали сварочного прутка. - Для сварки низколегированных сталей используются флюсы с высокой химической инертностью, — выше, чем для низкоуглеродистых сталей. Благодаря этому получают более пластичный сварной шов. Пример — флюс для сварки стали АН-46.
- Для сварки высоколегированных металлов применяются флюсы с минимальной химической активностью. Кремний, как и марганец, практически не используется — его заменяет флюорит (плавиковый шпат), благодаря которому образуются легко отделяемые легкоплавкие шлаки. Также в таких флюсах обычно содержатся оксид алюминия, негашеная известь.
- Для сварки активных металлов (таких, как титан) используют солевые флюсы — как правило, это хлоридные и фторидные соли щелочных металлов. Примесь кислорода в них полностью отсутствует, поскольку она снижает пластичность шва.

Назначение сварочного флюса – примеры
| Плавленые флюсы | Неплавленые флюсы | ||
| АН-348-А, АН-348-АМ, АН-348-В, АН-348-ВМ, ОСЦ-45, ОСЦ-45М, АН-60, ФЦ-9 | Механическая сварка и наплавка низколегированных и углеродистых сталей низколегированной и углеродистой сварочной проволокой | АНК-35 | Сварка низкоуглеродистых сталей низкоуглеродистой проволокой Св-08 и Св-08А |
| АН-8 | Электрошлаковая сварка углеродистых и низколегированных сталей; сварка низколегированных сталей углеродистой и низколегированной сварочной проволокой. | АНК-46 | Сварка низкоуглеродистых и низколегированных сталей |
| АН-15М, АН-18, АН-20С, АН-20П, АН-20СМ | Дуговая автоматическая сварка и наплавка высоко- и среднелегированных сталей | АНК-30, АНК-47 | Сварка швов высокой хладостойкости |
| АН-22 | Электрошлаковая сварка и дуговая автоматическая наплавка и сварка низко- и среднелегированных сталей | АНК-45 | Сварка высоколегированных сталей |
| АН-26С, АН-26П, АН-26СП | Автоматическая и полуавтоматическая сварка нержавеющих, коррозионностойких и жаропрочных сталей | АНК-40, АНК-18, АНК-19 | Наплавка низкоуглеродистой сварочной проволокой Св-08 и Св-08А; |
| АН-17М, АН-43 и АН-47 | Дуговая сварка и наплавка углеродистых, низко- и среднелегированных сталей высокой и повышенной прочности | АНК-3 | В качестве добавки к флюсам марок АН-348А, ОСЦ-45, АН-60 для повышения стойкости швов к образованию пор |
Флюсы для газовой сварки
Для сварки алюминия и других цветных металлов, чугуна, инструментальных сталей, отдельных марок тонколистовой стали используется защитная газовая атмосфера. Ее обеспечивают газообразные, пастообразные, а также порошковые флюсы. Они могут наносится:
Ее обеспечивают газообразные, пастообразные, а также порошковые флюсы. Они могут наносится:
- на кромки соединяемых деталей;
- напрямую в сварную ванну;
- на присадочный пруток.
В зависимости от физического состояния материала флюсы для сварки подают в рабочую зону по-разному. Некоторую сложность вызывают порошкообразные композиты — их необходимо равномерно и точно вносить в расплав, не позволяя потоку газа раздувать порошок. Составы в виде паст подают на участок соединения. Для подачи газообразных флюсов используют расходомеры — с их помощью газ дозированно подается в рабочую зону.
Электромагнитный расходомер
Важный момент: для газовой сварки флюс по составу подбирают в зависимости от образующихся в ходе сварки оксидов. Если они кислые, флюсы должны быть щелочными (основными), напротив, если щелочные оксиды — выбирают кислые флюсы.
Флюсы, применяемые при газовой сварке наиболее широко:
- медь, латунь, бронза — для их сварки используют кислые флюсы с включением борсодержащих соединений (борная кислота и т.
 д.) — например, такие марки, как МБ-2 или БМ-1;
д.) — например, такие марки, как МБ-2 или БМ-1; - чугун — для его сварки обычно используются флюсы с включением различных соединений щелочных металлов — натрия и калия;
- алюминий — здесь используются составы с содержанием фторидов калия, лития и натрия, а также хлориды. В этом случае наиболее широко применяется сварочный флюс марки АФ-4А.
Флюсы для газовой сварки не используются для соединения деталей из низкоуглеродистых сталей, поскольку на поверхности расплавленного металла интенсивно скапливаются легкоплавкие оксиды железа.
Флюсы для автоматической сварки
Автоматическая и полуавтоматическая сварка наиболее широко применяется при работе с большими конструкциями. Благодаря высоким токам и флюсу возможно сваривание деталей значительной толщины, при этом — без предварительной разделки кромки. Области использования — сваривание труб, изготовление резервуаров, судостроение.
Для такого способа сварки характерно автоматическое поддержание стабильно горящей электродуги, необходимого количества флюса (с отсосом нерасплавившегося), а также непрерывное обновление расплавленного электрода. Чтобы поддерживать в сварочной зоне защитное газовое облако нужного состава, толщина слоя флюса должна быть 40-80 мм, ширина 50-100 мм. Марка флюса для автоматической сварки, как и для классической дуговой, также зависит от характеристик свариваемого металла. Сварка осуществляется в нижнем пространственном положении.
Чтобы поддерживать в сварочной зоне защитное газовое облако нужного состава, толщина слоя флюса должна быть 40-80 мм, ширина 50-100 мм. Марка флюса для автоматической сварки, как и для классической дуговой, также зависит от характеристик свариваемого металла. Сварка осуществляется в нижнем пространственном положении.
Выгодно купить флюс для сварки различных типов и марок вы можете в компании «Центр Метиз».
Классификация химических реактивов по степени чистоты по различным стандартам
1. Классификация химических реактивов, принятая в РФ в соответствии ГОСТ 13867-68.
1.2. Классификация химических реактивов, принятая в других странах.
|
Обозначение |
Квалификация |
Процентное содержание основного химического вещества |
Характеристика |
|
«тех. |
Технический |
менее 95% |
Низшая квалификация реактива. Цвет полосы на упаковке – светло-коричневый. |
|
«ч.» «pur.» |
Чистый Purum |
более 98% |
Такие реактивы содержат всего 0,1 % примесей. Цвет полосы на упаковке – зелёный |
|
«ч.д.а.» «p.a.» |
Чистый для анализа Pro Analysi |
99% |
Эта квалификация характеризует аналитическое применение реактива. |
|
«х.ч.» «puriss.» |
Химически чистый Purissimum |
99,9% |
Высшая степень чистоты химического реактива. Вещество не должно иметь посторонних запахов и окраски и по внешнему виду должно соответствовать литературному описанию. Цвет полосы на упаковке – красный. |
|
«сп.ч.» |
Спектрально чистый |
более 99,9% |
Предназначены лишь для специальных целей, когда даже миллионные доли процента примеси являются совершенно недопустимыми. |
|
«осч» «puriss. spec.» |
Особо чистый Purissimum speciale |
более 99,9% |
Минимальное содержание отдельных примесей (от 0,00001 до 0,0000000001%) и максимально допустимая сумма определяемых примесей. Цвет полосы на упаковке ОСЧ реактивов – жёлтый. |
Требования к качеству химических реактивов, выпускаемых в РФ, определяются Государственными Стандартами (ГОСТ) или Техническими Условиями (ТУ) – ГОСТ 13867-68 – Продукты химические. Обозначение чистоты.
http://www. gostedu.ru/43109.html.
gostedu.ru/43109.html.
Государственная Фармакопея Российской Федерации XI издание «Испытания на чистоту и допустимые пределы примесей».
2. Классификация химических реактивов, принятая в других странах.
|
Обозначение |
Процентное содержание основного химического вещества |
Характеристика |
|
extra pure (особо чистый) |
99% |
Квалификация extra pure проходит контроль по большому количеству параметров. |
|
for synthesis (для синтеза) |
до 99% |
Квалификация for synthesis (относительно небольшое количество контролируемых показателей) имеет более доступную стоимость. |
|
GR for analysis (для анализа) |
менее 99% |
Квалификация GR for analysis изготавливается для осуществления химико-аналитического контроля. |
Reagent A.C.S. — реагент высокого качества для лабораторного использования, в соответствии с требованиями Американского химического общества.
USP (Фармакопея США) — вещества, изготовленные в соответствии с действующими правилами производства и удовлетворяющие требованиям Фармакопеи США.
BP (Фармакопея Британская) — вещества, изготовленные в соответствии с действующими правилами производства и удовлетворяющие требованиям Фармакопеи Британской.
DAB (Фармакопея Германии) — вещества, изготовленные в соответствии с действующими правилами производства и удовлетворяющие требованиям Фармакопеи Германии.
Ph. Eur (Фармакопея Европейская) — вещества, изготовленные в соответствии с действующими правилами производства и удовлетворяющие требованиям Фармакопеи Европейской.
HAB (Фармакопея Немецкая Гомеопатическая) — вещества, изготовленные в соответствии с действующими правилами производства и удовлетворяющие требованиям Фармакопеи Немецкой.
Guaranteed Reagent (Гарантированный реагент) — реагент для использования в аналитической химии, который отвечает требованиям Американского химического общества или превосходит их.
AR (Аналитический реагент) — стандартная классификация аналитических реагентов Маллинкродта, подходящих для лабораторного и общего использования. Если реагент также отвечает требованиям Комиссии Американского химического общества по аналитическим реагентам, он будет отмечен как реагент AR.
Первичный стандарт (Primary Standard) — аналитический реагент исключительной частоты, изготовленный специально для стандартизированных волюметрических растворов и приготовления эталонных образцов.
Reagent (Реагент) — высочайшее качество, коммерчески доступное для данного химического вещества. Американское химическое общество официально не устанавливало спецификаций для данного материала.
Американское химическое общество официально не устанавливало спецификаций для данного материала.
OR (Органические реагенты) — органические реагенты, которые подходят для проведения исследований.
Purified (Очищенное вещество) — химическое вещество высокого качества, в ситуации, когда официальных стандартов нет. Эта классификация обычно применяется только к неорганическим химическим веществам.
Practical (Вещество, пригодное для практического использования) — химическое вещество хорошего качества, в ситуации, когда официальных стандартов нет. Пригодно для использования в задачах общего назначения. Органические вещества этого класса могут содержать небольшое количество изомеров промежуточных форм.
LabGrade (Лабораторное вещество) — растворители, пригодные для использования в гистологии и общем лабораторном использовании.
USP/GenAR — химические вещества, изготовленные в соответствии с c GMP и удовлетворяющие применимым требованиям 1995 USP 23, Европейской Фармакопеи (Ph. Eur.EP) и Британской Фармакопеи (BP), а также прошедших эндотоксинное тестирование (LAL) при необходимости.
Eur.EP) и Британской Фармакопеи (BP), а также прошедших эндотоксинное тестирование (LAL) при необходимости.
NF — химические вещества, соответствующие требованиям Национального Фармакологического Справочника.
FCC — продукты, соответствующие требованиям Кодекса пищевых химикатов.
Химически чистое вещество (CP) — вещества, чистота которых позволяет использовать их в общих ситуациях.
Technical (Вещество, пригодное для технических целей) — вещество, подходящее для общего промышленного применения.
Стандартные растворы.
Standardized Solintions (Стандартизированные растворы) — Растворы приготовлены из исходных материалов, которые отвечают требованиям Американского химического общества или превосходят их. В случае, если этих требований не установлено, используются химические компоненты высочайшей очистки из других возможных. Все водные растворы приготавливаются с использованием деионизированной воды высокой очистки, отвечающей требованиям классификации реагентов ASTM типа 1. Эти растворы стандартизированы в соответствии со стандартами NIST или первичными стандартами. (Только из растворов, изготовленных из компонентов классификации «Реагент»).
Эти растворы стандартизированы в соответствии со стандартами NIST или первичными стандартами. (Только из растворов, изготовленных из компонентов классификации «Реагент»).
StandARd — Растворы, приготовленные с использованием титрации и стандартов атомической абсорбции. Эти растворы пригодны для использования в методах ACS, USP и NF и общего применения в лаборатории.
Acculute — Стандартные волюметрические концентраты растворов, упакованные в ампулы или запечатанные бутылки.
Дополнительно к вышеуказанным квалификациям химических реактивов по степени чистоты некоторые производители используют индивидуальные обозначения:
MP Biomedicals:
UP (Ultra-Pure) — очень чистый, реальная чистота зависит от вещества.
C (Compendial) — соответствует фармакопейной статье.
PanReac Applichem:
BioChemica — реагенты для университетов и исследовании и разработке в биохимии, молекулярной биологии и биотехнологической индустрии.
Chemicals — реагенты для качественного контроля в фармацевтическом и пищевом производстве, экологических лабораторий и химической промышленности в целом.
Microbiology product — реагенты для экологических анализов воды, воздуха и поверхности, также для пищевой, фармацевтической и косметической промышленности.
Excipients — сырьё для фармацевтической, пищевой, биофармацевтической, ветеринарной и косметической промышленности.
VIII. Принципы классификации
Информация об изобретенииДополнительная информацияТехнические объекты изобретенийПодразделения в классификации для классифицирования технических объектов изобретенийФункционально-ориентированные и отраслевые подразделенияКлассификация технической сущности изобретенийОбщие замечанияКатегории тематики, для которой нет соответствующего точного заголовка рубрики МПК Периодическая Таблица химических элементов
Химические соединения Химические смеси или композиции (составы) Получение и обработка химических соединений Устройства или способы Изделия Многоступенчатые способы, агрегаты (установки) Детали, конструктивные элементы Общие химические формулы Комбинаторные библиотеки
75. Основным назначением классификации, как отмечено в п. 6, является облегчение поиска технических решений. В связи с этим классификация разработана и должна использоваться таким образом, чтобы одинаковые технические решения классифицировались одинаково и, следовательно, могли быть найдены в одном и том же месте классификации. Это место должно быть самым подходящим для проведения поиска таких технических решений.
Основным назначением классификации, как отмечено в п. 6, является облегчение поиска технических решений. В связи с этим классификация разработана и должна использоваться таким образом, чтобы одинаковые технические решения классифицировались одинаково и, следовательно, могли быть найдены в одном и том же месте классификации. Это место должно быть самым подходящим для проведения поиска таких технических решений.
76. В патентном документе может быть два типа информации. Это «изобретательская информация» и «дополнительная информация». Значение этих выражений объясняется ниже в п.п. 77-80. Правила выбора классификационных индексов одинаковы для обоих типов информации (см. также главу XI ниже). Хотя в «Руководстве к МПК» упоминаются только изобретения или технические объекты изобретений, это в равной мере относится к техническим объектам, охватываемым дополнительной информацией.
ИНФОРМАЦИЯ ОБ ИЗОБРЕТЕНИИ
77. Изобретательская информация – это техническая информация, раскрываемая в патентном документе (например, описании, рисунках, патентной формуле), которая представляет дополнение к уровню техники. Изобретательская информация определяется в контексте с уровнем техники, используя в качестве руководства патентную формулу патентного документа, уделяя дополнительное внимание описанию и рисункам.
Изобретательская информация определяется в контексте с уровнем техники, используя в качестве руководства патентную формулу патентного документа, уделяя дополнительное внимание описанию и рисункам.
78. «Дополнение к уровню техники» означает все новое и неочевидное в технической сущности, особо раскрытое в патентном документе, что не является частью предшествующего уровня, т.е. разница между технической сущностью патентного документа и подборкой всех знаний о технической сущности, доступной публике.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
79. Дополнительная информация – это техническая информация, которая сама по себе не является дополнением к уровню техники, но может представлять полезную информацию для поиска.
80. Дополнительная информация сопровождает изобретательскую информацию, указывая, например, составляющие композиции или смеси, или элементы или компоненты способа или конструкции, или использование классифицируемых технических объектов.
КАТЕГОРИИ ТЕХНИЧЕСКИХ ОБЪЕКТОВ ИЗОБРЕТЕНИЯ
81. Техническими объектами изобретений могут быть новые и неочевидные способы, продукты, устройства или материалы (или способы их использования или применения). Эти термины, обычно используемые для категории технического объекта, следует интерпретировать в широком смысле, как указано в следующих примерах:
(а) Примеры способов: полимеризация, ферментация, разделение, формование, транспортирование, обработка текстиля, передача и преобразование энергии, строительство, приготовление пищи, испытание, методы работы на машинах и способы их работы, обработка и передача информации.
(б) Примеры продуктов: химические соединения, составы, ткани, промышленные изделия.
(в) Примеры устройств: установки для проведения химических или физических процессов, инструменты, орудия, машины, устройства для выполнения технических операций.
(г) Примеры материалов: ингредиенты смеси.
82. Следует отметить, что устройство можно также рассматривать как продукт, в том смысле, что каждое устройство произведено в результате выполнения определенного процесса. Термин «продукт», однако, используется для обозначения конечного результата процесса независимо от его последующей функции, например, конечный продукт химического или производственного процесса, тогда как термин «устройство», как правило, предполагает его использование по определенному назначению или для определенной цели, например устройство для генерирования газов, устройство для резания. Материалы сами по себе могут составлять продукты.
Следует отметить, что устройство можно также рассматривать как продукт, в том смысле, что каждое устройство произведено в результате выполнения определенного процесса. Термин «продукт», однако, используется для обозначения конечного результата процесса независимо от его последующей функции, например, конечный продукт химического или производственного процесса, тогда как термин «устройство», как правило, предполагает его использование по определенному назначению или для определенной цели, например устройство для генерирования газов, устройство для резания. Материалы сами по себе могут составлять продукты.
ПОДРАЗДЕЛЕНИЯ В КЛАССИФИКАЦИИ ДЛЯ КЛАССИФИЦИРОВАНИЯ ТЕХНИЧЕСКИХ ОБЪЕКТОВ ИЗОБРЕТЕНИЙ
83. Классификация разработана для обеспечения классифицирования любой технической сущности изобретения в целом, а не по отдельным составным частям.
84. Составные части технического объекта изобретения могут также составлять изобретательскую информацию, если они сами по себе представляют дополнение к уровню техники, т. е. являются новыми и неочевидными объектами.
е. являются новыми и неочевидными объектами.
ФУНКЦИОНАЛЬНО-ОРИЕНТИРОВАННЫЕ И ОТРАСЛЕВЫЕ ПОДРАЗДЕЛЕНИЯ
85. Техническая сущность изобретений, описываемая в патентных документах, касается либо самой природы или функции какого-либо объекта, либо способа применения или использования объекта. В связи с этим термин «объект» используется для обозначения как осязаемых, так и неосязаемых технических объектов, например, способа, продукта, устройства. Вышеупомянутое находит отражение в строении схемы классификации. Она содержит рубрики для классифицирования:
а) объекта «вообще», т.е. характеризующегося своей природой или функцией; объекта, который либо не зависит от какой-либо конкретной области его применения, либо остается технически неизменным, если отвлечься от области применения, т.е. не приспособленным специально для использования в какой-то области;
Примеры:
(1) Подкласс F 16К предусмотрен для клапанов, характеризуемых конструктивными или функциональными свойствами, которые не зависят от особенностей текучей среды, проходящей через него, или от системы, частью которой он является.
(2) Класс С07 предусмотрен для органических химических соединений, характеризующихся их химической структурой, а не их применением.
(3) Подкласс В01D предусмотрен для фильтров вообще.
(б) объекта «специально приспособленного для» особого использования или цели, т.е. модифицированного или сконструированного специально для данного использования или цели;
Пример: A61F 2/24 – рубрика для механического клапана, специально приспособленного для человеческого сердца.
(в) особого использования или применения объекта;
Пример: Фильтры, специально приспособленные для особых целей, или комбинации их с другими устройствами, классифицируются в отраслевых рубриках, например A24D 3/00, A47J 31/06.
(г) встраивание объекта в большую систему.
Пример: B60G имеет подразделение для встраивания рессор в подвеску колес транспортного средства.
86. Подразделения категории (а), указанные выше, называются “функционально-ориентированными подразделениями”. Подразделения категории (б) – (г), указанные выше, называются «ориентированными по применению» подразделениями.
Подразделения категории (б) – (г), указанные выше, называются «ориентированными по применению» подразделениями.
87. Подразделения, например, подклассы, не всегда следует рассматривать как полностью функционально – ориентированными или полностью ориентированными по применению по отношению к другим подразделениям МПК.
Пример: Несмотря на то, что подклассы F16K (клапаны и т.д.) и F16N (смазка) являются по своему содержанию функциональными, подкласс F16N содержит рубрики для некоторых клапанов, специально предназначенных для смазочных устройств или систем (например, F16N 23/00 – обратные клапаны для смазочных устройств), и, наоборот, подкласс F16К содержит отраслевые рубрики для смазочных устройств в шиберных затворах или золотниках (например, F16К 3/36 – конструктивные особенности, относящиеся к смазке).
Выражения «функционально-ориентированное подразделение» и «ориентированнoе по применению подразделение» не всегда могут рассматриваться в их абсолютном значении. Подразделение может быть более функциональным, чем другое рассматриваемое подразделение, но менее функциональным, чем другие подразделения по отношению к какой-либо тематике.
Подразделение может быть более функциональным, чем другое рассматриваемое подразделение, но менее функциональным, чем другие подразделения по отношению к какой-либо тематике.
Пример: Группа F02F 3/00 относится к поршням двигателей внутреннего сгорания вообще и, следовательно, является более функционально-ориентированной, чем группа F02B 55/00, которая специально предназначена для вращающегося типа поршней двигателей внутреннего сгорания, но менее функционально-ориентированной, чем подкласс F16J, который предназначен для поршней вообще.
87 бис. В МПК существуют также подразделения, которые применяются для классифицирования только при условии, если не существует другого места в МПК для рассматриваемой тематики. Такие подразделения относятся к «остаточным».
Выражения, приведённые ниже и используемые в заголовках соответствующих подразделений, ясно указывают на «остаточный» характер этих подразделений:
– «не предусмотренные в других рубриках МПК»,
– «не предусмотренные в…»,
– «не охватываемые …».
«Остаточная» природа подразделения может быть относительной по отношению к другим подгруппам, другим основным группам того же подкласса, другим подклассам или даже ко всей МПК. Основные группы с номером 99/00 по всей МПК являются специально выделенными остаточными подразделениями.
Примеры: F21S 15/00 Неэлектрические осветительные устройства или системы с применением источников света, не отнесенных к основным группам F21S 11/00, F21S 13/00 или F21S 19/00
G06Q 99/00 Тематика, не предусмотренная в других группах данного подкласса
A99Z Тематика, не предусмотренная в этом разделе
F21K источники света, не предусмотренные в других рубриках МПК
КЛАССИФИКАЦИЯ ТЕХНИЧЕСКОЙ СУЩНОСТИ ИЗОБРЕТЕНИЙ
Общие замечания
88. Очень большое значение имеет правильное определение или выявление технической сущности изобретений. При этом следует иметь в виду, что для определения наиболее подходящего места в классификации объект следует рассмотреть в отношении каждой категории, представленной в п.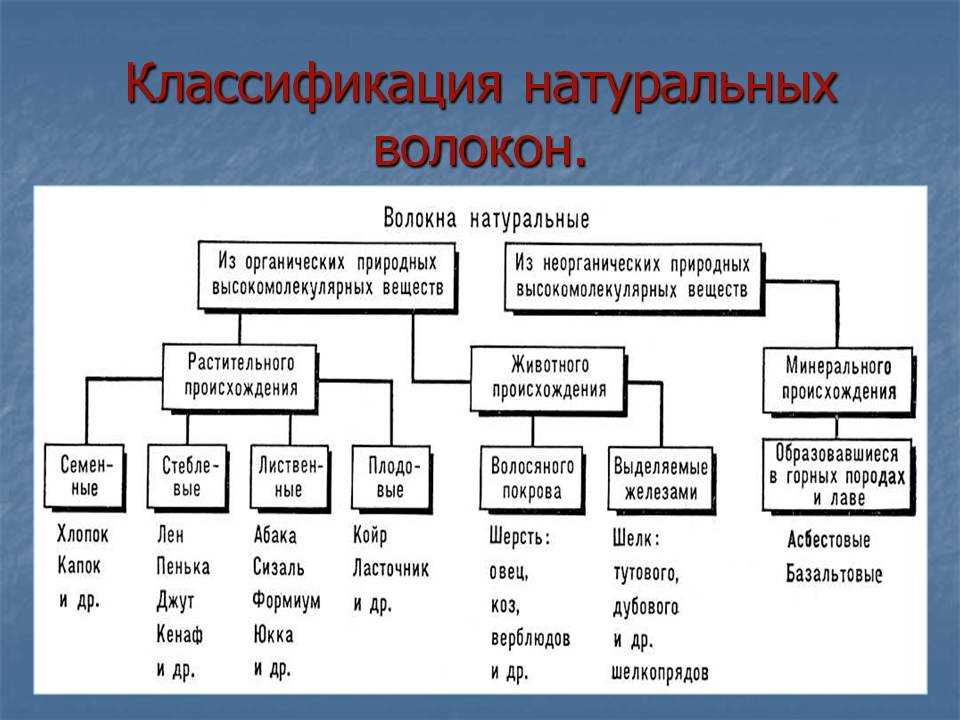 п. 81-85.
п. 81-85.
Пример: Если в патентном документе раскрыт поршень, то необходимо рассмотреть вопрос о том, является ли технической сущностью изобретения поршень как таковой или, например, специальное приспособление поршня для использования в особых устройствах, или размещение поршней в целой системе, например, в двигателе внутреннего сгорания.
89. Часто информация об изобретении касается только определенной технической области использования. В этом случае изобретение будет полностью классифицировано в ориентированном по применению подразделении. Функционально-ориентированные подразделения разработаны на основании другого подхода. Его суть в том, что конструктивные и функциональные особенности объекта изобретения, которые классифицируются в этих подразделениях, относятся к нескольким областям применения и применение в какой-то определенной области не является информацией об изобретении.
Пример: Группа С09D 5/00 охватывает составы для нанесения покрытий для различных областей применения (например, С09D 5/16 охватывает противообрастающие краски). Группы С09D 101/00-201 /00 охватывают функционально-ориентированные аспекты составов для покрытия, а именно полимер, на котором состав основан.
Группы С09D 101/00-201 /00 охватывают функционально-ориентированные аспекты составов для покрытия, а именно полимер, на котором состав основан.
90. Когда при классифицировании технической сущности возникают сомнения в выборе функционально-ориентированного или ориентированнoго по применению подразделения, необходимо руководствоваться следующим:
(а) Если определенная область применения упомянута, но детально не раскрыта или не определена полностью, классифицирование проводится в функционально-ориентированном подразделении, если таковое имеется. То же относится к случаю, когда широко заявлено несколько областей применения.
(б) Если технически существенные характеристики объекта относятся к самой природе или функции объекта, а также к области его применения или специальному приспособлению или встраиванию в целую систему, то классифицирование проводится и в функционально-ориентированном и в ориентированнoм по применению подразделениях, если таковые имеются.
(в) Если таких ориентиров, как (а) и (б), нет, классифицирование проводится и в функционально-ориентированном, и в ориентированнoм по применению подразделении.
91. При классифицировании большой системы (комбинации) в целом следует уделять внимание частям или деталям. Если они являются новыми и неочевидными, классифицирование и системы, и этих частей или деталей является необходимым.
Пример: В том случае, если документ относится к встраиванию какого-либо объекта, например, листовой рессоры, в целую систему, например, в подвеску колес транспортного средства, это означает, что он относится к целой системе и должен быть проклассифицирован в подразделении для этой системы (B60G). Если документ относится также к объекту как таковому, например, к листовой рессоре как таковой, и является новым и неочевидным, документ необходимо классифицировать также в подразделении для этого объекта (F16F).
Категории тематики, для которой нет соответствующего точного заголовка рубрики МПК
92. Из п.п. 81 и 82 следует, что техническая сущность изобретения может выражаться различными категориями объектов. Если для одной из этих категорий нельзя подобрать точно рубрику с соответствующим заголовком, для классифицирования выбирается наиболее подходящая рубрика, предусмотренная для других категорий объектов (см. п.п. 93-99 для конкретных ситуаций). В таких ситуациях, даже если заголовок рубрики не совсем явно предусматривает эту категорию объекта, возможны другие указания на нее, такие как отсылки, примечания, определения или упоминания о подобной тематике в других группах (подгруппах) данной части схемы. Определения, если таковые имеются, должны давать конкретную информацию о классификационных рубриках для подходящих категорий объектов, не указанных в заголовках рубрик.
Из п.п. 81 и 82 следует, что техническая сущность изобретения может выражаться различными категориями объектов. Если для одной из этих категорий нельзя подобрать точно рубрику с соответствующим заголовком, для классифицирования выбирается наиболее подходящая рубрика, предусмотренная для других категорий объектов (см. п.п. 93-99 для конкретных ситуаций). В таких ситуациях, даже если заголовок рубрики не совсем явно предусматривает эту категорию объекта, возможны другие указания на нее, такие как отсылки, примечания, определения или упоминания о подобной тематике в других группах (подгруппах) данной части схемы. Определения, если таковые имеются, должны давать конкретную информацию о классификационных рубриках для подходящих категорий объектов, не указанных в заголовках рубрик.
Периодическая Таблица химических элементов
92 бис. Во всех разделах МПК при отсутствии особого указания Периодическая Система химических элементов, на которую содержится ссылка, является Системой с восьмью группами, как представлено ниже в Таблице. Например, в группе C07F 3/00 “Соединения, содержащие элементы 2-ой группы Периодической системы” имеются в виду элементы колонок IIA и IIB.
Например, в группе C07F 3/00 “Соединения, содержащие элементы 2-ой группы Периодической системы” имеются в виду элементы колонок IIA и IIB.
Химические соединения
93. Сущность изобретения, относящегося к химическому соединению (органическому, неорганическому или высокомолекулярному), классифицируется в разделе C в соответствии с его химической структурой. Если сущность изобретения относится также к определенной области его применения, то химическое соединение классифицируется также и в рубрике для этой области применения, если таковая является существенно важной технической характеристикой предмета изобретения. Однако, в случае, когда химическое соединение уже известно, а сущность изобретения относится исключительно к применению химического соединения, то изобретение классифицируется в рубрике, соответствующей области его применения, как информация об изобретении. При этом химическая структура соединения может быть также проклассифицирована в рубрике для химического соединения, как такового.
Химические смеси или композиции (составы)
94. Сущность изобретения, относящаяся к смесям или композициям (составам), классифицируется в тех подразделениях, которые соответствуют (если они существуют) их химическому составу, например в С03С (стекло), С04B (цемент, керамика), С08L (композиции органических высокомолекулярных соединений), С22С (сплавы). Если подходящее подразделение отсутствует, объект изобретения классифицируется в соответствии с областью его применения или использования. В тех случаях, когда применение или использование является существенным признаком изобретения, смесь или композиция классифицируются как по их химическому составу, так и по области применения или использования. Но, если данная химическая смесь или композиция известна, а сущность изобретения относится только к ее применению, то она классифицируется в рубрике, соответствующей области применения, как информация об изобретении. При этом смесь или композиция может также быть проклассифицирована в рубрике для данной химической смеси или композиции, как таковой.
Получение и обработка химических соединений
95. Сущность изобретения, касающаяся способа получения или обработки химического соединения, классифицируется в подразделении, соответствующем данному способу получения или обработки рассматриваемого химического соединения, а если такой рубрики не существует, то в рубрике, соответствующей данному химическому соединению. Если соединение, образующееся в результате данного процесса получения, является новым, то его следует также классифицировать в рубрике, соответствующей его химическому строению. Техническая сущность изобретения, касающаяся общих способов получения или обработки целых классов химических соединений, классифицируется в рубриках для способов, если такие рубрики существуют.
Устройства или способы
96. Сущность изобретения, касающаяся устройства, классифицируется в рубрике для данного устройства, если таковая существует. Если же для такого устройства специальной рубрики не существует, то устройство классифицируется в рубрике, соответствующей способу, в котором используется это устройство. Сущность изобретения, касающаяся способа изготовления или обработки продуктов, классифицируется в рубрике для применяемого способа. Если такой рубрики не существует, то изготовление или обработка продуктов классифицируется в рубрике для устройства, которое используется в данном способе. Если не существует рубрики для изготовления продукта, то устройство для изготовления или способ классифицируется в рубрике, соответствующей данному продукту.
Если же для такого устройства специальной рубрики не существует, то устройство классифицируется в рубрике, соответствующей способу, в котором используется это устройство. Сущность изобретения, касающаяся способа изготовления или обработки продуктов, классифицируется в рубрике для применяемого способа. Если такой рубрики не существует, то изготовление или обработка продуктов классифицируется в рубрике для устройства, которое используется в данном способе. Если не существует рубрики для изготовления продукта, то устройство для изготовления или способ классифицируется в рубрике, соответствующей данному продукту.
Изделия
97. Сущность изобретения, касающаяся изделия, классифицируется в рубрике, соответствующей этому изделию. Если для изделия как такового не существует подходящей рубрики, оно классифицируется в подходящем функционально-ориентированном подразделении (т.е. в соответствии с функцией, выполняемой данным изделием) или, если таковое отсутствует, в соответствии с областью применения этого изделия.
Например: Если изделием, подлежащим классифицированию, является распылитель клея, специально предназначенный для книжных переплетов, то оно классифицируется в группе B42C 9/00 «Использование клея или склеивающих веществ в переплетном производстве». Поскольку не существует специальной рубрики для распылителей клея для переплетных работ, то они классифицируются в рубрике, соответствующей их функции, т.е. «использование клея».
Многоступенчатые способы, агрегаты (установки)
98. Сущность изобретения, заключающаяся в многоступенчатом способе или промышленном агрегате, которые состоят из комбинации стадий процесса или комбинации нескольких устройств в едином агрегате, классифицируется как нечто целое, т.е. в подразделении, соответствующем такой комбинации, например в подклассе B09B. Если такого подразделения не существует, изобретение классифицируется в подразделении, соответствующем продукту, получаемому в результате использования такого многоступенчатого способа или агрегата. Если сущность изобретения касается также отдельного элемента комбинации, например, отдельной стадии процесса или отдельной машины агрегата, то такой элемент классифицируется обособленно в соответствующей рубрике.
Если сущность изобретения касается также отдельного элемента комбинации, например, отдельной стадии процесса или отдельной машины агрегата, то такой элемент классифицируется обособленно в соответствующей рубрике.
Детали, конструктивные элементы
99. В тех случаях, когда техническая сущность изобретения касается конструктивных элементов или деталей объекта, например, устройств, применяются следующие правила:
(а) если конструктивные элементы или детали предназначены или могут использоваться только для одного определенного объекта, то они классифицируются в рубриках, соответствующих этому объекту, если такие рубрики существуют;
(б) при отсутствии таких рубрик эти конструктивные элементы или детали классифицируются в рубрике, предназначенной для рассматриваемой тематики;
(в) конструктивные элементы или детали, которые могут использоваться в нескольких видах объектов, классифицируются в рубриках более общего характера, если таковые существуют;
(г) при отсутствии таких рубрик более общего характера, данные конструктивные элементы или детали классифицируются в рубриках, соответствующих всем видам объектов, к которым они точно относятся.
Например: В подклассе A45B группы 11/00-23/00 охватывают различные виды зонтов, а группа 25/00 – детали зонтов, которые могут использоваться более, чем для одного типа зонтов.
Общие химические формулы
100. Большое количество химических соединений часто выражается или заявляется в виде общих формул. Общие формулы представляют родовое химическое соединение, по крайней мере, с одним компонентом формулы, являющимся переменным, выбранным из специфической подборки альтернатив (например, формулы «Маркуша»). Использование общих формул вызывает проблемы при классифицировании, когда они охватывают большое количество соединений, которые могут быть отдельно проклассифицированы в большом количестве рубрик. В таких ситуациях классифицируются только индивидуальные химические соединения, наиболее полезные для поиска. Если химические соединения описываются с использованием общей химической формулы, должна применяться следующая процедура классифицирования.
| Стадия 1: | Классифицируются все «полностью идентифицированные» соединения, которые являются новыми и неочевидными, при условии, что они: |
Стадия 2: | Если «полностью определенные» соединения не раскрыты, например, когда соединения получают методом компьютерного моделирования, и они не подвергаются реальному эксперименту, классификация проводится по соединениям с точным химическим наименованием или по развёрнутой химической формуле. |
Стадия 3 | Когда раскрыта только общая формула Маркуша, классификация проводится в наиболее специфических группе или группах, которые охватывают все или большинство возможных видов реализации. Классификацию следует ограничивать одной или очень малым количеством групп. |
Стадия 4 | В дополнение к вышеуказанной обязательной классификации, может быть представлена необязательная классификация, если другие соединения в объеме общей формулы представляют интерес. |
Если классификация всех «полностью определенных» соединений в их наиболее специфических рубриках приведет к большому числу классификационных рубрик (например, более 20), классифицирующий может уменьшить число индексов. Это может быть сделано, если классификация «полностью определенных» соединений приведет к присвоению большого числа подгрупп под одной иерархически старшей группой. Классификация таких соединений может быть выполнена только в группе более высокой иерархии. В других случаях классификация соединений проводится во всех более специфичных подгруппах.
Классификация таких соединений может быть выполнена только в группе более высокой иерархии. В других случаях классификация соединений проводится во всех более специфичных подгруппах.
Комбинаторные библиотеки
101. Совокупность большого количества химических соединений, биологических единиц или других веществ, может быть представлена в виде «библиотек». Библиотека обычно включает огромное число членов, которые, если их классифицировать по отдельности в большом количестве классификационных подразделений, перегрузят поисковую систему. Поэтому только индивидуальные члены, которые считаются «полностью определенными» каким-то образом как соединения общей формулы, классифицируются обязательно в группах, наиболее специфичных для них, например соединения в разделе С. Библиотека в целом классифицируется в соответствующей группе в подклассе С40В. В дополнение к вышеупомянутому обязательному классифицированию необязательное классифицирование проводится, если члены библиотеки представляют интерес.
1.4: Классификация и свойства вещества
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 85134
- Элизабет Гордон
- Университет Фурмана
Цели обучения
- Использовать физические и химические свойства, включая фазовые, для описания вещества.
- Различать физические и химические изменения.
- Идентифицируйте образец вещества как элемент, соединение или смесь (гомогенную/гетерогенную).
- Знать физические методы, используемые для разделения смесей.
Физические и химические свойства
Свойства, которые химики используют для описания вещества, делятся на две основные категории. Физические свойства – это характеристики, которые описывают материю. К ним относятся такие характеристики, как размер, форма, цвет и масса. Многие из этих свойств могут носить количественный характер. Например, количественными физическими свойствами воды будут температура кипения (100°C/212°F) и температура плавления (0°C/32°F).
Физические свойства – это характеристики, которые описывают материю. К ним относятся такие характеристики, как размер, форма, цвет и масса. Многие из этих свойств могут носить количественный характер. Например, количественными физическими свойствами воды будут температура кипения (100°C/212°F) и температура плавления (0°C/32°F).
Рисунок \(\PageIndex{1}\): Физические свойства. (Авторское право; https://www.slideshare.net/cfoltz/ph…cal-properties)
Химические свойства – это характеристики, которые описывают, как материя изменяет свою химическую структуру или состав. Примером химического свойства является воспламеняемость — способность материала гореть, — поскольку горение (также известное как горение) изменяет химический состав материала. Окисление, ржавление, разложение и инертность также являются химическими свойствами. Нажмите на это видео и запишите физические и химические свойства элемента натрия.
Рис. \(\PageIndex{2}\): Окисление железа в Порт-Рояле, Южная Каролина. Изображение предоставлено Элизабет Р. Гордон.
\(\PageIndex{2}\): Окисление железа в Порт-Рояле, Южная Каролина. Изображение предоставлено Элизабет Р. Гордон.
Элементы и соединения
Любой образец вещества, имеющий одинаковые физические и химические свойства во всем образце, называется веществом. Существует два типа веществ. Вещество, которое нельзя разложить на химически более простые компоненты, называется элементом. Алюминий, который используется в банках с газировкой, является элементом. Вещество, которое можно разложить на химически более простые компоненты (поскольку оно состоит из более чем одного элемента), называется соединением (рис. \(\PageIndex{1}\)). Вода представляет собой соединение, состоящее из элементов водорода и кислорода. На сегодняшний день в известной Вселенной насчитывается 118 элементов. Напротив, на сегодняшний день ученые идентифицировали десятки миллионов различных соединений.
Рисунок \(\PageIndex{3}\): Для химика вода в чистом виде представляет собой соединение (она содержит два типа атомов, связанных друг с другом в молекулу только одного типа). Эколог может считать воду «чистой», даже если она содержит нормальное количество растворенного кислорода и углекислого газа, но не содержит других «загрязнителей». Для химика вода, содержащая кислород, уже не чистое вещество, а смесь. В чистой воде соотношение атомов водорода и кислорода всегда равно 2:1.
Эколог может считать воду «чистой», даже если она содержит нормальное количество растворенного кислорода и углекислого газа, но не содержит других «загрязнителей». Для химика вода, содержащая кислород, уже не чистое вещество, а смесь. В чистой воде соотношение атомов водорода и кислорода всегда равно 2:1.Иногда слово чистое 9В вещество добавляется 0065, но это не обязательно. По определению, любое отдельное вещество является чистым.
Наименьшая часть элемента, сохраняющая идентичность этого элемента, называется атомом. Атомы чрезвычайно малы; чтобы сделать линию длиной 1 дюйм, вам потребуется 217 миллионов атомов железа. Наименьшая часть соединения, сохраняющая идентичность этого соединения, называется молекулой. Молекулы состоят из атомов, которые соединены вместе и ведут себя как единое целое. Ученые обычно работают с миллионами и миллионами атомов и молекул одновременно. Когда ученый работает с большим количеством атомов или молекул одновременно, он изучает макроскопическую картину Вселенной.
Рисунок \(\PageIndex{4}\): Оценка элементов, молекул и соединений.
Неорганические и органические соединения
Соединения могут быть далее классифицированы как неорганические или органические. Органические соединения содержат углерод, водород и обычно еще один элемент из правой части таблицы Менделеева. Будьте осторожны, думая об органических химикатах. В реальном мире термин «органический» обычно используется для описания продуктов, которые имеют натуральные ингредиенты. В мире науки слово «органический» используется для обозначения соединений, которые имеют углеродные и водородные связи. Посмотрите на некоторые из приведенных ниже структур, чтобы получить представление об органических химических структурах.
Органические структуры
Две молекулы, показанные ниже, широко используются в фармацевтической промышленности. Соединение слева известно как гидрокодон. Это опиоидное болеутоляющее, вызывающее сильную зависимость. Его регулярно назначают при хирургической и хронической боли. Соединение справа — Adderall. Этот препарат используется для лечения СДВГ и нарколепсии. Оба эти лекарства контролируются DEA (Агентством по борьбе с наркотиками), и их хранение является незаконным, если у вас нет действительного рецепта.
Соединение справа — Adderall. Этот препарат используется для лечения СДВГ и нарколепсии. Оба эти лекарства контролируются DEA (Агентством по борьбе с наркотиками), и их хранение является незаконным, если у вас нет действительного рецепта.
Смеси
Материал, состоящий из двух или более веществ, представляет собой смесь. В смеси отдельные вещества сохраняют свою химическую идентичность. Многие смеси представляют собой очевидные комбинации двух или более веществ, например смесь песка и воды. Такие смеси называются гетерогенными смесями . В некоторых смесях компоненты настолько тесно связаны, что действуют как единое вещество (хотя это и не так). Смеси с постоянным составом на всем протяжении называются гомогенные смеси (или растворы ). Сахар, растворенный в воде, является примером раствора. Металлический сплав, такой как сталь, является примером твердого раствора. Воздух, смесь в основном азота и кислорода, представляет собой газообразный раствор.
Металлический сплав, такой как сталь, является примером твердого раствора. Воздух, смесь в основном азота и кислорода, представляет собой газообразный раствор.
Упражнение \(\PageIndex{1}\)
Как бы химик классифицировал каждый образец вещества?
- морская вода
- почва
- вода
- кислород
Раствор
- Соленая вода действует так, как если бы она была одним веществом, даже если она содержит два вещества — соль и воду. Соленая вода представляет собой однородную смесь или раствор.
- Почва состоит из мелких кусочков различных материалов, поэтому представляет собой неоднородную смесь.
- Вода — это вещество; более конкретно, поскольку вода состоит из водорода и кислорода, она является соединением.
- Кислород, вещество, является элементом.
Упражнение \(\PageIndex{2}\)
Как бы химик классифицировал каждый пример материи?
- кофе
- водород
- яйцо
- Ответить на
Кофе может быть гетерогенной или гомогенной смесью.
 Если нерастворимые части могут быть идентифицированы, то это будет классифицироваться как гетерогенное. Если нет, то кофе был бы однородной смесью или раствором.
Если нерастворимые части могут быть идентифицированы, то это будет классифицироваться как гетерогенное. Если нет, то кофе был бы однородной смесью или раствором.- Ответ б
Водород является элементом. Его можно найти в периодической таблице.
- Ответ c
Яйцо (предположим, сырое) будет гетерогенной смесью. Желток и яичный белок — это два разных вещества, которые легко увидеть.
Фазы
Другой способ классификации вещества состоит в описании его как твердого, жидкого или газообразного, что и было сделано в примерах растворов. Эти три описания, каждое из которых подразумевает, что материя обладает определенными физическими свойствами, представляют собой три фазы материи. Твердое тело имеет определенную форму и определенный объем. Жидкости обычно имеют определенный объем, но не определенную форму; они принимают форму своих контейнеров. Газы не имеют ни определенной формы, ни определенного объема, и они расширяются, чтобы заполнить свои сосуды. Мы сталкиваемся с материей в каждой фазе каждый день; на самом деле мы регулярно встречаемся с водой во всех трех фазах: лед (твердое тело), вода (жидкость) и пар (газ).
Газы не имеют ни определенной формы, ни определенного объема, и они расширяются, чтобы заполнить свои сосуды. Мы сталкиваемся с материей в каждой фазе каждый день; на самом деле мы регулярно встречаемся с водой во всех трех фазах: лед (твердое тело), вода (жидкость) и пар (газ).
Из нашего опыта с водой мы знаем, что вещества могут переходить из одной фазы в другую при правильных условиях. Как правило, изменение температуры вещества (и, реже, давления на него) может вызвать фазовый переход — физический процесс, при котором вещество переходит из одной фазы в другую (рис. \(\PageIndex{3}\) ). Изменения фаз имеют определенные имена в зависимости от того, какие фазы задействованы, как показано в таблице \(\PageIndex{1}\).
| Смена | Имя |
|---|---|
| из твердого в жидкое | плавка, плавка |
| твердое тело в газообразное | сублимация |
| из жидкости в газ | кипение, испарение |
| из жидкого в твердое | затвердевание, замораживание |
| газ в жидкость | конденсат |
| из газа в твердое | показания |
Рисунок \(\PageIndex{6}\): Классификация материи.
 Вещество можно классифицировать по-разному, в зависимости от его свойств. (Cc BY-NC-SA; анонимно)
Вещество можно классифицировать по-разному, в зависимости от его свойств. (Cc BY-NC-SA; анонимно)Упражнение \(\PageIndex{3}\)
- Классифицировать каждый элемент как элемент, соединение, гетерогенную смесь или гомогенную смесь (раствор): воздух в Университете Фурмана, вода озера Фурман , медный провод и водопроводная вода «Фурман».
- В чем разница между гетерогенной смесью и гомогенной смесью? Приведите пример каждого.
- Физические изменения: сжигание топлива, переваривание пищи, растворение соли в воде, медь, проводящая электричество, и кипение воды.
- Ответить на
Надеюсь, воздух Фурмана представляет собой гомогенную смесь (раствор). Если в этом месте нет горения или скопления пыли, это можно с уверенностью предположить. Озеро Фурман определенно представляет собой неоднородную смесь (в некоторых местах оно может быть немного заболочено). Медная проволока является элементом.
 В природе очень мало элементов. Наконец, водопроводная вода Furman обычно представляет собой однородную смесь. В нашей водопроводной воде содержатся природные и искусственные химические вещества (поверьте мне, вам нужен хлор). В наших туалетах используется грязная вода, которая может выглядеть неоднородной (подойдет для канализации, но не для питья).
В природе очень мало элементов. Наконец, водопроводная вода Furman обычно представляет собой однородную смесь. В нашей водопроводной воде содержатся природные и искусственные химические вещества (поверьте мне, вам нужен хлор). В наших туалетах используется грязная вода, которая может выглядеть неоднородной (подойдет для канализации, но не для питья).- Ответ б
Неоднородная смесь, очевидно, является смесью, такой как грязь; однородная смесь ведет себя как одно вещество, например соленая вода.
- Ответ c
Физические изменения: растворение соли в воде, медная проводка и кипение воды. Если состав не меняется, то это физическое изменение. Если есть метод физического разделения компонентов (например, кипячение, выпаривание, дистилляция, магнетизм или фильтрация), то физическое изменение произошло.
Авторы и авторство
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Элизабет Гордон
- Лицензия
- СС BY-NC-SA
- Показать страницу TOC
- № на стр.

- Теги
химическое соединение | Определение, примеры и типы
молекула метана
Просмотреть все СМИ
- Ключевые люди:
- Антуан Лавуазье Луи Бернар Гайтон де Морво Карл Вильгельм Шееле Мартин Генрих Клапрот Николя-Луи Воклен
- Похожие темы:
- химическая связь химический анализ координационное соединение металлоорганическое соединение химическая реакция
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
химическое соединение , любое вещество, состоящее из идентичных молекул, состоящих из атомов двух или более химических элементов.
Вся материя во Вселенной состоит из атомов более 100 различных химических элементов, которые встречаются как в чистом виде, так и в виде химических соединений.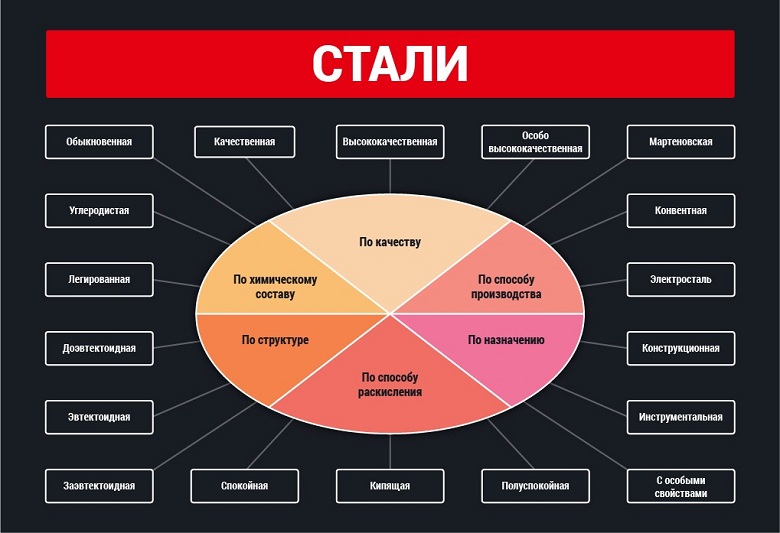 Образец любого данного чистого элемента состоит только из атомов, характерных для этого элемента, и атомы каждого элемента уникальны. Например, атомы, составляющие углерод, отличаются от атомов, составляющих железо, которые, в свою очередь, отличаются от атомов золота. Каждый элемент обозначается уникальным символом, состоящим из одной, двух или трех букв, возникающих либо из текущего имени элемента, либо из его исходного (часто латинского) имени. Например, символы углерода, водорода и кислорода — это просто C, H и O соответственно. Символом железа является Fe, от его первоначального латинского названия 9.0064 железо . Фундаментальный принцип науки химии состоит в том, что атомы различных элементов могут соединяться друг с другом, образуя химические соединения. Метан, например, который образуется из элементов углерода и водорода в соотношении четыре атома водорода на каждый атом углерода, как известно, содержит различные молекулы CH 4 . Формула соединения, такого как CH 4 , указывает типы присутствующих атомов, а нижние индексы представляют относительное количество атомов (хотя цифра 1 никогда не пишется).
Образец любого данного чистого элемента состоит только из атомов, характерных для этого элемента, и атомы каждого элемента уникальны. Например, атомы, составляющие углерод, отличаются от атомов, составляющих железо, которые, в свою очередь, отличаются от атомов золота. Каждый элемент обозначается уникальным символом, состоящим из одной, двух или трех букв, возникающих либо из текущего имени элемента, либо из его исходного (часто латинского) имени. Например, символы углерода, водорода и кислорода — это просто C, H и O соответственно. Символом железа является Fe, от его первоначального латинского названия 9.0064 железо . Фундаментальный принцип науки химии состоит в том, что атомы различных элементов могут соединяться друг с другом, образуя химические соединения. Метан, например, который образуется из элементов углерода и водорода в соотношении четыре атома водорода на каждый атом углерода, как известно, содержит различные молекулы CH 4 . Формула соединения, такого как CH 4 , указывает типы присутствующих атомов, а нижние индексы представляют относительное количество атомов (хотя цифра 1 никогда не пишется).
Исследуйте магнитоподобную ионную связь, образующуюся при переносе электронов от одного атома к другому
Просмотреть все видео к этой статьеПосмотрите, как работают молекулярные связи, когда два атома водорода соединяются с атомом серы, образуя сероводород
Просмотреть все видео к этой статье Вода , представляющий собой химическое соединение водорода и кислорода в соотношении два атома водорода на каждый атом кислорода, содержит молекулы H 2 O. Хлорид натрия представляет собой химическое соединение, образованное из натрия (Na) и хлора (Cl) в соотношении 1:1. Хотя формула хлорида натрия – NaCl, соединение не содержит реальных молекул NaCl. Скорее, он содержит равное количество ионов натрия с положительным зарядом (Na + ) и ионы хлора с отрицательным зарядом единицы (Cl – ). ( См. ниже Тенденции химических свойств элементов для обсуждения процесса превращения незаряженных атомов в ионы [т. соединения: молекулярные (ковалентные) и ионные. Метан и вода состоят из молекул; то есть они являются молекулярными соединениями. Хлорид натрия, с другой стороны, содержит ионы; это ионное соединение.
Метан и вода состоят из молекул; то есть они являются молекулярными соединениями. Хлорид натрия, с другой стороны, содержит ионы; это ионное соединение.
Атомы различных химических элементов можно сравнить с буквами алфавита: так же, как буквы алфавита объединяются, образуя тысячи слов, атомы элементов могут комбинироваться различными способами, образуя множество соединений. . На самом деле известны миллионы химических соединений, и возможно еще много миллионов, но еще не открытых и не синтезированных. Большинство встречающихся в природе веществ, таких как древесина, почва и камни, представляют собой смеси химических соединений. Эти вещества можно разделить на составляющие их соединения физическими методами, то есть методами, которые не изменяют способ агрегации атомов внутри соединений. Соединения можно разложить на составляющие их элементы путем химических превращений. Химическое изменение (то есть химическая реакция) — это изменение организации атомов. Примером химической реакции является горение метана в присутствии молекулярного кислорода (O 2 ) с образованием диоксида углерода (CO 2 ) и воды. CH 4 + 2O 2 → CO 2 + 2H 2 O В этой реакции, которая является примером реакции горения, происходят изменения в том, как атомы углерода, водорода и кислорода связаны друг с другом. в соединениях.
CH 4 + 2O 2 → CO 2 + 2H 2 O В этой реакции, которая является примером реакции горения, происходят изменения в том, как атомы углерода, водорода и кислорода связаны друг с другом. в соединениях.
Викторина «Британника»
Химия: плюсы и минусы
Возможно, вы знаете, что элементы составляют воздух, которым мы дышим, и воду, которую мы пьем, но знаете ли вы о них больше? Какой элемент почти так же легок, как водород? Что вы называете смесью двух химических элементов? Узнайте ответы в этом тесте.
Химические соединения демонстрируют ошеломляющий набор характеристик. При обычных температурах и давлениях некоторые из них являются твердыми, некоторые — жидкими, а некоторые — газообразными. Цвета различных соединений охватывают цвета радуги. Некоторые соединения очень токсичны для человека, тогда как другие необходимы для жизни. Замена только одного атома в соединении может быть причиной изменения цвета, запаха или токсичности вещества. Для того чтобы из этого большого разнообразия можно было извлечь некоторый смысл, были разработаны системы классификации. В приведенном выше примере соединения классифицируются как молекулярные или ионные. Соединения также классифицируются как органические или неорганические. Органические соединения ( см. ниже Органические соединения), названные так потому, что многие из них были первоначально выделены из живых организмов, обычно содержат цепочки или кольца атомов углерода. Из-за большого разнообразия способов, которыми углерод может связываться с самим собой и другими элементами, существует более девяти миллионов органических соединений. Соединения, которые не считаются органическими, называются неорганическими соединениями ( см. ниже Неорганические соединения).
Для того чтобы из этого большого разнообразия можно было извлечь некоторый смысл, были разработаны системы классификации. В приведенном выше примере соединения классифицируются как молекулярные или ионные. Соединения также классифицируются как органические или неорганические. Органические соединения ( см. ниже Органические соединения), названные так потому, что многие из них были первоначально выделены из живых организмов, обычно содержат цепочки или кольца атомов углерода. Из-за большого разнообразия способов, которыми углерод может связываться с самим собой и другими элементами, существует более девяти миллионов органических соединений. Соединения, которые не считаются органическими, называются неорганическими соединениями ( см. ниже Неорганические соединения).
В широких классификациях органических и неорганических веществ существует множество подклассов, в основном основанных на конкретных элементах или группах присутствующих элементов. Например, среди неорганических соединений оксиды содержат O 2- ионов или атомов кислорода, гидриды содержат ионы H – или атомы водорода, сульфиды содержат ионы S 2- и так далее. К подклассам органических соединений относятся спирты (содержащие группу «ОН»), карбоновые кислоты (содержащие группу «СООН»), амины (содержащие группу «NH 2 ») и т. д.
К подклассам органических соединений относятся спирты (содержащие группу «ОН»), карбоновые кислоты (содержащие группу «СООН»), амины (содержащие группу «NH 2 ») и т. д.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Различные способности различных атомов объединяться в соединения лучше всего можно понять с точки зрения периодической таблицы. Периодическая таблица была первоначально построена для представления закономерностей, наблюдаемых в химических свойствах элементов ( см. химическая связь). Другими словами, по мере развития науки химии было замечено, что элементы можно группировать в соответствии с их химической реакционной способностью. Элементы со схожими свойствами перечислены в вертикальных столбцах периодической таблицы и называются группами. По мере раскрытия деталей строения атома стало ясно, что положение элемента в периодической таблице коррелирует с расположением электронов, которыми обладают атомы этого элемента (9). 0064 см. атом). В частности, было замечено, что электроны, определяющие химическое поведение атома, находятся в его самой внешней оболочке. Такие электроны называются валентными электронами.
0064 см. атом). В частности, было замечено, что электроны, определяющие химическое поведение атома, находятся в его самой внешней оболочке. Такие электроны называются валентными электронами.
Например, атомы элементов 1-й группы периодической таблицы имеют один валентный электрон, атомы элементов 2-й группы имеют два валентных электрона и так далее до 18-й группы, элементы которой содержат восемь валентных электронов. , достигается. Самое простое и наиболее важное правило для предсказания того, как атомы образуют соединения, состоит в том, что атомы склонны объединяться таким образом, что позволяют им либо опустошить свою валентную оболочку, либо заполнить ее (то есть заполнить ее), в большинстве случаев имея в общей сложности восемь электронов. . Элементы в левой части периодической таблицы имеют тенденцию терять свои валентные электроны в химических реакциях. Например, натрий (в группе 1) имеет тенденцию терять свой единственный валентный электрон, образуя ион с зарядом +1. Каждый атом натрия имеет 11 электронов ( e – ), каждый из которых имеет заряд -1, чтобы просто сбалансировать заряд +11 на его ядре. Потеря одного электрона оставляет у него 10 отрицательных зарядов и 11 положительных зарядов, что дает суммарный заряд +1: Na → Na + + e – . Калий, расположенный непосредственно под натрием в группе 1, также образует в своих реакциях ионы +1 (K + ), как и остальные члены группы 1: рубидий (Rb), цезий (Cs) и франций (Fr). Атомы элементов в правом конце периодической таблицы, как правило, вступают в реакции, в результате которых они получают (или делят) достаточное количество электронов, чтобы завершить свою валентную оболочку. Например, кислород в 16-й группе имеет шесть валентных электронов и, следовательно, нуждается в еще двух электронах, чтобы завершить свою внешнюю оболочку. Кислород достигает такого расположения, реагируя с элементами, которые могут терять или делиться электронами.
Каждый атом натрия имеет 11 электронов ( e – ), каждый из которых имеет заряд -1, чтобы просто сбалансировать заряд +11 на его ядре. Потеря одного электрона оставляет у него 10 отрицательных зарядов и 11 положительных зарядов, что дает суммарный заряд +1: Na → Na + + e – . Калий, расположенный непосредственно под натрием в группе 1, также образует в своих реакциях ионы +1 (K + ), как и остальные члены группы 1: рубидий (Rb), цезий (Cs) и франций (Fr). Атомы элементов в правом конце периодической таблицы, как правило, вступают в реакции, в результате которых они получают (или делят) достаточное количество электронов, чтобы завершить свою валентную оболочку. Например, кислород в 16-й группе имеет шесть валентных электронов и, следовательно, нуждается в еще двух электронах, чтобы завершить свою внешнюю оболочку. Кислород достигает такого расположения, реагируя с элементами, которые могут терять или делиться электронами. Атом кислорода, например, может реагировать с атомом магния (Mg) (в группе 2), принимая два валентных электрона магния, образуя Mg 9ионы 0356 2+ и О 2– . (Когда нейтральный атом магния теряет два электрона, он образует ион Mg 2+ , а когда нейтральный атом кислорода получает два электрона, он образует ион O 2– .) Образующийся Mg 2+ и O 2- затем объединяют в соотношении 1:1, чтобы получить ионное соединение MgO (оксид магния). (Хотя составной оксид магния содержит заряженные частицы, он не имеет суммарного заряда, поскольку содержит равные количества Mg 2+ и O 2− ионов.) Аналогичным образом кислород реагирует с кальцием (чуть ниже магния в группе 2) с образованием CaO (оксида кальция). Кислород аналогичным образом реагирует с бериллием (Be), стронцием (Sr), барием (Ba) и радием (Ra), остальными элементами группы 2. Ключевым моментом является то, что, поскольку все элементы данной группы имеют одинаковое количество валентных электронов, они образуют аналогичные соединения.
Атом кислорода, например, может реагировать с атомом магния (Mg) (в группе 2), принимая два валентных электрона магния, образуя Mg 9ионы 0356 2+ и О 2– . (Когда нейтральный атом магния теряет два электрона, он образует ион Mg 2+ , а когда нейтральный атом кислорода получает два электрона, он образует ион O 2– .) Образующийся Mg 2+ и O 2- затем объединяют в соотношении 1:1, чтобы получить ионное соединение MgO (оксид магния). (Хотя составной оксид магния содержит заряженные частицы, он не имеет суммарного заряда, поскольку содержит равные количества Mg 2+ и O 2− ионов.) Аналогичным образом кислород реагирует с кальцием (чуть ниже магния в группе 2) с образованием CaO (оксида кальция). Кислород аналогичным образом реагирует с бериллием (Be), стронцием (Sr), барием (Ba) и радием (Ra), остальными элементами группы 2. Ключевым моментом является то, что, поскольку все элементы данной группы имеют одинаковое количество валентных электронов, они образуют аналогичные соединения.
Химические элементы можно классифицировать по-разному. Наиболее фундаментальное деление элементов на металлы, составляющие большинство элементов, и неметаллы. Типичными физическими свойствами металлов являются блестящий внешний вид, ковкость (способность превращаться в тонкий лист), пластичность (способность вытягиваться в проволоку) и эффективная тепло- и электропроводность. Важнейшим химическим свойством металлов является склонность отдавать электроны с образованием положительных ионов. Медь (Cu), например, является типичным металлом. Он блестящий, но легко тускнеет; это отличный проводник электричества и обычно используется для электрических проводов; и из него легко формуются изделия различной формы, такие как трубы для водопроводных систем. Медь содержится во многих ионных соединениях в виде Cu + или ион Cu 2+ .
Металлические элементы находятся слева и в центре таблицы Менделеева. Металлы групп 1 и 2 называются репрезентативными металлами; те, что находятся в центре периодической таблицы, называются переходными металлами. Лантаноиды и актиноиды, показанные под периодической таблицей, представляют собой особые классы переходных металлов.
Лантаноиды и актиноиды, показанные под периодической таблицей, представляют собой особые классы переходных металлов.
Неметаллы, которых относительно немного, находятся в верхнем правом углу периодической таблицы, за исключением водорода, единственного неметаллического члена группы 1. Физические свойства, характерные для металлов, у неметаллов отсутствуют. В химических реакциях с металлами неметаллы приобретают электроны, образуя отрицательные ионы. Неметаллические элементы также реагируют с другими неметаллами, в этом случае образуя молекулярные соединения. Хлор — типичный неметалл. При обычных температурах элементарный хлор содержит Cl 2 молекул и реагирует с другими неметаллами с образованием таких молекул, как HCl, CCl 4 и PCl 3 . Хлор реагирует с металлами с образованием ионных соединений, содержащих ионы Cl –.
Разделение элементов на металлы и неметаллы является приблизительным. Несколько элементов вдоль разделительной линии проявляют как металлические, так и неметаллические свойства и называются металлоидами или полуметаллами.
Чтение: Классификация минералов | Геология
Классы полезных ископаемых
Минералы классифицируются в соответствии с их химическими свойствами. За исключением класса природных элементов, химической основой для классификации минералов является анион, отрицательно заряженный ион, который обычно появляется в конце химической формулы минерала. Например, сульфиды основаны на ионе серы S 2– . Пирит, например, FeS 2 , является сульфидным минералом. В некоторых случаях анион класса минералов является многоатомным, например (CO 3 ) 2–, карбонат-ион. Основные классы минералов:
- силикаты
- сульфиды
- карбонаты
- оксиды
- галогениды
- сульфаты
- фосфаты
- родные элементы
Силикаты
На основе многоатомного аниона (SiO 4 ) 4– , имеющего тетраэдрическую форму. Большинство минералов в земной коре и мантии представляют собой силикатные минералы.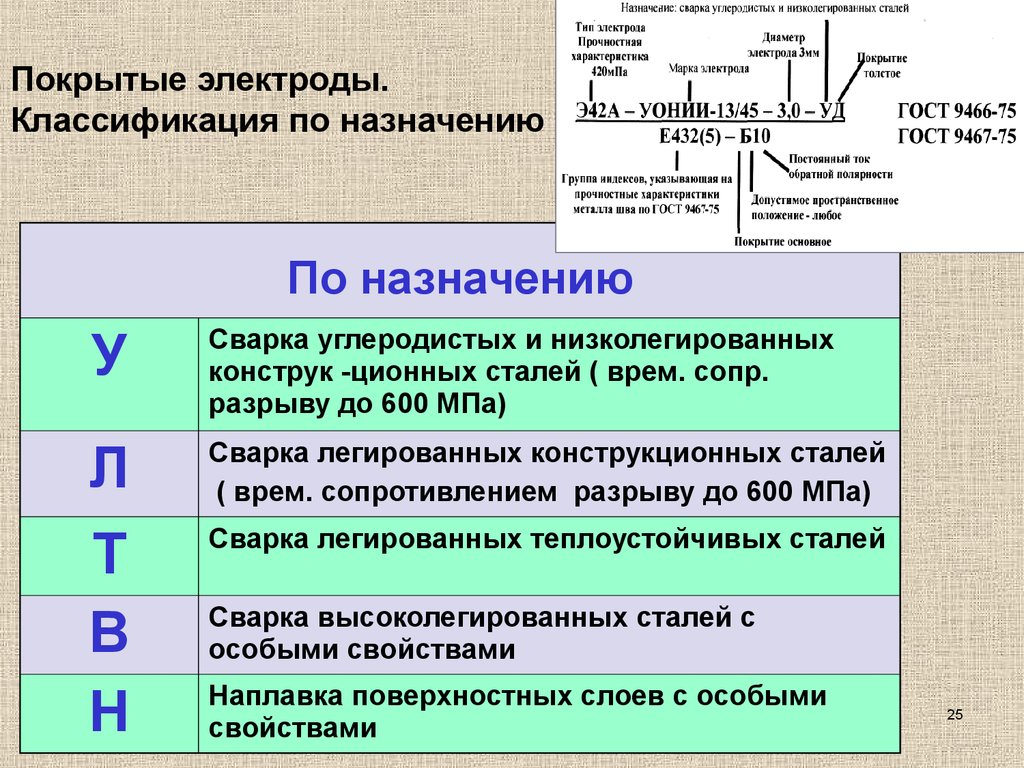 Все силикатные минералы построены из кремнекислородных тетраэдров (SiO 4 ) 4– в различных схемах соединения, которые создают разные кристаллические решетки. Вы можете понять свойства силикатного минерала, такие как форма кристалла и расщепление, зная, какой тип кристаллической решетки он имеет.
Все силикатные минералы построены из кремнекислородных тетраэдров (SiO 4 ) 4– в различных схемах соединения, которые создают разные кристаллические решетки. Вы можете понять свойства силикатного минерала, такие как форма кристалла и расщепление, зная, какой тип кристаллической решетки он имеет.
- В несиликатах , также называемых островными силикатами, силикатные тетраэдры отделены друг от друга и полностью связаны с несиликатными атомами. Оливин — островной силикат.
- В соросиликатах или парных силикатах, таких как эпидот, силикатные тетраэдры связаны попарно.
- В циклосиликатах , также называемых кольцевыми силикатами, силикатные тетраэдры соединены в кольца. Берилл или изумруд представляет собой кольцевой силикат.
- В филлосиликатах или листовых силикатах тетраэдры соединены по трем углам, образуя плоские листы. Биотит представляет собой листовой силикат.

- В одноцепочечных иносиликатах силикатные тетраэдры связаны в одинарные цепи. Пироксены представляют собой одноцепочечные иносиликаты.
- В двухцепочечные иносиликаты силикатные тетраэдры связаны двойными цепочками. Амфиболы представляют собой двухцепочечные иносиликаты.
- В тектосиликатах , также известных как каркасные силикаты, все углы силикатных тетраэдров связаны с углами других силикатных тетраэдров, образуя полный каркас силикатных тетраэдров во всех направлениях. Полевой шпат, наиболее распространенный минерал в земной коре, и кварц являются каркасными силикатами.
Сульфиды
Основаны на сульфид-ионе S 2– . Примеры включают пирит, FeS 2 , галенит, PbS, и сфалерит, ZnS в форме чистого цинка. Некоторые сульфиды добываются как источники таких металлов, как цинк, свинец, медь и олово.
Карбонаты
Основаны на ионе карбоната (CO 3 ) 2– . Кальцит CaCO 3 и доломит CaMg(CO 3 )2 являются карбонатными минералами. Карбонатные минералы, как правило, относительно легко растворяются в воде, особенно в кислой воде, а природная дождевая вода слабокислая.
Кальцит CaCO 3 и доломит CaMg(CO 3 )2 являются карбонатными минералами. Карбонатные минералы, как правило, относительно легко растворяются в воде, особенно в кислой воде, а природная дождевая вода слабокислая.
Оксиды
Основаны на анионе кислорода O 2– . Примеры включают оксиды железа, такие как гематит Fe 2 O 3 и магнетит Fe 3 O 4 и пиролюзит MgO.
Галогениды
Они содержат элемент галогена в качестве аниона, будь то фторид, F –, хлорид, Cl –, бромид, Br –, йодид, I –, или астатид, At – . Галит, NaCl, является галоидным минералом.
Сульфаты
Они содержат многоатомный ион сульфата (SO 4 ) 2– в качестве аниона. Ангидрит, CaSO 4 , представляет собой сульфат.
Фосфаты
Они содержат многоатомный ион фосфата (PO 4 ) 3– в качестве аниона. Фторапатит, Ca 5 (PO 4 ) 3 F, который делает ваши зубы твердыми, является фосфатным минералом.
Фторапатит, Ca 5 (PO 4 ) 3 F, который делает ваши зубы твердыми, является фосфатным минералом.
Элементы Native
Состоят из одного элемента. Золото (Au), самородная медь (Cu), а также алмаз и графит, состоящие из углерода, являются природными минералами. Напомним, что минерал определяется как встречающийся в природе. Следовательно, элементы, очищенные и кристаллизованные в лаборатории, не считаются минералами, если они также не были обнаружены в природе.
Таблицы классификации минералов
В таблицах 1–3 твердость измеряется по шкале Мооса. Читая таблицы, вы можете нажимать на изображения минералов, чтобы увидеть увеличенную версию фотографии.
| Таблица 1. Неметаллический блеск — светлый цвет | ||||
|---|---|---|---|---|
| Стандартный цвет | Твердость | Расщепление/перелом | Наименование минерала | Фото минерала |
| бесцветный | 7 | конходиальный перелом | кварц | |
| переменная | 7 | конходиальный перелом | халцедон (кремни и др. ) ) | |
| розовый или белый | 5–6 | 2 плоскости под прямым углом | ортоклаз (полевой шпат) | |
| белый | 5–6 | 2 плоскости под прямым углом | Na-плагиоклаз (полевой шпат) | |
| от белого до серого | 5–6 | 2 плоскости под прямым углом | Ка-плагиоклаз (полевой шпат) | |
| переменная | 4 | 4 плоскости | флюорит | |
| бесцветный или белый | 3 | 3 плоскости под нечетными углами | кальцит | |
| розовый или белый | 3 | 3 плоскости под нечетными углами | доломит | |
| бесцветный или белый | 2,5–3 | 3 плоскости под нечетными углами | галит | |
| бесцветный или белый | 2,5 | 1 самолет | москвич | |
| бесцветный или белый | 2 | 2 плоскости под прямым углом | гипс | |
| переменная | 1 | 1 самолет | тальк | |
| белый | < 1 | неровный (превращается в порошок) | каолинит | |
Таблица 2. Неметаллический блеск — темный цвет Неметаллический блеск — темный цвет | ||||
|---|---|---|---|---|
| Стандартный цвет | Твердость | Расщепление/перелом | Наименование минерала | Фото минерала |
| зеленый | 5–6 | неправильный | оливин | |
| красный | 5–6 | нерегулярный | гранат | |
| красный | 3–6 | нерегулярный | гематит | |
| темно-зеленый | 3–6 | 2 плоскости под прямым углом | пироксен | |
| черный | 4,5–6 | 2 плоскости под нечетными углами | роговая обманка (амфибол) | |
| черный | 2,5 | 1 самолет | биотит | |
| зеленый | 2 | 1 самолет | хлорит | |
Таблица 3. Металлический блеск Металлический блеск | ||||
|---|---|---|---|---|
| Стандартный цвет | Твердость | Расщепление/перелом | Наименование минерала | Фото Минерала |
| черный или темно-серый | 6 | нерегулярный | магнетит | |
| желтая латунь | 6 | нерегулярный | пирит | |
| медно-желтый | 4 | нерегулярный | халькопирит | |
| серебро | 3 | 3 плоскости под прямым углом | галенит | |
Как определить минералы
Во-первых, вам нужен хороший свет и ручная линза или увеличительное стекло. Ручная линза — это небольшое увеличительное стекло с двумя линзами, которое имеет не менее 8-кратное увеличение и может быть приобретено в некоторых книжных и природных магазинах.
Минералы идентифицируются на основе их физических свойств, описанных в предыдущем разделе. Чтобы идентифицировать минерал, вы внимательно смотрите на него. На первый взгляд кальцит и кварц похожи. Оба обычно бесцветны, со стеклянным блеском. Однако по другим своим свойствам они совершенно разные. Кварц намного тверже, достаточно тверд, чтобы поцарапать стекло. Кальцит мягкий и не царапает стекло. Кварц не расщепляется на минералы и не трескается так же неравномерно, как разбивается стекло. Кальцит имеет три направления спайности, которые встречаются под углами, отличными от 90°, поэтому он распадается на твердые куски с идеально плоскими, гладкими, блестящими сторонами.
Чтобы идентифицировать минерал, вы внимательно смотрите на него. На первый взгляд кальцит и кварц похожи. Оба обычно бесцветны, со стеклянным блеском. Однако по другим своим свойствам они совершенно разные. Кварц намного тверже, достаточно тверд, чтобы поцарапать стекло. Кальцит мягкий и не царапает стекло. Кварц не расщепляется на минералы и не трескается так же неравномерно, как разбивается стекло. Кальцит имеет три направления спайности, которые встречаются под углами, отличными от 90°, поэтому он распадается на твердые куски с идеально плоскими, гладкими, блестящими сторонами.
При идентификации минерала необходимо:
- Внимательно посмотреть на него со всех видимых сторон, чтобы увидеть, как он отражает свет
- Испытание на твердость
- Определить расщепление или перелом
- Назовите его блеск
- Оценка любых других физических свойств, необходимых для определения идентичности минерала
В таблицах минералов, прилагаемых к этому разделу, минералы сгруппированы в соответствии с их блеском и цветом. Они также классифицируются на основе их твердости и расщепления или излома. Если вы можете идентифицировать несколько из этих физических свойств, вы можете идентифицировать минерал.
Они также классифицируются на основе их твердости и расщепления или излома. Если вы можете идентифицировать несколько из этих физических свойств, вы можете идентифицировать минерал.
В этом видео показан простой урок о том, как идентифицировать минералы.
Поддержите!
У вас есть идеи по улучшению этого контента? Мы будем признательны за ваш вклад.
Улучшить эту страницуПодробнее
Классификация минералов – Музей естественной истории им. Штернберга
Свойства минералов
Представьте, что вы находитесь снаружи и находите минерал. Вы хотите идентифицировать его, но не знаете, как. Это нормально! Минералоги используют различные физические и оптические свойства, чтобы идентифицировать минералы без помощи специального оборудования. Эти свойства включают цвет минерала, форму кристалла, твердость, расщепление (способ разрушения минерала), полосатость, блеск, магнетизм, способность пропускать свет и удельный вес.
Форма кристалла
Форма кристалла относится к общей или характерной форме кристалла минерала или совокупности кристаллов, которые ограничены набором плоских граней, связанных друг с другом симметрией . Некоторые минералы имеют узнаваемые формы, такие как кубы или восьмиугольники, которые помогают идентифицировать минерал. Например, гранаты часто образуют додекаэдры (12 граней). Большинство минералов имеют только одну общую форму, но есть некоторые, которые могут развиваться в несколько форм. Галенит обычно имеет форму куба, но также может образовывать октаэдрическую форму.
Гранат с додекаэдрической формой кристалла. Два образца галенита —
, один с кубической формой
(6-гранный) и один с
октаэдрической формой (8-гранник)
В следующей таблице перечислены некоторые из наиболее распространенных форм кристаллов.
| Пирамидальки (5 сторон) | Сера |
| Куб (6 сторон) | Галена |
| Ромбоэдр (6 сторон) | Родохрозит – Образец из Национальная коллекция минералов в Национальном музее естественной истории , Смитсоновский институт — Родохрозит — NMNH_147520 https://geogallery.  si.edu si.edu |
| Октаэдр (8 сторон) | Флюорит |
| Додекаэдр (12 сторон) | Гранат |
Кристаллический габитус
Склонность минерала постоянно приобретать характерные формы называется кристаллическим габитусом. В отличие от кристаллических форм, кристаллические привычки не связаны кристаллическими гранями или симметрией. Кристаллическая привычка минерала может быть использована для дифференциации минералов. Условия и химический состав окружающей среды, в которой образуется минерал, могут влиять на развитие привычки. Некоторые минералы, такие как пирит, могут образовывать несколько форм кристаллов, в том числе кубические (форма и форма) или лучистые.
| Хрустальная привычка | Описание | Изображение минерала |
| Массивный | минерал не имеет кристаллических граней | Сера |
| Гранулированный | кристаллических зерна примерно равны по размеру ; размер зерен варьируется примерно от 2 до 10 мм | паллазитовый метеорит |
| Пластинчатый | состоит из слоев | Молибденит |
| Слюдяной | , также известный как листовой; кристаллы, которые образуют листовую или слоистую структуру; часто можно разделить на тонкие листы | Слюда |
| С лезвиями | удлиненные кристаллы, которые длиннее они широкие и их ширина больше их глубины; напоминают прямой меч или нож | Стибнит |
| Волокнистый | встречаются в виде очень тонких нитевидных кристаллов | Актинолит |
| Излучающий | агрегаты кристаллов растут наружу из центральной точки | Томсонит |
| Оолит | кристаллические агрегаты округлой формы размером менее четырех миллиметров | Ооиды |
| Полосатый | минералы, имеющие узкие слои или полосы различного цвета и/или текстуры | Агат полосатый |
| Ботриоидальный | , также называемый шаровидным или маммиллярным; агрегаты кристаллов шаровидной или округлой формы | Гематит |
| Столбчатый | длинные призмы достаточной ширины, чтобы название игольчатое (игольчатое) не применялось | Гипс |
| Геодик | скопления минерала образуют округлую массу путем кристаллизации на внутренних стенках полости | Аметистовая жеода (собор) |
| Розетка | скопления таблитчатых кристаллов в радиальном расположении , напоминающем розу или цветок | Баритовые розы |
Твердость
Шкала твердости минералов Мооса основана на сложности поцарапать поверхность минерала. Впервые созданная в 1812 году немецким геологом и минералогом Фридрихом Моосом, шкала имеет 10 уровней и используется для сравнения твердости различных материалов или минералов, чтобы увидеть, какой из них царапает другой. Например, тальк чаще всего используется для твердости по Моосу 1, а алмаз, являющийся минералом твердости на Земле, используется для твердости по шкале Мооса 10. В таблице ниже показаны минералы на каждом уровне твердости и некоторые распространенные материалы, которые также можно использовать для проверить твердость минералов.
Впервые созданная в 1812 году немецким геологом и минералогом Фридрихом Моосом, шкала имеет 10 уровней и используется для сравнения твердости различных материалов или минералов, чтобы увидеть, какой из них царапает другой. Например, тальк чаще всего используется для твердости по Моосу 1, а алмаз, являющийся минералом твердости на Земле, используется для твердости по шкале Мооса 10. В таблице ниже показаны минералы на каждом уровне твердости и некоторые распространенные материалы, которые также можно использовать для проверить твердость минералов.
| Номер шкалы | Наименование минерала | Минеральный Фото | Общий объект |
| 10 | Алмаз | ||
| 9 | Корунд | ||
| 8 | Топаз | Сверло по каменной кладке (8,5) | |
| 7 | Кварц | ||
| 6 | Ортоклаз | Стальной гвоздь (6,5) | |
| 5 | Апатит | Нож/стеклянная тарелка (5,5) | |
| 4 | Флюорит | ||
| 3 | Кальцит | Медный пенни (3,5) | |
| 2 | Гипс | Ноготь (2,5) | |
| 1 | Тальк |
Таблица, показывающая шкалу твердости минералов Мооса. Изображения образцов алмаза, корунда и топаза взяты из Национальной коллекции минералов в Национальном музее естественной истории Смитсоновского института. https://geogallery.si.edu
Изображения образцов алмаза, корунда и топаза взяты из Национальной коллекции минералов в Национальном музее естественной истории Смитсоновского института. https://geogallery.si.edu
Спайность
Когда минералы ломаются, они имеют тенденцию ломаться определенным образом. Это называется декольте. Расщепление происходит по плоскостям, которые зависят от кристаллической структуры минерала и там, где минерал имеет слабые связи, удерживающие атомы вместе. Минералы имеют тенденцию ломаться в этих слабых местах. Минерал может иметь несколько плоскостей спайности. Когда вы смотрите на минерал, обычно его форма определяется плоскостями спайности. Иногда отдельные кристаллы ломаются или не образуют четко очерченных кристаллов, из-за чего трудно увидеть плоскости спайности минерала.
Слюда имеет одну плоскость спайности, которая обозначается как базальная спайность . При расщеплении плоскости спайности минерала можно «расколоть», как страницы книги. Галенит чаще всего образует кубическую спайность . Если бы вы разбили кубик галенита, он разбился бы на все более мелкие кубики. Подобно кубической спайности, такие минералы, как кальцит, которые имеют ромбоэдрическую спайность , могут распадаться на более мелкие ромбоэдрические кристаллы, которые, как следует из названия, выглядят как ромб.
Галенит чаще всего образует кубическую спайность . Если бы вы разбили кубик галенита, он разбился бы на все более мелкие кубики. Подобно кубической спайности, такие минералы, как кальцит, которые имеют ромбоэдрическую спайность , могут распадаться на более мелкие ромбоэдрические кристаллы, которые, как следует из названия, выглядят как ромб.
. В этой таблице приведены
определения различных рисунков спайности,
форма минерала с заданным рисунком спайности
, а также диаграммы
и фотографии, например. Изображение
изменено на основе изображения, принадлежащего
Pearson Prentice Hall, Inc, 2006.
Разрушение
Некоторые минералы имеют химические связи, которые примерно одинаковы во всех направлениях и не имеют предсказуемой точки ослабления. Когда минерал не разрушается по плоскости спайности, это называется изломом. Когда минерал трескается, в большинстве случаев образуются неровные поверхности, которые описываются как неравномерный излом.
Когда минерал трескается, в большинстве случаев образуются неровные поверхности, которые описываются как неравномерный излом.
раковистым изломом – диагностическое
физическое свойство кварца.
Источник: https://www.sandatlas.org/
conchoidal-fracture/
Полоса
При идентификации минерала вы можете использовать его «полосу», чтобы облегчить идентификацию. Полоса — это цвет порошкообразного минерала, который остается на неглазурованной фарфоровой тарелке. Эта пластина также называется полосовой пластиной. Полосатая пластина имеет твердость 7 по шкале твердости Мооса, поэтому любой минерал с твердостью выше семи не оставит полосы, например корунд с твердостью 9.. Вместо этого он оставит белый порошок в том месте, где он поцарапал пластину. Когда минерал имеет более низкую твердость, для его идентификации можно использовать полосу. Цвет минерала не всегда совпадает с цветом прожилки.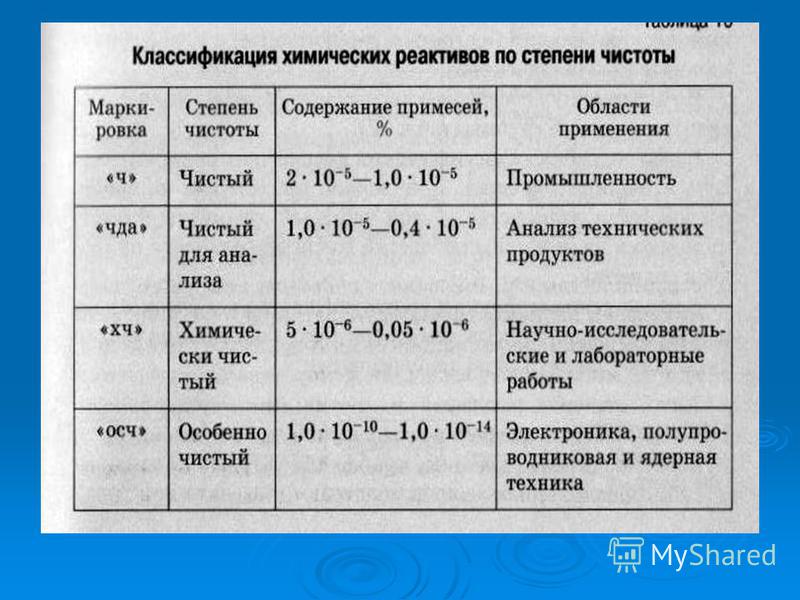 Следовательно, для таких минералов, как кварц, которые могут быть разных цветов, цвет полосы остается неизменным.
Следовательно, для таких минералов, как кварц, которые могут быть разных цветов, цвет полосы остается неизменным.
- Минералы с металлическим блеском обычно имеют темную полосу. Минералы с неметаллическим блеском, как правило, имеют светлую полосу.
- Гематит с красной полосой Гематит
при тестировании на пластине для штрихов.
Магнетизм
Большинство минералов не притягивается магнитом. Следовательно, магнетизм является полезным свойством для идентификации минералов, потому что магнитных минералов мало. Минералы, не обладающие магнитными свойствами, называются диамагнитными минералами . Альтернативно, несколько минералов, обладающих магнитными свойствами, называются парамагнитными минералами . Наиболее магнитоактивные минералы являются ферромагнитными, такими как магнетит (состоит из железа и кислорода; Fe 3 O 4 .)
Магнетит с железной стружкойи притянутыми к нему гвоздями.
 Виден магнетит с кристаллическим габитусом.
Виден магнетит с кристаллическим габитусом.Ферромагнитные минералы важны для понимания магнитного поля Земли. Эти минералы фиксируют направление магнитного поля Земли и поэтому помогают геофизикам реконструировать движение тектонических плит Земли (кусков земной коры и мантии). Геохронология, которая использует ферромагнитные минералы для измерения того, как магнитное поле Земли изменилось во времени, является изучением возраста горных пород и геологических событий.
Вскипание
Когда разбавленную соляную кислоту наносят на поверхность некоторых минералов, минерал будет пузыриться или вскипать. Эта реакция характерна для минералов, содержащих карбонат (CO 3 ). Количество вскипания зависит от того, насколько растворимы минералы. Например, кальцит (CaCO 3 ) вскипает сильнее, чем доломит (CaMg(CO 3 ) 2 ).
Происходит химическая реакция:
- CaCO 3 + 2HCl → Ca 2+ + H 2 O + 2Cl + CO 2 (газ)
- При взаимодействии карбоната кальция и соляной кислоты образуется вода и двуокись углерода (газ).
 Когда углекислый газ высвобождается, он пузырится через воду и оставшуюся соляную кислоту на минерале.
Когда углекислый газ высвобождается, он пузырится через воду и оставшуюся соляную кислоту на минерале.
Оптические свойства
Цвет
При идентификации минералов важно не полагаться только на цвет, поскольку он часто изменчив. Цвет таких минералов, как кварц и кальцит, может ввести в заблуждение. Примеси в кварце могут придавать ему различные оттенки, включая фиолетовый (аметист), желтый (цитрин) и черный (дымчатый кварц). Золото имеет характерный цвет, однако пирит, также известный как «золото дураков», имеет аналогичный цвет. Чтобы определить между ними, необходимы другие оптические и физические свойства минералов.
Золото.Образец из Национальной коллекции минералов
в
Национальном музее естественной истории
Смитсоновского института —
Gold-NMNH_145644.
https://geogallery.si.edu
Самородная сера — для самородных элементов цвет минерала соответствует цвету элемента.
Блеск
Блеск — это внешний вид света, отраженного от поверхности минерала. Блеск бывает двух видов: металлик и неметаллические .
Metallic — это блеск полированного металла, например, внешний вид стали, меди и золота. Этот блеск отражает свет, как металлы, и непрозрачен для проходящего света.
Железный метеорит. Вырезанный и отполированный метеоритс перекрещенным узором
, образованным различными металлами
внутри.
Неметаллический блеск проявляют многие минералы, пропускающие свет. Внешний вид неметаллического блеска варьируется от тщательно отполированной стеклянной поверхности до матового землистого вида. Например, полевой шпат имеет неметаллический блеск, тусклый и землистый. Большинство минералов имеют неметаллический блеск и обычно описываются такими прилагательными, как стекловидный, стеклянный, тусклый, землистый, жемчужный или шелковистый. В неметаллических минералах блеск часто обусловлен разрывом химических связей вдоль плоскостей спайности.
| Стекловидный блеск: | Кварц |
| Стеклянный блеск: | Обсидиан |
| Тусклый блеск: | Ортоклаз |
| Жемчужный блеск: | Слюда |
| Шелковистый блеск: | Гипс |
Способность пропускать свет
Возьмите прозрачную стеклянную чашку и обратите внимание, как через нее проходит свет. Свет, проходящий через стекло, можно описать как непрозрачный, прозрачный или полупрозрачный. Способность минерала пропускать свет обычно используется в процессе идентификации таких минералов, как кварц. Непрозрачные минералы не пропускают свет. Полупрозрачные минералы пропускают немного света, но не дают четкого изображения. Когда через минерал можно передать и свет, и изображение, его называют прозрачным. Крупный образец мусковита на первый взгляд выглядит непрозрачным. Однако при разделении слоев по плоскостям спайности отдельные слои становятся прозрачными.
| Прозрачный: | Кварц |
| Полупрозрачный: | Турмалин |
| Непрозрачный: | Хризоколла |
Двойное преломление
Когда свет проходит через прозрачный минерал, он не всегда проходит как один луч. Некоторые минералы, такие как кальцит, расщепляют простой неполяризованный свет на два луча. Когда на кусок кальцита помещается текст с надпечаткой, эти разделенные световые лучи заставят текст появиться дважды. Посмотрите видео ниже для демонстрации оптического кальцита и того, что происходит, когда свет поляризуется фильтром.
Флуоресценция и фосфоресценция
Минералы, такие как гипс, при освещении ультрафиолетовым (УФ) светом, рентгеновскими лучами и/или электронными лучами светятся яркими цветами, которых нет у минерала. просматривается при обычном свете. Например, кальцит, который в видимом свете выглядит белым, может флуоресцировать разными цветами, такими как красный, синий, розовый, зеленый и оранжевый. На цвет флуоресценции влияют микроэлементы, содержащиеся в минерале.
просматривается при обычном свете. Например, кальцит, который в видимом свете выглядит белым, может флуоресцировать разными цветами, такими как красный, синий, розовый, зеленый и оранжевый. На цвет флуоресценции влияют микроэлементы, содержащиеся в минерале.
и кальцит в видимом свете. Порода, содержащая виллемит и кальцит
, в ультрафиолетовом свете.
Виллемит — зеленый минерал
, а кальцит — оранжевый минерал.
Минералы, такие как флюорит, могут продолжать светиться после удаления первоначального активирующего УФ-излучения. Возникновение света, испускаемого минералом после удаления УФ-излучения, называется фосфоресценцией. Посмотрите видео музея Штернберга, чтобы узнать больше о том, как и почему минералы светятся при освещении УФ-светом.
Пожалуйста, дважды проверьте веб-адрес или воспользуйтесь функцией поиска на этой странице, чтобы найти то, что вы ищете. Если вы уверены, что у вас правильный веб-адрес, но столкнулись с ошибкой, пожалуйста, свяжитесь с администрацией сайта. Спасибо. Возможно, вы искали…
по Брайан Ледвелл — Последнее изменение 04 августа 2011 г., 10:54 |
Общая классификация магматических пород
Общая классификация магматических пород| ЭЭНС 2120 | Петрология |
Проф.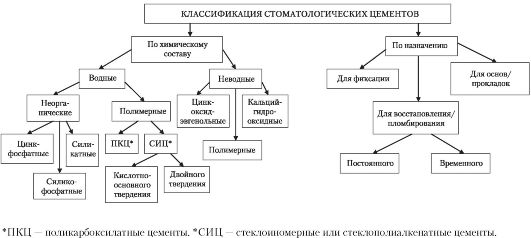 Стивен А.
Нельсон Стивен А.
Нельсон | Тулейнский университет |
Общие Классификация магматических пород | |
| Классификация магматических пород является одним из наиболее запутанных аспектов геологии. Этот отчасти из-за исторических причин, отчасти из-за природы магм, а отчасти из-за различные критерии, которые потенциально могут быть использованы для классификации горных пород. |
Из-за ограничений различных критериев, которые можно использовать для классификации магматических
горных пород, геологи используют подход, основанный на информации, получаемой на различных стадиях
рассматривая скалы.
|
| Простая полевая классификация вулканических пород | ||
| Название камня | Основные минералы* | Прочие полезные ископаемые (может или может отсутствовать) |
| Базальт | Оливин | Cpx, Opx, Plag. |
| Базанит | Оливин + Фельдшпатоид (Нефелин/ лейцит) | Cpx, Плат. |
| Андезит | Нет оливина, много плагиоклаза | Cpx, Opx, роговая обманка |
| Трахита | Санидин + Плагиоклаз | Na-Cpx, роговая обманка, биотит |
| Дацит | Плагиоклаз + роговая обманка | Cpx, Opx, биотит |
| Риолит | Кварц | Санидин, биотит, платина, роговая обманка, Cpx, ОП |
* Количество стекла в основной массе в целом увеличивается сверху вниз
внизу диаграммы..jpg) | ||
|
Обратите внимание, что на каждом этапе процесса классификация может меняться, но она
важно иметь в виду, что каждый этап имеет ограничения, и что классификация на каждом
стадия предназначена для целей описания породы, а не только для отдельных
следователь, но и любой другой. Таким образом, схема классификации должна использоваться в
последовательным образом, чтобы последующие следователи могли понять, о чем вы говорите
на каждом этапе процесса. Таким образом, схема классификации должна использоваться в
последовательным образом, чтобы последующие следователи могли понять, о чем вы говорите
на каждом этапе процесса. |
Общая химическая классификация SiO 2 (диоксид кремния) Содержание
Эта терминология основана на существовавшей когда-то идее, что скалы с высоким
% SiO 2 выпадали из вод с высокой концентрацией
гидрокремниевая кислота H 4 SiO 4 . Хотя теперь мы знаем, что это не
правда, кислотно-щелочная терминология прочно укоренилась в литературе. Насыщение кремнеземом Если магма перенасыщена кремнеземом, то минерал кремнезема,
такие как кварц, кристобалит, тридимит или коэсит, должны осаждаться из магмы,
и быть в скале. С другой стороны, если магма недонасыщена
по отношению к кремнезему, то минерал кремнезема не должен осаждаться из магмы, и, таким образом,
не должно быть в камне. Таким образом, концепция насыщения кремнеземом может быть использована для
разделить породы на недонасыщенные кремнеземом, насыщенные кремнеземом и перенасыщенные кремнеземом породы.
Наиболее легко увидеть первый и последний из этих терминов. |
Нефелин-NaAlSiO 4 Лейцит – KAlSi 2 O 6 Форстеритовый оливин – Mg 2 SiO 4 Содалит-3NaAlSiO 4 . NaCl
Носеан – 6NaAlSiO 4 . Na 2 SO 4 Хейн-6NaAlSiO 4 . (Na 2 , Ca) SO 4 Перовскит – CaTiO 3 Меланит – Ca 2 Fe +3 Si 3 O 12 Мелилит – (Ca, Na) 2 (Mg, Fe +2 , Al, Si) 3 O 7
Таким образом, если мы найдем любой из этих минералов в горной породе, за исключением того, что мы увидим в момент, то мы можем ожидать, что порода будет недонасыщена кремнеземом. Если мы рассчитаем норму CIPW (посмотрим, как это сделать в лаборатории), нормативные минералы
которые встречаются в недонасыщенных кремнеземом породах, представляют собой нефелин и/или лейцит. Чтобы получить представление о том, что означает насыщение кремнеземом, давайте рассмотрим простой силикат. система – система Mg 2 SiO 4 – SiO 2 |
Обратите внимание, как составы между Fo и En закончат свою кристаллизацию
только с оливином Fo и энстатитом. Это SiO 2 -недосыщенные.
композиции. Все составы между En и SiO 2 заканчивают свое
кристаллизация с кварцем и энстатитом. Это SiO 2 – пересыщенные
композиции. Это SiO 2 -недосыщенные.
композиции. Все составы между En и SiO 2 заканчивают свое
кристаллизация с кварцем и энстатитом. Это SiO 2 – пересыщенные
композиции.Обратите также внимание, что это может вызвать некоторую путаницу в вулканических породах, которые не завершают свою кристаллизацию из-за быстрого охлаждения на поверхности. Давайте представьте себе сначала состав в области недонасыщения кремнеземом. Охлаждение в любом месте на ликвидусе приведет к кристаллизации оливина, богатого фтором. Если это жидкость, содержащая оливин, извергается, а остальная жидкость гаснет до стакана, затем это приведет к образованию породы с вкрапленниками оливина в стекловидной основной массе. |
Применение приведенных выше критериев для выявления недонасыщенных кремнеземом пород даст нам
что это порода, недонасыщенная кремнеземом, что, как мы знаем, верно. Далее, давайте
посмотрите на перенасыщенный кремнеземом состав, например, тот, что слева от точки
на схеме обозначен буквой «П». Если эту жидкость охладить до ликвидуса, а оливин
если дать кристаллизоваться, а затем закалить на поверхности, он будет содержать вкрапленники
богатого фтором оливина в стеклообразной основной массе. Применение вышеуказанных критериев предполагает
что эта порода также недонасыщена кремнеземом, но мы знаем, что это не так. Этот
иллюстрирует одну из трудностей применения каких-либо критериев классификации вулканических
породы, в которых неполная кристаллизация/реакция не позволила сформироваться всем минералам. Далее, давайте
посмотрите на перенасыщенный кремнеземом состав, например, тот, что слева от точки
на схеме обозначен буквой «П». Если эту жидкость охладить до ликвидуса, а оливин
если дать кристаллизоваться, а затем закалить на поверхности, он будет содержать вкрапленники
богатого фтором оливина в стеклообразной основной массе. Применение вышеуказанных критериев предполагает
что эта порода также недонасыщена кремнеземом, но мы знаем, что это не так. Этот
иллюстрирует одну из трудностей применения каких-либо критериев классификации вулканических
породы, в которых неполная кристаллизация/реакция не позволила сформироваться всем минералам. |
Глинозем (Al 2 O 3 ) Насыщенность После кремнезема,
глинозем является вторым наиболее распространенным оксидным компонентом в магматических породах. Полевые шпаты
в общем, самые распространенные минералы, встречающиеся в магматических породах.
Существуют три возможных состояния.
|
Щелочные/Субщелочные породы Последняя схема общей классификации отделяет породы щелочные от слабощелочных. Обратите внимание, что этот критерий основан исключительно на диаграмме щелочи и диоксида кремния, как показано ниже. Щелочные породы не следует путать с щелочными породами, как обсуждалось выше. В то время как большинство щелочные породы также являются щелочными, щелочные породы не обязательно являются щелочными. С другой стороны, очень щелочные породы, т.е. разделительной линии на рисунке ниже, также обычно являются недонасыщенными кремнеземом. |
Примеры вопросов по этому материалу, которые могут быть на экзамене
|


 Присутствие ванадия, карбидов и кремния увеличивает жаростойкость металла и снижает показатель хрупкости, позволяя избегать его растрескивания;
Присутствие ванадия, карбидов и кремния увеличивает жаростойкость металла и снижает показатель хрупкости, позволяя избегать его растрескивания;
 д.). Их преимуществом являются высокая эффективность и длительный период защиты.
д.). Их преимуществом являются высокая эффективность и длительный период защиты.




 д. Также к данному классу принадлежат биопрепараты: Триходермин, Псевдобактерин, Лепидоцид, Битоксибациллин, Фитоверм, Метавайт и т.д.
д. Также к данному классу принадлежат биопрепараты: Триходермин, Псевдобактерин, Лепидоцид, Битоксибациллин, Фитоверм, Метавайт и т.д.


 Второй вариант — малая доля марганца (или вообще его отсутствие) во флюсе, но легирующие добавки присутствуют в стали сварочного прутка.
Второй вариант — малая доля марганца (или вообще его отсутствие) во флюсе, но легирующие добавки присутствуют в стали сварочного прутка.
 д.) — например, такие марки, как МБ-2 или БМ-1;
д.) — например, такие марки, как МБ-2 или БМ-1; »
»
 Цвет полосы на упаковке – синий.
Цвет полосы на упаковке – синий.

 И эта квалификация отличается особой чистотой: процентное содержание основного химического вещества — не меньше 99%.
И эта квалификация отличается особой чистотой: процентное содержание основного химического вещества — не меньше 99%.

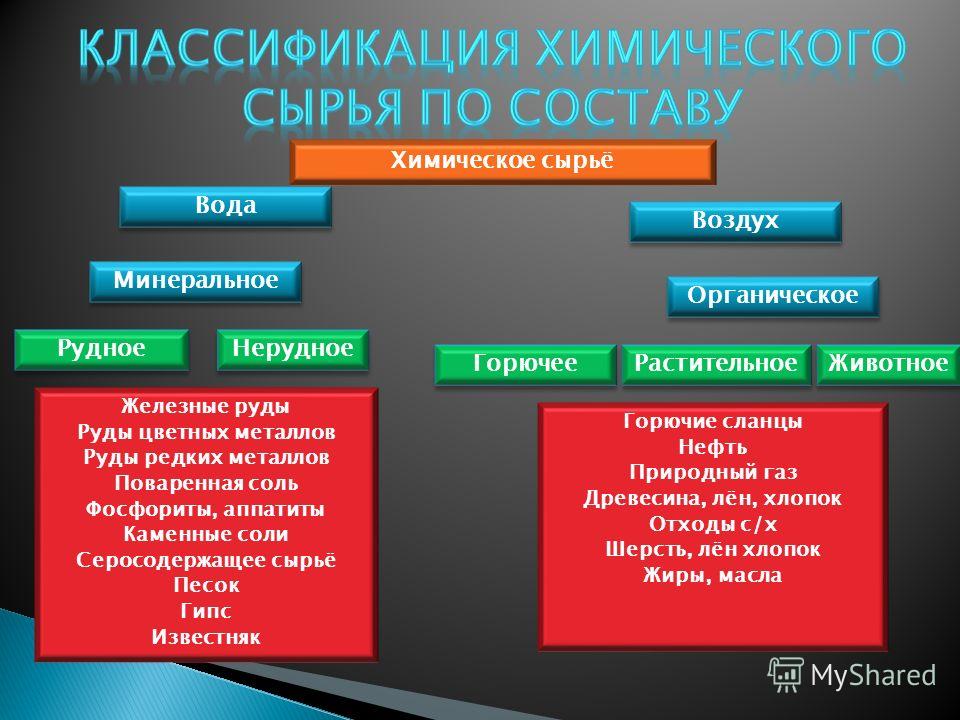 Классификацию следует ограничивать одной или очень малым количеством групп.
Классификацию следует ограничивать одной или очень малым количеством групп. Если нерастворимые части могут быть идентифицированы, то это будет классифицироваться как гетерогенное. Если нет, то кофе был бы однородной смесью или раствором.
Если нерастворимые части могут быть идентифицированы, то это будет классифицироваться как гетерогенное. Если нет, то кофе был бы однородной смесью или раствором. В природе очень мало элементов. Наконец, водопроводная вода Furman обычно представляет собой однородную смесь. В нашей водопроводной воде содержатся природные и искусственные химические вещества (поверьте мне, вам нужен хлор). В наших туалетах используется грязная вода, которая может выглядеть неоднородной (подойдет для канализации, но не для питья).
В природе очень мало элементов. Наконец, водопроводная вода Furman обычно представляет собой однородную смесь. В нашей водопроводной воде содержатся природные и искусственные химические вещества (поверьте мне, вам нужен хлор). В наших туалетах используется грязная вода, которая может выглядеть неоднородной (подойдет для канализации, но не для питья).

 Когда углекислый газ высвобождается, он пузырится через воду и оставшуюся соляную кислоту на минерале.
Когда углекислый газ высвобождается, он пузырится через воду и оставшуюся соляную кислоту на минерале.
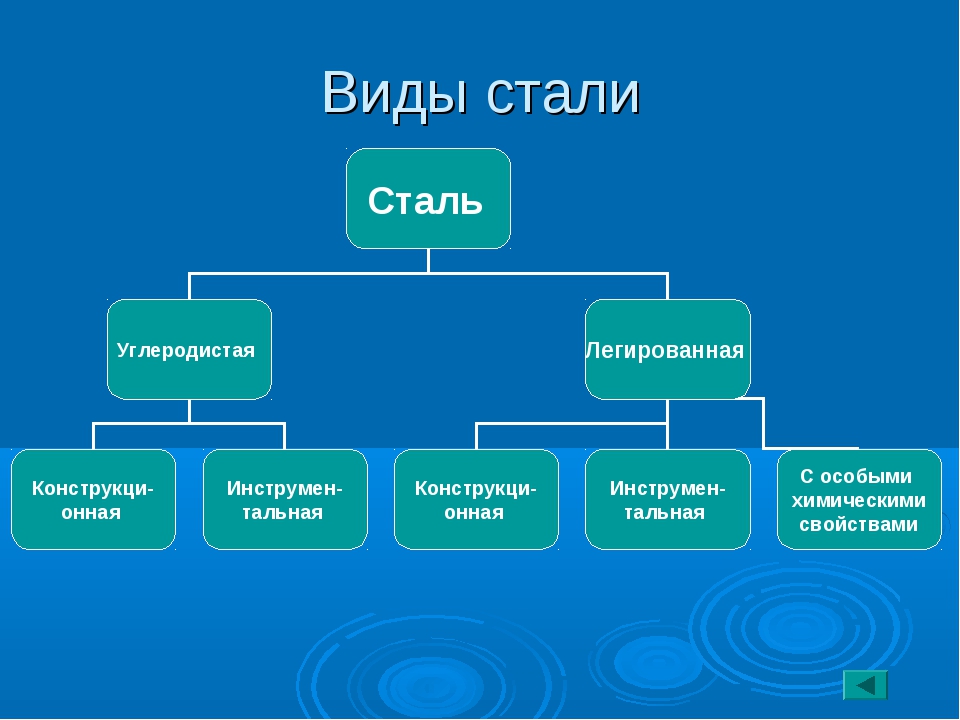 Михалик,
04 августа 2011 г., 10:22
Михалик,
04 августа 2011 г., 10:22 , 10:18
, 10:18 , 13:57
, 13:57 2018 г., 17:08
2018 г., 17:08 Обычно это
по минералогическому составу и текстуре. Для глубинных пород система IUGS
можно использовать классификацию. Для вулканических пород можно использовать следующую таблицу.
Обычно это
по минералогическому составу и текстуре. Для глубинных пород система IUGS
можно использовать классификацию. Для вулканических пород можно использовать следующую таблицу.
 NaCl
NaCl
 Таким образом
понятие насыщения глиноземом основано на том, есть ли избыток или недостаток Al
для составления полевых шпатов. Обратите внимание, что Al 2 O 3 встречается в полевых шпатах
в соотношении 1 Al к 1 Na, 1K или 1 Ca:
Таким образом
понятие насыщения глиноземом основано на том, есть ли избыток или недостаток Al
для составления полевых шпатов. Обратите внимание, что Al 2 O 3 встречается в полевых шпатах
в соотношении 1 Al к 1 Na, 1K или 1 Ca: Это состояние выражается
химически на молекулярной основе как:
Это состояние выражается
химически на молекулярной основе как: Для них характерно отсутствие
Аль 2 O 3 -богатый минерал и отсутствие натриевых пироксенов и амфиболов в
режим.
Для них характерно отсутствие
Аль 2 O 3 -богатый минерал и отсутствие натриевых пироксенов и амфиболов в
режим.