Коррозии металлов определение: Коррозия – Что такое Коррозия?
alexxlab | 08.05.2023 | 0 | Разное
определение понятия, основные признаки и классификация
Химия
12.11.21
9 мин.
Сущность процесса коррозии состоит в физико-химическом воздействии внешней среды на металлические предметы или сплавы. Это сопровождается медленным разрушением материала. При этом каждые тела обладают способностью к сопротивлению внешним воздействиям. Различают несколько видов коррозии металлов, классификация которых идет по механизму или условиям протекания.
Оглавление:
- Основные признаки и классификация
- Влияние окружающей среды
- Химический процесс
- Электрохимическая коррозия
Основные признаки и классификация
Коррозией в химии называется разрушительный процесс, проходящий в металлах. Это приводит к потере материалами своих первоначальных физических характеристик.
Основные признаки:
- Наблюдается процесс окислительно-восстановительных реакций на поверхности металла.

- Коррозия происходит произвольно. Ее сила зависит от факторов внешней среды.
- Разрушение металла носит пластинчатый характер. Если кратко, начинается она на поверхности, а потом перемещается вглубь металлических предметов.
Определение термина «коррозия» распространяется не только на металлические материалы. Это понятие касается также бетона и керамических изделий.
Разрушение металлов может иметь разный характер. Все зависит от степени разъедания материала. Коррозия бывает нескольких типов:
- Сплошная. Вся поверхность материала подвергается разрушению.
- Неравномерная. В этом случае разрушительный процесс происходит в отдельных точках с разной скоростью.
- Местная. Располагается отдельными пятнами. В этих местах формируются дефекты в виде раковин.
- Подповерхностная. Сначала появляется на поверхности, затем проникает внутрь и распространяется по металлу. Такая коррозия носит пластовый характер.

- Межкристаллитная. Схема перемещения идет между зернами кристаллов. Наблюдается при электрохимической коррозии. В итоге материал теряет свои физические характеристики и становится хрупким.
- Щелевая. Происходит в тех местах, где присутствуют резьбовые соединения. Часто наблюдается в зазорах, где неплотно прилегают прокладки.
Все эти процессы наносят вред изделиям. Если разрушение началось, то самостоятельно оно уже не остановится.
Влияние окружающей среды
Степень разрушения в полной мере зависит от того, какая вокруг металла присутствует среда. В зависимости от этого различают несколько разновидностей коррозии:
- Влажная. В этом случае на поверхности материала формируется тонкая пленка. Величина ее будет зависеть от размера образованного конденсата.
- Мокрая. Разъедание металлического сплава, опущенного в жидкость, происходит усиленными темпами.

- Сухая. К ней относится атмосферная среда. В этом случае материал меньше всего подвержен разрушениям. Этому препятствует образованная на его поверхности пленка.
- Подземная. Коррозийные процессы протекают при взаимодействии с почвой.
- Биокоррозия. Происходит при длительном контакте материала с микроорганизмами и продуктами их жизнедеятельности.
Таким образом, коррозия меньше всего может проявляться в сухой атмосфере. Однако в небольшой степени она присутствует и здесь.
Химический процесс
Химическая коррозия — это длительное взаимодействие между собой металла и агрессивной среды. В результате происходит непрерывный процесс окисления и восстановления. Это возможно только в тех средах, где не протекает электрический ток. К ним относятся:
- Жидкостная. Сюда можно отнести нефть и ее производные.
- Газовая. Происходит при высоких температурах. Например, кислород, сероводород, пары воды.

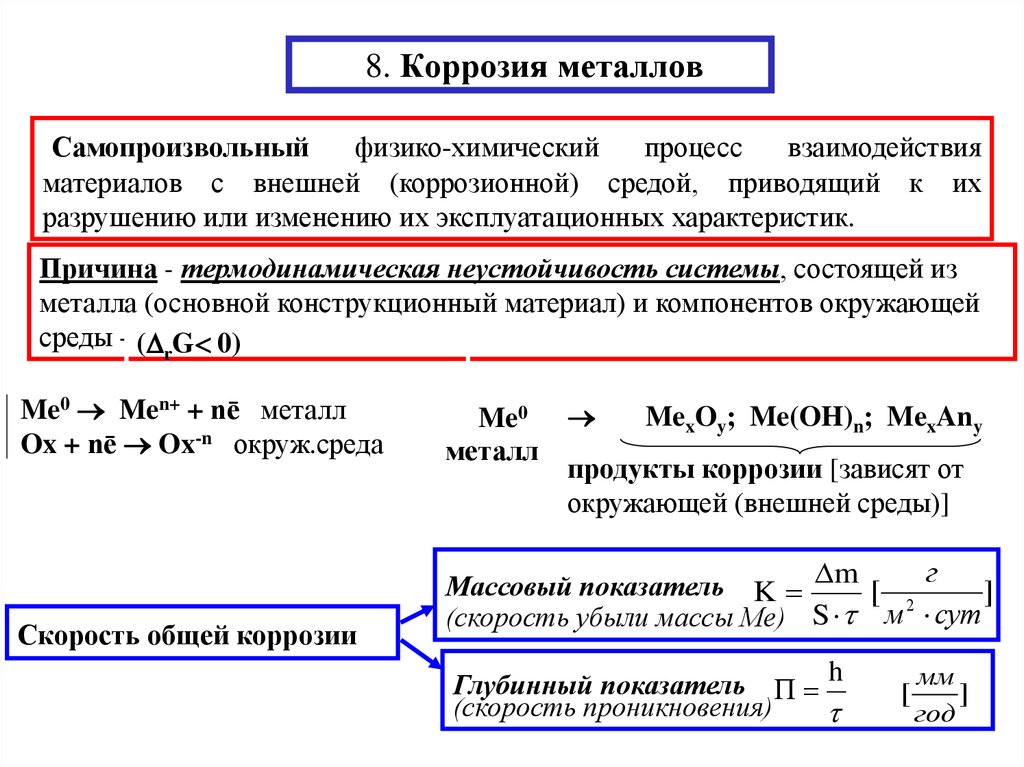
Скорость, при которой наблюдаются разрушения, находится в пропорциональной зависимости от быстроты проникновения агрессивной среды сквозь оксидную пленку сплава. При этом течение реакции будет зависеть от степени сопротивления пленки. Здесь появляется такой термин, как сплошность, который отражает защитные свойства пленки.
Существует известная формула сплошности, имеющее обозначение α: α = Vок/VМе, где:
- Vок — объем образовавшегося оксида:
- VМе — объем металла, израсходованный на образование оксида.
В итоге общее уравнение имеет вид: α = Мок*ρМе/(n*AMe*ρок), где:
- Мок — молярная масса оксида;
- ρМе — плотность сплава;
- n — число атомов металла;
- AMe — атомная масса;
- ρок — плотность оксида.
Оптимальным вариантом является 1<α<2,5. В этом случае защитная пленка хорошо защищает материал.
Электрохимическая коррозия
При электрохимической коррозии реакция происходит в растворе электролита. Здесь наблюдается ионизация металла, который находится в агрессивной среде. Отрыв ионов идет под воздействием электрического потенциала. Чем он выше, тем быстрее протекает коррозионный процесс. Возникающая ржавчина является восстановленной коррозионной средой. При этом наблюдается два процесса:
Здесь наблюдается ионизация металла, который находится в агрессивной среде. Отрыв ионов идет под воздействием электрического потенциала. Чем он выше, тем быстрее протекает коррозионный процесс. Возникающая ржавчина является восстановленной коррозионной средой. При этом наблюдается два процесса:
- Анодный. Ионы металла переходят в раствор.
- Катодный. Высвободившиеся при формировании ионов электроны деполяризуются. Вещество, способствующее их отводу, называется деполяризатором.
Чаще всего бывает водородная или кислородная деполяризация. Водородный процесс выражается следующими уравнениями:
- 2H+ + 2e– = h3;
- 2h4O+ + 2e– = h3 + 2h3O.
Аналогично кислородная деполяризация имеет уравнения:
- O2 + 4H+ +4e– = h3O;
- O2 + 2h3O + 4e– = 4OH–.
При этом металлы, участвующие в электрохимической коррозии, разделяются на несколько групп:
- Активные.
 Процесс коррозии с ними возможен даже в нейтральных средах.
Процесс коррозии с ними возможен даже в нейтральных средах. - Средней активности. Для них требуется присутствие кислой среды.
- Малоактивные. Обладают устойчивостью к коррозионным процессам.
- Благородные. Для воздействия на них требуется наличие очень сильных окислителей.
Протекание коррозийного процесса ведет к разрушению металла. Учитывая, что это явление начинается в верхних слоях материала, для его устранения на поверхность наносится специальное покрытие. При этом следует помнить, что полностью коррозию исключить невозможно. Однако есть вероятность замедлить ее возникновение.
Воздействие коррозии металла на детали трубопровода
18 мая 2021, 15:30
Коррозия металлов
Коррозия металлов — это самопроизвольное нежелательное разрушение сплавов вследствие их химического или электрохимического взаимодействия с окружающей средой. Негативные последствия может выражаться различными дефектами, например: трещины, утолщение стенок, изменение химического состава сплава, возникновение каверн (полостей), точечное образование ям и язв (питтинговая коррозия) и др. Коррозия может привести к возникновению аварийных ситуаций, например, способствовать разгерметизации трубопровода. Какие существуют виды коррозии? Как защитить трубопровод от разрушения?
Негативные последствия может выражаться различными дефектами, например: трещины, утолщение стенок, изменение химического состава сплава, возникновение каверн (полостей), точечное образование ям и язв (питтинговая коррозия) и др. Коррозия может привести к возникновению аварийных ситуаций, например, способствовать разгерметизации трубопровода. Какие существуют виды коррозии? Как защитить трубопровод от разрушения?
Классификация коррозионных процессов:
Снижается работоспособность конструкции. Существует широкое разнообразие коррозионных процессов. Важно отметить, что каждая из разновидностей имеет свои особенности протекания процесса. Происходящее окисление металла напрямую воздействуют на используемую конструкцию. Скорость коррозии зависит от концентрации реагентов и может возникать по химическому и электрохимическому механизму. Наиболее распространенный механизм коррозии – электрохимический. Коррозионной средой может служить как жидкость, так и газ.
Какая коррозия может возникнуть в газовых средах:
-
образование окисной пленке на металле в сухом воздухе
-
коррозия металла в газовых средах при высоких температурах (выше 200 °С), включая среды, содержащие водяной газ
-
образование окалины на трубчатых электронагревателях (ТЭНы)
Какая коррозия встречается в жидких средах:
-
коррозия металлов в неэлектролитах
-
коррозия внутренней поверхности нефтепроводов при контакте с нефтепродуктами
-
коррозия стали под действием жидкого брома
-
коррозия элементов теплообменников при контакте с жидкометаллическими теплоносителями
Иногда, атмосферную коррозию выделяют в отдельный вид. Атмосферная коррозия металлоконструкций и трубопроводов возникает во влажном климате и влажных грунтах. Например, такая ситуация может возникнуть при подземной, полуподземной или наземной (в насыпи) схемах прокладки трубопровода. Болотистые, вечномерзлые и скальные грунты, районы горных выработок, оползней и прочих неустойчивых грунтах. Однако, при установке трубопроводов на опорах (надземный способ) вырастает значительная подверженность трубопровода суточным и сезонным колебаниям температуры.
Атмосферная коррозия металлоконструкций и трубопроводов возникает во влажном климате и влажных грунтах. Например, такая ситуация может возникнуть при подземной, полуподземной или наземной (в насыпи) схемах прокладки трубопровода. Болотистые, вечномерзлые и скальные грунты, районы горных выработок, оползней и прочих неустойчивых грунтах. Однако, при установке трубопроводов на опорах (надземный способ) вырастает значительная подверженность трубопровода суточным и сезонным колебаниям температуры.
Виды атмосферной коррозии:
-
подземная или почвенная коррозия на влажных грунтах. Дополнительная агрессивность почвы зависит от ее пористости и кислотности.
-
при взаимодействии с природными водными средами. Они содержат растворенные соли, продукты жизнедеятельности живых организмов, растворенные газы и т.д.
-
коррозия по ватерлинии – линия соприкосновения поверхности с водой.

Дополнительными факторами, влияющими на возникновение коррозии может быть механическое воздействие, не рациональное конструирование, наличие внешней поляризации – такой вид разрушения принято называть контактной коррозией. Вид коррозионного поражения, главным образом, зависит от свойств сплава и особенностей коррозионной среды.
Меры защиты металла от коррозии
Коррозия наблюдается во всех областях народного хозяйства и имеет множество разновидностей. Коррозия – сложное явление, которое протекает за счет множества сопряженных процессов и возникает из-за особенностей сплава и условий его эксплуатации. Компания «ОНИКС» предлагает произвести оцинкование деталей трубопровода, чтобы защитить конструкцию от вредоносного воздействия.
Помимо выбора коррозионностойких сплавов, вы можете нанести защитное покрытие. В «ОНИКС» вы можете заказать два вида защитных покрытий: гальваническим или термодиффузионным методом воздействия на металл.
В «ОНИКС» вы можете заказать два вида защитных покрытий: гальваническим или термодиффузионным методом воздействия на металл.
Таблица – Методы оцинкования для деталей трубопровода
| Гальванический метод | Термодиффузионный метод | |
|---|---|---|
| Преимущества | Внешний вид (блестящая, гладкая поверхность) | Высокие защитные свойства |
| Толщина покрытия от 4 мкм до 20 мкм | Проникновение в структуру металла, что влияет на долговечность использования | |
| Равномерное покрытие | Ровное и однородное покрытие | |
| Возможность приваривать без зачистки поверхности | ||
| Большой срок годности | ||
| Недостатки | Хрупкость покрытия | Грязно-серый цвет поверхности |
| Срок годности 1,5-2 года | Габариты изделий, которые могут быть подвергнуты термодиффузионному цинкованию ограничены | |
| При сварке необходимо зачищать от цинка свариваемую поверхность |
Продукция для заказа:
- Гальваническим методом: фланцы типа 01 и 11, фланцевые и эллиптические заглушки, крутоизогнутые отводы, переходы и тройники.

- Термодиффузионным методом: болты, шпильки, шайбы, гайки, крутоизогнутые отводы, переходы и тройники диаметром до 400-500 мм.
Широкое распространение защитных покрытий обусловлено высокой эффективностью их применений. Чтобы заказать нанесение защитного покрытия на детали трубопровода, отправьте заявку по почте [email protected] или свяжитесь с менеджерами отдела продаж.
— Осколкова Анастасия, контент-менеджер «ОНИКС»
ЧИТАЙТЕ ТАКЖЕ
Черная сталь 09Г2С для крайнего Севера. Химический состав и механические свойства 22.12.2022
Сравнение допусков по шероховатости для исполнений фланцев двух стандартов: ГОСТ 33259-15 и ASME B 16.5 07.12.2022
Сравнение стали 10Х17Н13М2Т и 316Ti. Механические свойства и преимущества коррозионно-стойкого сплава
02. 11.2022
11.2022
Как расшифровываются марки сталей? Классификация марок сталей 19.10.2022
Что такое коррозия? – О коррозии
by Mariano Iannuzzi
NACE/ASTM G193
Коррозия – это повреждение материала, обычно металла, в результате химической или электрохимической реакции с окружающей средой. (1)
ISO 8044
Физико-химическое взаимодействие между металлом и окружающей средой, которое приводит к изменению свойств металла и может привести к значительному нарушению функции металла, окружающей среды или технической системы , частью которых они являются. (2)
Международный союз теоретической и прикладной химии.
Коррозия представляет собой необратимую межфазную реакцию материала (металла, керамики или полимера) с окружающей средой, которая приводит к изнашиванию материала или растворению в материале компонента окружающей среды.
Часто , но не обязательно коррозия приводит к последствиям вредным использованию рассматриваемого материала. Исключительно физические или механические процессы, такие как плавление или испарение, истирание или механическое разрушение, не включаются в термин коррозия. (3)
Электрохимическая коррозия : Электрохимическая коррозия всегда связана с электродными реакциями. Типичными примерами являются коррозия металла при растворении ионов металла или при образовании оксидной пленки.
М. Фонтана
Коррозия – это ухудшение материала из-за реакции с его окружающей средой . (4)
Д.А. Jones
Коррозия является разрушительным результатом химические реакции между металлом и окружающей средой. (5)
P.R. Roberge
Коррозия представляет собой разрушительное воздействие на материал в результате реакции с окружающей средой. (6)
(6)
E. McCafferty
Коррозия представляет собой разрушительное воздействие на металл в результате его реакции с окружающей средой. (7)
L.L. Shreir
Определение трансформации : термин металлическая коррозия охватывает все взаимодействия металла или сплава (твердого или жидкого) с окружающей средой, независимо от того, является ли это преднамеренным и полезным или случайным и вредным . Это определение включает, например, преднамеренное анодное растворение цинка при катодной защите и гальванике, а также самопроизвольный постепенный износ цинкового кровельного листа в результате воздействия атмосферы.
Определение износа : коррозия определяется как нежелательное ухудшение металла или сплава , т. е. взаимодействие металла с окружающей средой, которое неблагоприятно влияет на те свойства металла, которые необходимо сохранить. Это определение также применимо к неметаллическим материалам, таким как стекло, дерево, бетон, керамика и композиты. Это определение рассматривает коррозию только как вредный процесс.
Это определение также применимо к неметаллическим материалам, таким как стекло, дерево, бетон, керамика и композиты. Это определение рассматривает коррозию только как вредный процесс.
Образование пассивных оксидных пленок на коррозионно-стойких сплавах соответствует преобразование определение коррозии, , но не с определением износа . В этих примерах скорость и степень реакции не оказывают существенного вредного воздействия на рассматриваемый металл. (8)
Р.М. Latanison
Коррозия — это разрушение материалов под воздействием окружающей среды
- NACE International/ASTM G193-12d, 2012 г., «Стандартная терминология и сокращения, относящиеся к коррозии», ASTM International, West Conshohocken, PA, 2012, DOI: 10.1520/G0193-12Д.
- ISO 8044:1999, «Коррозия металлов и сплавов. Основные термины и определения», Международная организация по стандартизации, Брюссель, 2000 г.
- К.
 Э. Heuslerl, D. Landolt и S. Trasatti, «Номенклатура электрохимической коррозии», Pure & Appl. хим. 61 (1), (1989): стр. 19-22. DOI: 10.1351/pac198961010019.
Э. Heuslerl, D. Landolt и S. Trasatti, «Номенклатура электрохимической коррозии», Pure & Appl. хим. 61 (1), (1989): стр. 19-22. DOI: 10.1351/pac198961010019. - М.Г. Фонтана, «Наука и техника коррозии», 3-е издание, Tata McGraw-Hill, ISBN: 978-0070607446, 2005.
- Д.А. Джонс, «Принципы и предотвращение коррозии», 2-е издание, Prentice Hall, ISBN: 978-0133599930, 1995.
- П. Р. Роберж, «Справочник по коррозионной инженерии», 1-е издание, McGraw-Hill, ISBN 0-07-076516-2, 1999 г. или издание Kindle.
- Э. МакКафферти, «Введение в науку о коррозии», 1-е издание, Springer, ISBN 978-1-4419-0454-6, e-ISBN 978-1-4419-0455-3, 2010 г.
- Л.Л. Шрейр, Р.А. Джарман и Г.Т. Бурштейн, «Коррозия, том 1: реакции металла и окружающей среды», 3-е издание, Butterworth-Heinemann, ISBN 0 7506 1077 8, 1994. Издание Kindle.
Рубрики: Определения, Библиотека С тегами: коррозия, определение
Профессор | Директор Curtin Corrosion Center
Chevron & Woodside Chair in Corrosion | Curtin University
Адъюнкт-профессор
Норвежский университет науки и технологий (NTNU)
CET Corrosion Fundamentals
Fundamentals of Corrosion
Коррозию можно определить как деградацию металла под воздействием окружающей среды.
Деградация подразумевает ухудшение физических свойств материала. Это может быть ослабление материала из-за потери площади поперечного сечения, это может быть разрушение металла из-за водородного охрупчивания или растрескивание полимера из-за воздействия солнечного света. Материалами могут быть металлы, полимеры (пластмассы, резины и т. д.), керамика (бетон, кирпич и т. д.) или композиты — механические смеси двух или более материалов с разными свойствами. Поскольку металлы являются наиболее используемым типом конструкционных материалов, большая часть этого веб-сайта будет посвящена коррозии металлов.
Почему металлы подвергаются коррозии
Металлы подвергаются коррозии, потому что мы используем их в средах, где они химически нестабильны. Только медь и драгоценные металлы (золото, серебро, платина и др.) встречаются в природе в металлическом состоянии. Все другие металлы, в том числе железо — наиболее часто используемый металл — перерабатываются из минералов или руд в металлы, которые по своей природе нестабильны в окружающей среде.
Эта золотая статуя в Бангкоке, Таиланд, сделана из единственного металла, термодинамически стабильного при комнатной температуре воздуха. Все другие металлы нестабильны и имеют тенденцию возвращаться к своим более стабильным минеральным формам. Некоторые металлы образуют на своей поверхности защитные керамические пленки (пассивные пленки), которые предотвращают или замедляют процесс коррозии. Женщина на снимке ниже носит серьги из анодированного титана. Толщина оксида титана на поверхности металла преломляет свет и вызывает радужные цвета на ее серьгах. Ее муж носит очки из нержавеющей стали. Пассивная пленка, образовавшаяся на его очках, имеет толщину всего около дюжины атомов, но эта пассивная пленка настолько защитна, что его очки защищены от коррозии. Мы можем предотвратить коррозию, используя металлы, образующие естественную защитную пассивную пленку, но эти сплавы обычно дороги, поэтому мы разработали другие средства борьбы с коррозией.
Электрохимические элементы
Окисление и восстановление:
Металлы — это элементы, которые имеют тенденцию терять электроны, когда они участвуют в химических реакциях, а неметаллы — это элементы, которые имеют тенденцию приобретать электроны.
Иногда эти элементы образуют ионы, заряженные элементы или группы элементов. Ионы металлов, поскольку они образуются из атомов, потерявших электроны, заряжены положительно (ядро не изменилось). Когда атом или ион теряет электроны, говорят, что он окислился.
Распространенной реакцией окисления при коррозии является окисление нейтральных атомов железа до положительно заряженных ионов железа:
Fe » Fe+2 + 2e-
Электроны, потерянные металлом, должны куда-то деваться, и обычно они оказываются на неметаллическом атом, образующий отрицательно заряженный ион неметалла. Поскольку заряд этих ионов стал меньше (больше отрицательных зарядов), говорят, что ион или атом, получивший электрон (электроны), был восстановлен.
4H+ +O2 + 4e- » 2h3O
или
2H+ +2e- » h3
Хотя возможны и другие реакции восстановления, восстановление кислорода происходит более чем в 90% всех реакций коррозии. Таким образом, количество кислорода, присутствующего в окружающей среде, и его способность поглощать электроны являются важным фактором, определяющим степень окисления или коррозии металла.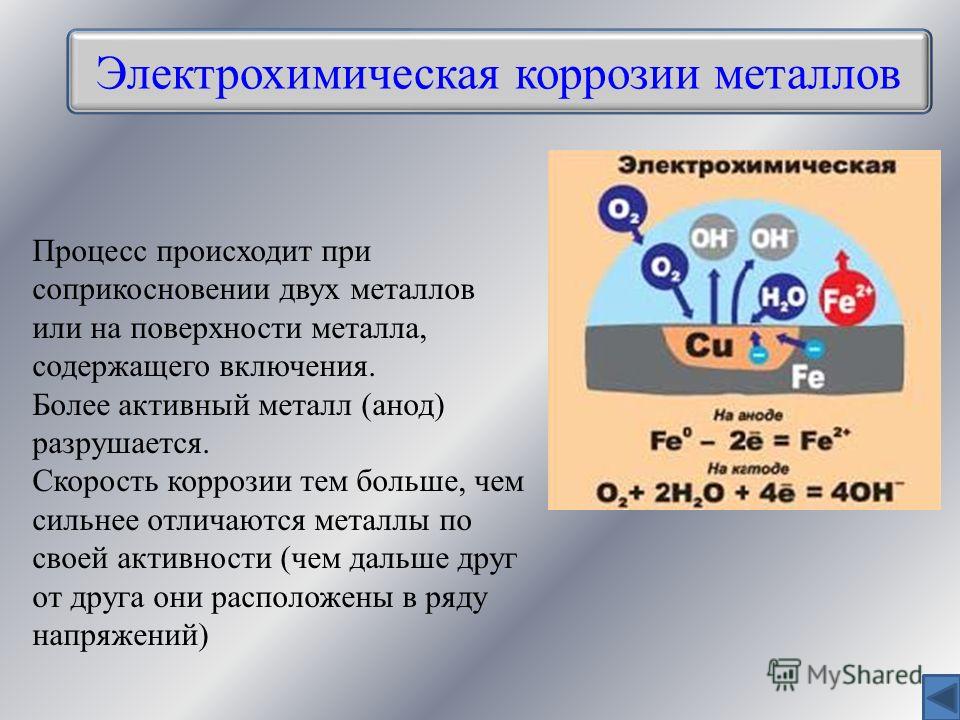
Электрохимические реакции:
Две металлические полоски, показанные ниже, подвергаются воздействию одной и той же кислоты.
Оба металла вступают в сходные реакции окисления: Cu » Cu+2 + 2e-
и
Zn » Zn+2 + 2e-
Электроны, высвобождаемые в реакциях окисления, расходуются в реакциях восстановления.
На меди реакция восстановления: 4H+ +O2 +4e- » 2h3O
Скорость коррозии меди ограничена количеством растворенного кислорода в кислоте.
Реакция восстановления цинка выглядит следующим образом: 2H+ +2e- » h3
Ионы водорода превращаются в молекулы газообразного водорода, и их действительно можно увидеть пузырящимися из кислоты.
Если теперь мы соединим два металлических образца проводом и измерим электричество через соединительный провод, мы обнаружим, что один из электродов становится другим по потенциалу, чем другой, и что скорость коррозии меди уменьшается, в то время как скорость коррозии меди цинк увеличивается. Соединив два металла, мы сделали медь катодом в электрохимической ячейке, а цинк стал анодом. Ускоренная коррозия цинка может быть настолько велика, что все окисление меди прекращается и она становится защищенной от коррозии. Мы называем этот метод борьбы с коррозией катодной защитой.
Соединив два металла, мы сделали медь катодом в электрохимической ячейке, а цинк стал анодом. Ускоренная коррозия цинка может быть настолько велика, что все окисление меди прекращается и она становится защищенной от коррозии. Мы называем этот метод борьбы с коррозией катодной защитой.
Реакция на меди (катоде) принимает вид: 2H+ +2e- » h3
Напряжение меди смещается в точку, при которой на поверхности меди может происходить восстановление ионов водорода. Окисление (коррозия) медного катода может полностью прекратиться за счет электрического соединения с цинковым анодом.
Реакция на цинке (аноде) остается прежней: Zn » Zn+2 + 2e-
Скорость реакции увеличивается из-за того, что площадь чистой (не подверженной коррозии) поверхности меди теперь может поддерживать реакцию восстановления по высокой ставке.
Таким образом, соединение этих двух металлов практически остановило коррозию меди и увеличило скорость коррозии цинка. Мы говорим, что цинк катодно защищал медь от коррозии.


