Коррозия химическая и электрохимическая: Химическая коррозия
alexxlab | 19.11.2022 | 0 | Разное
Коррозия металлов. Химическая и электрохимическая коррозия. Защита от коррозии
Химия \ Химия
Страницы работы
5 страниц (Word-файл)
Посмотреть все страницы
Скачать файл
Содержание работы
Коррозия металлов
Коррозия – это активное разрушение металлов и сплавов под влиянием окружающей среды. Самопроизвольный окислительно-восстановительный процесс. Представляет собой окисление металла при контакте с водой и под воздействием растворённого в ней кислорода (кислородная коррозия).
Наносит большой экономический ущерб (выход из строя оборудования, машин, механизмов, разрушение металлических конструкций, аппаратуры химической промышленности, контактирующей с агрессивными химическими средами).
Коррозия
Ø В зависимости от локализации:
o Сплошная = общая – затрагивает всю поверхность металла
o Местная = локальная – в отдельных участках
Ø В зависимости от механизма процесса:
o Химическая
o Электрохимическая
Химическая коррозия
Это окисление
металлов без возникновения гальванической пары (например, в аппаратах
химической промышленности или в цилиндрах двигателей внутреннего сгорания). Электрический
ток в системе не возникает. Металлы взаимодействуют с составными частями среды
– газами, растворами неэлектролитов.
Электрический
ток в системе не возникает. Металлы взаимодействуют с составными частями среды
– газами, растворами неэлектролитов.
Газовая коррозия – окисление металлов компонентами газовой среды. Наиболее опасны О2, пары Н2О, СО2, SO2. Скорость окисления значительно возрастает при высоких температурах (выше 600оС).
Коррозионное разрушение железа и его сплавов в атмосфере кислорода
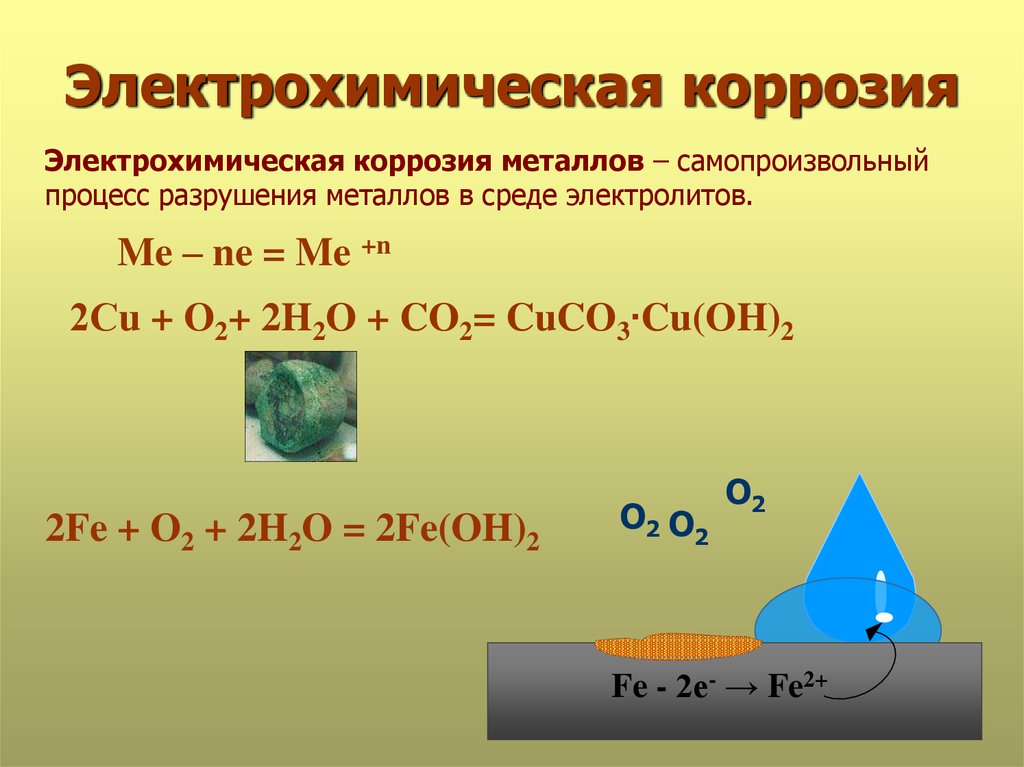
На поверхности железа появляется слой окалины Fe3O4 – смесь оксидов железа (2) и железа (3).
2Fe + O2 = 2FeO
Fe –2e– = Fe2+ | 2
O2 + 4e– = 2O-2 | 1
4Fe + 3O2 = 2Fe2O3
Fe – 3e– = Fe3+ | 4
O2 + 4e- = 2O-2 | 3
Рыхлая плёнка
оксидов не защищает железо от дальнейшего разрушения. Поэтому при длительной
работе аппарата в условиях высоких температур и в присутствии кислорода железо
полностью окисляется, и аппарат разрушается.
Поэтому при длительной
работе аппарата в условиях высоких температур и в присутствии кислорода железо
полностью окисляется, и аппарат разрушается.
Коррозия в среде неэлектролитов (в двигателях внутреннего сгорания и в реактивных двигателях). Примеси серы и её соединений, содержащиеся в топливе, окисляются до оксида серы (4) и оксида серы (6). Эти вещества вызывают разрушение металла.
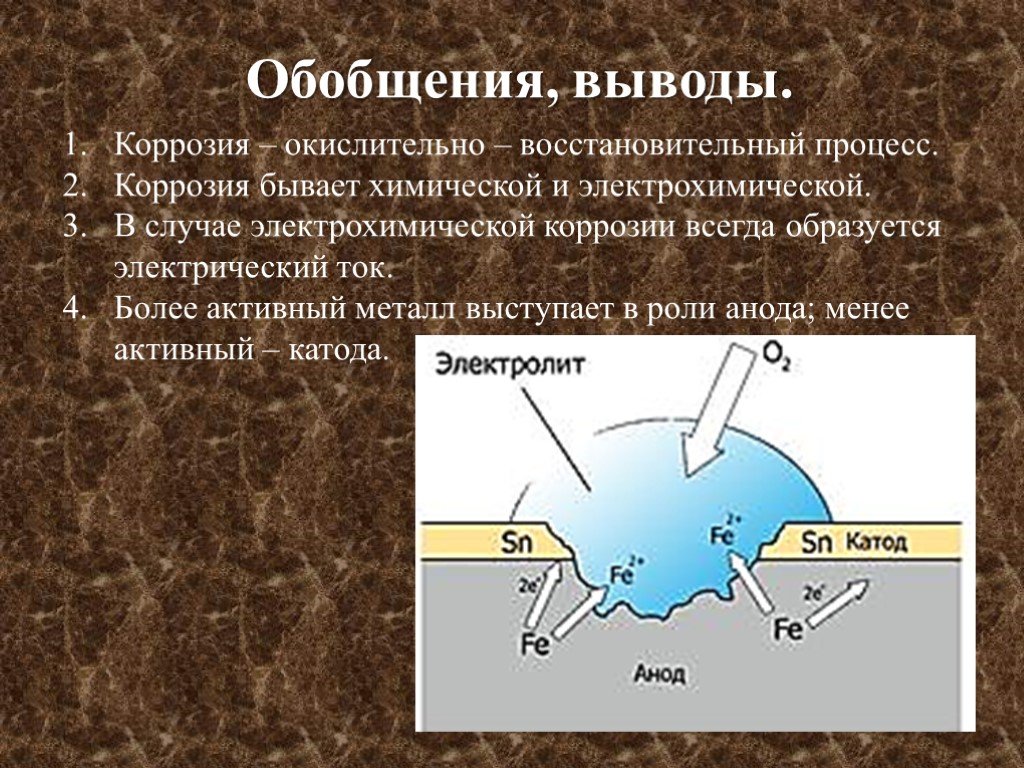
Электрохимическая коррозия
Это разрушение металла при контакте с раствором электролита с возникновением гальванической пары. Происходит не только окисление металла, но и возникновение электрического тока в системе «металл – окружающая среда». Наносит наибольший вред (разрушение металла).
Разновидности электрохимической коррозии:
Ø Атмосферная – протекает на поверхности металла под
действием сконденсированной влаги. Эта влага растворяет примеси из воздуха
(оксиды азота, диоксид серы, хлороводород и др.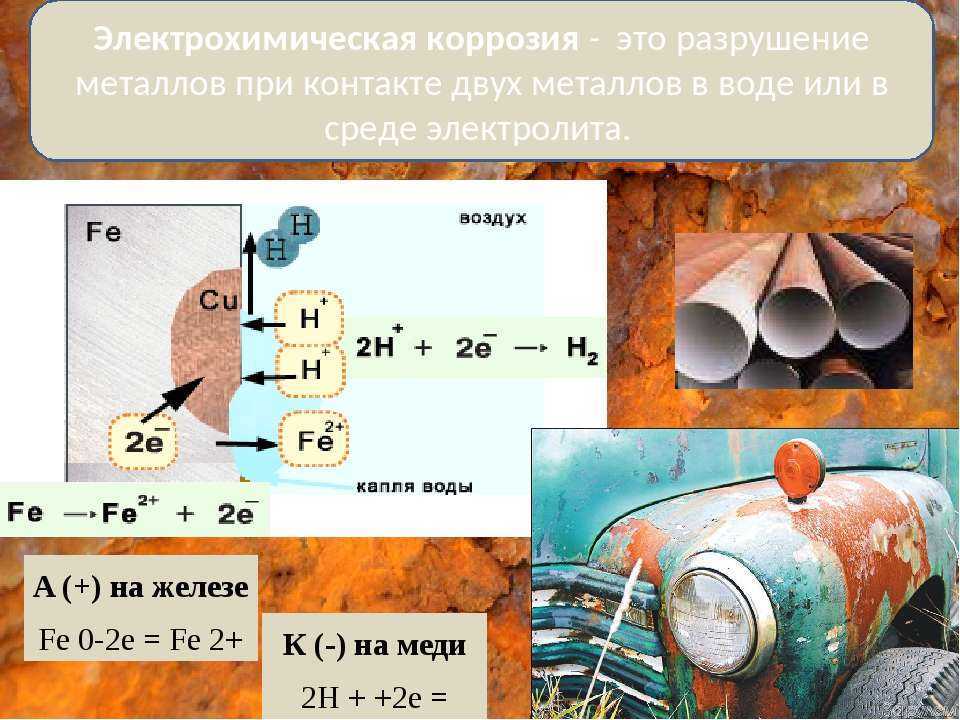 ), которые ускоряют коррозию.
), которые ускоряют коррозию.
Ø Почвенная – протекает при контакте металлов с грунтовыми водами (трубопроводы, кабели, рельсы)
Ø Морская – протекает при контакте металлов с морской водой (обшивка судов, оборудование, применяемое в портах)
Электрохимическую коррозию вызывают:
v Примеси других металлов и неметаллов. Чем дальше друг от друга в ряду напряжений расположены металлы, образующие гальваническую пару, тем выше скорость коррозии.
v Неоднородность поверхности металла, на которой образуется микрогальванический элемент (электролитом является влага).
При электрохимической коррозии на металле протекают одновременно 2 процесса:
Ø Анодный – окисление металла М, который в результате растворяется:
М – ze– = Mz+
Ø Катодный – восстановление окислителей – компонентов среды Ох:
Ох + ze– = Red
В качестве
окислителя в водных растворах в кислой среде выступают Н+ (а)
или растворенный в воде кислород воздуха (б).
а) 2Н+ + 2е- = Н2
б) О2 + 2Н2О + 4е– = 4ОН–
Металлы, имеющие положительный стандартный электродный потенциал, подвергаются коррозии только с участием О2 в средах любой кислотности. Например, коррозия меди:
Cu – 2e– = Cu2+ | 2
О2 + 2Н2О + 4е– = 4ОН– | 1
2Cu + O2 + 2H2O = 2Cu(OH)2
Контактная коррозия происходит в месте контакта 2 разнородных металлов, помещённых в раствор.
Между двумя
разнородными металлами в месте контакта возникает гальваническая пара. Поток
электронов идёт от более активного металла, стоящего левее в ряду напряжений, к
менее активному металлу, и более активный металл разрушается
(корродирует). Менее активный металл является проводником.
Ø Химический процесс – окисление более активного металла (Me – ze– = Mez+)
Ø Электрический процесс – перенос электронов от одного участка к другому: от более активного металла – анода (донора электронов) к менее активному – катоду (акцептору электронов). (При электролизе – наоборот!)
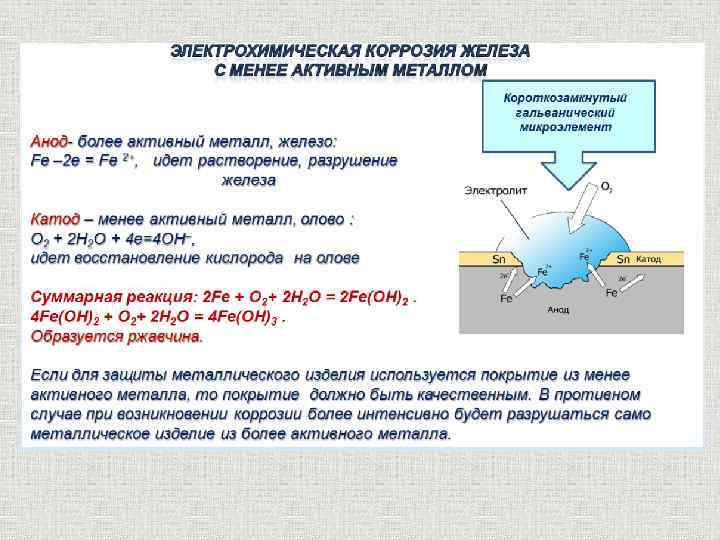
Если железо, из которого изготовлена деталь, содержит примесь менее активного металла (например, меди), то ионы железа, выходя в раствор, передают электроны менее активной меди. В дальнейшем возможны 2 пути развития процесса.
1) При коррозии железных изделий в нейтральной или щелочной среде железо (анод) окисляется до Fe2+:
Fe0 – 2e– = Fe2+
Кислород,
растворённый в электролите, при этом восстанавливается на меди до ионов ОН
О20 + 2Н2О + 4е– = 4ОН– (рН > 7)
Далее в
растворе между ними протекают химические реакции, приводящие к образованию
твёрдых рыхлых гидроксидов и оксидов железа (ржавчина), и железо рассыпается в
порошок.
Fe2+ + 2OH– = Fe(OH)2 (2Fe + O2 + 2H2O = 2Fe(OH)2)
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 (2Fe2O3 . 6H2O)
Постепенно образуется ржавчина, имеющая переменный состав: Fe2O3 . nH2O
2) Аналогично протекает коррозия железа в кислотной среде, например, в воде, содержащей растворённые газы СО 2 и SO2 (водородная коррозия):
Fe0 – 2e– = Fe2+; ионы выходят в раствор, электроны перемещаются к менее активному металлу
2H+ + 2e– = H20 (pH < 7) – разряжаются на менее активном металле (водородная деполяризация катода)
Похожие материалы
Информация о работе
Скачать файл
КОРРОЗИЯ МЕТАЛЛОВ.
 Химическая и электрохимическая коррозия. Анодный и катодный процессы при электрохимической коррозии. Электрохимическая коррозия с водородной и кислородной
Химическая и электрохимическая коррозия. Анодный и катодный процессы при электрохимической коррозии. Электрохимическая коррозия с водородной и кислороднойПоделись
Химическая и электрохимическая коррозия. Анодный и катодный процессы при электрохимической коррозии. Электрохимическая коррозия с водородной и кислородной деполяризацией. Коррозия при контакте разнородных металлов. Основные способы защиты металлических конструкций от коррозии. Металлические покрытия анодные и катодные. Электрохимические способы защиты – протекторная, катодная защита.
|
Основные понятия
При коррозии металл (восстановитель) окисляется под действием окислителя, являющегося компонентом среды, т.е. коррозия – окислительно-восстановительный процесс.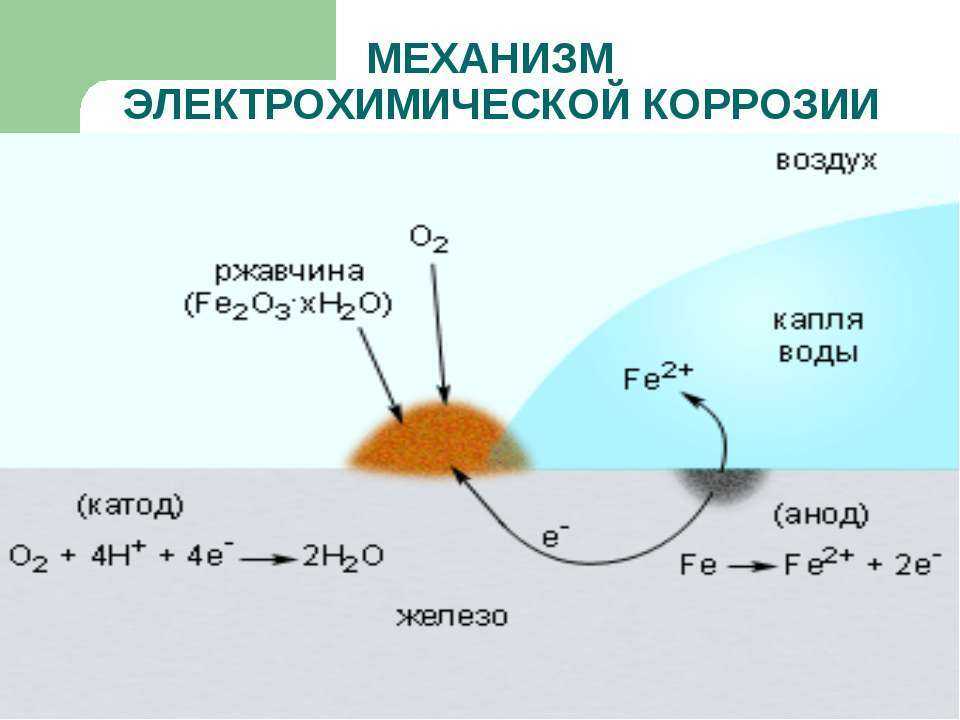
По механизму протекания коррозионного процесса выделяют химическую и электрохимическую коррозию.
Химическая коррозия проходит в среде неэлектролита путем непосредственного перехода электронов от атомов металла к окислителю. Наиболее распространенные виды химической коррозии – газовая коррозия и коррозия в среде неэлектролита (бензина, нефти, органических растворителей).
Газовая коррозия наблюдается в агрессивных газах (хлоре, кислороде, оксидах серы, азота) и парах без конденсации влаги на поверхности металла, обычно при высоких температурах. Этому виду коррозии подвергается режущий инструмент, лопатки газовых турбин, детали реактивных двигателей.
Пример коррозии в среде неэлектролита – коррозия в жидком топливе (разрушение деталей двигателей внутреннего сгорания и т.д.).
Электрохимическая коррозия проходит в среде электролита, ее отличие – разделение в пространстве процессов окисления и восстановления. Этот тип коррозии более распространен, ей подвергаются металлические конструкции в почвенных, речных и морских водах, в растворах солей, кислот, щелочей, в атмосфере под адсорбированными пленками влаги и т. д. Электрохимическая коррозия осуществляется при наличии разности потенциалов участков металлической поверхности.
д. Электрохимическая коррозия осуществляется при наличии разности потенциалов участков металлической поверхности.
Основные причины электрохимической коррозии (возникновения разности потенциалов)
v контакт разнородных металлов,
v микронапряжения в металлическом изделии,
v неоднородность механической или термической обработки металлической поверхности,
v наличие неметаллических включений и загрязнений (графита, карбидов, пятен краски на поверхности и т.д.),
v разность температур участков металлической поверхности.
Способность металла сопротивляться коррозионному воздействию среды называют коррозионной стойкостью. Коррозионную стойкость определяют качественно и количественно – скоростью коррозии в данных условиях, группой или баллом стойкости по принятой шкале. Металлы, обладающие высокой коррозионной стойкостью, называют коррозионно стойкими.
Типы коррозии в самолетах
Существуют две общие классификации коррозии, которые охватывают большинство конкретных форм: прямое химическое воздействие и электрохимическое воздействие.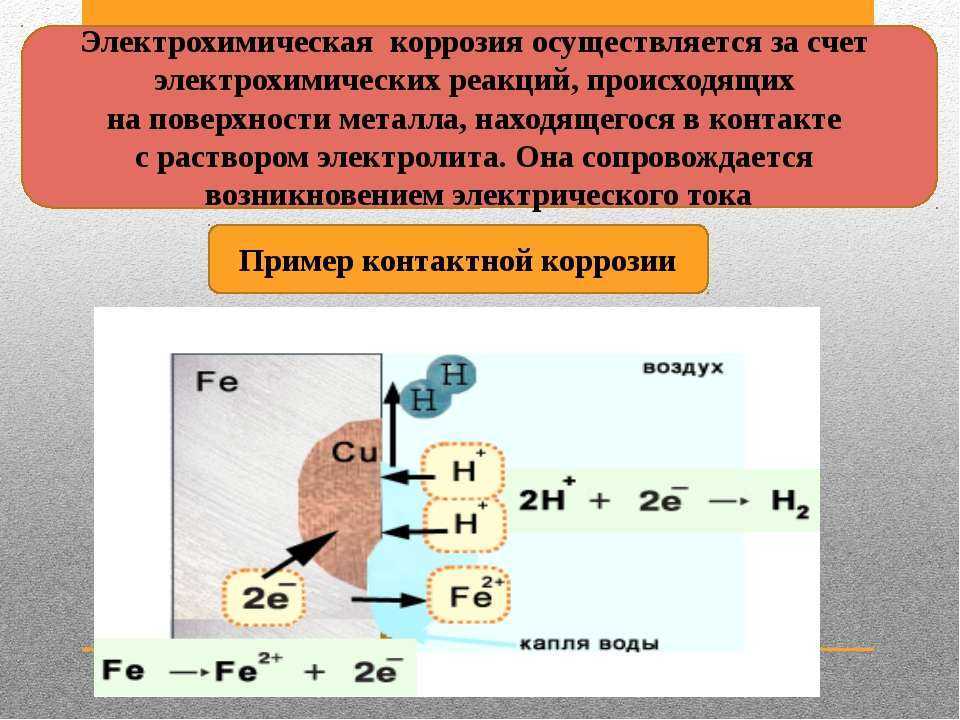 При обоих типах коррозии металл превращается в металлическое соединение, такое как оксид, гидроксид или сульфат. Процесс коррозии включает в себя два одновременных изменения: металл, подвергшийся воздействию или окислению, подвергается так называемому анодному изменению, а коррозионное вещество восстанавливается и считается претерпевающим катодное изменение.
При обоих типах коррозии металл превращается в металлическое соединение, такое как оксид, гидроксид или сульфат. Процесс коррозии включает в себя два одновременных изменения: металл, подвергшийся воздействию или окислению, подвергается так называемому анодному изменению, а коррозионное вещество восстанавливается и считается претерпевающим катодное изменение.
Прямая химическая атака
Прямая химическая атака или чисто химическая коррозия – это атака, возникающая в результате прямого воздействия на незащищенную поверхность едких жидких или газообразных веществ. В отличие от электрохимического воздействия, при котором анодные и катодные изменения происходят на измеримом расстоянии друг от друга, изменения при прямом химическом воздействии происходят одновременно в одной и той же точке. Наиболее распространенными агентами, вызывающими прямое химическое поражение самолетов, являются: пролитая аккумуляторная кислота или пары аккумуляторов; остаточные отложения флюса в результате недостаточно очищенных, сварных, паяных или паяных соединений; и захваченные едкие чистящие растворы. [Рисунок 1]
[Рисунок 1]
| Рисунок 1. Прямая химическая атака в аккумуляторном отсеке меньше проблем. Использование этих закрытых блоков снижает опасность разлива кислоты и паров батареи. Многие типы флюсов, используемых при пайке твердым припоем и сварке, вызывают коррозию, химически разрушая металлы или сплавы, с которыми они используются. Поэтому важно удалять остатки флюса с поверхности металла сразу после операции соединения. Остатки флюса гигроскопичны по своей природе, поглощают влагу и, если их тщательно не удалить, имеют тенденцию вызывать сильную точечную коррозию. Очищающие растворы щелочи в концентрированной форме хранят плотно закрытыми и как можно дальше от самолетов. Некоторые чистящие растворы, используемые для удаления коррозии, сами по себе являются потенциально коррозионными агентами. Поэтому особое внимание должно быть направлено на их полное удаление после использования на летательных аппаратах. Электрохимическая атакаКоррозия – это естественное явление, при котором металл подвергается химическому или электрохимическому воздействию, превращая его обратно в металлическое соединение. Следующие четыре условия должны выполняться до возникновения электрохимической коррозии. [Рисунок 2]
Устранение любого из этих условий останавливает электрохимическую коррозию. ПРИМЕЧАНИЕ. Краска может маскировать начальные стадии коррозии. Поскольку продукты коррозии занимают больший объем, чем исходный металл, окрашенные поверхности необходимо часто осматривать на наличие неровностей, таких как вздутия, чешуйки, сколы и комки.
Электрохимическую атаку химически можно сравнить с электролитической реакцией, которая происходит при гальванике, анодировании или в сухих батареях. Для реакции при этой коррозионной атаке требуется среда, обычно вода, способная проводить слабый электрический ток. Когда металл вступает в контакт с коррозионным агентом, а также связан жидким или газообразным путем, по которому проходят электроны, начинается коррозия, поскольку металл распадается в результате окисления. [Рисунок 2] Во время атаки количество коррозионного агента уменьшается и, если его не обновить или удалить, может полностью вступить в реакцию с нейтрализацией металла. Различные области одной и той же металлической поверхности имеют разные уровни электрического потенциала и, если они соединены проводником, таким как соленая вода, создают ряд коррозионных ячеек, и начинается коррозия. Все металлы и сплавы электрически активны и имеют определенный электрический потенциал в данной химической среде. Этот потенциал обычно называют «благородством» металла. [Рисунок 3] Чем менее благороден металл, тем легче он подвергается коррозии. Металлы, выбранные для использования в конструкциях самолетов, представляют собой продуманный компромисс прочности, веса, коррозионной стойкости, технологичности и стоимости, сбалансированный с потребностями конструкции.
Составляющие сплава также имеют определенные электрические потенциалы, которые обычно отличаются друг от друга. Воздействие на поверхность сплава проводящей коррозионной среды приводит к тому, что более активный металл становится анодным, а менее активный — катодным, что создает условия для коррозии. Они называются локальными ячейками. Условиями для этих коррозионных реакций являются наличие проводящей жидкости и металлов, имеющих разность потенциалов. Если путем регулярной очистки и повторной отделки поверхности удалить среду и устранить мельчайшую электрическую цепь, коррозия не может возникнуть. Это основа эффективной борьбы с коррозией. Электрохимическая атака является причиной большинства форм коррозии конструкции и компонентов самолета. СВЯЗАННЫЕ ПОСТЫ В чем разница между химической и электрохимической коррозией?Копия Химическая реакция: – В химической реакции электроны передаются от одного вида к другому непосредственно в той же среде. Электрохимические реакции: – В этих реакциях электроны переносятся от одного вида к другому опосредованно через электроды, помещенные в ту же или другую среду. Какая_есть_разница_между_химической_реакцией_и_электрохимической_реакцией Этот ответ: Учебные пособия Заработок + 20 баллы В: В чем разница между химической и электрохимической коррозией? Напишите свой ответ… Отправить Остались вопросы? Продолжить изучение химии Что такое электрохимическая коррозия?Электрохимическая коррозия включает поток электронов между анодной и катодной зонами. В чем разница между коррозией и ржавчиной? Коррозия – это химическая или электрохимическая реакция между
материал и его окружение. Материал, как правило, металл.
реакции приводят к порче материала.
Ржавчина – это оксид, который образуется при окислении железа на открытом воздухе. В чем разница между горением и коррозией?i вещь ХИМИЧЕСКАЯ РЕАКЦИЯ, ПРОИСХОДЯЩАЯ ПРИ ВЗАИМОДЕЙСТВИИ КИСЛОРОДА с вещество для образования нового вещества и выделения энергии коррозии медленное химическое превращение, которое происходит, когда кислород в воздухе реагирует с металл В чем разница между химической и электрохимической коррозией? Химическая коррозияЭлектрохимическая коррозияКоррозия – это распад инженерного материала на составляющие его атомы вследствие химических реакций с окружающей средой. В наиболее распространенном использовании этого слова это означает электрохимическое окисление металлов в реакции с окислителем, таким как кислород. Коррозия в водной среде и в атмосферной среде (которая также включает тонкие водные слои) является электрохимическим процессом, поскольку коррозия включает в себя перенос электронов между металлической поверхностью и водным раствором электролита. |


 Там, где вероятно улавливание чистящего раствора, используйте неагрессивное чистящее средство, даже если оно менее эффективно.
Там, где вероятно улавливание чистящего раствора, используйте неагрессивное чистящее средство, даже если оно менее эффективно.

 Чем больше разница в электрическом потенциале между двумя металлами, тем серьезнее коррозионная атака, если создать надлежащие условия.
Чем больше разница в электрическом потенциале между двумя металлами, тем серьезнее коррозионная атака, если создать надлежащие условия.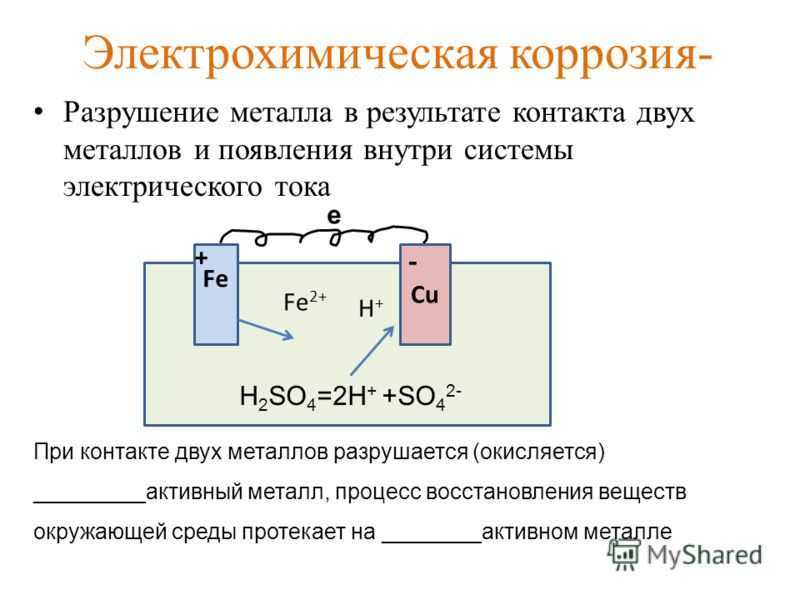
 Ржавление вызывается действием кислорода и влаги, а не
химические вещества.
Ржавление вызывается действием кислорода и влаги, а не
химические вещества. Другими словами, коррозия — это износ металлов в результате химической реакции. Многие конструкционные сплавы подвергаются коррозии просто от воздействия влаги в воздухе, но воздействие может сильно повлиять на этот процесс. к некоторым веществам (см. ниже). Коррозия может быть сосредоточена локально, образуя ямку или трещину, или она может распространяться на большую площадь, более или менее равномерно разъедая поверхность. Поскольку коррозия является процессом, контролируемым диффузией, она возникает на открытых поверхностях. В результате методы снижения активности открытой поверхности, такие как пассивация и хроматирование, могут повысить коррозионную стойкость материала. Однако некоторые механизмы коррозии менее заметны и менее предсказуемы. Электрохимическая коррозия, протекающая в таких условиях, является крупным разрушительным процессом, приводящим к таким дорогостоящим, неприглядным и разрушительным последствиям, как образование ржавчины и других продуктов коррозии, образование зияющих отверстий.
Другими словами, коррозия — это износ металлов в результате химической реакции. Многие конструкционные сплавы подвергаются коррозии просто от воздействия влаги в воздухе, но воздействие может сильно повлиять на этот процесс. к некоторым веществам (см. ниже). Коррозия может быть сосредоточена локально, образуя ямку или трещину, или она может распространяться на большую площадь, более или менее равномерно разъедая поверхность. Поскольку коррозия является процессом, контролируемым диффузией, она возникает на открытых поверхностях. В результате методы снижения активности открытой поверхности, такие как пассивация и хроматирование, могут повысить коррозионную стойкость материала. Однако некоторые механизмы коррозии менее заметны и менее предсказуемы. Электрохимическая коррозия, протекающая в таких условиях, является крупным разрушительным процессом, приводящим к таким дорогостоящим, неприглядным и разрушительным последствиям, как образование ржавчины и других продуктов коррозии, образование зияющих отверстий.