Коррозия металла что это: Коррозия металлов — урок. Химия, 9 класс.
alexxlab | 10.05.2023 | 0 | Разное
КОРРОЗИЯ МЕТАЛЛОВ | это… Что такое КОРРОЗИЯ МЕТАЛЛОВ?
ТолкованиеПеревод
- КОРРОЗИЯ МЕТАЛЛОВ
самопроизвольное физико-химическое разрушение и превращение полезного металла в бесполезные химические соединения. Большинство компонентов окружающей среды, будь то жидкости или газы, способствуют коррозии металлов; постоянные природные воздействия вызывают ржавление стальных конструкций, порчу корпусов автомобилей, образование питтингов (ямок травления) на хромированных покрытиях и т.д. В этих примерах поверхность металла видимым образом разрушается, но понятие коррозии включает случаи внутреннего разрушительного воздействия, например на границе между кристаллами металла. Эта так называемая структурная (межкристаллитная) коррозия протекает внешне незаметно, но может приводить к авариям и даже несчастным случаям. Зачастую неожиданные повреждения металлических деталей связаны с напряжениями, в частности, связанными с коррозионной усталостью металла.
Электрохимическая природа коррозии. М. Фарадеем (1830-1840) была установлена связь между химическими реакциями и электрическим током, что явилось основой электрохимической теории коррозии. Однако детальное понимание коррозионных процессов пришло только в начале 20 в. Электрохимия как наука возникла в 18 в. благодаря изобретению А.Вольта (1799) первого гальванического элемента (вольтов столб), с помощью которого был получен непрерывный ток за счет преобразования химической энергии в электрическую. Гальванический элемент состоит из одной электрохимической ячейки, в которой два различных металла (электроды) частично погружены в водный раствор (электролит), способный проводить электричество. Электроды вне электролита соединяются электрическим проводником (металлической проволочкой). Один электрод (“анод”) растворяется (корродирует) в электролите, образуя ионы металла, которые переходят в раствор, в то время как ионы водорода накапливаются на другом электроде (“катоде”). Поток положительных ионов в электролите компенсируется посредством прохождения тока электронов (электрического тока) от анода к катоду во внешней цепи.
Гальванический элемент состоит из одной электрохимической ячейки, в которой два различных металла (электроды) частично погружены в водный раствор (электролит), способный проводить электричество. Электроды вне электролита соединяются электрическим проводником (металлической проволочкой). Один электрод (“анод”) растворяется (корродирует) в электролите, образуя ионы металла, которые переходят в раствор, в то время как ионы водорода накапливаются на другом электроде (“катоде”). Поток положительных ионов в электролите компенсируется посредством прохождения тока электронов (электрического тока) от анода к катоду во внешней цепи.СХЕМА ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА иллюстрирует принцип естественного процесса коррозии металла.
Ионы металла, переходя в раствор, реагируют с компонентами раствора, давая продукты коррозии. Эти продукты зачастую растворимы и не препятствуют дальнейшей коррозии металлического анода. Так, если две смежные области, например на поверхности стали, хотя бы слабо отличаются друг от друга по составу или структуре, то в подходящей (например, влажной) среде на этом месте образуется коррозионная ячейка. Одна область является анодом по отношению к другой, и именно она будет корродировать. Таким образом, все малые локальные неоднородности металла образуют анодно-катодные микроячейки, по этой причине металлическая поверхность содержит многочисленные участки, потенциально подверженные коррозии. Если сталь опустить в обычную воду или почти любую водосодержащую жидкость, то уже готов подходящий электролит. Даже в умеренно влажной атмосфере на поверхности металла будет оседать конденсат влаги, приводящий к возникновению электрохимической ячейки. Как уже отмечалось, электрохимическая ячейка состоит из электродов, погруженных в электролит (т.е. из двух полуячеек). Потенциал (электродвижущая сила, ЭДС) электрохимической ячейки равен разности потенциалов электродов обеих полуячеек. Потенциалы электродов измеряются относительно водородного электрода сравнения. Измеренные электродные потенциалы металлов сведены в ряд напряжений, в котором благородные металлы (золото, платина, серебро и др.) находятся на правом конце ряда и имеют положительное значение потенциала.
Одна область является анодом по отношению к другой, и именно она будет корродировать. Таким образом, все малые локальные неоднородности металла образуют анодно-катодные микроячейки, по этой причине металлическая поверхность содержит многочисленные участки, потенциально подверженные коррозии. Если сталь опустить в обычную воду или почти любую водосодержащую жидкость, то уже готов подходящий электролит. Даже в умеренно влажной атмосфере на поверхности металла будет оседать конденсат влаги, приводящий к возникновению электрохимической ячейки. Как уже отмечалось, электрохимическая ячейка состоит из электродов, погруженных в электролит (т.е. из двух полуячеек). Потенциал (электродвижущая сила, ЭДС) электрохимической ячейки равен разности потенциалов электродов обеих полуячеек. Потенциалы электродов измеряются относительно водородного электрода сравнения. Измеренные электродные потенциалы металлов сведены в ряд напряжений, в котором благородные металлы (золото, платина, серебро и др.) находятся на правом конце ряда и имеют положительное значение потенциала. Обычные, неблагородные, металлы (магний, алюминий и т.д.) имеют сильно отрицательные потенциалы и располагаются ближе к началу ряда слева от водорода. Положение металла в ряду напряжений указывает на его устойчивость к коррозии, которая возрастает от начала ряда к его концу, т.е. слева направо.
Обычные, неблагородные, металлы (магний, алюминий и т.д.) имеют сильно отрицательные потенциалы и располагаются ближе к началу ряда слева от водорода. Положение металла в ряду напряжений указывает на его устойчивость к коррозии, которая возрастает от начала ряда к его концу, т.е. слева направо.
Поляризация. Движение положительных (водородных) ионов в электролите по направлению к катоду с последующим разрядом приводит к образованию молекулярного водорода на катоде, что изменяет потенциал данного электрода: устанавливается обратный по знаку (стационарный) потенциал, который уменьшает общее напряжение ячейки. Ток в ячейке очень быстро спадает до чрезвычайно малых величин; в этом случае говорят, что ячейка “поляризована”. Это состояние предполагает уменьшение или даже прекращение коррозии. Однако взаимодействие растворенного в электролите кислорода с водородом может свести на нет подобный эффект, поэтому кислород называют “деполяризатором”. Эффект поляризации иногда проявляется в уменьшении скорости коррозии в стоячих водах вследствие недостатка кислорода, хотя такие случаи нетипичны, поскольку эффекты конвекции в жидкой среде обычно достаточны для подвода растворенного кислорода к поверхности катода. Неравномерное распределение деполяризатора (как правило, это кислород) над поверхностью металла тоже может вызывать коррозию, поскольку при этом образуется кислородная концентрационная ячейка, в которой коррозия происходит таким же образом, как в любой электрохимической ячейке.
Эффект поляризации иногда проявляется в уменьшении скорости коррозии в стоячих водах вследствие недостатка кислорода, хотя такие случаи нетипичны, поскольку эффекты конвекции в жидкой среде обычно достаточны для подвода растворенного кислорода к поверхности катода. Неравномерное распределение деполяризатора (как правило, это кислород) над поверхностью металла тоже может вызывать коррозию, поскольку при этом образуется кислородная концентрационная ячейка, в которой коррозия происходит таким же образом, как в любой электрохимической ячейке.
Пассивность и другие анодные эффекты. Термин “пассивность” (пассивирование) был первоначально использован по отношению к коррозионной стойкости железа, погруженного в концентрированный раствор азотной кислоты. Однако это более общее явление, так как в определенных условиях многие металлы находятся в пассивном состоянии. Феномен пассивности был объяснен в 1836 Фарадеем, который показал, что ее причиной является чрезвычайно тонкая оксидная пленка, образующаяся в результате химических реакций на поверхности металла.
 Введение в электролит бихромата калия дает яркий оранжево-желтый оттенок, в то время как гексацианоферрат(II) калия, перманганат свинца и сульфид кобальта окрашивают пленки в голубой, красно-коричневый и черный цвета соответственно. Во многих случаях применяются водорастворимые органические красители, и это придает металлический глянец окрашенной поверхности. Образующийся слой необходимо закрепить, для чего достаточно обработать поверхность кипящей водой, хотя используются и кипящие растворы ацетатов никеля или кобальта.
Введение в электролит бихромата калия дает яркий оранжево-желтый оттенок, в то время как гексацианоферрат(II) калия, перманганат свинца и сульфид кобальта окрашивают пленки в голубой, красно-коричневый и черный цвета соответственно. Во многих случаях применяются водорастворимые органические красители, и это придает металлический глянец окрашенной поверхности. Образующийся слой необходимо закрепить, для чего достаточно обработать поверхность кипящей водой, хотя используются и кипящие растворы ацетатов никеля или кобальта.
Структурная (межкристаллитная) коррозия. Различные сплавы, в частности алюминиевые, увеличивают свою твердость и прочность при старении; процесс ускоряют, подвергая сплав термообработке. При этом образуются субмикроскопические частицы, которые располагаются вдоль пограничных слоев микрокристаллов (в межкристаллитном пространстве) сплава. В определенных условиях область, непосредственно примыкающая к границе, становится анодом по отношению к внутренней части кристалла, и в коррозионной среде границы между кристаллитами будут преимущественно подвержены коррозии, причем коррозионные трещины глубоко внедряются в структуру металла.
См. также МЕТАЛЛОПОКРЫТИЯ.
Предотвращение коррозии. При электрохимической коррозии образующиеся продукты часто растворяются (переходят в раствор) и не препятствуют дальнейшему разрушению металла; в некоторых случаях в раствор можно добавить химическое соединение (ингибитор), которое реагирует с первичными продуктами коррозии с образованием нерастворимых и обладающих протекторными свойствами соединений, которые осаждаются на аноде или на катоде. Например, железо легко корродирует в разбавленном растворе обычной соли (NaCl), однако при добавлении сульфата цинка в раствор образуется малорастворимый гидроксид цинка на катоде, а при добавлении фосфата натрия – нерастворимый фосфат железа на аноде (примеры катодных и анодных ингибиторов соответственно).
 Для этого к защищаемому металлу подсоединяют металл с более отрицательным потенциалом, который в образуемой гальванической паре играет роль протекторного анода и разрушается первым. Протекторные аноды из цинка применялись уже с 1825, когда знаменитый английский химик Х.Дэви предложил использовать их для защиты медной обшивки деревянных корпусов кораблей. Аноды на основе магниевых сплавов широко используются для защиты корпусов современных кораблей от коррозии в морской воде. Протекторные аноды чаще применяются по сравнению с анодами, связанными с внешними источниками тока, поскольку они не требуют энергозатрат. Окрашивание поверхности также используется для защиты от коррозии, особенно если конструкция не полностью погружена в жидкость. Металлические покрытия можно наносить путем напыления металлов или при помощи гальванотехники (например, хромирование, цинкование, никелирование).
Для этого к защищаемому металлу подсоединяют металл с более отрицательным потенциалом, который в образуемой гальванической паре играет роль протекторного анода и разрушается первым. Протекторные аноды из цинка применялись уже с 1825, когда знаменитый английский химик Х.Дэви предложил использовать их для защиты медной обшивки деревянных корпусов кораблей. Аноды на основе магниевых сплавов широко используются для защиты корпусов современных кораблей от коррозии в морской воде. Протекторные аноды чаще применяются по сравнению с анодами, связанными с внешними источниками тока, поскольку они не требуют энергозатрат. Окрашивание поверхности также используется для защиты от коррозии, особенно если конструкция не полностью погружена в жидкость. Металлические покрытия можно наносить путем напыления металлов или при помощи гальванотехники (например, хромирование, цинкование, никелирование).
Типы специфической коррозии. Коррозия в напряженном состоянии представляет собой разрушение металла под влиянием комбинированного действия статической нагрузки и коррозии. Основной механизм – первоначальное образование коррозионных питтингов и трещин с последующим разрушением конструкции, вызванным концентрациями напряжения в этих трещинах. Детали механизма коррозии сложны и не всегда понятны, они могут быть связаны с остаточными напряжениями. Чистые металлы, а также латунь не склонны к коррозии в напряженном состоянии. В случае сплавов появляются трещины в межкристаллитном пространстве, которое является анодом по отношению к внутренним участкам зерен; это увеличивает вероятность коррозионного воздействия вдоль межкристаллитных границ и облегчает последующий процесс растрескивания по ним. Коррозионная усталость также является следствием совместного действия механического напряжения и коррозии. Однако циклические нагрузки опаснее статических. Усталостное растрескивание часто наступает и в отсутствие коррозии, но разрушительный эффект коррозионных трещин, которые создают места концентрации напряжения, очевиден. Вероятно, все так называемые усталостные механизмы включают коррозию, так как невозможно полностью исключить поверхностную коррозию.
Основной механизм – первоначальное образование коррозионных питтингов и трещин с последующим разрушением конструкции, вызванным концентрациями напряжения в этих трещинах. Детали механизма коррозии сложны и не всегда понятны, они могут быть связаны с остаточными напряжениями. Чистые металлы, а также латунь не склонны к коррозии в напряженном состоянии. В случае сплавов появляются трещины в межкристаллитном пространстве, которое является анодом по отношению к внутренним участкам зерен; это увеличивает вероятность коррозионного воздействия вдоль межкристаллитных границ и облегчает последующий процесс растрескивания по ним. Коррозионная усталость также является следствием совместного действия механического напряжения и коррозии. Однако циклические нагрузки опаснее статических. Усталостное растрескивание часто наступает и в отсутствие коррозии, но разрушительный эффект коррозионных трещин, которые создают места концентрации напряжения, очевиден. Вероятно, все так называемые усталостные механизмы включают коррозию, так как невозможно полностью исключить поверхностную коррозию. Коррозия под действием жидких металлов – особая форма коррозии, которая не включает электрохимический механизм. Жидкие металлы имеют большое значение в системах охлаждения, в частности, ядерных реакторов. В качестве охладителей используются жидкие калий и натрий и их сплавы, а также жидкие свинец, висмут и свинцово-висмутовые сплавы. Большинство конструкционных металлов и сплавов при контакте с подобной жидкой средой в той или иной степени подвергаются деструкции, при этом механизм коррозии в каждом случае может быть различным. Во-первых, материал контейнера или труб в системе теплопередачи может в небольшой степени растворяться в жидком металле, а так как растворимость обычно изменяется с температурой, растворенный металл может осаждаться из раствора в охлажденной части системы, забивая при этом каналы и клапаны. Во-вторых, возможно межкристаллитное проникновение жидкого металла, если существует его селективная реакция с легирующими добавками конструкционного материала. Здесь, как и в случае электрохимической межкристаллитной коррозии, механические свойства ухудшаются без видимых проявлений и без изменения массы конструкции; правда, такие случаи разрушительного воздействия встречаются редко.
Коррозия под действием жидких металлов – особая форма коррозии, которая не включает электрохимический механизм. Жидкие металлы имеют большое значение в системах охлаждения, в частности, ядерных реакторов. В качестве охладителей используются жидкие калий и натрий и их сплавы, а также жидкие свинец, висмут и свинцово-висмутовые сплавы. Большинство конструкционных металлов и сплавов при контакте с подобной жидкой средой в той или иной степени подвергаются деструкции, при этом механизм коррозии в каждом случае может быть различным. Во-первых, материал контейнера или труб в системе теплопередачи может в небольшой степени растворяться в жидком металле, а так как растворимость обычно изменяется с температурой, растворенный металл может осаждаться из раствора в охлажденной части системы, забивая при этом каналы и клапаны. Во-вторых, возможно межкристаллитное проникновение жидкого металла, если существует его селективная реакция с легирующими добавками конструкционного материала. Здесь, как и в случае электрохимической межкристаллитной коррозии, механические свойства ухудшаются без видимых проявлений и без изменения массы конструкции; правда, такие случаи разрушительного воздействия встречаются редко. В-третьих, жидкий и твердый металлы могут взаимодействовать с образованием поверхностного сплава, который в некоторых случаях служит диффузионным барьером по отношению к дальнейшему воздействию. Эрозионная коррозия (ударная, кавитационная коррозия) относится к механическому воздействию жидкого металла, текущего в турбулентном режиме. В экстремальных случаях это приводит к кавитации и эрозионному разрушению конструкции.
В-третьих, жидкий и твердый металлы могут взаимодействовать с образованием поверхностного сплава, который в некоторых случаях служит диффузионным барьером по отношению к дальнейшему воздействию. Эрозионная коррозия (ударная, кавитационная коррозия) относится к механическому воздействию жидкого металла, текущего в турбулентном режиме. В экстремальных случаях это приводит к кавитации и эрозионному разрушению конструкции.
См. также КАВИТАЦИЯ. Коррозионные эффекты радиации интенсивно исследуются в связи с развитием атомной энергетики, однако в открытой печати мало информации по этому вопросу. Общеупотребительный термин “радиационное повреждение” относится ко всем изменениям механической, физической или химической природы твердых материалов, которые обусловлены воздействием радиации следующих типов: ионизирующее излучение (рентгеновское или g), легкие заряженные частицы (электроны), тяжелые заряженные частицы (a-частицы) и тяжелые незаряженные частицы (нейтроны). Известно, что бомбардировка металла тяжелыми частицами высоких энергий приводит к возникновению нарушений на атомном уровне, которые при соответствующих обстоятельствах могут быть местами возникновения электрохимических реакций. Однако более важное изменение происходит не в самом металле, а в его окружении. Такие непрямые эффекты возникают в результате действия ионизирующего излучения (например, g-лучей), которое не изменяет свойства металла, но в водных растворах вызывает образование высокореакционных свободных радикалов и пероксида водорода, а подобные соединения способствуют возрастанию скорости коррозии. Кроме того, такой ингибитор коррозии, как дихромат натрия, будет восстанавливаться и терять свою эффективность. Под действием ионизирующего излучения оксидные пленки также ионизируются и теряют свои коррозионнозащитные свойства. Все вышеперечисленные особенности сильно зависят от конкретных условий, связанных с коррозией.
Однако более важное изменение происходит не в самом металле, а в его окружении. Такие непрямые эффекты возникают в результате действия ионизирующего излучения (например, g-лучей), которое не изменяет свойства металла, но в водных растворах вызывает образование высокореакционных свободных радикалов и пероксида водорода, а подобные соединения способствуют возрастанию скорости коррозии. Кроме того, такой ингибитор коррозии, как дихромат натрия, будет восстанавливаться и терять свою эффективность. Под действием ионизирующего излучения оксидные пленки также ионизируются и теряют свои коррозионнозащитные свойства. Все вышеперечисленные особенности сильно зависят от конкретных условий, связанных с коррозией.
Окисление металлов. Большинство металлов взаимодействует с кислородом воздуха с образованием стабильных оксидов металла. Скорость, с которой происходит окисление, сильно зависит от температуры, и при нормальной температуре на металлической поверхности образуется только тонкая пленка оксида (на меди, например, это заметно по потемнению поверхности). При более высоких температурах процесс окисления протекает быстрее. Благородные металлы представляют исключение из этого правила, так как обладают малым сродством к кислороду. Предполагается, что золото вообще не окисляется при нагревании на воздухе или в кислороде, а слабое окисление платины при температурах до 450° С прекращается при нагревании до более высоких температур. Обычные же конструкционные металлы окисляются с образованием четырех типов оксидных соединений: летучих, плотных, защитных или непористых. Небольшое число тугоплавких металлов, таких, как вольфрам и молибден, становятся хрупкими при высоких температурах и образуют летучие оксиды, поэтому защитный оксидный слой не образуется и при высокой температуре металлы следует защищать инертной атмосферой (инертные газы). Сверхлегкие металлы образуют, как правило, слишком плотные оксиды, которые пористы и не защищают металлы от дальнейшего окисления. По этой причине магний окисляется очень легко. Защитные оксидные слои образуются у многих металлов, но обычно они обладают умеренной защитной способностью.
При более высоких температурах процесс окисления протекает быстрее. Благородные металлы представляют исключение из этого правила, так как обладают малым сродством к кислороду. Предполагается, что золото вообще не окисляется при нагревании на воздухе или в кислороде, а слабое окисление платины при температурах до 450° С прекращается при нагревании до более высоких температур. Обычные же конструкционные металлы окисляются с образованием четырех типов оксидных соединений: летучих, плотных, защитных или непористых. Небольшое число тугоплавких металлов, таких, как вольфрам и молибден, становятся хрупкими при высоких температурах и образуют летучие оксиды, поэтому защитный оксидный слой не образуется и при высокой температуре металлы следует защищать инертной атмосферой (инертные газы). Сверхлегкие металлы образуют, как правило, слишком плотные оксиды, которые пористы и не защищают металлы от дальнейшего окисления. По этой причине магний окисляется очень легко. Защитные оксидные слои образуются у многих металлов, но обычно они обладают умеренной защитной способностью. Оксидная пленка на алюминии, например, полностью покрывает металл, однако при напряжениях сжатия развиваются трещины, по-видимому, за счет изменений температуры и влажности. Защитный эффект оксидных слоев ограничивается относительно низкими температурами. Многие “тяжелые металлы” (например, медь, железо, никель) образуют непористые оксиды, которые, хотя и не растрескиваются, не всегда защищают основной металл. Теоретически эти оксиды представляют большой интерес и активно исследуются. Они содержат менее стехиометрического количества металла; отсутствующие атомы металла образуют дырки в решетке оксида. Вследствие этого атомы могут диффундировать сквозь решетку, и толщина оксидного слоя постоянно увеличивается.
Оксидная пленка на алюминии, например, полностью покрывает металл, однако при напряжениях сжатия развиваются трещины, по-видимому, за счет изменений температуры и влажности. Защитный эффект оксидных слоев ограничивается относительно низкими температурами. Многие “тяжелые металлы” (например, медь, железо, никель) образуют непористые оксиды, которые, хотя и не растрескиваются, не всегда защищают основной металл. Теоретически эти оксиды представляют большой интерес и активно исследуются. Они содержат менее стехиометрического количества металла; отсутствующие атомы металла образуют дырки в решетке оксида. Вследствие этого атомы могут диффундировать сквозь решетку, и толщина оксидного слоя постоянно увеличивается.
Применение сплавов. Так как все известные конструкционные металлы склонны к окислению, элементы конструкции, которые находятся при высоких температурах в окислительной среде, следует изготовлять из сплавов, которые в качестве легирующего элемента содержат металл, стойкий к действию окислителя. Этим требованиям отвечает хром – достаточно дешевый металл (применяемый в виде феррохрома), который присутствует в составе почти всех высокотемпературных сплавов, отвечающих требованиям устойчивости к окислению. Поэтому все нержавеющие стали, легированные хромом, имеют хорошую устойчивость к окислению и находят широкое применение в домашнем хозяйстве и промышленности. Сплав нихром, который повсеместно применяется в качестве проволоки для спиралей электрических печей, содержит 80% никеля и 20% хрома и вполне стоек к окислению при температурах до 1000° С. Не меньше, чем устойчивость к окислению, важны механические свойства, и часто оказывается, что определенные элементы сплавов (такие, как хром) придают сплаву и высокотемпературную прочность, и устойчивость к окислению, так что проблема высокотемпературного окисления не вносила серьезных затруднений до тех пор, пока не стали использовать (в газотурбинных двигателях) в качестве топлива мазут, содержащий ванадий или натрий. Эти загрязнения вместе с серой в топливе дают продукты сгорания, обладающие чрезвычайно сильным коррозионным действием.
Этим требованиям отвечает хром – достаточно дешевый металл (применяемый в виде феррохрома), который присутствует в составе почти всех высокотемпературных сплавов, отвечающих требованиям устойчивости к окислению. Поэтому все нержавеющие стали, легированные хромом, имеют хорошую устойчивость к окислению и находят широкое применение в домашнем хозяйстве и промышленности. Сплав нихром, который повсеместно применяется в качестве проволоки для спиралей электрических печей, содержит 80% никеля и 20% хрома и вполне стоек к окислению при температурах до 1000° С. Не меньше, чем устойчивость к окислению, важны механические свойства, и часто оказывается, что определенные элементы сплавов (такие, как хром) придают сплаву и высокотемпературную прочность, и устойчивость к окислению, так что проблема высокотемпературного окисления не вносила серьезных затруднений до тех пор, пока не стали использовать (в газотурбинных двигателях) в качестве топлива мазут, содержащий ванадий или натрий. Эти загрязнения вместе с серой в топливе дают продукты сгорания, обладающие чрезвычайно сильным коррозионным действием. Попытки решить эту проблему завершились разработкой добавок, которые при сгорании образуют безопасные летучие соединения с ванадием и натрием. Фреттинг-коррозия не включает в себя электрохимическую коррозию или прямое окисление в газовой фазе, а является в основном механическим эффектом. Это повреждение сочленных металлических поверхностей в результате истирания при их малых многократных относительных смещениях; наблюдается в виде царапин, язв, раковин; сопровождается заклиниванием и снижает устойчивость к коррозионной усталости, т.к. образующиеся царапины служат исходными точками для развития коррозионной усталости. Типичные примеры – повреждения в пазах крепления лопаток турбин при вибрации, истирание рабочих колес компрессора, изнашивание зубьев шестеренок, резьбовых соединений и т.д. При малых многократных смещениях защитные оксидные пленки разрушаются, истираются в порошок и увеличивается скорость коррозии. Фреттинг-коррозия стали легко идентифицируется по наличию красно-коричневых частиц оксида.
Попытки решить эту проблему завершились разработкой добавок, которые при сгорании образуют безопасные летучие соединения с ванадием и натрием. Фреттинг-коррозия не включает в себя электрохимическую коррозию или прямое окисление в газовой фазе, а является в основном механическим эффектом. Это повреждение сочленных металлических поверхностей в результате истирания при их малых многократных относительных смещениях; наблюдается в виде царапин, язв, раковин; сопровождается заклиниванием и снижает устойчивость к коррозионной усталости, т.к. образующиеся царапины служат исходными точками для развития коррозионной усталости. Типичные примеры – повреждения в пазах крепления лопаток турбин при вибрации, истирание рабочих колес компрессора, изнашивание зубьев шестеренок, резьбовых соединений и т.д. При малых многократных смещениях защитные оксидные пленки разрушаются, истираются в порошок и увеличивается скорость коррозии. Фреттинг-коррозия стали легко идентифицируется по наличию красно-коричневых частиц оксида. Борьбу с фреттинг-коррозией ведут путем совершенствования конструкций, применения защитных покрытий, эластомерных прокладок, смазок.
Борьбу с фреттинг-коррозией ведут путем совершенствования конструкций, применения защитных покрытий, эластомерных прокладок, смазок.
См. также
МЕТАЛЛЫ ЧЕРНЫЕ;
МЕТАЛЛОВ ТЕРМИЧЕСКАЯ ОБРАБОТКА.
ЛИТЕРАТУРА
Кеше Г. Коррозия металлов. М., 1984 Колотыркин Я.М. Металл и коррозия. М., 1985 Люблинский Е.Я. Что нужно знать о коррозии. Л., 1986 Фомин Г.С. Коррозия и защита от коррозии. Энциклопедия международных стандартов. М., 1994
Энциклопедия Кольера. — Открытое общество. 2000.
Игры ⚽ Нужен реферат?
- ИЗОТОПЫ
- МАГНИЙ
Полезное
Коррозия металла: причины возникновения и способы защиты
Что такое коррозия?
Коррозионные разрушения металла – явление достаточно известное. Поверхностная ржавчина является только одним из признаков коррозии. Под действием неблагоприятных факторов окружающей среды структура металла постепенно разрушается вглубь. Как правило, коррозионные процессы запускаются при контакте металла с жидкими, газообразными веществами. Чаще всего это влага – конденсат, атмосферные осадки, сточные воды. Последующее разрушение происходит из-за окисления материала. Результатом коррозионного воздействия становится утрата конструкцией своих свойств, выход изделия из строя. Скорость процесса окисления во многом зависит от степени агрессивности окружающей среды.
Как правило, коррозионные процессы запускаются при контакте металла с жидкими, газообразными веществами. Чаще всего это влага – конденсат, атмосферные осадки, сточные воды. Последующее разрушение происходит из-за окисления материала. Результатом коррозионного воздействия становится утрата конструкцией своих свойств, выход изделия из строя. Скорость процесса окисления во многом зависит от степени агрессивности окружающей среды.
Почему образуется коррозия?
Железо, его сплавы подвержены разрушению – коррозии. Она возникает при электрохимическом, химическом взаимодействии отдельных компонентов материала с веществами из окружающей среды. Окислительно-восстановительные реакции способствуют преобразованию металлов в их оксиды.
Виды коррозии металлов
Коррозионные процессы отличаются по следующим моментам:
- Характер разрушения материала;
- Механизм протекания процесса;
- Тип агрессивной среды, которая вызывает коррозию.

Основными видами коррозии являются химическая или электрохимическая.
Химическая
Химические реакции провоцируют процессы, разрушающие металлические связи. Их результатом становится образование новых связей между окислителем и атомами металла. Химические коррозионные процессы возникают, когда железо или его сплав контактирует со средой, которая не проводит электрический ток. Такие среды разделяются на газовые и жидкие.
- Когда на поверхности металла отсутствует влажный конденсат, но при этом он вступает в контакт с газом или паром, то происходит газовая коррозия. Она способна полностью разрушить изделия. Отдельные металлы и их сплавы в газовой среде могут защищаться от повреждения оксидной пленкой, образующейся на их поверхности. Химические коррозионные процессы газового типа вызываются кислородом, диоксидом серы, сероводородом и другими газами.
- Жидкостное ржавление возникает при соприкосновении поверхности металлов с неэлектролитными жидкостями.
 Это чаще нефть, продукты ее переработки.
Это чаще нефть, продукты ее переработки.
Но если при контакте присутствует даже малое количество влаги, то химическая коррозия быстро переходит в электрохимическую.
Электрохимическая
Наиболее распространенным видом коррозии можно назвать электрохимический. Он возникает, если происходит контакт между металлом и жидким электролитом. Здесь протекают два взаимосвязанных процесса. Первый – анодный. При нем ионы из металла переходят в электролитический раствор. Второй – катодный. Образованные на анодной стадии электроны, образуют связь с частицами окислителя.
Типы поражения ржавчиной
В зависимости от характера разрушения, вызываемого коррозией, поражение ржавчиной может быть:
- Сплошным;
- Местным;
- Точечным;
- Межкристаллическим.
Каждый тип имеет свои особенности.
Сплошная
При сплошной коррозии вся поверхность металлоизделий поражается ржавчиной. Она может быть равномерной или неравномерной.
Она может быть равномерной или неравномерной.
Местная
При местном виде коррозионного процесса ржавеют только отдельные части поверхности металла.
Точечная
Питтинг-коррозия разрушает металл точечно. Ржавчина появляется на отдельных участках, но проникает глубоко в структуру материала. Нередко поражения становятся сквозными.
Межкристаллическая
При межкристаллической коррозии разрушения структуры металла происходит по границам кристаллических зерен.
Типы агрессивных сред
Коррозионные процессы также разделяются по типу сред, в которых они протекают. Различают следующие агрессивные среды:
- Атмосферная – относится к наиболее распространенным. Ржавчина появляется в условиях атмосферы, влажных газов. Металл окисляется под воздействием кислорода и воды, содержащихся в воздухе. Химически активные загрязнения воздушных масс ускоряют коррозионный процесс.

- Растворы электролитов – кислотные, щелочные, солевые, пресная вода.
- Почвенная – наибольшей агрессией обладают кислые грунты, наименьшей – песчаники.
- Аэрационная – образуется при неравномерном доступе воздуха к различным участкам поверхности металла.
- Биологическая – возникает при воздействии на металлические изделия продуктов жизнедеятельности микроорганизмов. Это сероводород, углекислый и другие газы, способствующие коррозии материала.
- Электрическая – блуждающие токи.
Металлические поверхности, которые плохо обдуваются воздушными потоками, удобны для оседания и длительного сохранения пыли, влаги. Они подвержены коррозионным процессам активнее.
Способы защиты металла от коррозии
Защитить металлические изделия можно, предприняв своевременные меры по ограждению поверхности металла от нежелательных контактов с окружающей средой. Это в значительной степени способствует продлению срока эксплуатации конструкций.
Это в значительной степени способствует продлению срока эксплуатации конструкций.
На данный момент разработано большое количество разнообразных методов по защите металлов от окисления. Индустриальные, строительные металлоконструкции, транспортные средства защищают промышленными способами. Это затратно и довольно сложно. В быту применяются методы, которые более просты в технологии и доступнее по цене.
Коррозионная стойкость во многом зависит от природы металла, температуры окружающей среды, ее типа.
- Благодаря химической инертности благородные металлы окислению не подвергаются.
- На поверхности алюминия, цинка, титана, хрома, никеля образуется оксидная газонепроницаемая пленка, надежно защищающая металл от коррозии.
- У железа оксидная пленка рыхлая, поэтому оно ржавеет очень сильно.
Антикоррозийная защита металлов бывает конструктивной, пассивной, активной. Металлические поверхности предохраняют от ржавчины при помощи защитных покрытий, производства легированных сталей, электрохимическим способом.
Защитные покрытия
Толстослойные покрытия – панели, заслоны, резиновые прокладки используются нечасто. Они сложны в установке, стоят дорого, занимают немало места. Такая защита обычно применяется в труднодоступных местах.
Более распространены пассивные защищающие тонкослойные покрытия. Их задача заключается в создании надежного барьера между металлом и агрессивной средой. Для этого применяют краски, грунтовки, лаки, эмали. Такие покрытия способны создавать на поверхности металлоизделий твердую, прочную пленку, которая имеет хорошую адгезию с основанием.
К достоинствам пассивной защиты относится удобство нанесения, доступная цена, значительный ассортимент красящих материалов. Но у нее есть и минусы в применении. Защитный слой требует периодического обновления, он не сильно устойчив к механическим повреждениям.
Создание сплавов, стойких к коррозии
Защитить металл от коррозии можно еще в процессе его производства. Для этого в состав стали при выплавке добавляют легирующие элементы. Они способны предотвратить возникновение очагов ржавчины всех или отдельных видов коррозии. Наиболее часто применяемой легирующей добавкой является хром. В составе стали его должно быть больше 11 %. Также в качестве легирующих компонентов могут выступать никель, молибден, другие элементы.
Для этого в состав стали при выплавке добавляют легирующие элементы. Они способны предотвратить возникновение очагов ржавчины всех или отдельных видов коррозии. Наиболее часто применяемой легирующей добавкой является хром. В составе стали его должно быть больше 11 %. Также в качестве легирующих компонентов могут выступать никель, молибден, другие элементы.
Физические свойства таких сплавов существенно отличаются от характеристик чистого металла. Легирование улучшает коррозионную стойкость. Так получают нержавеющую сталь, новые высокотехнологичные сплавы.
Изменение состава воды
Коррозионные процессы можно замедлить, если в среду, которая окружает металлоконструкцию, добавить ингибиторы коррозии. Они способны снизить скорость или вообще подавить образование ржавчины.
Электрохимическая защита
Когда на поверхность металла наносится более активный металл (протектор), то защитный слой разрушается быстрее. При этом защищаемый металл не подвергается коррозии.
При этом защищаемый металл не подвергается коррозии.
Активная (электрохимическая) защита чаще выполняется с помощью цинкования поверхности металла. Цинк наносится несколькими методами:
- Горячим;
- Холодным;
- Термодиффузным;
- Гальваническим.
Большее распространение получила горячая оцинковка. Ее выполняют только в условиях производства. Здесь можно варьировать толщину защитного слоя. Холодное цинкование чаще используют в быту. На металлоизделия наносят цинконаполненный материал. Такой способ подходит для местного восстановления поврежденного цинкового слоя. Защита цинкованием долговечна, но поверхность металла нуждается в тщательной подготовке. Также необходимо четко соблюдать технологию процесса.
Методы защиты металлоизделий в индустрии очень разнообразны. Конкретный способ подбирается, исходя из их назначения и условий эксплуатации.
Народные средства защиты от коррозии
В бытовых условиях чаще используются защитные лакокрасочные покрытия с разнообразным составом. Изделия из металла, которые уже подверглись поражению коррозией, обычно обрабатывают преобразователями ржавчины. Такие средства не только способствуют восстановлению железа из окислов, но и предотвращают дальнейшие коррозионные процессы. К преобразователям ржавчины относятся различные грунты, стабилизаторы, составы, преобразующие оксиды железа в соли, смолы, масла, нейтрализующие частицы ржавчины.
Но защиту металлических изделий можно осуществить народными способами. Такие методы также подойдут, если нельзя применять готовые химические составы.
Керосин и парафин
Керосин и парафин соединяются в соотношении 10:1. Затем состав выдерживают в течение 24 часов. Средство наносят на ржавые участки металла. По истечении 12 часов место обработки протирают сухой тряпкой. Так можно убрать коррозию с поверхности инструментов, стройматериалов. Но этот метод не стоит применять в жилых помещениях, санузлах, кухнях из-за специфического запаха керосина.
Но этот метод не стоит применять в жилых помещениях, санузлах, кухнях из-за специфического запаха керосина.
Каустическая сода
Использование каустической соды в домашних условиях весьма эффективно. Чтобы приготовить состав, потребуется 40 % формалин (250 г), каустическая сода и аммоний (по 50 г), 300 мл воды. Указанные ингредиенты соединяются вместе, разбавляются в 1 л воды. В раствор на 15-30 мин помещаются заржавевшие металлоизделия. Затем их протирают сухой салфеткой.
Перекись водорода
Раствор из 40 г лимонной кислоты, 1 столовой ложки соли и 100 г перекиси водорода также активно применяют для устранения ржавчины. В него укладывают металлические детали на 2 часа. Очаги коррозии исчезают полностью. Для удаления ржавчины в санузлах и на кухне подойдет смесь нашатырного спирта и перекиси водорода.
Защита от коррозии необходима практически всем изделиям из металла. Профилактические меры способствуют более легкому и быстрому удалению ржавчины.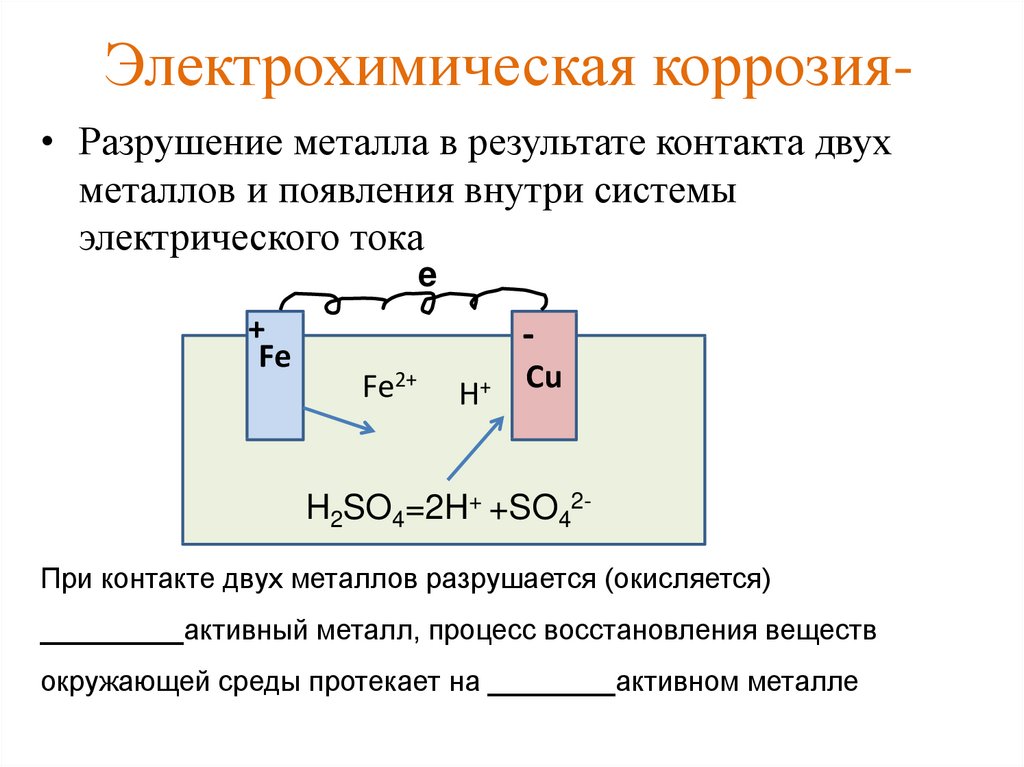 Иначе окислы с металлических поверхностей придется убирать при помощи дорогих сильнодействующих средств.
Иначе окислы с металлических поверхностей придется убирать при помощи дорогих сильнодействующих средств.
Что вызывает ржавчину в металлах
25 февраля 2022 г.
Коррозия металла, также известная как окисление, происходит, когда ионная химическая реакция встречается с присутствием кислорода на поверхности металла.
Процесс окисления происходит на воздухе при одновременном воздействии на металл воды или кислот. С научной точки зрения, это когда молекулы железа на поверхности стали подвергаются коррозии или ржавчине и превращаются в оксиды железа.
Итак, что вызывает ржавчину?
Что вызывает ржавчину на металле
Ржавчина является результатом коррозии, вызванной окислением металла. Процесс окисления разъедает металл и создает видимую ржавчину на поверхности металла. Срок службы металла без покрытия, подверженного ржавчине, значительно короче, чем у металла, покрытого составом для холодного цинкования с высоким содержанием цинка.
Без лечения ржавчина может полностью разъесть металл до состояния сухого оксидного порошка; результат химической реакции в процессе окисления.
Элементы, которые могут вызвать ржавчину и привести к полной коррозии металлов:
- Воздух
- Влага
- Соль
- Химикаты
Составы для холодного цинкования
Состав для холодного цинкования или состав с высоким содержанием цинка имеет характеристики краски, но не является краской. Самая большая разница заключается в процентном содержании цинка в антикоррозионном покрытии. Поскольку процентное содержание цинка в ZRC очень велико, а частицы не инкапсулированы, защита от коррозии является гальванической, как при горячем цинковании.
Состав для холодного цинкования представляет собой продукт, имитирующий характеристики горячего цинкования погружением. Так какая разница?
Так какая разница?
- Горячее цинкование должно применяться в контролируемых условиях, например, на производственном предприятии. Составы для холодного цинкования
- можно наносить на месте прямо из баллончика, аналогично краске.
Менее благородный металл разъедает более благородный. Соединения, богатые цинком, можно наносить на сталь распылением или кистью (как краску). Цинк, будучи менее благородным, чем сталь, при коррозии образует гидроксикарбонатную соль, которая связывается с существующим цинком в пленочном покрытии, поддерживая гальваническую защиту. Это создает передовую самовосстанавливающуюся пленку, которая обеспечивает защиту металлической поверхности под покрытием.
Это богатое цинком покрытие, изготовленное из цинковой пыли ATSM D520 Type III, также известной как «сверхнизкое содержание свинца». Эта цинковая пыль сверхвысокой чистоты содержит меньше примесей, чем свинец, и, следовательно, больше металлического цинка, подвергаемого жертвенной коррозии.
Узнайте больше о составах для холодного цинкования в этом сообщении блога.
Нанесение компаундов для холодного цинкования
После нанесения и высыхания покрытия с высоким содержанием цинка должны соответствовать высоким отраслевым стандартам защиты от коррозии независимо от того, наносятся они распылением или кистью.
Нанесение кистью:
Нанесение кистью создает лучший контакт между продуктом и защищаемой поверхностью, чем нанесение распылением. При чистке цинк втирается в поверхность и улучшается контакт между цинком и сталью.
Распыление:
Спрей для холодного цинкования можно наносить в виде аэрозоля или с помощью компрессора или методом безвоздушного распыления. Состав ZRC для холодного цинкования в аэрозоле обеспечивает такие же превосходные характеристики, как и состав для нанесения кистью. ZRC просто добавляет пропелленты и другие ингредиенты, поэтому он легко и равномерно распыляется из аэрозольного баллончика. Метод аэрозольного нанесения ZRC Worldwide отличается низким содержанием летучих органических соединений и обеспечивает постоянную толщину сухой пленки, которой нет в недорогих решениях. Это не меняет характеристик продукта.
Это не меняет характеристик продукта.
Работаете над более крупным проектом, требующим покрытия большой площади поверхности? Рассмотрите возможность использования компрессора для нанесения состава ZRC для холодного цинкования.
Подробнее о типах приложений.
Цинк в действии
Цинк, нанесенный в качестве защитного верхнего слоя, гораздо проще и выгоднее заменить, чем металл под ним, если он подвергнется ржавчине. Соединение, богатое цинком, имеет значительно более длительный срок службы, чем незащищенный окисленный металл, но оно также подвергается коррозии и в конечном итоге его необходимо заменить. Когда это время придет, просто отшлифуйте или отшлифуйте исходное покрытие, чтобы удалить образовавшиеся соли гидрокарбоната цинка. Затем нанесите новый слой состава ZRC для холодного цинкования, чтобы предотвратить коррозию.
Хотя цинк подвергается коррозии, защищаемая им поверхность не ржавеет.
В конечном итоге вам потребуется отремонтировать или заменить богатый цинком состав, защищающий вашу металлическую поверхность. Самовосстанавливающаяся пленка обеспечивает полную защиту, позволяя выиграть время до тех пор, пока не потребуется техническое обслуживание или ремонт.
Самовосстанавливающаяся пленка обеспечивает полную защиту, позволяя выиграть время до тех пор, пока не потребуется техническое обслуживание или ремонт.
Узнайте больше о том, как цинк борется с ржавчиной.
Борьба с коррозией
Существует множество продуктов, удовлетворяющих различные потребности в области защиты от коррозии. Подражание лестно, но доказательство в краске. Компания ZRC Worldwide разработала технологию цинкования в качестве альтернативы горячему погружению для борьбы с коррозией и уже почти 70 лет является мировым лидером в этой области.
Будь то ретуширование существующего проекта или выполнение полномасштабной работы с нуля, наша команда гарантирует, что вы получите правильный продукт и правильный метод нанесения для ваших нужд.
Средство поиска продуктов
Подпишитесь на наш блог
Получайте последние обновления прямо на свой почтовый ящик!
Металлы, которые не ржавеют — и те, которые ржавеют
Металлы, которые не ржавеют — и те, которые ржавеют
Вы, вероятно, знаете, что ржавчина — это чешуйчатая красноватая коррозия на металлических поверхностях. Термин «ржавчина» на самом деле относится к окислению железа — проще говоря, это комбинация железа и кислорода. Любой металл, содержащий железо, может ржаветь, в то время как другие металлы реагируют на кислород по-другому.
Термин «ржавчина» на самом деле относится к окислению железа — проще говоря, это комбинация железа и кислорода. Любой металл, содержащий железо, может ржаветь, в то время как другие металлы реагируют на кислород по-другому.
Ржавчина может разрушить металлические предметы и сделать их бесполезными, требуя дорогостоящей и трудоемкой замены. Самый простой способ избежать ржавчины — выбрать правильный металл.
Только железо может ржаветь. Это означает, что другие металлы, не содержащие железа, не подвержены коррозии. Это делает их идеальными для размещения на открытом воздухе, так как они прослужат намного дольше в естественных условиях. Узнайте, какие металлы не ржавеют, а какие ржавеют.
Какие металлы не ржавеют? Ржавчина — это химическая реакция, поэтому для образования ржавчины должны быть задействованы правильные элементы. Ржавчина может возникнуть только при наличии молекул железа, кислорода и воды. Любая другая реакция по определению не является ржавчиной. Металлы с низким содержанием железа или без него, также известные как цветные металлы, не будут ржаветь, хотя они могут реагировать на кислород другими способами. Обычные металлы, которые не ржавеют, включают:
Металлы с низким содержанием железа или без него, также известные как цветные металлы, не будут ржаветь, хотя они могут реагировать на кислород другими способами. Обычные металлы, которые не ржавеют, включают:
- Алюминий
- Нержавеющая сталь
- Бронза
- Медь
Алюминий устойчив к коррозии. Причина этого проста — алюминий не содержит железа. Алюминий — самостоятельный элемент в периодической таблице, а это значит, что он не содержит ничего, кроме самого себя. Во время производства производитель может добавлять небольшое количество магния, кремния, меди или других элементов, чтобы сделать конечный продукт более прочным. Свойства алюминия делают его практичным выбором для наружных электрических шкафов или других металлических предметов на открытом воздухе.
ПОЧЕМУ НЕРЖАВЕЮЩАЯ СТАЛЬ НЕ РЖАВЕТ? Обычная сталь представляет собой комбинацию железа и углерода, а также небольшого количества других элементов. Нержавеющая сталь немного отличается. Хотя сталь содержит железо, нержавеющая сталь также содержит элемент хром, обладающий высокой коррозионной стойкостью.
Нержавеющая сталь немного отличается. Хотя сталь содержит железо, нержавеющая сталь также содержит элемент хром, обладающий высокой коррозионной стойкостью.
Хром защищает сталь от ржавчины, поскольку хром соединяется с кислородом раньше, чем железо. Поскольку железо никогда не соединяется с кислородом, ржавчина никогда не образуется. Кроме того, нержавеющая сталь популярна, потому что она противостоит росту бактерий и остается стабильной при экстремальных температурах.
ПОЧЕМУ БРОНЗА НЕ РЖАВЕТ?Бронза не ржавеет благодаря минимальному содержанию железа. Имейте в виду, однако, что бронза может реагировать на кислород другими способами. Бронза не встречается в природе, как чистый алюминий или железо. Вместо этого бронза представляет собой смесь меди и олова. Эта композитная структура делает его более устойчивым к коррозии, но не полностью невосприимчивым. Он прочнее, чем сама по себе медь, но со временем может испортиться.
ПОЧЕМУ МЕДЬ НЕ РЖАВЕТ? Медь никогда не ржавеет по той же причине, что и бронза — в ней слишком мало железа. Хотя медь не ржавеет, со временем на ее поверхности может образовываться зеленая пленка или патина. Однако эта патина не будет отслаиваться, как ржавчина. Вместо этого он создает ровное толстое покрытие поверх самой меди. Многие люди на самом деле предпочитают внешний вид окисленной меди ее первоначальному состоянию.
Хотя медь не ржавеет, со временем на ее поверхности может образовываться зеленая пленка или патина. Однако эта патина не будет отслаиваться, как ржавчина. Вместо этого он создает ровное толстое покрытие поверх самой меди. Многие люди на самом деле предпочитают внешний вид окисленной меди ее первоначальному состоянию.
Только подумайте о Статуе Свободы. Ее медная кожа изначально выглядела коричневой, но со временем она стала зеленой из-за окисления меди. Эта зеленая пленка такая же толстая, как и исходный слой меди, и фактически помогает Lady Liberty противостоять атмосферным воздействиям. Вы также можете увидеть тот же эффект на старых пенни, которые могут начать выглядеть зелеными.
Металлы, которые ржавеютЛюбой металл, содержащий значительное количество железа, также известный как «черные металлы», может ржаветь. К металлам, которые будут ржаветь, относятся:
- Сталь
- Чугун
- Кованое железо
Поскольку сталь представляет собой смесь железа и углерода, она обязательно будет ржаветь. Что отличает сталь от нержавеющей стали, так это элемент хром — хром образует защитный экран от ржавчины, что делает нержавеющую сталь более устойчивой к коррозии. Чем больше содержание хрома, тем лучше. Обычная сталь не имеет такой защиты от коррозии.
Что отличает сталь от нержавеющей стали, так это элемент хром — хром образует защитный экран от ржавчины, что делает нержавеющую сталь более устойчивой к коррозии. Чем больше содержание хрома, тем лучше. Обычная сталь не имеет такой защиты от коррозии.
Любая форма железа может ржаветь под воздействием кислорода и молекул воды. Чугун представляет собой комбинацию железа, углерода и кремния. Хотя он известен своей устойчивостью к износу, он может ржаветь. С другой стороны, кованое железо содержит лишь следовые количества углерода. Это почти чистое железо, поэтому может образоваться ржавчина.
Железные предметы можно защитить от ржавчины, регулярно нанося краску и удаляя пятна ржавчины проволочной щеткой. Вы также должны держать железные предметы как можно более сухими — протирайте чугунные кастрюли и сковородки полотенцем после мытья, а не дайте им высохнуть на воздухе. Кроме того, мойте их сразу, а не оставляйте их замачиваться. Железо требует гораздо большего внимания и обслуживания, чем другие металлы, когда речь идет о предотвращении коррозии.
Железо требует гораздо большего внимания и обслуживания, чем другие металлы, когда речь идет о предотвращении коррозии.
Возможно, вы помните, как взрослый напоминал вам о том, что перед ливнем следует принести велосипед в гараж, иначе он промокнет и может заржаветь. Однако некоторые металлические предметы, такие как наружные электрические шкафы, должны постоянно оставаться снаружи. Металлические предметы, размещенные на открытом воздухе, должны выдерживать естественные условия, включая дождь и влажность.
Если бы эти предметы были подвержены ржавчине, их пришлось бы заменять слишком часто. Это было бы дорого и отнимало много времени, но также представляло бы угрозу безопасности. Электрический корпус, разрушающийся из-за ржавчины, может быть очень опасным.
Для таких применений популярны алюминий и нержавеющая сталь. Алюминий не ржавеет, поэтому его можно безопасно использовать на открытом воздухе. Он также имеет другие ценные характеристики, такие как:
- Он достаточно прочен, чтобы выдерживать сильные удары.

- Может рассеивать тепло для безопасного контроля температуры.
- Легкий по сравнению с другими металлами.
Как и алюминий, нержавеющая сталь часто используется для наружных металлических предметов. Нержавеющая сталь обладает впечатляющей температурной стабильностью. Он и пожаробезопасен, и устойчив к низким температурам. Если металлический предмет должен выдерживать экстремальные климатические условия — например, в пустыне, где температура может резко повышаться и понижаться за короткие промежутки времени, — нержавеющая сталь является одним из самых безопасных вариантов.
Узнайте больше о металлических корпусах для наружного применения Корпуса APX предлагают корпуса, сертифицированные Национальной ассоциацией производителей электрооборудования (NEMA). Они созданы, чтобы противостоять любым условиям — дождю, снегу, льду, огню, грязи, пыли, бактериям и экстремальным температурам. Вы можете настроить корпус в соответствии с вашими потребностями.

